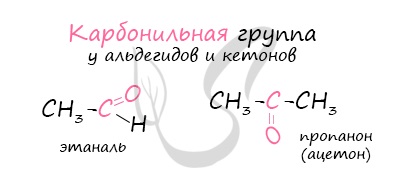
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Строение, изомерия и гомологический ряд альдегидов и кетонов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода.
Структурная формула альдегидов:
Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами.
Структурная формула кетонов:
Строение карбонильных соединений
Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три σ-связи и одну π-связь.
Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120о друг к другу.
π-Связь образована р-электронами атомов углерода и кислорода.
Из-за большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована, электронная плотность смещена к более электроотрицательному атому кислорода.
На атоме кислорода возникает частичный отрицательный (δ–), а на атоме углерода – частичный положительный (δ+) заряды.
Номенклатура карбонильных соединений
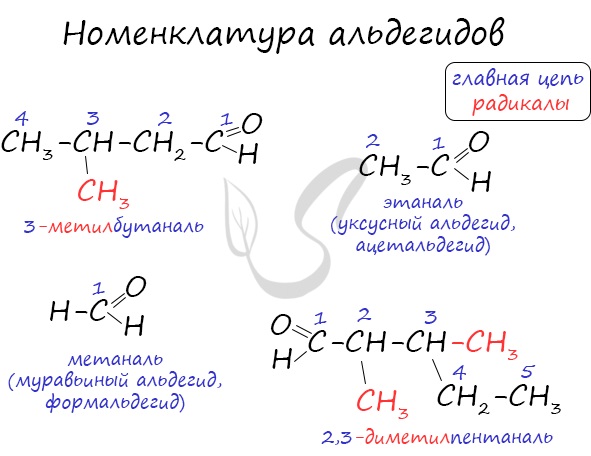
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-АЛЬ».
Нумерация ведется от атома углерода карбонильной группы.
Например, 2-метилпропаналь
- К названию кетонов добавляют в название суффикс «-ОН». После этого добавляют номер атомов углерода карбонильной группы.
- Тривиальные названия альдегидов и кетонов приведены в таблице.
Изомерия карбонильных соединений
Изомерия альдегидов
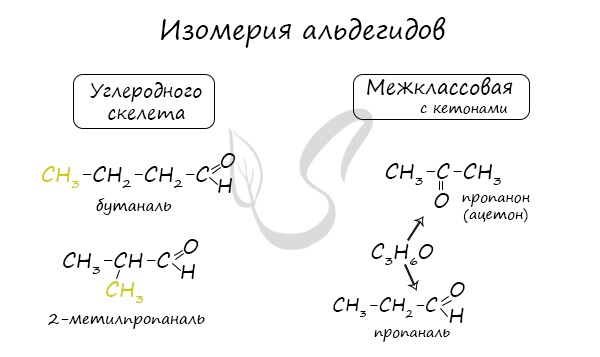
Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О соответствуют два альдегида-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют кетоны-изомеры углеродного скелета
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют два кетона-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
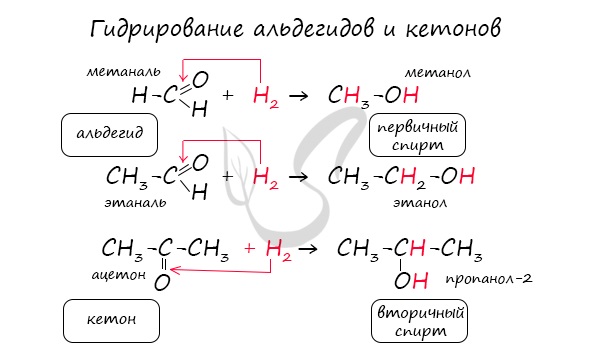
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
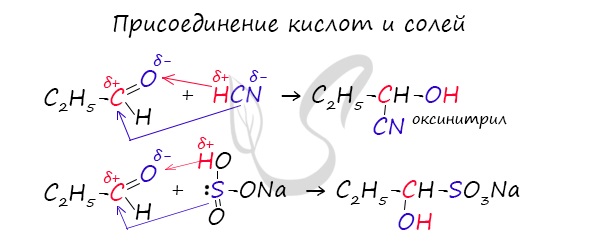
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Альдегид → карбоновая кислота
Формальдегид→ муравьиная кислота→ углекислый газ
вторичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Видеоопыт окисления муравьиного альдегида гидроксидом меди (II) можно посмотреть здесь.
Например, муравьиный альдегид окисляется гидроксидом меди (II)
HCHO + Cu(OH)2 = Cu + HCOOH + H2O
Чаще в этой реакции образуется оксид меди (I):
HCHO + 2Cu(OH)2 = Cu2O + HCOOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония
Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота
Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания метаналя:
CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
Получение карбонильных соединений
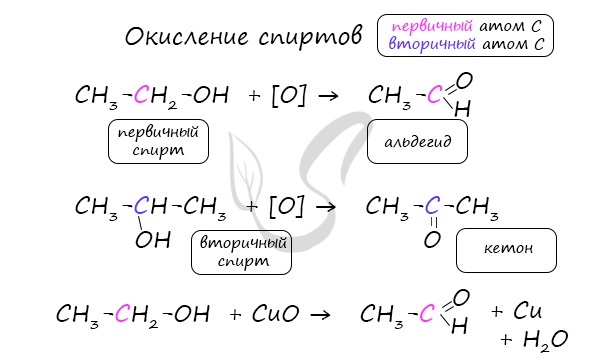
1. Окисление спиртов
При окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов – кетоны.
1.1. Окисление спиртов оксидом меди (II)
Например, при окислении этанола оксидом меди образуется уксусный альдегид
Например, при окислении изопропанола оксидом меди образуется ацетон
1.2. Окисление спиртов кислородом на меди
При пропускании паров спирта с кислородом над медной сеткой образуются альдегиды и кетоны.
Например, при окислении пропанола-1 кислородом в присутствии меди образуется пропаналь
В промышленности формальдегид получают окислением метанола на серебряном катализаторе при температуре 650оС и атмосферном давлении:
1.3. Окисление спиртов сильными окислителями
Вторичные спирты при этом окисляются до кетонов. Первичные спирты можно окислить до альдегидов, если предотвратить дальнейшее окисление альдегида (например, отгонять образующийся альдегид в ходе реакции).
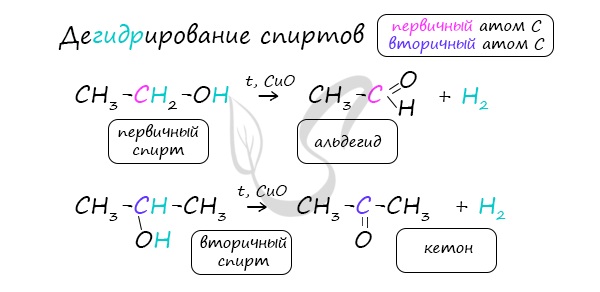
2. Дегидрирование спиртов
При пропускании спирта над медной сеткой при нагревании образуются карбонильные соединения.
Например, при дегидрировании этанола образуется этаналь
3. Гидратация алкинов
Присоединение воды к алкинам в присутствии солей ртути (II) приводит к образованию карбонильных соединений.
Например, при гидратации ацетилена образуется уксусный альдегид
Например: при гидратации пропина образуется ацетон
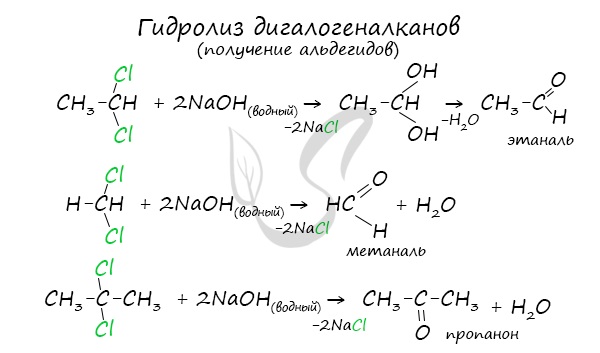
4. Гидролиз дигалогенпроизводных алканов
Под действием водного раствора щелочи образуется неустойчивый диол с двумя ОН-группами при одном атоме С, он теряет воду, превращаясь в альдегид или кетон.
Например: при гидролизе 1,1-дихлорэтана образуется этаналь
5. Пиролиз солей карбоновых кислот
При нагревании солей карбоновых кислот и двухвалентных металлов образуются неорганические соли (карбонаты) и кетоны.
Например: при пиролизе ацетата кальция образуется ацетон и карбонат кальция:
6. Кумольный способ получения ацетона
Ацетон в промышленности получают каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
7. Каталитическое окисление алкенов
При окислении этилена кислородом в присутствии катализаторов образуется уксусный альдегид.
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 114 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Из предложенного перечня выберите все вещества, с которыми взаимодействует как ацетон, так и ацетальдегид.
1) оксид меди(II)
2) кислород
3) водород
4) гидроксид меди(II)
5) аммиачный раствор оксида серебра
Запишите номера выбранных ответов.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 1
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропанол-1 и оксид меди (II)
Б) пропанол-2 и оксид меди (II)
В) пропанол-2 и муравьиная кислота
Г) пропин и вода
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропаналь
2) ацетон
3) пропен
4) изопропанол
5) пропилацетат
6) изопропилформиат
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропанол-1 и оксид меди(II)
Б) пропанол-2 и оксид меди(II)
В) пропанол-2 и муравьиная кислота
Г) пропин и вода
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропаналь
2) ацетон
3) пропен
4) изопропанол
5) пропилацетат
6) изопропилформиат
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между схемой реакции и исходным веществом X, принимающим участие в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Неэлектролитом является каждое вещество пары
1) хлорид аммония и этанол
2) ацетон и этиленгликоль
3) уксусная и серная кислоты
4) сульфат и ацетат натрия
Электролитом является каждое вещество пары
1) сульфат натрия и дистиллированная вода
2) гидрокарбонат калия и ацетон
3) хлорид алюминия и бензол
4) сульфат меди(II) и ацетат натрия
Установите соответствие между парами веществ и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПАРА ВЕЩЕСТВ
А) этанол и уксусная кислота
Б) этан и этилен
В) метан и метиламин
Г) пропанол-1 и ацетон
РЕАГЕНТ
1)
2)
3)
4) фенолфталеин
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ацетон в лаборатории получают прокаливанием
1) ацетата натрия со щёлочью
2) ацетата кальция
3) этанола
4) фенолята кальция
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропен и хлороводород
Б) ацетилен и водород (изб.)
В) пропин и вода
Г) циклопропан и бромоводород
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) этен
2) этан
3) 1-хлорпропан
4) 2-хлорпропан
5) ацетон
6) 1-бромпропан
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Источник: Эксперт в ЕГЭ. Под редакцией Медведева Ю. Н., Антошина А. Э., Лидина Р. А.
Установите соответствие между смесью и способом её разделения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СМЕСЬ
A) жидкий азот и кислород
Б) железо и магний
В) вода и ацетон
Г) поваренная соль и кварцевый песок
СПОСОБ РАЗДЕЛЕНИЯ
1) фракционной перегонкой
2) обработка водой, фильтрование, выпаривание раствора
3) с помощью магнита
4) декантацией
5) охлаждением
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Установите соответствие между названием вещества и общей формулой класса (группы) органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) рибоза
Б) ацетон
В) изопрен
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Установите соответствие между реагирующими веществами и реагентом, с помощью которого их можно отличить друг от друга: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
A) этаналь и ацетон
Б) пропанол-1 и этиленгликоль
B) метиламин и пропан
Г) этанол и глицерин
РЕАГЕНТ
1) метилоранж (р-р)
2)
3)
4) (р-р)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
A) ацетон и водород
Б) пропен и вода
B) пропаналь и водород
Г) пропионовая кислота и натрий
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропанол-1
2) пропанол-2
3) пропанон
4) пропановая кислота
5) пропионат натрия
6) пропилат натрия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Из предложенного перечня выберите два вещества, в молекулах которых между атомами углерода и кислорода присутствует двойная связь.
1) этанол
2) ацетон
3) ацетофенон
4) этиленгликоль
5) фенол
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите два вещества, у которых есть атомы углерода в состоянии sp2-гибридизации.
1) ацетон
2) пропанол
3) пропин
4) бутан
5) этилен
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Установите соответствие между названием вещества и его молекулярной формулой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) глицерин
Б) пропановая кислота
В) ацетон
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Установите соответствие между названием вещества и его молекулярной формулой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) глицерин
Б) пропановая кислота
В) ацетон
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Установите соответствие между названием вещества и классом (группой) органических соединений, к которому (-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) 2-метилбутанол-2
Б) изопропилэтаноат
В) ацетон
КЛАСС (ГРУППА) СОЕДИНЕНИЙ
1) спирт
2) кетон
3) альдегид
4) сложный эфир
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Установите соответствие между названием вещества и его молекулярной формулой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) этанол
Б) пропановая кислота
В) ацетон
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 3
Установите соответствие между названием вещества и общей формулой класса (группы) органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) рибоза
Б) ацетон
В) изопрен
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Всего: 114 1–20 | 21–40 | 41–60 | 61–80 …
Знания о кетонах в рамках ЕГЭ по химии.
Любой класс веществ характеризуют по плану:
Определение и общая формула. Гомологический ряд.
Номенклатура и изомерия.
Физические свойства.
Химические свойства на примере ацетона.
Получение.
Применение.
М
Слово кетон произошло от старого немецкого слова Aketon (ацетон). Придумал его в 1848 году немецкий химик Леопольд Гмелин (1788—1853)[1]. Первым представителем является ацетон, пропанон, диметилкетон, по ИЮПАК пропан -2-он, который изображают следующими формулами С3Н6О, CH3—CO—CH3 или (CH3)2CO.
По систематической номенклатуре названия кетонов составляют от соответствующего алкана с добавлением суффикса –ОН и цифра в конце, указывающая номер атома С, у которого карбонильная группа. Например, C1H3—C2H2—C3O—C4H2—C5H3 пентанон-3 (красным цветом указана нумерация атомов углерода). Нумерация цепи с того края молекулы, где ближе кетоногруппа. Этот же кетон по радикально-функциональной номенклатуре можно назвать диэтилкетон, т.е. перечисление названий радикалов с приставкой ди- в случае одинаковых радикалов, если же радикалы разные, то их называют в алфавитном порядке. Например, C1H3—C2O—C3H2—C4H3 бутанон-2 или метилэтилкетон.
Кетонам характерна структурная изомерия по положению функциональной группы, углеродной цепи и межклассовая с альдегидами (в рамках тех видов изомерии, которые изучаются в школе).
Физические свойства.
Кетоны — летучие жидкости или легкоплавкие твёрдые вещества, низшие представители хорошо растворимы в воде и смешиваются с органическими растворителями, некоторые (ацетон) смешиваются с водой в любых соотношениях. Невозможность образования межмолекулярных водородных связей обуславливает несколько бо́льшую их летучесть, чем у спиртов с той же молекулярной массой. Температуры кипения ниже, чем у спиртов (например, ацетон кипит при 56,1 °C, а пропанол -2 — при 82,4 °C)[1].
Ацетон — бесцветная подвижная летучая жидкость (при н.у.) с характерным резким запахом, во всех соотношениях смешивается с водой, спиртами, бензолом и другими органическими веществами. Сам является хорошим растворителем для многих веществ. Он легко воспламеняется и смеси с воздухом взрывоопасны, также быстро испаряется и распространяется от места работы с ним, поэтому необходимо соблюдать технику безопасности.
Ацетон встречается в организме человека – кетоновые тела в крови. Он является промежуточным продуктом обмена веществ. Незначительное количество ацетона, образующееся в организме человека в результате метаболических реакций, выводится вместе с мочой. У больных диабетом следы ацетона можно обнаружить в выдыхаемом воздухе. Ацетон обладает возбуждающим и наркотическим действием, поражает центральную нервную систему. Ацетон способен накапливаться в организме, т.к. медленно выводится из организма. Он может поступать в организм с вдыхаемым воздухом, а также через пищевой канал и кожу.
После поступления ацетона в кровь часть его переходит в головной мозг, селезенку, печень, поджелудочную железу, почки, легкие и сердце. Содержание ацетона в указанных органах несколько меньшее, чем в крови. При вдыхании паров ацетона происходит кислородное голодание мозга. Поэтому, в помещениях, в которых происходит испарение ацетона, создается опасность отравления при вдыхании его паров[2]. ПДК в воздухе рабочей зоны 800 мг/м3, в атмосферном воздухе населенных пунктов 0,35 мг/м3 максимально разовая доза[3].
Ацетон ядовит, но относится к малоопасным веществам — IV категория безопасности для здоровья. Он сильно раздражает слизистые оболочки, пары оказывают слабое наркотическое действие, опьянение. При попадании внутрь вызывает состояние, сопровождаемое слабостью и головокружением, нередко болями в животе; как правило, отравления ацетоном не смертельны.
Ацетон, в концентрации более 60 %, в России входит в таблицу III, спиcка IV «Перечня наркотических средств, психотропных веществ и их прекурсоров» и его оборот подлежит контролю. При работе в лаборатории с ацетоном, операции по его расходу должны вноситься в специальный «Журнал регистрации операций, при которых изменяется количество прекурсоров наркотических средств и психотропных веществ»[1].
Химические свойства.
Восстановление – гидрирование или присоединение водорода до вторичных спиртов.
Присоединение спиртов с образованием полуацеталей и ацеталей (происходит разрыв двойной связи С=О).
Присоединение синильной/ циановодородной кислоты с образованием нитрилов.
Галогенирование кетонов по α – атому С (ближайший к карбонильной группе) – это реакция замещения.
Присоединение пентахлорида фосфора, происходит разрыв кратной связи.
Кетоны горят на воздухе.
Кетоны окисляются раствором перманганата калия в кислой (до карбоновой кислоты) или нейтральной среде (до соли карбоновой кислоты).
Получение ацетона.
Гидратация пропина в присутствии солей ртути – реакция Кучерова.
Взаимодействие дигалогеналканов с водным раствором щелочи или водой (оба галогена у одного атома С в середине молекулы).
Дегидрирование – отщепление водорода от вторичных спиртов.
Окисление вторичных спиртов оксидом меди (II) или каталитическое окисление кислородом воздуха.
Внутримолекулярная дегидратация двухатомных спиртов (гидроксильные группы находятся рядом)в присутствии концентрированной серной кислоты и при нагревании более 140ͦ
Нагревание кальциевых или бариевых солей карбоновых кислот.
Окисление алкенов, у которых у атомов С с кратной связью имеется радикал, раствором перманганата калия в кислой среде.
Применение ацетона.
Применяется в производстве искусственного шелка, органического небьющегося стекла, целлулоида, бездымного пороха, кинопленок и т.д.
Так как ацетон хорошо растворяет ацетилен, он широко используется при наполнении стальных ацетиленовых баллонов, а также очищает от монтажной пены инструменты и поверхности.
Ацетон служит сырьем при производстве многих химических продуктов: индиго, синтетического каучука, ионона, то есть духов. В соединении с солями сернистой и гидросернистой кислот он применяется для окрашивания и печатания тканей. Используется ацетон и в производстве искусственной кожи, для обеззараживания меха и шерсти.
Благодаря сравнительно малой токсичности, продукт широко применяется в фармацевтике, а именно для экстрагирования некоторых видов лекарств и препаратов, то есть когда определенные вещества извлекают из раствора химическим путем. Так же он употребляется в пищевой промышленности, также для процедуры экстрагирования пищевых продуктов, жиров, витаминов.
В быту ацетон используется столь же широко, как и в промышленности. Вещество применяется для удаления лака с ногтей, удаления загрязнений с текстильных материалов, обезжиривания поверхности перед окрашиванием. Эффективно растворяет клей, нитроцеллюлозу, воски, алкалоиды, некоторые соли и другие органические вещества.
Источники информации:
https://wiki2.org/ru/Ацетон
https://himija-online.ru/organicheskaya-ximiya/aldegidy-i-ketony/aceton-predstavitel-ketonov.html
http://www.rihtop.ru/diagnoseassistant/Substance.aspx?id=15
https://acetyl.ru/o/a32j.php
https://nalivom.ru/blog/231-rastvoriteli-aceton-oblasti-primeneniya.html
https://chemprom.com/blog/primenenie-atseton
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа
в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных.
Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь,
этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь —
CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином
называется 40% раствор формальдегида.
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
- Окисление спиртов
- Пиролиз солей карбоновых кислот
- Каталитическое дегидрирование спиртов
- Реакция Кучерова
- Гидролиз дигалогеналканов
- Окисление метана
- Кумольный способ получения ацетона (и фенола)
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны.
Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или
бариевых солей карбоновых кислот возможно получение кетонов.

В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по
атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в
соответствующие кетоны.

Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы
и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.

В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.

Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
- Реакции присоединения
- Окисление альдегидов
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный
элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме
углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить
при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе.
Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
2CH3CHO + 5O2 → 4CO2 + 4H2O
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции
серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая
распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты.

Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для
альдегидов, в результате образуется кирпично-красный осадок оксида меди I.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Ацетон — простейший представитель насыщенных кетонов.
Физические свойства
Ацетон (пропанон-2, диметилкетон) СН3-СО-СН3 — летучая бесцветная жидкость с характерным запахом и температурой кипения 560С.

Ацетон легче воды, смешивается с ней в любых соотношениях, хорошо растворяется спирте и эфире.
Он хорошо растворяет многие органические вещества (жиры, смолы, ацетилцеллюлозу, воск, резину и др.), поэтому является незаменимым растворителем в быту и в лакокрасочной промышленности.
Ацетон встречается в организме человека. Он является промежуточным продуктом обмена веществ. Незначительное количество ацетона, образующееся в организме человека в результате метаболических реакций, выводится вместе с мочой. У больных диабетом следы ацетона можно обнаружить в выдыхаемом воздухе.
А знаете ли вы?
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины.
Токсичность ацетона
Ацетон обладает возбуждающим и наркотическим действием, поражает центральную нервную систему. Ацетон способен накапливаться в организме, т.к. медленно выводится из организма. Он может поступать в организм с вдыхаемым воздухом, а также через пищевой канал и кожу.
После поступления ацетона в кровь часть его переходит в головной мозг, селезенку, печень, поджелудочную железу, почки, легкие и сердце. Содержание ацетона в указанных органах несколько меньшее, чем в крови.
При вдыхании паров ацетона происходит кислородное голодание мозга. Поэтому, в помещениях, в которых происходит испарение ацетона, создается опасность отравления при вдыхании его паров.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов.
Ацетон, как и все кетоны, не дает реакции «серебряного зеркала», не полимеризуется. В этом его отличие от альдегидов.
1. Гидрирование (восстановление)
При тех же условиях, что и формальдегид, ацетон присоединят водород:
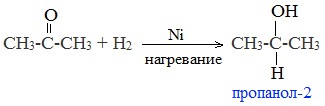
Водород присоединяется вследствие разрыва двойной связи карбонильной группы.
2. Взаимодействие с гидросульфитом натрия
Ацетон один из немногих кетонов образует бисульфитное соединение:
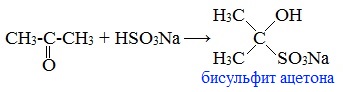
3. Альдольная конденсация
Под действием щелочей ацетон вступает в альдольную самоконденсацию, с образованием «ацетонового» (диацетонового) спирта:
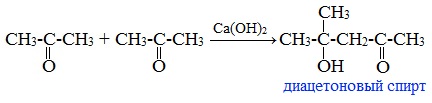
4. Взаимодействие с синильной кислотой
Одной из наиболее важных реакций ацетона является присоединение к нему синильной кислоты с образованием ацетонциангидрина:
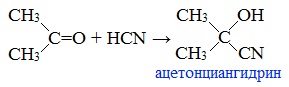
5. Пиролиз ацетона
При нагревании выше 5000C ацетон распадается на кетен и метан:
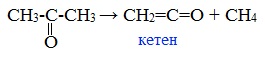
6. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на ацетон!
При взаимодействии ацетона с избытком йода в щелочной среде образуется йодоформ – желтое вещество с характерным запахом:
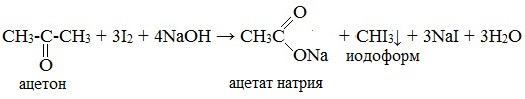
Аналогичные реакции идут с хлором и бромом, но только реакция с йодом приводит к нерастворимому йодоформу.
7. Взаимодействие с нитропруссидом натрия
Качественная реакция на ацетон!
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой CH3COOH окраска переходит в красно-фиолетовую:
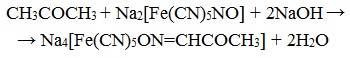
Йодоформная реакция и реакция с нитропруссидом натрия используются для обнаружения ацетона в моче при сахарном диабете.
Получение
Ацетон получают в больших количествах различными методами: при сухой перегонке дерева, разложением ацетата кальция, окислением пропена, «кумольным» способом, окислением изопропилового спирта, гидратацией ацетилена водяным паром.
1.Кумольный способ
Данный способ получения фенола основан на окислении кумола (изопропилбензола). В качестве исходных продуктов используют бензол и пропилен.
Процесс протекает в три стадии. На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса-Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
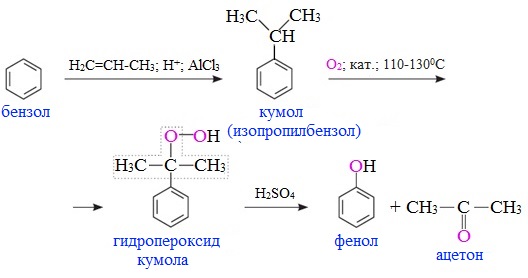
Окисление кумола — экономически выгодный метод, так как позволяет получить наряду с фенолом другой важный продукт — ацетон (на 1 кг фенола приходится 0,6 кг ацетона). В настоящее время этот метод наиболее широко используется в промышленности и позволяет производить более 80% синтетического фенола.
2. Окисление изопропилового спирта
Ацетон получают в больших количествах при окислении изопропилового спирта:

В качестве катализатора применяется медь, серебро, никель, платина и др. Воздух, насыщенный парами изопропилового спирта, пропускают над тонким слоем катализатора при температуре 400-6500С.
Если процесс окисления протекает в жидкой фазе, то, как побочный продукт образуется пероксид водорода:
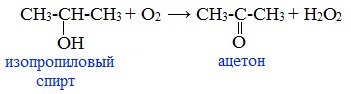
3. Каталитическое окисление пропена кислородом воздуха
В промышленности ацетон получают прямым окислением пропена в жидкой фазе в присутствии катализатора — смеси PdCl2 и CuCl2 при температуре 1000C:
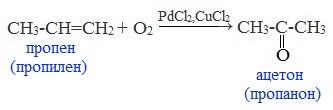
4. Брожение крахмала
Незначительное значение имеет метод брожения крахмала под действием бактерий с образованием ацетона и бутанола. Метод характеризуется малыми выходами.
5. Пиролиз ацетата кальция
Ацетон можно получить пиролизом ацетата кальция:
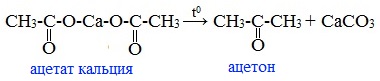
6. Гидратация ацетилена водяным паром
Реакция протекает при 400-4600С над катализатором, содержащим оксиды железа и марганца:
Применение
В качестве растворителя ацетон используется в производстве красок, лаков и олифы, резины, пластмасс, красителей, взрывчатых веществ, а также в фотографии.
Ацетон применяется в производство искусственного шелка и синтетической кожи, в производстве смазочных масел, бездымного пороха, кинопленки.
В химической промышленности ацетон является промежуточным химическим соединением при производстве многих химикатов, таких как кетен, уксусный ангидрид, бисфенол А, метилметакрилат, хлороформ, изофорон, йодоформ, витамин С.
Метилметакрилат применяется, главным образом, в виде листов пластика, порошков для литья и формовки, поверхностных покрытий, эмульсионных полимеров, волокон, чернил и пленок.
Метилметакрилат также применяется в производстве материалов, известных под названием плексигласа или люцита. Они используются в зубных протезах, твердых контактных линзах, и клеях.
Метилметакрилат – мономер для синтеза полиметилметакрилата («органическое сырье»).
Альдегиды и кетоны
Альдегиды и кетоны. Тренировочные задания для подготовки к ЕГЭ.
Тестовые задания с выбором двух вариантов ответа.
Задание №1
Выберите два утверждения, справедливые для формальдегида
1) хорошо растворим в воде
2) изменяет окраску индикаторов
3) является токсичным
4) молекула содержит атом углерода в состоянии sp3-гибридизации
5) в обычных условиях является жидкостью с характерным запахом
Решение
Ответ: 13
Задание №2
Выберите два утверждения, справедливые для ацетона.
1) молекула содержит атом углерода в состоянии sp2-гибридизации
2) хорошо растворим в воде
3) в обычных условиях является газом с резким запахом
4) между молекулами есть водородные связи
5) является гомологом ацетальдегида
Решение
Ответ: 12
Задание №3
Выберите два утверждения, которые не справедливы для ацетальдегида.
1) реагирует с серебром
2) хорошо растворим в воде
3) в промышленности может быть получен из этилена
4) является изомером метаналя
5) содержит карбонильную группу
Решение
Ответ: 14
Задание №4
Выберите два утверждения, справедливые для формальдегида.
1) проявляет кислотные свойства
2) содержит карбоксильную группу
3) его 40%-ный раствор называют формалином
4) при восстановлении дает метанол
5) все связи в молекуле ковалентные неполярные
Решение
Ответ: 34
Задание №5
Выберите два утверждения, справедливые для этаналя
1) гомологический рад имеет общую формулу CnH2nO2
2) молекула содержит 1 π-связь
3) может быть получен при окислении этанола
4) не является токсичным
5) при окислении не может образовать соль
Решение
Ответ: 23
Задание №6
Выберите два утверждения, которые справедливы и для этаналя, и для метаналя
1) в обычных условиях являются жидкостями
2) содержат в молекуле только атомы в состоянии sp2-гибридизации
3) имеют межклассовые изомеры
4) являются гомологами
5) при восстановлении образуют первичный спирт
Решение
Ответ: 45
Задание №7
Выберите два утверждения, которые справедливы и для этаналя, и для пропанона.
1) являются жидкостями без запаха
2) содержат карбонильную группу
3) могут быть получены из алкинов реакцией гидратации
4) при восстановлении образуют вторичные спирты
5) образуют межмолекулярные водородные связи
Решение
Ответ: 23
Задание №8
Выберите два утверждения, которые справедливы и для этаналя, и для метаналя.
1) вступают в реакцию серебряного зеркала
2) плохо растворимы в воде
3) используют для получения фенолформальдегидной смолы
4) реагируют с оксидом меди (II)
5) являются гомологами друг другу
Решение
Ответ: 15
Задание №9
Выберите два утверждения, которые справедливы и для метанола, и для метаналя
1) при обычных условиях являются жидкостями
2) применяются в медицине
3) окисляются гидроксидом меди (II)
4) имеют специфический запах
5) являются неэлектролитами
Решение
Ответ: 45
Задание №10
Выберите два утверждения, которые справедливы для этаналя, но не справедливы для этанола.
1) могут быть получены из ацетилена в одну стадию
2) реагируют с натрием
3) молекулы содержат атомы углерода в состоянии sp2-гибридизации
4) могут быть получены при гидратации алкена
5) вступают в реакцию этерификации
Решение
Ответ: 13
Задание №11
Из предложенного перечня реакций, выберите две таких, в которые может вступать формальдегид.
1) гидрогалогенирование
2) межмолекулярная дегидратация
3) поликонденсация
4) окисление
5) гидролиз
Решение
Ответ: 34
Задание №12
Из предложенного перечня реакций, выберите две таких, которые характерны для диметилкетона:
1) полимеризация
2) этерификация
3) гидрирование
4) окисление
5) дегидрирование
Решение
Ответ: 34
Задание №13
Из предложенного перечня реакций, выберите две таких, в которые может вступать этаналь
1) гидролиз
2) окисление
3) дегидратация
4) восстановление
5) дегидрогалогенирование
Решение
Ответ: 24
Задание №14
Из предложенного перечня выберите два вещества, которые являются гомологами
1) ацетон
2) бутаналь
3) метанол
4) бутанон
5) метилацетат
Решение
Ответ: 14
Задание №15
Из предложенного перечня выберите два вещества, которые являются гомологами.
1) пропаналь
2) пропанон
3) пропанол-1
4) ацетальдегид
5) метилэтиловый эфир
Решение
Ответ: 14
Задание №16
Из предложенного перечня выберите два вещества, которые являются структурными изомерами
1) бутанон
2) 2-метилбутаналь
3) 2-метилпропаналь
4) пропаналь
5) пропанол
Решение
Ответ: 13
Задание №17
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентанона-2.
1) бутанон
2) бутаналь
3) диэтилкетон
4) пентаналь
5) метилпропилкетон
Решение
Ответ: 34
Задание №18
Из предложенного перечня соединений, выберите два вещества, с которыми вступает в реакцию пропанон.
- 1. HCl
- 2. H2
- 3. CH3Cl
- 4. CH3OH
- 5. Cu(OH)2
Решение
Ответ: 24
Задание №19
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию метаналь
- 1. Cu(OH)2
- 2. NaOH
- 3. H2
- 4. C2H4
- 5. CH3OCH3
Решение
Ответ: 13
Задание №20
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию этаналь
- 1. Ca(OH)2
- 2. CuO
- 3. [Ag(NH3)2]OH
- 4. CH3OH
- 5. CH3NH2
Решение
Ответ: 34
[adsp-pro-3]
Задание №21
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию ацетальдегид и пропанон.
- 1. Cu(OH)2
- 2. [Ag(NH3)2]OH
- 3. H2
- 4. HBr
- 5. O2
Решение
Ответ: 35
Задание №22
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию как этаналь, так и этанол.
- 1. CH3COOH
- 2. KMnO4
- 3. H2
- 4. CH3OH
- 5. Сu(OH)2
Решение
Ответ: 24
Задание №23
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию 2-метилпропаналь и бутанол-2.
- 1. [Ag(NH3)2]OH
- 2. CH3COOH
- 3. H2
- 4. O2
- 5. K2Cr2O7
Решение
Ответ: 45
Задание №24
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию гидрирования
1) метанол
2) метилциклогексан
3) метаналь
4) изопрен
5) пропанол-2
Решение
Ответ: 34
Задание №25
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию бромной водой.
1) пропан
2) этин
3) бензол
4) ацетальдегид
5) циклогексан
Решение
Ответ: 24
Задание №26
Из предложенного перечня соединений, выберите два вещества, которые могут вступать друг с другом в реакцию поликонденсации.
1) метанол
2) метаналь
3) фенол
4) этанол
5) этан
Решение
Ответ: 23
Задание №27
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию c [Ag(NH3)2]OH.
1) этанол
2) ацетальдегид
3) бутанол-1
4) дивинил
5) ацетилен
Решение
Ответ: 25
Задание №28
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию c [Ag(NH3)2]OH.
1) пропанон
2) пропин
3) бутин-2
4) метаналь
5) бутанон
Решение
Ответ: 24
Задание №29
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию с метанолом.
1) этин
2) этилен
3) пропаналь
4) этанол
5) гексан
Решение
Ответ: 34
Задание №30
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию как с пропеном, так и с пропаналем.
- 1. H2
- 2. CuO
- 3. Na
- 4. HCl
- 5. Br2(водн.)
Решение
Ответ: 15
[adsp-pro-3]
Задание №31
Из предложенного перечня соединений, выберите два вещества, с помощью которых можно отличить этаналь от метанола.
- 1. NaOH
- 2. NaHCO3
- 3. CuSO4
- 4. Cu(OH)2
- 5. CuO
Решение
Ответ: 45
Задание №32
Из предложенного перечня соединений, выберите два вещества, с помощью которых можно отличить этаналь он пропанона.
- 1. FeCl3
- 2. [Ag(NH3)2]OH
- 3. CuO
- 4. CuSO4
- 5. Br2(водн)
Решение
Ответ: 25
Задание №33
Из предложенного перечня соединений, выберите два вещества, с помощью которых можно различить растворы этаналя и метанола.
- 1. KOH
- 2. CH3COOH
- 3. [Ag(NH3)2]OH
- 4. Cu(OH)2
- 5. CaCO3
Решение
Ответ: 34
Задание №34
Из предложенного перечня, выберите две пары веществ, с каждым из которых реагирует этаналь.
- 1. N2, HCl
- 2. [Ag(NH3)2]OH, Cu(OH)2
- 3. Н2,HCl
- 4. Ca(OH)2, O2
- 5. Cu(OH)2, CH3OH
Решение
Ответ: 25
Задание №35
Из предложенного перечня веществ выберите два, которые не могут быть использованы для синтеза этаналя в одну стадию.
1) этилен
2) этин
3) этанол
4) 1,1,1-трихлорэтан
5) ацетат бария
Решение
Ответ: 45
Задание №36
Из предложенного перечня веществ выберите два, которые могут быть использованы для синтеза ацетона:
1) ацетат кальция
2) кумол
3) пропионат кальция
4) пропионовая кислота
5) бутин-2
Решение
Ответ: 12
Задание №37
Из предложенного перечня веществ выберите два, которые могут быть использованы для синтеза формальдегида.
1) этин
2) метанол
3) этанол
4) метан
5) метановая кислота
Решение
Ответ: 24
Задание №38
Из предложенного перечня веществ выберите два, которые могут быть использованы для синтеза ацетона в одну стадию.
1) этин
2) пропанол-2
3) пропанол-1
4) 2,2-дихлорпропан
5) 1,2-дихлорпропан
Решение
Ответ: 24
Задание №39
Из предложенного перечня веществ выберите два, которые могут быть использованы для синтеза ацетальдегида в одну стадию.
1) 1,1-дихлорэтан
2) этанол
3) хлорэтан
4) этилацетат
5) уксусная кислота
Решение
Ответ: 12
Задание №40
Из предложенного перечня веществ выберите два, которые могут быть использованы для синтеза ацетона.
1) стирол
2) изопропилбензол
3) ацетилен
4) пропанол-1
5) пропин
Решение
Ответ: 25
[adsp-pro-3]
Задание №41
Из предложенного перечня реакций выберите две такие, из которых в одну стадию может быть получен метаналь
1) метанол
2) метан
3) хлорметан
4) муравьиная кислота
5) метилметаноат
Решение
Ответ: 12
Задание №42
Из предложенного перечня веществ выберите две пары, которые вступают в реакцию «серебряного зеркала».
1) метаналь и метанол
2) ацетилен и метаналь
3) ацетальдегид и пропаналь
4) метаналь и глюкоза
5) бутин-1 и этаналь
Решение
Ответ: 34
Задание №43
Из предложенного перечня веществ выберите два таких, в функциональной группе которых присутствуют как, так σ- и π-связи.
1) этиленгликоль
2) циклогексанол
3) этаналь
4) этанол
5) пропанон
Решение
Ответ: 35
Задание №44
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию с гидроксидом меди (II).
1) пропаналь
2) пропанол
3) глюкоза
4) дивинил
5) гексан
Решение
Ответ: 13
Задание №45
Из предложенного перечня веществ выберите два таких, которые не вступают в реакцию с гидроксидом меди (II).
1) этанол
2) этиленгликоль
3) этилен
4) метаналь
5) глицерин
Решение
Ответ: 13
Задание №46
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию с гидроксидом меди (II).
1) уксусная кислота
2) пропаналь
3) пропанон
4) бутанол-1
5) метилацетат
Решение
Ответ: 12
Задание №47
Из предложенного перечня веществ выберите две пары соединений, каждое из которых вступает в реакцию «серебряного зеркала».
1) этаналь и диметиловый эфир
2) ацетилен и метаналь
3) метаналь и бензальдегид
4) фруктоза и метаналь
5) пропаналь и этаналь
Решение
Ответ: 35
Задание №48
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию с бензальдегидом.
- 1. H2
- 2. H2O
- 3. CuO
- 4. HNO3
- 5. HCl
Решение
Ответ: 14
Задание №49
Из предложенного перечня выберите два вещества, которые могут вступать в реакцию с бензальдегидом.
- 1. KOH
- 2. Ca(OH)2
- 3. HBr
- 4. Cu(OH)2
- 5. [Ag(NH3)2]OH
Решение
Ответ: 45
Задание №50
Представлена следующая схема превращений веществ:
CH3CHCl2 CH3CHO
Y
Определите, какие из указанных веществ являются веществами X и Y.
- 1. H2SO4
- 2. CH3COOH
- 3. NaOH(спирт.)
- 4. KOH(водн.)
- 5. С2H5OH
Решение
Ответ: 45
[adsp-pro-3]
Задание №51
Представлена следующая схема превращений веществ:
метанол муравьиный альдегид
Y
Определите, какие из указанных веществ являются веществами X и Y.
- 1. (NH4)2CO3
- 2. H2
- 3. Cu(OH)2
- 4. CuO
- 5. CH2O
Решение
Ответ: 41
Задание №52
Представлена следующая схема превращений веществ:
уксусный альдегид этанол
Y
Определите, какие из указанных веществ являются веществами X и Y.
- 1. Cu(OH)2
- 2. H2
- 3. C4H6
- 4. C2H5OC2H5
- 5. CuO
Решение
Ответ: 23
Задание №53
Представлена следующая схема превращений веществ:
этанол уксусный альдегид
Y
Определите, какие из указанных веществ являются веществами X и Y.
- 1. CH3CHO
- 2. CO2
- 3. CuO
- 4. CH3COONH4
- 5. H2
Решение
Ответ: 34
Задание №54
Представлена следующая схема превращений веществ:
(CH3COO)2Ca X
Y
Определите, какие из указанных веществ являются веществами X и Y.
1) пропанон
2) пропанол-1
3) пропен
4) метан
5) пропанол-2
Решение
Ответ: 15
Задание №55
Представлена следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
- 1. CH3CHO
- 2. CH3CH2COOH
- 3. CH3CH2COOK
- 4. C2H5OH
- 5. CH3CH2CHO
Решение
Ответ: 52
Задание №56
Представлена следующая схема превращений веществ:
CH≡CH X
Y
Определите, какие из указанных веществ являются веществами X и Y.
- 1. HCHO
- 2. CH3CHO
- 3. CH3COOH
- 4. CH3C(O)CH3
- 5. (CH3CH2COO)2Cu
Решение
Ответ: 23
Задание №57
Представлена следующая схема превращений веществ:
X ацетон
Y
Определите, какие из указанных веществ являются веществами X и Y.
1) пропен
2) ацетилен
3) пропаналь
4) пропанол-2
5) пропин
Решение
Ответ: 54
[adsp-pro-3]
Альдегиды и кетоны. Задания на установление соответствия.
Задание №1
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) C2H4O Б) C3H8O В) C2H6O2 Г) C6H6O |
1) сложный эфир 2) предельный одноатомный спирт 3) предельный многоатомный спирт 4) фенол 5) предельная карбоновая кислота 6) альдегид |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 6234
Задание №2
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) C3H4 Б) C3H8O3 В) C3H6O Г) C7H8O |
1) кетон 2) предельный многоатомный спирт 3) алкин 4) ароматическая карбоновая кислота 5) ароматичекий спирт |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3215
Задание №3
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) C3H8O2 Б) С4Н6 В) СН2О Г) C2H6O |
1) предельный многоатомный спирт 2) алкен 3) простой эфир 4) алкадиен 5) альдегид |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1453
Задание №4
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) C4H8O Б) С4Н6 В) СН4О Г) C3H6 |
1) предельный одноатомный спирт 2) простой эфир 3) кетон 4) алкин 5) циклоалкан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3415
Задание №5
Установите соответствие между названием веществ и общей формулой класса органических соединений, к которому оно относится: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| НАЗВАНИЕ ВЕЩЕСТВА | ОБЩАЯ ФОРМУЛА |
|
А) дивинил Б) ацетон В) формальдегид Г) стирол |
1) СnН2n-2 2) СnН2nO 3) СnН2n+2O 4) СnН2n-8 5) СnН2n-6 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1224
[adsp-pro-3]
Задание №6
Установите соответствие между исходными веществами и продуктом, который образуется в результате реакции между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) CH3CHO + Cu(OH)2 → Б) HCHO + Cu(OH)2 → В) CH3CHO + Н2 → Г) СН3С(О)СН3 + Н2 → |
1) углекислый газ 2) уксусная кислота 3) уксусный альдегид 4) этанол 5) метаналь 6) пропанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2146
Задание №7
Установите соответствие между исходными веществами и продуктом, который образуется в результате реакции между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) CH3CHO + [Ag(NH3)2]OH→ Б) НСНО + [Ag(NH3)2]OH → В) НС≡С-СН3 + [Ag(NH3)2]OH → Г) СН3-С≡С-СН3 + [Ag(NH3)2]OH → |
1) не взаимодействуют 2) ацетат аммония 3) ацетат серебра 4) карбонат аммония 5) пропинид серебра 6) бутинид серебра |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2451
Задание №8
Установите соответствие между исходными веществами и конечным продуктом их окисления подкисленным раствором перманганата калия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) CH3CHO Б) НСНО В) CH3OH Г) C2H5OH |
1) уксусная кислота 2) метановая кислота 3) оксид углерода (IV) 4) этандиол-1,2 5) карбонат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1331
Задание №9
Установите соответствие между исходными веществами и продуктом, который образуется в результате реакции между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) CH3CHO Б) НС≡С-СН3 В) СН3-СН=СН-СН3 Г) НСНО |
1) углекислый газ 2) уксусная кислота 3) уксусная кислота и углекислый газ 4) карбонат калия 5) бутандиол-2,3 6) этаноат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 6354
[adsp-pro-3]
Задание №10
Установите соответствие между исходными веществами и основным продуктом, который образуется в результате реакции между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
|
|
1) бензойная кислота 2) бензальдегид 3) циклогексанон 4) адипиновая кислота 5) фенол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4321
[adsp-pro-3]
Задание №11
Установите соответствие между формулами веществ и реагентом, применяющимся для обнаружения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
|
А) HCHO Б) С2Н4(ОН)2 В) С6Н5ОН Г) CH3CHO |
1) KOH 2) FeCl3 3) CuSO4 4) HCl 5) Сu(OH)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5525
Задание №12
Установите соответствие между формулами веществ и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАКТИВ |
|
А) пропин и метаналь Б) этаналь и пропанон В) фенол и этанол Г) метанол и метаналь |
1) [Ag(NH3)2]OH 2) K2SO3 3) фенолфталеин 4) NaOH 5) FeCl3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1151
[adsp-pro-3]
Цепочки и задачи на альдегиды и кетоны.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Решение
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
2,2-дихлорбутан X1
X2
X3
X4
X5
Решение
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
ацетилен этан
CO2
CO
H2CO
карбонат аммония
Решение
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
хлорциклогексан циклогексен
гександиовая кислота
адипинат кальция
циклопентанон
C5H10O
Решение
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
CH3COONa X1
X2
X3
X4
X5
X6
Решение
Задание №6
Навеску неизвестного соединения массой 7,2 г сожгли в избытке кислорода и получили 17,6 г углекислого газа и равное количество вещества воды. Определите молекулярную формулу данного соединения и его структуру, если известно, что оно не реагирует с гидроксидом меди при нагревании.
Решение
n(CO2) = m(CO2)/M(CO2) = 17,6/44 = 0,4 моль, следовательно, n(C) = n(CO2) = 0,4 моль,
m(C) = M(C)·n(C) = 12·0,4 = 4,8 г,
Из условия:
n(H2O) = 0,4 моль, следовательно,
n(H) = 2·n(H2O) = 2·0,4 = 0,8 моль,
m(H) = n(H)·M(H) = 0,8·1 = 0,8 г,
m(O) = m(в-ва) — m(C) — m(H) = 7,2 — 4,8 — 0,8 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль,
n(C):n(H):n(O) = 0,4:0,8:0,1 = 4:8:1
Таким образом, простейшая формула искомого соединения C4H8O.
Если предположить, что простейшая формула совпадает с истинной молекулярной, то искомым веществом может являться бутанон, структурная формула которого:
Действительно, бутанон не взамодействует с гидроксидом меди.
Задание №7
При сжигании навески неизвестного вещества массой 3,5 г образовалось 4,48 л углекислого (н.у.) газа и 2,7 г воды. Определите молекулярную формулу вещества и его структуру, если известно, что оно не реагирует с аммиачным раствором оксидом серебра и способно полимеризоваться.
Решение
n(CO2) = V(CO2)/Vm = 4,48/22,4 = 0,2 моль, следовательно, n(C) = n(CO2) = 0,2 моль,
m(C) = n(C)·M(C) = 0,2·12 = 2,4 г,
n(H2O) = m(H2O)/M(H2O) = 2,7/18 = 0,15 моль, следовательно, n(H) = 2·n(H2O) = 2·0,15 = 0,3 моль,
m(H) = M(H)·n(H) = 1·0,3 = 0,3 г,
m(O) = m(в-ва) — m(C) — m(H) = 3,5 — 2,4 — 0,3 = 0,8 г,
n(O) = m(O)/M(O) = 0,8/16 = 0,05 моль,
n(C):n(H):n(O) = 0,2:0,3:0,05 = 4:6:1
Таким образом, простейшая формула искомого соединения C4H6O.
Предположим, что данная формула является также истинной молекулярной. В условии сказано, что вещество не реагирует с аммиачным раствором оксида серебра. Это означает, что в молекуле отсутствуют альдегидные группы, а также концевые тройные связи. Также сказано, что вещество способно полимеризоваться. В реакцию полимеризации вступают непредельные соединения. Таким образом, искомым веществом может являться бутенон, который имеет структурную формулу:
Задание №8
Навеску неизвестного соединения массой 10,6 г сожгли в избытке кислорода. В результате образовалось 15,68 л (н.у.) углекислого газа и 5,4 г паров воды. Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно реагирует с перманганатом калия и имеет циклическое строение.
Решение
n(CO2) = V(CO2)/Vm = 15,68/22,4 = 0,7 моль, следовательно, n(C) = n(CO2) = 0,7 моль,
m(C) = n(C)·M(C) = 0,7·12 = 8,4 г,
n(H2O) = m(H2O)/M(H2O) = 5,4/18 = 0,3 моль, следовательно, n(H) = 2·n(H2O) = 2·0,3 = 0,6 моль,
m(H) = n(H)·M(H) = 0,6·1 = 0,6 г,
m(O) = m(в-ва) — m(C) — m(H) = 10,6 — 8,4 — 0,6 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль,
n(C):n(H):n(O) = 0,7:0,6:0,1 = 7:6:1
Таким образом, простейшая формула искомого соединения C7H6O.
Если предположить, что истинная формула искомого соединения совпадает с его простейшей, то подходит бензальдегид, структурная формула которого:
Действительно, данное соединение реагирует с перманганатом калия за счет окисления альдегидной группы, и, очевидно, имеет циклическое строение.
[adsp-pro-10]





















































