Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Строение, изомерия и гомологический ряд альдегидов и кетонов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
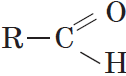
Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода.
Структурная формула альдегидов:
Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами.
Структурная формула кетонов:
Строение карбонильных соединений
Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три σ-связи и одну π-связь.
Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120о друг к другу.
π-Связь образована р-электронами атомов углерода и кислорода.
Из-за большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована, электронная плотность смещена к более электроотрицательному атому кислорода.
На атоме кислорода возникает частичный отрицательный (δ–), а на атоме углерода – частичный положительный (δ+) заряды.
Номенклатура карбонильных соединений
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-АЛЬ».
Нумерация ведется от атома углерода карбонильной группы.
Например, 2-метилпропаналь
- К названию кетонов добавляют в название суффикс «-ОН». После этого добавляют номер атомов углерода карбонильной группы.
- Тривиальные названия альдегидов и кетонов приведены в таблице.
Изомерия карбонильных соединений
Изомерия альдегидов
Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О соответствуют два альдегида-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют кетоны-изомеры углеродного скелета
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют два кетона-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Альдегид → карбоновая кислота
Формальдегид→ муравьиная кислота→ углекислый газ
вторичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
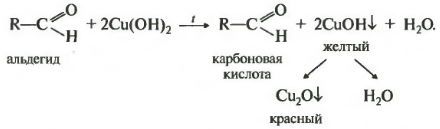
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Видеоопыт окисления муравьиного альдегида гидроксидом меди (II) можно посмотреть здесь.
Например, муравьиный альдегид окисляется гидроксидом меди (II)
HCHO + Cu(OH)2 = Cu + HCOOH + H2O
Чаще в этой реакции образуется оксид меди (I):
HCHO + 2Cu(OH)2 = Cu2O + HCOOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония
Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота
Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания метаналя:
CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
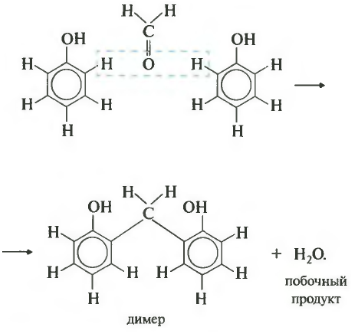
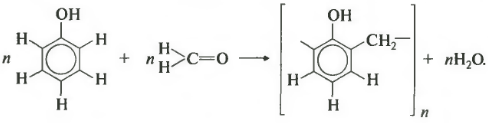
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
Получение карбонильных соединений
1. Окисление спиртов
При окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов – кетоны.
1.1. Окисление спиртов оксидом меди (II)
Например, при окислении этанола оксидом меди образуется уксусный альдегид
Например, при окислении изопропанола оксидом меди образуется ацетон
1.2. Окисление спиртов кислородом на меди
При пропускании паров спирта с кислородом над медной сеткой образуются альдегиды и кетоны.
Например, при окислении пропанола-1 кислородом в присутствии меди образуется пропаналь
В промышленности формальдегид получают окислением метанола на серебряном катализаторе при температуре 650оС и атмосферном давлении:
1.3. Окисление спиртов сильными окислителями
Вторичные спирты при этом окисляются до кетонов. Первичные спирты можно окислить до альдегидов, если предотвратить дальнейшее окисление альдегида (например, отгонять образующийся альдегид в ходе реакции).
2. Дегидрирование спиртов
При пропускании спирта над медной сеткой при нагревании образуются карбонильные соединения.
Например, при дегидрировании этанола образуется этаналь
3. Гидратация алкинов
Присоединение воды к алкинам в присутствии солей ртути (II) приводит к образованию карбонильных соединений.
Например, при гидратации ацетилена образуется уксусный альдегид
Например: при гидратации пропина образуется ацетон
4. Гидролиз дигалогенпроизводных алканов
Под действием водного раствора щелочи образуется неустойчивый диол с двумя ОН-группами при одном атоме С, он теряет воду, превращаясь в альдегид или кетон.
Например: при гидролизе 1,1-дихлорэтана образуется этаналь
5. Пиролиз солей карбоновых кислот
При нагревании солей карбоновых кислот и двухвалентных металлов образуются неорганические соли (карбонаты) и кетоны.
Например: при пиролизе ацетата кальция образуется ацетон и карбонат кальция:
6. Кумольный способ получения ацетона
Ацетон в промышленности получают каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
7. Каталитическое окисление алкенов
При окислении этилена кислородом в присутствии катализаторов образуется уксусный альдегид.
Альдегиды — органические вещества, молекулы которых содержат карбонильную группу 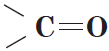
Общая формула альдегидов имеет вид:
В простейшем альдегиде — формальдегиде — роль углеводородного радикала играет второй атом водорода:
Карбонильную группу, связанную с атомом водорода, называют альдегидной:
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.
Очевидно, общая формула кетонов имеет вид:
Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
Номенклатура и изомерия
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль. Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. По этому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов — также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Тривиальные названия и температуры кипения некоторых альдегидов.
| Альдегид | Систематическое название (ИЮПАК) | Тривиальное название | $t_{кип.}, °С$ |
| $НСНО$ | Метаналь | Муравьиный альдегид, формальдегид | $–21$ |
| $СН_3CHО$ | Этаналь | Уксусный альдегид | $21$ |
| $СН_3CH_2CHО$ | Пропаналь | Пропионовый альдегид | $48$ |
| $СН_2=CHCHО$ | 2-Пропеналь | Акролеин | $53$ |
| $CH_3СН_2CH_2CHО$ | Бутаналь | Масляный альдегид | $74$ |
| $CH_3СН_2CH_2CH_2CHО$ | Пентаналь | Валериановый альдегид | $103$ |
| $C_6Н_5CHО$ | Бензальдегид | Бензойный альдегид | $179$ |
Физические и химические свойства
Физические свойства.
В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь $С=О$ сильно поляризована за счет смещения электронной плотности $π$-связи к кислороду:
Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов, в отличие от спиртов, нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Химические свойства
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Реакции восстановления.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:
Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2:
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Реакции окисления.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
Из пропионового альдегида (пропаналя), например, образуется пропионовая кислота:
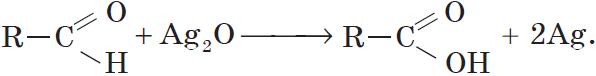
Альдегиды окисляются даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор оксида серебра. В упрощенном виде этот процесс можно выразить уравнением реакции:
Например:
Более точно этот процесс отражают уравнения:
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее ровной тонкой пленкой. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, $Cu^{2+}$ восстанавливается до $Cu^+$. Образующийся в ходе реакции гидроксид меди (I) $CuOH$ сразу разлагается на оксид меди (I) красного цвета и воду:
Эта реакция, так же, как и реакция «серебряного зеркала», используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид $HCHO$) — бесцветный газ с резким запахом и температурой кипения $–21С°$, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде ($40%$) называют формалином и применяют для дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности — для обработки кож. Формальдегид используют для получения уротропина — лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид $CH_3CHO$) — жидкость с резким неприятным запахом и температурой кипения $21°С$, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
Альдегиды и кетоны. Тренировочные задания для подготовки к ЕГЭ.
Тестовые задания с выбором двух вариантов ответа.
Задание №1
Выберите два утверждения, справедливые для формальдегида
1) хорошо растворим в воде
2) изменяет окраску индикаторов
3) является токсичным
4) молекула содержит атом углерода в состоянии sp3-гибридизации
5) в обычных условиях является жидкостью с характерным запахом
Решение
Ответ: 13
Задание №2
Выберите два утверждения, справедливые для ацетона.
1) молекула содержит атом углерода в состоянии sp2-гибридизации
2) хорошо растворим в воде
3) в обычных условиях является газом с резким запахом
4) между молекулами есть водородные связи
5) является гомологом ацетальдегида
Решение
Ответ: 12
Задание №3
Выберите два утверждения, которые не справедливы для ацетальдегида.
1) реагирует с серебром
2) хорошо растворим в воде
3) в промышленности может быть получен из этилена
4) является изомером метаналя
5) содержит карбонильную группу
Решение
Ответ: 14
Задание №4
Выберите два утверждения, справедливые для формальдегида.
1) проявляет кислотные свойства
2) содержит карбоксильную группу
3) его 40%-ный раствор называют формалином
4) при восстановлении дает метанол
5) все связи в молекуле ковалентные неполярные
Решение
Ответ: 34
Задание №5
Выберите два утверждения, справедливые для этаналя
1) гомологический рад имеет общую формулу CnH2nO2
2) молекула содержит 1 π-связь
3) может быть получен при окислении этанола
4) не является токсичным
5) при окислении не может образовать соль
Решение
Ответ: 23
Задание №6
Выберите два утверждения, которые справедливы и для этаналя, и для метаналя
1) в обычных условиях являются жидкостями
2) содержат в молекуле только атомы в состоянии sp2-гибридизации
3) имеют межклассовые изомеры
4) являются гомологами
5) при восстановлении образуют первичный спирт
Решение
Ответ: 45
Задание №7
Выберите два утверждения, которые справедливы и для этаналя, и для пропанона.
1) являются жидкостями без запаха
2) содержат карбонильную группу
3) могут быть получены из алкинов реакцией гидратации
4) при восстановлении образуют вторичные спирты
5) образуют межмолекулярные водородные связи
Решение
Ответ: 23
Задание №8
Выберите два утверждения, которые справедливы и для этаналя, и для метаналя.
1) вступают в реакцию серебряного зеркала
2) плохо растворимы в воде
3) используют для получения фенолформальдегидной смолы
4) реагируют с оксидом меди (II)
5) являются гомологами друг другу
Решение
Ответ: 15
Задание №9
Выберите два утверждения, которые справедливы и для метанола, и для метаналя
1) при обычных условиях являются жидкостями
2) применяются в медицине
3) окисляются гидроксидом меди (II)
4) имеют специфический запах
5) являются неэлектролитами
Решение
Ответ: 45
Задание №10
Выберите два утверждения, которые справедливы для этаналя, но не справедливы для этанола.
1) могут быть получены из ацетилена в одну стадию
2) реагируют с натрием
3) молекулы содержат атомы углерода в состоянии sp2-гибридизации
4) могут быть получены при гидратации алкена
5) вступают в реакцию этерификации
Решение
Ответ: 13
Задание №11
Из предложенного перечня реакций, выберите две таких, в которые может вступать формальдегид.
1) гидрогалогенирование
2) межмолекулярная дегидратация
3) поликонденсация
4) окисление
5) гидролиз
Решение
Ответ: 34
Задание №12
Из предложенного перечня реакций, выберите две таких, которые характерны для диметилкетона:
1) полимеризация
2) этерификация
3) гидрирование
4) окисление
5) дегидрирование
Решение
Ответ: 34
Задание №13
Из предложенного перечня реакций, выберите две таких, в которые может вступать этаналь
1) гидролиз
2) окисление
3) дегидратация
4) восстановление
5) дегидрогалогенирование
Решение
Ответ: 24
Задание №14
Из предложенного перечня выберите два вещества, которые являются гомологами
1) ацетон
2) бутаналь
3) метанол
4) бутанон
5) метилацетат
Решение
Ответ: 14
Задание №15
Из предложенного перечня выберите два вещества, которые являются гомологами.
1) пропаналь
2) пропанон
3) пропанол-1
4) ацетальдегид
5) метилэтиловый эфир
Решение
Ответ: 14
Задание №16
Из предложенного перечня выберите два вещества, которые являются структурными изомерами
1) бутанон
2) 2-метилбутаналь
3) 2-метилпропаналь
4) пропаналь
5) пропанол
Решение
Ответ: 13
Задание №17
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентанона-2.
1) бутанон
2) бутаналь
3) диэтилкетон
4) пентаналь
5) метилпропилкетон
Решение
Ответ: 34
Задание №18
Из предложенного перечня соединений, выберите два вещества, с которыми вступает в реакцию пропанон.
- 1. HCl
- 2. H2
- 3. CH3Cl
- 4. CH3OH
- 5. Cu(OH)2
Решение
Ответ: 24
Задание №19
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию метаналь
- 1. Cu(OH)2
- 2. NaOH
- 3. H2
- 4. C2H4
- 5. CH3OCH3
Решение
Ответ: 13
Задание №20
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию этаналь
- 1. Ca(OH)2
- 2. CuO
- 3. [Ag(NH3)2]OH
- 4. CH3OH
- 5. CH3NH2
Решение
Ответ: 34
[adsp-pro-3]
Задание №21
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию ацетальдегид и пропанон.
- 1. Cu(OH)2
- 2. [Ag(NH3)2]OH
- 3. H2
- 4. HBr
- 5. O2
Решение
Ответ: 35
Задание №22
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию как этаналь, так и этанол.
- 1. CH3COOH
- 2. KMnO4
- 3. H2
- 4. CH3OH
- 5. Сu(OH)2
Решение
Ответ: 24
Задание №23
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию 2-метилпропаналь и бутанол-2.
- 1. [Ag(NH3)2]OH
- 2. CH3COOH
- 3. H2
- 4. O2
- 5. K2Cr2O7
Решение
Ответ: 45
Задание №24
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию гидрирования
1) метанол
2) метилциклогексан
3) метаналь
4) изопрен
5) пропанол-2
Решение
Ответ: 34
Задание №25
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию бромной водой.
1) пропан
2) этин
3) бензол
4) ацетальдегид
5) циклогексан
Решение
Ответ: 24
Задание №26
Из предложенного перечня соединений, выберите два вещества, которые могут вступать друг с другом в реакцию поликонденсации.
1) метанол
2) метаналь
3) фенол
4) этанол
5) этан
Решение
Ответ: 23
Задание №27
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию c [Ag(NH3)2]OH.
1) этанол
2) ацетальдегид
3) бутанол-1
4) дивинил
5) ацетилен
Решение
Ответ: 25
Задание №28
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию c [Ag(NH3)2]OH.
1) пропанон
2) пропин
3) бутин-2
4) метаналь
5) бутанон
Решение
Ответ: 24
Задание №29
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию с метанолом.
1) этин
2) этилен
3) пропаналь
4) этанол
5) гексан
Решение
Ответ: 34
Задание №30
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию как с пропеном, так и с пропаналем.
- 1. H2
- 2. CuO
- 3. Na
- 4. HCl
- 5. Br2(водн.)
Решение
Ответ: 15
[adsp-pro-3]
Задание №31
Из предложенного перечня соединений, выберите два вещества, с помощью которых можно отличить этаналь от метанола.
- 1. NaOH
- 2. NaHCO3
- 3. CuSO4
- 4. Cu(OH)2
- 5. CuO
Решение
Ответ: 45
Задание №32
Из предложенного перечня соединений, выберите два вещества, с помощью которых можно отличить этаналь он пропанона.
- 1. FeCl3
- 2. [Ag(NH3)2]OH
- 3. CuO
- 4. CuSO4
- 5. Br2(водн)
Решение
Ответ: 25
Задание №33
Из предложенного перечня соединений, выберите два вещества, с помощью которых можно различить растворы этаналя и метанола.
- 1. KOH
- 2. CH3COOH
- 3. [Ag(NH3)2]OH
- 4. Cu(OH)2
- 5. CaCO3
Решение
Ответ: 34
Задание №34
Из предложенного перечня, выберите две пары веществ, с каждым из которых реагирует этаналь.
- 1. N2, HCl
- 2. [Ag(NH3)2]OH, Cu(OH)2
- 3. Н2,HCl
- 4. Ca(OH)2, O2
- 5. Cu(OH)2, CH3OH
Решение
Ответ: 25
Задание №35
Из предложенного перечня веществ выберите два, которые не могут быть использованы для синтеза этаналя в одну стадию.
1) этилен
2) этин
3) этанол
4) 1,1,1-трихлорэтан
5) ацетат бария
Решение
Ответ: 45
Задание №36
Из предложенного перечня веществ выберите два, которые могут быть использованы для синтеза ацетона:
1) ацетат кальция
2) кумол
3) пропионат кальция
4) пропионовая кислота
5) бутин-2
Решение
Ответ: 12
Задание №37
Из предложенного перечня веществ выберите два, которые могут быть использованы для синтеза формальдегида.
1) этин
2) метанол
3) этанол
4) метан
5) метановая кислота
Решение
Ответ: 24
Задание №38
Из предложенного перечня веществ выберите два, которые могут быть использованы для синтеза ацетона в одну стадию.
1) этин
2) пропанол-2
3) пропанол-1
4) 2,2-дихлорпропан
5) 1,2-дихлорпропан
Решение
Ответ: 24
Задание №39
Из предложенного перечня веществ выберите два, которые могут быть использованы для синтеза ацетальдегида в одну стадию.
1) 1,1-дихлорэтан
2) этанол
3) хлорэтан
4) этилацетат
5) уксусная кислота
Решение
Ответ: 12
Задание №40
Из предложенного перечня веществ выберите два, которые могут быть использованы для синтеза ацетона.
1) стирол
2) изопропилбензол
3) ацетилен
4) пропанол-1
5) пропин
Решение
Ответ: 25
[adsp-pro-3]
Задание №41
Из предложенного перечня реакций выберите две такие, из которых в одну стадию может быть получен метаналь
1) метанол
2) метан
3) хлорметан
4) муравьиная кислота
5) метилметаноат
Решение
Ответ: 12
Задание №42
Из предложенного перечня веществ выберите две пары, которые вступают в реакцию «серебряного зеркала».
1) метаналь и метанол
2) ацетилен и метаналь
3) ацетальдегид и пропаналь
4) метаналь и глюкоза
5) бутин-1 и этаналь
Решение
Ответ: 34
Задание №43
Из предложенного перечня веществ выберите два таких, в функциональной группе которых присутствуют как, так σ- и π-связи.
1) этиленгликоль
2) циклогексанол
3) этаналь
4) этанол
5) пропанон
Решение
Ответ: 35
Задание №44
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию с гидроксидом меди (II).
1) пропаналь
2) пропанол
3) глюкоза
4) дивинил
5) гексан
Решение
Ответ: 13
Задание №45
Из предложенного перечня веществ выберите два таких, которые не вступают в реакцию с гидроксидом меди (II).
1) этанол
2) этиленгликоль
3) этилен
4) метаналь
5) глицерин
Решение
Ответ: 13
Задание №46
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию с гидроксидом меди (II).
1) уксусная кислота
2) пропаналь
3) пропанон
4) бутанол-1
5) метилацетат
Решение
Ответ: 12
Задание №47
Из предложенного перечня веществ выберите две пары соединений, каждое из которых вступает в реакцию «серебряного зеркала».
1) этаналь и диметиловый эфир
2) ацетилен и метаналь
3) метаналь и бензальдегид
4) фруктоза и метаналь
5) пропаналь и этаналь
Решение
Ответ: 35
Задание №48
Из предложенного перечня соединений, выберите два вещества, которые могут вступать в реакцию с бензальдегидом.
- 1. H2
- 2. H2O
- 3. CuO
- 4. HNO3
- 5. HCl
Решение
Ответ: 14
Задание №49
Из предложенного перечня выберите два вещества, которые могут вступать в реакцию с бензальдегидом.
- 1. KOH
- 2. Ca(OH)2
- 3. HBr
- 4. Cu(OH)2
- 5. [Ag(NH3)2]OH
Решение
Ответ: 45
Задание №50
Представлена следующая схема превращений веществ:
CH3CHCl2 CH3CHO
Y
Определите, какие из указанных веществ являются веществами X и Y.
- 1. H2SO4
- 2. CH3COOH
- 3. NaOH(спирт.)
- 4. KOH(водн.)
- 5. С2H5OH
Решение
Ответ: 45
[adsp-pro-3]
Задание №51
Представлена следующая схема превращений веществ:
метанол муравьиный альдегид
Y
Определите, какие из указанных веществ являются веществами X и Y.
- 1. (NH4)2CO3
- 2. H2
- 3. Cu(OH)2
- 4. CuO
- 5. CH2O
Решение
Ответ: 41
Задание №52
Представлена следующая схема превращений веществ:
уксусный альдегид этанол
Y
Определите, какие из указанных веществ являются веществами X и Y.
- 1. Cu(OH)2
- 2. H2
- 3. C4H6
- 4. C2H5OC2H5
- 5. CuO
Решение
Ответ: 23
Задание №53
Представлена следующая схема превращений веществ:
этанол уксусный альдегид
Y
Определите, какие из указанных веществ являются веществами X и Y.
- 1. CH3CHO
- 2. CO2
- 3. CuO
- 4. CH3COONH4
- 5. H2
Решение
Ответ: 34
Задание №54
Представлена следующая схема превращений веществ:
(CH3COO)2Ca X
Y
Определите, какие из указанных веществ являются веществами X и Y.
1) пропанон
2) пропанол-1
3) пропен
4) метан
5) пропанол-2
Решение
Ответ: 15
Задание №55
Представлена следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
- 1. CH3CHO
- 2. CH3CH2COOH
- 3. CH3CH2COOK
- 4. C2H5OH
- 5. CH3CH2CHO
Решение
Ответ: 52
Задание №56
Представлена следующая схема превращений веществ:
CH≡CH X
Y
Определите, какие из указанных веществ являются веществами X и Y.
- 1. HCHO
- 2. CH3CHO
- 3. CH3COOH
- 4. CH3C(O)CH3
- 5. (CH3CH2COO)2Cu
Решение
Ответ: 23
Задание №57
Представлена следующая схема превращений веществ:
X ацетон
Y
Определите, какие из указанных веществ являются веществами X и Y.
1) пропен
2) ацетилен
3) пропаналь
4) пропанол-2
5) пропин
Решение
Ответ: 54
[adsp-pro-3]
Альдегиды и кетоны. Задания на установление соответствия.
Задание №1
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) C2H4O Б) C3H8O В) C2H6O2 Г) C6H6O |
1) сложный эфир 2) предельный одноатомный спирт 3) предельный многоатомный спирт 4) фенол 5) предельная карбоновая кислота 6) альдегид |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 6234
Задание №2
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) C3H4 Б) C3H8O3 В) C3H6O Г) C7H8O |
1) кетон 2) предельный многоатомный спирт 3) алкин 4) ароматическая карбоновая кислота 5) ароматичекий спирт |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3215
Задание №3
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) C3H8O2 Б) С4Н6 В) СН2О Г) C2H6O |
1) предельный многоатомный спирт 2) алкен 3) простой эфир 4) алкадиен 5) альдегид |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1453
Задание №4
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) C4H8O Б) С4Н6 В) СН4О Г) C3H6 |
1) предельный одноатомный спирт 2) простой эфир 3) кетон 4) алкин 5) циклоалкан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3415
Задание №5
Установите соответствие между названием веществ и общей формулой класса органических соединений, к которому оно относится: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| НАЗВАНИЕ ВЕЩЕСТВА | ОБЩАЯ ФОРМУЛА |
|
А) дивинил Б) ацетон В) формальдегид Г) стирол |
1) СnН2n-2 2) СnН2nO 3) СnН2n+2O 4) СnН2n-8 5) СnН2n-6 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1224
[adsp-pro-3]
Задание №6
Установите соответствие между исходными веществами и продуктом, который образуется в результате реакции между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) CH3CHO + Cu(OH)2 → Б) HCHO + Cu(OH)2 → В) CH3CHO + Н2 → Г) СН3С(О)СН3 + Н2 → |
1) углекислый газ 2) уксусная кислота 3) уксусный альдегид 4) этанол 5) метаналь 6) пропанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2146
Задание №7
Установите соответствие между исходными веществами и продуктом, который образуется в результате реакции между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) CH3CHO + [Ag(NH3)2]OH→ Б) НСНО + [Ag(NH3)2]OH → В) НС≡С-СН3 + [Ag(NH3)2]OH → Г) СН3-С≡С-СН3 + [Ag(NH3)2]OH → |
1) не взаимодействуют 2) ацетат аммония 3) ацетат серебра 4) карбонат аммония 5) пропинид серебра 6) бутинид серебра |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2451
Задание №8
Установите соответствие между исходными веществами и конечным продуктом их окисления подкисленным раствором перманганата калия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) CH3CHO Б) НСНО В) CH3OH Г) C2H5OH |
1) уксусная кислота 2) метановая кислота 3) оксид углерода (IV) 4) этандиол-1,2 5) карбонат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1331
Задание №9
Установите соответствие между исходными веществами и продуктом, который образуется в результате реакции между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) CH3CHO Б) НС≡С-СН3 В) СН3-СН=СН-СН3 Г) НСНО |
1) углекислый газ 2) уксусная кислота 3) уксусная кислота и углекислый газ 4) карбонат калия 5) бутандиол-2,3 6) этаноат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 6354
[adsp-pro-3]
Задание №10
Установите соответствие между исходными веществами и основным продуктом, который образуется в результате реакции между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
|
|
1) бензойная кислота 2) бензальдегид 3) циклогексанон 4) адипиновая кислота 5) фенол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4321
[adsp-pro-3]
Задание №11
Установите соответствие между формулами веществ и реагентом, применяющимся для обнаружения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
|
А) HCHO Б) С2Н4(ОН)2 В) С6Н5ОН Г) CH3CHO |
1) KOH 2) FeCl3 3) CuSO4 4) HCl 5) Сu(OH)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5525
Задание №12
Установите соответствие между формулами веществ и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАКТИВ |
|
А) пропин и метаналь Б) этаналь и пропанон В) фенол и этанол Г) метанол и метаналь |
1) [Ag(NH3)2]OH 2) K2SO3 3) фенолфталеин 4) NaOH 5) FeCl3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1151
[adsp-pro-3]
Цепочки и задачи на альдегиды и кетоны.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Решение
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
2,2-дихлорбутан X1
X2
X3
X4
X5
Решение
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
ацетилен этан
CO2
CO
H2CO
карбонат аммония
Решение
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
хлорциклогексан циклогексен
гександиовая кислота
адипинат кальция
циклопентанон
C5H10O
Решение
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
CH3COONa X1
X2
X3
X4
X5
X6
Решение
Задание №6
Навеску неизвестного соединения массой 7,2 г сожгли в избытке кислорода и получили 17,6 г углекислого газа и равное количество вещества воды. Определите молекулярную формулу данного соединения и его структуру, если известно, что оно не реагирует с гидроксидом меди при нагревании.
Решение
n(CO2) = m(CO2)/M(CO2) = 17,6/44 = 0,4 моль, следовательно, n(C) = n(CO2) = 0,4 моль,
m(C) = M(C)·n(C) = 12·0,4 = 4,8 г,
Из условия:
n(H2O) = 0,4 моль, следовательно,
n(H) = 2·n(H2O) = 2·0,4 = 0,8 моль,
m(H) = n(H)·M(H) = 0,8·1 = 0,8 г,
m(O) = m(в-ва) — m(C) — m(H) = 7,2 — 4,8 — 0,8 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль,
n(C):n(H):n(O) = 0,4:0,8:0,1 = 4:8:1
Таким образом, простейшая формула искомого соединения C4H8O.
Если предположить, что простейшая формула совпадает с истинной молекулярной, то искомым веществом может являться бутанон, структурная формула которого:
Действительно, бутанон не взамодействует с гидроксидом меди.
Задание №7
При сжигании навески неизвестного вещества массой 3,5 г образовалось 4,48 л углекислого (н.у.) газа и 2,7 г воды. Определите молекулярную формулу вещества и его структуру, если известно, что оно не реагирует с аммиачным раствором оксидом серебра и способно полимеризоваться.
Решение
n(CO2) = V(CO2)/Vm = 4,48/22,4 = 0,2 моль, следовательно, n(C) = n(CO2) = 0,2 моль,
m(C) = n(C)·M(C) = 0,2·12 = 2,4 г,
n(H2O) = m(H2O)/M(H2O) = 2,7/18 = 0,15 моль, следовательно, n(H) = 2·n(H2O) = 2·0,15 = 0,3 моль,
m(H) = M(H)·n(H) = 1·0,3 = 0,3 г,
m(O) = m(в-ва) — m(C) — m(H) = 3,5 — 2,4 — 0,3 = 0,8 г,
n(O) = m(O)/M(O) = 0,8/16 = 0,05 моль,
n(C):n(H):n(O) = 0,2:0,3:0,05 = 4:6:1
Таким образом, простейшая формула искомого соединения C4H6O.
Предположим, что данная формула является также истинной молекулярной. В условии сказано, что вещество не реагирует с аммиачным раствором оксида серебра. Это означает, что в молекуле отсутствуют альдегидные группы, а также концевые тройные связи. Также сказано, что вещество способно полимеризоваться. В реакцию полимеризации вступают непредельные соединения. Таким образом, искомым веществом может являться бутенон, который имеет структурную формулу:
Задание №8
Навеску неизвестного соединения массой 10,6 г сожгли в избытке кислорода. В результате образовалось 15,68 л (н.у.) углекислого газа и 5,4 г паров воды. Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно реагирует с перманганатом калия и имеет циклическое строение.
Решение
n(CO2) = V(CO2)/Vm = 15,68/22,4 = 0,7 моль, следовательно, n(C) = n(CO2) = 0,7 моль,
m(C) = n(C)·M(C) = 0,7·12 = 8,4 г,
n(H2O) = m(H2O)/M(H2O) = 5,4/18 = 0,3 моль, следовательно, n(H) = 2·n(H2O) = 2·0,3 = 0,6 моль,
m(H) = n(H)·M(H) = 0,6·1 = 0,6 г,
m(O) = m(в-ва) — m(C) — m(H) = 10,6 — 8,4 — 0,6 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль,
n(C):n(H):n(O) = 0,7:0,6:0,1 = 7:6:1
Таким образом, простейшая формула искомого соединения C7H6O.
Если предположить, что истинная формула искомого соединения совпадает с его простейшей, то подходит бензальдегид, структурная формула которого:
Действительно, данное соединение реагирует с перманганатом калия за счет окисления альдегидной группы, и, очевидно, имеет циклическое строение.
[adsp-pro-10]
КАРБОНИЛЬНЫЕ
СОЕДИНЕНИЯ.
Это соединения,
содержащие в молекуле КАРБОНИЛЬНУЮ группу >C=O.
АЛЬДЕГИДАМИ называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. Общая формула альдегидов:
КЕТОНАМИ называются соединения, в молекуле которых карбонильная
группа связана с двумя углеводородными радикалами. Общая формула кетонов:
ВИДЫ
ИЗОМЕРИИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ.
Изомерия альдегидов:
v
изомерия углеродного скелета, начиная с С4
v
межклассовая изомерия с кетонами, начиная с С3
v
непредельными спиртами и простыми эфирами (с С3)
Изомерия кетонов:
v
углеродного скелета (c C5)
v
положения карбонильной группы (c C5)
v
межклассовая изомерия (с альдегидами).
Строение
карбонильной группы.
Атом углерода в карбонильной группе
находится в состоянии sp2 -гибридизации и образует три σ — связи
(одна из них – связь С–О), которые расположены
в одной плоскости под углом 120оС друг к другу.
π-Связь
образована р-электронами атомов углерода и кислорода.
Ввиду
большей электроотрицательности атома кислорода по сравнению с атомом углерода,
связь С=О
сильно поляризована за счет смещения электронной плотности π- связи к атому
кислорода, в результате чего на атоме кислорода возникает частичный
отрицательный (δ—), а на атоме углерода – частичный положительный (δ+)
заряды:
ПОЛУЧЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ.
|
1.Окисление спиртов: а) при окислении первичных б) при окислении вторичных |
Первичные спирты при окислении образуют альдегиды, Окислить первичный спирт до альдегида можно: а) нагреванием над оксидом меди (II): СН3-СН2-СН2-ОН+CuO –tàCH3—CH2—C=O + Cu + H2O б) пропусканием смеси паров спирта с кислородом над медной сеткой: 2СН3-СН2-СН2-ОН При окислении вторичных спиртов образуются |
|
2. Дегидрирование |
СН3-СН2-СН2-ОН |
|
3. Реакция Кучерова а) при гидратации б) при гидратации других |
Присоединение воды к ацетилену в присутствии Кетоны получают при гидратации других гомологов |
|
4. Гидролиз дигалогенпроизводных |
СН3–CH2— à H2O + CH3— CH2 —
H |
|
5. Пиролиз кальциевых |
(СН3—СОО)2Са –tà CaCO3 + CH3—C—CH3 ацетат кальция \ |
|
6.Окисление алкенов (катализаторы — хлориды Pd и |
|
|
7.Кумольный способ получения ацетона (наряду с фенолом). |
|
СВОЙСТВА АЛЬДЕГИДОВ И
КЕТОНОВ.
|
1. Гидрирование |
Альдегиды при взаимодействии с |
|
2. Присоединение |
1.Присоединение 2.Присоединение Полуацетали — соединения, в которых атом углерода связан с гидроксильной и 3.Присоединение / H H |
|
3. Окисление |
Реакция R–CH=O+2[Ag(NH3)2]OH соль В случае муравьиного альдегида – продуктом НCH=O+4[Ag(NH3)2]OH à(NH4)2СО3+ 4Ag + 6NH3 + 2H2O При подкислении реакционной смеси Иногда пишут упрощенный вариант реакции: RCH=O + Ag2O Окисление RCH=O +2Cu(OH)2 -tà красный осадок КЕТОНЫ окисляются с трудом при действии сильных окислителей и нагревании с разрывом С–С-связей (соседних с карбонилом) и |
|
4. Конденсация с фенолами. |
Практическое значение имеет реакция Дальнейшее взаимодействие с другими |
1. Реакции присоединения к альдегидам и кетонам
Первая группа свойств — реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи. В реакциях присоединения пи-связь рвется и образуются две сигма связи — одна с углеродом, вторая — с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде — частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород — положительно заряженная часть молекулы.
Первое свойство — гидрирование, присоединение водорода.
Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования — никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.
У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство — гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.
Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты, наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая — гидрат формальдегида и уксусного альдегида — возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство — присоединение синильной кислоты.
Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство — присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.
Как обычно в реакциях присоединения к карбонильной группе — плюс к минусу, а минус к плюсу.
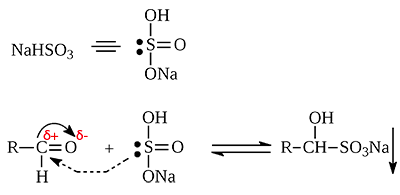
Пятое свойство — реакция с гидросульфитом натрия.
И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа — реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид — это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство — полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство — поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.
В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.
Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение — от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств — реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу — окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.
Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль — ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу — окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.
Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду. Так вот это неверно — по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты. Реакция встречается на егэ очень часто.
Десятая реакция — окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO2, проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция — горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n. Слева атомов кислорода столько же — 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород. Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения — галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде. Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом. Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 430 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Добавить в вариант
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) ацетилен
2) бромметан
3) этилен
4) муравьиный альдегид
5) уксусная кислота
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 2
Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
A) этаналь и перманганат калия (подкисленный раствор)
Б) этаналь и водород
В) ацетон и водород
Г) пропаналь и аммиачный раствор оксида серебра
ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ
1) этанол
2) пропионат аммония
3) уксусная кислота
4) пропанол-1
5) пропанол-2
6) этиленгликоль
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропаналь и гидроксид меди(II) (в растворе NaOH)
Б) пропаналь и перманганат калия (в сернокислом растворе)
В) пропаналь и водород
Г) пропаналь и бромная вода
ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Верны ли следующие суждения о свойствах указанных кислородсодержащих органических соединений?
А. Метаналь взаимодействует с гидроксидом меди(II).
Б. Муравьиная кислота вступает в реакцию «серебряного зеркала».
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5
Установите соответствие между реагирующими веществами и органическим продуктом их взаимодействия: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Из предложенного перечня выберите все вещества, с которыми реагирует этаналь.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите все вещества, с которыми реагируют как этаналь, так и ацетон.
1)
2)
3)
4)
5)
Из предложенного перечня выберите все вещества, с каждым из которых взаимодействует как муравьиная кислота, так и метаналь.
1) сера
2) карбонат натрия
3) аммиачный раствор оксида серебра
4) фенол
5) гидроксид меди(II)
Запишите в поле ответа номера выбранных веществ.
Источник: ЕГЭ по химии 2019. Досрочная волна
Задания Д14 № 19
Метанол образуется в результате взаимодействия
1) ацетилена с водой
2) гидрирования формальдегида
3) этилена с водой
4) метана с водой
Источник: Демонстрационная версия ЕГЭ—2012 по химии
Задания Д15 № 74
С пропаналем взаимодействует каждое из двух веществ:
1)
2)
3)
4)
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
Задания Д19 № 222
С гидроксидом меди (II) может взаимодействовать
1) этил ацетат
2) глюкоза
3) пропаналь
4) метановая кислота
5) пропанол-1
6) пропанол-2
Задания Д19 № 394
Ацетальдегид взаимодействует с
1)
2)
3)
4)
5)
6)
Задания Д19 № 437
Муравьиная кислота взаимодействует с
1) оксидом углерода (IV)
2) азотом
3) карбонатом кальция
4) хлороводородом
5) пропанолом-1
6) оксидом серебра (аммиачный раствор)
Задания Д19 № 695
С гидроксидом меди (II) может взаимодействовать
1) этилацетат
2) этандиол-1,2
3) формальдегид
4) этановая кислота
5) пропанол-1
6) пропанол-2
Задания Д14 № 935
Бутановая кислота образуется в результате взаимодействия
1) бутаналя с кислородом
2) бутана с азотной кислотой
3) бутена-1 с соляной кислотой
4) бутанола-1 с гидроксидом натрия
Задания Д19 № 996
Метаналь может реагировать с
1)
2)
3)
4)
5)
6)
Пропанол-1 образуется в результате реакции, схема которой
1)
2)
3)
4)
Для пропаналя характерна(-о):
1) sр-гибридизация атомов углерода
2) изменение окраски индикатора
3) восстановительные свойства
4) взаимодействие с гидроксидом меди (II)
5) взаимодействие с аммиачным раствором оксида серебра (I)
6) взаимодействие с карбоновыми кислотами
Верны ли следующие суждения о свойствах муравьиной кислоты?
А. Вступает в реакцию с аммиачным раствором оксида серебра.
Б. Является одноосновной кислотой.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
2-Метилпропаналь реагирует с
1) водородом
2) натрием
3) соляной кислотой
4) свежеосажденным гидроксидом меди(II)
5) уксусной кислотой
6) перманганатом калия
Всего: 430 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ
АЛЬДЕГИДЫ — органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода.
Общая формула
КЕТОНЫ — соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами.
Общая формула:
ФИЗИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ
Формальдегид представляет собой газообразное при комнатной температуре вещество.
Альдегиды до С12 — жидкости, а альдегиды нормального строения с более длинным неразветвлённым углеродным скелетом, являются твёрдыми веществами.
Формальдегид и ацетальдегид практически неограниченно смешиваются с водой, однако, с ростом длины углеродного скелета, растворимость альдегидов в воде сильно уменьшается.
Низшие альдегиды имеют резкий запах, а высшие гомологи (С8-С13) являются компонентами многих парфюмерных изделий. Ацетон — летучая жидкость, плохо растворимая в воде.
ХИМИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ.
РЕАКЦИИ ПРИСОЕДИНЕНИЯ ПО С=О СВЯЗИ
1. Гидрирование (восстановление)
Альдегиды при взаимодействии с водородом в присутствии Ni образуют первичные спирты, кетоны — вторичные:
2. Присоединение воды – образуются гидраты (реакция обратима) :
3. Присоединение циановодородной (синильной) кислоты НСN — образуются оксинитрилы:
4.Присоединение спиртов → полуацетали (катализатор — кислота или основание).
Полуацетали — соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к образованию ацеталя (две алкоксильные группы):
5. Реакция полимеризации → при длительном стоянии
Образуется осадок белого цвета – параформальдегид (с n= 8-10)
6. Реакция тримеризации → из формальдегида образуется
циклическое вещество триоксан, из уксусного альдегида — паральдегид
7. Реакция поликонденсации → образуются полимеры
Из формальдегида с фенолом → фенолформальдегидная смола.
(катализаторы — кислоты или основания) .
РЕАКЦИЯ ЗАМЕЩЕНИЯ КАРБОНИЛЬНОГО КИСЛОРОДА
1.Взаимодействие с пентахлоридом фосфора — образуются дихлоралканы
ОКИСЛЕНИЕ АЛЬДЕГИДОВ.
Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием мягких окислителей:
оксид серебра (аммиачный раствор) и гидроксид меди (II).
Данные реакции являются качественными на альдегидную группу
1. Реакция «серебряного зеркала« – окисление аммиачным раствором оксида серебра — качественная реакция №1 (серебряный налет на поверхности пробирки).
При
подкислении реакционной смеси образуются соли аммония карбоновых кислот, которые подвергаются гидролизу
При окислении муравьиного альдегида образуется карбонат аммония, при гидролизе дающий углекислый газ.
2. Окисление гидроксидом меди (II) → образуются кислоты. Качественная реакция №2 ( голубой осадок гидроксида меди при нагревании переходит в красно-кирпичноый осадок Cu2O)
3. Окисление кетонов.
Кетоны значительно более устойчивы к окислению, чем альдегиды, т. к. рядом с карбонильной группой у них нет атома водорода.
Сильные окислители, такие как перманганат калия и азотная кислота окисляют кетоны с разрывом углеродной цепи до кислот:
4. Горение альдегидов и кетонов → углекислый газ и вода
СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
Общая формула одноосновных карбоновых кислот предельного ряда: СnH2n+1COOH, или СnH2nO2.
Простейшая карбоновая кислота – муравьиная, не содержит радикала.
ФИЗИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
Низшие кислоты с числом атомов углерода до 3 — легкоподвижные бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом.
Карбоновые кислоты кипят при значительно более высоких температурах, чем спирты.
Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя.
ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
1. Простейшие карбоновые кислоты в водном растворе диссоциируют на ионы:
КИСЛОТНЫЕ СВОЙСТВА
ЗАМЕЩЕНИЕ АТОМА Н В КАРБОКСИЛЬНОЙ ГРУППЕ НА МЕТАЛЛ ИЛИ ИОН АММОНИЯ.
2.Взаимодействие с металлами → соли карбоновых кислот +H2↑
Реагируют с металлами, стоящими в ряду активности до водорода.
Самая сильная кислота — муравьиная.
3.Взаимодействие с оксидами металлов → соль + H2O
4.Реакция нейтрализации с гидроксидами металлов → соль + H2O
5.Взаимодействие с солями более слабых и летучих кислот → соль + газ
II. ЗАМЕЩЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ:
1.Реакция этерификации – образуются сложные эфиры
Высшие карбоновые кислоты с глицерином образуют сложные эфиры — жиры.
2.Взаимодействие с хлоридами фосфора (III) И (V) — образование галогенангидридов
3. Взаимодействие с аммиаком — образование амидов.
Вместо карбоновых кислот чаще используют их галогенангидриды:
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из λ-аминокислот с участием амидных групп — пептидных связей
4. Взаимодействие с оксидом фосфора — получение ангидридов карбоновых кислот.
С помощью Р2О5 можно дегидратировать карбоновую кислоту – в результате получается ангидрид.
III. ЗАМЕЩЕНИЕ АТОМА ВОДОРОДА ПРИ АТОМЕ УГЛЕРОДА, БЛИЖАЙШЕМ К КАРБОКСИЛЬНОЙ ГРУППЕ
1.Галогенирование кислот — замещение атомов водорода в радикале (реакция идёт в присутствии красного фосфора или на свету).
ОКИСЛЕНИЕ
1. Горение в атмосфере кислорода (образуется углекислый газ и вода):
ОСОБЕННОСТИ МУРАВЬИНОЙ КИСЛОТЫ
1. Разложение при нагревании — образуется угарный газ и вода.
2. Реакция «серебряного зеркала» и взаимодействие с гидроксидом меди (II) – муравьиная кислота проявляет свойства альдегидов.
3. Окисление галогенами и азотной кислотой — образуется углекислый газ.
ОСОБЕННОСТИ ЩАВЕЛЕВОЙ КИСЛОТЫ.
1. Разложение при нагревании — образуется углекислый газ, угарный газ и вода.
2. Разложение при 150C — образуется муравьиная кислота:
3. Окисление перманганатом калия — образуется угольная кислота
4. Взаимодействие с щелочами — образуется кислая соль, затем средняя:
5. Образование нерастворимого осадка оксалата кальция при добавлении к раствору кислоты растворимых солей кальция (обнаружения кальция или щавелевой кислоты):
ОСОБЕННОСТИ НЕПРЕДЕЛЬНЫХ КИСЛОТ (АКРИЛОВОЙ И ОЛЕИНОВОЙ).
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
1. Присоединение воды и галогеноводородов к акриловой кислоте идет против правила Марковникова.
2. Присоединение галогенов и водорода:
1. При мягком окислении акриловой кислоты: образуется 2 гидроксогруппы:
Под действием жесткого окислителя двойная связь рвется с образованием из осколков молекулы кислот и/или кетонов:
ОСОБЕННОСТИ БЕНЗОЙНОЙ КИСЛОТЫ
Проявляет свойства карбоновых кислот и ароматических углеводородов
СВОЙСТВА СОЛЕЙ КАРБОНОВЫХ КИСЛОТ.
1. Обменные процессы с более сильными кислотами и щелочами.
2. Термическое разложение солей двухвалентных металлов (кальция, магния, бария) — образуются кетоны.
3. Сплавление солей щелочных металлов с щелочами — образуются алканы и карбонаты (реакция Дюма).
4. Электролиз водных растворов солей карбоновых кислот (реакция Кольбе) — образуются алканы.
СВОЙСТВА ГАЛОГЕНАНГИДРИДОВ
1. При гидролизе образуются соответствующие кислоты
2. Взаимодействие бензола, аминов, фенола с галогенангидридами — образуются кетонные соединения.
СВОЙСТВА СЛОЖНЫХ ЭФИРОВ
Соединения, образующиеся в результате реакции этерификации (взаимодействия карбоновых кислот со спиртами.
Общая формула:
ФИЗИЧЕСКИЕ СВОЙСТВА.
Сложные эфиры — бесцветные жидкости, малорастворимые или совсем не растворимые в воде, обладают специфическим запахом (в малых концентрациях — приятным, часто фруктовым или цветочным).
Сложные эфиры высших спиртов и высших кислот — твердые вещества.
ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ (бывает кислотный и щелочной).
1 Кислотный гидролиз ведет к образованию кислоты и спирта, обратим:
2. Щелочной гидролиз ведет к образованию соли карбоновой кислоты (мыло) и спирта, поэтому эту реакцию называют омылением. Процесс необратим.
ВОССТАНОВЛЕНИЕ СЛОЖНЫХ ЭФИРОВ.
Восстановление сложных эфиров водородом приводит к образованию двух спиртов
Взаимодействие с аммиаком — образование амидов
15(Б) Тесты ЕГЭ ФИПИ 2015 Альдегиды. Кетоны. Карбоновые кислоты





































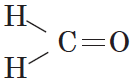
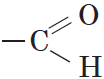
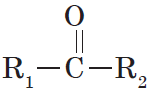
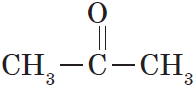
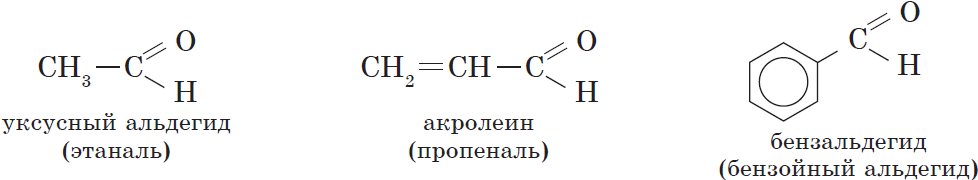
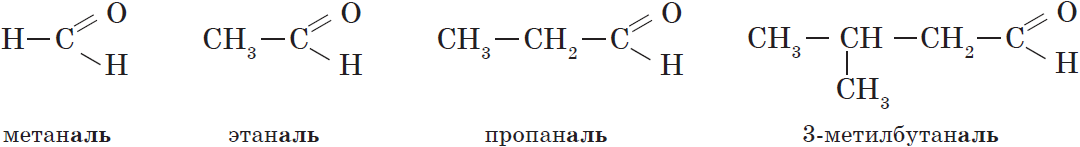

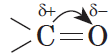
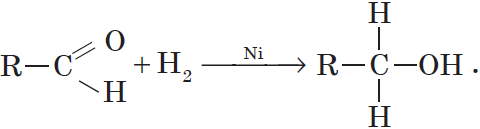
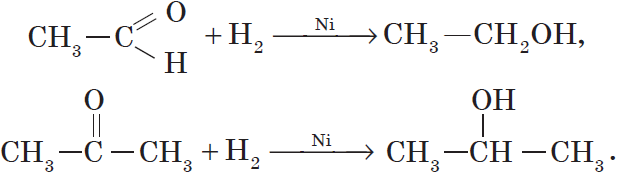
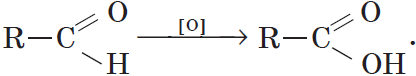
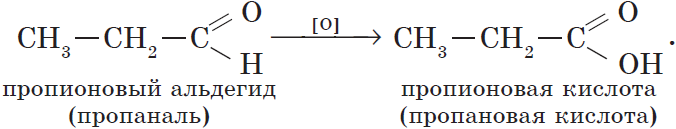
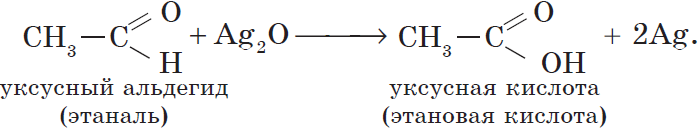
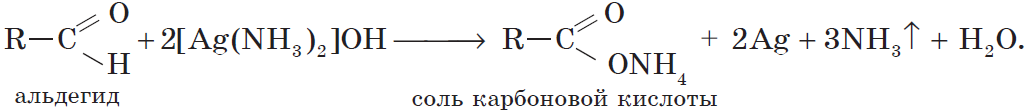
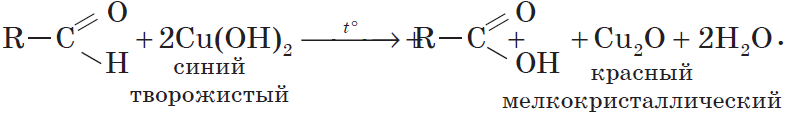






















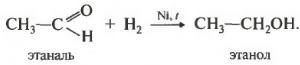
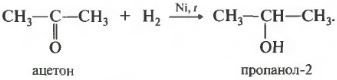
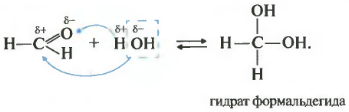
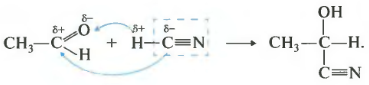
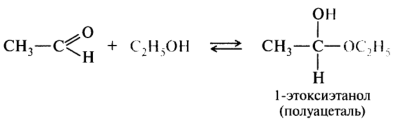
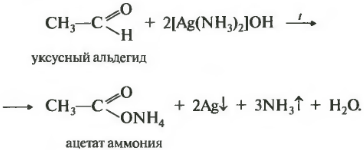

![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)




























































