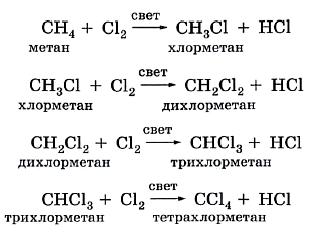Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько
основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает
химическое строение. - Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его
свойствах. - Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда
— CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления
этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos —
соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить
читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они
связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи
и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д. - Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный
атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по
строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной
(геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28′

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить
одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем
крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Гриньяра
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного
радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).

На схеме выше мы сначала получили реактив Гриньяра, а потом
использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
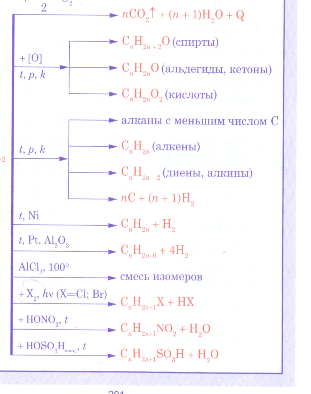
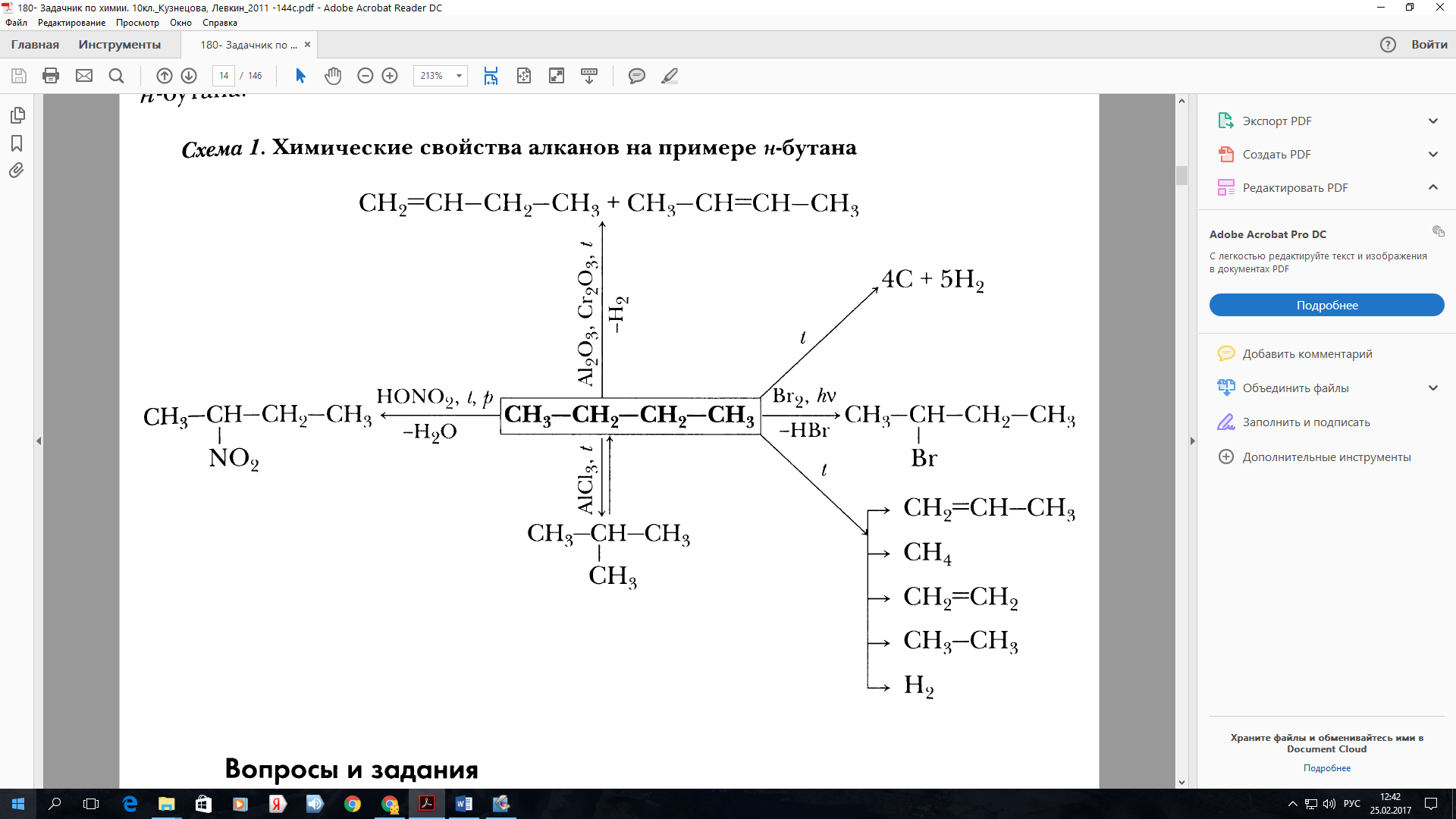
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для
алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее — у вторичного и значительно труднее — у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы,
которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция
идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)

Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное
отличие пиролиза от горения — в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат.) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат.) CH2=CH2 + H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их
химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Гомологический ряд алканов
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Все алканы легче воды, не растворимы в воде и не смешиваются с ней.
Строение алканов
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Наример, пространственное строение н-бутана — зигзагообразное
Изомерия алканов
Структурная изомерия
Для алканов характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
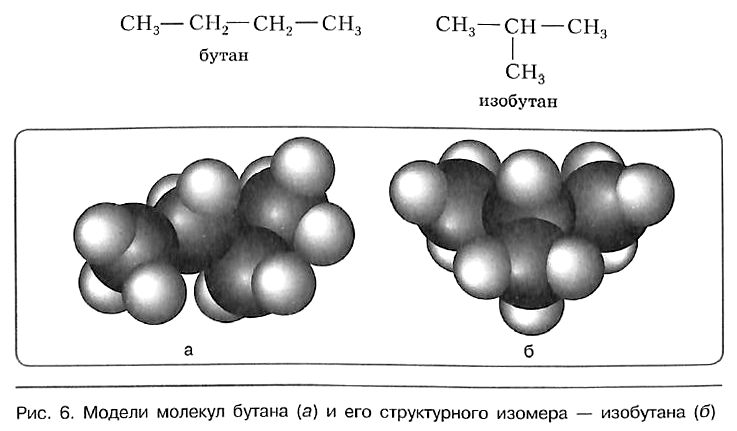
Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан
С увеличением числа атомов углерода в молекуле увеличивается количество изомеров, соответствующих данной формуле. У метана CH4, этана C2H6 и пропана C3H8 структурных изомеров нет.
Количество изомеров в ряду алканов:
| Молекулярная формула | Число структурных изомеров |
| C4H10 | 2 |
| C5H12 | 3 |
| C6H14 | 5 |
| C7H16 | 9 |
| C8H18 | 18 |
| C9H20 | 35 |
| C10H22 | 75 |
Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:
то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
Номенклатура алканов
В названиях алканов используется суффикс -АН.
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
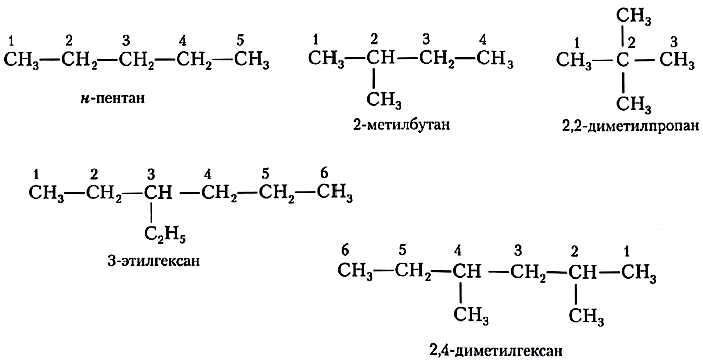
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:
2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения
2.1. Дегидрирование и дегидроциклизация
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
2.2. Пиролиз (дегидрирование) метана
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Получение алканов
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Хлорэтан взаимодействует с натрием с образованием бутана:
Реакция больше подходит для получения симметричных алканов.
При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
2. Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO– + Na+
При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O.
Разряжаться на катоде будут молекулы воды:
Kатод(-): 2H2O + 2e = H2 + 2OH–
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы.
При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан:
Aнод(+): 2CH3COO– – 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
4. Гидрирование алкенов, алкинов, циклоалканов, алкадиенов
При гидрировании этилена образуется этан:
При полном гидрировании ацетилена также образуется этан:
При гидрировании циклопропана образуется пропан:
5. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (2n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
6. Получение алканов в промышленности
В промышленности алканы получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.

I. Строение
sp3-гибридизация ∠109°28
λ|C—C|=0,154 нм Одинарная
связь, CH4-
Зигзагообразное
строение
Свободное
вращение
Тетраэдр
II. Изомерия
У/В цепи C—C—C—C—C : C—C—C—C
пентан C 2-метилпентан
III.Получение

2. Изомеризация C
C—C—C—C—C—C—C—C AlCl3, 450° C—C—C—C—Cl
Повышение октанового числа жидких У/В C6—C10
C C изооктан
3. Гидрирования (+H2) алкенов
H3C—CH2—CH=CH2+H2 Pt C—C—C—C
бутен-1 бутан

NaOH+CH3COONa (ацетат Na) Na2CO3+CH4
Тв Тв
R-CH2COONa+
NaOH R-CH3+Na2CO3 Al4C3+2H20
4Al (OH)3+CH4 CH3-CH2-CH2-COONa
C3H8
CH3-CH2COONa (иропионат Na) C2H6 карбид AC
бутаноат Na
5. Синтез
Вюрца
2CH3-CH2Br+Na
CH3-CH2-CH2-CH3+2NaBr CH3Br+C2H5Br+2Na
2NaBr+CH3-C2H5 пропан
бутан
CH3-CH3 этан
CH3-CH2-CH2-CH3
бутан
6. Электролиз Кольбе
2R-COONa+2H20
R-R+2CO2 +H2+2NaOH
на аноде на катоде
IV.Физические свойства
C1—C4 — Г (газы) C5—C15 — Ж
(жидкости) С16› Тв (твердые вещества), плохо
растворимы в воде
Ж(жидкости)
– органические растворители
V. Химические
свойства
Устойчивы
к окислителям, не обеспечивает Br2
1. Реакция
замещения (свободнорадикальный)
а) НаCl2
CH4+Cl2 hv CH3Cl+HCl , CHCl3 , CCl4
хлорметан хлороформ
четыреххлористый углерод
C—C—C + Br2 hv
C—C—C + HBr2
Br 2-бромпропан
б) Нитрирования
CH4+HNO3(10 % р-р) 120° CH3NO2 + H20
нитрометан (р-ль)
2. Дегидрирование
CH3—CH3 Pc, N2,
400-600° CH2=CH2+M2
3. Крекинг
C4H10
t C2H6+C2H4 CH4
1000° C+2H2 2CH4 1500°
CH=CH+3H2
4.Изомеризация ( см. получение)
5.Ароматизания
C—C—C—C—C—C Cr2O3,Al2O3,
500° + 4H2 C—C—C—C—C—C—C Cr2O3,Al2O3, 500° CH3 + 4H2
гексан бензол гексан
толуол
6.
Горение
а) CH4+2O2 CO2+2H2O (радикальный
механизм)
б) Каталитическое окисление
2CH4+O2 кат, p, 480° 2CH3OH
метанол 2C—C—C—C+O2 кат,р,200° 4CH3COOH уксусная кислота + 2H2O
VI.Применение
—CH4+H2O H2,O3,450° CO+3H2 синтез-газ
(R
COO)2Ba t BaO+CO2+R-C-R
O
Обо мне
Блог
Файлы
Тесты
Галерея
Активность
Награды
Опорный конспект Аканы. Материал для подготовки к ЕГЭ.
Категория:
Химия
29.06.2017 22:32
Опорный конспект поможен запомнить основные свойства класса органических веществ АЛКАНЫ
Просмотр содержимого документа
«Опорный конспект Аканы. Материал для подготовки к ЕГЭ.»
АЛКАНЫ СnH2n+2 в названии используют суффикс -АН
Все связи одинарные, в молекулах только ϭ – связи, sp3— гибридизация, угол = 109028
Получение:
-80%
Курсы профессиональной переподготовки
Учитель, преподаватель химии
Продолжительность 300 или 600 часов
13800 руб.
от 2760 руб.

Электронная тетрадь по химии 7 класс…

Электронная тетрадь по химии 9 класс…

Химия 9 класс ФГОС

Химия 11 класс ФГОС

Электронная тетрадь по химии 8 класс…

Химия. Вводный курс. 7 класс ФГОС

Электронная тетрадь по химии 11 класс…

Химия 8 класс
Скачать
© 2017,
Лысоконь Ирина Алексеевна
16408
3032
Рекомендуем курсы ПК и ППК для учителей

Профессиональная компетентность педагогов в условиях внедрения ФГОС
800 руб.
4000 руб.

Интерактивные методы в практике школьного образования
800 руб.
4000 руб.

Применение ИКТ на уроках химии и биологии в условиях реализации ФГОС
800 руб.
4000 руб.

Проектная деятельность учащихся
800 руб.
4000 руб.

Применение кейс-технологии на уроках химии и биологии в условиях…
800 руб.
4000 руб.

Методика обучения химии в условиях реализации ФГОС
800 руб.
4000 руб.
Похожие файлы
-
Опорный конспект Акены. Материал для подготовки к ЕГЭ.
0 нравится
2638
комментариев
Предельные углеводороды. Алканы
Ключевые слова конспекта: Предельные углеводороды. Алканы. Циклоалканы. Гомологический ряд. Общая формула алканов. Структурная изомерия. Радикал. Алкильный радикал. Международная (систематическая) номенклатура органических веществ. Реакции изомеризации. Реакции замещения (галогенирование). Реакции дегидрирования.
Гомологический ряд алканов
Трудно себе представить наш быт без голубых язычков огня кухонной плиты или газовой зажигалки. В этих устройствах сгорают углеводороды одного и того же класса — алканы. Различие лишь в том, что бытовой газ представляет собой главным образом метан СН4, а в резервуаре зажигалки находятся под давлением сжиженные газы пропан С3Н8 и бутан С4Н10.
Углеводороды, молекулы которых не содержат кратных связей, называют предельными или насыщенными.
Своё название предельные углеводороды получили потому, что все валентности углеродных атомов в их молекулах насыщены атомами водорода до предела.
Сокращённая структурная формула пропана СН3—СН2—СН3. Для бутана возможно написание двух структурных формул: в одной углеродная цепь имеет линейное, а в другой — разветвлённое строение:
Свойства бутана и изобутана различны: бутан имеет более низкие температуры кипения и плавления. По отношению друг к другу бутан и изобутан являются изомерами, различающимися строением углеродной цепи. Изомерия углеродной цепи — вариант структурной изомерии.
Алканы — это предельные углеводороды с общей формулой СnН2n+2, в молекулах которых все атомы соединены простыми (одинарными) связями.
В молекулах алканов углеродные цепи открытые, т. е. незамкнутые. Но предельными могут быть и углеводороды, имеющие замкнутую углеродную цепь. Этот класс соединений называют циклоалканами. Некоторые циклоалканы, например циклогексан С6Н12, входят в состав нефти.
Простейший представитель алканов — метан СН4. Именно это соединение является родоначальником гомологического ряда алканов.
Ряд расположенных в порядке возрастания относительных молекулярных масс веществ, сходных по строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп СН2 (гомологическую разность), называют гомологическим рядом. Вещества такого ряда называют гомологами.
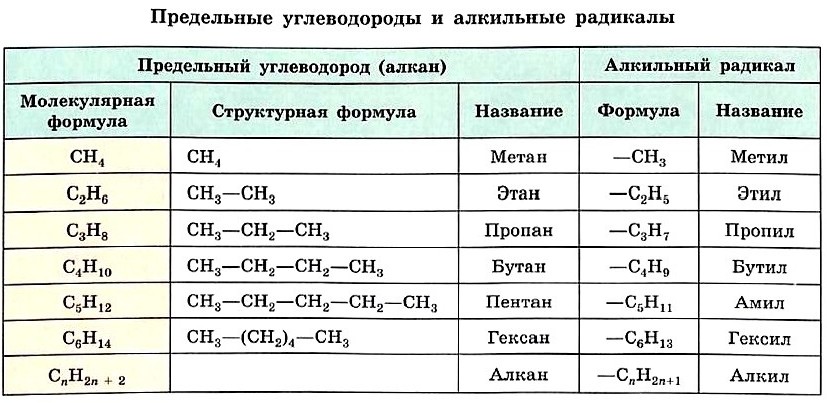
Формулу каждого последующего члена гомологического ряда легко получить из формулы предыдущего, заменив один атом водорода в молекуле на группу СН3. Так, второй гомолог ряда алканов — этан — имеет формулу СН3—СН3. Формулы и названия первых шести представителей алканов с неразветвлённой цепью атомов углерода приведены в таблице.
Если от молекулы алкана мысленно отщепить один атом водорода, мы получим частицу со свободной валентностью у атома углерода — радикал.
Название радикала, соответствующего предельному углеводороду, т. е. алкильного радикала, строится так: суффикс -ан заменяют на -ил, а состав будет подчиняться общей формуле СnН2n+1. Формулы и названия алкильных радикалов, приведённые в таблице, нужно запомнить, чтобы уметь называть органические вещества с разветвлённой углеродной цепью.
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Номенклатура алканов
Для построения названий органических веществ, в частности предельных углеводородов, используют свод правил — номенклатуру. В соответствии с так называемой международной, или систематической, номенклатурой при составлении названий алканов руководствуются следующими правилами:
- 1) выбирают в молекуле самую длинную цепь атомов углерода;
- 2) нумеруют атомы углерода в цепи с того конца, к которому ближе разветвление;
- 3) записывают основу названия вещества — название углеводорода с тем же числом углеродных атомов, что и в пронумерованной цепи;
- 4) перед основой названия перечисляют все заместители основной цепи с указанием номеров атомов углерода, при которых они стоят. Если одинаковых заместителей несколько, перед их названиями ставят приставки ди-, три-, тетра-,
- 5) все цифры друг от друга отделяют запятыми, буквы от цифр — дефисом. Если при одном углеродном атоме имеется не один, а два заместителя, его цифра повторяется в названии дважды;
- 6) перед названием предельного углеводорода нормального (неразветвлённого) строения ставят букву н-.
Проиллюстрируем эти правила примерами названий алканов.
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.
Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.
В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов:
Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.
Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.
Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
Реакцию, при которой от молекулы органического вещества отщепляется молекула водорода, называют реакцией дегидрирования.
При дегидрировании этана образуются два продукта — этилен и водород:
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речь в следующем параграфе.
Таблица «Предельные углеводороды
(алканы, парафины)»
Конспект урока по химии «Предельные углеводороды. Алканы«. В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Химия, 10 класс
Урок № 2. Предельные углеводороды – алканы
Перечень вопросов, рассматриваемых в теме: урок посвящён предельным углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека. В ходе урока школьники познакомятся с представителями данного класса органических веществ.
Глоссарий
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся друг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Группа функциональная – группа атомов, определяющая наиболее характерные химические свойства вещества и его принадлежность к определенному классу.
Галогенирование – замещение одного или нескольких атомов водорода на галоген.
Дегидрирование – отщепление атомов водорода за счет отщепления связи С-Н.
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Изомеризации реакция – характерна для алканов, протекает под влиянием катализаторов и при нагревании, вещества превращаются в разветвленные, без изменения состава молекулы.
Крекинг – процесс термического или каталитического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул на молекулы с меньшим числом атомов углерода. Чаще всего при этом образуются алкан и алкен.
Парафины – исторически сложившееся название, отражающее их малую химическую активность.
Цепная реакция – реакция, в ходе которой исходные вещества вступают в цепь превращений с участием промежуточных активных частиц и их регенерацией в каждом элементарном акте реакции.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Алканы – это углеводороды, в молекулах которых атомы углерода соединены между собой только простыми (одиночными) ковалентными связями. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,187 нм. При этом оси четырех sр3-гибридных орбиталей оказываются направленными к вершинам тетраэдра, угол равен 109°28′.
Метан является родоначальником ряда предельных углеводородов (алканов). Их состав выражается общей формулой CnH2n+2. По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса — ан путём добавления к соответствующему корню от названия углеводорода.
Наращивание углеродной цепи на один атом углерода ведёт к увеличению состава на группу СН2 (гомологическая разность). При этом химические свойства и строение веществ одинаковы. Такие ряды называют гомологическими рядами, их члены по отношению друг к другу являются гомологами.
Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета.
Электронное строение алканов определяет инертный характер алканов. При комнатной температуре С1-C4 — газы, C5-C15 — жидкости, C16 и следующие — твердые вещества; нерастворимы в воде. С увеличением числа атомов углерода в молекуле возрастает температура кипения и плавления.
По химическим свойствам алканы – инертные вещества. Они вступают только в реакции замещения, протекающие с разрывом связей C-H. Протекают эти реакции в жестких условиях (высокая температура, освещенность).
Реакция галогенирования алканов протекает по радикально — цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
В разработке теории цепных реакций большую роль сыграли труды академика, лауреата Нобелевской премии Н.Н. Семёнова.
Еще одно подтверждение малоактивных свойств алканов — на них не действуют сильные окислители. При пропускании метана через растворы перманганата калия (KMnO4, Br2(H2O) бромной воды) никаких изменений не наблюдается. Не действует на алканы и концентрированная серная кислота.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи о получении метана
Сколько граммов карбида алюминия требуется для получения 5,6 л (н. у.) метана с помощью реакции гидролиза? Ответ округлите до целых.
Ответ: 12г
Решение:
1.Запишем уравнение реакции
Al4C3+12H2O→3CH4+4Al(OH)3
2.Рассчитаем количество вещества метана
ν(СН4) = 5.6 /22.4 = 0.25 (моль)
3.Составим пропорцию, приняв за х количество вещества карбида алюминия:
0,25/3 = х/1
x = 0,083 (моль).
4. Определяем массу карбида алюминия
m(Al4C3) = 0.083 · 144 = 12 (г)
- Определение формул гомологов.
Подчеркните формулы алканов, которые должны в итоге образовать линию из трех веществ (она может быть как по прямой, так и по диагонали)
|
C2H4 |
CH4 |
C5H12 |
|
C3H4 |
C6H6 |
C3H8 |
|
C10H22 |
C5H10 |
C8H18 |
Решение:
- Определяем в каких ячейках находятся алканы, т.е. вещества, соответствующие общей формуле CnH2n+2
|
C2H4 |
CH4 |
C5H12 |
|
C3H4 |
C6H6 |
C3H8 |
|
C10H22 |
C5H10 |
C8H18 |
- После подсчета получается, что алканы находятся только в одной вертикальной линии.
|
C2H4 |
CH4 |
C5H12 |
|
C3H4 |
C6H6 |
C3H8 |
|
C10H22 |
C5H10 |
C8H18 |
Урок по химии с применением ИКТ по теме «Алканы»
Анциферова Светлана Владимировна, учитель химии
Цель урока: познакомить учащихся с алканами и выявить важную их роль в промышленности.
Задачи урока:
Образовательная: рассмотреть гомологический ряд предельных углеводородов, строение, физические и химические свойства, способы их получения при переработке природного газа, возможности их получения из природных источников: природного и попутного нефтяного газов, нефти и каменного угля.
Развивающая: развить понятие о пространственном строении алканов; развитие познавательных интересов, творческих и интеллектуальных способностей, развитие самостоятельности в приобретении новых знаний с использованием новых технологий.
Воспитательная: показать единство материального мира на примере генетической связи углеводородов разных гомологических рядов, получаемых при переработки природного и попутного нефтяного газов, нефти и каменного угля.
Оборудование: компьютер, мультимедиа проектор, экран, презентация.
Ход урока
I. Организационный момент. (Сообщить цель и тему урока).
II. Изученного нового материала.
Учитель
Тема урока: «Алканы». Слайд № 1
План изучения алканов. Слайд № 2
Определение. Общая формула класса углеводородов.
Гомологический ряд.
Виды изомерии.
Строение алканов.
Физические свойства.
Способы получения.
Химические свойства.
Применение.
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы — углеводороды в молекулах которых все атомы углерода связаны одинарными связями и имеют общую формулу: CnH2n+2 Слайд № 3
— Что такое гомологи?
Гомологический ряд метана
СН4 метан
С2H6 этан
C3H8 пропан
C4H10 бутан
C5H12 пентан
C6H14 гексан
C7H16 гептан
C8H18 октан
C9H20 нонан
C10H22 декан Слайд № 4
Гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СH2.
Структурная изомерия:
Алгоритм.
1. Выбор главной цепи: Слайд № 5
2. Нумерация атомов главной цепи: Слайд № 6
3. Формирование названия: Слайд № 7
2 — метилбутан
Строение алканов.
Атом углерода во всех органических веществах находится в «возбуждённом» состоянии, имеет на внешнем уровне четыре неспаренных электрона.
Каждое электронное облако обладает запасом энергии: s- облако имеет меньший запас энергии, чем р-облако, в атоме углерода они находятся в разных энергетических состояниях. Поэтому при образовании химической связи происходит гибридизация, т. е. выравнивание электронных облаков по запасу энергии. Это отображается на форме и направленности облаков, происходит перестройка (пространственная) электронных облаков.
В результате sp3 — гибридизации все четыре валентных электронных облака гибридизованы: валентный угол между этими осями гибридизованных облаков 109° 28′, поэтому молекулы имеют пространственную тетраэдрическую форму, форма углеродных цепей зигзагообразна; атомы углерода не находятся на одной прямой, т. к. при вращении атомов валентные углы остаются прежними.
Все органические вещества построены в основном за счёт ковалентных связей. Углерод — углеродные и углерод — водородные связи относятся к сигма — связям — это связь, образующаяся при перекрывании атомных орбиталей по линии, проходящей через ядра атомов. Возможно вращение вокруг сигма — связей, поскольку эта связь имеет осевую симметрию. Слайд № 13
Физические свойства.
СН4:C4Н10 — газы
T кипения: -161,6:-0,5 °C
T плавления: -182,5:-138,3 °C
С5Н12:C15Н32 — жидкости
T кипения: 36,1:270,5 °C
T плавления: -129,8:10 °C
С16Н34:и далее- твёрдые вещества
T кипения: 287,5 °C
T плавления: 20 °C
С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления. Слайд № 14
Получение.
В промышленности
1) крекинг нефтепродуктов:
C16H34 -> C8H18 + C8H16
2) В лаборатории:
а) Гидролиз карбидов:
Al4C3 +12 H2O = 3 CH4 + 4 Al(OH)3
б) Реакция Вюрца:
C2H5Cl + 2Na -> C4H10 + 2NaCl
в) Декарбоксилирование натриевых солей карбоновых солей:
СН3СООNa + 2NaОН -> СН4 + Nа2СО3 Слайд № 15
Химические свойства
Для алканов характерны следующие типы химических реакций:
Замещение атомов водорода;
Дегидрирование;
Крекинг;
Окисление.
1) Замещение атомов водорода:
А) Реакция галогенирования:
CH4 +Cl2 -> CH3Cl + HCl
Б) Реакция нитрования (Коновалова):
CH4 + HNO3 -> CH3-NO2 + H2O + Q
В) Реакция сульфирования:
CH4 + H2SO4 -> CH3-SO3 H + H2O + Q
2) Реакция изомеризации:
CH3-CH2-CH2-CH2-CH3 -> СН3-СН-СН2-СН3
СН3
3) Реакция с водяным паром:
CH4 + H2O = CO + 3H2
4) Реакция дегидрирования:
2СН4 -> НС=СН + 3Н2 + Q
5) Реакция окисления:
CH4 + O2 -> Н2C=О + H2O
6) Горение метана:
CH4 + 2O2 > CO2 + 2H2O + Q Слайд № 20
Применение.
(Возможно, заранее подготовленные выступления учащихся.)
Широко используются в качестве топлива, в том числе для
двигателей внутреннего сгорания, а также при производстве сажи
(1 — картриджи; 2 — резина; 3 — типографическая краска), при получение органических веществ (4 — растворителей; 5 — хладогентов, используемых в холодильных установках; 6 — метанол; 7 — ацетилен) Слайд № 21
III. Закрепление.
Составьте все возможные изомеры для гептана и назовите их.
Составьте 2 ближайших гомолога для пентана и назовите их.
Определить предельный углеводород, плотность паров которого по воздуху равна 2. (C4H10).
Учебник: №12 (стр. 33).
IV. Домашнее задание: Учебник О.С. Габриелян (10 класс базовый уровень): 3, упр. 4, 7, 8 (стр. 32).
Литература.
Горковенко М. Ю. Поурочные разработки по химии к учебным комплектам О. С. Габриеляна и др., 10 (11) класс. М.: «ВЕКО», 2008 г.