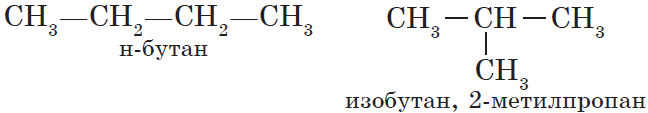Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько
основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает
химическое строение. - Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его
свойствах. - Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда
— CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления
этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos —
соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить
читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они
связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи
и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д. - Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный
атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по
строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной
(геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

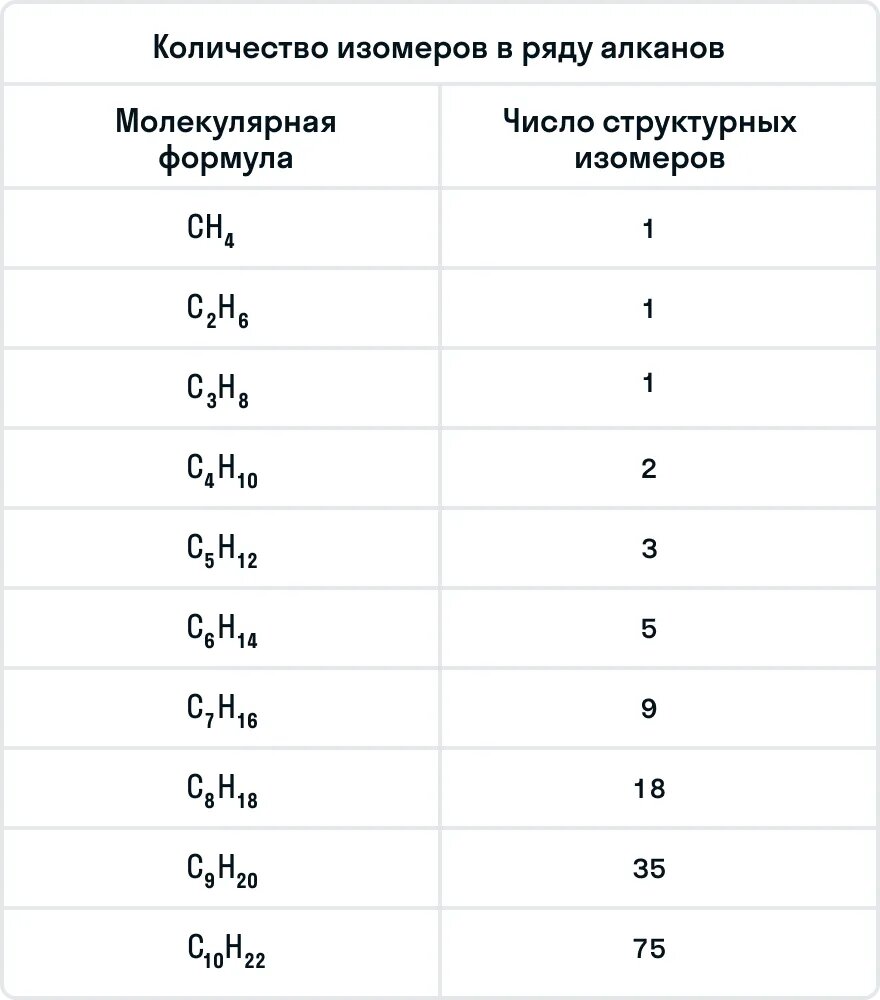
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
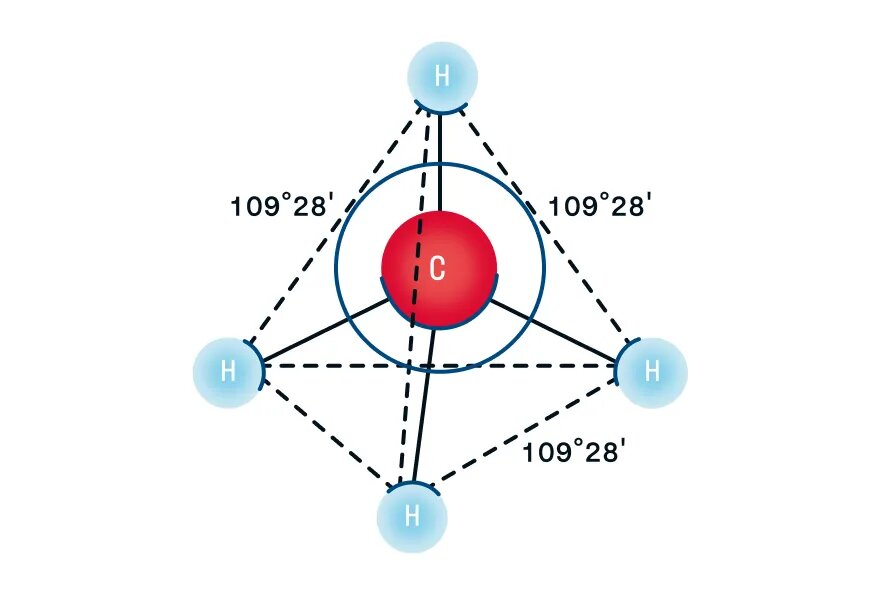
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28′

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить
одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем
крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Гриньяра
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного
радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).

На схеме выше мы сначала получили реактив Гриньяра, а потом
использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для
алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее — у вторичного и значительно труднее — у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы,
которые и осуществляют атаку на молекулу углеводорода.

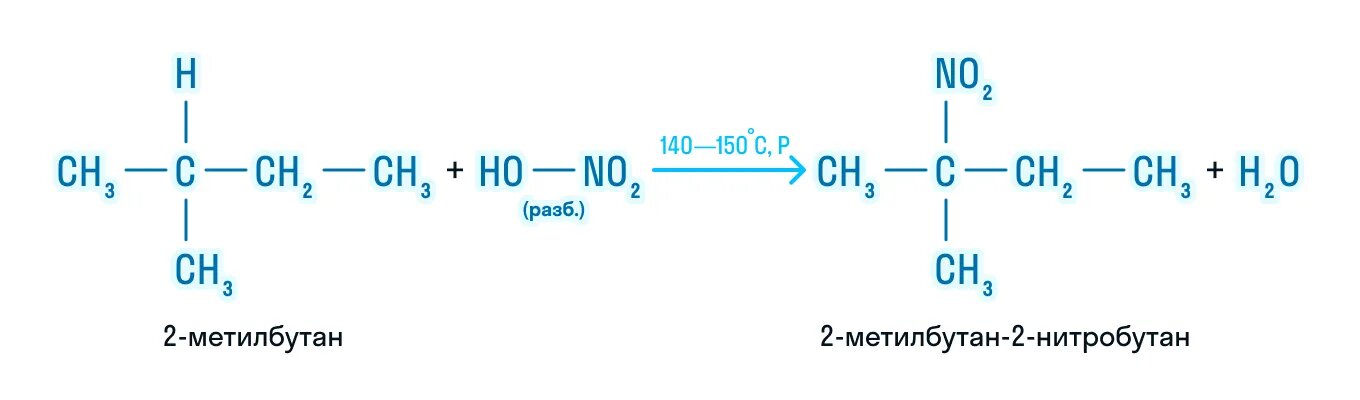
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция
идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)

Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное
отличие пиролиза от горения — в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат.) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат.) CH2=CH2 + H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их
химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Гомологический ряд алканов
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Все алканы легче воды, не растворимы в воде и не смешиваются с ней.
Строение алканов
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Наример, пространственное строение н-бутана — зигзагообразное
Изомерия алканов
Структурная изомерия
Для алканов характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан
С увеличением числа атомов углерода в молекуле увеличивается количество изомеров, соответствующих данной формуле. У метана CH4, этана C2H6 и пропана C3H8 структурных изомеров нет.
Количество изомеров в ряду алканов:
| Молекулярная формула | Число структурных изомеров |
| C4H10 | 2 |
| C5H12 | 3 |
| C6H14 | 5 |
| C7H16 | 9 |
| C8H18 | 18 |
| C9H20 | 35 |
| C10H22 | 75 |
Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:
то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
Номенклатура алканов
В названиях алканов используется суффикс -АН.
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:
2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения
2.1. Дегидрирование и дегидроциклизация
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
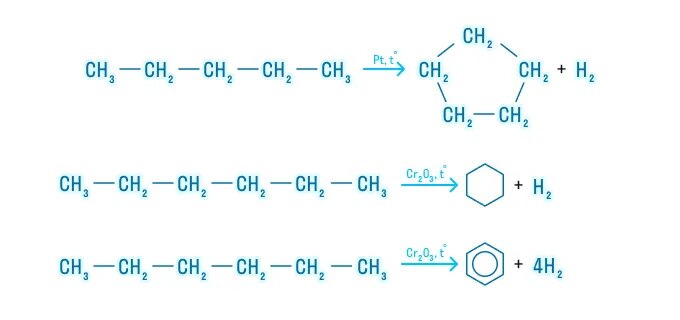
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
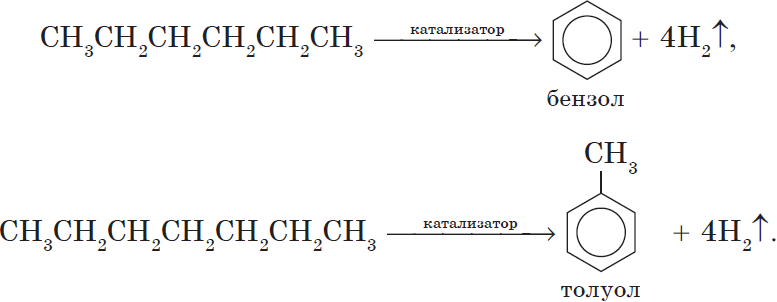
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
2.2. Пиролиз (дегидрирование) метана
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Получение алканов
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Хлорэтан взаимодействует с натрием с образованием бутана:
Реакция больше подходит для получения симметричных алканов.
При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
2. Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO– + Na+
При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O.
Разряжаться на катоде будут молекулы воды:
Kатод(-): 2H2O + 2e = H2 + 2OH–
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы.
При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан:
Aнод(+): 2CH3COO– – 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
4. Гидрирование алкенов, алкинов, циклоалканов, алкадиенов
При гидрировании этилена образуется этан:
При полном гидрировании ацетилена также образуется этан:
При гидрировании циклопропана образуется пропан:
5. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (2n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
6. Получение алканов в промышленности
В промышленности алканы получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_{n}Н_{2n+2}$.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
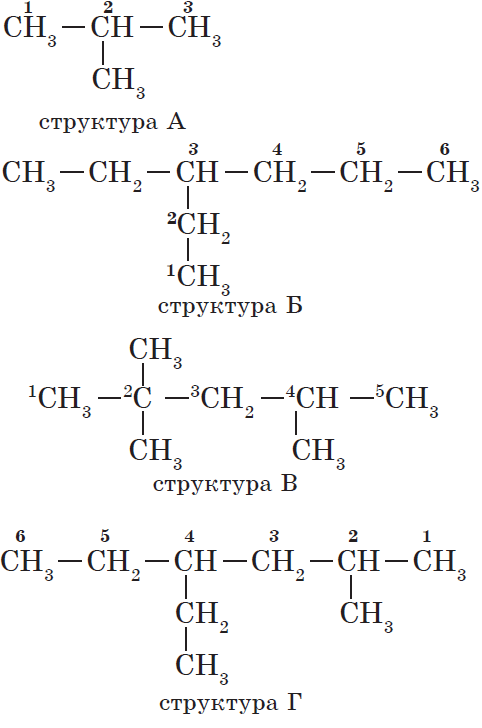
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2.2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_{12}$ до $С_{15}Н_{32}$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
$CH_4+Cl_2→CH_3Cl+HCl$.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
$CH_3Cl+Cl_2→HCl+{CH_2Cl_2}↙{text»дихлорметан(хлористый метилен)»}$,
$CH_2Cl_2+Cl_2→HCl+{CHСl_3}↙{text»трихлорметан(хлороформ)»}$,
$CHCl_3+Cl_2→HCl+{CCl_4}↙{text»тетрахлорметан(четыреххлористый углерод)»}$.
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400–600°С$) происходит отщепление молекулы водорода и образование алкена:
$CH_3—CН_3→СH_2=CH_2+Н_2↑$
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
$СН_4+2О_2→СО_2+2Н_2O+880 кДж.$
В общем виде реакцию горения алканов можно записать следующим образом:
$C_{n}H_{2n+2}+({3n+1}/{2})O_2→nCO_2+(n+1)H_2O$
Термическое расщепление углеводородов:
$C_{n}H_{2n+2}{→}↖{400-500°C}C_{n-k}H_{2(n-k)+2}+C_{k}H_{2k}$
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
$CH_4{→}↖{1000°C}C+2H_2↑$
При нагревании до температуры $1500°С$ возможно образование ацетилена:
$2CH_4{→}↖{1500°C}CH=CH+3H_2↑$
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алканы — это предельные углеводороды, в строении которых имеются только одинарные или σ-связи.
Этот класс относится к алифатическим соединениям, так как не имеет ароматических связей. К тому же алканы — предельные углеводороды, то есть они содержат максимально возможное число атомов водорода. Поэтому общая формула алканов — CnH2n+2.
Строение алканов
Основные химические связи у алканов — это ковалентная неполярная связь между атомами углерода (С—С) и ковалентная полярная связь между атомами углерода и водорода (С—Н).
Так как алканы — это предельный класс, делаем вывод, что все связи между атомами являются одинарными, то есть σ-связями.
Разберемся с типом гибридизации атомов углерода в алканах, но сначала вспомним, что такое гибридизация. Упрощенное определение гибридизации звучит так: это смешение различных орбиталей в многоатомной молекуле для выравнивания формы и энергии, которое приводит к изменению формы орбитали. Гибридизация атомов углерода в алканах — sp3. Рассмотрим, как она образуется.
При образовании связи между углеродами происходит смешение их орбиталей — вот так:
В то время как образование связи между углеродом и водородом происходит следующим образом:
Рассмотрим пространственное строение алканов на примере метана — первого представителя гомологического ряда алканов. При наличии четырех атомов водорода и одного атома углерода в молекуле образуются четыре гибридизованные орбитали, которые взаимно отталкиваются друг от друга, но не произвольно, а под определенным углом. Максимальный угол взаимного отталкивания — это валентный угол, для алканов он равен 109°28′. Таким образом, молекула метана в пространстве выглядит как тетраэдр:
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Номенклатура алканов
Познакомьтесь с номенклатурой гомологического ряда алканов (ее необходимо выучить):
Названия первых четырех представителей этого ряда сложились исторически. Названия остальных алканов образованы от греческих числительных, которые обозначают количество атомов углерода, с помощью суффикса -ан-.
Важно помнить, что бутан и следующие за ним алканы могут иметь изомеры. Ниже в таблице указано количество изомеров у каждого представителя алканов:
Помимо структурной изомерии, для алканов характерна изомерия оптическая. Но для ее реализации нужно одно условие — наличие хирального атома углерода, то есть атома с четырьмя различными заместителями.
Молекулы таких соединений относятся друг к другу как предмет и его зеркальное отражение. Как бы мы ни вращали эти молекулы, нельзя получить из одной другую.
Физические свойства алканов
Свойства этих соединений меняются по мере продвижения по гомологическому ряду:
-
первые четыре представителя алканов являются газами;
-
алканы, в составе молекулы которых от 5 до 15 атомов углерода, являются жидкостями;
-
алканы, в составе молекулы которых от 16 атомов углерода, — твердые вещества.
С увеличением количества атомов углерода в структуре молекулы и с ее формой в пространстве связана одна особенность: у линейных молекул, в отличие от разветвленных, температура кипения и плавления выше. В таблице собрали справочные данные о температуре плавления и составе алканов.
Все алканы бесцветны, легче воды и нерастворимы в ней, однако хорошо растворяются в органических растворителях. Жидкие алканы, такие как пентан и гексан, сами широко используются как растворители.
Химические свойства алканов
Для алканов характерны реакции замещения. Для всех реакций замещения алканов нужно соблюдать правило: сначала замещается водород у третичного атома углерода, затем — у вторичного, в последнюю очередь — у первичного атома углерода.
Рассмотрим все возможные реакции, характерные для алканов.
Реакция нитрования (реакция Коновалова)
Галогенирование
.
Реакция может продолжаться до полного замещения атомов водорода на хлор.
Дегидрирование (отщепление водорода)
Катализаторы для дегидрирования: Ni, Pt, Pd, Cr2O3, Fe2O3, ZnO и другие.
Реакции разложения
-
Крекинг:
C8H18 → C4H10 + C4H8.
-
Пиролиз метана:
— при медленном и длительном нагревании;
-
— при очень быстром нагревании.
Реакция окисления (горение)
Все алканы, кроме метана, горят с образованием углекислого газа и воды. Метан горит с образованием угля и воды.
Алканы не окисляются сильными окислителями, такими как перманганаты, дихроматы и хроматы.
Вопросы для самопроверки
-
Выберите алкан с наибольшей молярной массой.
-
Пентан
-
Бутан
-
Октан
-
Гексан
-
Какая гибридизация у атомов углерода в предельных углеводородах?
-
sp3
-
sp2
-
sp
-
Гибридизации нет
-
Какие виды изомерии характерны для алканов?
-
Оптическая и пространственная
-
Цис-транс-изомерия
-
Углеродного скелета и геометрическая
-
Углеродного скелета и оптическая
-
Вспомните общую формулу алканов.
-
CnH2n
-
CnH2n−2
-
CnH2n+2
-
CnH2n−6
-
Какой тип реакций характерен для алканов?
-
Присоединение
-
Замещение
-
Присоединение и замещение
-
Любые типы реакций
-
Какая именная реакция удвоит углеродный скелет у алканов?
-
Реакция Коновалова
-
Реакция Вюрца — Фиттинга
-
Реакция Вюрца
-
Реакция Зинина
Подготовиться к ЕГЭ на онлайн-курсах по химии, пожалуй, лучший вариант. Можно заниматься дома и не тратить время на дорогу — нужен лишь компьютер и стабильный интернет. Преподаватели онлайн-школы Skysmart помогут не только упорядочить знания, но и подготовиться к экзамену психологически. Пройти вводное тестирование и получить рекомендации по самостоятельному обучению можно бесплатно!
Ответы на вопросы
-
c
-
a
-
d
-
c
-
b
-
c
Готовимся к ЕГЭ.Алканы.
АЛКАНЫ (предельные углеводороды, парафины)
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи, с общей формулой CnH2n+2, где n ≥1.
Алканы – название предельных углеводородов по международной номенклатуре.
Парафины– исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – имеющий мало сродства, малоактивный).
Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода.
Гомологический ряд алканов
Алканы, имея общую формулу СnH2n+2, представляют собой ряд родственных соединений с однотипной структурой, в котором каждый последующий член отличается от предыдущего на постоянную группу атомов (-CH2-). Такая последовательность соединений называется гомологическим рядом (от греч. homolog – сходный), отдельные члены этого ряда – гомологами, а группа атомов, на которую различаются соседние гомологи, – гомологической разностью.
- CH4– первый член гомологического ряда – метан (содержит 1 атом C);
- CH3-CH3 или СН3-СН3– этан (2 атома С);
- CH3-CH2-CH3 или СН3-СН2-СН3 – пропан (3 атома С);
- CH3-CH2-CH2-CH3 или СН3-СН2-СН2-СН3 – бутан (4 атома С).
Суффикс -ан является характерным для названия всех алканов. Начиная с пятого гомолога, название алкана образуется из греческого числительного, указывающего число атомов углерода в молекуле, и суффикса -ан: пентан С5Н12, гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22 и т.д.
Гомологи отличаются молекулярной массой, и следовательно, физическими свойствами. С увеличением числа углеродных атомов в молекуле алкана в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов: повышаются температуры кипения и плавления, увеличивается плотность. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями. Алканы от СН4 до С4Н10– газы, от С5Н12 до С17Н36 – жидкости, далее – твердые вещества. Имея одинаковый качественный состав и однотипные химические связи, гомологи обладают сходными химическими свойствами. Поэтому, зная химические свойства одного из членов гомологического ряда, можно предсказать химическое поведение и других членов этого ряда.
Строение алканов
В алканах имеются два типа химических связей:
С–С и С–Н.
Связь С–С является ковалентной неполярной. Связь С–Н — ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности).
Все атомы углерода в алканах находятся в состоянии sp3-гибридизации.
Четыре σ-связи углерода направлены в пространстве под углом 109о28′, что соответствует наименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода.
Изомерия алканов
Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами.
Различия в порядке соединения атомов в молекулах (т.е. в химическом строении) приводят к структурной изомерии (изомерии углеродного скелета). В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т.е. начиная с бутана С4Н10. Например, алкан состава C4H10 может существовать в виде двух структурных изомеров:
СН3–СН2–СН2–СН3(бутан) и СН3–СН(СН3)–СН3 (2-метилпропан).
Структурные изомеры отличаются физическими свойствами. Алканы с разветвленным строением из-за менее плотной упаковки молекул и, соответственно, меньших межмолекулярных взаимодействий, кипят при более низкой температуре, чем их неразветвленные изомеры.
Химические свойства алканов
Тривиальное (историческое) название алканов — «парафины» — означает «не имеющие сродства». Алканы при нормальных условиях химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С-С и С-Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода. Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия. К реакциям присоединения алканы вообще не способны в силу предельной насыщенности всех связей атомов углерода.
I. Реакции замещения
В определенных условиях (при нагревании, или на свету, или с применением катализаторов) происходит разрыв С-Н-связей и осуществляется замена атомов водорода на другие атомы или группы атомов. В этих реакциях происходит гомолитическое расщепление кoвалентных связей, т. е. они осуществляются по свободно-радикальному (цепному) механизму.
1) Галогенирование
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов R-Cl или Сn H2n+1 – Cl.
Реакция алканов с хлором и бромом идет на свету или при нагревании.
Хлорирование метана:
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия)
(hν — квант света; CH3Cl — хлорметан)
При достаточном количестве хлора реакция продолжается дальше:
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия)
(CH2Cl2 – дихлорметан)
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия)
(CHCl3 – трихлорметан или хлороформ)
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия)
(CCl4 – тетрахлорметан)
Реакция галогенирования алканов протекает по радикальному цепному механизму. В разработке теории цепных реакций большую роль сыграли труды академика, лауреата Нобелевской премии Н.Н.Семенова.
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
CH3 –CH2 –Cl + Cl2 hν → CH3 – CHCl2 + HCl
(CH3 – CHCl2 – 1,1-дихлорэтан)
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
С фтором реакция идёт со взрывом.
2) Нитрование (реакция Коновалова)
Несмотря на то, что в обычных условиях алканы не взаимодействуют с концентрированной азотной кислотой, при нагревании до 140°С с разбавленной (10%-ной) азотной кислотой под давлением осуществляется реакция нитрования – замещение атома водорода нитрогруппой NO2. Пpодукты pеакции – нитpоалканы R-NO2 или Сn H2n+1– NO2.
Схема реакции:
CH4 + HNO3t˚С ,Р→ CH3NO2+ H2O (при нитровании метана получается нитрометан).
В реакциях легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных.
3) Сульфирование
Серная кислота при обыкновенной температуре не действует на алканы, а при слабом нагревании концентрированная серная кислота может действовать на предельные углеводороды приводя к замещению атома водорода на сульфогруппу SO3H
II. Реакции окисления алканов
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.).
1) При внесении в открытое пламя алканы горят. При этом в избытке кислорода происходит их полное окисление до СО2 и воды. Горение углеводородов сопровождается выделением большого количества тепла (экзотермическая реакция).
CH4 + 2O2 →CO2 + 2H2O+ Q
C5H12 + 
Уравнение реакции горения алканов в общем виде:
Из этого уравнения следует, что с увеличением числа углеродных атомов (n) в алкане увеличивается количество кислорода, необходимого для его полного окисления. При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления до СО2. Тогда образуются продукты частичного окисления: угарный газ СО,
сажа (мелкодисперсный углерод, нулевая степень окисления). Поэтому высшие алканы горят на воздухе коптящим пламенем, а выделяющийся попутно токсичный угарный газ (без запаха и цвета) представляет опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
2CH4 + 3O2→2CO +4H2O
CH4 + O2→C +2H2O
2) Каталитическое окисление кислородом воздуха.
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С-С и С-Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
2CH4 + O2→2CH3OH (CH3OH — метанол )
CH4 + O2→HCOH +H2O (HCOH — метаналь )
2CH4 + 3O2→2HCOOH +2H2O (HCOOH – метановая кислота)
При неполном окислении бутана получают уксусную кислоту:
2C4H10+ 5O2→4СH3COOH +2H2O
III.Термические превращения алканов
1) Крекинг алканов – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием молекул алканов и алкенов с более короткой цепью.
Крекинг алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел и т.п., а также сырья для химической и нефтехимической промышленности.
Для осуществления этого процесса используются два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора).
C10H22 t°С → C5H12 + C5H10
2) Дегидрирование алканов
При нагревании алканов в присутствии катализаторов (Pt, Pd, Ni, Cr2O3, Al2O3) происходит их каталитическое дегидрирование – отщепления атомов водорода за счет разрыва связей С—Н.
3)Изомеризация алканов.
Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов.
Например, изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100°С в присутствии катализатора хлорида алюминия:
4) Реакция дегидроциклизации или ароматизации
Алканы с основной цепью в 6 и более атомов углерода вступают в реакцию дегидроциклизации, но всегда образуют 6-членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). Например:
Эти реакции лежат в основе процесса риформинга – переработки нефтепродуктов с целью получения аренов (ароматизация предельных углеводородов) и водорода. Превращение н-алканов в арены ведет к улучшению детонационной стойкости бензина.
5)Термическое разложение до простых веществ
CH4 t → C + 2H2
6) Пиролиз метана.
При 1500 °С происходит межмолекулярное дегидрирование метана
с образованием ацетилена:
2CH4 1500°С → C2H2 + 3H2
Данная реакция используется для промышленного получения ацетилена.
IV.Конверсия метана
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом — «синтез-газ»:
Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
Получение алканов
Алканы выделяют из природных источников (природный и попутный газы, нефть). Природный газ до 95 % состоит из метана. Такой же состав имеет болотный газ, образующийся в результате переработки бактериями (гниения) углеводов. Попутные нефтяные газы состоят в основном из этана, пропана, бутана и частично пентана. Их отделяют от нефти на специальных установках по подготовке нефти. При отсутствии газоконденсатных станций попутные нефтяные газы сжигают в факелах, что является крайне неразумной и разорительной практикой в нефтедобыче. Одновременно с газами нефть очищается от воды, грязи и песка, после чего поступает в трубу для транспортировки. Из нефти при ее перегонке получают
более 100 индивидуальных соединений, нормальных и разветвленных алканов, циклоалканов и ароматических углеводородов.
Используются также синтетические методы.
- Крекинг алканов (промышленный способ)
- Гидpиpование непpедельных углеводоpодов:
CnH2n+ H2 t˚С, Ni или Pd → CnH2n+2
H3C- CH=CH2+H2 H3C-CH2-CH3
- Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni):
- Из синтез-газа (СО + Н2) получают смесь алканов:
- Реакция Вюpца.
Синтез более сложных алканов при действии металлического натрия на моногалогеналканы с меньшим числом атомов углеpода:
2CH3–CH2Br+2Na→CH3–CH2–CH2–CH3+2NaBr
Реакция Вюрца имеет смысл лишь для получения из одного алкилгалогенида, поскольку в противном случае получается трудноразделимая в лабораторных условиях смесь алканов.
Например:
Кроме пропана C3H8 образуются бутан C4H10 (из 2-х молекул C2H5Br) и этан C2H6 (из 2-х молекул CH3Br).
- Термическое декарбоксилирование. Сплавление солей карбоновых кислот со щелочью (реакция Дюма):
или в общем виде
R-COONa + NaOH R-H + Na2CO3
- Электролиз солей карбоновых кислот (реакция Кольбе):
- Изомеризация. Под влиянием катализаторов при нагревании алканы нормального строения подвергаются изомеризации — перестройке углеродного скелета с образованием алканов разветвленного строения.
н-алкан AlCl3, t°С → изоалкан
CH3-CH2-CH-CH3 → CH3-CH(CH3)-CH3
- Разложение карбида алюминия водой:
Применение алканов
Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
- Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива.
- Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
- Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) — пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
- Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
- Паpафин (смесь твеpдых алканов С19-С35) — белая твеpдая масса без запаха и вкуса (т.пл. 50-70 °C) — пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине. Служит сырьём при получении органических кислот и спиртов, моющих средств и поверхностно-активных веществ.
- Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти.
- Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.
- В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Источники
- Г.И.Дерябина, Г.В.Кантария. Органическая химия. Электронный ресурс.
- И.И.Новошинский, Н.С.Новошинская. Органическая химия: пособие для старшеклассников и абитуриентов. – М.:ООО «Издательский дом ОНИКС 21 век»,2004
- Кузьменко Н.Е.,Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. М.: Экзамен, 2002.