Скачать материал

Скачать материал


- Сейчас обучается 113 человек из 49 регионов


- Сейчас обучается 50 человек из 32 регионов


- Сейчас обучается 30 человек из 23 регионов


Описание презентации по отдельным слайдам:
-
1 слайд
Непредельные
углеводороды
Алкены
Выполнила преподаватель химии
Макиенко О.В. -
2 слайд
Алкены
(этиленовые углеводороды)
это углеводороды, содержащие в молекуле одну двойную связь.
CnH2n общая формула (n = 2,3,4….)
С2Н4 – этилен – этен СН2 = СН2
С3Н6 – пропен СН2 = СН – СН3
С4Н8 — бутен
С5Н10 — пентен
С6Н12 — гексен -
3 слайд
Физические свойства
По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4 – газы, C5–C17 – жидкости, высшие представители – твердые вещества. Температура их плавления и кипения, а также плотность увеличиваются с ростом молекулярной массы. Все алкены легче воды, плохо растворимы в ней, однако растворимы в органических растворителях.
-
4 слайд
Этилен – газ, почти без запаха, плохо растворим в воде.
Строение этилена
С2Н4 – молекулярная формулаН Н структурная
С = С формула
Н Н этилена -
5 слайд
1. Образование σ -связей
Каждый атом С образует по 3 σ-связи (одну – с соседним атомом С и две связи с атомами Н). На их образование углерод затрачивает 3 электрона (один s-электрон и два
р-электрона), поэтому происходит sp2-гибридизация.Схематическое изображение строения молекулы этилена
В результате каждый атом углерода обладает тремя гибридными sp2-орбиталями, которые лежат в одной плоскости под углом 120º друг к другу. -
6 слайд
Схема образования
sp2-гибридных орбиталей
В гибридизации участвуют орбитали одного s- и двух p-электронов:
s
2p
sp2 -
7 слайд
2. Образование π-связи
У каждого атома С есть ещё по одному облаку, которые в гибридизации не участвуют и сохраняют форму правильных восьмерок. Перекрываясь над и под плоскостью, они образуют π- связь, которая располагается перпендикулярно к плоскости σ- связей. Двойная связь алкенов представляет собой сочетание σ- и π- связей.
Длина двойной связи = 0,134 нм. -
8 слайд
Запомните.
Простая (ординарная) связь – это всегда
σ-связь.
В кратных (двойных или тройных) связях –
одна σ-связь, а остальные π-связи.σ-связи всегда образованы гибридными орбиталями (неправильными восьмерками).
π-связи образованы негибридными
p – орбиталями (правильными восьмерками). -
9 слайд
π- связь менее прочна, чем σ- связь.
В связи с этим, π- связь легко разрывается и переходит в две новые σ- связи в результате присоединения по месту двойной связи двух атомов или групп атомов реагирующих веществ. Для алкенов наиболее типичными являются реакции присоединения. -
10 слайд
Изомерия алкенов
1) углеродного скелета
CH2 = CH – CH2 – CH3 CH2 = C – CH3
бутен-1 ׀
CH3
2-метилпропен-1
2) положения двойной связи
CH2 = CH – CH2 – CH3 CH3 – CH = CH – CH3
бутен-1 бутен-2
3) классов соединений (циклоалканы)
CH2 = CH – CH2 – CH3 CH2 – CH2
бутен-1 | |
CH2 – CH2
циклобутан -
11 слайд
4) пространственная (цис-транс-изомерия)
CH3 H H H
/ /
C = C C = C
/ /
H CH3 CH3 CH3
транс — цис —
Запомните!
Если одинаковые заместители находятся по одну сторону двойной связи, это цис–изомер, если по разные – это транс–изомер. -
12 слайд
Номенклатура алкенов
Название алкенов по систематической номенклатуре образуют из названий алканов, заменяя суффикс –ан на –ен, цифрой указывается номер того атома углерода, от которого начинается двойная связь.
Главная цепь атомов углерода должна обязательно включать двойную связь, и ее нумерацию проводят с того конца главной цепи, к которому она ближе.
В начале названия перечисляют радикалы с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов, то цифрой указывается место каждого из них в главной цепи и перед их названием ставят соответственно приставки: ди-, три-, тетра- и т.д. -
13 слайд
Химические свойства алкенов
1) Горение
При сжигании на воздухе алкены образуют
углекислый газ и воду.
C2 H4 + 3O2 → 2CO2 + 2H2O + Q2) Окисление – качественная реакция на двойную связь
(растворы окислителей обесцвечиваются) -
14 слайд
При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера). Реакция протекает на холоде.
3H2C=CH2 + 2KMnO4 + 4H2O → 2MnO2 +
2KOH + 3CH2−CH2
| |
OH OH
В результате реакции наблюдается обесцвечивание
раствора перманганата калия.
Реакция Вагнера служит качественной пробой на
двойную связь.
H2C=CH2 + [О] + НОН → CH2−CH2 этилен-
| | гликоль
OH OH -
15 слайд
3) Реакции присоединения.
а) Присоединение галогенов — Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к дигалогенопроизводным алканов, содержащим атомы галогена у соседних углеродных атомов.
H2C=CH2 + Br2 → BrCH2–CH2Br
С2Н4 + Br2 → С2Н4 Br2 дибромэтан
С2Н4 + Cl2 → С2Н4 CI 2 дихлорэтанПриведенная реакция — обесцвечивание этиленом бромной воды является качественной реакцией на двойную связь.
-
16 слайд
б) Гидрирование – присоединение водорода. Алкены легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni) образуя предельные углеводороды.
CH2 = CH2 + H2 → CH3 – CH3
С2Н4 + H2 → C2 H6 этан t,kat
в) Присоединение галогеноводородов — Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов.
H2C = CH2 + HСI → CH3 – CH2 CI
С2Н4 + HCI → C2 H5 CI хлорэтан -
17 слайд
Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом В.В.Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, то есть к атому углерода с наибольшим числом водородных атомов).
CH3−CH=CH2 + HCl → CH3 – CH(Cl)−CH3 -
18 слайд
Гидратация. В присутствии минеральных кислот алкены присоединяют воду, образуя спирты. H+
CH3−C=CH2 + H2O → CH3−CH(CH3)−CH3
| |
CH3 OH
Как видно, направление реакций гидратации определяется правилом Марковникова.
г) Гидратация – присоединение воды
С2Н4 + НОН → С2Н5ОН этиловый спирт
(этанол) -
19 слайд
4. Полимеризация — это процесс соединения многих маленьких одинаковых молекул в одну большую молекулу.
При полимеризации двойные связи в молекулах исходного непредельного соединения «разрываются», и за счет образующихся свободных валентностей эти молекулы соединяются друг с другом.
Полимеризация алкенов вызывается нагреванием, давлением, облучением, действием свободных радикалов или катализаторов. В упрощенном виде такую реакцию на примере этилена можно представить следующим образом:
n CH2 = CH2 → (- CH2 – CH2 -)n
ЭТИЛЕН ПОЛИЭТИЛЕН -
20 слайд
Вывод:
Реакции присоединения, окисления и полимеризации алкенов идут за счет разрыва двойной связи ( π-связи). -
21 слайд
Получение алкенов
1) Дегидрирование (отщепление водорода) алканов при повышенной температуре с катализатором.
СН3 – СН3 → СН2 = СН2 + Н2
С2Н6 → С2Н4 + Н2 t, kat2) Дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная кислоты) или при пропускании паров спирта над катализатором (окись алюминия).
CH3 – CH2 – OH → CH2 = CH2 + H2O
С2Н5ОН → С2Н4 + Н2О
-
22 слайд
Применение алкенов
Алкены широко используются в промышленности в качестве исходных веществ для получения многих важнейших продуктов.
Наибольшее значение имеет этилен и его производные.Применение этилена и его производных:
-
23 слайд
Этилен ускоряет созревание плодов
-
24 слайд
В качестве топлива
-
25 слайд
Для получения алканов
-
26 слайд
Этиленгликоль – для получения антифризов, тормозных жидкостей
-
27 слайд
Дихлорэтан – растворитель
-
28 слайд
Дихлорэтан – для борьбы с вредителями (окуривание зернохранилищ)
-
29 слайд
Дибромэтан – антидетонационная добавка в топливо
-
30 слайд
Дибромэтан – для обработки бревен от термитов и жуков
-
31 слайд
Хлорэтан, бромэтан – для наркоза при легких операциях
-
32 слайд
Этиловый спирт — растворитель, анти-септик в медицине , в производстве синтетического каучука…
-
33 слайд
Производство полиэтилена:
-
34 слайд
Содержание
Алкены
Номенклатура
Изомерия
Физические свойства
Строение алкенов
Химические свойства (реакции присоединения: галогенирование, гидрирование, гидрогалогенирование, гидратация; окисление, реакция полимеризации)
Получение (дегидрогенизация алканов, дегидратация спиртов, дегидрогалогенирование галогенпроизводных, дегалогенирование)
Применение
Литература -
-
-
-
-
39 слайд
Д) Изоляция проводов и кабелей
-
40 слайд
Ж) Каркасы катушек
-
41 слайд
З) Бронепанели в бронежилетах
-
42 слайд
И) Предметы быта
-
-
44 слайд
Применение этилена
-
-
46 слайд
Применение этилена (эталон)
-
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 153 153 материала в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
-
«Химия. Среднее профессиональное образование», Габриелян О.С., Остроумов И.Г.
Тема
Глава 11. Этиленовые и диеновые углеводороды. Каучуки
Больше материалов по этой теме
Другие материалы







- 11.01.2020
- 3575
- 29

Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Методика написания учебной и научно-исследовательской работы в школе (доклад, реферат, эссе, статья) в процессе реализации метапредметных задач ФГОС ОО»
-
Курс профессиональной переподготовки «Организация и предоставление туристских услуг»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС юридических направлений подготовки»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Организация системы менеджмента транспортных услуг в туризме»
-
Курс повышения квалификации «Финансовые инструменты»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
1. Основы органической химии
E-mail: [email protected]
Основы
органической
химии
Семинар-8.
Углеводороды.Алкены
лектор:
проф. Рохин Александр
Валерьевич
2. Алкены
(этиленовые углеводороды,
олефины) — непредельные
алифатические углеводороды,
молекулы которых содержат двойную
связь.
Общая формула ряда алкенов:
2
27.07.2017
3. Простейшие представители
3
27.07.2017
4. Алкены
В отличие от предельных
углеводородов, алкены содержат
двойную связь С=С, которая
осуществляется 4-мя общими
электронами:
В образовании такой связи
участвуют атомы углерода в sp2гибридизованном состоянии
4
27.07.2017
5. Строение С=С связи
Каждый из атомов имеет по три 2sp2гибридных орбитали, направленных друг к
другу под углом 120°, и одну
негибридизованную 2р-орбиталь,
расположенную под углом 90° к плоскости
гибридных АО:
5
27.07.2017
6. Строение С=С связи
Двойная связь является сочетанием σ- и πсвязей (хотя она изображается двумя
одинаковыми черточками, всегда следует
учитывать их неравноценность).
σ-Связь возникает при осевом перекрывании
sp2-гибридных орбиталей,
π -связь – при боковом перекрывании рорбиталей соседних sp2-гибридизованных
атомов углерода.
6
27.07.2017
7. Строение С=С связи
Образование связей в молекуле этилена
можно изобразить следующей схемой:
7
27.07.2017
8. Строение С=С связи
σ-Связи, образуемые sp2-гибридными
орбиталями, находятся в одной
плоскости под углом 120°.
Поэтому молекула этилена имеет
плоское строение :
8
27.07.2017
9. Номенклатура алкенов
названия алкенов производят от
названий соответствующих алканов
(путем замены суффикса –ан на –ен:
2 атома С → этан → этен;
3 атома С →пропан → пропен
Главная цепь выбирается таким образом,
чтобы она обязательно включала в себя
двойную связь.
9
27.07.2017
10. Номенклатура алкенов
названия алкенов производят от
названий соответствующих алканов
(путем замены суффикса –ан на –ен:
2 атома С → этан → этен;
3 атома С →пропан → пропен
Главная цепь выбирается таким образом,
чтобы она обязательно включала в себя
двойную связь.
10
27.07.2017
11. Номенклатура алкенов
Нумерацию углеродных атомов
начинают с ближнего к двойной связи
конца цепи.
Цифра, обозначающая положение
двойной связи, ставится обычно после
суффикса –ен.
Например:
11
27.07.2017
12. Номенклатура алкенов
В номенклатуре различных классов
органических соединений наиболее
часто используются следующие
одновалентные радикалы алкенов:
12
27.07.2017
13. Номенклатура алкенов
Назовите следующие алкены:
CH2=CH2
CH3—CH=CH2
CH3—CH3—CH=CH2
CH3—CH=CH—CH3
CH2=CH—CH=CH2
CH3—CH=CH2
|
CH3
13
27.07.2017
14. Структурная изомерия алкенов
1. Изомерия углеродного скелета
(начиная с С4Н8):
14
27.07.2017
15. Структурная изомерия алкенов
2. Изомерия положения двойной
связи (начиная с С4Н8) :
15
27.07.2017
16. Структурная изомерия алкенов
3.Межклассовая изомерия с
циклоалканами, начиная с С3Н6 :
16
27.07.2017
17. Пространственная изомерия алкенов
Вследствие жесткой закрепленности
атомов поворотная изомерия
относительно двойной связи не
проявляется.
Но становится возможной цис-трансизомерия:
17
27.07.2017
18. Пространственная изомерия алкенов
в молекуле СН3–СН=СН–СН3 группы СН3
могут находиться либо по одну сторону
от двойной связи в цис-изомере, либо
по разные стороны в транс-изомере:
18
27.07.2017
19. Свойства алкенов
Физические свойства алкенов
изменяются в гомологическом ряду:
от С2Н4 до С4Н8 – газы,
начиная с С5Н10 – жидкости,
с С18Н36 – твердые вещества.
Алкены практически нерастворимы в
воде, но хорошо растворяются в
органических растворителях
19
27.07.2017
20. Свойства алкенов
Химические свойства алкенов
определяются строением и свойствами
двойной связи С=С, которая значительно
активнее других связей в молекулах
этих соединений.
Алкены химически более активны, чем
алканы.
20
27.07.2017
21. Реакции присоединения
Алкены вступают в реакции с
различными соединениями:
21
27.07.2017
22. Гидрирование (присоединение водорода)
Алкены взаимодействуют с водородом
при нагревании в присутствии
металлов Pt, Pd или Ni:
22
27.07.2017
23. Гидрирование (присоединение водорода)
Присоединение водорода к атомам
углерода в алкенах приводит к
понижению степени их окисления:
Поэтому гидрирование алкенов относят
к реакциям восстановления.
23
27.07.2017
24. Гидрирование (присоединение водорода)
Эта реакция используется в
промышленности для получения
высокооктанового топлива:
24
27.07.2017
25. Галогенирование (присоединение галогенов)
Присоединение галогенов по двойной
связи С=С происходит легко в обычных
условиях (при комнатной температуре,
без катализатора):
Эти реакции протекают по механизму
электрофильного присоединения
25
27.07.2017
26. Механизм электрофильного присоединения галогена к алкенам
Электрофильные («любящие электроны»)
реагенты, это частицы (катионы или
молекулы), имеющие свободную орбиталь
на внешнем электронном уровне (H+, CH3+,
Br+, Cl+, NO2+, AlCl3 и т.п.) :
26
27.07.2017
27. Механизм электрофильного присоединения галогена к алкенам
Механизм присоединения протекает в три
стадии:
Ст адия 1: образование π-комплекса. pЭлектронное облако двойной связи С=С
взаимодействует с электрофилом, например,
с катионом брома (Br+):
27
27.07.2017
28. Механизм электрофильного присоединения галогена к алкенам
Ст адия 2 (лимитирующая): образование
карбокатиона. Электрофил (Br+)
присоединяется к одному из атомов углерода
за счет электронной пары π-связи.
На втором углеродном атоме, лишенном
связывающих p-электронов, появляется
положительный заряд:
28
27.07.2017
29. Механизм электрофильного присоединения галогена к алкенам
Ст адия 3: взаимодействие карбокатиона с
анионом Br-, образовавшемся при
диссоциации HBr (или Вr2), которое
приводит к продукту реакции:
29
27.07.2017
30. Механизм электрофильного присоединения галогена к алкенам)
Изменение энергии на различных
стадиях реакции:
30
27.07.2017
31. Гидрогалогенирование (присоединение галогеноводородов)
Реакция идет по механизму
электрофильного присоединения с
гетеролитическим разрывом связей.
Электрофилом является протон Н+ в
составе молекулы галогеноводорода
HX (X — галоген):
31
27.07.2017
32. Гидрогалогенирование (присоединение галогеноводородов)
Механизм реакции протекает в три
стадии:
32
27.07.2017
33. Гидратация (присоединение воды)
Гидратация происходит в присутствии
минеральных кислот по механизму
электрофильного присоединения:
33
27.07.2017
34. Гидратация (присоединение воды)
Реакция происходит в присутствии
минеральных кислот (донора Н+) по
механизму электрофильного
присоединения:
34
27.07.2017
35. Полимеризация алкенов
1. Полимеризация – реакция
образования высокомолекулярного
соединения (полимера) путем
последовательного присоединения
молекул низкомолекулярного вещества
(мономера) по схеме:
35
27.07.2017
36. Полимеризация алкенов
Число n называется степенью
полимеризации. Реакции
полимеризации алкенов идут в
результате присоединения по кратным
связям:
36
27.07.2017
37. Полимеризация алкенов
2. Димеризация алкенов – образование
димера в результате реакции
присоединения.
В присутствии минеральной кислоты
(донора протона Н+) происходит
присоединение протона по двойной
связи:
37
27.07.2017
38. Получение алкенов
I. Крекинг алканов:
например:
38
27.07.2017
39. Получение алкенов
II. Отщепление (элиминирование) двух
атомов или групп атомов от соседних
атомов углерода с образованием между
ними π-связи двух типов:
дегидратация
дегидрогалогенирование
39
27.07.2017
40. Получение алкенов
II. Отщепление :
дегидратация (при температуре
менее 150°C в присутствии
водоотнимающих реагентов )
40
27.07.2017
41. Получение алкенов
II. Отщепление :
Дегидрогалогенирование
(Дегидрогалогенирование
моногалогеналканов при действии
спиртового раствора щелочи)
41
27.07.2017
42. Применение алкенов
Алкены применяются в качестве
исходных продуктов в производстве
полимерных материалов (пластмасс,
каучуков, пленок) и других
органических веществ
42
27.07.2017
43. Применение алкенов
Этилен (этен) Н2С=СН2 используется
для получения многих органических
соединений.
43
27.07.2017
44. Применение алкенов
Пропилен (пропен) Н2С=СН2–СН3 и
бутилены (бутен-1 и бутен-2)
используются для получения спиртов и
полимеров.
Изобутилен (2-метилпропен)
Н2С=С(СН3)2 применяется в
производстве синтетического каучука.
44
27.07.2017
45. 1.Контрольная работа
1. Какие модели соответствуют
молекулам алкенов?
45
27.07.2017
46. 2. Контрольная работа
Дайте названия следующих алкенов,
полученных из алканов:
— пропан
— декан
— октан
— этан
— пентан
— гексан
46
27.07.2017
47. 3.Контрольная работа
Назовите соединение:
Ответ 1: 3-метил-4-этилпентен-2
Ответ 2: 3-метил-2-этилпентен-3
Ответ 3: 3,4-диметилгексен-2
Ответ 4: 2-этил-3-метилпентен-2
47
27.07.2017
48. 4. Контрольная работа
Сколько изомерных алкенов
соответствует формуле С4Н8 ?
Ответ
Ответ
Ответ
Ответ
48
1:
2:
3:
4:
изомеров нет
два
три
четыре
27.07.2017
49. 5. Контрольная работа
Двойная связь является сочетанием . . .
Ответ
Ответ
Ответ
Ответ
связи
49
1:
2:
3:
4:
двух σ-связей
двух π-связей
одной σ-связи и одной π-связи
ионной связи и ковалентной
27.07.2017
50. 6. Контрольная работа
Какова гибридизация атомов углерода в
молекуле алкена:
Ответ
Ответ
Ответ
Ответ
sp2
1:
2:
3:
4:
50
1
1
1
1
и
и
и
и
4
4
4
4
–
–
–
–
sp2, 2 и 3 – sp3
sp3, 2 и 3 – sp2
sp3, 2 и 3 – sp
не гибридизованы, 2 и 3 –
27.07.2017
51. 7. Контрольная работа
Наиболее характерными реакциями
алкенов являются:
Ответ 1: реакции замещения
Ответ 2: реакции присоединения
Ответ 3: реакции разложения
51
27.07.2017
Слайд 1
Непредельные углеводороды
Слайд 2
Алкены (этиленовые углеводороды) это углеводороды, содержащие в молекуле одну двойную связь. C n H 2 n общая формула (n = 2,3,4….) С 2 Н 4 – этилен – эт ен СН 2 = СН 2 С 3 Н 6 – проп ен СН 2 = СН – СН 3 С 4 Н 8 — бут ен С 5 Н 10 — пент ен С 6 Н 12 — гекс ен
Слайд 3
Физические свойства По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C 2 – C 4 – газы, C 5 – C 17 – жидкости, высшие представители – твердые вещества. Температура их плавления и кипения, а также плотность увеличиваются с ростом молекулярной массы. Все алкены легче воды, плохо растворимы в ней, однако растворимы в органических растворителях.
Слайд 4
Этилен – газ, почти без запаха, плохо растворим в воде. Строение этилена С 2 Н 4 – молекулярная формула Н Н структурная С = С формула Н Н этилена
Слайд 5
1. Образование σ -связей Каждый атом С образует по 3 σ -связи (одну – с соседним атомом С и две связи с атомами Н). На их образование углерод затрачивает 3 электрона (один s- электрон и два р-электрона), поэтому происходит sp 2 -гибридизация. Схематическое изображение строения молекулы этилена В результате каждый атом углерода обладает тремя гибридными sp 2 -орбиталями, которые лежат в одной плоскости под углом 120º друг к другу.
Слайд 6
Схема образования sp 2 -гибридных орбиталей В гибридизации участвуют орбитали одного s — и двух p -электронов: s 2p sp 2
Слайд 7
2. Образование π -связи У каждого атома С есть ещё по одному облаку, которые в гибридизации не участвуют и сохраняют форму правильных восьмерок. Перекрываясь над и под плоскостью, они образуют π — связь , которая располагается перпендикулярно к плоскости σ — связей. Двойная связь алкенов представляет собой сочетание σ — и π — связей. Длина двойной связи = 0,134 нм.
Слайд 8
Запомните. Простая (ординарная) связь – это всегда σ -связь. В кратных (двойных или тройных) связях – одна σ -связь, а остальные π -связи. σ -связи всегда образованы гибридными орбиталями (неправильными восьмерками). π -связи образованы негибридными p – орбиталями (правильными восьмерками).
Слайд 9
π — связь менее прочна, чем σ — связь. В связи с этим, π — связь легко разрывается и переходит в две новые σ — связи в результате присоединения по месту двойной связи двух атомов или групп атомов реагирующих веществ. Для алкенов наиболее типичными являются реакции присоединения.
Слайд 10
Изомерия алкенов 1) углеродного скелета CH 2 = CH – CH 2 – CH 3 CH 2 = C – CH 3 бутен-1 ׀ CH 3 2-метилпропен-1 2) положения двойной связи CH 2 = CH – CH 2 – CH 3 CH 3 – CH = CH – CH 3 бутен-1 бутен-2 3) классов соединений (циклоалканы) CH 2 = CH – CH 2 – CH 3 CH 2 – CH 2 бутен-1 | | CH 2 – CH 2 циклобутан
Слайд 11
4) пространственная (цис-транс-изомерия) CH 3 H H H / / C = C C = C / / H CH 3 CH 3 CH 3 транс — цис — Запомните! Если одинаковые заместители находятся по одну сторону двойной связи, это цис–изомер, если по разные – это транс–изомер.
Слайд 12
Номенклатура алкенов Название алкенов по систематической номенклатуре образуют из названий алканов, заменяя суффикс –ан на –ен , цифрой указывается номер того атома углерода, от которого начинается двойная связь. Главная цепь атомов углерода должна обязательно включать двойную связь, и ее нумерацию проводят с того конца главной цепи, к которому она ближе. В начале названия перечисляют радикалы с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов, то цифрой указывается место каждого из них в главной цепи и перед их названием ставят соответственно приставки: ди- , три- , тетра- и т.д.
Слайд 13
Химические свойства алкенов 1) Горение При сжигании на воздухе алкены образуют углекислый газ и воду. C 2 H 4 + 3 O 2 → 2 CO 2 + 2 H 2 O + Q 2 ) Окисление – качественная реакция на двойную связь (растворы окислителей обесцвечиваются)
Слайд 14
При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли ( реакция Е.Е.Вагнера ). Реакция протекает на холоде. 3H 2 C=CH 2 + 2KMnO 4 + 4H 2 O → 2MnO 2 + 2KOH + 3CH 2 −CH 2 | | OH OH В результате реакции наблюдается обесцвечивание раствора перманганата калия. Реакция Вагнера служит качественной пробой на двойную связь. H 2 C=CH 2 + [О] + НОН → CH 2 −CH 2 этилен- | | гликоль OH OH
Слайд 15
3 ) Реакции присоединения. а) Присоединение галогенов — Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к дигалогенопроизводным алканов, содержащим атомы галогена у соседних углеродных атомов. H 2 C = CH 2 + Br 2 → BrCH 2 – CH 2 Br С 2 Н 4 + Br 2 → С 2 Н 4 Br 2 дибромэтан С 2 Н 4 + Cl 2 → С 2 Н 4 CI 2 дихлорэтан Приведенная реакция — обесцвечивание этиленом бромной воды является качественной реакцией на двойную связь.
Слайд 16
б) Гидрирование – присоединение водорода. Алкены легко присоединяют водород в присутствии катализаторов ( Pt , Pd , Ni ) образуя предельные углеводороды. CH 2 = CH 2 + H 2 → CH 3 – CH 3 С 2 Н 4 + H 2 → C 2 H 6 этан t,kat в) Присоединение галогеноводородов — Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов. H 2 C = CH 2 + H С I → CH 3 – CH 2 CI С 2 Н 4 + HCI → C 2 H 5 CI хлорэтан
Слайд 17
Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом В.В.Марковникова ( водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, то есть к атому углерода с наибольшим числом водородных атомов ). CH 3 − CH = CH 2 + HCl → CH 3 – CH ( Cl )− CH 3
Слайд 18
Гидратация. В присутствии минеральных кислот алкены присоединяют воду, образуя спирты. H+ CH 3 − C = CH 2 + H 2 O → CH 3 − CH(CH 3 ) − CH 3 | | CH 3 OH Как видно, направление реакций гидратации определяется правилом Марковникова. г) Гидратация – присоединение воды С 2 Н 4 + НОН → С 2 Н 5 ОН этиловый спирт (этанол)
Слайд 19
4. Полимеризация — это процесс соединения многих маленьких одинаковых молекул в одну большую молекулу. При полимеризации двойные связи в молекулах исходного непредельного соединения «разрываются», и за счет образующихся свободных валентностей эти молекулы соединяются друг с другом. Полимеризация алкенов вызывается нагреванием, давлением, облучением, действием свободных радикалов или катализаторов. В упрощенном виде такую реакцию на примере этилена можно представить следующим образом: n CH 2 = CH 2 → (- CH 2 – CH 2 -) n ЭТИЛЕН ПОЛИЭТИЛЕН
Слайд 20
Вывод: Реакции присоединения, окисления и полимеризации алкенов идут за счет разрыва двойной связи ( π -связи ).
Слайд 21
Получение алкенов 1) Дегидрирование (отщепление водорода) алканов при повышенной температуре с катализатором. СН 3 – СН 3 → СН 2 = СН 2 + Н 2 С 2 Н 6 → С 2 Н 4 + Н 2 t, kat 2) Дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная кислоты) или при пропускании паров спирта над катализатором (окись алюминия). CH 3 – CH 2 – OH → CH 2 = CH 2 + H 2 O С 2 Н 5 ОН → С 2 Н 4 + Н 2 О
Слайд 22
Применение алкенов Алкены широко используются в промышленности в качестве исходных веществ для получения многих важнейших продуктов. Наибольшее значение имеет этилен и его производные. Применение этилена и его производных:
Слайд 23
Этилен ускоряет созревание плодов
Слайд 24
В качестве топлива
Слайд 25
Для получения алканов
Слайд 26
Этиленгликоль – для получения антифризов, тормозных жидкостей
Слайд 27
Дихлорэтан – растворитель
Слайд 28
Дихлорэтан – для борьбы с вредителями (окуривание зернохранилищ)
Слайд 29
Дибромэтан – антидетонационная добавка в топливо
Слайд 30
Дибромэтан – для обработки бревен от термитов и жуков
Слайд 31
Хлорэтан, бромэтан – для наркоза при легких операциях
Слайд 32
Этиловый спирт — растворитель, анти-септик в медицине , в производстве синтетического каучука…
Слайд 33
Производство полиэтилена:
Слайд 34
Содержание Алкены Номенклатура Изомерия Физические свойства Строение алкенов Химические свойства ( реакции присоединения: галогенирование, гидрирование, гидрогалогенирование, гидратация; окисление, реакция полимеризации ) Получение (дегидрогенизация алканов, дегидратация спиртов, дегидрогалогенирование галогенпроизводных, дегалогенирование) Применение Литература
Слайд 35
А) Пленка
Слайд 36
Б) Тара
Слайд 37
В) Трубы
Слайд 38
Г) Сантехника
Слайд 39
Д) Изоляция проводов и кабелей
Слайд 40
Ж) Каркасы катушек
Слайд 41
З) Бронепанели в бронежилетах
Слайд 42
И) Предметы быта
Слайд 44
Применение этилена Свойство Применение 1 . Горение 2. Присоединение галогенов 3. Присоединение водорода (гидрирование) 4. Присоединение галогеноводородов (гидрогалогенирование)
Слайд 45
Свойство Применение 5.Присоединение воды (гидратация) 6. Окисление раствором KMnO 4 7. Полимеризация 8. Особое свойство этилена
Слайд 46
Применение этилена (эталон) Свойство Применение 1 . Горение В качестве топлива 2. Присоединение галогенов Растворители (дихлорэтан) 3. Присоединение водорода (гидрирование) 4. Присоединение галогеноводородов Для получения алканов Растворители (хлорэтан)
Слайд 47
Свойство Применение 5.Присоединение воды (гидратация) Для получения этилового спирта, используемого как растворитель, анти-септик в медицине , в производстве синтетического каучука 6. Окисление раствором KMnO 4 Получение антифризов, тормозных жидкостей 7. Полимеризация 8. Особое свойство этилена Производство полиэтилена Этилен ускоряет созревание плодов
Презентация «АЛКЕНЫ»
Подписи к слайдам:
- Дмитриенко К. Е., учитель химии
- МОУ
- Кайгородская СОШ
- Краснозерского района
- Новосибирской области
Номенклатура и изомерия
- H H
- | |
- H – C – C = C – C – H
- | | | |
- H H H H
- Для алкенов характерны следующие виды изомерии:
- Структурная изомерия:
- а) изомерия углеродного скелета
- б) изомерия положения кратной связи
- в) изомерия положения заместителей (Hal, — NO2, SO2-OH и др.) в замещенных соединениях алкенов
- Пространственная геометрическая изомерия.
- Межклассовая изомерия (с циклоалканами).
Изомерия
- Структурная изомерия:
- а) изомерия углеродного скелета
- CH2 = CH – CH2 – CH2 – CH3
- пентен-1
- б) изомерия положения кратной связи
- CH2 = CH – CH2 – CH2 – CH3
- пентен-1
- в) изомерия положения заместителей (Hal, — NO2, SO2-OH и др.) в замещенных соединениях алкенов
- Cl
- |
- CH2 = CH – CH – CH2 – CH3
- CH3
- |
- CH2 = C – CH2 – CH3
- 1 2 3 4 5
- 1 2 3 4
- 2-метилбутен-1
- C5H10
- пентен-2
- CH3–CH = CH – CH2 – CH3
- 1 2 3 4 5
- C5H10
- 1 2 3 4 5
- 1 2 3 4 5
- 3-хлорпентен-1
- 4-хлорпентен-1
- Cl
- |
- CH2 = CH – CH2 – CH – CH3
- 1 2 3 4 5
- C5H9Cl
Изомерия
- Пространственная геометрическая изомерия
- Межклассовая изомерия (с циклоалканами)
- CH2 = CH – CH2 ― CH2 – CH3
- пентен-1
- бутилен-2
- CH3 – CH = CH – CH3
- транс-изомер
- цис-изомер
- CH3 CH3
- /
- C = C
- /
- H H
- CH3 H
- /
- C = C
- /
- H CH3
- 1 2 3 4 5
- CH2―CH2
- | |
- CH2 CH2
- /
- CH2
- циклопентан
- C5H10
Физические свойства
- Их температуры плавления и кипения, также как у алканов , закономерно повышаются при увеличении молекулярной массы соединения. Алкены с разветвленной углеродной цепью имеют более низкие температуры кипения, чем изомеры с нормальной (неразветвленной) цепью.
- По принципу «подобное растворяется в подобном» алкены должны быть растворимы в неполярных растворителях и плохо растворимы в полярных. Действительно, они хорошо растворяются в бензоле, тетрахлорометане, петролейном и диэтиловом эфирах, но практически не растворяются в воде.
- C2H4 – C4H8
- газы
- C5H10 – C16H32
- жидкости
- C17H34 – …
- твердые вещества
Химические свойства
- H – C = C – H
- | |
- H H
- Реакции присоединения
- Реакции окисления
- Реакции замещения
- Реакции изомеризации
- Реакции элиминирования (отщепления)
- +
- +
- —
- +
- +
Реакции присоединения
- |
- |
- пропан
- CH3 – CH2 – CH3
- CH2 – CH – CH3
- | |
- Br Br
- 1,2-дибромпропан
- CH2 – CH – CH3
- –
- +
- H
- H
- –
- 1 2 3
- |
- |
- Br
- H
- H
- пропен
- (пропилен)
- –
- Гидрирование (в присутствии металлических катализаторов –
- Pt, Pd, Ni):
- Галогенирование
- Br
- CH2 – CH – CH3
- –
- пропен
- (пропилен)
- –
- –
- Br
- Br
- +
- –
- –
- Реакция с бромной водой – качественная реакция на алкены
- (бромная вода обесцвечивается).
Реакции присоединения
- |
- |
- CH3 – CH – CH3
- |
- Br
- 2-бромпропан
- 1 2 3
- H
- Гидрогалогенирование (по правилу Марковникова)
- Br
- CH2 – CH – CH3
- –
- пропен
- (пропилен)
- –
- –
- Br
- H
- +
- –
- Правило Марковникова: при присоединении веществ с полярной ковалентной связью
- типа HX (где X – это -Hal, -OH и т.д.) к несимметричным непредельным углеводородам по
- месту разрыва π-связи атом водорода присоединяется к наиболее гидрированному атому
- углерода, а X – к наименее гидрированному атому углерода.
Реакции присоединения
- пропанол-2
- CH3 – CH2 – OH
- этанол
- CH2 – CH – CH3
- –
- +
- H
- OH
- –
- |
- |
- H
- H
- OH
- пропен
- (пропилен)
- –
- Гидратация (по правилу Марковникова): с образованием вторичных спиртов
- (кроме этилена – у него образуется первичный спирт)
- OH
- CH2 – CH2
- –
- этен
- (этилен)
- –
- –
- OH
- H
- +
- –
- –
- C H3 – CH – CH3
- |
- OH
- –
- (пропиловый спирт,
- (этиловый спирт)
- 1 2 3
- вторичный пропанол)
Реакции присоединения
- пропил-2-серная кислота
- пропанол
- CH2 – CH – CH3
- –
- +
- H
- O – SO2OH
- –
- |
- |
- H
- H
- O – SO2OH
- пропен
- (пропилен)
- –
- Сульфирование (по правилу Марковникова) – взаимодействие с
- концентрированной серной кислотой с образованием алкилсерных кислот
- OH
- –
- пропил-2-серная кислота
- (пропилгидросульфат)
- OH
- +
- –
- C H3 – CH – CH3
- |
- O – SO2OH
- (пропилгидросульфат)
- (пропиловый спирт)
- 1 2 3
- (моноалкилгидросульфатов).
- серная кислота
- H2SO4(конц.)
- CH3 – CH – CH3
- |
- O – SO2OH
- +
- HO – SO2OH
- C H3 – CH – CH3
- |
- OH
- серная кислота
- В дальнейшем используется как удобный метод для получения спиртов при
- гидратации алкенов (как промежуточный этап):
- O – SO2OH
- 1 2 3
Реакции присоединения
- Алкилирование
- CH3
- |
- C H3 – C
- |
- CH3
- H
- +
- CH2 – C – CH3
- |
- CH3
- –
- |
- –
- CH3
- |
- C H3 – C
- |
- CH3
- CH3
- |
- CH3 – C – CH2 – CH – CH3
- | |
- CH3 CH3
- метилпропан
- метилпропен
- 2,2,4-триметилпентан
- (изооктан)
- 1 2 3 4 5
- H
- CH3
- |
- C
- / \
- HC C
- || |
- HC CH
- //
- C
- +
- CH2 – CH2
- CH2 – CH2
- H
- H
- H
- H
- –
- –
- |
- –
- –
- –
- CH3
- |
- C
- / \
- HC C–CH2–CH3
- || |
- HC CH
- //
- CH
- +
- CH3
- |
- C
- / \
- HC CH
- || |
- HC CH
- //
- C
- |
- CH2–CH3
- метилбензол
- 1-метил-2-этилбензол
- 1-метил-4 этилбензол
- CH2 – CH2
- этен
- 2
- 2
Реакции присоединения
- Взаимное алкилирование (обратный процесс крекинга алкенов),
- CH2=CH2
- +
- CH2=CH2
- Kt, t0
- CH3 – CH=CH – CH3
- бутилен-2
- CH2=CH – CH2 – CH3
- бутилен-1
- CH2=C – CH3
- |
- CH3
- метилпропилен
- CH2=CH – CH=CH2
- +
- H2
- бутадиен-1,3
- при разных температурах образуются разные соединения
Реакции присоединения
- Реакции полимеризации.
- ..– CH2–CH2 –CH2–CH2 –..
- полиэтилен
- (– CH2 – CH2 –)
- структурное звено
- полимера
- (– CH – CH2 –)
- |
- CH3
- полипропилен
- пропилен
- H2C CH2
- –
- –
- ..
- +
- +
- H2C CH2
- t0, kt, P
- +
- ..
- –
- –
- ..
- +
- H2C CH2
- +
- H2C CH2
- +
- ..
- –
- –
- |
- |
- |
- |
- –
- –
- –
- –
- этилен
- t0, kt, P
- t0, kt, P
- H2C = CH2
- n
- n
- мономер
- где n – это степень полимеризации
- CH = CH2
- |
- CH3
- n
- n
- –
Реакции окисления
- Горение
- 2 H2O
- +
- 2 CO2 ↑
- 2 CO ↑
- +
- 2 H2O
- 2 C
- +
- 2 H2O
- Этилен при смешивании с воздухом образует взрывоопасную смесь.
- C2H4 + 3 O2 (избыток)
- C2H4 + 2 O2 (недостаток)
- C2H4 + O2 (сильный недостаток)
Реакции окисления
- Частичное окисление кислородом воздуха с образованием
- H2C CH2
- /
- O
- 2
- 2
- t0, Ag
- этиленоксид
- (эпоксиэтан
- этилен
- пропиленоксид
- (эпоксипропан
- –
- –
- –
- +
- –
- /
- |
- |
- H2C CH2
- O
- O
- O
- O
- –
- –
- +
- –
- –
- –
- –
- –
- или окись этилена)
- эпоксидов (реакция Прилежаева):
- CH3 – H2C CH2
- 2
- 2
- CH3 – H2C CH2
- +
- +
- t0, Ag
- пропилен
- или окись пропилена)
- –
- O
- /
- O
- O
- O
- O
- –
- –
- –
- –
- –
- –
- –
- –
- –
- –
- |
- |
- /
Реакции окисления
- Окисление кислородом окислителя (KMnO4, K2Cr2O7 и др.) в
- CH2=CH2
- C H2=C H2
- + [O] + H – OH
- – CH2 – CH2 –
- HO
- 1 2
- OH
- из KMnO4
- ––––––––
- (этандиол-1,2)
- этиленгликоль
- 3
- | |
- 3
- -2
- 2
- KOH
- ––
- H2O
- KMn O4
- +
- 4
- +
- -2
- +7
- OH OH
- C H2 – C H2
- -1
- -1
- +
- 2
- KOH
- Mn O2
- +
- 2
- +4
- 3 C2-2
- →
- C2-1
- 3
- →
- 3
- 2
- 2 Mn+7
- –6ē
- Mn+4
- 2
- 6
- + 6ē
- C
- -2ē
- + 3ē
- -2
- -1
- +7
- +4
- 2
- →
- C
- 2
- Mn
- Mn
- →
- качественная реакция на этиленовые углеводороды.
- щелочной среде (реакция Вагнера)
- Обесцвечивание щелочного раствора KMnO4 без нагревания – это
Реакции окисления
- Жесткое окисление кислородом более энергичного окислителя в кислой среде (кислый раствор KMnO4, HNO3, хромовая смесь) при нагревании
- (обесцвечивание раствора KMnO4 – это качественная реакция на непредельные углеводороды ).
- R – CH=CH – R + 4 [O]
- CH3 – CH2 – CH=CH – CH3 + 4 [O]
- -1
- +7
- +2
- 2
- R — COOH
- 5 4 3 2 1
- +
- +
- R – COOH
- CH3 – CH2 – COOH
- этановая кислота
- CH3 – COOH
- +H3O+, t°
- пропановая кислота
- +H3O+, t°
- пентен-2
- H2SO4
- 4
- KMn O4
- 8
- CH3–CH2–C H=C H–CH3
- Mn SO4
- 8
- K2SO4
- 12
-
- +
- 12
- H2O
- +
- +
- +
- +
- 5
- этановая кислота
- CH3–C OOH
- 5
- +
- пентен-2
- пропановая кислота
- 5
- CH3–CH2–C OOH
- +
- -1
- -40ē
- →
- 8
- + 40ē
- Mn
- C
- 10
- C
- 5
- →
- +3
- -1
- 8
- Mn
- +2
- +7
- C
- 40
- 8
- 5
- -8ē
- →
- 2
- Mn
- C
- Mn
- +5ē
- →
- 2
- -1
- +3
- +7
- +2
- +3
- +3
- 8
- 5
Реакции окисления
- CH3 – CH2 – CH =CH2
- Но метановая (муравьиная) кислота окисляется до угольной кислоты,
- HCOOH + [O]
- CH3 –CH2–CH2–C H=C H2
- +
- HCOOH
- CH3 – CH2 – COOH
- +H3O+, t°
- бутилен-1
- угольная кислота
- (муравьиная)
- метановая
- кислота
- пропановая
- кислота
- CO2↑
- +
- H2O
-
- (т.е. H2CO3)
- HOCOOH
- метановая кислота
- которая распадается на углекислый газ и воду:
- 4 3 2 1
- + 4 [O]
- пентен-1
- 5 4 3 2 1
- H2O
- +
- 4
- +
- →
-
- K2SO4
- 2
- Mn SO4
- +
- H2SO4
- 3
- +
- KMn O4
- CH3 –CH2–CH2–C OOH
- C O2 ↑
- 2
- +
- бутановая кислота
- +
- +
- -1
- -2
- +2
- +7
- +3
- +4
- C+3
- -6ē
- →
- C+4
- C-1
- -4ē
- +10ē
- →
- Mn+2
- 2
- C-2
- 2
- 1
- 2
- Mn+7
- →
- + 5ē
- Mn
- -10ē
- 10
- →
- – 6ē
- Mn
- C
- C
- – 4ē
- →
- C
- C
- -1
- +3
- -2
- +4
- +7
- +2
Реакции изомеризации
- метилпропен
- +
- CH3–CH=CH–CH3
- CH3–C=CH2
- бутен-2
- бутен-1
- 550°C
- 1 2 3
- 1 2 3 4
- CH C C
- H
- 2
- H
- CH3
- –
- |
- CH3
- –
- –
- |
- 3
- H
- 2
- –
- CH3
- 4
- –
- H
- –
- Изомеризация по кратной связи
- и по углеродному скелету
Реакции отщепления
(элиминирования)
- до алкадиенов
- CH2 CH C C
- CH2 = CH – CH = CH2
- бутадиен-1,3
- бутен-1
- MgO, ZnO
- H2
- +
- 1200°C
- этен
- (этилен)
- (ацетилен)
- H – C ≡ C – H
- +
- H2
- этин
- 1 2 3 4
- 1 2 3 4
- –
- 2
- –
- –
- –
- –
- 2
- 3
- |
- |
- H
- H
- H
- H
- H
- –
- H – C C – H
- –
- –
- –
- |
- |
- H
- –
- до алкинов
Обобщение
Получение алкенов
- Крекинг нефтепродуктов
- C C C – CH3
- 2
- C16H34
- C8H18
- +
- C8H16
- гексадекан
- октан
- октен
- Обычно образуется смесь различных углеводородов: например, при крекинге бутана
- конечными продуктами будет – смесь бутенов, пропилена, этилена и метана; при
- крекинге пропана – смесь пропилена, этилена и метана; при крекинге метилпропана –
- смесь метилпропилена, пропилена и метана.
- Дегидрирование предельных углеводородов
- CH2 = CH – CH2 – CH3
- CH3 – CH = CH – CH3
- бутен-1
- бутен-2
- 1 2 3 4
- 1 2 3 4
- — H2
- 2CH4
- 550-650oc, Kt
- C2H4
- +
- H2
- 2
- метан
- этилен
- H
- H
- H
- H
- 2
- 2
- –
- –
- –
- –
- |
- |
- |
- 3
- H
- H
- –
- 2
- бутан
- H
- –
Получение алкенов
- Внутримолекулярная дегидратация спиртов
- H2SO4, 140-150oC
- H2O
- +
- H H
- | |
- C C
- | |
- H H
- этанол
- этилен
- CH2 = CH2
- Правило Зайцева: при отщеплении галогенводорода от вторичных и
- CH3 – CH = CH – CH3
- +
- NaBr
- H2O
- +
- +
- OH
- спирт, to
- бутен-2
- 2-бромбутан
- Дегидрогалогенирование галогенпроизводных алканов (по правилу Зайцева)
- –
- –
- –
- H
- H
- OH
- OH
- –
- –
- третичных галогеналканов атом водорода отщепляется от наименее
- гидрированного атома углерода.
- CH3 – CH C – CH3
- Na
- 2
- |
- |
- H
- H
- Br
- OH
- Na
- –
- –
- Br
- |
- 1 2 3 4
- 1 2 3 4
Получение алкенов
- Дегалогенирование дигалогенпроизводных алканов
- ZnBr2
- +
- CH3 – CH = CH – CH3
- +
- Zn
- 2.3-дибромбутан
- бутен-2
- 1 2 3 4
- 1 2 3 4
- CH3 – CH CH – CH3
- |
- |
- |
- |
- –
- –
- Br
- Br
- Br
- Br
Применение этилена
Применение пропилена
Применение изомеров бутилена
Домашнее задание
Используемая литература
- «Репетитор по химии (издание 15-ое)», под редакцией Егорова А. С., Феникс – Ростов-на-Дону, 2006
- Габриелян О. С., Маскаев Ф. Н., Пономарев С. Ю., Теренин В. И. « Химия 10 класс: профильный уровень». (Учебник для общеобразовательных учреждений), Дрофа – Москва, 2005
- Рудзитис Г. Е., Фельдман Ф. Г. «Химия 10: органическая химия (Учебник для 10 класса средней школы)», Просвещение – Москва, 1991
- Перекалин В. В., Зонис С. А. «Органическая химия (учебное пособие для студентов педагогических институтов по химическим и биологическим специальностям)», Просвещение – Москва, 1982
- «Органическая химия. Том1 (Основной курс)» под редакцией Н. А. Тюкавкиной (учебник для студентов вузов по специальности «Фармация»), Дрофа – Москва, 2004
11/10/18
Алкены
ХИМИЯ — 10
Автор: Кунова Г.В. — учитель химии ГОАОУ «ЦОРиО»
г. Липецк
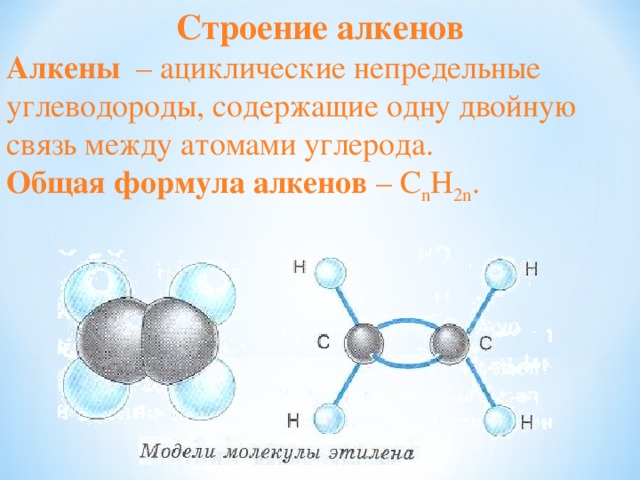
11/10/18
- Строение молекулы
- К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода .
- Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения , прежде всего водорода, с образованием предельных, или насыщенных, углеводородов – алканов.
- Какую пользу получит аудитория от презентации: взрослых учащихся больше интересует предмет, если они знают, почему и насколько он важен для них.
- Уровень знаний докладчика по теме: кратко укажите свои профессиональные успехи в этой области или объясните, почему участникам интересно будет вас послушать.
- По названию первого представителя гомологического ряда – этилена – алкены называют этиленовыми углеводородами.
11/10/18
- Строение молекулы
- Орбитали атомов углерода, между которыми имеется двойная связь, находятся в состоянии sp 2 -гибридизации.
- Это означает, что в гибридизации участвуют одна s- и две p-орбитали , а одна p-орбиталь остаётся негибридизованной.
- Перекрывание гибридных орбиталей приводит к образованию σ-связи , а за счёт негибридизованных p-орбиталей соседних атомов углерода образуется вторая, π-связь.
Вывод: двойная связь состоит из одной σ- и одной π-связи.
11/10/18
- Строение молекулы
- Оси гибридных орбиталей атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π-связь , располагаются перпендикулярно плоскости молекулы.
- Двойная связь (0,132 нм) короче одинарной, а её энергия больше, т. е. она является более прочной. Тем не менее наличие подвижной, легко поляризуемой π-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
- Гомологический ряд этена
11/10/18
11/10/18
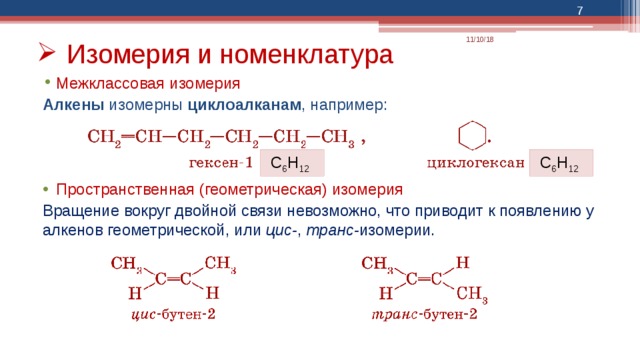
- Изомерия и номенклатура
- Структурная изомерия
1) изомерия углеродного скелета:
2) изомерия положения двойной связи:
11/10/18
- Изомерия и номенклатура
- Межклассовая изомерия
Алкены изомерны циклоалканам , например:
- Пространственная (геометрическая) изомерия
Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов геометрической, или цис- , транс- изомерии.
С 6 Н 12
С 6 Н 12
11/10/18
- Изомерия и номенклатура
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Определения главной цепи – самой длинной цепочки атомов углерода в молекуле. Главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Если по расположению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, -ен.
5-метилгексен-2
11/10/18
Получение алкенов
Рассмотрим основные способы получения алкенов
- в промышленности
- в лаборатории
11/10/18
- Получение – в промышленности
- Крекинг нефтепродуктов.
В процессе термического крекинга предельных углеводородов наряду с образованием алканов происходит образование алкенов, например:
- Дегидрирование предельных углеводородов.
При пропускании алканов над катализатором (Pt, Ni, Cr2O3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена.
11/10/18
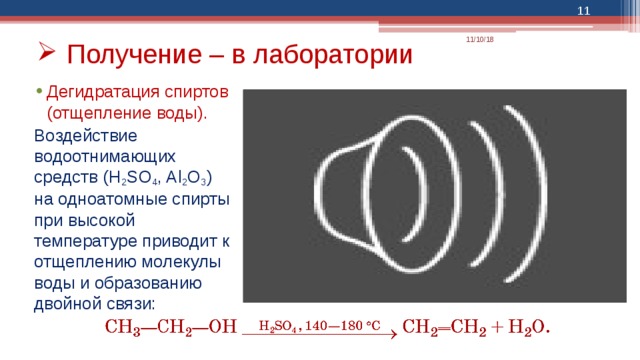
- Получение – в лаборатории
- Дегидратация спиртов (отщепление воды).
Воздействие водоотнимающих средств (H 2 SO 4 , Al 2 O 3 ) на одноатомные спирты при высокой температуре приводит к отщеплению молекулы воды и образованию двойной связи:
11/10/18
- Получение – в лаборатории
- Дегидрогалогенирование (отщепление галогеноводорода).
При взаимодействии галогеналкана с щёлочью в спиртовом растворе образуется двойная связь в результате отщепления молекулы галогеноводорода:
Реакция идёт по правилу Зайцева:
11/10/18
- Получение – в лаборатории
- Дегалогенирование.
При действии цинка или магния на дибромпроизводное алкана происходит отщепление атомов галогенов, находящихся при соседних атомах углерода, и образование двойной связи:
11/10/18
Химические свойства алкенов
- Реакции присоединения
- Реакции полимеризации
- Реакции окисления
11/10/18
- Химические свойства
Отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения.
- Гидрирование алкенов.
Алкены способны присоединять водород в присутствии катализаторов гидрирования — металлов — платины, палладия, никеля:
11/10/18
- Химические свойства
- Галогенирование (присоединение галогенов).
Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (CCl 4 ) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов:
- Признак реакции – обесцвечивание бромной воды.
Качественна реакция на кратную
углерод-углеродную связь С=С
11/10/18
- Химические свойства
- Гидрогалогенирование (присоединение галогеноводорода):
Эта реакция подчиняется правилу Марковникова:
?
11/10/18
- Химические свойства
- Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов.
При присоединении воды к этену образуется первичный спирт –
этиловый спирт:
При гидратации пропена или других алкенов образуются вторичные или третичные спирты:
11/10/18
- Химические свойства
- Реакция полимеризации – особый случай реакции присоединения:
Реакции полимеризации веществ, содержащих двойную связь, используют для получения различных высокомолекулярных соединений:
11/10/18
- Химические свойства
- Реакции окисления
- Алкены горят в кислороде с образованием CO 2 и H 2 O:
- Алкены легко окисляются под действием водного раствора перманганата калия до двухатомных спиртов:
Качественна реакция на кратную углерод-углеродную связь С=С
11/10/18
- Применение алкенов
- Алкены широко используются в химической промышленности как сырьё для получения разнообразных органических веществ и материалов.
- Этен — исходное вещество для производства этанола, этиленгликоля, эпоксидов, дихлорэтана.
Большое количество этена перерабатывается в полиэтилен , который используется для изготовления упаковочной плёнки, посуды, труб, электроизоляционных материалов.
- Из пропена получают глицерин, ацетон, изопропиловый спирт, растворители.
Полимеризацией пропена получают полипропилен, который по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.
В настоящее время из полимеров — аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Так, например, волокно из полипропилена — одно из самых прочных синтетических волокон.
Материалы, изготовленные из этих волокон, являются перспективными и находят всё большее применение в разных областях человеческой деятельности.
11/10/18
- Источники
Презентация на тему «Алкены»
-
Скачать презентацию (0.13 Мб)
-
276 загрузок -
5.0 оценка
Ваша оценка презентации
Оцените презентацию по шкале от 1 до 5 баллов
- 1
- 2
- 3
- 4
- 5
Комментарии
Добавить свой комментарий
Аннотация к презентации
Посмотреть и скачать презентацию по теме «Алкены» по химии, включающую в себя 25 слайдов. Скачать файл презентации 0.13 Мб. Средняя оценка: 5.0 балла из 5. Большой выбор учебных powerpoint презентаций по химии
-
Формат
pptx (powerpoint)
-
Количество слайдов
25
-
Слова
-
Конспект
Отсутствует
Содержание
-
Слайд 1
Алкены
Учитель химии
МОУ лицея № 6
Дробот Светлана Сергеевна -
Слайд 2
Содержание
Алкены
Номенклатура
Изомерия
Физические свойства
Строение алкенов
Химические свойства (реакцииприсоединения: галогенирование, гидрирование, гидрогалогенирование, гидратация; окисление, реакция полимеризации)
Получение (дегидрогенизация алканов, дегидратация спиртов, дегидрогалогенирование галогенпроизводных, дегалогенирование)
Применение
Литература -
Слайд 3
Алкены
Алкенами или олефинами, или этиленовыми углеводородами называются углеводороды, содержащие в молекуле одну двойную связь и имеющие общую формулу CnH2n.
-
Слайд 4
Номенклатура
Название алкенов по систематической номенклатуре образуют из названий аналогично построенных алканов, заменяя суффиксы –ан на –ен, цифрой указывается номер того атома углерода, от которого начинается двойная связь.
Главная цепь атомов углерода должна обязательно включать двойную связь, и ее нумерацию проводят с того конца главной цепи, к которому она ближе.
В начале названия перечисляют радикалы с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов, то цифрой указывается место каждого из них в главной цепи и перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д. -
Слайд 5
Изомерия
1) углеродного скелета
CH2 = CH – CH2 – CH3 CH2 = C – CH3
бутен-1׀
CH3
2-метилпропен-1
2) положения двойной связи
CH2 = CH – CH2 – CH3 CH3 – CH = CH – CH3
бутен-1 бутен-2
3) классов соединений (циклоалканы)
CH2 = CH – CH2 – CH3CH2 – CH2
бутен-1||
CH2 – CH2
циклобутан -
Слайд 6
4) пространственная
CH3 H H H
/ /
C = C C = C
/ /
H CH3 CH3 CH3
транс — цис —
Запомните!
Если одинаковые заместители находятся по одну сторону двойной связи, это цис–изомер, если по разные – это транс–изомер. -
Слайд 7
Физические свойства
По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4 – газы, C5–C17 – жидкости, высшие представители – твердые вещества. Температура их плавления и кипения, а также плотность увеличиваются с ростом молекулярной массы. Все олефины легче воды, плохо растворимы в ней, однако растворимы в органических растворителях.
-
Слайд 8
Строение алкенов
Углеродные атомы в молекуле этилена находятся в
состоянии sp2-гибридизации, т.е. в гибридизации
участвуют одна s- и две p -орбитали.
Схематическое изображение строения молекулы этилена
В результате каждый атом углерода обладает тремя гибридными sp2-орбиталями, оси которых находятся в одной плоскости под углом 120º друг к другу, и одной негибридной гантелеобразной p-орбиталью, ось которой расположена под прямым углом к плоскости осей трех sp2-орбиталей. Одна из трех гибридных орбиталей атома углерода перекрывается с подобной орбиталью другого атома углерода, образуя σ- связь. -
Слайд 9
Каждая оставшаяся гибридная орбиталь атомов углерода перекрывается с s- орбиталью атомов водорода, приводя к образованию в той же плоскости четырех σ- связей C–H. Две негибридные p- орбитали атомов углерода взаимно перекрываются и образуют π- связь, максимальная плотность которой расположена перпендикулярно плоскости σ- связей. Двойная связь алкенов представляет собой сочетание σ- и π- связей.Длина связи C = C – 0,134 нм, энергия связи – 620 кДж.
-
Слайд 10
Длина связиλ – расстояние между центрами ядер связанных друг с другом атомов (нм).
Энергия связиЕ – энергия, которая выделяется (поглощается) при образовании (разрыве) связи (кДж/ моль).
-
Слайд 11
σ-связь – плотность электронного облака
максимальна вдоль оси, соединяющей
ядра атомов.
π–связь – плотность электронного облака
максимальна «над» и «под» плоскостью
σ-связи.
Запомните! Простая (ординарная) связь – это всегда σ-связь. В кратных (двойных или тройных) связях – одна σ-связь, а остальные π-связи.
σ-связи всегдаобразованы гибридными орбиталями,π-связи – негибридными p – орбиталями. -
Слайд 12
π- Связь менее прочна, чем σ- связь, так как p- орбитали с параллельными осями перекрываются значительно меньше, чем при образовании теми же p- орбиталями и s- орбиталями σ- связи (перекрывание осуществляется по оси орбиталей). В связи с этим, π- связь легко разрывается и переходит в две новые σ- связи посредством присоединения по месту двойной связи двух атомов или групп атомов реагирующих веществ. Для алкенов наиболее типичными являются реакции присоединения.
-
Слайд 13
Химические свойства
Для алкенов наиболее типичными являются реакции присоединения.
1) Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к дигалогенопроизводным алканов, содержащим атомы галогена у соседних углеродных атомов.
H2C=CH2 + Br2 → BrCH2–CH2Br
Приведенная реакция — обесцвечивание алкеном бромной воды является качественной реакцией на двойную связь. -
Слайд 14
2) Гидрирование. Легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni) образуя предельные углеводороды.
CH3–CH=CH2 + H2 ––Ni→ CH3–CH2–CH3
3) Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов.
H2C=CH2 + HBr → CH3–CH2Br -
Слайд 15
Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом В.В.Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, то есть к атому углерода с наибольшим числом водородных атомов).
CH3−CH=CH2 + HCl → CH3 – CH(Cl)−CH3 -
Слайд 16
4) Гидратация. В присутствии минеральных кислот олефины присоединяют воду, образуя спирты. H+
CH3−C=CH2 + H2O→ CH3−CH(CH3)−CH3
| |
CH3 OH
Как видно, направление реакций гидратации определяется правилом Марковникова. -
Слайд 17
Окисление
Алкены легко окисляются. Взависимости от
условий проведенияреакцииобразуются
различные продукты.
1) При сжигании на воздухе олефины дают
углекислый газ и воду.
H2C=CH2 + 3O2 → 2CO2 + 2H2O
2) При жестком окислении алкенов кипящим
раствором перманганата калия в кислой среде
происходит полный разрыв двойной связи и
образование кислот или кетонов.
CH3−CH=CH−CH2−CH3 –[O]→ CH3−COOH + CH3- CH2- COOH -
Слайд 18
3) При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера). Реакция протекает на холоде.
3H2C=CH2 + 2KMnO4 + 4H2O → 2MnO2 +
2KOH + 3CH2−CH2 | | OH OH
В результате реакции наблюдается обесцвечивание
раствора перманганата калия.
Реакция Вагнера служит качественной пробой на
двойную связь. -
Слайд 19
Реакция полимеризации.
Реакцией полимеризации называется процесс образования высокомолекулярного соединения (полимера) путем соединения друг с другом молекул исходного низкомолекулярного соединения (мономера). При полимеризации двойные связи в молекулах исходного непредельного соединения «раскрываются», и за счет образующихся свободных валентностей эти молекулы соединяются друг с другом.Полимеризация олефинов вызывается нагреванием, давлением, облучением, действием свободных радикалов или катализаторов. В упрощенном виде такую реакцию на примере этилена можно представить следующим образом: n CH2 = CH2 -kat→ (- CH2 – CH2 -)n
-
Слайд 20
Получение
1) Дегидрогенизация алканов при повышенной температуре с катализатором. CH3–CH2–CH2–CH3 ––300°C,Cr2O3→CH2=CH–CH2–CH3(бутен-1) + H2
CH3–CH2–CH2–CH3 ––300°C,Cr2O3→
CH3–CH=CH–CH3(бутен-2) + H2
2) Дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная кислоты) или при пропускании паров спирта над катализатором (окись алюминия).CH3–CH2–OH(этанол) ––t°,Al2O3→
CH2=CH2 + H2O -
Слайд 21
Порядок дегидратации вторичных и третичных
спиртов определяется правилом А.М.Зайцева:
при образовании воды атом водорода
отщепляется от наименее гидрогенизированного
соседнего атома углерода, т.е. с наименьшим
количеством водородных атомов. CH3 – CH (OH)–CH(H) –CH3 ––t°,Al2O3→ CH3 –CH = CH – CH3 + H2O
3) Дегидрогалогенирование (отщепление галогеноводорода) из галогенопроизводных при действии спиртового раствора щелочи. Направление данной реакции также соответствует правилу Зайцева.CH3–CH(Br)–CH2–CH3(2-бромбутан) + NaOH(спирт p-p) →CH3–CH=CH–CH3 + NaBr + H2O -
Слайд 22
4) Реакция дегалогенирования (отщепление двух атомов галогена от соседних атомов углерода) при нагревании дигалогенидов с активными металлами также приводит к алкенам.CH2(Br)–CH(Br) –CH3(1,2-дибромпропан) + Mg →CH2=CH–CH3(пропен) + MgBr2
CH2(Br)–CH(Br) –CH3(1,2-дибромпропан) + Zn(пыль) -t°→CH2=CH–CH3(пропен) + ZnBr2 -
Слайд 23
Применение
Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры гликолей и пр.), полимеров (полиэтилен, поливинилхлорид, полиизобутилен и др.), а также многих других важнейших продуктов.
-
Слайд 24
Литература
1. Петров А.А., Бальян Х.В., Трощенко А.Т.
Органическая химия. Учебник для вузов./ Под
ред. Петрова А.А. – М.: Высшая школа, 1981.
2. Хомченко Г.П. Пособие по химии для
поступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
3. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
4. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для учащихся
10 кл. – М.: Просвещение, 1980.
5. Оганесян Э.Т. Руководство по химии поступающим в вузы. Справочное пособие. М.: Высшая школа,1991. -
Слайд 25
Если химию учить – интересней будет жить!
Удачи Вам в изучении химии!
Посмотреть все слайды
Сообщить об ошибке
Похожие презентации









Спасибо, что оценили презентацию.
Мы будем благодарны если вы поможете сделать сайт лучше и оставите отзыв или предложение по улучшению.
Добавить отзыв о сайте
Алкены
Выполнил ученик 11 «А» класса
КГУ ОШ №61 г. Алматы
Фазылов Фарух
Руководитель учитель химии
Гайдук Сергей Николаевич
Содержание
- Строение алкенов
- Изомерия и номенклатура алкенов
- Физические свойства
- Получение
- Химические свойства
- Применение алкенов
Строение алкенов
Алкены – ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода.
Общая формула алкенов – C n H 2n .
Изомерия и номенклатура алкенов
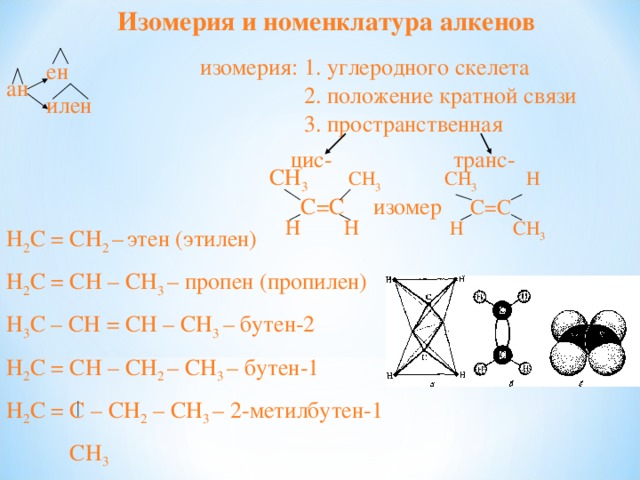
ен
ан
илен
изомерия: 1. углеродного скелета
2. положение кратной связи
3. пространственная
цис — транс —
СН 3 СН 3 СН 3 Н
С=С изомер С=С
Н Н Н СН 3
H 2 C = CH 2 – этен (этилен)
H 2 C = CH – CH 3 – пропен (пропилен)
H 3 C – CH = CH – CH 3 – бутен-2
H 2 C = CH – CH 2 – CH 3 – бутен-1
H 2 C = C – CH 2 – CH 3 – 2-метилбутен-1
CH 3
Физические свойства
Формула название
Температура кипения
C 2 H 4 — этилен
Агрегатное состояние
— 103,8
C 3 H 6 — пропилен
газы
— 47,7
C 4 H 8 — бутен
— 6,3; — 6,9
C 5 H 10 — пентен
+ 30,1; + 31,2
C 6 H 12 — гексен
+ 63,5
C 7 H 14 — гептен
жидкости
+ 93,6
C 18 H 36 — октадецен
C 19 H 38 — нонадецен
твердые
Этилен – бесцветный горючий газ со слабым запахом.
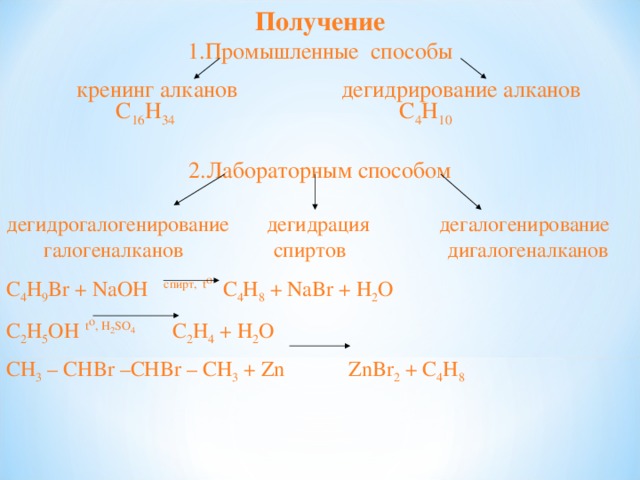
Получение
- Промышленные способы
кренинг алканов дегидрирование алканов
C 16 H 34 C 4 H 10
- Лабораторным способом
дегидрогалогенирование дегидрация дегалогенирование
галогеналканов спиртов дигалогеналканов
C 4 H 9 Br + NaOH спирт, t o C 4 H 8 + NaBr + H 2 O
C 2 H 5 OH t o , H 2 SO 4 C 2 H 4 + H 2 O
С H 3 – CHBr –CHBr – CH 3 + Zn ZnBr 2 + C 4 H 8
Химические свойства
Химические свойства алкенов определяются строением и свойствами двойной связи С=С, которая значительно активнее других связей в молекулах этих соединений. Алкены химически более активны, чем алканы.
Для алкенов наиболее характерны реакции, протекающие за счет раскрытия менее прочной p -связи. При этом p -связь (в исходном алкене) преобразуется в s -связь в продукте реакции. Исходное ненасыщенное соединение превращается в насыщенное без образования других продуктов, т.е. происходит реакция присоединения.
Реакция присоединения
Окисление алкенов
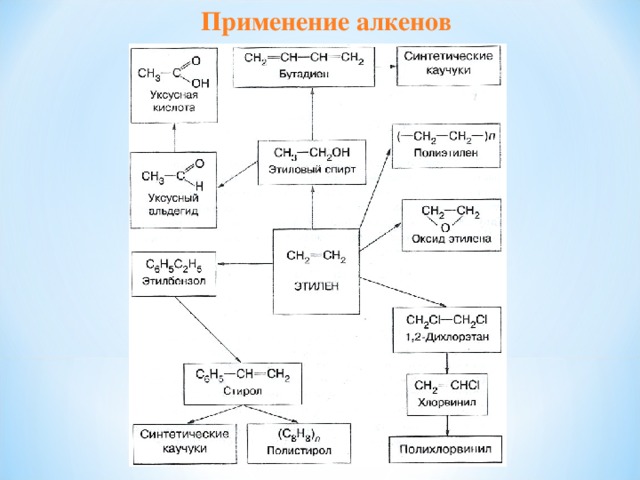
Применение алкенов
Основные источники информации:
http://ru.wikipedia.org/wiki/ Алкены
http://www.niikm.ru/articles/element_articles/ethylene/
http://www.turbopro.ru/itk/itk_02_08/2004/ceeva_ann/alkenreak.htm
http://www.chemistry.ssu.samara.ru/chem2/u44.htm
https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass—tretij-god-obucenia/urok-no13-fiziceskie-i-himiceskie-svojstva-alkenov