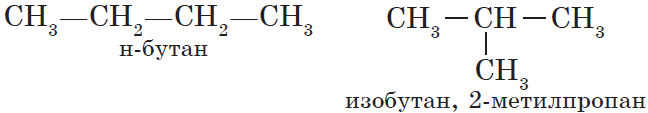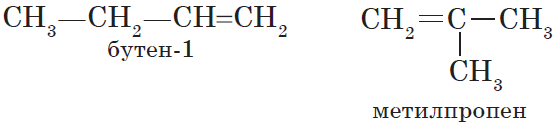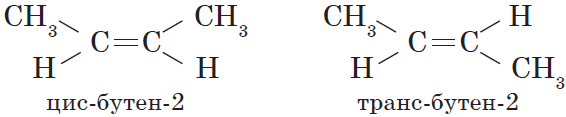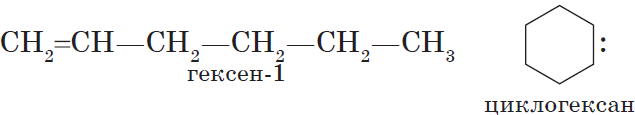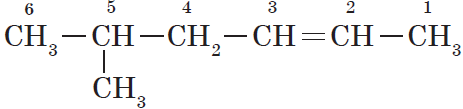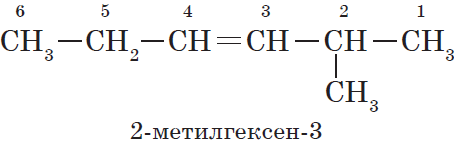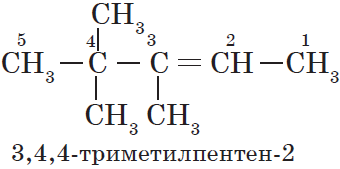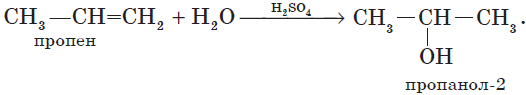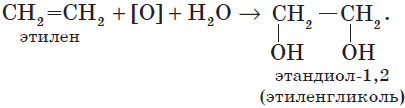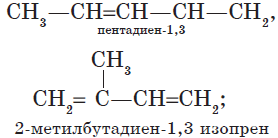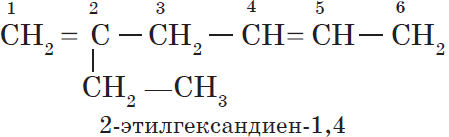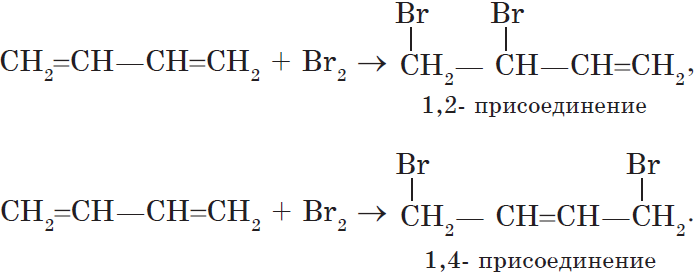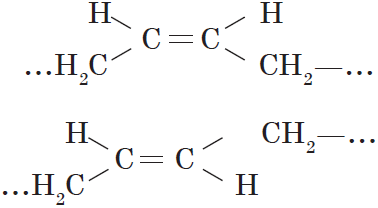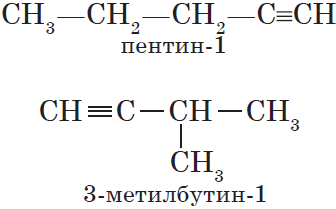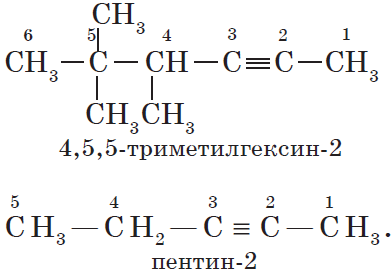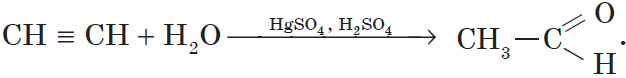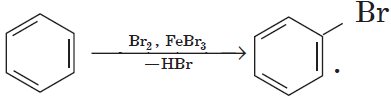Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит
одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2.
Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия алкенов
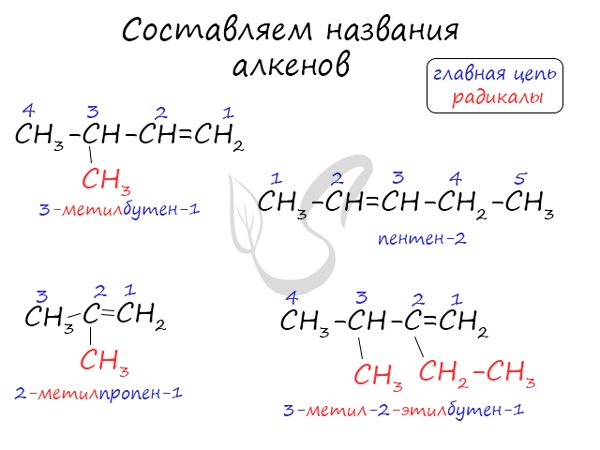
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом:
этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию
атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого
начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
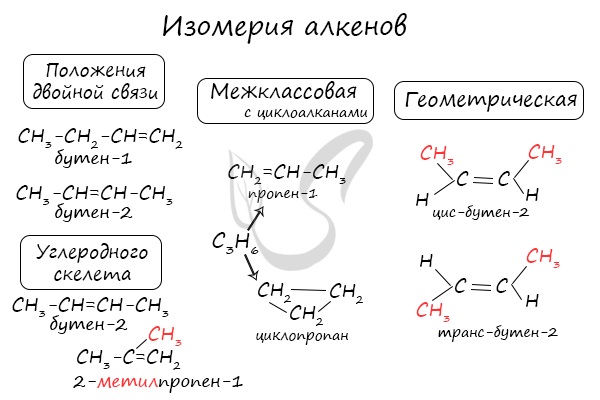
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая
изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
- Дегидрирование алканов
- Дегидрогалогенирование галогеналканов
- Дегалогенирование дигалогеналканов
- Внутримолекулярная дегидратация спиртов
В результате крекинга нефти образуется один алкан и один алкен.
C12H26 → C6H12 + C6H14
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко
водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
CH3-CH3 → (t, кат) CH2=CH2 + H2

В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород
отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные
рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими
свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

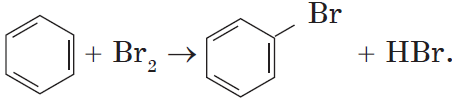
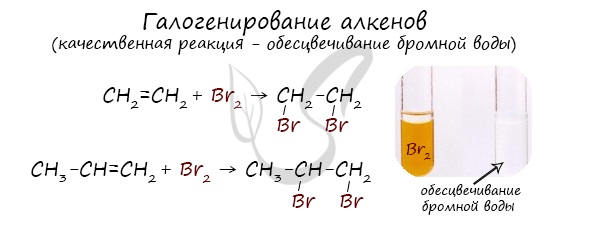
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.

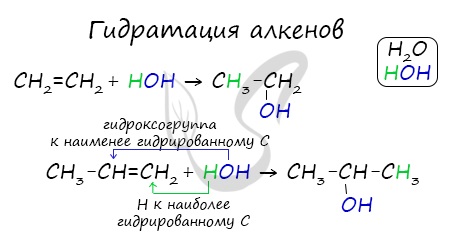
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода,
гидроксогруппа — к наименее гидрированному.
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном
окислении образуются окиси.

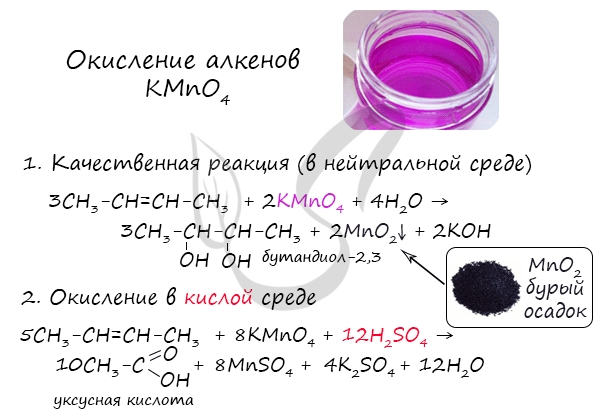
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные
углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной
связи.
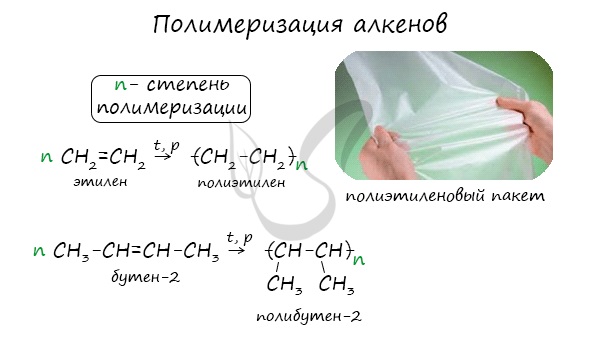
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения
молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Еπ = Е(С=С) — Е(С-С) = 620 — 348 = 272 кДж/моль
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
Например, при гидрировании бутена-2 образуется бутан.
Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление.
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан.
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
Например, при взаимодействии этилена с бромоводородом образуется бромэтан.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан.
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен.
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида)
Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2)
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия:
Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон:
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания пропилена:
2C3H6 + 9O2 → 6CO2 + 6H2O
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500оС или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен
CH2=CH-CH2-CH3 → CH3-CH=CH-CH3
Алкены: получение.
1.Крекинг нефтепродуктов СnH2n+2→СnH2n+2 + СnH2n получаются
углеводороды с более короткой углеродной цепь.
2.Дегидрирование алканов. СnH2n+2→ СnH2n + Н2
(кат Pt, Ni, Cr2O3, t 400-6000)
3. Дегидратация спиртов (H2SO4
конц, Al2O3, 140-1800)
Атом водорода отщепляется преимущественно по правилу Зайцева: от менее
гидрогенизированного атома углерода. CH3 — CH3 — CHОН – CH2 — CH3 → CH3 — CН = CH — CH3 + H2O
4.Дегидрогалогенирование (отщепление
галогеноводорода) при нагревании со спиртовым раствором щелочи. Атом водорода
отщепляется преимущественно по правилу Зайцева: от менее гидрогенизированного
атома углерода.
СН3
– СНГ – СН2 — СН3 + NаОН (спирт) → СН3 – СН =
СН — СН3 + NаГ + H2O
5.Дегалогенирование (цинк или магний
с дигалогеналканом, атомы галогенов располагаются у соседних атомов углерода)
СН3
– СНГ – СНГ — СН3 + Zn → ZnГ2 + СН3 – СН = СН
— СН3
Алкены: химические
свойства.
Реакции
присоединения.
1.Гидрирование
алкенов. СnH2n + Н2
(кат Pt, Ni, Pd; P, T) → СnH2n+2
2.Галогенирование алкенов. СnH2n + Г2→
СnH2nГ2 дигалогеналкан
(присоединение идет по двойной связи, качественная реакция на непредельный
характер – обесцвечивание бромной воды.
3.Гидрогалогенирование алкенов CH2 = CH — CH3 + НГ → CH3 — CHГ — CH3 (
присоединение происходит по правилу Марковникова – к более гидрогенизированному
атому углерода при двойной связи присоединяется водород, к менее
гидрогенизированному атому углерода – галоген ,происходит по ионному механизму)
4.Гидратация алкенов. CH2 = CH — CH3 + Н-ОН →
CH3 — CHОН — CH3 (
образуется предельный одноатомный спирт, присоединение по правилу Марковникова,
происходит по ионному механизму)
5.Полимеризация. по радикальному
механизму, образуется полимер
nCH2 = CH2 → (CH2 — CH2 )n (этилен
→ полиэтилен)
мономер
структурное звено
nCH2 = CH →
(CH2 — CH) n (пропилен
→ полипропилен)
│ │
CH3 CH3
мономер
структурное звено
nCH2 = CH →
(CH2 — CH) n (хлорэтен,
винилхлорид → поливинилхлорид)
│ │
Cl Cl
мономер
структурное звено
nCH2 = CH →
(CH2 — CH) n (винилбензол,
стирол → полистирол)
│ │
C6H5
C6H5
мономер
структурное звено
nCH2 = CH →
(-CH2 — CH-) n (винилацетат
→ поливинилацетат)
│ │
ОСОСН3 ОСОСН3
мономер
структурное звено
nC(СН3)
= CH2 → (C(СН3)
= CH2) n
(метилметакрилат →полиметилметакрилат)
│
│
СООСН3
СООСН3
Мономер структурное звено
Химические
свойства алкенов. Реакции окисления.
А)Мягкое
окисление
по Вагнеру (окисление водным раствором перманганата калия в нейтральной среде)
качественная реакция на непредельный характер – обесцвечивание перманганата
калия.
3СН 2 =
СН2 + 2КМnО4 + 4Н2О →3СН 2
— СН2 +2МnО2 +2 КОН
│ │
ОН ОН
Б)Жесткое
окисление
алкенов проводят сильными окислителями при нагревании в кислой
среде (обычно используют H2SO4),
цепь алкена разрывается по месту двойной связи, образуется два продукта,
строение которых зависит от строения исходной цепи. Возможны несколько случаев:
1. Двойная связь при вторичном
углероде, R–СН= звено окисляется до карбоксильной
группы
R–СOOH,
образуется карбоновая кислота:
5 Н3С –
СН = СН – СН2 – СН3 + 8 КМnО4 + 12Н2SO4 →
5СН3СООН
+
5НООС —
СН2 – СН3 +4К2SO4 + 8МnSO4 + 12 Н2О
2.Реакция с симметричным алкеном:
Н3С –
СН = СН – СН3 + 8 КМnО4 + 12Н2SO4 → 10СН3СООН + 4К2SO4 + 8МnSO4 + 12 Н2О
3. Двойная
связь при звене H2C=
окисляется до углекислого газа и воды. Звено = СН – СН3
окисляется до уксусной кислоты:
СН2 =
СН – СН3 + 2КМnО4 + 3Н2SO4 →СН3СООН + СО2 + К2SO4 + 2МnSO4 + 4Н2О
4. Двойная
связь при третичном углероде, R’RC=. Звено
окисляется до кетона R’–CO–R, другой
фрагмент окисляется до кислоты:
5Н3С –
С(СН3) = СН – СН3 + 6КМnО4 + 9Н2SO4 →
5СН3СООН
+5Н3С
– С(О) — СН3 + 3К2SO4 + 6МnSO4 + 9Н2О
Или 5Н3С
– С(СН3) = СН2 + 8КМnО4 + 12Н2SO4 →
5СО2
+5Н3С
– С(О) — СН3 + 4К2SO4 + 8МnSO4 + 17Н2О
В)Жесткое
окисление алкенов в нейтральной среде при нагревании.
1. Двойная связь
при вторичном углероде, R–СН=.
Звено окисляется до группы R–СOOK,
образуется соль карбоновой кислоты:
3Н3С –
СН = СН – СН2 – СН3 + 8 КМnО4 →
3СН3СООК
+
3КООС —
СН2 – СН3 +2КОН + 8МnO2 + 2Н2О
2. Двойная
связь при звене H2C=.
Звено окисляется до карбоната калия:
3СН2 =
СН – СН3 + 10КМnО4 → 3СН3СООК + 3К2СО3 + 10МnO2 + 4Н2О
+ КОН
3. Двойная
связь при третичном углероде, R’RC=.
Звено окисляется до кетона R’—CO–R:
Н3С –
С(СН3) = СН – СН3 + 2КМnО4 →
СН3СООК +Н3С
– С(О) — СН3 +2МnO2 + КОН
Г)Каталитическое
окисление алкенов (катализатор хлорид палладия)
2СН2 =
СН2 + О2 → 2СН3СООН
Алкены. Что нужно знать для решения заданий ЕГЭ по Химии.
Алкены — это непредельные ациклические углеводороды, которые имеют одну двойную(‘ = ‘) связь(пи-связь).
Алкены также имеют название олефины, которое берет начало с латинского названия «gaz olefiant«- «маслородный газ», которое впервые дано этилену из-за его способности образовывать при взаимодействии с хлором жидкое маслянистое вещество(хлористый этилен).
Изомерия:
— структурная(изомерия углеродного скелета);
— межклассовая(метамерия, алкены имеют такую же формулу классу, как и циклоалканы);
— изомерия положения кратной связи;
— пространственная(цис-, транс-изомерия).
Что такое цис и транс изомерия?
Пи-связь(‘ = ‘) не имеет цилиндрической симметрии, и поворот
относительно двойной связи приведет к разрыву кратной связи, поэтому
свободное вращение вокруг двойной связи невозможно, и положение в
пространстве заместителей при углеродных атомах, соединенных двойной
связью четко фиксировано. Следствием этого является наличие у алкенов
геометрической цис-транс изомерии.
Если
заместители расположены по одну сторону от двойной связи(например,
углеводородные радикалы, или галогены), то такое положение называется
цис-изомерия(от лат. cis — «с одной стороны»), если по разные стороны — транс-изомерия(от лат. trans — «через»).
Важно: Транс изомеры термодинамически более стабильны, чем цис-изомеры.
Часто встречающиеся радикалы:
— винил(CH2═CHꟷ)
— аллил(CH2═CHꟷCH2ꟷ)
Характерный тип реакции: электрофильное присоединение(AdE)
В какие реакции вступают: присоединение, замещение, полимеризация, окисление, дегидрирование, гидрирование, гидратация, горение.
Именные реакции и правила:
- Правило Марковникова(только для НЕСИММЕТРИЧНЫХ алкенов): Атом
водорода присоединяется к наиболее гидрогенизированному атому углерода, а
атом галогена(или группа -OH) — к наименее гидрогенизированному.
CH3ꟷCH═CH2 + HBr → CH3ꟷCH(Br)ꟷCH3
- Правило Хараша(перекисный эффект): радикальное присоединение к двойной связи, в присутствии H2O2 реакция идет против правила Марковникова, то есть водород присоединяется к наименее гидрогенизированному атому углерода.
CH3ꟷCH═CH2 + HBr → CH3ꟷCH2ꟷCH2ꟷBr (условия реакции: перекись водорода)
- Правило Зайцева: при отщеплении воды и галогеноводородов наиболее
легко отщепляется водород от соседнего наименее гидрогенизированного
атома углерода.
CH3ꟷCH(OH)ꟷCH2ꟷCH3 → CH3ꟷCH═CHꟷCH3 + H2O (условия реакции: t > 140, H2SO4(конц.))
- Реакция Вагнера(мягкое окисление):
3CH2═CH2 + 2KMnO4 + 4H2O → 3CH2OHꟷCH2OH + 2MnO2 + 2KOH
- Реакция Гарриеса(озонолиз):
CH3ꟷCH═CH2 + O3 → озонид → CH3COH + HCOH (условия реакции: цинковая пыль, вода)
- Реакция Львова(радикальное замещение(SR)):
CH2 ═CHꟷCH2ꟷCH3 + Cl2 → CH2 ═CHꟷCH(Cl)ꟷCH3 + HCl (условия реакции: облучение, 450 С)
- Реакция Циглера(получение полиэтилена низкого давления(ПЭНД)):
nCH2═CH2 → …ꟷCH2ꟷCH2ꟷCH2ꟷCH2ꟷ…(условия реакции: 0,2 МПа, 100 С, kat — металлорганические соединения)
Какие классы органических веществ можно получить из алкенов:
— алканы(гидрирование);
— алкины(дегидрирование);
— одноатомные спирты(гидратация);
— двухатомные спирты(мягкое окисление перманганатом и водой);
— уксусный альдегид(каталитическое окисление этилена под действием хлорида палладия и t);
— карбоновые кислоты(жесткое окисление алкенов в присутствии серной кислоты и t)
Как обнаружить алкены в растворе:
- Бромная вода(Br2). При добавлении Br2 к алкену происходит обесцвечивание раствора: был красный — стал бесцветный(за счет разрыва кратной связи и присоединения брома).
- Окислители(перманганат калия, дихромат калия). При добавлении какого либо сильного окислителя, например, KMnO4, происходит разрыв двойной связи и раствор меняет окраску: был розовый — стал бесцветный.
Специфические реакции
Алкены
могут образовывать эпоксиды, вступать в реакцию с серной кислотой(с
щелочами алкены НЕ реагируют, так как сами проявляют основные свойства).
- Образование эпоксидов: 2CH2═CH2 + O2 → 2C2H4O (условия реакции: t 150-300 C, Ag)
Важно: Оксид этилена(эпоксид) легко присоединяет воду, образуя двухатомный спирт этиленгликоль.
- Получение уксусного альдегида: 2CH2═CH2 + O2 → 2CH3COH (условия реакции: t, PdCl2)
- Реакция с серной кислотой: CH2═CH2 + HꟷSO4H → CH3ꟷCH2ꟷSO4H (образуется этилсерная кислота)
- Реакция Виттига(процесс синтеза олефинов):
[(C6H5)3PCH3]Br(бромистый метилтрифенилфосфоний) + C4H9Li → (C6H5)3P═CH2(метилентрифенилфосфоран) + C4H10 + LiBr
(C6H5)3P═CH2 + O═CHꟷC4H9 → (C6H5)3P═O(окись трифенилфосфина) + CH2═CHꟷC4H9
Реакции из заданий ЕГЭ 2021:
1) Из предложенного перечня выберите два ряда веществ, каждое из которых не обесцвечивает бромную воду.
1) этан, этилен, ацетилен;
2) хлорэтан, пропан, бензол;
3) стирол, этилен, ацетилен;
4) толуол, 1,3-бутадиен, ацетилен;
5) бензол, циклогексан, 2-метилбутан.
Решение: В данном вопросе №13 из ЕГЭ нужно выбрать те варианты
ответа, в которых должны быть предельные углеводороды, в молекулах
которых нет кратных связей, это 25.
2) Установите соответствие между спиртом и исходным веществом, использованным для его получения:
СПИРТ
А) глицерин;
Б) изопропиловый спирт;
В) пропиловый спирт;
Г) этиленгликоль.
ИСХОДНОЕ ВЕЩЕСТВО
1) CH3ꟷCH═CH2
2) CH2═CH2
3) C2H5COH
4) C6H12O6
5) CO
6) CH3COH
Решение:
глицерин, как и изопропиловый спирт получают из пропилена(реакцией
Вагнера и гидратацией соответственно), пропиловый спирт можно получить
из пропаналя(восстановление(+ H2)), и этиленгликоль образуется из этилена мягким окислением в водной среде, ответ 1132.
3)
Установите соответствие между названием вещества и продуктом, который
преимущественно образуется при взаимодействии этого вещества с
подкисленной серной кислотой раствором перманганата калия.
НАЗВАНИЕ ВЕЩЕСТВА
А) бутен-2;
Б) пропен;
В) бутин-1;
Г) изопропилбензол.
ПРОДУКТ РЕАКЦИИ
1) 1,2-пропиленгликоль
2) пропановая кислота
3) бензойная кислота
4) бутановая кислота
5) уксусная кислота
6) бутанон
Решение:
реакция вещества с серной кислотой и раствором перманганат калия
является жестким окислением, которое приводит к разрыву кратной связи;
бутен-2 и пропен образуют уксусную кислоту, окисление бутина-1 образует
пропановую кислоту, изопропилбензол — бензойную кислоту, ответ 5523.
4) Установите соответствие между формулой спирта и продуктом, который преимущественно образуется при дегидратации этого спирта.
ФОРМУЛА СПИРТА
А) CH3ꟷCH(OH)ꟷC2H5
Б) C2H5ꟷCH(OH)ꟷCH(CH3)2
В) C2H5ꟷC(CH3)(OH)ꟷC2H5
Г) (CH3)2CHꟷCH2ꟷCH(OH) ꟷCH3
ПРОДУКТ РЕАКЦИИ
1) бутен-1
2) бутен-2
3) 2-метилпентен-2
4) 4-метилпентен-2
5) 3-метилпентен-2
6) 4-метилпентен-1
Решение:
это задание не является сложным, главное нужно расписать эти соединения
и все станет ясно; первое вещество — это бутанол-2, при его
дегидратации образуется бутен-2; второе вещество — 4-метилпентанол-3,
при отщеплении образует 4-метилпентен-2; третье — 3-метилпентанол-3, при
отщеплении воды дает 3-метилпентен-2; последнее соединение —
4-метилпентанол-2, дегидратация которого приводит к появлению
4-метилпентена-2, ответ 2454.
5) Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентена-1.
1) циклопентан;
2) пентадиен-1,3;
3) 2-метилбутан;
4) 2-метилбутен-2;
5) 3-метилбутин-1.
Решение:
пентен-1 это представитель класса алкенов, которые, как ты помнишь,
являются межклассовыми изомерами циклоалканов; исходя из этого факта
можно с легкостью понять, какие ответы здесь верны — это циклопентан и
2-метилбутен-2, имеющий одинаковую количественную формулу с пентеном-1,
ответ 14.
6) Задана следующая схема превращений веществ:
C2H4 → X → + H2 → Y → CH3COOH
Определите, какие из указанных веществ являются веществами X и Y.
1) этаналь;
2) этан;
3) этанол;
4) ацетон;
5) бромэтан.
Решение:
первое вещество схемы — это этилен, из него в одну стадию можно
получить этаналь(смотри реакцию образования уксусного альдегида выше), который, при восстановлении образует соответствующий этиловый спирт, или этанол, ответ 13.
7)
Установите соответствие между названием вещества и продуктом, который
преимущественно образуется при взаимодействии этого вещества с
хлороводородом.
НАЗВАНИЕ ВЕЩЕСТВА
А) бутан;
Б) бутен-1;
В) бутен-2;
Г) циклобутан.
ПРОДУКТ РЕАКЦИИ
1) 3-хлорбутан;
2) 2-хлорбутан;
3) не взаимодействуют;
4) 1-хлорбутан;
5) хлорциклобутан;
6) 1,2-дихлорбутан.
Решение:
бутан не содержит кратных связей, поэтому не вступает в реакцию с
хлороводородом; бутен-1 и бутен-2 образуют 2-хлобутан; циклобутан в
реакции с HCl разрывает цикл и образует соединение 1-хлорбутан, ответ
3224.
Заключение:
Алкены вступают в реакции присоединения, при этом происходит разрыв кратной связи.
Алкены имеют общую формулу класса CnH2n, имеют межклассовый изомер — циклоалканы, гибридизация — sp2.
Олефины
вступают в реакцию с водой, образуя спирты. Главные химические
свойства: гидрирование, гидратация, полимеризация, окисление.
Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов, ароматических углеводородов
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_{n}Н_{2n+2}$.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
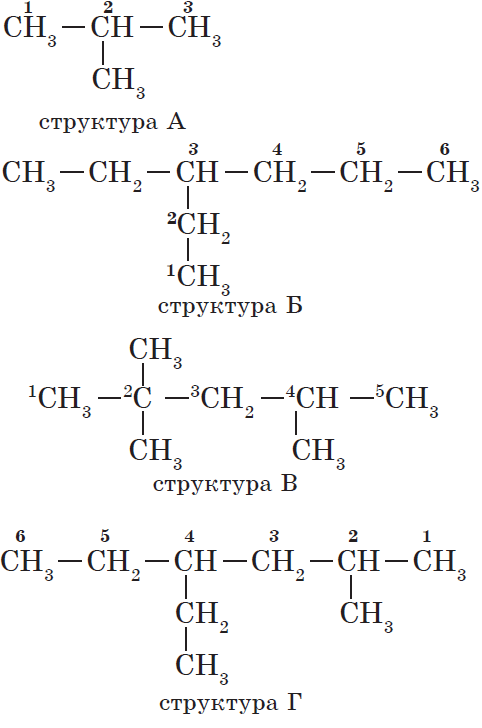
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2.2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_{12}$ до $С_{15}Н_{32}$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
$CH_4+Cl_2→CH_3Cl+HCl$.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
$CH_3Cl+Cl_2→HCl+{CH_2Cl_2}↙{text»дихлорметан(хлористый метилен)»}$,
$CH_2Cl_2+Cl_2→HCl+{CHСl_3}↙{text»трихлорметан(хлороформ)»}$,
$CHCl_3+Cl_2→HCl+{CCl_4}↙{text»тетрахлорметан(четыреххлористый углерод)»}$.
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400–600°С$) происходит отщепление молекулы водорода и образование алкена:
$CH_3—CН_3→СH_2=CH_2+Н_2↑$
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
$СН_4+2О_2→СО_2+2Н_2O+880 кДж.$
В общем виде реакцию горения алканов можно записать следующим образом:
$C_{n}H_{2n+2}+({3n+1}/{2})O_2→nCO_2+(n+1)H_2O$
Термическое расщепление углеводородов:
$C_{n}H_{2n+2}{→}↖{400-500°C}C_{n-k}H_{2(n-k)+2}+C_{k}H_{2k}$
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
$CH_4{→}↖{1000°C}C+2H_2↑$
При нагревании до температуры $1500°С$ возможно образование ацетилена:
$2CH_4{→}↖{1500°C}CH=CH+3H_2↑$
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n}$.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
$С_2Н_4$ — этен, $С_3Н_6$ — пропен, $С_4Н_8$ — бутен, $С_5Н_{10}$ — пентен, $С_6Н_{12}$ — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
$СН_3—{СН_2}↙{бутен-1}—СН=СН_2$ $СН_3—{СН=СН}↙{бутен-2}—СН_3$
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости $π$-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:
$5$-метилгексен-$2$, а не $2$-метилгексен-$4$, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Например:
Физические и химические свойства алкенов
Физические свойства. Первые три представителя гомологического ряда алкенов — газы; вещества состава $С_5Н_{10}$ – $С_{16}Н_{32}$ — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
$CH_3—CH_2—CH=CH_2+H_2{→}↖{Pt}CH_3—CH_2—CH_2—CH_3$.
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалоген алканов:
$СН_2=СН_2+Br_2→CH_2Br—CH_2Br$.
3. Гидрогалогенирование (присоединение галогеноводорода).
$CH_3-{CH}↙{пропен}=CH_2+HBr→CH_3-{CHBr}↙{2-бромпропен}-CH_3$
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
${CH_2}↙{этен}=CH_2+H_2O{→}↖{t,H_3PO_4}CH_3-{CH_2OH}↙{этанол}$
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
$nCH_2{=}↙{этен}CH_2{→}↖{УФ-свет,R}(…{-CH_2-CH_2-}↙{полиэтилен}…)_n$
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием $СО_2$ и $Н_2О$:
$СН_2=СН_2+3О_2→2СО_2↑+2Н_2О$.
В общем виде:
$C_{n}H_{2n}+{3n}/{2}O_2→nCO_2↑+nH_2O$
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Алкадиены (диеновые углеводороды)
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
В зависимости от взаимного расположения двойных связей различают три вида диенов:
— алкадиены с кумулированным расположением двойных связей:
$CH_2=C=CH_2$;
— алкадиены с сопряженными двойными связями;
$CH_2=CH—CH=CH_2$;
— алкадиены с изолированными двойными связями
$CH_2=CH—CH_2—CH=CH_2$.
Эти все три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии $sp$-гибридизации. Он образует две $σ$-связи, лежащие на одной прямой и направленные в противоположные стороны, и две $π$-связи, лежащие в перпендикулярных плоскостях. $π$-Связи образуются за счет негибридизированных р-орбиталей каждого атома углерода. Свойства алкадиенов с изолированными двойными связями весьма специфичны, т.к. сопряженные $π$-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные $π$-связи, составляют практически единую систему (ее называют $π$-системой), т.к. р-орбитали соседних $π$-связей частично перекрываются.
Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
Структурная изомерия.
— изомерия углеродного скелета:
— изомерия положения кратных связей:
${CH_2=CH—CH=CH_2}↙{бутадиен-1,3}$ ${CH_2=C=CH—CH_3}↙{бутадиен-1,2}$
Цис-, транс-изомерия (пространственная и геометрическая)
Например:
Алкадиены изомерны соединениям классов алкинов и циклоалкенов.
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Например:
Физические и химические свойства алкадиенов
Физические свойства.
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.
Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
$nCH_2={CH—CH=CH_2}↙{бутадиен-1,3}→{(… —CH_2—CH=CH—CH_2— …)_n}↙{text»синтетический бутадиеновый каучук»}$.
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию.
Алкины
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
$С_2Н_2$ — этин, $С_3Н_4$ — пропин, $С_4Н_6$ — бутин, $С_5Н_8$ — пентин, $С_6Н_{10}$ — гексин и т. д.
Изомерия и номенклатура
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
$СН_3—{СН_2}↙{бутин-1}—С≡СН$ $СН_3—{С≡С}↙{бутин-2}—СН_3$
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу $С_6Н_{10}$ имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические и химические свойства алкинов
Физические свойства. Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
$CH≡CH+Br_2→{CHBr=CHBr}↙{1,2-дибромэтан},$
$CHBr=CHBr+Br_2→{CHBr_2-CHBr_2}↙{1,1,2,2-тетрабромэтан}$
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
$CH_3-C≡CH+Br→{CH_3-CBr=CH_2}↙{2-бромпропен},$
$CH_3-CBr=CH_2+HBr→{CH_3-CHBr_2-CH_3}↙{2,2-дибромпропан}$
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов ($Pt, Pd, Ni$):
$R-C≡C-R+H_2{→}↖{Pt}R-CH=CH-R,$
$R-CH=CH-R+H_2{→}↖{Pt}R-CH_2-CH_2-R$
Так как тройная связь содержит две реакционноспособные $π$-связи, алканы присоединяют водород ступенчато:
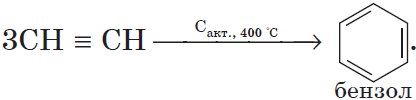
1) тримеризация.
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
2) димеризация.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
$2HC≡CH→{HC≡C-CH=CH_2}↙{text»бутен-1-ин-3(винилацетилен)»}$
Это вещество используется для получения хлоропрена:
$HC≡C-CH=CH_2+HCl{→}↖{CaCl}H_2C={CCl-CH}↙{хлоропрен}=CH_2$
полимеризацией которого получают хлоропреновый каучук:
$nH_2C=CCl-CH=CH_2→(…-H_2C-CCl=CH-CH_2-…)_n$
Окисление алкинов.
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
$2C_2H_2+5O_2→4CO_2↑+2H_2O+2600кДж$ На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более $3000°С$), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Ионный (правило В. В. Марковникова) и радикальный механизмы реакции в органической химии
Типы химических реакций в органической химии
Реакции органических веществ можно формально разделить на четыре основных типа: замещения, присоединения, отщепления (элиминирования) и перегруппировки (изомеризации). Очевидно, что все многообразие реакций органических соединений невозможно свести к предложенной классификации (например, реакции горения). Однако такая классификация поможет установить аналогии с уже знакомыми вам из курса неорганической химии реакциями, протекающими между неорганическими веществами.
Как правило, основное органическое соединение, участвующее в реакции, называют субстратом, а другой компонент реакции условно рассматривают как реагент.
Реакции замещения
Реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов, называются реакциями замещения.
В реакции замещения вступают предельные и ароматические соединения, такие как алканы, циклоалканы или арены.
Приведем примеры таких реакций.
Под действием света атомы водорода в молекуле метана способны замещаться на атомы галогена, например, на атомы хлора:
$CH_4+Cl_2→CH_3Cl+HCl$
Другим примером замещения водорода на галоген является превращение бензола в бромбензол:
Уравнение этой реакции может быть записано иначе:
При этой форме записи реагенты, катализатор, условия проведения реакции записывают над стрелкой, а неорганические продукты реакции — под ней.
Реакции присоединения
Реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну, называют реакциями присоединения.
В реакции присоединения вступают ненасыщенные соединения, такие как алкены или алкины.
В зависимости от того, какая молекула выступает в качестве реагента, различают гидрирование (или восстановление), галогенирование, гидрогалогенирование, гидратацию и другие реакции присоединения. Каждая из них требует определенных условий.
1. Гидрирование — реакция присоединения молекулы водорода по кратной связи:
$CH_3{-CH=}↙{text»пропен»}CH_2+H_2{→}↖{Pt}CH_3{-CH_2-}↙{text»пропан»}-CH_3$
2. Гидрогалогенирование — реакция присоединения галогеноводорода (гидрохлорирование):
${CH_2=}↙{text»этен»}CH_2+HCl→CH_3{-CH_2-}↙{text»хлорэтан»}-Cl$
3. Галогенирование — реакция присоединения галогена:
${CH_2=}↙{text»этен»}CH_2+Cl_2→{CH_2Cl-CH_2Cl}↙{text»1.2-дихлорэтан»}$
4. Полимеризация — особый тип реакций присоединения, в ходе которых молекулы вещества с небольшой молекулярной массой соединяются друг с другом с образованием молекул вещества с очень высокой молекулярной массой — макромолекул.
Реакции полимеризации — это процессы соединения множества молекул низкомолекулярного вещества (мономера) в крупные молекулы (макромолекулы) полимера.
Примером реакции полимеризации может служить получение полиэтилена из этилена (этена) под действием ультрафиолетового излучения и радикального инициатора полимеризации $R:$
${nCH_2=}↙{text»этен»}CH_2{→}↖{text»УФ-свет,R»}{(…-CH_2-CH_2-…)_n}↙{text»полиэтилен»}$
Наиболее характерная для органических соединений ковалентная связь образуется при перекрывании атомных орбиталей и образовании общих электронных пар. В результате этого образуется общая для двух атомов орбиталь, на которой находится общая электронная пара. При разрыве связи судьба этих общих электронов может быть разной.
Типы реакционноспособных частиц в органической химии
Орбиталь с неспаренным электроном, принадлежащая одному атому, может перекрываться с орбиталью другого атома, на которой также находится неспаренный электрон. При этом происходит образование ковалентной связи по обменному механизму:
$H•+•H→H:H,$ или $H-H$
Обменный механизм образования ковалентной связи реализуется в том случае, если общая электронная пара образуется из неспаренных электронов, принадлежащих разным атомам.
Процессом, противоположным образованию ковалентной связи по обменному механизму, является разрыв связи, при котором к каждому атому отходит по одному электрону. В результате этого образуются две незаряженные частицы, имеющие неспаренные электроны:
$R:R=R•+R•$
Такие частицы называются свободными радикалами.
Свободные радикалы — атомы или группы атомов, имеющие неспаренные электроны.
Реакции, которые протекают под действием и при участии свободных радикалов, называются свободнорадикальными реакциями.
В курсе неорганической химии это реакции взаимодействия водорода с кислородом, галогенами, реакции горения. Обратите внимание, что реакции этого типа отличаются высокой скоростью, выделением большого количества тепла.
Ковалентная связь может образоваться и по донорно-акцепторному механизму. Одна из орбиталей атома (или аниона), на которой находится неподеленная электронная пара, перекрывается незаполненной орбиталью другого атома (или катиона), имеющего незаполненную орбиталь, при этом формируется ковалентная связь, например:
$H^{+}+{:O-H^{-}}↙{text»акцептор»}→{H-O-H}↙{text»донор»}$
Разрыв ковалентной связи приводит к образованию положительно и отрицательно заряженных частиц; так как в данном случае оба электрона из общей электронной пары остаются при одном из атомов, у второго атома получается незаполненная орбиталь:
$R:|R=R:^{-}+R^{+}$
Рассмотрим электролитическую диссоциацию кислот:
$H:|Cl=H^{+}+Cl^{-}$
Можно легко догадаться, что частица, имеющая неподеленную электронную пару $R:^{-}$, т. е. отрицательно заряженный ион, будет притягиваться к положительно заряженным атомам или к атомам, на которых существует по крайней мере частичный или эффективный положительный заряд. Частицы с неподеленными электронными парами называют нуклеофильными агентами (nucleus — ядро, положительно заряженная часть атома), т. е. «друзьями» ядра, положительного заряда.
Нуклеофилы ($Nu$) — анионы или молекулы, имеющие неподеленную пару электронов, взаимодействующие с участками молекул, на которых сосредоточен эффективный положительный заряд.
Примеры нуклеофилов: $Cl^{-}$ (хлорид-ион), $ОН^{-}$ (гидроксид-анион), $СН_3О^{-}$ (метоксид-анион), $СН_3СОО^{-}$ (ацетат-анион).
Частицы, имеющие незаполненную орбиталь, напротив, будут стремиться заполнить ее и, следовательно, будут притягиваться к участкам молекул, на которых присутствует повышенная электронная плотность, отрицательный заряд, неподеленная электронная пара. Они являются электрофилами, «друзьями» электрона, отрицательного заряда или частиц с повышенной электронной плотностью.
Электрофилы — катионы или молекулы, имеющие незаполненную эле к трон ную орбиталь, стремящиеся к заполнению ее электронами, так как это приводит к более выгодной электронной конфигурации атома.
Примеры электрофилов: $NO_2$ (нитрогруппа), —$СООН$ (карбоксил), —$СN$ (нитрильная группа), —$СОН$ (альдегидная группа).
Не любая частица с незаполненной орбиталью является электрофилом. Так, например, катионы щелочных металлов имеют конфигурацию инертных газов и не стремятся к приобретению электронов, так как имеют низкое сродство к электрону. Из этого можно сделать вывод, что, несмотря на наличие у них незаполненной орбитали, подобные частицы не будут являться электрофилами.
Основные механизмы протекания реакций
Мы выделили три основных типа реагирующих частиц — свободные радикалы, электрофилы, нуклеофилы — и три соответствующих им типа механизма реакций:
— свободнорадикальные;
— электрофильные;
— нуклеофильные.
Кроме классификации реакций по типу реагирующих частиц, в органической химии различают четыре вида реакций по принципу изменения состава молекул: присоединения, замещения, отщепления, или элиминирования (от лат. eliminaue — удалять, отщеплять) и перегруппировки. Так как присоединение и замещение могут происходить под действием всех трех типов реакционноспособных частиц, можно выделить несколько основных механизмов протекания реакций.
1. Свободнорадикальное замещение:
${CH_4}↙{text»метан»}+Br_2{→}↖{text»УФ-свет»}{CH_3Br}↙{text»бромметан»}+HBr$
2. Свободнорадикальное присоединение:
$nCH_2=CH_2{→}↖{text»УФ-свет,R»}(…-CH_2-CH_2-…)_n$
3. Электрофильное замещение:
4. Электрофильное присоединение:
$CH_3-{CH=}↙{text»пропен»}CH_2+HBr{→}↖{text»раствор»}{CH_3-CHBr-CH_3}↙{text»2-бромпропан»}$
$СH_3{-C≡}↙{text»пропин»}CH+Cl_2{→}↖{text»раствор»}{CH_3-CCl=CHCl}↙{text»1,2-дихлорпропен»}$
5. Нуклеофильное присоединение:
Кроме того, мы рассмотрим реакции отщепления, или элиминирования, которые идут под воздействием нуклеофильных частиц — оснований.
6. Элиминирование:
$СH_3-CHBr-CH_3+NaOH{→}↖{text»спиртовой раствор»}CH_3-CH=CH_2+NaBr+H_2O$
Можно считать, что в этой реакции происходит отщепление молекулы бромводорода от молекулы 2-бромпропана. В присутствии щелочи образуются бромид натрия и вода.
Правило В. В. Марковникова
Отличительной чертой алкенов (непредельных углеводородов) является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
Гидрогалогенирование (присоединение галогеноводо рода):
$СH_3{-CH-}↙{text»пропен»}CH_2+HBr→CH_3{-CHBr-CH_3}↙{text»2-бромпропан»}$
Эта реакция подчиняется правилу В. В. Марковникова: при присоединении галогенводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются
алкены, алкины, алкадиены (полиены)
. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (
циклоалкены
), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Строение алкенов
Алкены
— ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СнН2н. Свое второе название —
олефины
— алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел.
Атомы углерода, между которыми есть двойная связь, находятся в состоянии ср
2
-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей
соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.

Строение этилена

Образование двойной связи в алкенах
Гомологический ряд этена
Неразветвленные алкены составляют гомологи- ческий ряд этена (
этилена
): С
2
Н
4
— этен, С
3
Н
6
— пропен, С
4
Н
8
— бутен, С
5
Н
10
— пентен, С
6
Н
12
— гексен, С
7
Н
14
— гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или
цис- и транс-
изомерии
.
Цис-изомеры
отличаются от
транс-изомеров
пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Номенклатура алкенов
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Например,правильное название соединения:
5-метилгексен-2
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
3. Формирование названия.
В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс
-ен
, обозначающий принадлежность соединения к классу алкенов. Например:
Физические свойства алкенов
Первые три представителя гомологического ряда алкенов — газы; вещества состава С5Н10 — С16Н32 — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства алкенов
Реакции присоединения
. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму
электрофильного присоединения
.
1. Гидрирование алкенов.
Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов)
. Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.
3.
Гидрогалогенирование (присоединение галогеноводорода)
.
Эта реакция подчиняется
правилу Марковникова
:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются
вторичные спирты
.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация.
Особым случаем присоединения является реакция полимеризации алкенов:
Эта реакция присоединения протекает по свободнорадикальному механизму.
Реакции окисления.
1. Горение.
Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
2. Окисление в растворах.
В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь: