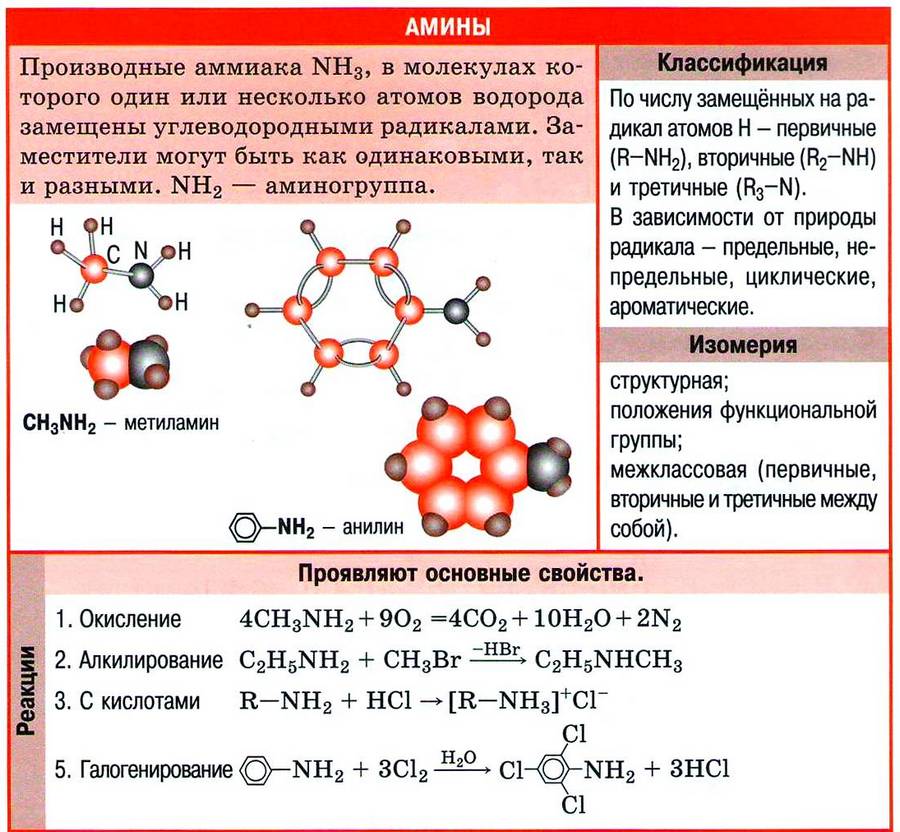
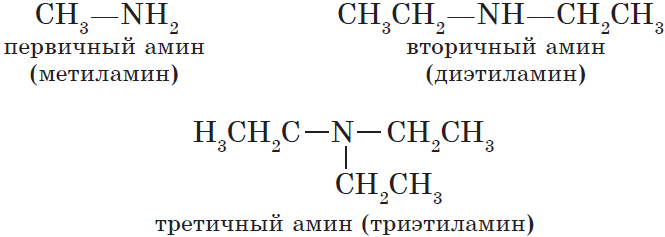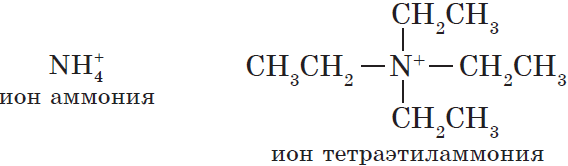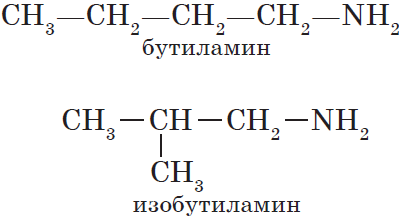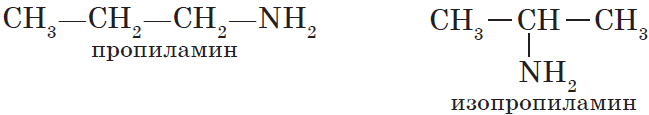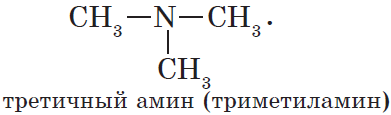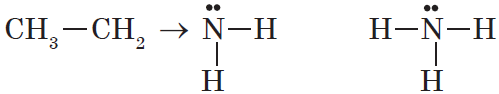Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
R-NH2, R1-NH-R2, R1-N(R2)-R3
Строение аминов
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
Классификация аминов
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин
CH3-NH2 |
Диметиламин
CH3-NH-CH3 |
Триметиламин
(CH3)3N |
| Ароматические | Фениламин
C6H5-NH2 |
Дифениламин
(C6H5)2NH |
Трифениламин
(C6H5)3N |
| Смешанные | Метилфениламин
CH3-NH-C6H5 |
Диметилфениламин
(CH3)2N-C6H5 |
Номенклатура аминов
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин
СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Изомерия аминов
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Например. Формуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета.
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Например.Формуле С4Н11N соответствуют амины положения аминогруппы.
| 1-Аминобутан (н-бутиламин) |
2-Аминобутан (втор-бутиламин) |
 |
Изомерия между типами аминов
Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины.
| Пропиламин
(первичный амин) |
Метилэтиламин (вторичный амин) | Триметиламин
(третичный амин) |
 |
 |
 |
Физические свойства аминов
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Химические свойства аминов
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
|
Аммиак :NH3 |
Первичный амин R–:NH2 |
 |
 |
Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства аминов
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми.
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
Основные свойства аминов возрастают в ряду:
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II):
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
Это качественная реакция на первичные амины – выделение азота.
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
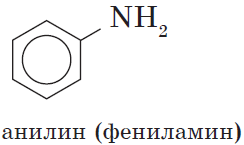
Анилин С6H5-NH2 – это ароматический амин.
Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется.
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Видеоопыт изучения среды раствора анилина можно посмотреть здесь.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).
Видеоопыт бромирования анилина можно посмотреть здесь.
Получение аминов
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
- Восстановление сульфидом аммония:
- Алюминий в щелочной среде.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
Видеоопыт взаимодействия хлорида диметиламмония с щелочью с образованием диметиламина можно посмотреть здесь.
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная
группой аминов является аминогруппа — NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом,
у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин,
пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина
и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.

Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.

При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая
температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Амины
Ключевые слова конспекта: Аминогруппа. Амины предельные и ароматические. Метиламин. Анилин. Реакция Зинина.
Понятие об аминах
Окружающая нас природа удивительно многоцветна. Никто никогда не сосчитает точное число всех оттенков, передающих многообразие природной гаммы цвета.
Окраска природных объектов обусловлена присутствием веществ, способных выборочно поглощать или отражать электромагнитные волны определённой длины.
Природа научилась синтезировать окрашенные вещества гораздо успешнее, чем это делает человек. С незапамятных времён люди применяли природные красители. Например, синий краситель индиго извлекали из сока индигоносных растений. Этот краситель, только получаемый промышленным способом, до сих пор используют для окраски джинсовой ткани.
Красящие вещества содержатся и в организмах насекомых. В Мексике за 1000 лет до нашей эры открыли красный краситель кармин. Его извлекали из насекомых кошенили, обитавших на кактусах. Краситель содержится только в особях женского пола, их собирали вручную, и для приготовления 1 г красителя требовалось собрать 150 000 тлей!
Вплоть до середины XIX в. краски для тканей стоили невероятно дорого и были доступны лишь обеспеченным людям. Вполне понятно желание химиков разгадать тайну цвета и научиться синтезировать качественные и доступные красители.
Студент английского Королевского химического колледжа Уильям Перкин проводил опыты по синтезу лекарства от малярии. В качестве исходного вещества он использовал вещество, выделенное из каменноугольной смолы, — анилин. Из смеси продуктов реакции 18-летний студент выделил соединение с яркой пурпурной окраской. Пурпурный цвет в то время был в моде, и новое соединение прочно удерживалось на тканях. Так в 1856 г. был запатентован первый синтетический краситель мовеин (от франц. mauve — мальва).
Совместно с братом и отцом Перкин построил фабрику по производству мовеина. Успех был ошеломительным! Королевские особы носили одежду, окрашенную новым красителем. В течение последующих нескольких лет на основе анилина химики синтезировали десятки красителей красного, розового, зелёного и синего цветов.
Какое отношение рассказ о синтетических красителях имеет к материалу конспекта? Самое непосредственное — поскольку анилин относят к классу органических соединений, называемых аминами.
Органические вещества, в молекулах которых углеводородный радикал связан с аминогруппой —NH2, называют аминами.
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Классификация аминов
Общая формула аминов R—NH2, где R — углеводородный радикал. В зависимости от природы радикала различают предельные амины (R — остаток предельного углеводорода, т. е. алкил) и ароматические амины (R — остаток ароматического углеводорода).
Гомологический ряд предельных аминов начинает простейший представитель класса — метиламин. Структурные формулы метиламина и его ближайших гомологов приведены ниже:
Общая формула членов данного гомологического ряда CnH2n+1NH2, или CnH2n+3N.
Представителем ароматических аминов является уже упомянутый нами анилин. В молекуле этого вещества аминогруппа —NH2 связана с остатком ароматического углеводорода бензола — фенильным радикалом С6Н5—. Следовательно, химическая формула анилина С6Н5—NH2:
Физические свойства и получение важнейших аминов
Метиламин — бесцветное газообразное вещество с резким аммиачным запахом, хорошо растворимое в воде. Анилин представляет собой бесцветную жидкость, которая на воздухе приобретает красно-бурую окраску вследствие окисления; он также обладает резким запахом и плохо растворим в воде.
Промышленное производство метиламина основано на взаимодействии метилового спирта с аммиаком:
Вторым удобным способом получения аминов заданного строения служит реакция галогеналканов с избытком аммиака:
Производство анилина в промышленных масштабах связано с именем выдающегося русского учёного-химика Николая Николаевича Зинина. В 1841 г., проводя опыты с нитробензолом, он нашёл способ восстановления нитрогруппы до аминогруппы:
Эту реакцию назвали в честь учёного — реакция Зинина. Современник Н. Н. Зинина немецкий химик Август Гофман по достоинству оценил вклад русского коллеги в развитие органической химии: «Если бы Зинин не сделал ничего более, кроме превращения нитробензола в анилин, то и тогда его имя осталось бы записанным золотыми буквами в истории химии».
Химические свойства аминов
Химические свойства аминов определяются в первую очередь наличием в их молекулах аминогруппы.
Амины рассматривают как продукты замещения в молекуле аммиака атомов водорода аминогруппами. Логично предположить, что химические свойства, характерные для аммиака, будут характерны и для его органических производных. Так оно и есть.
Аммиак характеризуется основными свойствами за счёт неподелённой электронной пары атома азота. Его водный раствор имеет щелочную реакцию, аммиак легко реагирует с кислотами с образованием солей аммония:
NH3 + НСl = NH4Cl
Амины представляют собой органические основания. Водный раствор метиламина, подобно аммиаку, изменяет окраску индикаторов, указывающих на щелочной характер среды. В растворе образуется слабый электролит — гидроксид метиламмония:
Электролитическая диссоциация этого основания приводит к появлению в растворе гидроксид-ионов:
Как и аммиак, амины легко образуют соли с сильными неорганическими кислотами:
Третье положение теории строения органических соединений о взаимном влиянии атомов в молекулах подтверждается сравнением свойств рассматриваемых аминов и аммиака.
Основные свойства аминов, по сравнению с аммиаком, отражают влияние углеводородного радикала на поведение аминогруппы. Усиление основных свойств наблюдается в ряду
Аминогруппа оказывает ответное влияние на свойства углеводородного радикала. Действительно, анилин, в отличие от бензола, легко вступает в реакцию бромирования при добавлении бромной воды, при этом никакого катализатора не требуется, а бромирование протекает не по одному, а по трём атомам углерода цикла:
Продукт реакции — 2,4,6-триброманилин — это нерастворимое в воде вещество белого цвета, поэтому реакцию с бромной водой можно использовать для обнаружения анилина, т. е. как качественную реакцию на анилин.
Области применения аминов
Предельные амины широко используют в органическом синтезе для производства лекарственных веществ, синтетических волокон, пластмасс, стимуляторов роста растений. Встречаются предельные амины и в природе. Они являются результатом разложения природных азотсодержащих органических веществ и часто имеют неприятный запах, напоминающий запах протухшей рыбы.
Основное количество получаемого в промышленности анилина используют для производства полимерных материалов (полиуретана), лекарств, взрывчатых веществ, гербицидов, красителей.
Аминогруппа входит в состав не только аминов, но и более сложных органических соединений. О них пойдёт речь в следующем конспекте.
Справочная таблица «Амины»
Конспект урока по химии «Амины». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
АМИНЫ
Амины – органические производные аммиака NH3, в
молекуле которого один, два или три атома водорода замещены на углеводородные
радикалы:
R-NH2,
R2NH, R3N
Простейший представитель – метиламин:
Строение
Атом азота находится в
состоянии sp3-гибридизации,
поэтому молекула имеет форму тетраэдра.
Также
атом азота имеет два неспаренных электрона, что обуславливает свойства аминов
как органических оснований.
КЛАССИФИКАЦИЯ АМИНОВ.
По количеству и типу
радикалов, связанных с атомом азота:
|
АМИНЫ |
Первичные амины |
Вторичные амины |
Третичные амины |
|
Алифатические |
CH3— |
(CH3)2NH |
(CH3)3N |
|
Ароматические |
|
(C6H5)2NH |
|
НОМЕНКЛАТУРА АМИНОВ.
1. В большинстве случаев названия аминов
образуют из названий углеводородных радикалов и суффикса амин.
Различные радикалы перечисляются в алфавитном порядке. При наличии одинаковых радикалов
используют приставки ди и три.
CH3-NH2 Метиламин СH3CH2-NH2
Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
2. Первичные амины часто называют как
производные углеводородов, в молекулах которых один или несколько атомов
водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа
указывается в названии приставкой амино-:
CH3-CH2-CH2-NH2 1-аминопропан
H2N-CH2-CH2-CH(NH2)-CH3 1,3-диаминобутан

смешанных аминов, содержащих алкильные и ароматические радикалы, за основу
названия обычно берется название первого представителя ароматических аминов анилин.
Символ N-
ставится перед названием алкильного радикала, чтобы показать, что этот радикал
связан с атомом азота, а не является заместителем в бензольном кольце.
ИЗОМЕРИЯ АМИНОВ
1) углеродного скелета, начиная с С4H9NH2:
СН3-СН2— СН2-СН2
–NH2 н-бутиламин (1-аминобутан)
CH3—CH— СН2—NH2 изо-бутиламин (1-амин-2-метилпропан)
│
СН3
2) положения аминогруппы, начиная с С3H7NH2:
СН3-СН2— СН2-СН2
–NH2 1-аминобутан (н-бутиламин)
CH3—CH— СН2-СH3 2-аминобутан (втор-бутиламин)
│
NН2
3) изомерия
между типами аминов – первичный, вторичный, третичный:
ФИЗИЧЕСКИЕ СВОЙСТВА
АМИНОВ.
Первичные и вторичные амины образуют слабые
межмолекулярные водородные связи:

Это объясняет относительно более высокую
температуру кипения аминов по сравнению с алканами с близкой молекулярной
массой. Например:
|
Пропиламин (М=59) t кип = 49оС |
Бутан (М=58) t кип = -0,5оС |
Третичные амины не
образуют ассоциирующих водородных связей (отсутствует
группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и
вторичных аминов:
|
Триэтиламин t кип = 89 °С |
н-Гексиламин tкип = 133 °С |
По сравнению со спиртами алифатические амины
имеют более низкие температуры кипения, т.к. в спиртах водородная связь
более прочная:
|
Метиламин t кип = -6 °С |
Метанол t кип = +64,5 °С |
При
обычной температуре только низшие алифатические амины CH3NH2,
(CH3)2NH и (CH3)3N – газы (с
запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие
– твердые вещества без запаха.
Ароматические амины – бесцветные
высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо
растворимы в воде.
С увеличением числа и размеров
углеводородных радикалов растворимость аминов в воде уменьшается, т.к.
увеличиваются пространственные препятствия образованию водородных связей.
Ароматические амины в воде практически не растворяются.
Анилин: С6H5-NH2 – важнейший из ароматических аминов:
Он находит широкое применение в
качестве полупродукта в производстве красителей, взрывчатых веществ и
лекарственных средств (сульфаниламидные препараты).
Анилин — бесцветная маслянистая
жидкость с характерным запахом. На воздухе окисляется и приобретает
красно-бурую окраску. Ядовит.
ПОЛУЧЕНИЕ АМИНОВ.
|
1. Первичные а) Гидрирование водородом: R—NO2 + H2 —tà R—NH2 + H2O б) Восстановление: в щелочной и нейтральной R-NO2 + 3(NH4)2S R-NO2 + 2Al + 2KOH + 4H2O à R- NH2 + 2K[Al(OH)4] Восстановлением нитробензола получают в) в кислой среде (железо, олово или цинк в Амины из раствора выделяют с помощью щелочи: [RNH3+]Cl— +КОН = H2O + КCl + R— NH2 |
|
2. Алкилирование СH3Br + NH3 à [CH3NH3]Br -(+KOH)à CH3—NH2 + C2H5Br à [CH3NH2+]Br— —(+KOH)à CH3 — NH + KBr + H2O вторичный амин Возможно дальнейшее алкилирование до третичного |
|
3.Восстановление нитрилов с R–C Этим способом в промышленности получают гексаметилендиамин, |
|
4. Взаимодействие аммиака со |
ХИМИЧЕСКИЕ
СВОЙСТВА АМИНОВ.
Амины имеют сходное с аммиаком
строение и проявляют подобные ему свойства.
Как в аммиаке, так и в аминах атом азота имеет
неподеленную пару электронов:
Поэтому амины и аммиак обладают свойствами оснований.
|
1. Основные свойства. Будучи производными аммиака, все амины Алифатические амины являются более Это СН3 Это приводит к усилению основных свойств. Фенильный В водном растворе амины обратимо |
|
2. Амины реагируют с кислотами, образуя Cоли аминов — твердые вещества без запаха, хорошо растворимые в воде, но не При действии щелочей на соли аминов [CH3NH3]Cl Соли аминов вступают в обменные реакции [CH3NH3]Cl |
|
3. Амины |
|
4. Горение. 4 С2Н5NH2 + 15O2 à 8CO2 + 2N2 + 14 H2O |
|
5. Реакции с а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты: R—NH2 + NaNO2 + HCl à R—OH +N2 + NaCl + H2O б) Вторичные амины (алифатические и ароматические) |
Особенности
свойств анилина:
Для анилина
характерны реакции как по аминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены взаимным
влиянием атомов.
— бензольное кольцо ослабляет
основные свойства аминогруппы по сравнению алифатическими аминами и
даже с аммиаком.
— бензольное кольцо становится более
активным в реакциях замещения, чем бензол.
Аминогруппа — заместитель 1-го рода
(активирующий орто-пара-ориентант в реакциях электрофильного замещения
в ароматическом ядре).
Качественная
реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина
(белый осадок ↓).
Амины — органические производные аммиака, в молекуле которого один, два или все три атома водорода замещены углеродным остатком.
Соответственно, обычно выделяют три типа аминов:
Можно также считать, что первичные амины являются производными углеводородов, в молекулах которых атом водорода замещен на функциональную группу $NH^{2—}$, аминогруппу.
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или анилин:
Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары. Это приводит к тому, что амины проявляют свойства оснований.
Существуют ионы, которые являются продуктом формального замещения на углеводородный радикал всех атомов водорода в ионе аммония:
Эти ионы входят в состав солей, похожих на соли аммония. Они называются четвертичными аммонийными солями.
Изомерия и номенклатура
Для аминов характерна структурная изомерия:
— изомерия углеродного скелета:
— изомерия положения функциональной группы:
Первичные, вторичные и третичные амины изомерны друг другу (межклассовая изомерия):
${CH_3-CH_2-CH_2-NH_2}↙{text»первичный амин (пропиламин)»}$
${CH_3-CH_2-NH-CH_3}↙{text»вторичный амин (метилэтиламин)»}$
Как видно из приведенных примеров, для того, чтобы назвать амин, перечисляют заместители, связанные с атомом азота (по порядку старшинства), и добавляют суффикс -амин.
Физические и химические свойства аминов
Физические свойства.
Простейшие амины (метил амин, диметиламин, триметиламин) — газообразные вещества. Остальные низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но не способными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре $184°С$.
Химические свойства.
Химические свойства аминов определяются в основном наличием у атома азота неподеленной электронной пары.
1. Амины как основания. Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т.е. выступать в роли основания:
$NH_3+H^{+}→{NH_4^{+}}↙{text»ион аммония»}$
$CH_3CH_2—NH_2+H^{+}→CH_3—{CH_2—NH_3^{+}}↙{text»ион этиламмония»}$
Известно, что реакция аммиака с водой приводит к образованию гидроксид-ионов:
$NH_3+H_2O⇄NH_3·H_2O⇄NH_4^{+}+OH^{-}$.
Раствор амина в воде имеет щелочную реакцию:
$CH_3CH_2-NH_2+H_2O⇄CH_3-CH_2-NH_3^{+}+OH^{-}$.
Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами:
$2NH_3+H_2SO_4→{(NH_4)_2SO_4}↙{text»сульфат аммония»}$,
$CH_3—CH_2—NH_2+H_2SO_4→{(CH_3—CH_2—NH_3)_2SO_4}↙{text»сульфат этиламмония»}$.
Основные свойства алифатических аминов выражены сильнее, чем у аммиака. Повышение электронной плотности превращает азот в более сильного донора пары электронов, что повышает его основные свойства:
2. Амины горят на воздухе с образованием углекислого газа, воды и азота:
$4CH_3NH_2+9O_2→4CO_2↑+10H_2O+2N_2↑$
АМИНЫ
Амины – органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы:
R-NH2, R2NH, R3N
Простейший представитель – метиламин:
Строение
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота имеет два неспаренных электрона, что обуславливает свойства аминов как органических оснований.
КЛАССИФИКАЦИЯ АМИНОВ.
По количеству и типу радикалов, связанных с атомом азота:
|
АМИНЫ |
Первичные амины |
Вторичные амины |
Третичные амины |
|
Алифатические |
CH3— NH2 |
(CH3)2NH |
(CH3)3N |
|
Ароматические |
|
(C6H5)2NH |
|
НОМЕНКЛАТУРА АМИНОВ.
1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке. При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин (CH3)2NH Диметиламин
2. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
CH3-CH2-CH2-NH2 1-аминопропан H2N-CH2-CH2-CH(NH2)-CH3 1,3-диаминобутан
Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов анилин.
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
ИЗОМЕРИЯ АМИНОВ
1) углеродного скелета, начиная с С4H9NH2:
СН3-СН2— СН2-СН2 –NH2 н-бутиламин (1-аминобутан)
CH3-CH- СН2-NH2 изо-бутиламин (1-амин-2-метилпропан)
│
СН3
2) положения аминогруппы, начиная с С3H7NH2:
СН3-СН2— СН2-СН2 –NH2 1-аминобутан (н-бутиламин)
CH3-CH- СН2-СH3 2-аминобутан (втор-бутиламин)
│
NН2
3) изомерия между типами аминов – первичный, вторичный, третичный:
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой. Например:
|
Пропиламин (М=59) t кип = 49оС |
Бутан (М=58) t кип = -0,5оС |
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов:
|
Триэтиламин t кип = 89 °С |
н-Гексиламин tкип = 133 °С |
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения, т.к. в спиртах водородная связь более прочная:
|
Метиламин t кип = -6 °С |
Метанол t кип = +64,5 °С |
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Анилин: С6H5-NH2 – важнейший из ароматических аминов:
Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Анилин — бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит.
ПОЛУЧЕНИЕ АМИНОВ.
|
1. Первичные амины можно получить восстановлением нитросоединений. а) Гидрирование водородом: R-NO2 + H2 -t🡪 R-NH2 + H2O б) Восстановление: в щелочной и нейтральной среде получаются амины: R-NO2 + 3(NH4)2S 🡪 R- NH2 + 3S + 6NH3 +2H2O (реакция Зинина) R-NO2 + 2Al + 2KOH + 4H2O 🡪 R- NH2 + 2K[Al(OH)4] Восстановлением нитробензола получают анилин. в) в кислой среде (железо, олово или цинк в соляной кислоте) получаются соли аминов: R-NO2 + 3Fe + 7HCl 🡪 [RNH3+]Cl— + 2H2O + 3FeCl2 Амины из раствора выделяют с помощью щелочи: [RNH3+]Cl— +КОН = H2O + КCl + R- NH2 |
|
2. Алкилирование аммиака и аминов. При взаимодействии аммиака с алкилгалогенидами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин. Этот амин способен взаимодействовать с новой порцией галогеналкана с образованием вторичного амина: СH3Br + NH3 🡪 [CH3NH3]Br -(+KOH)🡪 CH3-NH2+ KBr + H2O первичный амин CH3-NH2 + C2H5Br 🡪 [CH3NH2+]Br— —(+KOH)🡪 CH3 — NH + KBr + H2O вторичный амин │ │ C2H5 C2H5 Возможно дальнейшее алкилирование до третичного амина. |
|
3.Восстановление нитрилов с образованием первичных аминов: R–C Этим способом в промышленности получают гексаметилендиамин, который используется в производстве полиамидного волокна найлон. |
|
4. Взаимодействие аммиака со спиртами: R-OH + NH3 -(t,p)🡪 R –NH2 + H2O |
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства.
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
Поэтому амины и аммиак обладают свойствами оснований.
|
1. Основные свойства. Будучи производными аммиака, все амины обладают основными свойствами. Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. Это объясняется тем, что радикалы СН3-, С2Н5— и др. проявляют положительный индуктивный (+I) эффект и увеличивают электронную плотность на атоме азота: СН3 → NH2 Это приводит к усилению основных свойств. Фенильный радикал C6H5— проявляет отрицательный мезомерный (-М) эффект и уменьшает электронную плотность на атоме азота: В водном растворе амины обратимо реагируют с водой, при этом среда становится слабощелочная: R-NH2 +H2O ⇄[R-NH3]++ OH— |
|
2. Амины реагируют с кислотами, образуя соли: CH3-NH2 + H2SO4 🡪 [CH3NH3]HSO4 C6H5NH2 + HCl 🡪 [C6H5NH3]Cl Cоли аминов — твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов). При действии щелочей на соли аминов выделяются свободные амины: [CH3NH3]Cl + NaOH -t🡪 CH3NH2 + NaCl + H2O Соли аминов вступают в обменные реакции в растворе: [CH3NH3]Cl + AgNO3 -t🡪 [CH3NH3]NO3+ AgCl ↓ |
|
3. Амины способны осаждать гидроксиды тяжелых металлов из водных растворов: 2R-NH2 + FeCl2 + 2H2O 🡪 Fe(OH)2↓+ 2[RNH3]Cl |
|
4. Горение. Амины сгорают в кислороде, образуя азот, углекислый газ и воду: 4 С2Н5NH2 + 15O2 🡪 8CO2 + 2N2 + 14 H2O |
|
5. Реакции с азотистой кислотой. а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты: R-NH2 + NaNO2 + HCl 🡪 R-OH +N2 + NaCl + H2O б) Вторичные амины (алифатические и ароматические) дают нитрозосоединения — вещества с характерным запахом: R2NH + NaNO2 + HCl 🡪 R2N-N=O + NaCl + H2O |
Особенности свойств анилина:
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены взаимным влиянием атомов.
— бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
— бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Аминогруппа — заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях электрофильного замещения в ароматическом ядре).
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).
План урока:
Строение аминов
Классификация аминов
Номенклатура аминов
Изомерия аминов
Способы получения аминов
Физические свойства аминов
Химические свойства аминов
Особенности анилина
Особенности аминокислот
Применение аминов
Вредное воздействие аминов
Серотонин улучшает аппетит, повышает настроение и контролирует эмоции человека. Адреналин стимулирует центральную нервную систему. Все эти соединения – амины. Без них невозможно представить жизнь человека.
Амины – углеводородные производные аммиака, в которых вместо водородных атомов располагаются радикалы. Функциональная группа аминов: аминогруппа (-NH2).
Строение аминов
Аммиак и амины схожи по многим параметрам. Для азота в этих соединениях свойственна sp3-гибридизация.
Строение аминов определяет свойства. Для представителей этого класса соединений свойственна основность. Это связано с расположением неподеленной электронной пары на азоте.
Классификация аминов
Группировка по количеству радикалов
Основные свойства соотносятся с количеством электронной плотности на азоте. Чем плотность выше, тем основность выше. Но у третичных аминов обилие радикалов создает пространственные затруднения, поэтому их основные свойства ослаблены.
Группировка по строению органического радикала
Номенклатура аминов
Согласно международной номенклатуре название представителей этого класса соединений формируется из радикала и суффикса«-амин». Если в соединении несколько радикалов, то они располагаются в названии согласно алфавиту.
Амины также можно назвать как производные аммиака. Для этого к радикалу прибавляется приставка «амино-».
Например, молекула CH3-CH2-СН2-CH2-CH2-CH2-NH2называется 1-аминогексан (гексамин).
Изомерия аминов
Для аминов свойственно несколько видов изомерии.
Способы получения аминов
Существует несколько методов получения аминов.
Реакции нитросоединений
С помощью восстановления нитросоединений синтезируются амины.
- Гидрирование (взаимодействие с молекулами водорода) при нагревании
СН3-СН2-СН2-СН2-NO2 + 3H2 →СН3-СН2-СН2-СН2-NH2 + 2 H2O
- Реакция с сульфидом аммония
СН3-СН2-NO2 +3 (NH4)2S → СН3-СН2-NH2 + 3 S + 6 NH3 + 2 H2O
- Взаимодействие с алюминием в щелочи
СН3-СН2-NO2 +2 Al + 2 KOH + 4 H2O → СН3-СН2-NH2 +2 K[Al(OH)4]
- Реакции с металлами (железом, оловом, цинком) и кислотой
СН3-СН2-NO2 + 3 Fe + 7 HCl → [СН3-СН2-NH3]Cl + 2 H2O + 3 FeCl3
В результате образуется соль. При ее взаимодействии с щелочью образуется амин.
[СН3-СН2-NH3]Cl + KOH → СН3-СН2-NH2 + H2O + KCl
Алкилирование (взаимодействие с галогеналканами) аммиака
При недостатке аммиака образуется соль. При ее взаимодействии с щелочью получается амин.
СН3-СН2-СН2-СН2-Br + NH3 → [СН3-СН2-СН2-СН2-NH3]Br
[СН3-СН2-СН2-NH3]Br + KOH → СН3-СН2-СН2 -NH2 + H2O + KBr
При избытке аммиака амин образуется сразу.
R-Br + 2 NH3 → R-NH2 + NH4Br
Гидрирование нитрилов
Данная реакция протекает при наличии никеля.
Физические свойства аминов
Первые представители всех типов аминов существуют в виде газов с аммиачным ароматом, средние представители гомологического ряда– жидкостей с запахом рыбы, а высшие существуют в твердом агрегатном состоянии. Ароматические амины – это прозрачные жидкости с большими температурами кипения или твердые соединения.
Первичным и вторичным аминам свойственны высокие температуры плавления и кипения. Это связано с тем, что амины формируют свободные связи между молекулами.
Растворимость аминов обусловлена тем, что они создают связи с молекулами воды. Чем выше молекулярная масса соединения, тем ниже растворимость. Молекулы ароматических аминов не растворяются в воде.
Химические свойства аминов
Основные свойства
Из-за неподеленной электронной пары на азоте амины выражают основные свойства. Основность возрастает в следующем ряду:
Ароматические амины>аммиак>алифатические амины
По мере увеличения электронной плотности на азоте основность увеличивается.
- Гидратация (взаимодействие с водой)
- Взаимодействие с кислотами
Амины взаимодействуют с органическими, минеральными кислотами, аминокислотами. В результате образуются соли.
СН3-СН2-СН2—СН2-NH2 + HCl → [СН3-СН2-СН2-СН2-NH3]+Cl—
- Взаимодействие с солями
2СН3-СН2-СН2-СН2-NH2 + FeCl2 + 2 H2O → 2 [СН3-СН2-СН2-СН2-NH3]+Cl— + Fe(OH)3
Окисление
Амины при взаимодействии с кислородом (горении) образуют свободный азот.
4 CH3-CH2-NH2 + 15 O2→ 8 CO2 + 2 N2 + 14 H2O
Реакция с азотистой кислотой
Из первичных спиртов синтезируются спирты.
R-NH2 + NaNO2 + HCl → R-OH + N2 + NaCl + H2O
Из вторичных спиртов синтезируются нитрозосоединения (вещества желтого цвета).
Алкилирование аминов
В результате реакции первичных аминов и галогеналканов синтезируются соли вторичных аминов, а из вторичных – соли третичных аминов.
Анилин
Анилин – прозрачная жидкость с особенным запахом. При взаимодействии с кислородом (окислении) анилин становится красно-бурым. Анилин токсичен и не растворим в воде.
Реакции могут идти как по боковой цепи, так и по ароматическому кольцу.
Основные свойства анилина
У ароматических аминов самые низкие основные свойства. Они также не реагируют с водой, но взаимодействуют с кислотами.
Для анилина характерны реакции замещения. В эти реакции он вступает легче, чем бензол. Реакция идет без катализаторов. Бром замещается в орто- и параположениях. В результате образуется белый осадок.
Аминокислоты
Аминокислоты – элементарная структура белков, из которых состоят все тела животных. Аминокислоты включают две функциональные группы – аминогруппу (-NH2) и карбоксильную группу (-СООН). Эти две группы не соединены между собой непосредственно.
Общая формула аминокислот
Для аминокислот характерна оптическая изомерия. Белки включают только α-аминокислоты. На нашей планете существует только 20 аминокислот, из которых строится все живое.
Аминокислоты – амфотерные соединения, которые могут реагировать как по карбоксильной группе, так и по аминогруппе.
Аминокислоты. Источник
Применение аминов
Амины в свободном виде в природе встречаются редко. Они образуются при гниении органических остатков. В этом процессе синтезируются такие соединения как путресцин и кадаверин.
Путресцин и кадаверин
Для средних представителей гомологического ряда аминов характерен рыбный запах. Запах селедочного рассола определяется триметиламином.
Амины используются также в промышленности. Например, как:
- отвердитель эпоксидной смолы,
- ускоритель реакции в металлургической промышленности,
- исходное вещество для производства полиамидных волокон,
- вещество для синтеза анилина,
- сырье для получения фенолформальдегидных смол,
- вещество для получения пестицидов, инсекцидов, фунгицидов,
- добавка к машинным топливам и маслам и др.
Метиламин – первичный амин. Он применяется в производстве лекарственных препаратов, красителей, пестицидов.
Метиламин
Диэтиламин – вторичный амин. С его помощью получают пестициды, красители, лекарственные препараты, добавки к машинным маслам и т.д. Также он служит сырьем для изготовления веществ от коррозии металлов. Он может отвердевать эпоксидные смолы и играть роль катализатора при вулканизации.
Диэтиламин
Триэтиламин – третичный алифатический амин. Он применяется при получении резин, эпоксидных смол и пенополиуретанов. Из него также производят лекарственные препараты, минеральные удобрения, краски и т.д.
Триэтиламин
Анилин – ароматический амин. Он широко применяется в качестве сырья для получения красителей, лекарственных препаратов, взрывчаток и т.д.
Анилин
Амины образуются в растениях и животных в результате биохимического распада аминокислот под действием ферментов. Они обладают высокой биологической активности.
Амины животного происхождения – серотонин, адреналин, мелатонин, тирамин и др. Амины растительного происхождения – кофеин, кокаин, никотин, хинин и др.
Вредное воздействие аминов
Практически все амины ядовиты. Ароматический амин анилин проникает через кожу, окисляет гемоглобин, угнетает работу центральной нервной системы. Его действие может привести к гибели.
Отравление можно выявить по следующим признакам:
- трудности при дыхании,
- посинение носа, губ, кончиков пальцев,
- сильное сердцебиение,
- обмороки.
Первая помощь:
- смыть анилин спиртом,
- дать возможность дышать чистым воздухом,
- вызвать медицинских специалистов.
Алифатические амины оказывают негативное влияние на нервную систему, нарушают работу печени, развивают дистрофию. Некоторые ароматические амины — канцерогены, способные вызвать рак мочевого пузыря. Опасны даже пары аминов.