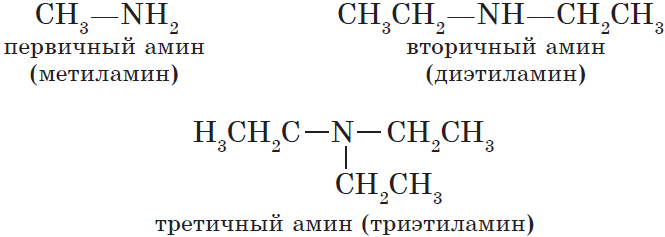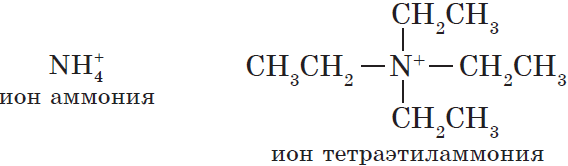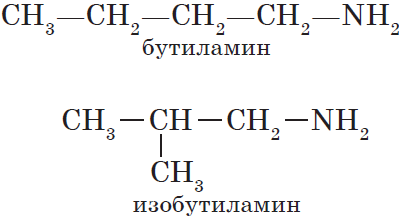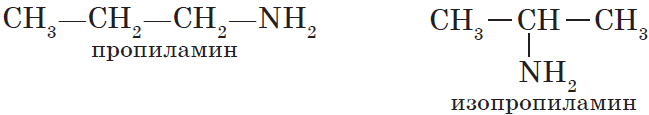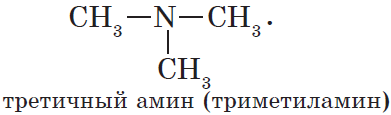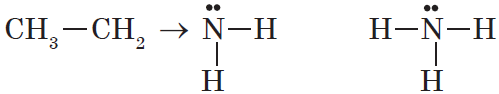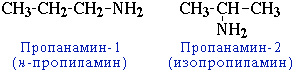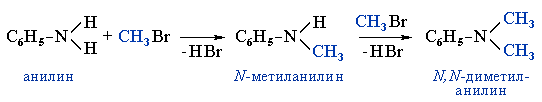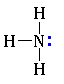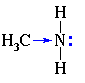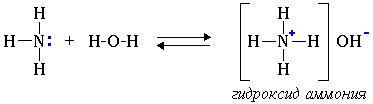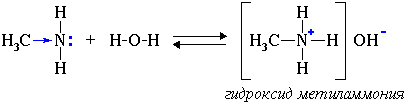Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная
группой аминов является аминогруппа — NH2.

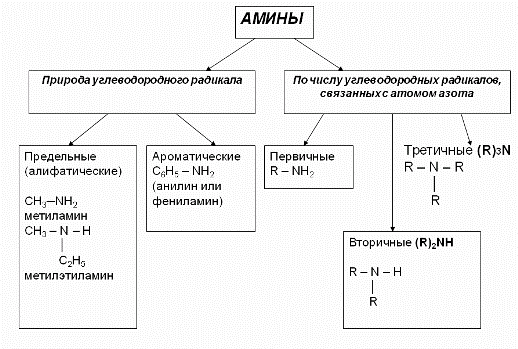
Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом,
у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин,
пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

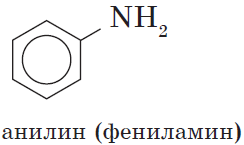
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина
и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.

Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.

При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая
температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
R-NH2, R1-NH-R2, R1-N(R2)-R3
Строение аминов
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
Классификация аминов
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин
CH3-NH2 |
Диметиламин
CH3-NH-CH3 |
Триметиламин
(CH3)3N |
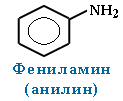
| Ароматические | Фениламин
C6H5-NH2 |
Дифениламин
(C6H5)2NH |
Трифениламин
(C6H5)3N |
| Смешанные | Метилфениламин
CH3-NH-C6H5 |
Диметилфениламин
(CH3)2N-C6H5 |
Номенклатура аминов
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин
СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Изомерия аминов
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Например. Формуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета.
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Например.Формуле С4Н11N соответствуют амины положения аминогруппы.
| 1-Аминобутан (н-бутиламин) |
2-Аминобутан (втор-бутиламин) |
 |
Изомерия между типами аминов
Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины.
| Пропиламин
(первичный амин) |
Метилэтиламин (вторичный амин) | Триметиламин
(третичный амин) |
 |
 |
 |
Физические свойства аминов
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Химические свойства аминов
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
|
Аммиак :NH3 |
Первичный амин R–:NH2 |
 |
 |
Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства аминов
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми.
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
Основные свойства аминов возрастают в ряду:
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II):
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
Это качественная реакция на первичные амины – выделение азота.
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется.
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Видеоопыт изучения среды раствора анилина можно посмотреть здесь.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
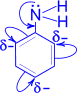
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
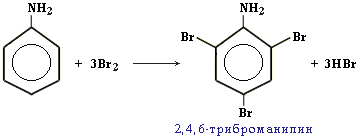
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).
Видеоопыт бромирования анилина можно посмотреть здесь.
Получение аминов
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
- Восстановление сульфидом аммония:
- Алюминий в щелочной среде.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
Видеоопыт взаимодействия хлорида диметиламмония с щелочью с образованием диметиламина можно посмотреть здесь.
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
Амины — органические производные аммиака, в молекуле которого один, два или все три атома водорода замещены углеродным остатком.
Соответственно, обычно выделяют три типа аминов:
Можно также считать, что первичные амины являются производными углеводородов, в молекулах которых атом водорода замещен на функциональную группу $NH^{2—}$, аминогруппу.
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или анилин:
Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары. Это приводит к тому, что амины проявляют свойства оснований.
Существуют ионы, которые являются продуктом формального замещения на углеводородный радикал всех атомов водорода в ионе аммония:
Эти ионы входят в состав солей, похожих на соли аммония. Они называются четвертичными аммонийными солями.
Изомерия и номенклатура
Для аминов характерна структурная изомерия:
— изомерия углеродного скелета:
— изомерия положения функциональной группы:
Первичные, вторичные и третичные амины изомерны друг другу (межклассовая изомерия):
${CH_3-CH_2-CH_2-NH_2}↙{text»первичный амин (пропиламин)»}$
${CH_3-CH_2-NH-CH_3}↙{text»вторичный амин (метилэтиламин)»}$
Как видно из приведенных примеров, для того, чтобы назвать амин, перечисляют заместители, связанные с атомом азота (по порядку старшинства), и добавляют суффикс -амин.
Физические и химические свойства аминов
Физические свойства.
Простейшие амины (метил амин, диметиламин, триметиламин) — газообразные вещества. Остальные низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но не способными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре $184°С$.
Химические свойства.
Химические свойства аминов определяются в основном наличием у атома азота неподеленной электронной пары.
1. Амины как основания. Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т.е. выступать в роли основания:
$NH_3+H^{+}→{NH_4^{+}}↙{text»ион аммония»}$
$CH_3CH_2—NH_2+H^{+}→CH_3—{CH_2—NH_3^{+}}↙{text»ион этиламмония»}$
Известно, что реакция аммиака с водой приводит к образованию гидроксид-ионов:
$NH_3+H_2O⇄NH_3·H_2O⇄NH_4^{+}+OH^{-}$.
Раствор амина в воде имеет щелочную реакцию:
$CH_3CH_2-NH_2+H_2O⇄CH_3-CH_2-NH_3^{+}+OH^{-}$.
Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами:
$2NH_3+H_2SO_4→{(NH_4)_2SO_4}↙{text»сульфат аммония»}$,
$CH_3—CH_2—NH_2+H_2SO_4→{(CH_3—CH_2—NH_3)_2SO_4}↙{text»сульфат этиламмония»}$.
Основные свойства алифатических аминов выражены сильнее, чем у аммиака. Повышение электронной плотности превращает азот в более сильного донора пары электронов, что повышает его основные свойства:
2. Амины горят на воздухе с образованием углекислого газа, воды и азота:
$4CH_3NH_2+9O_2→4CO_2↑+10H_2O+2N_2↑$
АМИНЫ
Амины – органические производные аммиака NH3, в
молекуле которого один, два или три атома водорода замещены на углеводородные
радикалы:
R-NH2,
R2NH, R3N
Простейший представитель – метиламин:
Строение
Атом азота находится в
состоянии sp3-гибридизации,
поэтому молекула имеет форму тетраэдра.
Также
атом азота имеет два неспаренных электрона, что обуславливает свойства аминов
как органических оснований.
КЛАССИФИКАЦИЯ АМИНОВ.
По количеству и типу
радикалов, связанных с атомом азота:
|
АМИНЫ |
Первичные амины |
Вторичные амины |
Третичные амины |
|
Алифатические |
CH3— |
(CH3)2NH |
(CH3)3N |
|
Ароматические |
|
(C6H5)2NH |
|
НОМЕНКЛАТУРА АМИНОВ.
1. В большинстве случаев названия аминов
образуют из названий углеводородных радикалов и суффикса амин.
Различные радикалы перечисляются в алфавитном порядке. При наличии одинаковых радикалов
используют приставки ди и три.
CH3-NH2 Метиламин СH3CH2-NH2
Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
2. Первичные амины часто называют как
производные углеводородов, в молекулах которых один или несколько атомов
водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа
указывается в названии приставкой амино-:
CH3-CH2-CH2-NH2 1-аминопропан
H2N-CH2-CH2-CH(NH2)-CH3 1,3-диаминобутан

смешанных аминов, содержащих алкильные и ароматические радикалы, за основу
названия обычно берется название первого представителя ароматических аминов анилин.
Символ N-
ставится перед названием алкильного радикала, чтобы показать, что этот радикал
связан с атомом азота, а не является заместителем в бензольном кольце.
ИЗОМЕРИЯ АМИНОВ
1) углеродного скелета, начиная с С4H9NH2:
СН3-СН2— СН2-СН2
–NH2 н-бутиламин (1-аминобутан)
CH3—CH— СН2—NH2 изо-бутиламин (1-амин-2-метилпропан)
│
СН3
2) положения аминогруппы, начиная с С3H7NH2:
СН3-СН2— СН2-СН2
–NH2 1-аминобутан (н-бутиламин)
CH3—CH— СН2-СH3 2-аминобутан (втор-бутиламин)
│
NН2
3) изомерия
между типами аминов – первичный, вторичный, третичный:
ФИЗИЧЕСКИЕ СВОЙСТВА
АМИНОВ.
Первичные и вторичные амины образуют слабые
межмолекулярные водородные связи:

Это объясняет относительно более высокую
температуру кипения аминов по сравнению с алканами с близкой молекулярной
массой. Например:
|
Пропиламин (М=59) t кип = 49оС |
Бутан (М=58) t кип = -0,5оС |
Третичные амины не
образуют ассоциирующих водородных связей (отсутствует
группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и
вторичных аминов:
|
Триэтиламин t кип = 89 °С |
н-Гексиламин tкип = 133 °С |
По сравнению со спиртами алифатические амины
имеют более низкие температуры кипения, т.к. в спиртах водородная связь
более прочная:
|
Метиламин t кип = -6 °С |
Метанол t кип = +64,5 °С |
При
обычной температуре только низшие алифатические амины CH3NH2,
(CH3)2NH и (CH3)3N – газы (с
запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие
– твердые вещества без запаха.
Ароматические амины – бесцветные
высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо
растворимы в воде.
С увеличением числа и размеров
углеводородных радикалов растворимость аминов в воде уменьшается, т.к.
увеличиваются пространственные препятствия образованию водородных связей.
Ароматические амины в воде практически не растворяются.
Анилин: С6H5-NH2 – важнейший из ароматических аминов:
Он находит широкое применение в
качестве полупродукта в производстве красителей, взрывчатых веществ и
лекарственных средств (сульфаниламидные препараты).
Анилин — бесцветная маслянистая
жидкость с характерным запахом. На воздухе окисляется и приобретает
красно-бурую окраску. Ядовит.
ПОЛУЧЕНИЕ АМИНОВ.
|
1. Первичные а) Гидрирование водородом: R—NO2 + H2 —tà R—NH2 + H2O б) Восстановление: в щелочной и нейтральной R-NO2 + 3(NH4)2S R-NO2 + 2Al + 2KOH + 4H2O à R- NH2 + 2K[Al(OH)4] Восстановлением нитробензола получают в) в кислой среде (железо, олово или цинк в Амины из раствора выделяют с помощью щелочи: [RNH3+]Cl— +КОН = H2O + КCl + R— NH2 |
|
2. Алкилирование СH3Br + NH3 à [CH3NH3]Br -(+KOH)à CH3—NH2 + C2H5Br à [CH3NH2+]Br— —(+KOH)à CH3 — NH + KBr + H2O вторичный амин Возможно дальнейшее алкилирование до третичного |
|
3.Восстановление нитрилов с R–C Этим способом в промышленности получают гексаметилендиамин, |
|
4. Взаимодействие аммиака со |
ХИМИЧЕСКИЕ
СВОЙСТВА АМИНОВ.
Амины имеют сходное с аммиаком
строение и проявляют подобные ему свойства.
Как в аммиаке, так и в аминах атом азота имеет
неподеленную пару электронов:
Поэтому амины и аммиак обладают свойствами оснований.
|
1. Основные свойства. Будучи производными аммиака, все амины Алифатические амины являются более Это СН3 Это приводит к усилению основных свойств. Фенильный В водном растворе амины обратимо |
|
2. Амины реагируют с кислотами, образуя Cоли аминов — твердые вещества без запаха, хорошо растворимые в воде, но не При действии щелочей на соли аминов [CH3NH3]Cl Соли аминов вступают в обменные реакции [CH3NH3]Cl |
|
3. Амины |
|
4. Горение. 4 С2Н5NH2 + 15O2 à 8CO2 + 2N2 + 14 H2O |
|
5. Реакции с а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты: R—NH2 + NaNO2 + HCl à R—OH +N2 + NaCl + H2O б) Вторичные амины (алифатические и ароматические) |
Особенности
свойств анилина:
Для анилина
характерны реакции как по аминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены взаимным
влиянием атомов.
— бензольное кольцо ослабляет
основные свойства аминогруппы по сравнению алифатическими аминами и
даже с аммиаком.
— бензольное кольцо становится более
активным в реакциях замещения, чем бензол.
Аминогруппа — заместитель 1-го рода
(активирующий орто-пара-ориентант в реакциях электрофильного замещения
в ароматическом ядре).
Качественная
реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина
(белый осадок ↓).
АМИНЫ
Амины – органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы:
R-NH2, R2NH, R3N
Простейший представитель – метиламин:
Строение
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота имеет два неспаренных электрона, что обуславливает свойства аминов как органических оснований.
КЛАССИФИКАЦИЯ АМИНОВ.
По количеству и типу радикалов, связанных с атомом азота:
|
АМИНЫ |
Первичные амины |
Вторичные амины |
Третичные амины |
|
Алифатические |
CH3— NH2 |
(CH3)2NH |
(CH3)3N |
|
Ароматические |
|
(C6H5)2NH |
|
НОМЕНКЛАТУРА АМИНОВ.
1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке. При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин (CH3)2NH Диметиламин
2. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
CH3-CH2-CH2-NH2 1-аминопропан H2N-CH2-CH2-CH(NH2)-CH3 1,3-диаминобутан
Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов анилин.
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
ИЗОМЕРИЯ АМИНОВ
1) углеродного скелета, начиная с С4H9NH2:
СН3-СН2— СН2-СН2 –NH2 н-бутиламин (1-аминобутан)
CH3-CH- СН2-NH2 изо-бутиламин (1-амин-2-метилпропан)
│
СН3
2) положения аминогруппы, начиная с С3H7NH2:
СН3-СН2— СН2-СН2 –NH2 1-аминобутан (н-бутиламин)
CH3-CH- СН2-СH3 2-аминобутан (втор-бутиламин)
│
NН2
3) изомерия между типами аминов – первичный, вторичный, третичный:
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой. Например:
|
Пропиламин (М=59) t кип = 49оС |
Бутан (М=58) t кип = -0,5оС |
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов:
|
Триэтиламин t кип = 89 °С |
н-Гексиламин tкип = 133 °С |
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения, т.к. в спиртах водородная связь более прочная:
|
Метиламин t кип = -6 °С |
Метанол t кип = +64,5 °С |
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Анилин: С6H5-NH2 – важнейший из ароматических аминов:
Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Анилин — бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит.
ПОЛУЧЕНИЕ АМИНОВ.
|
1. Первичные амины можно получить восстановлением нитросоединений. а) Гидрирование водородом: R-NO2 + H2 -t🡪 R-NH2 + H2O б) Восстановление: в щелочной и нейтральной среде получаются амины: R-NO2 + 3(NH4)2S 🡪 R- NH2 + 3S + 6NH3 +2H2O (реакция Зинина) R-NO2 + 2Al + 2KOH + 4H2O 🡪 R- NH2 + 2K[Al(OH)4] Восстановлением нитробензола получают анилин. в) в кислой среде (железо, олово или цинк в соляной кислоте) получаются соли аминов: R-NO2 + 3Fe + 7HCl 🡪 [RNH3+]Cl— + 2H2O + 3FeCl2 Амины из раствора выделяют с помощью щелочи: [RNH3+]Cl— +КОН = H2O + КCl + R- NH2 |
|
2. Алкилирование аммиака и аминов. При взаимодействии аммиака с алкилгалогенидами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин. Этот амин способен взаимодействовать с новой порцией галогеналкана с образованием вторичного амина: СH3Br + NH3 🡪 [CH3NH3]Br -(+KOH)🡪 CH3-NH2+ KBr + H2O первичный амин CH3-NH2 + C2H5Br 🡪 [CH3NH2+]Br— —(+KOH)🡪 CH3 — NH + KBr + H2O вторичный амин │ │ C2H5 C2H5 Возможно дальнейшее алкилирование до третичного амина. |
|
3.Восстановление нитрилов с образованием первичных аминов: R–C Этим способом в промышленности получают гексаметилендиамин, который используется в производстве полиамидного волокна найлон. |
|
4. Взаимодействие аммиака со спиртами: R-OH + NH3 -(t,p)🡪 R –NH2 + H2O |
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства.
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
Поэтому амины и аммиак обладают свойствами оснований.
|
1. Основные свойства. Будучи производными аммиака, все амины обладают основными свойствами. Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. Это объясняется тем, что радикалы СН3-, С2Н5— и др. проявляют положительный индуктивный (+I) эффект и увеличивают электронную плотность на атоме азота: СН3 → NH2 Это приводит к усилению основных свойств. Фенильный радикал C6H5— проявляет отрицательный мезомерный (-М) эффект и уменьшает электронную плотность на атоме азота: В водном растворе амины обратимо реагируют с водой, при этом среда становится слабощелочная: R-NH2 +H2O ⇄[R-NH3]++ OH— |
|
2. Амины реагируют с кислотами, образуя соли: CH3-NH2 + H2SO4 🡪 [CH3NH3]HSO4 C6H5NH2 + HCl 🡪 [C6H5NH3]Cl Cоли аминов — твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов). При действии щелочей на соли аминов выделяются свободные амины: [CH3NH3]Cl + NaOH -t🡪 CH3NH2 + NaCl + H2O Соли аминов вступают в обменные реакции в растворе: [CH3NH3]Cl + AgNO3 -t🡪 [CH3NH3]NO3+ AgCl ↓ |
|
3. Амины способны осаждать гидроксиды тяжелых металлов из водных растворов: 2R-NH2 + FeCl2 + 2H2O 🡪 Fe(OH)2↓+ 2[RNH3]Cl |
|
4. Горение. Амины сгорают в кислороде, образуя азот, углекислый газ и воду: 4 С2Н5NH2 + 15O2 🡪 8CO2 + 2N2 + 14 H2O |
|
5. Реакции с азотистой кислотой. а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты: R-NH2 + NaNO2 + HCl 🡪 R-OH +N2 + NaCl + H2O б) Вторичные амины (алифатические и ароматические) дают нитрозосоединения — вещества с характерным запахом: R2NH + NaNO2 + HCl 🡪 R2N-N=O + NaCl + H2O |
Особенности свойств анилина:
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены взаимным влиянием атомов.
— бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
— бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Аминогруппа — заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях электрофильного замещения в ароматическом ядре).
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).
Чтобы поделиться, нажимайте
1. Амины – азотсодержащие органические вещества, производные аммиака (NH3), в молекулах которых один или несколько атомов водорода замещены на углеводородный радикал (- R или – CnH2n+1)
2. Функциональная группа: — NH2 аминогруппа
3. Классификация аминов:
4. Нахождение аминов в природе
Амины широко распространены в природе, так как образуются при гниении живых организмов. Например, с триметиламином вы встречались неоднократно. Запах селедочного рассола обусловлен именно этим веществом. Обиходное словосочетание “трупный яд”, встречающиеся в художественной литературе, связано с аминами.
5. Номенклатура аминов
1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин
При наличии одинаковых радикалов используют приставки ди и три.
(CH3)2NH Диметиламин
2. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин (две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
6. Изомерия аминов
Структурная изомерия
— углеродного скелета, начиная с С4H9NH2:
— положения аминогруппы, начиная с С3H7NH2:
— изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов:
Пространственная изомерия
Возможна оптическая изомерия, начиная с С4H9NH2:
7. Получение аминов
Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин.
1842 г Н. Н. Зинин получил анилин восстановлением нитробензола — в промышленности
Восстановление нитросоединений:
R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O
или
R—NO2+3(NH4)2S t, Fe в кислой среде →R—NH2 +3S↓ +6NH3↑ + 2H2O (р. Зинина)
Другие способы:
1). Промышленный
CH3Br + 2NH3 t, ↑p → CH3—NH2 + NH4Br
2). Лабораторный — Действие щелочей на соли алкиламмония
(получение первичных, вторичных, третичных аминов):
[R—NH3]Г + NaOH t → R—NH2 + NaГ + H2O
3). Действием галогеналканов на первичные алифатические и ароматические амины получают вторичные и третичные амины, в том числе, смешанные.
8. Физические свойства аминов
Метиламин, диметиламин и триметиламин — газы, средние члены алифатического ряда — жидкости, высшие — твердые вещества. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.
Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).
Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, а н-гексиламин – при 133 °С).
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения (т. кип. метиламина -6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность водородных связей с атомом азота меньше, чем с участием более электроотрицательного кислорода.
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов:
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
9. Свойства аминов
I. Основные свойства
Для аминов характерны основные свойства, которые обусловлены наличием не поделённой электронной пары на атоме азота
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
C6H5-NH2 < NH3 < R3N < R-NH2 < R2NH
————————————————-→
возрастание основных свойств
В растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов.
Водные растворы аминов имеют щелочную реакцию (амины реагируют с водой по донорно-акцепторному механизму):
R-NH2 + H2O → [R-NH3]+ + OH—
ион алкиламмония
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Взаимодействие с кислотами (донорно-акцепторный механизм):
CH3-NH2 + H2SO4 → [CH3-NH3]HSO4
(соль — гидросульфат метиламмония)
2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4
(соль — сульфат метиламмония)
Соли неустойчивы, разлагаются щелочами:
[CH3-NH3]2SO4 + 2NaOH → 2CH3-NH2 ↑ + Na2SO4 + H2O
Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.
II. Реакции окисления
Реакция горения (полного окисления) аминов на примере метиламина:
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Ароматические амины легко окисляются даже кислородом воздуха. Являясь в чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление ароматических аминов используется в производстве красителей. Эти реакции обычно очень сложны.
III. Особые свойства анилина
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
1). Для анилина характерны свойства бензольного кольца – действие аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях:
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина:
С6Н5NН2 + HCl → [С6Н5NН3 ]+Сl—
хлорид фениламмония
10. Применение
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна.
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Задания для подготовки к ЕГЭ на амины.
Амины. Тестовые задания с выбором двух вариантов ответа.
Задание №1
Выберите два утверждения, справедливые для метиламина:
1) плохо растворим в воде
2) проявляет амфотерные свойства
3) газ с резким запахом
4) легче воздуха
5) основные свойства выражены сильнее, чем у фениламина
Решение
Ответ: 35
Задание №2
Среди перечисленных, выберите два вещества, которые относятся к классу аминов
- 1. CH3NO2
- 2. [C6H5NH3]Cl
- 3. NH2CH2COOH
- 4. CH3NHCH3
- 5. (CH3)3N
Решение
Ответ: 45
Задание №3
Выберите два утверждения, справедливые для анилина:
1) основные свойства выражены сильнее, чем у метиламина
2) жидкость, с характерным запахом
3) хорошо растворим в воде
4) ядовит
5) является вторичным амином
Решение
Ответ: 24
Задание №4
Выберите два утверждения, справедливые для метиламина:
1) основные свойства выражены сильнее, чем у аммиака
2) является гомологом диметиламина
3) хорошо растворим в воде
4) является ароматическим амином
5) реагирует с основаниями
Решение
Ответ: 13
Задание №5
Выберите два утверждения, справедливые для анилина:
1) используется в производстве красителей
2) хорошо растворим в воде
3) при окислении кислородом воздуха легко темнеет
4) проявляет амфотерные свойства
5) при нормальных условиях находится в твердом агрегатном состоянии
Решение
Ответ: 13
Задание №6
Из предложенного перечня веществ, выберите два таких, у которых основные свойства выражены сильнее чем у аммиака
1) аминобензол
2) этиламин
3) дифениламин
4) трифениламин
5) метиламин
Решение
Ответ: 25
Задание №7
Из предложенного перечня веществ, выберите два таких, у которых основные свойства выражены слабее, чем у аммиака
1) трифениламин
2) анилин
3) этиламин
4) диэтиламин
5) метилэтиламин
Решение
Ответ: 12
Задание №8
Из предложенного перечня веществ, выберите два таких, при взаимодействии с которыми анилин образует соль:
- 1. HCl
- 2. H2O
- 3. O2
- 4. CH3I
- 5. CH4
Решение
Ответ: 14
Задание №9
Из предложенного перечня веществ, выберите два таких, которые при реакции с метиламином в качестве конечного продукта образуют соль:
- 1. HNO2
- 2. H2O
- 3. KOH
- 4. HCl
- 5. H2SO4
Решение
Ответ: 45
Задание №10
Из предложенного перечня веществ, выберите два таких, которые при реакции с метиламином в качестве конечного продукта образуют соль:
- 1. NaCl
- 2. CH3Cl
- 3. CH3OH
- 4. HNO2
- 5. HBr
Решение
Ответ: 25
[adsp-pro-3]
Задание №11
Из предложенного перечня веществ, выберите два таких, при действии которых на этиламин не образуется соль:
- 1. NaCl
- 2. CH3Cl
- 3. CH3OH
- 4. HNO3
- 5. HBr
Решение
Ответ: 13
Задание №12
Выберите два утверждения, справедливые для диметиламина:
1) плохо растворим в воде
2) водный раствор диметиламина имеет слабокислую среду
3) является изомером этиламина
4) является вторичным амином
5) как и большинство аминов не имеет запаха
Решение
Ответ: 34
Задание №13
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию триметиламин:
- 1. O2
- 2. Na2CO3
- 3. C2H6
- 4. CH3COOH
- 5. NaOH
Решение
Ответ: 14
Задание №14
Выберите два утверждения, которые справедливы и для метиламина, и для анилина:
1) хорошо растворимы в воде
2) при сгорании в кислороде образуют азот
3) относятся к первичным аминам
4) имеют общую формулу СnH2n+3N
5) взаимодействуют с гидроксидом натрия
Решение
Ответ: 23
Задание №15
Выберите два утверждения, которые справедливы и для метиламина, и для анилина:
1) плохо растворимы в воде
2) реагируют с азотной кислотой
3) относятся к ароматическим аминам
4) при нормальных условиях являются газами
5) являются токсичными веществами
Решение
Ответ: 25
Задание №16
Из предложенного перечня выберите два типа реакций, характерных для алифатических аминов
1) гидролиз
2) горение
3) полимеризация
4) гидратация
5) дегидратация
Решение
Ответ: 24
Задание №17
Из предложенного перечня выберите два типа реакций, характерных для анилина
1) гидратация
2) дегидрирование
3) горение
4) присоединение галогенов
5) галогенирование
Решение
Ответ: 35
Задание №18
Из предложенного перечня выберите два вещества, которые являются гомологами анилина:
1) о-толуидин
2) метиламин
3) м-толуидин
4) этиламин
5) диметиламин
Решение
Ответ: 13
Задание №19
Из предложенного перечня выберите два вещества, которые являются гомологами этиламина:
1) диметиламин
2) метилэтиламин
3) аминобензол
4) метиламин
5) пропиламин
Решение
Ответ: 45
Задание №20
Из предложенного перечня выберите два вещества, которые являются изомерами метилэтиламина:
1) диметиламин
2) пропиламин
3) диэтиламин
4) изопропиламин
5) метилпропиламин
Решение
Ответ: 24
[adsp-pro-3]
Задание №21
Из предложенного перечня выберите два вещества, которые являются изомерами диэтиламина:
1) метилпропиламин
2) дипропиламин
3) этилпропиламин
4) метилбутиламин
5) бутиламин
Решение
Ответ: 15
Задание №22
Из предложенного перечня выберите два вещества, являющиеся структурными изомерами 2-амино-3-метилбутана
1) анилин
2) диэтиламин
3) 2-амино-2-метилбутан
4) этилпропиламин
5) метилпропиламин
Решение
Ответ: 34
Задание №23
Из предложенного перечня веществ выберите два таких, с которыми метиламин может вступить в реакцию
1) бензол
2) вода
3) азотная кислота
4) бромная вода
5) этан
Решение
Ответ: 23
Задание №24
Из предложенного перечня веществ выберите два таких, с которыми может прореагировать анилин
1) гидроксид бария
2) хлоридом калия
3) метан
4) серная кислота
5) бромная вода
Решение
Ответ: 45
Задание №25
Из предложенного перечня веществ выберите два таких, с которыми диметиламин может вступить в реакцию
1) метанол
2) сульфат натрия
3) метан
4) вода
5) бромная вода
Решение
Ответ: 14
Задание №26
Из предложенного перечня веществ выберите два таких, с которыми триметиламин может вступить в реакцию 1) метанол 2) соляная кислота 3) гидроксид натрия 4) хлорид натрия 5) кислород Решение
Ответ: 25
Задание №27
Из предложенного перечня веществ выберите два таких, с которыми анилин может вступить в реакцию
1) вода
2) бромная вода
3) хлорметан
4) гидроксид кальция
5) бензол
Решение
Ответ: 23
Задание №28
Из предложенного перечня веществ выберите два таких, с которыми может прореагировать метилэтиламин
1) бромэтан
2) карбонат калия
3) аммиак
4) серная кислота
5) толуол
Решение
Ответ: 14
Задание №29
Из предложенного перечня веществ выберите два таких, которые не могут образоваться при горении метиламина
- 1. N2
- 2. NO2
- 3. H2O
- 4. CO2
- 5. NH3
Решение
Ответ: 25
Задание №30
Из предложенного перечня веществ выберите два таких, которые могут образоваться при горении анилина
- 1. NH3
- 2. NO
- 3. С6Н6
- 4. CO2
- 5. N2
Решение
Ответ: 45
[adsp-pro-3]
Задание №31
Из предложенного перечня веществ выберите два таких, с которыми может прореагировать анилин
1) гидроксид бария
2) бромная вода
3) кислород
4) хлорид железа(III)
5) вода
Решение
Ответ: 23
Задание №32
Из предложенного перечня веществ, выберите два таких, с которыми может прореагировать хлорид метиламмония
1) вода
2) бромная вода
3) водород
4) гидроксид натрия
5) нитрат серебра
Решение
Ответ: 45
Задание №33
Из предложенного перечня веществ выберите два таких, с которыми может прореагировать гидрокарбонат метиламмония
1) хлорид натрия
2) гидроксид кальция
3) хлорид серебра
4) бромоводородная кислота
5) бромная вода
Решение
Ответ: 24
Задание №34
Из предложенного перечня веществ выберите два таких, качественной реакцией на которые является взаимодействие с азотистой кислотой
1) триметиламин
2) метиламин
3) диметилэтиламин
4) пропан
5) пропиламин
Решение
Ответ: 25
Задание №35
Из предложенного перечня веществ выберите два таких, качественной реакцией на которые является взаимодействие с бромной водой
1) пропанол-1
2) хлорид метиламмония
3) анилин
4) фенол
5) метиламин
Решение
Ответ: 34
Задание №36
Из предложенного перечня веществ выберите два таких, с которыми не реагирует метиламин, но реагирует анилин
1) бромная вода
2) кислород
3) водород
4) серная кислота
5) хлорид калия
Решение
Ответ: 13
Задание №37
Из предложенного перечня веществ выберите два таких, с которыми не реагирует метиламин, но реагирует фенол
1) гидроксид алюминия
2) соляная кислота
3) бромная вода
4) карбонат натрия
5) хлорид железа (III)
Решение
Ответ: 35
Задание №38
Из предложенного перечня реакций выберите две такие, с помощью которых может быть получен этиламин
1) C2H6 + N2
2) C2H5NO2 + H2
3) C2H6 + HNO2
4) C2H5OH + N2
5) C2H5OH + NH3
Решение
Ответ: 25
Задание №39
Из предложенного перечня реакций выберите две, которые могут быть использованы для синтеза метиламина.
1) CH3OH + H2
2) CH4 + N2
3) [CH3NH3]Cl + NaOH
4) CH3NO2 + Fe + HCl
5) CH3NO2 + H2O
Решение
Ответ: 34
Задание №40
Из предложенного перечня реакций выберите две такие, в результате протекания которых образуется анилин:
1) C6H5Cl + NH3(избыток) →
2) C6H5Cl + NaOH →
3) C6H5NO2 + Zn + HCl →
4) C6H5Cl + HNO3 →
5) [C6H5NH3]Cl + KOH →
Решение
Ответ: 15
[adsp-pro-3]
Задание №41
Из предложенного перечня реакций выберите две такие, в результате протекания которых может образоваться диметиламин:
1) [(CH3)2NH2]Cl + AgNO3 →
2) CH3NH2 + CH3OH →
3) CH3OH + H2 →
4) [(CH3)2NH2]Cl + Ca(OH)2 →
5) [(CH3)3NH]Cl + NaOH →
Решение
Ответ: 24
Задание №42
Из предложенного перечня веществ выберите два таких, которые можно превратить в этиламин в одну стадию:
1) С2Н6
2) С2Н5ОН
3) СН3ОCH3
4) С2Н5NO2
5) CH3COOH
Решение
Ответ: 24
Задание №43
Из предложенного перечня веществ выберите два таких, которые можно превратить в этиламин в одну стадию:
1) C2H5NH3Br
2) (С2Н5)2NH
3) NH2СН2COOH
4) С2Н5NO2
5) C2H5OC2H5
Решение
Ответ: 14
Задание №44
Из предложенного перечня веществ выберите два таких, с которыми может вступать в реакцию как этиламин, так и анилин
1) гидроксид калия
2) кислород
3) водород
4) бромоводородная кислота
5) бромная вода
Решение
Ответ: 24
Задание №45
Из предложенного перечня реакций выберите две такие, в результате протекания которых образуется аминобензол
1) C6H5NO2 + Al + KOH →
2) C6H5NO2 + Zn + HCl(избыток) →
3) C6H5NO2 + HNO3 →
4) C6H5Cl + HNO3 →
5) C6H5Br + NH3(избыток) →
Решение
Ответ: 15
Задание №46
Из предложенного перечня веществ выберите два таких, из которых можно получить хлорид метиламмония в одну стадию:
1) метиламин
2) метанол
3) диметиламин
4) азот
5) хлорметан
Решение
Ответ: 15
Задание №47
Из предложенного перечня веществ выберите два таких, с которыми может прореагировать гидросульфат метиламмония
1) вода
2) аммиак
3) хлорид триметиламмония
4) гидроксид калия
5) сульфат бария
Решение
Ответ: 24
Задание №48
Представлена следующая схема превращений веществ:
метан нитрометан
метиламин
Определите, какие из указанных веществ являются веществами X и Y
- 1. HNO2
- 2. N2
- 3. HNO3
- 4. H2
- 5. H2O
Решение
Ответ: 34
Задание №49
Представлена следующая схема превращений веществ:
метиламинметанол
хлорметан
Определите, какие из указанных веществ являются веществами X и Y
- 1. Cl2
- 2. HCl
- 3. KOH
- 4. NH3
- 5. HNO2
Решение
Ответ: 52
Задание №50
Представлена следующая схема превращений веществ:
[ СH3NH3]HCO3 метиламин
азот
Определите, какие из указанных веществ являются веществами X и Y
- 1. O2
- 2. NaOH
- 3. CH3OH
- 4. HCl
- 5. HNO3
Решение
Ответ: 21
[adsp-pro-3]
Задание №51
Представлена следующая схема превращений веществ:
[ СH3NH3]HCO3 метиламин
азот
Определите, какие из указанных веществ являются веществами X и Y
- 1. NH3
- 2. NH2CH2COOH
- 3. KOH
- 4. HCl
- 5. HNO2
Решение
Ответ: 35
Амины. Задания на установление соответствия.
Задание №1
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) анилин Б) глицерин В) метилэтиламин Г) ацетон |
1) простой эфир 2) ароматический спирт 3) ароматический амин 4) многоатомный спирт 5) алифатический амин 6) кетон |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3456
Задание №2
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) дифениламин Б) гидроксибензол В) диметиламин Г) стирол |
1) углевод 2) фенол 3) первичный амин 4) непредельный углеводород 5) вторичный амин 6) ароматический спирт |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5254
Задание №3
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) трифениламин Б) ацетон В) хлороформ Г) анилин |
1) углевод 2) галогенопроизводные углеводородов 3) амин 4) углеводород 5) спирт 6) кетон |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3623
Задание №4
Установите соответствие между формулами веществ и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАКТИВ |
|
А) пропан и пропен Б) метиламин и триметиламин В) бензол и анилин Г) фенол и толуол |
1) [Ag(NH3)2]OH 2) HNO2 3) K2CO3 4) Br2(водн) 5) CuO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4244
Задание №5
Установите соответствие между формулой вещества и окраской индикатора лакмуса в ее водном растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ОКРАСКА ЛАКМУСА |
|
А) C6H5NHC6H5 Б) CH3-O-CH3 В) C2H5OH Г) C6H5OK |
1) красный 2) синий 3) фиолетовый |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3332
[adsp-pro-3]
Задание №6
Установите соответствие между формулой амина и продуктом его взаимодействия с соляной кислотой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАКТИВ | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
1) (CH3)3N 2) (С2Н5)2NH 3) C6H5NH2 4) CH3NH2 |
1) [CH3NH3]Cl 2) [(C6H5)2NH2]Cl 3) [(CH3)3NH]Cl 4) [C6H5NH3]Cl 5) [С2Н5NH2С2Н5]Cl 6) [(CH3)2NH2]Cl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3541
Задание №7
Установите соответствие между исходными веществами и возможным(и) органическим(и) продуктом(ами) этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ(Ы) РЕАКЦИИ |
|
А) CH3OH+NH3 Б) CH3NH2+HNO2 В) C6H5NH2+Br2(водн) Г) CH3NH2+C2H5Cl |
1) CH3OH+NO2+H2O 2) [C6H5NH3]Br+HBr 3) CH3OH+N2+H2O 4) C6H2Br3NH2+3HBr 5) CH3NH2C2H5Cl 6) CH3NH2+H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 6345
Задание №8
Установите соответствие между исходными веществами и возможным(и) органическим(и) продуктом(ами) этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
1) C6H5NO2 + Fe+HCl 2) CH3CH2NO2 + Zn + HCl 3) C6H5NO2 + Al + NaOH 4) CH3CH2NH2 + СH3Cl |
1) анилин 2) хлорид фениламмония 3) этиламин 4) хлорид этиламмония 5) хлорид пропиламмония 6) хлорид метилэтиламмония |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2416
Задание №9
Установите соответствие между исходными веществами и возможным(и) органическим(и) продуктом(ами) этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
А) C2H5OH + C2H5NH2 Б) C6H5Cl + NH3 В) 2C2H5OH + NH3 Г) (C2H5)2NH + CH3OH |
1) диметиламин 2) метилэтиламин 3) аминобензол 4) диэтиламин 5) метилдиэтиламин 6) триэтиламин |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4345
Задание №10
Установите соответствие между формулой вещества и окраской индикатора в его водном растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ОКРАСКА МЕТИЛОРАНЖА |
|
А) C2H5ONa Б) C2H5OH В) C6H5NH2 Г) (C2H5)2NH |
1) красный 2) желтый 3) оранжевый |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2332
[adsp-pro-3]
Задания на амины повышенной сложности.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
CH3NO2 X1
X2
X3
X2
X4
Решение
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
X1
X2
X3
X4
Решение
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
C2H5Cl X1
X2
X3
X2
CO2
Решение
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
CH3COOH X1
X2
X3
X4
Решение
Задание №5
Навеску неизвестного азотсодержащего соединения массой 10,7 г сожгли в избытке кислорода и получили 15,68 л углекислого газа, 8,1 г воды и 1,4 г азота. Определите молекулярную формулу данного соединения и его структуру, если известно, что оно имеет циклическое строение, содержит только один заместитель в кольце, а также реагирует с азотистой кислотой с выделением газа.
Решение
n(CO2) = V(CO2)/Vm = 15,68/22,4 = 0,7 моль, следовательно, n(C) = n(CO2) = 0,7 моль,
m(C) = n(C)·M(C) = 0,7·12 = 8,4 г,
n(H2O) = m(H2O)/M(H2O) = 8,1/18 = 0,45 моль, следовательно, n(H) = 2n(H2O) = 2·0,45 = 0,9 моль,
m(H) = n(H)·M(H) = 0,9·1 = 0,9 г,
n(N2) = m(N2)/M(N2) = 1,4/28 = 0,05 моль, следовательно, n(N) = 2n(N2) = 2·0,05 = 0,1 моль,
m(N) = n(N)·M(N) = 0,1·14 = 1,4 г,
m(O) = m(в-ва) — m(С) — m(H) — m(N) = 10,7 — 8,4 — 0,9 — 1,4 = 0 г, следовательно, кислорода в соединении нет.
n(C):n(H):n(N) = 0,7:0,9:0,1 = 7:9:1
Таким образом, простейшая формула искомого соединения C7H9N.
Если предположить, что истинная молекулярная формула совпадает с простейшей, то искомое соединение может являться ароматическим амином. Под формулу C7H9N подходят 4 соединения: о-метиланилин, м-метиланилин, п-метиланилин, а также бензиламин.
Поскольку в условии сказано, что соединение содержит только один заместитель в цикле, это означает, что подходит только бензиламин, структурная формула которого:
[adsp-pro-3]
Задание №6
При сжигании навески неизвестного азотсодержащего вещества массой 10,3 г образовалось 8,96 л углекислого газа, 1,12 л азота и 8,1 г воды. Определите молекулярную формулу вещества и его структуру, если известно, что оно не реагирует с содой, а при его гидролизе образуется простейший одноатомный спирт и вещество природного происхождения.
Решение
n(CO2) = V(CO2)/Vm = 8,96/22,4 = 0,4 моль, следовательно, n(C) = n(CO2) = 0,4 моль,
m(C) = n(C)·M(C) = 0,4·12 = 4,8 г,
n(N2) = V(N2)/Vm = 1,12/22,4 = 0,05 моль, следовательно, n(N) = 2n(N2) = 2·0,05 = 0,1 моль,
m(N) = n(N)·M(N) = 0,1·14 = 1,4 г,
n(H2O) = m(H2O)/M(H2O) = 8,1/18 = 0,45 моль, следовательно, n(H) = 2·n(H2O) = 2·0,45 = 0,9 моль,
m(H) = n(H)·M(H) = 0,9·1 = 0,9 г,
m(O) = m(в-ва) — m(С) — m(H) — m(N) = 10,3 — 4,8 — 0,9 — 1,4 = 3,2 г,
n(O) = m(O)/M(O) = 3,2/16 = 0,2 моль,
n(C):n(H):n(O):n(N) = 0,4:0,9:0,2:0,1 = 4:9:2:1,
Таким образом, простейшая формула искомого соединения C4H9O2N.
Простейший одноатомный спирт – это метанол.
Если предположить, что истинная молекулярная формула совпадает с простейшей, то искомое соединение может являться сложным эфиром метанола и аланина, структурная формула которого:
Задание №7
Навеску неизвестного азотсодержащего соединения массой 13,2 г сожгли в избытке кислорода. В результате образовалось 8,96 л углекислого газа, такое же количество вещества воды, а также 2,24 л азота. Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно гидролизуется под действием раствора едкого натра с образованием единственного соединения.
Решение
n(N2) = V(N2)/Vm = 2,24/22,4 = 0,1 моль, следовательно, n(N) = 2n(N2) = 2·0,1 = 0,2 моль,
m(N) = n(N)·M(N) = 0,2·14 = 2,8 г,
n(CO2) = V(CO2)/Vm = 8,96/22,4 = 0,4 моль, следовательно, n(C) = n(CO2) = 0,4 моль,
m(C) = n(C)·M(C) = 0,4·12 = 4,8 г,
По условию, n(H2O) = n(CO2) = 0,4 моль,
n(H) = 2·n(H2O) = 2·0,4 = 0,8 моль,
m(H) = n(H)·M(H) = 1·0,8 = 0,8 моль,
m(O) = m(в-ва) — m(С) — m(H) — m(N) = 13,2 — 4,8 — 0,8 — 2,8 = 4,8 г,
n(O) = m(O)/M(O) = 4,8/16 = 0,3 моль,
n(C):n(H):n(O):n(N) = 0,4:0,8:0,3:0,2 = 2:4:1,5:1 = 4:8:3:2
Таким образом, простейшая формула искомого соединения C4H8O3N2.
Если предположить, что истинная молекулярная формула совпадает с простейшей, то искомое соединение может представлять собой дипептид глицилглицин:
[adsp-pro-10]