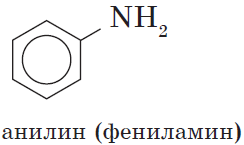
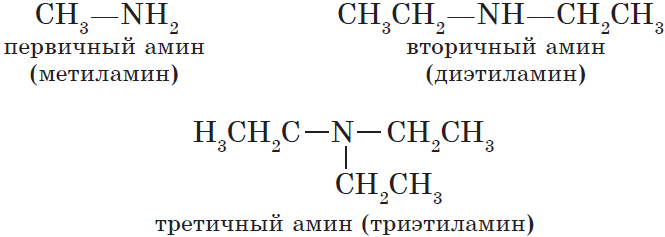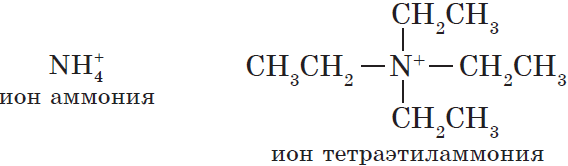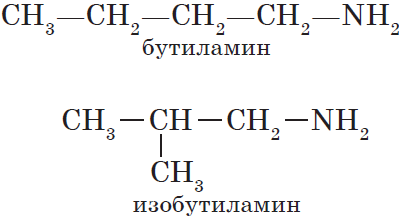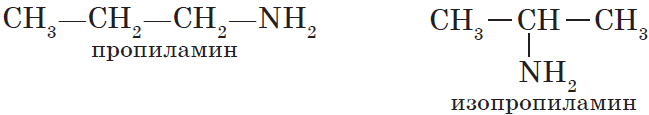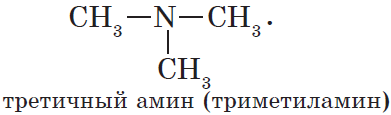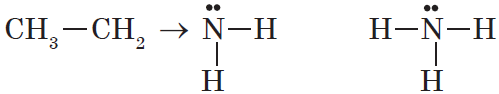Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
R-NH2, R1-NH-R2, R1-N(R2)-R3
Строение аминов
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
Классификация аминов
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин
CH3-NH2 |
Диметиламин
CH3-NH-CH3 |
Триметиламин
(CH3)3N |
| Ароматические | Фениламин
C6H5-NH2 |
Дифениламин
(C6H5)2NH |
Трифениламин
(C6H5)3N |
| Смешанные | Метилфениламин
CH3-NH-C6H5 |
Диметилфениламин
(CH3)2N-C6H5 |
Номенклатура аминов
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин
СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Изомерия аминов
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Например. Формуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета.
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Например.Формуле С4Н11N соответствуют амины положения аминогруппы.
| 1-Аминобутан (н-бутиламин) |
2-Аминобутан (втор-бутиламин) |
 |
Изомерия между типами аминов
Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины.
| Пропиламин
(первичный амин) |
Метилэтиламин (вторичный амин) | Триметиламин
(третичный амин) |
 |
 |
 |
Физические свойства аминов
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Химические свойства аминов
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
|
Аммиак :NH3 |
Первичный амин R–:NH2 |
 |
 |
Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства аминов
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми.
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
Основные свойства аминов возрастают в ряду:
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II):
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
Это качественная реакция на первичные амины – выделение азота.
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется.
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Видеоопыт изучения среды раствора анилина можно посмотреть здесь.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).
Видеоопыт бромирования анилина можно посмотреть здесь.
Получение аминов
Восстановление нитросоединений
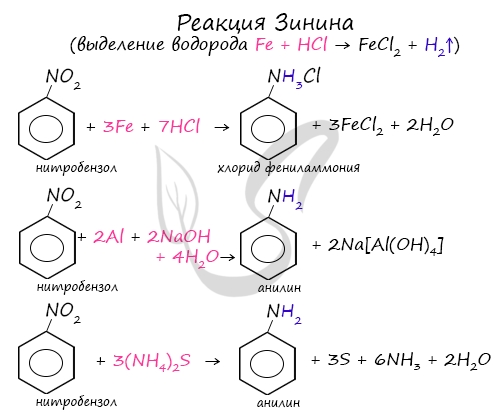
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
- Восстановление сульфидом аммония:
- Алюминий в щелочной среде.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
Видеоопыт взаимодействия хлорида диметиламмония с щелочью с образованием диметиламина можно посмотреть здесь.
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная
группой аминов является аминогруппа — NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом,
у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин,
пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина
и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.

При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая
температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Амины — органические производные аммиака, в молекуле которого один, два или все три атома водорода замещены углеродным остатком.
Соответственно, обычно выделяют три типа аминов:
Можно также считать, что первичные амины являются производными углеводородов, в молекулах которых атом водорода замещен на функциональную группу $NH^{2—}$, аминогруппу.
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или анилин:
Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары. Это приводит к тому, что амины проявляют свойства оснований.
Существуют ионы, которые являются продуктом формального замещения на углеводородный радикал всех атомов водорода в ионе аммония:
Эти ионы входят в состав солей, похожих на соли аммония. Они называются четвертичными аммонийными солями.
Изомерия и номенклатура
Для аминов характерна структурная изомерия:
— изомерия углеродного скелета:
— изомерия положения функциональной группы:
Первичные, вторичные и третичные амины изомерны друг другу (межклассовая изомерия):
${CH_3-CH_2-CH_2-NH_2}↙{text»первичный амин (пропиламин)»}$
${CH_3-CH_2-NH-CH_3}↙{text»вторичный амин (метилэтиламин)»}$
Как видно из приведенных примеров, для того, чтобы назвать амин, перечисляют заместители, связанные с атомом азота (по порядку старшинства), и добавляют суффикс -амин.
Физические и химические свойства аминов
Физические свойства.
Простейшие амины (метил амин, диметиламин, триметиламин) — газообразные вещества. Остальные низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но не способными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре $184°С$.
Химические свойства.
Химические свойства аминов определяются в основном наличием у атома азота неподеленной электронной пары.
1. Амины как основания. Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т.е. выступать в роли основания:
$NH_3+H^{+}→{NH_4^{+}}↙{text»ион аммония»}$
$CH_3CH_2—NH_2+H^{+}→CH_3—{CH_2—NH_3^{+}}↙{text»ион этиламмония»}$
Известно, что реакция аммиака с водой приводит к образованию гидроксид-ионов:
$NH_3+H_2O⇄NH_3·H_2O⇄NH_4^{+}+OH^{-}$.
Раствор амина в воде имеет щелочную реакцию:
$CH_3CH_2-NH_2+H_2O⇄CH_3-CH_2-NH_3^{+}+OH^{-}$.
Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами:
$2NH_3+H_2SO_4→{(NH_4)_2SO_4}↙{text»сульфат аммония»}$,
$CH_3—CH_2—NH_2+H_2SO_4→{(CH_3—CH_2—NH_3)_2SO_4}↙{text»сульфат этиламмония»}$.
Основные свойства алифатических аминов выражены сильнее, чем у аммиака. Повышение электронной плотности превращает азот в более сильного донора пары электронов, что повышает его основные свойства:
2. Амины горят на воздухе с образованием углекислого газа, воды и азота:
$4CH_3NH_2+9O_2→4CO_2↑+10H_2O+2N_2↑$
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
Амины
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н+.
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H+.
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
C6H5-NO2 + 3Fe + 7HCl = [C6H5-NH3]+Cl- + 3FeCl2 + 2H2O
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
[C6H5-NH3]+Cl— + NaOH = C6H5-NH2 + NaCl + H2O
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
С6H5−Cl + 2NH3 → C6H5NH2 + NH4Cl
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
NH2CH2COOH + CH3OH → NH2CH2COOCH3+ H2O
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
NH2CH2COOH + HCl → [NH3CH2COOH]+Cl—
2. Взаимодействие с азотистой кислотой
NH2-CH2-COOH + HNO2 → НО-CH2-COOH + N2↑ + H2O
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
3. Алкилирование
NH2CH2COOH + CH3I → [CH3NH2CH2COOH]+I—
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
И аланина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
Cl-CH2-COOH + 2NH3 = NH2-CH2-COOH + NH4Cl
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
АМИНЫ
Амины – органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы:
R-NH2, R2NH, R3N
Простейший представитель – метиламин:
Строение
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота имеет два неспаренных электрона, что обуславливает свойства аминов как органических оснований.
КЛАССИФИКАЦИЯ АМИНОВ.
По количеству и типу радикалов, связанных с атомом азота:
|
АМИНЫ |
Первичные амины |
Вторичные амины |
Третичные амины |
|
Алифатические |
CH3— NH2 |
(CH3)2NH |
(CH3)3N |
|
Ароматические |
|
(C6H5)2NH |
|
НОМЕНКЛАТУРА АМИНОВ.
1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке. При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин (CH3)2NH Диметиламин
2. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
CH3-CH2-CH2-NH2 1-аминопропан H2N-CH2-CH2-CH(NH2)-CH3 1,3-диаминобутан
Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов анилин.
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
ИЗОМЕРИЯ АМИНОВ
1) углеродного скелета, начиная с С4H9NH2:
СН3-СН2— СН2-СН2 –NH2 н-бутиламин (1-аминобутан)
CH3-CH- СН2-NH2 изо-бутиламин (1-амин-2-метилпропан)
│
СН3
2) положения аминогруппы, начиная с С3H7NH2:
СН3-СН2— СН2-СН2 –NH2 1-аминобутан (н-бутиламин)
CH3-CH- СН2-СH3 2-аминобутан (втор-бутиламин)
│
NН2
3) изомерия между типами аминов – первичный, вторичный, третичный:
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой. Например:
|
Пропиламин (М=59) t кип = 49оС |
Бутан (М=58) t кип = -0,5оС |
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов:
|
Триэтиламин t кип = 89 °С |
н-Гексиламин tкип = 133 °С |
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения, т.к. в спиртах водородная связь более прочная:
|
Метиламин t кип = -6 °С |
Метанол t кип = +64,5 °С |
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Анилин: С6H5-NH2 – важнейший из ароматических аминов:
Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Анилин — бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит.
ПОЛУЧЕНИЕ АМИНОВ.
|
1. Первичные амины можно получить восстановлением нитросоединений. а) Гидрирование водородом: R-NO2 + H2 -t🡪 R-NH2 + H2O б) Восстановление: в щелочной и нейтральной среде получаются амины: R-NO2 + 3(NH4)2S 🡪 R- NH2 + 3S + 6NH3 +2H2O (реакция Зинина) R-NO2 + 2Al + 2KOH + 4H2O 🡪 R- NH2 + 2K[Al(OH)4] Восстановлением нитробензола получают анилин. в) в кислой среде (железо, олово или цинк в соляной кислоте) получаются соли аминов: R-NO2 + 3Fe + 7HCl 🡪 [RNH3+]Cl— + 2H2O + 3FeCl2 Амины из раствора выделяют с помощью щелочи: [RNH3+]Cl— +КОН = H2O + КCl + R- NH2 |
|
2. Алкилирование аммиака и аминов. При взаимодействии аммиака с алкилгалогенидами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин. Этот амин способен взаимодействовать с новой порцией галогеналкана с образованием вторичного амина: СH3Br + NH3 🡪 [CH3NH3]Br -(+KOH)🡪 CH3-NH2+ KBr + H2O первичный амин CH3-NH2 + C2H5Br 🡪 [CH3NH2+]Br— —(+KOH)🡪 CH3 — NH + KBr + H2O вторичный амин │ │ C2H5 C2H5 Возможно дальнейшее алкилирование до третичного амина. |
|
3.Восстановление нитрилов с образованием первичных аминов: R–C Этим способом в промышленности получают гексаметилендиамин, который используется в производстве полиамидного волокна найлон. |
|
4. Взаимодействие аммиака со спиртами: R-OH + NH3 -(t,p)🡪 R –NH2 + H2O |
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства.
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
Поэтому амины и аммиак обладают свойствами оснований.
|
1. Основные свойства. Будучи производными аммиака, все амины обладают основными свойствами. Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. Это объясняется тем, что радикалы СН3-, С2Н5— и др. проявляют положительный индуктивный (+I) эффект и увеличивают электронную плотность на атоме азота: СН3 → NH2 Это приводит к усилению основных свойств. Фенильный радикал C6H5— проявляет отрицательный мезомерный (-М) эффект и уменьшает электронную плотность на атоме азота: В водном растворе амины обратимо реагируют с водой, при этом среда становится слабощелочная: R-NH2 +H2O ⇄[R-NH3]++ OH— |
|
2. Амины реагируют с кислотами, образуя соли: CH3-NH2 + H2SO4 🡪 [CH3NH3]HSO4 C6H5NH2 + HCl 🡪 [C6H5NH3]Cl Cоли аминов — твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов). При действии щелочей на соли аминов выделяются свободные амины: [CH3NH3]Cl + NaOH -t🡪 CH3NH2 + NaCl + H2O Соли аминов вступают в обменные реакции в растворе: [CH3NH3]Cl + AgNO3 -t🡪 [CH3NH3]NO3+ AgCl ↓ |
|
3. Амины способны осаждать гидроксиды тяжелых металлов из водных растворов: 2R-NH2 + FeCl2 + 2H2O 🡪 Fe(OH)2↓+ 2[RNH3]Cl |
|
4. Горение. Амины сгорают в кислороде, образуя азот, углекислый газ и воду: 4 С2Н5NH2 + 15O2 🡪 8CO2 + 2N2 + 14 H2O |
|
5. Реакции с азотистой кислотой. а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты: R-NH2 + NaNO2 + HCl 🡪 R-OH +N2 + NaCl + H2O б) Вторичные амины (алифатические и ароматические) дают нитрозосоединения — вещества с характерным запахом: R2NH + NaNO2 + HCl 🡪 R2N-N=O + NaCl + H2O |
Особенности свойств анилина:
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены взаимным влиянием атомов.
— бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
— бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Аминогруппа — заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях электрофильного замещения в ароматическом ядре).
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).