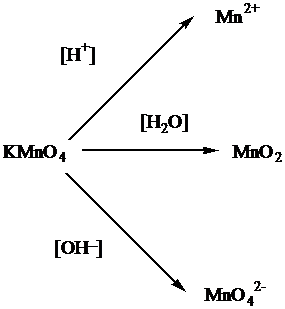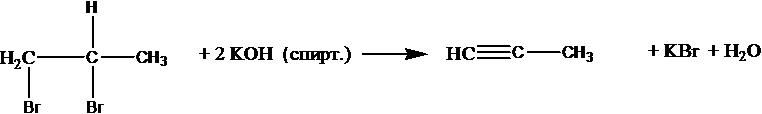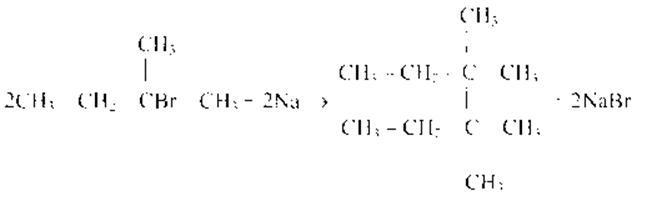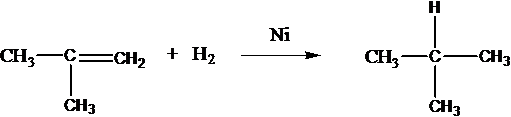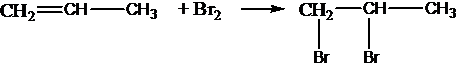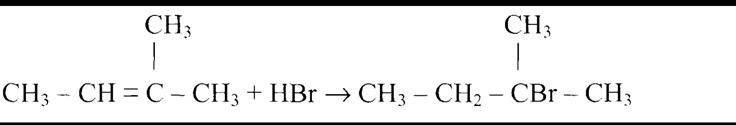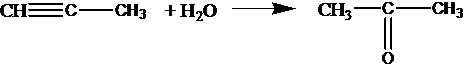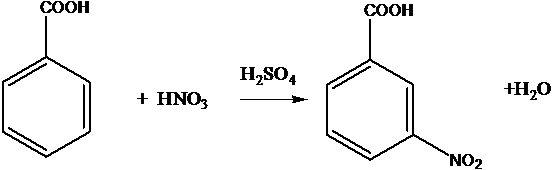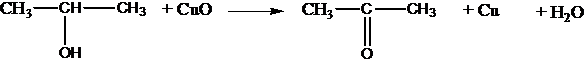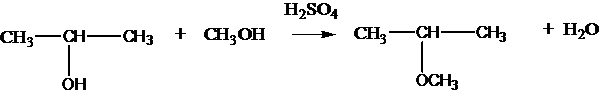Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Как показали результаты репетиционного экзамена по химии, наиболее трудными оказались задания, направленные на проверку знаний химических свойств веществ. К числу таких заданий можно отнести задание С3 – «Цепочка органических веществ», С2 – «Реакции между неорганическими веществами и их растворами».
При решении задания С3 «Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
Рассмотрим составление одного из таких окислительно-восстановительных уравнений:
СН3СНО X1
Чтобы составить уравнение окислительно-восстановительной реакции с участием органических веществ, нужно научиться определять степень окисления в органическом веществе по его структурной формуле. Для этого нужно иметь знания о химической связи, знать, что такое электроотрицательность.
Структурная формула помогает оценить смещение электронов по каждой из связей. Так атом углерода метильной группы (–СН3) сместит электрон по каждой из связей к себе. Таким образом, степень окисления углерода метильной группы будет равна (-3). Атом углерода карбонильной группы (СО) отдаст 2 электрона атому кислорода, но частично компенсирует недостачу, приняв 1 электрон от атома водорода. Следовательно, его степень окисления будет равна +1:
В продукте реакции степень окисления углерода метильной группы не изменится. Карбонильная группа атомов превратится в карбоксильную с замещенным водородом на натрий, вследствие щелочной среды (-СООNa). Атом углерода карбоксильной группы сместит два электрона в сторону карбонильного кислорода и один электрон в сторону кислорода замещенной гидроксильной группы. Таким образом, степень окисления атома углерода карбоксильной группы будет равна (+3):
Следовательно, одна молекула этаналя отдает 2 электрона:
С+1-2е=С+3
Рассмотрим теперь процессы, происходящие с перманганатом натрия. Обращает внимание, что в схеме дан перманганат натрия, а не калия. Свойства перманганата натрия должны быть аналогичны свойствам перманганта калия, который в зависимости от кислотности среды способен давать различные продукты:
Так как в нашем случае перманганат натрия используется в щелочной среде, то продуктом реакции будет манганат ион – MnO42-.
Определим степень окисления иона марганца в перманганате калия NaMnO4 пользуясь правилом равенства числа положительных и отрицательных зарядов в нейтральной структурной единице вещества. Четыре кислорода каждый по (-2) дадут восемь отрицательных зарядов, так как степень окисления у калия +1, то у марганца будет +7:
Na+1Mn+7O4-2
Записав формулу манганата натрия Na2MnO4, определим степень окисления марганца:
Na2+1Mn+6O4-2
Таким образом, марганец принял один электрон:
Mn+7+1e=Mn+6
Полученные уравнения позволяют определить множители перед формулами в уравнении химической реакции, которые называют коэффициентами:
С+1-2е=С+3 ·1
Mn+7+1e=Mn+6 ·2
Уравнение реакции приобретет следующий вид:
2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
Задание С2 требует от участника ЕГЭ знание свойств разнообразных свойств неорганических веществ, связанных с протеканием как окислительно-восстановительных реакций между веществами, находящимися как в одном, так и в различных агрегатных состояниях, так и обменных реакций протекающих в растворах. Такими свойствами могут быть некоторые индивидуальный свойства простых веществ и их соединений, например, реакция лития или магния с азотом:
2Li+3N2=2Li3N
2Mg+N2=Mg2N2
горение магния в углекислом газе:
Mg+CO2=MgO+CO
2Mg+CO2=2MgO+C
Особую трудность у учащихся вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3¯+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2¯+2Na2SO4+2CO2
Традиционно трудны для написания уравнения с участием комплексных соединений. Так растворы амфотерных гидроксидов в избытке щелочи обладают всеми свойствами щелочей. Они способны вступать в реакции с кислотами и кислотными оксидами:
Na[Al(OH)4]+HCl=NaCl+Al(OH)3¯+H2O
Na[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3¯
2Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3¯+H2O
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
На экзамене желательно помнить об окислительных свойствах солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Традиционно вызывают затруднения, связанные с проявлением основных свойств раствором аммиака. В результате чего могут протекать обменные реакции в водных растворах:
MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
В заключение приведем серию уравнений химических реакций, которые нужно знать участникам ЕГЭ по химии:
ОБЩАЯ ХИМИЯ
Кислоты. Основания. Соли. Оксиды.
Кислотные оксиды (кроме SiO2) реагируют с водой, как амфотерным оксидом с образованием кислот:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Для получения азотной кислоты азот оксид азота (IV) должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О = 4HNO3
Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту:
NaCl + H2SO4 = NaHSO4 + HCl
Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту:
NaBr+ H3PO4 = NaH2PO4 + HBr
Кислоты реагируют с металлами, стоящими в ряду напряжений до водорода:
Fe + 2 HCl = FeCl2 + H2
И их оксидами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Обратите внимание на валентность переходных элементов в солях.
Щелочные и щелочноземельные металлы взаимодействуют с водой:
K + H2O = KOH + ½ H2
В условиях избытка кислоты могут образовываться и кислые соли:
2Н3РО4 + 2Na = 2NaH2PO4 + Н2
Органические кислоты также проявляют кислотные свойства:
2СН3СООН + 2Na = 2CH3COONa + Н2
СНзСООН + NaOH = CH3COONa + Н2О
Комплексные гидроксиды реагируют с кислотами с образованием солей и воды:
Na[Al(OH)4] + HCl = AlCl3 + 4H2O + NaCl
LiOH + HNO3 = LiNO3 + H2O
Многоосновные кислоты в реакции с гидроксидами могут образовывать кислые соли:
Н3РО4 + КОН = КН2РО4 + Н2О
Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль:
NH3 + H3PO4 = NH4H2PO4
Обратим внимание на свойства оснований, их взаимодействие с кислотами:
2Н3РО4 + ЗСа(ОН)2 = Са3(РО4)2¯ + 6Н2О
с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3¯ + H2O
2Ca(OH)2 + CO2=(СaOH)2CO3+H2O
Реакция гидроксидов с кислотными оксидами может приводить и к кислым солям:
KOH + CO2 = KHCO3
Основные оксиды реагируют с амфотерными оксидами:
CaO + H2O = Ca(OH)2
Средние соли в воде реагируют с кислотными оксидами с образованием кислых солей:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Более сильные кислоты вытесняют более слабые из их солей:
CH3COONH4 + HCl = CH3COOH + NH4Cl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
Кислоты в присутствии серной кислоты реагируют со спиртами с образованием сложных эфиров:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Более сильное основание вытесняет более слабое из его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH = MgOHCl + KCl
NH4С1 + NaOH = NaCl + NH3 + H2O
Чтобы получить из основной соли получить среднюю соль нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
Гидроксиды металлов (кроме щелочных металлов) разлагаются при нагревании в твердом виде до оксидов:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Гидрокарбонаты при нагревании разлагаются до карбонатов:
2KHCO3 = K2CO3 + H2O + CO2
Нитраты обычно разлагаются до оксидов (обратите внимание на повышение степени окисления переходного элемента находящегося в промежуточной степени окисления):
2Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2Fe(NO3)3 ® Fe2O3 + 6NO2 + 1,5 O2
2Cu(NO3)2 = 2CuO + 4NO2 + О2
Нитраты щелочных металлов разлагаются до нитритов:
NaNO3 = NaNO2 + ½ O2
Карбонаты металлов (кроме щелочных) разлагаются до оксидов:
CaCO3 = CaO + CO2
При составлении уравнений реакций ионного обмена пользуйтесь таблицей растворимости:
K2SO4 + BaCl2 = BaSO4¯ + 2KCl
[C6H5-NH3]C1 + AgNО3 = [C6H5NH3]NO3 + AgCl¯
Электролиз
Электролиз расплавов солей:
2KCl = 2K + Cl2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода:
2HgSO4 + 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде: Hg2+ + 2e = Hg°
2) на аноде: 2Н2О – 4е = О2 + 4Н+
Электролиз раствора сульфата натрия
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I— — 2e = I2
Сравните свойства одноэлементных и кислородсодержащих анионов.
Химические реакции, возможные при электролизе сульфата хрома (III):
1)Сг3+ + e = Сг2+
2) Cr2+ + 2e = Сг°
3) Сг3+ + 3 e= Сг°
4) 2Н+ + 2e = Н2
Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O = CH3CH3 + 2CO2 + H2 + 2NaOH
Гидролиз
Пример взаимного гидролиза солей:
A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2 + 3K2SO4
Амфотерность
Амфотерные гидроксиды растворяются в водных растворах щелочей:
A1(OH)3 + 3KOH = K3[A1(OH)6]
A1(OH)3 + KOH = K[Al(OH)4]
реагируют с твердыми щелочами при сплавлении:
Al(OH)3 + KOH KAlO2 + 2H2O
Амфотерные металлы реагируют с водными растворами щелочей:
Al + NaOH + 3H2O = Na[Al(OH)4] + 3/2 H2
Продукт сплавления амфотерного гидроксида со щелочью легко разлагается водой:
KAlO2 + 2H2O = KOH + Al(OH)3¯
Комплексные гидроксиды реагируют с кислотами:
K[Al(OH)4] + HCl =KCl + Al(OH)3¯ + H2O
Бинарные соединения
Способ получения:
СаО + 3С = СаС2 + СО
Бинарные соединения реагируют с кислотами:
Al2S3 + 3H2SO4 := Al2(SO4)3 + 3H2S
Mg3N2 + 8HNO3 = Mg(NO3)2 + 2NH4NO3
и водой:
A14C3 + 12Н2О = 4А1(ОН)3 + ЗСН4
PCl3 + H2O = 3H3PO3 + 3HCl
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Азот
Азотная кислота является сильным окислителем:
окисляют неметаллы:
ЗР + 5HNO3 + 2Н2О = Н3РО4 + 5NO
P + 5HNO3 = H3PO4 + 5NO2 + H2O
металлы:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5H2O
оксиды переходных металлов в промежуточных степенях окисления:
3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO+ 7H2O (возможно выделение NО2)
оксиды азота также проявляют окислительные свойства:
5N2O + 2P = 5N, + P2O
но по отношению к кислороду являются восстановителями:
2NO + O2 = 2NO2
Азот реагирует с некоторыми простыми веществами:
N2+3H2= 2NH3
N2 + O2 = 2NO
3Mg + N2 = Mg3N2
Галогены
обычно проявляют окислительные свойства:
PH3 + 4Br2 + 4Н2О = Н3РО4 + 8НВг
2P + 5Cl2 = 2PCl5
2P + 3PCl5 = 5PCl3
PH3 + 4Br2 + 4H2O = H3PO4 + 8HBr
Cl2 + H2 = 2HCl
2HCl + F2 = 2HF + Cl2
2NH3 + 3Br2 = N2 + 6HBr
Галогены в растворах щелочей диспропорционируют при комнатной температуре:
Cl2 + 2KOH = KCl + H2O + KClO
и при нагревании:
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Окислительные свойства перманганата калия:
5Н3РО3 + 2КМnО4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5Н3РО4 + ЗН2О
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
Сера
реагирует с простыми веществами:
S + O2 = SO2
3S + 2А1 = A12S3
оксид серы (IV) может быть доокислен кислородом:
2SO2 + O2 = 2SO3
2SO2 + O2 + 2H2O = 2H2SO4
и выступать в роли окислителя:
SO2 + 2H2S = 3S + 2H2O
Концентрированная серная кислота проявляет окислительные свойства:
Cu + H2SO4 = CuSO4 + SO2 +2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Фосфор
получение фосфора:
Са3(Р04)2 + 5С + 3SiO2 = 3CaSiO3 + 5СО + 2Р
Металлы
реагируют с галогенами:
2Fe + 3Cl2 = 2FeCl3
Алюминий без оксидной пленки растворяется в воде:
Al (без оксидной пленки) + Н2О = Al(OH)3 + 3/2 H2
методы получения металлов:
Fe2O3 + CO = 2FeO + CO2
FeO + CO = Fe + CO2
CuO + H2 = Cu + H2O
Гидроксид железа (II) может быть легко доокислен пероксидом водорода:
2Fe(OH)2 + H2O2 = 2Fe(OH)3
обжиг пирита:
2FeS2 + O2 = Fe2O3 + 4SO2
ОРГАНИЧЕСКАЯ ХИМИЯ
Горение органических веществ
2С10Н22 + 31O2 = 20CО2 + 22H2О
Алканы
Методы получения алканов из простых веществ:
С + 2H2 = CH4
сплавлением солей щелочных металлов с щелочами:
СН3СООК + КОН ® СН4 + К2СО3
Химические свойства алканов — промышленное окисление метана:
CH4 + O2 = CH2O + H2O
Взаимодействие алканов с галогенами:
С2Н6 + Сl2 С2Н5Сl + НСl
Изомеризация алканов:
Галогеналканы
Реакция со спиртовыми растворами щелочей:
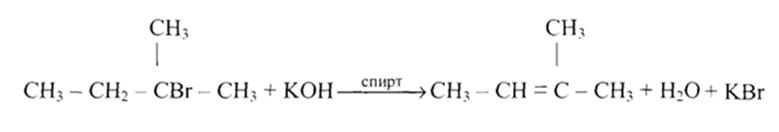
С6Н5-СНВг-СН3 + КОН  С6Н5СН=СН2 + КВг + Н2О
С6Н5СН=СН2 + КВг + Н2О
с водными растворами щелочей:
С6Н5-СНВг-СН3 + КОН (водн.) ® С6Н5-СНОН-СН3 + KBr
C6H5Br + KOH ® C6H5OH + KBr
По правилу Зайцева водород отщепляется от наименее гидрированного атома
Из дигалогеналканов можно получить алкины:
Реакция Вюрца:
Алкены
Присоединяют водород:
присоединяют галогены:
присоединяют галогенводороды:
присоединят воду:
СН2=СН2 + Н2О ® СН3СН2ОН
С водным раствором перманганата калия без нагревания образуют гликоли (двухатомные спирты)
ЗС6Н5СН=СН2 + 2КМnО4 + 4Н2О ® ЗС6Н5СН(ОН)-СН2ОН + MnO2¯ + 2KOH
Алкины
промышленный способ получения ацетилена
2СН4 ® С2Н2 + ЗН2
карбидный способ получения ацетилена:
CaC2 + 2H2O = Ca(OH)2 + C2H2
реакция Кучерова — альдегид можно получить только из ацетилена:
С2Н2 + Н2О СН3СНО
Реакция алкинов с концевой тройной связью с аммиачным раствором оксида серебра:
2CH3-CH2-CºCH + Ag2O 2CH3-CH2-CºCAg +H2O
использование полученных продуктов в органическом синтезе:
CH3-CH2-CºCAg + C2H5Br ® CH3-CH2-CºC-C2H5 + AgBr
Бензол и его производные
Получение бензола из алкенов:
из ацетилена:
3C2H2 C6H6
Нитрование бензола и его производных в присутствие серной кислоты
C6H6 + HNO3 ® C6H5-NO2 + H2O
карбоксильная группа является ориентантом второго рода
реакция бензола и его производных с галогенами:
C6H6 + Cl2 C6H5Cl + HCl
С6Н5С2Н5 + Вг2 С6Н5-СНВг-СН3 + НВг
галогеналканами:
C6H6 + С2Н5С1 C6H5C2H5 + НС1
алкенами:
C6H6 + CH2=CH-CH3 ® C6H5-CH(CH3)2
Окисление бензола перманганатом калия в присутствии серной кислоты при нагревании:
5C6H5-CH3 + 6KMnO4 + 9H2SO4 = 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
Спирты
Промышленный способ получения метанола:
CO + 2H2 = CH3OH
при нагревании с серной кислотой в зависимости от условий могут образовываться простые эфиры:
2С2Н5OH C2Н5ОС2Н5 + Н2О
или алкены:
2С2Н5OH CH2=CH2 + H2O
спирты реагируют с щелочными металлами:
С2Н5OH + Na ® C2H5ONa + ½ H2
с галогенводородами:
СН3СН2ОН + НСl ® CH3CH2Cl + H2O
с оксидом меди (II):
СН3СН2ОН + СuO ® CH3CHO + Cu + H2O
более сильная кислота вытесняет более слабые из их солей:
C2H5ONa + HCl ® C2H5OH + NaCl
при нагревании смеси спиртов с серной кислотой образуются несимметричные простые эфиры:
Альдегиды
Образуют с аммиачным раствором оксида серебра серебряное зеркало:
CH3CHO + Ag2O CH3COONH4 + 2Ag
реагируют со свежеосажденным гидроксидом меди (II):
CH3CHO + 2Cu(OH)2 ® CH3COOH + 2CuOH + H2O
могут быть восстановлены до спиртов:
CH3CHO + H2 ® CH3CH2OH
окисляются перманганатом калия:
ЗСН3СНО + 2КМnО4® 2СН3СООК + СН3СООН + 2МnО2 + Н2О
Амины
можно получить восстановлением нитросоединений в присутствии катализатора:
C6H5-NO2 + 3H2 = C6H5-NH2 + 2H2O
реагируют с кислотами:
C6H5-NH2 + HC1 =[C6H5-NH3]C1
Углеводы
Глюкозу можно получить гидролизом крахмала или целлюлозы:
(С6Н10О5)n + n H2O = nC6H12O6
Для глюкозы характерно спиртовое брожение:
C6H12O6 ® 2C2H5OH + 2CO2
молочнокислое брожение:
C6H12O6 ® 2СН3СН(ОН)СООН
реакция серебряного зеркала:
C6H12O6+Ag2O 2Ag¯+C6H12O7
Аминокислоты
Аминокислоты реагируют как с кислотами:
H2N-CH-COOH+HCl ® Cl— H3N+-CH-COOH
так и c щелочами:
H2N-CH-COOH+NaOH ® H2N-CH-COONa+H2O
соли аминокислот также способны участвовать в реакциях обмена в водном растворе:
Cl— H3N+-CH-COOH+NaOH ® H2N-CH-COOH +NaCl + H2O
Cl— H3N+-CH-COOH+2NaOH ® H2N-CH-COONa +NaCl + 2H2O
H2N-CH-COONa+HCl ® H2N-CH-COOH +NaCl
H2N-CH-COONa+2HCl ® Cl— H3N+-CH-COOH +NaCl
Получение одноатомных cпиртов
Гидратация алкенов
В присутствии сильных минеральных кислот, алкены вступают в реакцию гидратации с образованием спиртов:
В случае несимметричных алкенов присоединение происходит в соответствии с правилом Марковникова – атом водорода молекулы воды присоединяется к более гидрированному атому углерода, а гидрокси-группа к менее гидрированному при двойной связи:
Гидрирование (восстановление) альдегидов и кетонов
Гидрирование альдегидов на металлических катализаторах (Pt, Pd или Ni) при нагревании приводит к образованию первичных спиртов:
В аналогичных условиях из кетонов получаются вторичные спирты:
Гидролиз сложных эфиров
При действии на сложные эфиры сильных минеральных кислот они подвергаются гидролизу с образованием спирта и карбоновой кислоты:
Гидролиз сложных эфиров в присутствии щелочей называют омылением. Данный процесс является необратимым и приводит к образованию спирта и соли карбоновой кислоты:
Данный процесс протекает по действием на моногалогенпроизводные углеводородов водного раствора щелочи:
Другие способы получения отдельных представителей одноатомных спиртов
Спиртовое брожение глюкозы
В присутствии некоторых дрожжей, точнее под действием вырабатываемых ими ферментов, возможно образование этилового спирта из глюкозы. При этом в качестве побочного продукта образуется также углекислый газ:
Получение метанола из синтез-газа
Синтез-газом называют смесь угарного газа и водорода. Действием на данную смесь катализаторов, нагрева и повышенных давлений в промышленности получают метанол:
Получение многоатомных спиртов
Реакция Вагнера (мягкое окисление алкенов)
При действии на алкены нейтрального раствора перманганата калия на холоду (0oC) образуются вицинальные двухатомные спирты (диолы):
Схема, представленная выше, не является полноценным уравнением реакции. В таком виде ее проще запомнить, для того чтобы суметь ответить на отдельные вопросы тестовые вопросы ЕГЭ. Однако, если данная реакция попадется в заданиях высокой сложности, то ее уравнение обязательно нужно записывать в полном виде:
Хлорирование алкенов с последующим гидролизом
Данный метод является двустадийным и заключается в том, что на первой стадии алкен вступает в реакцию присоединения с галогеном (хлором или бромом). Например:
А на второй, полученный дигалогеналкан подвергается обработке водным раствором щелочи:
Получение глицерина
Основным промышленным способом получения глицерина является щелочной гидролиз жиров (омыление жиров):
Получение фенола
Трехстадийный метод через хлорбензол
Данный метод является трехстадийным. На первой стадии осуществляют бромирование или хлорирование бензола в присутствии катализаторов. В зависимости от используемого галогена (Br2 или Cl2) в качестве катализатора используется соответствующий галогенид алюминия или железа (III)
На второй стадии полученное выше галогенпроизводное обрабатывается водным раствором щелочи:
На третьем этапе фенолят натрия обрабатывается сильной минеральной кислотой. Фенол вытесняется поскольку является слабой кислотой, т.е. малодиссоциирующим веществом:
Окисление кумола
Получение альдегидов и кетонов
Дегидрирование спиртов
При дегидрировании первичных и вторичных спиртов на медном катализаторе при нагревании получаются альдегиды и кетоны соответственно
Окисление спиртов
При неполном окислении первичных спиртов получаются альдегиды, а вторичных – кетоны. В общем виде схемы такого окисления можно записать как:
и
Как можно заметить неполное окисление первичных и вторичных спиртов приводит к тем же продуктам, что и дегидрирование этих же спиртов.
В качестве окислителей можно использовать оксид меди при нагревании:
Или другие более сильные окислители, например раствор перманганата калия в кислой, нейтральной, или щелочной среде.
Гидратация алкинов
В присутствии солей ртути (часто вместе с сильными кислотами) алкины вступают в реакцию гидратации. В случае этина (ацетилена) образуется альдегид, в случае любого другого алкина — кетон:
Пиролиз солей карбоновых кислот двухвалентных металлов
При нагревании солей карбоновых кислот двухвалентных металлов, например, щелочно-земельных, образуется кетон и карбонат соответствующего металла:
Гидролиз геминальных дигалогенпроизводных
Щелочной гидролиз геминальных дигалогенпроизводных различных углеводородов приводит к альдегидам если атомы хлора были прикреплены к крайнему атому углерода и к кетонам,если не к крайнему:
Каталитическое окисление алкенов
Каталитическим окислением этилена получают ацетальдегид:
Получение карбоновых кислот
Каталитическое окисление алканов
Окисление алкенов и алкинов
Для этого чаще всего используют подкисленный раствор перманганата или дихромата калия. При этом происходит разрыв кратной углерод-углеродной связи:
Окисление альдегидов и первичных спиртов
В этом способе получения карбоновых кислот также наиболее распространенные используемые окислители это подкисленный раствор перманганата или дихромата калия:
С помощью гидролиза тригалогензамещенных углеводородов
На первой стадии тригалогеналкан подвергается обработке водным раствором щелочи. При этом образуется соль карбоновой кислоты:
На второй стадии следует обработка соли карбоновой кислоты сильной минеральной кислотой. Т.к. карбоновые кислоты являются слабыми они легко вытесняются сильными кислотами:
Гидролиз сложных эфиров
Из солей карбоновых кислот
Данная реакция уже была рассмотрена при получении карбоновых кислот посредством гидролиза тригалогенпроизодных (см. выше). Заключается в том, что карбоновые кислоты, являясь слабыми, легко вытесняются сильными неорганическими кислотами:
Специфические методы получения кислот
Получение муравьиной кислоты из угарного газа
Данный метод является промышленным и заключается в том, что на первой стадии угарный газ под давлением при высоких температурах реагирует с безводной щелочью:
а на второй полученный формиат обрабатывают сильной неорганической кислотой:
2HCOONa + H2SO4 > 2HCOOH + Na2SO4
Получение высших карбоновых кислот гидролизом жиров
Данный метод является основным для получения высших карбоновых кислот:
Получение бензойной кислоты окислением гомологов бензола
Автор: С.И. Широкопояс https://scienceforyou.ru/
Задание:
изучите
материал, напишите уравнения реакций по схемам, расставьте коэффиценты.
Аммиак
—
NH3
1. Строение молекулы
— структура треугольной пирамиды;
— атом азота в sp3-гибридизации;
— одна неподеленная электронная пара на атоме азота;
— химическая связь ковалентная полярная, в жидком
состоянии между молекулами водородные связи;
— с.о. на атоме азота = -3.
2.
Физические свойства
Бесцветный
газ с резким запахом («нашатырного спирта»), в 14,5 раз легче воздуха, очень
хорошо растворимый в воде (в 1 V Н2О – 700 V NH3 при
комн. t)
Аммиачная вода — 18,5 – 25%-ный раствор
Нашатырный спирт – 3 – 10%-ный
3. Получение
В
промышленности – синтез из простых веществ (обратимая,
экзотермическая, каталитическая)
Азот +
водород ®
Сырье — азотоводородная
смесь
(азот – фракционная перегонка жидкого воздуха, водород – конверсия метана(из
природного газа)) подвергают тщательной очистке
Условия:р=25*106
Па (300 атм.), Т=450-500 0С, кат. – губчатое Fe, Pt.
Давление
азотоводородной смеси создается при помощи турбокомпрессора. Реакцию проводят в
колене синтеза. Теплоту, выделяющуюся при реакции используют для прогревания
смеси азота и водорода (принцип теплообмена).
Образующиеся NH3 и
непрореагировавшие газы поступают в холодильник (NH3 сжижается)
=> сепаратор
(отделяется от непрореагировавших газов) ==> склад готовой продукции.
Оставшаяся смесь с
помощью циркуляционного компрессора с новой порцией сырья в колонну синтеза (принцип
циркуляции) (h(NH3) = 95%).
В
лаборатории – нагревание солей аммония со щелочью
Хлорид аммония +
гидроксид кальция ®
Собирают методом
вытеснения воздуха в перевернутый сосуд, доказательство наличия (посинение
влажной индикаторной бумаги, по запаху, «дым без огня»)
4. Химические
свойства
1) с водой
NH3(г) + H2O ↔ NH3
* H2O (р)↔ NH4++ OH–
слабое
основание, среда
раствора – щелочная, изменяет окраску индикаторов
2) с кислотами ® соли аммония (хим.связь образуется по донорно-акцепторному
механизму)
NH3
+ соляная кислота ® NH3 +
серная кислота ®
NH3
+ серная кислота(изб) ® NH3 + СО2
+ Н2О ®
NH3
+ СО2(изб) + Н2О ® NH3
+ фосфорная к-та ®
NH3
+ уксусная кислота ® NH3 +
уксусная к-та ®(при
t)
3) c
кислородом
NH3
+ кислород ®
(сгорание)
NH3
+ кислород ®
(каталитическое окисление, кат Pt)
4)
восстанавливает малоактивные металлы из их оксидов при нагревании
аммиак
+ оксид меди (II) ®
5) с
растворами солей, если образуется ¯
Аммиак
+ вода + сульфат железа (III) ®
Аммиак
+ вода + хлорид хрома (III) ®
6)
комплексообразование (донорно-акцепторн мех-зм)
Сульфат
меди (II) + аммиак ®
Гидроксид
меди (II) + аммиак ®
Нитрат
серебра + аммиак + вода ®
Хлорид
серебра + аммиак ®
6) с
различными окислителями – восстановительные свойства
(чаще до N2)
Аммиак
+ хлор ®
Аммиак
+ пероксид водорода ®
Аммиак
+ перманганат калия ®
7) с
активными металлами ® амиды или нитриды
NH3
+ Na ®
NaNH2 + H2O
NH3
+ Mg®
Mg3N2 + H2O
Амиды и нитриды
легко гидролизуются
NaNH2 + H2O ®
Mg3N2
+ H2O ®

углекислым газом ®
карбамид или мочевина
NH3 + СО2 ® (NH2)2СО
+ H2O
9) с
органическими веществами
+
карбоновые кислоты ®
+
спирты ®
+
галогеналканы ®
+
хлорбензол ®
+
хлоруксусная кислота ®
5. Качественные реакции – образование
белого «дыма» при контакте с газообразным HCl, почернение бумажки,
смоченной раствором Hg2(NO3)2.
6. Применение
Промежуточный продукт при синтезе азотной
кислоты и солей аммония. Применяется в производстве соды,
азотных удобрений (аммиачная селитра – NH4NO3.мочевины (NH2)2СО
и др), красителей, взрывчатых веществ, уротропина, синтетических волокон (нейлона и капрона), в медицине, в быту. Жидкий аммиак в качестве хладагента в промышленных холодильных установках,
в качестве отбеливателя при очистке и крашении хлопка, шерсти и шелка.
Содержание
- Щелочной или кислотный гидролиз бинарных соединений
- Гидролиз
- Обратимый гидролиз солей
- Необратимый гидролиз
- Факторы, влияющие на степень гидролиза:
Щелочной или кислотный гидролиз бинарных соединений
Для школьного курса – экзотическая вещь, но вот в ЕГЭ-2014 встретилось… Речь идет о таких, например, реакциях:
Здесь можно рассуждать так. Щелочь (NaOH) или кислота (HCl) реагируют с бинарным соединением в растворе. А это значит, что фактически сначала идет реакция с водой (гидролиз бинарного соединения):
А затем продукты гидролиза реагируют с щелочью (в первом случае) или с кислотой (во втором случае):
В итоге уравнения будут выглядеть так:
Задача 3.2 Рассуждая аналогично, определите, что получится при взаимодействии:
Аммиак и его свойства
Аммиак реагирует с кислотами, присоединяя протон по донорно-акцепторному механизму и образуя при этом соли аммония.
Задача 4.1. Через раствор серной кислоты пропустили аммиак. Какие две соли при этом могут образоваться? От чего это зависит? Напишите уравнения реакций.
Водный раствор аммиака обладает свойствами слабой щелочи, поэтому с его помощью можно осаждать нерастворимые гидроксиды металлов.
Задача 4.2. Через водный раствор сульфата хрома (III) пропустили избыток аммиака. Запишите уравнение реакции.
3) Аммиак – восстановитель. В частности, способен восстанавливать металлы из оксидов.
Задача 4.3. Через оксид меди (II) пропустили поток аммиака при нагревании. Напишите уравнение реакции.
4) Аммиак способен быть лигандом и может образовывать комплексы – аммиакаты. Особенно вероятно упоминание в ЕГЭ аммиачного комплекса меди, так как он имеет ярко-синее окрашивание и может использоваться для обнаружения соединений двухвалентной меди.
Задача 4.4. К раствору сульфата меди (II) добавили избыток водного раствора аммиака. Запишите уравнение реакции.
Реакции комплексных соединений
Включать в ЕГЭ такие задания – это подлость, так как химия комплексных соединений в школе не изучается. Но что делать…
Попробуем запомнить хоть немного:
1) гидроксокомплексы разрушаются кислотами и кислотными оксидами
При небольшом количестве кислоты — реагирует только внешняя сфера:
При избытке кислоты реагирует и внешняя сфера и комплексообразователь:
Углекислый газ, будучи слабой кислотой, реагирует только со внешней сферой:
(кислая соль получается, так как реакция идет при избытке углекислого газа)
2) аммиачные комплексы разрушаются кислотами, которые связывают аммиак в прочные ионы аммония:
3) комплексы также могут реагировать, если комплексообразователь переходит во что-нибудь устойчиво-нерастворимое:
4) при нагревании комплексы могут разлагаться с удалением летучих лигандов:
Попробуйте запомнить хотя бы эти примеры и увидеть в них некие закономерности. Будем надеяться, что этого хватит. А вот упражнения:
Задача 5.1 Закончите уравнения реакций с участием комплексов:
Восстановительные свойства иона I —
Ион иода (I — ) (например: HI, NaI, KI) в большинстве реакций участвует не в реакциях обмена, а является восстановителем.
в реакции FeCl3 + KI получается вовсе не FeI3 и KCl, а идет восстановление трехвалентного железа до двухвалентного:
Задача 6.1 Запишите уравнения реакций:
С наибольшей скоростью реагируют между собой…
Вообще с наибольшей скоростью идут те реакции, которые сопровождаются взрывами. А при обычных условиях – реакции ионного обмена в водных растворах. Почему? Потому что в них участвуют электролиты, которые уже диссоциированы, связи разрушены. Поэтому ничто не мешает ионам моментально соединиться между собой. Можно считать, что активационный барьер такой реакции приближается к нулю.
Какие вещества реагируют между собой с наибольшей скоростью при комнатной температуре:
1) HCl(p-p) и NaOH(p-p)
Правильный ответ – 1), так как это реакция ионного обмена.
Железо образует смешанный оксид – железную окалину Fe3O4 (FeO ∙ Fe2O3) со степенями окисления +2 и +3.
Свинец образует смешанный оксид – сурик Pb3O4 (2PbO ∙ PbO2) со степенями окисления +2 и +4.
При реакциях этих оксидов с кислотами могут получаться сразу две соли:
Переходы Fe +2 ↔ Fe +3 и Cu +1 ↔ Cu +2
Вот несколько сложных ситуаций:
Казалось бы, должны получиться две соли и вода: Fe(NO3)2 + Fe(NO3)3 + H2O (смотри предыдущий раздел), но HNO3 – сильный окислитель, поэтому будет окислять железо +2 в составе железной окалины до железа +3 и получится только одна соль:
Аналогично в реакции Cu2O + HNO3 может показаться, что продуктами будут CuNO3 + H2O. А на самом деле одновалентная медь (Cu +1 2O) может окисляться до двухвалентной, поэтому пойдет окислительно-восстановительная реакция:
Задача 7.1. Запишите уравнения реакций:
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Источник
Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой , гидролизуются ПО АНИОНУ .
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH — . Водородный показатель такого раствора рН>7 .
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой , гидролизуются ПО КАТИОНУ . Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
или в молекулярной форме:
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н + . Водородный показатель такого раствора рН .
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой , гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ .
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7 . Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой , в водных растворах НЕ ИДЕТ .
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
- Некоторые соли необратимо гидролизуются с образованием оксосолей :
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза .
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Источник
| Соединение, функциональная группа | Реагент | Что наблюдается, уравнение реакции |
|
Алкены >C=C< |
Водный раствор KMnO4 |
Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка диоксида марганца бурого цвета 3 >C=C< + 2KMnO4 + 4H2O → 3 >C(OH)-C(OH)< + 2MnO2↓ + 2KOH |
| Раствор Br2 в органическом растворителе или воде (бромная вода) |
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции: >C=C< + Br2 → >C(Br)-C(Br)< |
|
| Алкины -С≡С- | Раствор Br2 в органическом растворителе или воде (бромная вода) |
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции: R-С≡С-R’ + 2Br2 → R-CBr2-CBr2-R’ |
|
Водные растворы аммиачных комплексов Ag(I), например, аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Алкины с тройной связью на конце молекулы дают желтый осадок: R-С≡СН + [Ag(NH3)2]OH → R-С≡СAg↓ + 2NH3 + H2O Алкины, у который при тройной связи нет атомов водорода в такую реакцию не вступают |
|
|
Водный раствор аммиачных комплексов одновалентной меди Cu(I), например, аммиачный раствор оксида меди (I) [Cu(NH3)2]OH |
Алкины с тройной связью на конце молекулы дают красный осадок : R-С≡СН + [Cu(NH3)2]OH → R-С≡СCu↓ + 2NH3 + H2O Алкины, у которых при тройной связи нет атомов водорода в такую реакцию не вступают, что позволяет отличить их друг от друга |
|
| Бензол | Нитрующая смесь – смесь конц. азотной и серной кислот |
Образование желтой жидкости с запахом горького миндаля на дне реакционной смеси |
| Гомологи бензола | Нейтральный водный раствор KMnO4 |
При кипячении с каким-либо гомологом бензола водный раствор перманганата калия обесцвечивается и выпадает бурый осадок оксида марганца (IV). На примере с толуолом и этилбензолом реакции выглядят следующим образом: C6H5CH3 +2KMnO4 = C6H5COOK + 2MnO2↓ + KOH + H2O (при кипячении) C6H5CH2CH3 + 4KMnO4 = C6H5COOK + K2CO3 + 2H2O + 4MnO2↓ + KOH (при нагревании) |
| Подкисленный водный раствор перманганата калия KMnO4(водн.), H+ |
Постепенное обесцвечивание подкисленного раствора KMnO4. Выпадения бурого осадка MnO2 не наблюдается, поскольку марганец восстанавливается до практически бесцветной соли двухвалентного марганца. Чаще всего в качестве подкислителя изпользуют серную кислоту. На примере с толуолом реакция выглядит следующим образом: 5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 6MnSO4 + 3K2SO4 +14H2O |
|
| Фенол | Бромная вода |
Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка трибромфенола: |
|
Разбавленный водный раствор соли железа (III), например, FeCl3 |
Светло-желтая окраска разбавленного раствора соли трехвалентного железа сменяется на фиолетовую | |
| Анилин | Бромная вода |
Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка триброманилина: |
|
Одноатомные первичные и вторичные спирты CH3OH, C2H5OH, (CH3)2CH-OH и т.д. |
Оксид меди (II) CuO |
Черный CuO при нагревании со спиртом изменяет свою окраску на красную в связи с восстановлением до Cu0. Первичный спирт при этом превращается в альдегид: R-CH2-OH + CuO =to=> R-CHO + Cu + H2O, вторичный — в кетон: R-C(OH)-R’+ CuO =to=> R-C(O)-R’ + Cu + H2O, В случае метанола появляется легко узнаваемый запах формальдегида (естественно, чтобы он был узнаваемым, нужно до этого быть знакомым с его запахом:-) ) В случае реакции с CuO этилового спирта чувствуется специфический запах ацетальдегида, схожий с ароматом прелых яблок сорта «антоновка» |
| Многоатомные спирты | Свежеосажденный Cu(OH)2 (II) |
Растворение голубого осадка Cu(OH)2 с образование ярко-синего раствора комплексного соединения меди. На примере с глицерином уравнение реакции выглядит следующим образом: |
|
Альдегиды, —CHO |
Аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Так называемая реакция серебряного зеркала. В результате восстановления Ag+1 в металлическое серебро Ag0 на стенках сосуда образуется зеркало. При небрежном смешении реагентов или в недостаточно чистом сосуде вместо серебряного зеркала может образоваться черный осадок, состоящий из мелкодисперсных частиц металлического серебра. В обоих случаях наблюдаемые явления описываются уравнением в общем виде: R-CHO + 2[Ag(NH3)2]OH = R-СООNH4 + 2Ag↓ + 3NH3↑ + H2O |
|
Свежеосажденный Cu(OH)2 |
Образование оранжево-красного осадка Cu2O при нагревании в результате реакции: R-CHO + 2Cu(OH)2 = R-COOH + Cu2O↓ + 2H2O |
|
|
Карбоновые кислоты, -COOH |
Лакмус | Окрашивание лакмуса в красный цвет |
| Карбонаты, например, K2CO3 |
Выделение углекислого газа в результате разложения образующейся нестойкой угольной кислоты H2CO3: 2R-COOH + CO32- → CO2 + H2O + R-COO— |
|
| Спирт + конц. H2SO4 |
Появление запаха сложного эфира, образующегося в результате реакции: R-COOH + R’-OH → R-COO-R’ + H2O Запахи эфиров весьма разнообразны, но общим является ярко выраженная пахучесть, нередко, могут напоминать ароматы различных фруктов. |
|
|
Муравиная кислота -СНО и -СООН |
Лакмус |
Окрашивание лакмуса в красный цвет, по причине кислой среды, создаваемой муравьиной кислотой: HCOOH ↔ HCOO— + H+ |
|
Аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Молекуле муравьиной кислоты, не смотря на ее малый размер удается сочетать в себе помимо карбоксильной группы также и карбонильную, которая позволяет вступать муравьиной кислоте в реакцию серебряного зеркала подобно альдегидам: HCOOH + 2[Ag(NH3)2]OH → 2Ag↓ + 4NH3↑ + CO2↑ + 2H2O |
|
|
Растворимые соли жирных карб. кислот, например, стеарат натрия CH3(CH2)16COONa (мыло) |
Любая сильная неорганическая кислота или кислота средней силы H2SO4 (разб.) HCl HI HBr HNO3 (разб.) H3PO4 |
Выпадение хлопьевидного белого осадка малорастворимой жирной кислоты: CH3(CH2)16COONa + H+ → Na+ + CH3(CH2)16COOH |
| Раствор соли Ca или Mg |
Выпадение белого осадка нерастворимой кальциевой или магниевой соли жирной кислоты. Ионное уравнение в общем виде: 2R-COO— + Ca2+ → (R-COO)2Ca↓, где R-длинный углеводородный радикал. На примере, стеарата натрия и хлорида кальция молекулярное уравнение реакции выглядит так: 2CH3(CH2)16COONa + CaCl2 → (CH3(CH2)16COONa)2Ca↓ |
|
| Фенолфталеин |
Окрашивание фенолфталеина в малиновый цвет как в щелочах, ввиду того, что соли жирных кислот гидролизуются по аниону: CH3(CH2)16COO— + H2O → CH3(CH2)16COOH + OH— |
|
|
Олеиновая кислота, -COOH; >C=C< |
Водный раствор KMnO4(водн.) |
Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка оксида марганца бурого цвета MnO2 3>C=C< + 2KMnO4 + 4H2O → 3>C(OH)-C(OH)< + 2MnO2↓ + 2KOH |
| Раствор Br2 в орг. растворителе или воде (бромная вода) |
Исчезает желто-коричневая окраска раствора брома из-за протекания реакции (указан структурный фрагмент молекулы олеиновой кислоты): >C=C< + Br2 → C(Br)=C(Br)< |
|
| Раствор щелочи, например, NaOH |
Олеиновая кислота, будучи практически нерастворимой в воде жирной кислотой, растворяется в водных растворах щелочей: C17H33COOH + NaOH → C17H33COONa + H2O |
|
|
Глюкоза, -CHO -C(OH)-C(OH)- |
Аммиачный раствор оксида серебра [Ag(NH3)2]OH |
Глюкоза относится к так называемым альдегидоспиртам, т.к. ее молекулы содержат альдегидную группу и 5 гидроксильных групп. Поэтому она вступает в реакцию «серебряного зеркала» |
|
Свежеосажденный Cu(OH)2 |
Если раствор глюкозы прибавить к свежеосажденному гидроксиду меди без нагревания наблюдается растворение осада гидроксида меди и образование синего раствора. В этом случае глюкоза реагирует как многоатомный спирт — с образованием растворимых комплексов меди. Если же полученный синий раствор нагреть, выпадает оранжево-красный осадок одновалентного оксида меди Cu2O. При этом глюкоза реагирует как альдегид — альдегидная группа молекулы глюкозы окисляется до карбоксильной — образуется глюконовая кислота. | |
| Крахмал |
Йод, I2 |
Появление синей окраски |
| Белок |
концентрированная азотная кислота НNО3(конц.) |
Ксантопротеиновая реакция Появление ярко-желтого окрашивания по причине нитрования бензольных колец молекул белка |
|
Свежеосажденный Cu(OH)2 |
Появляется сине-фиолетовое окрашивание раствора в следствие образование комплексов меди (II) с белком |
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.

Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.

Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.

В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.

Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем
охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 + H2O → H3AsO4 + NO↑
As2O3 + HNO3 + H2O → H3AsO4 + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2—).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.