Анализ
заданий ЕГЭ по химии 2019 года
Белоногова Г.У., заслуженный учитель РБ, МБОУ «Школа № 110» Советского района
ГО город Уфа.
Вот и прошел очередной экзамен. Позади
остались волнения и ожидания результатов. Хотелось бы остановиться на типичных
ошибках выпускников при решении заданий повышенного уровня сложности. Проверка
заданий этой части осуществляется на основе сравнения ответа выпускника с поэлементным
анализом приведенного образца ответа, каждый правильно выполненный элемент
оценивается в один балл.
Задание 30 проверяет
умение выпускников составлять окислительно-восстановительные реакции. Из предложенного списка веществ учащимся
необходимо выбрать окислитель и восстановитель, определить продукты реакции в
соответствии с данными исходными веществами, составить электронный баланс
реакции и на его основе расставить коэффициенты в уравнении.
Например, из предложенного перечня веществ
выберите вещества, между которыми возможна окислительно-восстановительная
реакция. Запишите уравнение реакции только одной из возможных
окислительно-восстановительных реакций. Составьте электронный баланс, укажите
окислитель и восстановитель. Даны вещества: нитрит аммония, сульфат железа (II),
серная кислота, ацетат магния, оксид марганца (IV).
2FeSO4
+ MnO2 + 2H2SO4 → Fe2(SO4)3
+ MnSO4 + 2H2O
ок-ль
1│ Mn +4 + 2e—
→ Mn+2
в-ль
2│ Fe+2
— e—
→ Fe+3
Работа учащихся должна включать следующие
элементы ответа:
1.
Выбраны вещества, и записано уравнение окислительно-восстановительной
реакции. (1
балл)
2.
Составлен электронный баланс, указаны окислитель
и восстановитель.
(1
балл)
Суммарный балл – 2 балла.
Помимо
данного в ключах уравнения эксперты оценивают все возможные варианты ответов,
не искажающие смысла задания. Так как в задании не указана концентрация серной
кислоты, то учитывались уравнения как с концентрированной, так и с разбавленной
кислотой. В данном задании были учтены и следующие предложенные учащимися уравнения
реакций:
NН4NO2
+ H2SO4 (конц)
→ NН4NO3 + SO2
+ H2O
2FeSO4
+ 2H2SO4 (конц)
→ Fe2(SO4)3 + SO2 + 2H2O
MnO2
+ NН4NO2 + H2SO4
→ MnSO4 + NН4NO3
+ H2O
Типичные
ошибки, которые допускают учащиеся:
1. Названия
веществ даны в письменном виде и учащиеся не всегда правильно пишут формулы
исходных веществ, путают сульфат, сульфит, сульфид, следовательно, неверно
пишут уравнение реакции.
2. Неправильно
определяют степень окисления элемента в соединении.
3. Неправильно
определен окислитель или восстановитель.
4. Неправильно
подсчитывают количество отданных или принятых электронов.
5. Такие
обозначения степеней окисления как N5+
или Са 2+(сначала цифра, затем знак)
считаются неверными.
6. Недопустима
запись: Cr2+6
+ 6e—
→2Cr+3
Задание 31 ориентировано
на проверку усвоения важных элементов содержания: «Реакции ионного обмена». Из
предложенного перечня веществ нужно выбрать вещества, между которыми возможна
реакция ионного обмена, которая протекает между электролитами в направлении
связывания ионов. Необходимо записать молекулярное, полное и сокращенное ионные
уравнения. Обычно к этим реакциям относятся реакции обмена.
Работа учащихся должна включать следующие элементы
ответа:
1.
Выбраны вещества и записано молекулярное уравнение реакции ионного обмена. (1
балл)
2.
Записаны полное и сокращенное ионное уравнения реакций.
(1
балл)
Суммарный балл – 2 балла.
Если в качестве одного из исходных веществ выбрана соль,
то она должна быть растворима в воде. (исключение – взаимодействие
нерастворимых карбонатов с кислотами).
Константа диссоциации фосфорной кислоты по
первой ступени больше, чем по второй и третьей ступеням поэтому в ионном
уравнении можно записывать кислоту как Н+ + Н2РО4−
так и Н3РО4. При взаимодействии солей аммония с
щелочами допустимы записи NH3
∙ H2O или NH3
+ H2O
Типичные ошибки,
которые допускают учащиеся:
1.
Названия веществ даны в письменном виде и
учащиеся не всегда правильно пишут формулы исходных веществ, следовательно,
неверно пишут уравнение реакции.
2.
Неправильно определяют заряд иона.
3.
Неправильно обозначают заряд иона, т.е.
вместо 2+ пишут +2.
4. В сокращенном ионном уравнении дробные или удвоенные коэффициенты не
допускаются.
В 2020 году составители заданий
хотят внести некоторые уточнения в условия заданий № 30 и 31, т.к. для
представленного перечня может быть предложено множество уравнений и составители
хотят сузить круг возможных реакций.
Пример №1.
Для выполнения заданий 30, 31используйте следующий перечень веществ: перманганат
калия, гидрокарбонат натрия, сульфит натрия, гидроксид калия, пероксид
водорода. Допустимо использование водных растворов веществ. 30 задание.
Из предложенного перечня веществ выберите вещества, между которыми
окислительно-восстановительная реакция протекает с изменением цвета
раствора. Выпадение осадка или газа в ходе этой реакции не наблюдается.
В ответе запишите уравнение реакции только одной из возможных
окислительно-восстановительных реакций с участием выбранных веществ. Составьте
электронный баланс, укажите окислитель и восстановитель.
Такие задания удобнее начинать делать,
определив все возможные окислители, восстановители и среду.
Окислители:
Восстановители: Среда:
KMnO4
Na2SO3
KOH
H2O2
H2O2
H2O
Схемы возможных реакций:
1. 2KMnO4 + Na2SO3 + 2KOH
→ Na2SO4 + 2K2MnO4 + H2O
2. 2KMnO4 + 3Na2SO3 +
H2O →2MnO2 ↓+3Na2SO4 + 2KOH
3. 2KMnO4 + 3H2O2 → 2MnO2
↓+ 3O2↑ + 2KOH + 2H2O
4. Na2SO3
+ H2O2
→ Na2SO4
+ H2O
По условию задания – реакция протекает с
изменением цвета, осадок или газ не выделяется, следовательно, подходит первая
реакция.
В 31 задании сказано, что из
предложенного перечня веществ выберите кислую соль и вещество, которое вступает
с этой солью в реакцию ионного обмена. Запишите молекулярное, полное и
сокращенное ионное уравнения реакций с участием выбранных веществ.
2NaHCO3 + 2KOH → Na2CO3 +
K2CO3 + 2H2O
2Na++ 2HCO3− + 2K+
+ 2OH− → 2Na+ + CO32− + 2K+ +
CO32− + 2H2O
HCO3−
+ OH−
→ CO32−
+ H2O
Коэффициенты в сокращенном ионном
уравнении обязательно сокращаем.
Пример №2.
Для выполнения заданий 30, 31используйте следующий перечень веществ: дихромат
калия, бром, нитрат бария, оксид серы (IV),
хлороводород, карбонат аммония. Допустимо использование водных растворов
веществ.
30 задание.
Из предложенного перечня веществ выберите вещества, между которыми
окислительно-восстановительная реакция протекает с образованием двух
кислот. В ответе запишите уравнение реакции только одной из
возможных окислительно-восстановительных реакций с участием выбранных веществ.
Составьте электронный баланс, укажите окислитель и восстановитель.
При данном уточнении возможна только одна
реакция:
Br2 +
SO2
+ 2H2O
→ H2SO4
+ 2HBr
31 задание.
Из предложенного перечня веществ необходимо выбрать
вещества, реакция ионного обмена между которыми протекает с выделением газа.
Запишите молекулярное, полное и сокращенное ионное уравнения только одной из
возможных реакций.
При данных условиях возможна только одна
реакция:
(NН4)2СO3
+ 2HCl → 2NН4Cl
+ CO2 + H2O
Задание 32 проверяет
знание генетической взаимосвязи неорганических веществ различных классов.
Условие задания включает описание конкретного химического эксперимента, ход
которого учащиеся должны отразить составлением соответствующих реакций.
Выполнение заданий «мысленного эксперимента» требует знания химических свойств
веществ, условий проведения реакций и изменений, которые сопровождают различные
превращения. Каждое уравнение оценивается в 1 балл, максимальное число баллов –
4.
Например,
в недостатке кислорода сожгли газ, полученный при взаимодействии
концентрированной серной кислоты с иодидом калия. Образовавшееся твёрдое
вещество вступило при нагревании в реакцию с концентрированной азотной
кислотой. Выделившийся в результате реакции газ поглотили избытком раствора
гидроксида калия. Напишите уравнения четырёх описанных реакций
8KI
+ 5H2SO4 (к)
→ 4H2O + 4I2 + 4 K2SO4 + H2S
O2
+ 2Н2S → 2S + 2H2O
3S
+ 4HNO3 → 3SO2 + 4NO + 2H2O
SO2
+ 2NaOH → Na2SO3 + H2O
Задание
не поменялось. Ничего неожиданного не было.
Типичные ошибки,
которые чаще всего встречаются у учащихся при выполнении задания:
1.
Не знают химические свойства и получение
классов неорганических соединений.
2. Неправильно
пишут продукты гидролиза бинарных соединений (нитриды, гидриды, карбиды и
т.д.).
3. Не
учитывают гидролиз образовавшейся соли при взаимодействии двух солей в
растворе.
4. Не
учитывают разницу в продуктах реакции при взаимодействии соединений цинка и алюминия
в растворе и в расплаве.
5. Не
знают продукты взаимодействия и изменение цвета раствора соединений хрома и
марганца в различной среде.
Задание
33 проверяет знание генетической взаимосвязи
органических веществ различных классов. При решении цепочки необходимо записывать структурные формулы веществ,
которые однозначно отражают порядок соединения атомов в молекуле. Допустимо
записывать сокращённые структурные формулы таких веществ, как метан, этан,
ацетилен. Каждое уравнение оценивается в 1 балл, максимальное количество
баллов – пять, это самая «дорогая» задача. Например, напишите уравнения реакций,
с помощью которых можно осуществить следующие превращения:
Этилбензол
X1
X2 →
→ X3 X4
Остановимся на типичных ошибках,
учащихся:
1. Учащиеся не используют структурные
формулы веществ.
2. Вместо уравнений реакций используют
схемы реакций.
3. Не расставляют коэффициенты в
уравнении.
4. Записывают продукты, не соответствующие
условиям протекания реакций.
В Задании 34 были
предложены задачи по теме «Растворы» с использованием понятия «растворимость».
Для решения этих задач учащимся нужно было использовать понятие «растворимость»,
т.е. понимать, что в 100 г воды растворяется определенное количество соли. И
остается только найти массу соли в насыщенном растворе. Далее задача решается
по известным учащимся алгоритмам.
Приведем примеры задач данного типа.
Задача № 1. Растворимость
хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды.
Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой
767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата
серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г
40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в
растворе, образовавшемся во второй колбе. В ответе запишите уравнения реакций,
которые указаны в условии задачи, и приведите все необходимые вычисления
(указывайте единицы измерения искомых физических величин).
1.
Запишем уравнения реакций.
344,4 г
(I)
AlCl3 + 3AgNO3 → 3AgCl↓ + Al(NO3)3
|
|
||||
|
(II) |
AlCl3 |
→ |
Na[Al(OH)4] + |
3NaCl |
2. Рассчитаем массу
хлорида алюминия в насыщенном растворе:
в 767 г – х г AlCl3
= 267 г
в 153,4 г – 53,4 г
3. Рассчитаем количество
вещества реагентов и продуктов реакций:
n(AlCl3)
= 267/133,5 = 2 моль;
n(AgCl)
= 344,4/143,5 = 2,4 моль;
n1(AlCl3)
= 1/3 ∙ n(AgCl)
= 0,8 моль;
n2(AlCl3)
= 2 – 0,8 = 1,2 моль;
m(NaOH)
= 960 ∙ 0,4 = 384 г
n(NaOH)
= 384/40 = 9,6 моль.
Реакция идет 1 : 4,
следовательно, гидроксид натрия в избытке.
n(NaCl)
= 3n2(AlCl3) = 1,2 ∙ 3 = 3,6 моль;
m(NaCl)
= 3,6 ∙ 58,5 = 210,6 г
4.
Вычислим массу раствора хлорида алюминия во втором растворе:
767 г – 2 моль AlCl3
= 460,2 г
х г – 1,2 моль
5.
Вычислим массу конечного раствора:
mр-ра
= 460,2 + 960 – 12,8 = 1420,2 г.
6.
Вычислим массовую долю хлорида натрия в растворе:
Задача № 2. Растворимость
сульфата железа (II) при некоторой
температуре составляет 30,4 г на 100 г воды. Насыщенный раствор, приготовленный
при этой температуре добавлением необходимого количества сульфата железа (II)
к 400 мл воды, разлили по двум колбам. В первую колбу раствора прилили избыток
аммиачной воды. При этом образовалось 27 г осадка. Во вторую колбу добавили 780
г 20%-ного раствора хлорида бария. Определите массовую долю хлорида бария в
растворе, образовавшемся во второй колбе. В ответе запишите уравнения реакций,
которые указаны в условии задачи, и приведите все необходимые вычисления
(указывайте единицы измерения искомых физических величин).
1.
Запишем уравнения реакций.
(I) 2NH3
+ 2H2O + FeSO4 → Fe(OH)2↓+ (NH4)2SO4
(II) BaCl2
+ FeSO4 → FeSO4 + BaSO4↓
2.
Рассчитаем массу сульфата железа в насыщенном растворе:
в
100 г – 30,4 г FeSO4
= 121,6 г
в
400 г – х г
3.
Рассчитаем количество вещества реагентов и продуктов реакций:
n(FeSO4)
= 121,6/152 = 0,8 моль;
n(Fe(OH)2)
= 27/90 = 0,3 моль;
n1(FeSO4)
= n(Fe(OH)2) = 0,3 моль;
на
вторую реакцию осталось:
n2(FeSO4)
= 0,8 – 0,3 = 0,5 моль;
mч
(BaCl2)
= 780 ∙ 0,2 = 156 г
n(BaCl2)
= 156/208 = 0,75 моль
Реакция идет 1 : 1,
следовательно, хлорид бария в избытке.
nпрор(BaCl2)
= n2(FeSO4)
= 0,5 моль
nост(BaCl2)
= 0,75 – 0,5 = 0,25 моль
mост
(BaCl2)
= 0,25 ∙ 208 = 52 г
n(BaSO4)
= n2(FeSO4)
= 0,5 моль
m(BaSO4)
= 0,5 ∙ 233 = 116,5 г
4. Рассчитаем
массовую долю хлорида бария в растворе:
m2р-ра(FeSO4)
(400 + 121,6) – 0,8 моль
х г – 0,5 моль х
= 326 г
mр-ра =
m2р-ра(FeSO4)
+ mр-ра
(BaCl2)
– m(BaSO4)
= 326 + 780 – 116,5 = 989,5 г
Характерные
ошибки, которые допускают учащиеся при решении задач данного типа:
1.
Неправильно составляют уравнения реакций.
2.
Не усвоили понятие «растворимость».
3.
Невнимательно читают условие задачи («раствор разделили на две части»), но не
на две равные части.
4.
При нахождении массы раствора не учитывают массы веществ, выпавших в осадок или
выделившихся в виде газа.
5.
Неправильно находят массу оставшегося после реакции вещества.
6.
Не пишут единицы измерения.
Задание 35 на
определение молекулярной и
структурной формулы органического вещества. Выпускник должен произвести
математический расчёт, то есть определить соотношение атомов в составе того или
иного органического вещества, составить структурную формулу, используя условия,
которые даны в задаче. Написать уравнение химической реакции, в котором
обязательно использовать именно структурную формулу вещества, т.е.
ученик должен знать химические свойства классов органических веществ.
Большая часть ребят, решавших задачу смогли
получить один балл – они смогли провести только математические расчеты. Три
балла получили небольшое количество учащихся.
Давайте рассмотрим данные задания и
выработаем алгоритм их решения.
Задача № 1
Соль
органической кислоты содержит 28,48% углерода, 3,39% водорода, 21,69% кислорода
и 46,44% бария по массе. Известно, что при нагревании этой соли образуется
карбонильное соединение. На основании данных условия задания:
1) произведите необходимые вычисления и
установите молекулярную формулу соли органической кислоты;
2) составьте структурную формулу
исходного вещества, которая однозначно отражает порядок связи атомов в его
молекуле;
3) напишите уравнение реакции, протекающей
при нагревании этой соли (используя структурные формулы органического вещества).
Для
решения данной задачи учащиеся используют алгоритм нахождения химической
формулы по вещества по массовым долям элементов.
|
Д а н о: |
|
|
ω(С) = 24,74% |
x |
|
ω(H) = 2,06% |
y |
|
ω(O) = 32,99% ω(К) = 40,21% |
z n |
|
CxHyOzКn — ? |
1) Р е ш е н и е:
Пусть
mобр
= 100 г., тогда
m(C)
= 24,74 г; m(H)
= 2,06 г; m (O)
= 32,99 г;
m(К)
=40,21 г
n(C)
= =
2,06 моль ; n(H)
= 2,06 моль;
n(O)
= =
2,06 моль ; n(К)
== = 1,03 моль
n(С)
: n(H)
: n(O)
: n(К)
= 2,06 : 2,06 : 2,06 : 1,03 = 2 : 2 : 2 : 1 = 4 : 4 : 4 : 1
C4H4O4К
– молекулярная формула вещества. (1
балл)
2) Составлена структурная формула вещества:

(1
балл)
4) Составлено уравнение реакции, протекающей при
нагревании этой соли:

+
2КОН → Н3С – СН3 + 2К2СО3
(1 балл)
Задача № 2.
При сжигании образца органического вещества массой
15,84 получено 13,44 л (н.у.) углекислого газа и 8,64 г воды. Известно, что это
органическое вещество образуется при окислении циклического углеводорода, не
содержащего заместителей в цикле, перманганатом калия в присутствии серной
кислоты. На основании данных условия задания:
1) проведите необходимые вычисления
(указывайте единицы измерения физических величин) и установите молекулярную
формулу исходного вещества;
2) составьте возможную структурную
формулу исходного вещества, которая однозначно отражает порядок связи атомов в
его молекуле;
3) напишите уравнение реакции
окисления органического вещества перманганатом калия в присутствии серной
кислоты.
Во втором примере даны продукты сгорания, для решения
данной задачи используют следующий алгоритм.
|
15,84г |
13,44 л |
8,64 г |
||||
|
X + O2 |
||||||
|
22,4 |
18 г/моль |
|||||
1) n(CO2)
= = 0,6 моль; n(H2O) =
= 0,48 моль;
n(C)
= n(CO2) = 0,6 моль;
n(H) = 2n(H2O) = 0,48 ∙ 2 = 0,96 моль;
m(C)
= 7,2 г; m(Н) = 0,96 г;
m(О)
= 15,84 – 7,2 – 0,96 = 7,68 г (следовательно, кислород в веществе есть). n(О)
= =
0,48 моль
n(C)
: n(H)
: n(О)
= 0,6 : 0,96 : 0,48 = 1,25 : 2 : 1 = 5 : 8 : 4
С5Н8О4
– молекулярная формула вещества.
(1 балл)

структурная формула вещества:
(1 балл)
3)
Составлено уравнение реакции получения вещества А:
(1
балл)
+ 8KMnO4
+ 12H2SO4
→ + 4K2SO4
+
8MnSO4
+ 12H2O
Еще раз остановимся на ошибках,
допускаемых абитуриентами при решении задач на вывод молекулярной формулы:
1.
Не проверяют наличие кислорода в
органическом веществе;
2.
Неправильно составляют структурную формулу
вещества;
3.
Неправильно пишут уравнение реакции.
4.
Грубо или неверно округляют числа.
5.
Не расставляют коэффициенты в уравнении
или пропускают формулы побочных продуктов реакции.
Ниже приведен подробный разбор демоверсии ЕГЭ-2023 по химии, проектная версия. Задания разобраны от 1 до 34 подряд, приведена логика рассуждения по каждому из них. Если есть желание разобраться более детально, то переходите по ссылкам в тексте или записывайтесь к нам на курс.
Для выполнения первого задания всегда рекомендую расписать электронно-графические формулы элементов (с ячейками). В большинстве случаев достаточно изобразить внешний и предвнешний уровень. Напомню также, что для элементов дальше IV периода не нужно изображать формулу целиком, а можно воспользоваться аналогией строения валентных подуровней с соседом из подгруппы. По приведенным элементам:
- Цезий находится в первой группе, главной подгруппе, аналог натрия по строению внешнего уровня. Имеет 1 электрон на 6s-подуровне, он же является неспаренным.
- Углерод находится в четвертой группе, главной подгруппе. На внешнем уровне имеет 4 электрона, из них неспаренных два, которые находятся на 2р-подуровне.
- Кислород находится в шестой группе, главной подгруппе. На внешнем уровне имеет 6 электронов, из них неспаренных два, которые находятся на 2р-подуровне.
- Хром находится в шестой группе, побочной подгруппе. Необходимо вспомнить о проскоке электрона, за счет которого на внешнем уровне, 4s-подуровне, имеет 1 электрон, а не предвнешнем, 3d-подуровне, – пять. Итого 6 неспаренных.
- Азот находится в пятой группе, главной подгруппе. На внешнем уровне имеет 5 электронов, из них неспаренных три, которые находятся на 2р-подуровне.
Выбираем углерод и кислород, у обоих по два неспаренных электрона.
Ответ: 23
Необходимо вспомнить, что к р-элементам можно отнести элементы главных подгрупп шести последних групп в периоде. Представители первых двух относятся к s-элементам, а элементы побочных подгрупп относим к d-элементам. Исходя из приведенных соображений, выбираем пункты 2), 3), 5).
Атомный радиус уменьшается направо по периоду, поэтому располагаем выбранные ранее элементы в порядке 2), 5), 3).
Ответ: 253
Для выполнения такого рода заданий рекомендую выписать на лист бумаги высшую и низшую степени окисления для каждого из элементов.
- Цезий имеет высшую степень окисления +1, низшую – 0. Разность 1.
- Углерод имеет высшую степень окисления +4, низшую – -4. Разность 8.
- Кислород имеет высшую степень окисления +2, низшую – -2. Разность 4.
- Хром имеет высшую степень окисления +6, низшую – 0. Разность 6.
- Азот имеет высшую степень окисления +5, низшую – -3. Разность 8.
Таким образом, выбираем углерод и азот.
Ответ: 25
В задании, по сути, есть два фильтра: по типу строения и по характеру связи. Начнем с типа строения. Поскольку необходимо выбрать вещества молекулярного строения, то сразу можно исключить соли и иные соединения, имеющие ионные связи. Убираем из рассмотрения пункты 1) и 4). Среди оставшихся нужно найти вещества с ковалентной полярной связью. Вспомним, что такая связь может возникать между атомами разных неметаллов (или сильно различающихся фрагментов в органических молекулах). По такому принципу можно исключить пункт 5). Остаются вещества 2) и 3).
Ответ: 23
К двухосновным кислотам относятся те из них, которые содержат в молекуле 2 атома водорода, способных замещаться на катионы металлов. Подобным требованиям отвечает сернистая кислота, пункт 4).
К средним можно отнести соли, не содержащие способных к замещению атомов водорода, фрагментов ОН, комплексных ионов и подобного. Из приведенного списка можно взять аммиачную селитру, тривиальное название нитрата аммония.
К амфотерным гидроксидам можно отнести гидроксиды металлов в степенях окисления +3 и +4, также гидроксиды бериллия, цинка, свинца, олова. Подойдет пункт 2).
Ответ: 482
Попробуем найти в приведенном списке сильные кислоты. Пункт 1) подходит, поскольку в пункте 3) находится слабая кислота. Таким образом X уже установлен.
Среди оставшихся пунктов нужно найти вещество, которое при добавлении вызовет растворение гидроксида алюминия. Поскольку гидроксид является амфотерным, то сможет прореагировать с кислотой, кроме наиболее слабых, или щелочью. Среди приведенных соединений можно взять 4), поскольку гидроксид калия является щелочью.
Ответ: 14
Для выполнения подобных заданий советую следующий порядок действий:
- Берем вещество из левого столбика
- Классифицируем его, вспоминаем характерные типы реакций для такого класса соединений
- Оцениваем его с точки зрения кислотно-основных и окислительно-восстановительных свойств
- Подбираем вещества и правого столбика, противоположные по свойствам и способные реагировать с веществом из правого столбика
Пункт А):
Сера относится к простым веществам-неметаллам, средняя по активности. Способна вступать в реакцию со щелочами, сильными окислителями и активными восстановителями. С водой и кислотами, кроме кислот-окислителей, реакции нет.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) водород выступит против серы в качестве восстановителя, хлор и кислород – окислители. Подходит.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Пункт Б):
Оксид серы (VI) относится к кислотным оксидам, реагирует с водой, большинством веществ основной и амфотерной природы. Восстановительных свойств не проявляет, может быть окислителем.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) оксид бария – основный, КОН – щелочь, с водой реакция тоже есть. Подходит.
В пункте 3) хлор и кислород – окислители, не подходит.
В пункте 4) нет реакции с уксусной кислотой, не подходит.
В пункте 5) нет реакции уже со вторым веществом, дальше не продолжаем.
Пункт В):
Гидроксид цинка относится к амфотерным гидроксидам, может реагировать со щелочами, кислотами. Выраженных окислительных или восстановительных свойств не проявляет. В воде нерастворим, с солями не обменивается.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции с водой, не подходит.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) реагирует с кислотами и щелочью. Подходит.
В пункте 5) нет реакции с хлоридом бария, не подходит.
Пункт Г):
Бромид цинка относится к солям, может вступать в реакции обмена со щелочами и солями. Может проявлять восстановительные свойства за счет бромид-иона.
В пункте 1) обмен имеет смысл с первым и вторым веществам, с третьим будет ОВР. Подходит.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Ответ: 3241
Для ответа на вопрос имеет смысл оценить свойства веществ в каждой паре, а при необходимости записать уравнение реакции между ними. Сделаем и то, и другое.
В пункте А) магний является сильным восстановителем, а концентрированная серная кислота – окислителем. Магний способен восстановить серу до низшей степени окисления:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
В пункте Б) встречаются основный оксид и кислота, произойдет обмен:
MgO + H2SO4 = MgSO4 + H2O
В пункте В) сера выступает в качестве восстановителя, а концентрированная серная кислота – окислитель. Произойдет ОВР:
S + 2H2SO4 = 3SO2 + 2H2O
В пункте Г) сероводород выступает в качестве восстановителя, а кислород – окислитель. Произойдет ОВР:
2H2S + 3O2 = 2SO2 + 2H2O
Ответ: 5144
Обратим внимание, что железо в одну стадию переходит в степень окисления +3. Для этого нам нужен сильный окислитель- хлор.
2Fe + 3Cl2 = 2FeCl3
Во второй реакции железо понижает степень окисления до +2, поэтому необходимо найти восстановитель. Им тут может быть только йодид калия.
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
Ответ: 43
Для установления соответствия имеет смысл найти в структурах из левого столбика характерные функциональные группы и фрагменты.
В структуре А) видим фрагмент -NH-, который можно отнести ко вторичному амину. Циклическая структура молекулы в данном случае ничего не значит.
В структуре Б) есть аминогруппа и карбоксильная группа. Соответственно, вещество можно отнести к аминокислотам.
В структуре В) есть структурный фрагмент -С(О)NH- и просматриваются два остатка от аминокислот, что указывает на дипептид.
Ответ: 231
К решению подобных заданий может быть несколько подходов. Можно для начала определить молекулярную формулу бутена-1, а затем сравнить ее с молекулярными формулами предложенных вариантов. Изомеры по определению должны иметь одинаковые молекулярные формулы.
Бутен-1 – С4Н8
- С4Н10
- С4Н8
- С4Н6
- С4Н6
- С4Н8
Ответ: 25
Поскольку подкисленный раствор перманганата проявляет сильные окислительные свойства, следует поискать вещества, которые могут окисляться с образованием карбоновой кислоты. Прокомментируем все предложенные пункты:
- Окисляется с разрывом кратной связи, кислота будет
- Не окисляется
- Окисляется по боковой цепи, кислота будет
- Не окисляется
- Окисляется до кислоты
Ответ: 135
Метиламин относится к первичным алифатическим аминам, проявляет выраженные основные свойства, вступает в реакции алкилирования, реагирует с азотистой кислотой. Прокомментируем все предложенные пункты:
- Алкан, низкая активность, реакции нет
- Хлоралкан, реакция алкилирования, реагирует
- Водород, гидрировать нечего, не реагирует
- Основание, не реагирует
- Кислота, образование соли, реагирует
Ответ: 25
Для решения имеет смысл записать классы соединений из левого столбика, далее оценить происходящие изменения:
А) 1,2-дигалогеналкан – алкен
Б) моногалогеналкан – алкен
В) моногалогеналкан – алкан
Г) 1,2-дигалогеналкан – алкин
По изменениям назвать тип происходящей реакции и подобрать к ней подходящий реагент:
А) дегалогенирование, магний
Б) дегидрогалогенирование, спиртовой раствор щелочи
В) реакция Вюрца, натрий
Г) дегидрогалогенирование, спиртовой раствор щелочи
Ответ: 1252
Для надежности перед выбором ответа имеет смысл преобразовать названия веществ в формулы и прописать предложенные реакции. Попробуем это сделать:
А) 2CH3COOH + Na2S = 2CH3COONa + H2S
Б) HCOOH + NaOH = HCOONa + H2O
В) HCOH + 4Cu(OH)2 = 2Cu2O + CO2 + 5H2O
Г) 2CH3CH2OH + 2Na = 2CH3CH2ONa + H2
Ответ: 5462
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
В первых двух реакциях цепочки число атомов углерода удваивается, что наводит на мысль о реакции Вюрца. Если рассуждение верное, то веществом Х должен быть галогеналкан. Действительно, его можно получить в одну стадию из спирта, а затем превратить в алкан.
Следующее превращение можно понять, если посмотреть на условия реакции. Нагревание линейного алкана в присутствии хлорида алюминия приводит к его изомеризации в разветвленный алкан.
Ответ: 54
Для решения можно переписать вещества в парах в виде формул, оценить их окислительно-восстановительные свойства и возможность реакции между ними:
- K2S – восстановитель, KMnO4 – окислитель, имеет смысл
- H2SO4 – окислитель, NaCl – очень слабый восстановитель, не ОВР
- NH4Cl – очень слабый восстановитель, NaNO2 – окислитель, специфический случай обмена, сопровождаемого ОВР
- SiO2 – выраженных окислительно-восстановительных свойств не проявляет, Na2CO3 — выраженных окислительно-восстановительных свойств не проявляет, не ОВР
- HI – восстановитель, Na2Cr2O7 – сильный окислитель, имеет смысл
Для надежности можно записать уравнения реакций между ними:
- 2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
- NaCl + H2SO4 = NaHSO4 + HCl
- NaNO2 + NH4Cl = NaCl + N2 + 2H2O
- Na2CO3 + SiO2 = Na2SiO3 + CO2
- Na2Cr2O7 + 14HI = 2NaI + 2CrI3 + 3I2 + 7H2O
Ответ: 135
Изменение давления не будет влиять на скорость реакций, в которых нет газообразных реагентов. Среди приведенных пунктов это будут 2), 3), 5).
Ответ: 235
Для решения подобных заданий нужно расставить степени окисления на атомах азота до и после реакции.
Если степень не меняется, то азот не проявляет окислительно-восстановительных свойств. Так будет в пункте А) (переход -3 в -3).
Если степень увеличится, то азот проявляет восстановительные свойства. Так будет в пунктах Б) (переход -3 в 0) и В) (переход -3 в +2).
Ответ: 422
В первом случае для решения необходимо вспомнить зависимость продуктов электролиза от состава соли:
А) соль образована катионом активного металла и кислородсодержащим анионом, на электродах выделятся водород и кислород.
Б) соль образована катионом активного металла и галогенид-ионом, на электродах выделятся водород и галоген.
В) соль образована катионом малоактивного металла и галогенид-ионом, на электродах выделятся металл и галоген.
Ответ: 342
Во втором случае нужно помнить, что алюминий получают при электролизе раствора оксида в расплаве криолита. Калий и подобные наиболее активные металлы только из расплавов галогенидов. Кислород в данном случае можно получить при электролизе водного раствора фторида калия.
Ответ: 124
Для начала имеет смысл определить класс каждого из соединений:
- Средняя соль
- Средняя соль
- Средняя соль
- Сильная кислота
Исходя из этого уже можно сказать, что наиболее низкое значение рН (самая кислая среда) будет в пункте 4).
Как разобраться с солями? Нужно оценить их способность к гидролизу и потенциальное влияние на среду раствора:
- Соль сильной кислоты и сильного основания, не гидролизуется, среда нейтральная
- Соль слабого основания и сильной кислоты, гидролиз по катиону, среда кислая
- Соль сильного основания и слабой кислоты, гидролиз по аниону, среда щелочная
Ответ: 4213
В задании на равновесие следует учитывать разные факторы. Пройдем по каждому из пунктов:
А) кислота при диссоциации может дать дополнительное количество ионов Н+, которые участвуют в равновесии. При увеличении их концентрации равновесие сместится в сторону обратной реакции.
Б) давление в данном случае не окажет влияния, поскольку нет участников-газов
В) повышение температуры сместит равновесие в сторону эндотермической реакции. В данном случае – прямой.
Г) твердая щелочь может раствориться и прореагировать с Н+, уменьшая концентрацию таких ионов в системе. Равновесие сместится в сторону прямой реакции.
Ответ: 2311
Задания подобного типа удобнее всего решать с помощью таблицы. Данный подход к решению задания ЕГЭ-2023 на равновесие в реакторе можно посмотреть по ссылке ниже:
Способ, на мой взгляд, наиболее оптимальный и доступный каждому.
Ответ: 25
В первом случае нужно подобрать такое вещество из правого столбика, которое реагирует с одним или двумя веществами из пары в левом столбике. При этом очень важно, чтобы реакция сопровождалась видимыми признаками:
Пара А):
- Есть реакция с азотной кислотой, сопровождается выделением газа и растворением твердого вещества. Нитрат натрия не реагирует. Подходит.
- Есть реакция с азотной кислотой, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
Пара Б):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом калия, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом натрия, сопровождается образованием осадка. Хлорид калия не реагирует. Подходит.
Пара В):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с хлоридом бария, сопровождается образованием осадка. Хлорид натрия не реагирует. Подходит.
Пара Г):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Специфический случай, поскольку один из изначально образовавшихся нерастворимых гидроксидов (Al(OH)3) может раствориться снова при избытке щелочи. Подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
В заданиях второго типа имеет смысл записать происходящие реакции и попытаться себе их представить. Как может выглядеть и что увидим:
- 2CH3CH2COOH + 2Li = 2CH3CH2COOLi + H2
- 2CH3CH(OH)CH3 + 2K = 2CH3CH(OK)CH3 + H2
- Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H2O
- C2H2 + 2Br2 = CHBr2-CHBr2
В первом и втором случаях наблюдаем выделение газообразного водорода. В третьем наблюдаем растворение осадка гидроксида цинка. В четвертом исчезнет окраска брома, наблюдается обесцвечивание.
Ответ: 4415
Задание 25 охватывает несколько совершенно разнородных тем, каждая из которых требует отдельного блока знаний. Приведу здесь ссылки на полезные материалы по заданию, поскольку многое здесь нужно просто выучить.
По первому блоку следует знать, что сопряженные алкадиены используются для производства каучуков, а алкены – пластмасс. Метан в составе природного газа используют в качестве топлива.
По второму блоку можно относительно легко соотнести мономер и полимер, если представить себе структуру молекулы мономера. В молекуле этена всего два атома углерода, поэтому элементарное звено формулы полимера тоже содержит два атома углерода. По той же логике здесь можно действовать и для пропена с дивинилом.
Третий блок нужно просто выучить. По переработке углеводородов можно заглянуть сюда. Хорошее описание технологических процессов можно посмотреть здесь.
Ответ: 234; 214; 312
Для решения подобных заданий на растворы рекомендую использовать метод таблиц, подробно описанный здесь.
В итоге решение задачи сводится к уравнению вида
(15+х)/(150+х) = 0,12
15+х = 18+0,12х
0,88х = 3
х = 3,4
Ответ: 3,4 г
Задания такого типа сводятся к решению пропорции. Для начала переведем известный объем аммиака в количество:
n(NH3) = V(NH3)/Vm = 0,56/22,4 = 0,025 (моль)
2 моль – 92 кДж
0,025 моль – х кДж
х = 1,15 кДж
Ответ: 1,15 кДж
Для решения первой задачи запишем уравнение протекающей реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
Далее вычислим количество нитрата кальция:
n(Ca(NO3)2) = m(Ca(NO3)2)/M(Ca(NO3)2) = 196800/164 = 1200 (моль)
Вычислим массу чистого карбоната кальция, который содержался в известняке:
m(CaCO3) = n(Ca(NO3)2)·M(Ca(NO3)2) = 1200·100 = 120000 (г) = 120 (кг)
Вычислим массу примесей в известняке:
m(примеси) = m(известняка) – m(CaCO3) = 150 — 120 = 30 (кг)
Определим массовую долю примеси в известняке:
ω(примеси) = m(примеси)/m(известняка)·100% = 30/150·100% = 20%
Ответ: 20%
Для решения второй задачи запишем уравнение протекающей реакции:
3С2Н2 = С6Н6
Вычислим количества ацетилена и практически полученного бензола:
n(С2Н2) = V(С2Н2)/Vm = 26,88/22,4 = 1,2 (моль)
n(С6Н6 практ.) = m(С6Н6)/M(С6Н6) = 23,4/78 = 0,3 (моль)
Вычислим теоретически возможное количество бензола и сравним его с практическим:
n(С6Н6 теор.) = n(С2Н2)/3 = 1,2/3 = 0,4 (моль)
η(С6Н6) = n(С6Н6 практ.)/n(С6Н6 теор.)·100% = 0,3/0,4·100% = 75%
Ответ: 75%
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. Поскольку должно происходить изменение цвета раствора, нужно найти окрашенный реагент. Из предложенных это может быть только KMnO4. Это вещество проявляет сильные окислительные свойства, поэтому нужно подобрать восстановитель. Осадка в ходе реакции образоваться не должно, поэтому брать нейтральную среду нельзя. В противном случае выпадет осадок MnO2. Среда может быть кислой или щелочной. Кислоты в предложенном наборе нет, поэтому выберем гидроксид калия для создания среды. Восстановителей в предложенном наборе два: сульфит натрия и пероксид водорода. Пероксид брать нельзя, поскольку по описанию реакции газа образоваться не должно. Таким образом приходим к выводу, что нужно взять сульфит, перманганат и щелочь. Приведем соответствующую реакцию и электронный баланс:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
2∙ | Mn+7 + 1ē → Mn+6
1∙ | S+4 – 2ē → S+6
марганец в степени окисления +7 (или перманганат калия) является окислителем.
сера в степени окисления +4 (или сульфит натрия) – восстановителем.
Есть хороший инструмент для отработки данного задания, рекомендую.
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. К кислым солям здесь относится только NaHCO3. В обмен с ней вступит только гидроксид калия, поскольку кислое и щелочь точно смогут прореагировать. Приведем молекулярное, полное и сокращенное ионные уравнения:
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3− + 2K+ + 2OH− = 2Na+ + CO32− + 2K+ + CO32− + 2H2O
HCO3− + OH− = CO32− + H2O
Решение 31 номера сводится к знанию неорганической химии, свойств и реакций отдельных веществ. Приведем уравнения протекающих процессов:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
SO2 + 2H2S = 3S + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
Начнем с циклогексана. Получить его путем гидрирования можно, например, из бензола. Его, в свою очередь, можно получить из гексана по реакции дегидроциклизации. Х1 – бензол. Далее в цепочке много неизвестных веществ, заглянем в самый конец. Циклогексанон относится к кетонам, получить его можно из вторичного спирта. Условия последней реакции на это указывают, поскольку там дан сильный окислитель в кислой среде. Тогда Х3 – циклогексанол. Получить такой спирт в две стадии нужно из циклоалкана. Тогда можно предположить последовательно галогенирование и замещение полученного галогенпроизводного под действием водного раствора щелочи. Тогда Х2 – хлорциклогексан, можно бромциклогексан. Последовательность реакций получается следующей:
Решение задачи начинается с анализа и расчета молекулярной формулы. Поскольку продуктами сгорания являются только углекислый газ и вода, можно приписать веществу формулу CxHyOz. Вычислим количества углекислого газа и воды:
n(H2O) = m(H2O)/M(H2O) = 1,8/18 = 0,1 (моль)
n(СО2) = V(CO2)/Vm = 4,48/22,4 = 0,2 (моль)
Тогда можно определить количества и массы элементов, входивших в состав исходного вещества:
n(С) = n(СО2) = 0,2 моль
m(С) = n(С)·M(С) = 0,2·12 = 2,4 г
n(H) = 2n(H2O) = 0,2 моль
m(H) = n(H)·M(H) = 0,2·1 = 0,2 г
m(О) = m(CxHyOz) − m(С) − m(H) = 3,4 − 2,4 − 0,2 = 0,8 (г)
n(O) = m(O)/M(O) = 0,8/16 = 0,05 (моль)
Вычислим молекулярную формулу неизвестного вещества:
x : y : z = n(С) : n(H) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Поскольку по условию один из фрагментов молекулы должен содержать 7 атомов углерода, разумным будет удвоить простейшее соотношение и получить формулу C8H8O2.
С8Н8О2 – молекулярная формула
Вещество по условию реагирует со щелочью, процесс гидролиза с образованием соли и спирта. В остатке кислоты 7 атомов углерода и малое количество атомов водорода, что вполне соответствует бензоату. Тогда на спирт приходится всего один атом углерода, что соответствует метанолу. Тогда можно предложить структуру метилбензоата:
Запишем уравнение его реакции с гидроксидом лития:
К заданию 34 следует приступать только после ПОЛНОГО выполнения и проверки всех остальных заданий КИМа. Убедитесь также, что все прочие задания перенесены в бланк ответов, а не остались на черновике. Времени на это задание нужно больше всего, поэтому велик риск потерять остальное и не успеть что-то перенести в бланк.
Для решения следует внимательно прочитать условие и написать реакции, которые сразу же очевидны, без дополнительных расчетов. Здесь их можно записать две:
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Поскольку напрямую ничего не известно про массу и количество кальция и карбоната кальция, можно сказать, что кальция было х моль, а его карбоната у моль. Тогда в ходе реакций выделилось х моль водорода и у моль углекислого газа. Выразим массы указанных веществ:
m(Ca) = n·M = 40х г
m(CaCO3) = n·M = 100у г
m(Н2) = n·M = 2х г
m(CO2) = n·M = 44у г
Выразим массу раствора после добавления исходной твердой смеси к соляной кислоте:
m(р-ра) = m(Ca) + m(CaCO3) + m(р-ра HCl) − m(Н2) − m(CO2)
m(р-ра) = 40х + 100у + 300 − 2х − 44у = 330 (г)
38х + 56у = 30
Первое уравнение системы готово. Второе составим по массовой доле кальция в исходной смеси:
m(смеси) = m(Ca) + m(CaCO3) = 40х + 100у (г)
m(Ca) = 40х + 40у (г)
ω(Са) = m(Ca)/m(смеси)·100% = (40х+40у)/(40х+100у)·100% = 50%
(40х+40у)/(40х+100у) = 0,5
Составим и решим систему уравнений:
38х + 56у = 30
(40х + 40у)/(40х + 100у) = 0,5
38х + 56у = 30
(2х + 2у)/(2х + 5у) = 0,5
38х + 56у = 30
2х + 2у = х + 2,5у
38х + 56у = 30
х = 0,5у
75у = 30
у = 0,4
х = 0,2
n(Ca) = 0,2 моль
n(CaСО3) = 0,4 моль
Далее вычислим количество и массу углекислого газа:
n(СО2) = n(CaСО3) = 0,4 моль
m(СО2) = n(СО2)·M(СО2) = 0,4·44 = 17,6 г
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH)·ω(NaOH)/100% = 400·4%/100% = 16 (г)
n(NaOH) = m(NaOH)/M(NaOH) = 16/40 = 0,4 (моль)
Далее нужно сравнить количества щелочи и углекислого газа, чтобы понять, какая будет реакция между ними:
n(СО2)/n(NaOH) = 0,4/0,4 = 1:1
Соотношение 1:1, поэтому образуется кислая соль:
NaOH + CO2 = NaHCO3
Вычислим массу образовавшейся соли и массу раствора:
n(NaHCO3) = n(СО2) = 0,4 моль
m(NaHCO3) = n·M = 0,4·84 = 33,6 г
m(р-ра конечн.) = m(р-ра NaOH) + m(CO2) = 400 + 17,6 = 417,6 (г)
Вычислим массовую долю гидрокарбоната натрия в полученном растворе:
ω(NaHCO3) = m(NaHCO3)/m(р-ра конечн.)·100% = 33,6/417,6·100% = 8,05%
Ответ: 8,05%
Практическое занятие №3
Проанализируйте задания раздела «Неорганическая химия» в КИМах ЕГЭ, составьте список тем и виды заданий, предложите вариант подготовки учащихся к государственной итоговой аттестации.
Задания ЕГЭ по химии по неорганической химии:
5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) кислотного оксида; Б) средней соли; В) одноосновной кислоты.
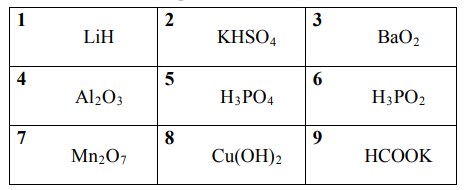
Запишите в поле ответа выбранные цифры в нужной последовательности.
6. В двух пробирках находился порошок серы. В первую пробирку добавили концентрированный раствор вещества Х, и пробирку нагревали до завершения реакции, во вторую пробирку прилили концентрированный раствор вещества Y. В обеих пробирках порошок растворился, но в первой пробирке газ выделился, а во второй – нет.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) H2S
2) Na2SO3
3) H2SO4
4) NH3
5) HCl
Запишите в поле ответа выбранные цифры в нужной последовательности.
7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ВЕЩЕСТВО |
РЕАГЕНТЫ |
|
А) Si |
1) H2, S, NaCl |
|
Б) Be |
2) Cl2, Mg, NaOH |
|
В) Ag2O |
3) O2, HCl, KOH |
|
Г) (NH4)2CO3 |
4) CaCl2, KOH, HCl |
|
5) H2, CO, HNO3 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
8. Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ИСХОДНЫЕ ВЕЩЕСТВА |
ПРОДУКТЫ РЕАКЦИИ |
|
А) Al + KOH + H2O |
1) KAlO2 + H2 |
|
Б) Al(NO3)3 + K2CO3 + H2O |
2) KAlO2 + CO2 |
|
В) Al2O3(тв) + K2CO3(тв) |
3) K[Al(OH)4] + H2 |
|
Г) KNO3 + Al + KOH + H2O |
4) K[Al(OH)4] + NH3 |
|
5) K[Al(OH)4] + CO2 |
|
|
6) Al(OH)3 + KNO3 + CO2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
9. Задана следующая схема превращений веществ:
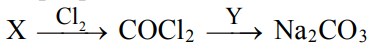
Определите, какие из указанных веществ являются веществами X и Y.
1) C
2) CO
3) CO2
4) NaCl
5) NaOH
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
|
Для записи ответов на задания 29–34 используйте чистый лист бумаги. Запишите сначала номер задания (29, 30 и т.д.), а затем его подробное решение. Ответы записывайте чётко и разборчиво. |
|
Для выполнения заданий 29 и 30 используйте следующий перечень веществ: сульфат меди(II), гидроксид натрия, карбонат натрия, сульфид аммония, бромат калия, серная кислота. Допустимо использование воды в качестве среды для протекания реакций. |
29. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием осадка.
В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Перечень элементов содержания, проверяемых на едином государственном экзамене по химии
|
Код раз- дела |
Код контроли -руемого элемента |
Элементы содержания, проверяемые заданиями экзаменационной работы |
||
|
Федеральный компонент государственного стандарта среднего общего образования |
Наличие позиций ФК ГОС в ПООП СОО |
|||
|
базовый уровень |
углублённый уровень |
|||
|
2 |
НЕОРГАНИЧЕСКАЯ ХИМИЯ |
ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ |
||
|
2.1 |
Классификация неорганических ве- ществ. Номенклатура неорганичес- ких веществ (тривиальная и между- народная) |
– |
– |
|
|
2.2 |
Характерные химические свойства простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) |
Окислительно-восстановительные свойства простых веществ – металлов главных и побочных подгрупп (медь, железо) и неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния |
Общие физические и химические свойства металлов. Закономерности в изменении свойств простых веществ, водородных соединений, высших оксидов и гидроксидов |
|
|
2.3 |
Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния |
Свойства, получение и применение угля. Активированный уголь как адсорбент. Наноструктуры. Мировые достижения в области создания наноматериалов. Круговорот углерода в живой и неживой природе. Физические и химические свойства кремния. Свойства, получение и применение фосфора. Особенности химии фтора. Применение галогенов и их важнейших соединений. Закономерности в изменении свойств простых веществ, водородных соединений, высших ок- сидов и гидроксидов |
||
|
2.4 |
Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных |
– |
Оксиды и пероксиды натрия и калия. Электронное строение молекулы угарного газа. Получение и применение угарного газа. Биологическое действие угарного газа. Оксид кремния(IV). Оксиды и гидроксиды этих металлов, зависимость их свойств от степени окисления элемента. Закономерности в изменении свойств простых веществ, водородных соединений, высших оксидов и гидроксидов |
|
|
2.5 |
Характерные химические свойства оснований и амфотерных гидрок- сидов |
– |
||
|
2.6 |
Характерные химические свойства кислот |
– |
Кремниевые кислоты и их соли. Азотная кислота как окислитель. Фосфорные и полифосфорные кислоты. Особые свойства концентрированной серной кислоты. Галогеноводороды и их получение. Кислородсодержащие соединения хлора. Галогеноводородные кислоты и их соли |
|
|
2.7 |
Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соедине- ний алюминия и цинка) |
– |
Важнейшие соли. Соли натрия, калия, кальция и магния, их значение в природе и жизни чело- века. Жёсткость воды и способы её устране- ния. Комплексные соединения алюминия. Алюмосиликаты. Окислительные свойства со- лей хрома и марганца в высшей степени окис- ления. Комплексные соединения хрома. Крем- ниевые кислоты и их соли. Нитраты, их физические и химические свойства, применение. Биологическая роль фосфатов. Карбонаты и гидрокарбонаты. Силикатные минералы – основа земной коры. Галогеноводородные кислоты и их соли |
|
|
2.8 |
Взаимосвязь различных классов неорганических веществ |
– |
– |
Обобщённый план варианта КИМ ЕГЭ 2022 года по ХИМИИ
Используются следующие условные обозначения.
Уровни сложности заданий: Б – базовый; П – повышенный; В – высокий.
|
Номер зада- ния |
Проверяемые элементы содержания |
Коды про- веряемых элементов содержа- ния по коди- фикатору |
Коды требо- ваний |
Уро- вень слож- ности зада- ния |
Макс. балл за выпол- нение зада- ния |
При- мерное время выпол- нения задания (мин.) |
|
Часть 1 |
||||||
|
1 |
Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояния атомов |
1.1.1 |
1.2.1, 2.3.1 |
Б |
1 |
2–3 |
|
2 |
Закономерности изменения химических |
1.2.1, |
1.2.3, |
Б |
1 |
2–3 |
|
свойств элементов и их соединений по |
1.2.2, |
2.4.1, |
||||
|
периодам и группам. |
1.2.3, |
2.3.1 |
||||
|
Общая характеристика металлов IА–IIIА |
1.2.4 |
|||||
|
групп в связи с их положением |
||||||
|
в Периодической системе химических |
||||||
|
элементов Д.И. Менделеева |
||||||
|
и особенностями строения их атомов. |
||||||
|
Характеристика переходных элементов – |
||||||
|
меди, цинка, хрома, железа – по их |
||||||
|
положению в Периодической системе |
||||||
|
химических элементов Д.И. Менделеева |
||||||
|
и особенностям строения их атомов. |
||||||
|
Общая характеристика неметаллов IVА– |
||||||
|
VIIА групп в связи с их положением |
||||||
|
в Периодической системе химических |
||||||
|
элементов Д.И. Менделеева |
||||||
|
и особенностями строения их атомов |
||||||
|
3 |
Электроотрицательность. Степень |
1.3.2 |
1.1.1, |
Б |
1 |
2–3 |
|
окисления и валентность химических |
2.2.1 |
|||||
|
элементов |
© 2022 Федеральная служба по надзору в сфере образования и науки

|
Номер зада- ния |
Проверяемые элементы содержания |
Коды про- веряемых элементов содержа- ния по коди- фикатору |
Коды требо- ваний |
Уро- вень слож- ности зада- ния |
Макс. балл за выпол- нение зада- ния |
При- мерное время выпол- нения задания (мин.) |
|
4 |
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения |
1.3.1, 1.3.3 |
2.2.2, 2.4.2, 2.4.3 |
Б |
1 |
2–3 |
|
5 |
Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) |
2.1 |
1.3.1, 2.2.6 |
Б |
1 |
2–3 |
|
6 |
Характерные химические свойства |
1.4.5, |
1.1.1, |
П |
2 |
5–7 |
|
простых веществ – металлов: щелочных, |
1.4.6, |
1.1.2, |
||||
|
щёлочноземельных, магния, алюминия; |
2.5, |
1.2.1, |
||||
|
переходных металлов: меди, цинка, хрома, |
2.6, |
2.3.3, |
||||
|
железа. |
2.7 |
2.4.4 |
||||
|
Характерные химические свойства |
||||||
|
простых веществ – неметаллов: водорода, |
||||||
|
галогенов, кислорода, серы, азота, |
||||||
|
фосфора, углерода, кремния. Характерные |
||||||
|
химические свойства оксидов: оснóвных, |
||||||
|
амфотерных, кислотных |
||||||
|
Характерные химические свойства |
||||||
|
оснований и амфотерных гидроксидов. |
||||||
|
Характерные химические свойства кислот. |
||||||
|
Характерные химические свойства солей: |
||||||
|
средних, кислых, оснóвных; комплексных |
||||||
|
(на примере гидроксосоединений |
||||||
|
алюминия и цинка). |
||||||
|
Электролитическая диссоциация |
||||||
|
электролитов в водных растворах. |
||||||
|
Сильные и слабые электролиты. |
||||||
|
Реакции ионного обмена |
© 2022 Федеральная служба по надзору в сфере образования и науки
Спецификация КИМ ЕГЭ 2022 г. ХИМИЯ, 11 класс 14 / 18
|
Номер зада- ния |
Проверяемые элементы содержания |
Коды про- веряемых элементов содержа- ния по коди- фикатору |
Коды требо- ваний |
Уро- вень слож- ности зада- ния |
Макс. балл за выпол- нение зада- ния |
При- мерное время выпол- нения задания (мин.) |
|
7 |
Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). Характерные химические свойства неорганических веществ:
комплексных (на примере гидроксосоединений алюминия и цинка) |
2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7 |
1.3.1, 2.2.6, 2.3.3 |
П |
2 |
5–7 |
|
8 |
Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная); Характерные химические свойства неорганических веществ:
гидроксосоединений алюминия и цинка) |
2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7 |
1.3.1, 2.2.6, 2.3.3, 2.4.3, 2.4.4 |
П |
2 |
5–7 |
|
9 |
Взаимосвязь неорганических веществ |
2.8 |
2.3.3, 2.4.3 |
Б |
1 |
2–3 |
© 2022 Федеральная служба по надзору в сфере образования и науки

|
Номер зада- ния |
Проверяемые элементы содержания |
Коды про- веряемых элементов содержа- ния по коди- фикатору |
Коды требо- ваний |
Уро- вень слож- ности зада- ния |
Макс. балл за выпол- нение зада- ния |
При- мерное время выпол- нения задания (мин.) |
|
10 |
Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) |
3.3 |
2.2.6 |
Б |
1 |
2–3 |
|
11 |
Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа |
3.1, 3.2 |
1.2.1, 2.2.2, 2.2.3, 2.2.7 |
Б |
1 |
2–3 |
|
12 |
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории). Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории) |
3.4, 3.5, 3.6, 4.1.7, 4.1.8 |
1.3.4, 2.3.4, 2.4.4, 2.5.1 |
Б |
1 |
2–3 |
|
13 |
Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки |
3.7, 3.8 |
2.3.4 |
Б |
1 |
2–3 |
© 2022 Федеральная служба по надзору в сфере образования и науки
Спецификация КИМ ЕГЭ 2022 г. ХИМИЯ, 11 класс 16 / 18
|
Номер зада- ния |
Проверяемые элементы содержания |
Коды про- веряемых элементов содержа- ния по коди- фикатору |
Коды требо- ваний |
Уро- вень слож- ности зада- ния |
Макс. балл за выпол- нение зада- ния |
При- мерное время выпол- нения задания (мин.) |
|
14 |
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Важнейшие способы получения углеводородов. Ионный (правило В.В. Марковникова) и радикальные механизмы реакций в органической химии |
3.4, 4.1.7 |
2.3.4, 2.4.4 |
П |
2 |
5–7 |
|
15 |
Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений |
3.5, 3.6, 4.1.8 |
2.3.4 |
П |
2 |
5–7 |
|
16 |
Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений |
3.9 |
2.3.4, 2.4.3 |
Б |
1 |
2–3 |
|
17 |
Классификация химических реакций в неорганической и органической химии |
1.4.1 |
2.2.8 |
Б |
1 |
2–3 |
|
18 |
Скорость реакции, её зависимость от различных факторов |
1.4.3 |
2.4.5 |
Б |
1 |
2–3 |
|
19 |
Реакции окислительно-восстановительные |
1.4.8 |
2.2.1, 2.2.5 |
Б |
1 |
2–3 |
|
20 |
Электролиз расплавов и растворов (солей, щелочей, кислот) |
1.4.9 |
1.1.3, 2.2.5 |
Б |
1 |
2–3 |
|
21 |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная |
1.4.7 |
2.2.4 |
Б |
1 |
2–3 |
|
22 |
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов |
1.4.4 |
2.4.5 |
П |
2 |
5–7 |
|
23 |
Обратимые и необратимые химические реакции. Химическое равновесие. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ |
1.4.4, 4.3.3 |
1.1.1, 2.5.2 |
П |
2 |
5–7 |
|
24 |
Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений |
4.1.4, 4.1.5 |
2.5.1 |
П |
2 |
5–7 |
© 2022 Федеральная служба по надзору в сфере образования и науки

|
Номер зада- ния |
Проверяемые элементы содержания |
Коды про- веряемых элементов содержа- ния по коди- фикатору |
Коды требо- ваний |
Уро- вень слож- ности зада- ния |
Макс. балл за выпол- нение зада- ния |
При- мерное время выпол- нения задания (мин.) |
|
25 |
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки |
4.1.1, 4.1.2, 4.2.1, 4.2.2, 4.2.3, 4.2.4, 4.2.5 |
1.3.2, 1.3.3, 1.3.4, 2.2.4 |
Б |
1 |
2–3 |
|
26 |
Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе» |
4.3.1 |
2.5.2 |
Б |
1 |
3–4 |
|
27 |
Расчёты теплового эффекта (по термохимическим уравнениям) |
4.3.4 |
2.5.2 |
Б |
1 |
3–4 |
|
28 |
Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси |
4.3.3, 4.3.8, 4.3.9 |
2.5.2 |
Б |
1 |
3–4 |
|
Часть 2 |
||||||
|
29 |
Окислитель и восстановитель. Реакции окислительно-восстановительные |
2.8 |
2.3.3, 2.4.3, 2.4.4 |
В |
2 |
10–15 |
© 2022 Федеральная служба по надзору в сфере образования и науки
Спецификация КИМ ЕГЭ 2022 г. ХИМИЯ, 11 класс 18 / 18
|
Номер зада- ния |
Проверяемые элементы содержания |
Коды про- веряемых элементов содержа- ния по коди- фикатору |
Коды требо- ваний |
Уро- вень слож- ности зада- ния |
Макс. балл за выпол- нение зада- ния |
При- мерное время выпол- нения задания (мин.) |
|
30 |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена |
1.4.8 |
2.2.5, 2.4.4 |
В |
2 |
10–15 |
|
31 |
Реакции, подтверждающие взаимосвязь различных классов неорганических веществ |
4.3.1 |
2.5.2 |
В |
4 |
10-15 |
|
32 |
Реакции, подтверждающие взаимосвязь органических соединений |
3.9 |
2.3.4, 2.4.3 |
В |
5 |
10–15 |
|
33 |
Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества. Расчёты массовой доли (массы) химического соединения в смеси |
4.3.1, 4.3.5, 4.3.6, 4.3.9 |
2.5.2 |
В |
4 |
20–25 |
Вариант подготовки к ЕГЭ по химии по неорганической химии:
Часть 1. Классификация неорганических веществ.
Часть 2. Оксиды.
Часть 3. Основания.
Часть 4. Амфотерные гидроксиды.
Часть 1.Классификация неорганических веществ.
К важнейшим классам неорганических веществ по традиции относят:
-
простые вещества (металлы и неметаллы),
-
оксиды (кислотные, основные и амфотерные),
-
гидроксиды (часть кислот, основания, амфотерные гидроксиды),
-
соли.
Простые вещества обычно делят на металлы и неметаллы.
Металлы – простые вещества, в которых атомы связаны между собой металлической связью.
Неметаллы – простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями.
По химическим свойствам среди металлов выделяют группу так называемых амфотерных металлов.
Это название отражает способность этих металлов, их оксидов и гидроксидов реагировать как с кислотами, так и со щелочами.
Оксиды – бинарные соединения, одним из двух элементов в которых является кислород со степенью окисления -2.
|
Основные |
Амфотерные |
Кислотные |
Несолеобразующие |
Солеобразные (двойные) |
|
Оксиды металлов в степенях окисления +1, +2, кроме амфотерных. |
Оксиды металлов в степенях окисления +2: толькоBe, Zn, Sn, Pb; +3 (все, кроме La2O3), +4 |
1) Оксиды неметаллов, кроме несолеобразующих; 2) Оксиды металлов в степенях окисления от +5 и выше. |
Оксиды неметаллов, которым не соответствуют кислоты. NO, N2O, CO, (SiO) |
Некоторые оксиды, в которых элемент имеет 2 степени окисления: Fe3O4 |
|
С о л е о б р а з у ю щ и е |
Каждому солеобразующему оксиду соответствует гидроксид:
Основным оксидам соответствуют основания;
Амфотерным оксидам – амфотерные гидроксиды,
Кислотным оксидам – кислородсодержащие кислоты.
Гидроксиды – соединения, в состав которых входит группа Э–О-Н. И основания, и кислородсодержащие кислоты, и амфотерные гидроксиды – относятся к ГИДРОКСИДАМ!
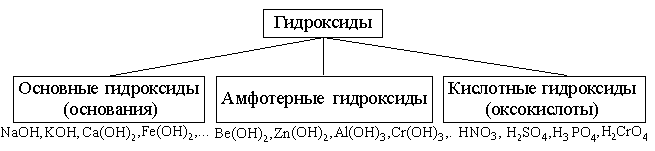
Связь между оксидом и гидроксидами.
|
Степень окисления |
Оксид |
Гидроксиды |
Примеры |
||
|
Основания |
Кислоты |
||||
|
+1 |
Э2О |
ЭОН |
НЭО |
КОН |
НClO |
|
+2 |
ЭО |
Э(ОН) 2 |
Н2ЭО2 |
Ba(OH) 2 |
? |
|
+3 |
Э2О3 |
Э(ОН) 3 |
НЭО2 (мета—форма) —(+H2O) Н3ЭО3 (орто-форма) |
Al(OH) 3 |
HNO2 H3PO3 |
|
+4 |
ЭО2 |
—— |
H2ЭО3 H 4ЭO 4 |
—— |
Н2СО3 H 4SiO 4 |
|
+5 |
Э2О5 |
—— |
НЭО3 Н3ЭО4 |
—— |
HNO3 H3PO4 |
|
+6 |
ЭО3 |
—— |
H2ЭO4 |
—— |
H2SO4 |
|
+7 |
Э2О7 |
—— |
НЭО4 —(+ 2H2O) H 5ЭО6 |
—— |
HClO4 H5IO6 |
КАК СОСТАВИТЬ ФОРМУЛУ КИСЛОТНОГО ГИДРОКСИДА
А. Если чётная степень окисления элемента в оксиде: ПРИБАВЛЯЕМ ВОДУ к оксиду. Пример: WO3 –(+H2O) H2WO4
Б. Если нечетная степень окисления:
|
Мета-форма кислоты — ОДИН атом водорода: НЭОх |
Орто-форма кислоты – отличается от МЕТА-формы на одну молекулу воды. Н3ЭОх+1 |
Пример: Оксид As2O5, степень окисления мышьяка +5.
Составим формулу кислоты: Н+As+5O-2x
Так как суммарный заряд =0, легко рассчитать, что х=3.
HAsO3 Это МЕТА-форма кислоты — мета-мышьяковая кислота.
Но для фосфора и мышьяка существует и более устойчива ОРТО-форма. Прибавив к мета-форме Н2О, получим H3AsO4. Это орто-
мышьяковая кислота.
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы ОН— и при диссоциации образующие в качестве анионов только эти ионы.
Типы оснований
|
Растворимые (Щелочи) |
Нерастворимые |
|
1) гидроксиды металлов первой группы главной подгруппы: LiOH, NaOH, KOH, RbOH, CsOH 2) гидроксиды металлов второй группы главной подгруппы, начиная с кальция: Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Все остальные гидроксиды металлов. |
КИСЛОТНОСТЬ основания – это число групп ОН в его формуле:
однокислотные – содержащие только 1 гидроксогруппу
двухкислотные – имеющие 2 гидроксогруппу;
трёхкислотные – с тремя группами ОН.
Кислоты – сложные вещества, содержащие в своем составе ионы оксония Н+ или при взаимодействии с водой образующие в качестве катионов только эти ионы.
Классификация кислот по составу.
|
Кислородсодержащие кислоты |
Бескислородные кислоты |
|
1) высшие кислоты H2SO4 серная кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота 2) кислоты с меньшей степенью окисления неметалла H2SO3 сернистая кислота HNO2 азотистая кислота |
HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
Классификация кислот по числу атомов водорода.
|
Одноосновные |
Двухосновные |
Трехосновные |
|
HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная |
H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
H3PO4 фосфорная |
Классификация по силе и устойчивости
|
Сильные кислоты |
Слабые кислоты |
|
HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная HClO4 хлорная |
HF фтороводородная H3PO4 фосфорная HNO2 азотистая (неустойчивая) H2SO3 сернистая (неустойчивая) H2CO3 угольная (неустойчивая) H2S↑ сероводородная H2SiO3↓ кремниевая СН3СООН уксусная |
Соли – это сложные вещества, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп, например, аммонийных групп NН4+) и одного (или нескольких) кислотных остатков.
Классификация солей.
|
СОЛИ |
|||||
|
Средние |
Кислые |
Основ-ные |
Двойные |
Сме-шанные |
Комплексные |
|
Продукт полного замещения атомов водорода в кислоте на металл |
Продукт непол-ного замещения атомов водоро-да в кислоте на металл |
Продукт непол-ного заме-щения ОН-групп на кислотный остаток |
Содержат два разных металла и один кислотный остаток |
Содер-жат один металл и два кислотных остатка |
Содержат комплексный катион или анион – атом металла, связанный с несколькими лигандами. |
|
AlCl3 |
КHSO4 |
FeOHCl |
KAl(SO4)2 |
CaClBr |
K2[Zn(OH)4] |
|
Хлорид алюминия |
Гидросульфат калия |
Хлорид гидроксожелеза (II) |
Сульфат алюминия-калия |
Хлорид-бромид кальция |
Тетрагидроксоцинкат калия |
Номенклатура солей. В названиях солей используются латинские названия образующих кислоты неметаллов.
|
Элемент |
Латинское название |
Корень |
|
Н |
гидрогениум |
ГИДР- |
|
С |
карбоникум |
КАРБ- |
|
N |
нитрогениум |
НИТР- |
|
S |
сульфур |
СУЛЬФ- |
Построение названий солей.
|
Соль какой кислоты |
Кислотный остаток |
Название солей |
Примеры |
|
|
Высшие кислоты |
Азотная HNO3 |
NO3— |
нитраты |
Ca(NO3)2 нитрат кальция |
|
Кремниевая H2SiO3 |
SiO32— |
силикаты |
Na2SiO3 силикат натрия |
|
|
Угольная H2CO3 |
CO32— |
карбонаты |
Na2CO3 карбонат натрия |
|
|
Фосфорная H3PO4 |
PO43- |
фосфаты |
AlPO4 фосфат алюминия |
|
|
Серная H2SO4 |
SO42— |
сульфаты |
PbSO4 сульфат свинца |
|
|
Бескислородные кислоты |
Бромоводородная HBr |
Br— |
бромиды |
NaBr бромид натрия |
|
Иодоводородная HI |
I— |
иодиды |
KI иодид калия |
|
|
Сероводородная H2S |
S2— |
сульфиды |
FeS сульфид железа (II) |
|
|
Соляная HCl (хлороводородная) |
Cl— |
хлориды |
NH4Cl хлорид аммония |
|
|
Фтороводородная HF |
F— |
фториды |
CaF2 фторид кальция |
|
|
Более низкая степ. ок. |
Cернистая кислота H2SO3 |
SO32— |
сульфиты |
К2SO3 сульфит калия |
|
Азотистая HNO2 |
NO2— |
нитриты |
КNO2 нитрит калия |
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода. Названия кислых солей содержат приставку «гидро»: NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы. Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо»:
Mg(OH)Cl — гидроксохлорид магния (основная соль)
Двойные соли – имеют два разных катиона металла или аммония. В названии их перечисляют через дефис:
(NH4)Fe(SO4)2 – сульфат железа (III)-аммония.
Смешанные соли – имеют два разных аниона кислотных остатков. В названии их называют через дефис: СаOCl2 или CaCl(OCl) — хлорид-гипохлорит кальция (традиционное название хлорная известь).
Комплексные соли – содержат сложный комплексный анион (или реже катион), состоящий из металла-комплексообразователя и нескольких лигандов (отрицательно заряженные ионы или молекулы аммиака или воды).
Пример: K[Al(OH)4] – тетрагидроксоалюминат калия
K4[Fe(CN)6] – гексацианоферрат калия
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II)
Бытовые (тривиальные) названия некоторых солей.
|
Соль |
Международное название |
Традиционное название |
|
NaHCO3 |
Гидрокарбонат натрия |
Сода питьевая |
|
Na2CO3 |
Карбонат натрия |
Сода кальцинированная |
|
K2CO3 |
Карбонат калия |
Поташ |
|
Na2SO4 |
Сульфат натрия |
Глауберова соль |
|
KClO3 |
Хлорат калия |
Бертолетова соль |
|
Ca3(PO4)2 |
Фосфат кальция |
Фосфорит |
|
СаСО3 |
Карбонат кальция |
Известняк |
|
CuSO4∙5H2O |
Пентагидрат сульфата меди |
Медный купорос |
|
Na2CO3∙10Н2О |
Декагидрат карбоната натрия |
Сода кристаллическая |
Часть 2. Оксиды, получение и свойства.
Получение оксидов:
|
Способы получения. |
Примеры. |
Ограничения и примечания |
|
1. Окисление простых веществ: |
а) металлов: 2Ca + O2 2CaO б) неметаллов: 4P + 3O2 (нед) 2P2O 3 4P + 5O2 (изб) 2P2O5 (Из S – SO2, из Fe – Fe2O3 и Fe3O4, из N2 – NO) |
С кислородом не реагируют галогены, инертные газы, Au, Pt. Азот реагирует в жестких условиях (2000°C). |
|
2. Окисление сложных веществ: |
а) водородных соединений: 2Н2S + 3O 2 2H2O + 2SO 2 б) сульфидов, карбидов, фосфидов (бинарных соединений): 2ZnS + 3O2 2ZnO + 2SO2 |
Каждый элемент сложного вещества окисляется в соответствии со своими свойствами. |
|
3. Разложение гидроксидов и солей: |
а) гидроксидов (оснований и кислот):2Al(OH)3→ t Al2O3 + 3H2O H2SiO3 → t SiO2 + H2O б) карбонатов: СаСО3→ t CaO+CO2 |
Гидроксиды и карбонаты щелочных металлов (Na,K, Rb,Cs) не разлагаются. |
|
4. Окисление кислородом или озоном |
а) кислородом: 2СО + О2 2СО2 б) озоном: NO + O3 NO2 + O2 |
Возможна, если элемент имеет несколько оксидов (сера, фосфор, углерод, азот, железо). |
СВОЙСТВА ОКСИДОВ.
Основные оксиды – оксиды, которым соответствуют основания. Это оксиды металлов со степенями окисления +1 и +2, кроме амфотерных (ZnO, BeO, SnO, PbO)
Свойства основных оксидов.
|
Свойства |
Примеры реакций |
Ограничения и примечания |
|
1) Реакция с растворами кислот |
Li2O + 2HCl= 2LiCl+ H2O NiO + H2SO4 = NiSO4 + H2O |
Кислота должна существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная) |
|
2) Реакция с водой |
Li2O + H2O = 2LiOH BaO + H2O = Ba(OH)2 (только 8 оксидов: IA группа, СаО, SrO, ВаО) |
Оксид реагирует с водой, только если в результате образуется растворимый гидроксид (щелочь). |
|
3) Реакция с кислотными и амфотерными оксидами |
BaO + CO2 = BaCO3, FeO + SO3 = FeSO4, CuO + N2O5 = Cu(NO3) 2 СаО + SO2 = CaSO3 |
Один из реагирующих оксидов (основный или кислотный) должен соответствовать сильному гидроксиду. |
|
4) Восстановление оксида до металла или до низшего оксида: |
MnO + C = Mn + CO (при нагревании), FeO + H2 = Fe + H2O (при нагревании). Fe2O3 + CO = FeO + CO2 |
В качестве восстановителей используют: СО, С, водород, алюминий, магний. С водородом реагируют оксиды неактивных металлов. |
|
5) Окисление кислородом. |
4FeO + O2 = 2Fe2O3 |
Если металл имеет несколько оксидов с разными степенями окисления. |
Кислотные оксиды – оксиды, которым соответствуют кислоты.
Кислотные оксиды при комнатной температуре бывают:
*газы (например: СО2, SO2, NO, SeO2)*жидкости (например, SO3, Mn2O7) *твердые вещества (например: B2O3, SiO2, N2O5, P2O3, P2O5, I2O5, CrO3).
Свойства кислотных оксидов.
|
Свойства |
Примеры реакций |
Примечания |
|
1) Реакция с основа—ниями |
CO2 + Ca(OH) 2 = CaCO3 + H2O SiO2 + 2KOH = K2SiO3 + H2O (при нагревании), SO3 + 2NaOH = Na2SO4 + H2O, N2O5 + 2KOH = 2KNO3 + H2O. |
Реакция возможна со щелочами. Наиболее активные кислотные оксиды (SO3, CrO3, N2O5, Cl2O7) могут реагировать и с нерастворимыми (слабыми) основаниями. |
|
2) Реакция с амфотер-ными и основными оксидами |
CO2 + CaO = CaCO3 P2O5 + 6FeO = 2Fe3(PO4)2 (при нагревании) N2O5 + ZnO = Zn(NO3)2 |
Один из реагирующих оксидов (основный или кислотный) должен соответствовать сильному гидроксиду. |
|
3) Реакция с водой. Образуют-ся КИСЛОТЫ. |
N2O3 + H2O = 2HNO2 SO2 + H2O = H2SO3 N2O5 + H2O = 2HNO3 SO3 + H2O = H2SO4 |
Оксид реагирует с водой, если в результате образуется растворимый гидроксид. Не реагирует с водой SiO2. |
|
4) Реакции с солями летучих кислот. |
SiO2 + K2CO3 = K2SiO3 + CO2 (при нагревании) |
Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие. |
|
5) Окисле—ние. |
2SO2 + O2 ⇆ 2SO3 |
Низшие оксиды окисляются до высших. |
Амфотерные оксиды – оксиды, способные реагировать и с кислотами, и со щелочами. По химическим свойствам амфотерные оксиды похожи на основные оксиды и отличаются от них только своей способностью реагировать с щелочами, как с твердыми (при сплавлении), так и с растворами, а также с основными оксидами.
Вещества, образуемые катионами амфотерных металлов в щелочной среде:
|
Степень окисления |
В растворе |
В расплаве |
|
+2 (Zn, Be, Sn) |
Na 2[Zn (OH) 4] тетрагидроксоцинкат натрия |
Na2ZnO2 цинкат натрия |
|
+3 (Al, Cr, Fe*) |
Na[Al(OH)4] тетрагидроксоалюминат натрия Na3[Al(OH)6] гексагидроксоалюминат натрия |
NaAlO2 метаалюминат натрия и Na3AlO3 ортоалюминат натрия |
|
*) железо не образует устойчивых гидроксокомплексов, амфотерно только в расплаве, образуя NaFeO2 |
СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ.
|
Cвойства |
Примеры реакций |
Примечания |
|
1) Реагируют с кислотами, так же, как основные оксиды – образуются соли. |
ZnO + 2HCl = ZnCl2 + H2O Al2O3 + 6HNO3 = 2Al(NO3)3 +3H2O |
Только с сильными кислотами |
|
2) Взаимодействуют с растворами щелочей – образуются растворы гидроксокомплексов. |
Al2O3 + 2KOH +3H2O = 2K[Al(OH)4] или K3[Al(OH)6] ZnO +2NaOH +H2O=Na2[Zn(OH)4] |
|
|
3) Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов. |
Al2O3 + 2KOH → t 2KAlO2 + H2O (или K3AlO3) ZnO + 2KOH → t K2ZnO2 + H2O |
|
|
4) При сплавлении могут взаимодействовать с карбонатами щелочных металлов, как со щелочами. |
Al2O3 + Na2CO3 → t 2NaAlO2+CO2 (или Na3AlO3) ZnO + Na2CO3 → t Na2ZnO2+ CO2 |
Часть 3. Основания.
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы или при взаимодействии с водой образующие эти ионы в качестве анионов.
Щелочи – растворимые основания, в водном растворе создают щелочную среду засчёт иона ОН—, который образуется при их ДИССОЦИАЦИИ: KOH K+ + OH—
Нерастворимые основания в водном растворе щелочную среду не создают!
Получение оснований:
|
Способ получения |
Примеры реакций |
Примечания |
|
1) Реакция активных металлов с водой (только если образуется растворимый гидроксид!) |
2Na + 2H2O = 2NaOH + H2 |
С водой реагируют металлы IA подгруппы, Са, Sr, Ba |
|
2) Взаимодействие основных оксидов с водой (только если образуется растворимый гидроксид!) |
ВаО + Н2О = Ва(ОН)2 |
С водой реагируют оксиды металлов IA подгруппы, Са, Sr, Ba. |
|
3) Электролиз растворов хлоридов и бромидов щелочных металлов. |
2KCl + 2H2O sup9(эл.ток Cl2+ H2 + 2KOH |
|
|
4) Обменные реакции в растворе. |
Ba(OH)2 + Na2SO4 = BaSO4 ↓+ 2NaOH |
Исходные вещества должны быть растворимы!В продуктах должен быть осадок! |
|
5) Взаимодействие солей тяжелых металлов со щелочами. |
СuCl2 + 2KOH = Сu(OH)2 + 2KCl |
Получение нерастворимых гидроксидов. |
СВОЙСТВА ОСНОВАНИЙ:
1. Свойства щелочей – растворимых оснований.
|
1) Взаимодействие с кислотами – реакция нейтрализации |
NaOH + HNO2 = NaNO2 + H2O |
|
2) С кислотными оксидами. В зависимости от соотношения щелочи и оксида получаются средние и кислые соли |
SiO2(тв.)+ 2NaOH → t Na2SiO3 + +H2O 2NaOH (избыток) + CO2 = Na2CO3 + H2O NaOH+ CO2(избыток) = NaНCO3 |
|
3)Реакция с растворами средних солей. |
2NaOH + FeSO4 = Fe(OH)2↓+ Na2SO4 2KOH + (NH4)2SO4 = K2SO4 + 2NH3+ 2H2O Исходные вещества должны быть растворимы, в продуктах — газ или осадок. |
|
3*) Соль амфотерного металла со щелочью. |
AlCl3 + 3KOH(недостаток) = Al(OH)3↓ + 3KCl AlCl3 + 4KOH(избыток) = 3KCl + K[Al(OH)4] В зависимости от количества щелочи может образовывать гидроксид или гидроксокомплекс. |
|
4) Реакция с кислыми солями – образуется средняя соль или менее кислая. |
NaOH + NaHCO3 = H2O + Na2CO3 КОН + КН2РО4 = К2НРО4+H2O |
|
5) Реакция с амфотерными оксидами и гидроксидами. |
2NaOH + Cr2O3 → t 2NaCrO2 + H2O (сплавление) Раствор: 2KOH + ZnO +H2O=K2[Zn(OH)4] 2NaOH +Zn(OH)2=Na2[Zn(OH)4] 3KOH + Cr(OH)3 = K3[Cr(OH)6] |
|
6) Реакция с амфотерными металлами |
2NaOH + Zn +2H2O = Na2[Zn(OH)4] + H2 (кроме Fe и Cr) |
|
7) Взаимодействие с неметаллами (кроме N2, C, O2, инертных газов): |
2F2 + 4NaOH = O2 + 4NaF + 2H2O Si + 2KOH + H2O = K2SiO3 + 2H2 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O– реакция диспропорционирования (S,P,Cl2,Br2,I2). |
|
|
2LiOH –(t) Li2O + H2O |
2. Свойства нерастворимых оснований.
|
1) Взаимодействие с сильными кислотами – реакция нейтрализации. |
Fe(OH) 2+2HCl =FeCl2 + 2H2O |
|
2) Реакция с кислотными оксидами (только очень сильных кислот – SO3,N2O5, Cl2O7) |
Cu(OH)2 + N2O5 → t Cu(NO3)2 |
|
3) Разложение при нагревании. |
Сu(OH)2 → t CuO + H2O AgOH распадается сразу в момент получения. |
|
4) Окисление низших неустойчивых оснований кислородом. |
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 2Mn(OH)2 + O2 = 2MnO2 + 2H2O |
Часть 4. Амфотерные гидроксиды
– это гидроксиды, которые могут в зависимости от условий проявлять как кислотные, так и основные свойства (двойственный характер).
+2: Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2
+3: Al(OH)3, Cr(OH)3, [Fe(OH)3–слабо амфотерный, не образует гидроксокомплексов, реагирует со щелочами только в сплаве!]
Получение амфотерных гидроксидов.
|
1) Реакции растворов солей со щелочью в недостатке: ZnCl2 + NaOH (недостаток) = Zn(OH)2↓ + 2NaCl |
|
2) Реакции взаимного гидролиза солей Al+3 ,Cr+3 , Fe+3 и солей летучих кислот: 2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓+3CO2+ 6NaCl (SO32-,S2-) |
|
3) Выделение из гидроксокомплекса под действием слабых кислот или их оксидов: K3[Cr(OH)6] + 3CO2 Cr(OH)3 + 3KHCO3 (Al3+) (H2S, SO2) |
Свойства амфотерных гидроксидов.
|
Свойства |
Примеры реакций |
Примечания |
|
1) Реагируют с кислотами, образуются соли. |
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Al(OH)3+3HNO3=Al(NO3)3+ 3H2O |
Только с сильными кислотами |
|
2) Взаимо-действуют с растворами щелочей. |
2NaOH+Zn(OH)2=Na2[Zn(OH)4] Тетрагидроксоцинкат натрия. 3KOH+ Cr(OH)3 = K3[Cr(OH)6] Гексагидроксохромат (III) калия |
в растворе образуются гидроксокомплексы, кроме железа! |
|
3) Реагируют с расплавами щелочей – образуя соли. |
Al(OH)3 + KOH → t KAlO2+ 2H2O (или K3AlO3) Zn(OH)2+2KOH→ t K2ZnO2 + 2H2O |
|
|
4) При сплавлении реагируют с карбонатами щелочных металлов. |
2Al(OH)3+ Na2CO3 = 2NaAlO2 (или Na3AlO3) + CO2+ 3Н2О (при нагревании) Zn(OH)2 + Na2CO3 = Na2ZnO2 + CO2 + Н2О (при нагревании) |
|
|
5) Разлагаются при нагревании |
2Al(OH)3 → t Al2O3 + 3H2O |

















































 Щелочи (кроме LiOH) при нагревании не разлагаются.
Щелочи (кроме LiOH) при нагревании не разлагаются.