Образовательный портал для подготовки к экзаменам
Химия
Сайты, меню, вход, новости
Задания
Версия для печати и копирования в MS Word
Установите соответствие между веществом и его применением: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) анилин
Б) ацетилен
В) толуол
ПРИМЕНЕНИЕ
1) в качестве моторного топлива
2) газовая сварка металлов
3) в качестве растворителя
4) производство красителей и лекарств
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
А. Анилин применяется в производстве красителей (4).
Б. Ацетилен используется для газовой резки и сварки металлов (2).
В. Толуол широко используется в качестве растворителя (3).
Ответ: 423.
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
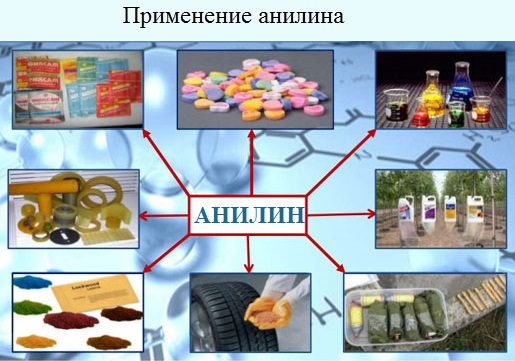
Применение анилина
Анилин широко применяется в производстве синтетических красителей. Он также входит в состав типографских красок и красителей для тканей.
Используется в производстве лекарственных средств (сульфаниламидные препараты), смол, лаков, духов, кремов для обуви, фотографических химикалий, взрывчатых веществ, гербицидов и фунгицидов.
Анилин находит применение в качестве вулканизатора каучука, антиоксиданта и антиозонового средства.
Анилин
Анилин (фениламин)
C6H5NH2
— это первичный ароматический амин. При обычных условиях анилин представляет собой бесцветную маслянистую жидкость с неприятным запахом, малорастворимую в воде. При длительном хранении он постепенно окисляется и темнеет. Анилин ядовит.
1. Основные свойства.
Из-за влияния бензольного кольца основные свойства анилина выражены слабее, чем у насыщенных аминов и аммиака. Анилин не реагирует с водой, но вступает в реакции с сильными кислотами. При взаимодействии анилина с серной кислотой может образоваться гидросульфат или сульфат фениламмония:
C6H5NH2+H2SO4→[C6H5NH3]HSO4,
2C6H5NH2+H2SO4→[C6H5NH3]2SO4.
В реакции с соляной кислотой образуется хлорид фениламмония:
C6H5NH2+HCl→[C6H5NH3]Cl.
Смотри видео по теме.
Соли фениламмония растворяются в воде. Они реагируют со щелочами с образованием анилина:
[C6H5NH3]Cl+NaOH→C6H5NH2+NaCl+H2O.
Эти соли могут вступать и в другие реакции обмена, если один из продуктов выпадает в осадок:
[C6H5NH3]Cl+AgNO3→C6H5NH2NO3+AgCl↓.
2. Свойства бензольного кольца.
Аминогруппа также оказывает влияние на бензольное кольцо, что приводит к изменению его свойств. Так, анилин, в отличие от бензола, реагирует с бромной водой. Продукт реакции — (2), (4), (6)-триброманилин, он выпадает в виде белого осадка:
C6H5NH2+3Br2→C6H2Br3NH2↓+3HBr.
Реакцию с бромной водой используют для качественного определения анилина.
Смотри видео по теме.
3. Реакция горения.
В результате горения анилина в избытке кислорода происходит его полное окисление до углекислого газа, воды и азота:
4C6H5NH2+31O2→24CO2+14H2O+2N2.
Анилин получают восстановлением нитробензола. В качестве восстановителя используют атомарный водород в момент его образования при взаимодействии металла (цинка или железа) с соляной кислотой:
C6H5−NO2+6H⟶Zn,HClC6H5−NH2+2H2O.
Восстановителем может служить также газообразный водород в присутствии катализатора:
C6H5−NO2+3H2⟶Cu,tC6H5−NH2+2H2O.
Анилин находит применение как химическое сырьё в производстве многочисленных красителей, лекарств (например, сульфаниламидных препаратов), полимеров, взрывчатых материалов. Ароматические амины входят в состав чёрных чернил для принтеров.
Содержание
- Анилин: химические свойства, получение, применение, токсичность
- Получение
- Физические свойства
- Химические свойства
- Применение
- Токсичность
- Свойства и применение анилина
- Физические свойства анилина
- Основные области применения анилина
- Анилиновые красители
- Токсичность анилина
- Анилин
- 1. Химические свойства
- 2. История
- 3. Производство и применение
- 4. Токсичные свойства
- Примечания
Анилин: химические свойства, получение, применение, токсичность
Анилин — это органическое соединение, содержащее ароматическое ядро и аминогруппу, соединенную с ним. Его также иногда называют фениламином или аминобензолом. Представляет собой маслянистую жидкость, не имеющую цвета, но с характерным запахом. Сильно ядовит.
Получение
Анилин — очень полезное промежуточное вещество, поэтому производится он в относительно больших масштабах. Промышленный синтез начинается с бензола. Его нитруют при температуре 60 °C смесью концентрированных серной и азотной кислот. Далее полученный нитробензол восстанавливают водородом при температуре около 250 °C, используя катализаторы. Также может применяться повышенное давление.
В лаборатории восстановление может производится водородом в момент его выделения. Для этого в реакционной смеси проводят взаимодействие металлического цинка или железа с кислотой. Полученный атомарный водород вступает во взаимодействие с нитробензолом.
Получать анилин можно в одну стадию, если проводить взаимодействие бензола со смесью азида натрия и хлорида алюминия. Реакция длится 12 часов. Выход такой реакции составляет 63 %.
Физические свойства
Как уже было отмечено выше, анилин — это бесцветная маслянистая жидкость. При температуре -5,9 °C он замерзает. Кипит при 184,4 °C. Плотность почти как у воды (1,02 г/см3). Анилин растворим в воде, хотя довольно слабо. Зато он смешивается в любых соотношениях с различными органическими растворителями: бензолом, толуолом, ацетоном, диэтиловым эфиром, этанолом и многими другими.
Химические свойства
Химические свойства анилина довольно разнообразны. Например, он проявляет как кислотные, так и основные свойства. Последние обусловлены тем, что аминогруппа может присоединять к себе ион водорода (протон). Отсюда и название этого процесса — протонирование. Благодаря этому анилин может взаимодействовать с кислотами, образуя соли:
C6H5NH2 + HCl → [C6H5NH3]+Cl-
Кислотные свойства объясняются тем, что атомы водорода в аминогруппе легко отщепляются и замещаются другими атомами. Так, анилин может взаимодействовать со щелочными металлами.
Реакция с калием идет без катализаторов, с натрием необходимо присутствие катализаторов: меди, никеля, кобальта или солей этих металлов.
[attention type=yellow]
Идти эта реакция может и с кальцием, но в этом случае необходимо нагревание до 200 °C.
[/attention]
Замещается водород и радикалами. Это происходит при взаимодействии анилина со спиртами. Реакция проводится в кислой среде, так как необходимо протонирование аминогруппы.
Температура реакционной смеси должна поддерживаться около 220 °C. Иногда применяется повышенное давление. Конечный продукт содержит моно-, ди- и тризамещенные производные анилина.
Поэтому для получения чистого вещества необходимо использовать очистку, например перегонку.
Алкилирование можно также проводить, используя алкилгалогениды. Здесь также может быть получены несколько продуктов.
Анилин может вступать в реакции и по ароматическому ядру. Обычно это реакции электрофильного замещения (нитрование, сульфирование, алкилирование, ацилирование). Аминогруппа активирует бензольное ядро, поэтому новые группы встают в пара-положение. Галогенирование происходит очень легко. В данном случае замещаются все атомы водорода в ядре.
Как видно из уравнений реакций, химические свойства анилина довольно разнообразные. Здесь указаны далеко не все.
Применение
Из-за своих физических и химических свойств, анилин в чистом виде применяется только в лабораториях, как реагент или органический растворитель. В промышленности весь анилин уходит на синтез более сложных и полезных соединений. Например, фосфат анилина применяется как ингибитор (замедлитель) коррозии углеродистых сталей.
Большая доля анилина идет на производство полиизоцианатов, из которых, в свою очередь, получают полиуретаны. Это органический полимер, который используют во многих отраслях промышленности для изготовления эластичных форм, защитных покрытий, лаков, герметиков.
7 % анилина применяется в качестве добавки для полимеров. Это может быть как чистый анилин, так и соединения, полученные из него. Они оказывают роль инициаторов, стабилизаторов, пластификаторов, порообразователей, вулканизаторов или ускорителей полимеризации. Такое разнообразие достигается благодаря специфичным химическим свойствам анилина.
Азотсодержащие органические вещества часто применяют в производстве красителей. Анилин не стал исключением. Из него напрямую синтезируют более 150 различных красителей, еще больше — из его производных. Самые важные из них — это анилиновый черный, пигмент глубоко-черный, нигрозины, индулины и азокрасители.
Токсичность
Анилин — токсичное вещество. Попадая в кровь, он образует соединения, которые вызывают кислородное голодание. Проникать в организм он может также и в виде паров, через кожу или слизистые оболочки. Признаками отравления анилином служат слабость, головокружение, головная боль. При более сильном отравлении возникает тошнота, рвота, а также учащение пульса.
Это вещество оказывает губительное воздействие на нервную систему. При хроническом отравлении может возникать снижение памяти, расстройства сна, а также психические нарушения.
Первая помощь при интоксикациии состоит в том, чтобы убрать источник отравления и омыть пострадавшего теплой водой. Это поможет растворить анилин, который осел на коже пострадавшего. Существуют и специальные антидоты. Их вводят в организм при тяжелых случаях.
Свойства и применение анилина
Анилин — органическое вещество. Впервые его получили в 1826 году. Другие названия – фениламин, аминобензол. Наименование «анилин» произошло от названия растения «индигофера анил», в котором содержится индиго. Раньше фениламин создавался с участием этого вещества. Рассмотрим свойства и применение анилина.
Вещество относится к простейшим ароматическим аминам. Его формула C6H5NH2.
Физические свойства анилина
Ядовитое вещество, пары которого токсичны. Представляет собой маслянистую жидкость, не имеющую цвета. Запах слабый, характерный именно для этого вещества. При его возгорании пламя яркое, коптящее.
Частично растворим в воде (при температуре кипения растворимость 6,4 %). Минерализованная вода понижает его растворимость, за исключением содержания бромидов лития и цезия, а также йодида цезия. Последний, наоборот, повышает растворимость анилина.
При хранении вещество темнеет, особенно быстро это происходит при воздействии воздуха и света. При этом он делается более вязким. Иначе данный процесс называют «аутооксидацией». Окисление может быть замедленно при помощи добавления антиоксидантов – щавелевой кислоты, гидро- и тиосульфата натрия.
Ниже приведены характеристики анилина при нормальном атмосферном давлении:
- температура кипения — 184,4 °С;
- температура плавления/замерзания – минус 5,89 °С;
- плотность при температуре 20 °С — 1,02 г/см куб.;
- температура самовоспламенения на воздухе — 562 °C;
- температура вспышки на воздухе – 79 °C.
Основные области применения анилина
В России вещество в основном применяют для синтеза красителей и лекарственных средств, в текстильной и фармацевтической промышленности. С помощью анилина получают препараты группы сульфамидов, обладающие антибактериальным действием, а также синтезируют заменители сахара.
Существуют и другие области применения аниолина. В химии его используют для получения гидрохинона – вещества, использующегося в косметике, в основном в составе отбеливающих кожу средств. Также вещество применяется в создании взрывчатых веществ, клеев, герметиков.
При помощи анилина замедляется коррозия металлов: его фосфаты добавляют к растворам сильных электролитов, в результате чего ингибируется коррозия углеродистой стали.
[attention type=red]
Применяют анилин и для повышения антидетонационности топлива (автомобильного, ракетного, авиационного). Октановое число бензина при однопроцентном содержании анилина повышается на 3 единицы и более.
[/attention]
Но в чистом виде вещество стараются не использовать, так как при длительном хранении понижается качество бензина с анилином, а также токсичность его газов. Чаще используются производные вещества.
В ряде западных государств существуют ограничения на применение анилина в составе топлива.
В мире большая часть получаемого анилина используется в производстве полиуретанов, а также синтетических каучуков, красок, средств от сорняков.
Анилиновые красители
Самой главной сферой применения анилина было и остается производство красителей. Они изготовляются при помощи окисления анилина и его солей.
Первоначально анилиновые краски выпускались только в форме порошка. В СССР им находили применение в быту, реставрируя и переделывая вещи посредством их окраски. Но покрашенные вещи быстро блёкли при попадании солнечного света, краска вымывалась в процессе стирки.
В настоящее время анилиновые красители производятся и в форме растворов, причем некоторые производители выпускают концентрированные растворы, которые в отличие от порошков не требуют особой подготовки ткани.
Но, несмотря на ощутимый прогресс и улучшение красителей, ткани, покрашенные ими, по-прежнему быстро выгорают на солнце.
Токсичность анилина
Анилин — токсичное вещество. Может угнетать нервную систему, при попадании в кровь вызывает кислородное голодание тканей. Попасть в организм может в виде паров, а также проникнуть через кожу и слизистые оболочки.
Сейчас отравления анилином бывают редко. Опасность это вещество представляет в основном для тех, кто работает с ним. Во избежание попадания токсина в организм нужно соблюдать установленные меры безопасности.
При окрашивании дома вещей анилиновыми красителями, в особенности порошковыми, нужно беречь их от детей, проветривать помещение, в котором производится окраска, не глотать вещество, при попадании на части тела немедленно смывать его водой и производить окрашивание в перчатках.
Если анилин был случайно проглочен, нужно незамедлительно обращаться к врачу.
Анилин
- Введение
- 1 Химические свойства
- 2 История
- 3 Производство и применение
- 4 Токсичные свойства
Примечания
Анили́н (фениламин) — органическое соединение с формулой С6H5NH2, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
1. Химические свойства
Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок).
2. История
Впервые анилин был получен в 1826 году при перегонке индиго с известью немецким химиком Отто Унфердорбеном (нем. Otto Unverdorben), который дал ему название «кристаллин». В 1834 Ф. Pyнгe обнаружил анилин в кам.-уг. смоле и назвал «кианолом». В 1841 Ю. Ф. Фришце получил анилин нагреванием индиго с р-ром КОН и назвал его «анилином».
В 1842 анилин был получен Н. Н. Зининым восстановлением нитробензола действием (NH4)2SO3 и назван им «бензидамом». В 1843 А. В. Гофман установил идентичность всех перечисленных соединений.
Слово «анилин» происходит от названия одного из растений, содержащих индиго — Indigofera anil (современное международное название растения — Indigofera suffruticosa).
3. Производство и применение
Изначально анилин получали восстановлением нитробензола молекулярным водородом; практический выход анилина не превышал 15 %. В 1842 году профессором Казанского университета Н. Н.
Зининым был разработан более рациональный способ получения анилина восстановлением нитробензола (реакция Зинина). При взаимодействии концентрированной соляной кислоты с железом выделялся атомарный водород, более химически активный по сравнению с молекулярным.
В реакционную массу вливали нитробензол, восстанавливавшийся до анилина.
Промышленное производство фиолетового красителя мовеина на основе анилина началось в 1856 году.
В настоящий момент в мире основная часть (85 %) производимого анилина используется для производства метилдиизоцианатов, (MDI) используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков (9 %), гербицидов (2 %) и красителей (2 %). [1]
В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), но в связи с ожидаемым ростом производства полиуретанов возможно значительное изменение картины потребителей в среднесрочной перспективе.
4. Токсичные свойства
Анилин оказывает негативное воздействие на центральную нервную систему. Вызывает кислородное голодание организма за счёт образования в крови метгемоглобина, гемолиза и дегенеративных изменений эритроцитов.
В организм анилин проникает при дыхании, в виде паров, а также через кожу и слизистые оболочки. Всасывание через кожу усиливается при нагреве воздуха или приёме алкоголя.
При лёгком отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин и ногтей. При отравлениях средней тяжести также наблюдаются тошнота, рвота, иногда, шатающаяся походка, учащение пульса. Тяжёлые случаи отравления крайне редки.
[attention type=green]
При хроническом отравлении анилином (анилизм) возникают токсический гепатит, а также нервно-психические нарушения, расстройство сна, снижение памяти и т. д.
[/attention]
При отравлении анилином необходимо прежде всего удаление пострадавшего из очага отравления, обмывание тёплой (но не горячей!) водой. Так же вдыхание кислорода с карбогеном. Также применяют кровопускание, введение антидотов (метиленовая синь), сердечно-сосудистые средства. Пострадавшему надо обеспечить покой.
Предельно допустимая концентрация анилина в воздухе рабочей зоны 3 мг/м3. В водоёмах (при их промышленном загрязнении) 0,1 мг/л (100 мг/м3).[2]
Примечания
- Aniline producers price capacity market demand consumption production growth uses outlook n.d., The Chemical Market Reporter, Schnell Publishing Company. Retrieved January 12, 2002 from http://www.the-innovation-group.com/ChemProfiles/Aniline.htm — www.the-innovation-group.com/ChemProfiles/Aniline.htm
- Раздел составлен по материалам БСЭ
скачать
Данный реферат составлен на основе статьи из русской Википедии. Синхронизация выполнена 11.07.11 01:41:21
Категории: Появились в 1826 году, Продукция основного органического синтеза, Ароматические амины.
Текст доступен по лицензии Creative Commons Attribution-ShareA.