Задачи на атомистику — это задачи на соотношения частиц (атомов, молекул, ионов и т.д.) в гомогенных и гетерогенных системах (растворах, твердых и газообразных смесях). Это могут быть массовые соотношения (например, массовая доля элемента в смеси), мольные соотношения (например, соотношение числа атомов водорода и кислорода или мольная доля), объемные соотношения (объемная доля и др.).
Ниже я выкладываю задачи на атомистику из реального ЕГЭ по химии 16 июля 2020 года.
Для решения задач на атомистику используются довольно простые идеи. Во-первых, понятие массовой доли. Во-вторых, умение выражать число атомов через число молекул или других структурных единиц.
Например, в молекуле триоксида серы SO3 на 1 молекулу приходится один атом серы и три атома кислорода:
1 молекула SO3 — 1 атом серы, 3 атома кислорода
Несложно пропорцией определить, что на две молекулы триоксида серы будет приходиться два атома серы и шесть атомов кислорода:
2 молекулы SO3 — 2 атома S, 6 атомов О
На 20 молекул триоксида:
20 молекул SO3 — 20 атомов S, 60 атомов О
А вот сколько атомов приходится на х молекуле триоксида? Это также легко определить через пропорцию:
х молекул SO3 — х атомов S, 3х атомов О
Иначе говоря, количество атомов кислорода в молекуле SO3 в три раза больше, чем количество молекул. А количество атомов серы равно количеству молекул триоксида серы. Это простая, но не всегда очевидная идея. То есть индексы в формуле вещества показывают не только, как соотносится количество атомов между собой, но и какое число атомов приходится на 1 молекулу или другую структурную единицу вещества.
Если так соотносится число атомов и молекул, то также будет соотноситься и количество вещества атомов и молекул, выраженное в молях. Потому что 1 моль — это не что иное, как порция, состоящая из одинакового числа данных частиц.
То есть на х моль триоксида серы приходится:
х моль SO3 — х моль атомов S, 3х моль атомов О
Представьте себе, что атомы — это элементы изделия, а молекула состоит из некоторого числа таких деталей. Таким образом, число деталей разного типа всегда больше или равно числа изделий. Получается, в молекуле число атомов всегда больше или равно, чем количество молекул.
И наоборот, число молекуле триоксида серы в 3 раза меньше, чем число атомов кислорода в составе SO3. И число молекул равно количеству атомов серы.
Например, на х моль атомов серы приходится х моль молекул SO3.
Еще одно понятие, которое пригодится при решении задач на атомистику — молярное соотношение веществ.
Молярное соотношение — это отношение количества одного вещества к количеству другого вещества.
Например, молярное соотношение хлорида натрия и воды в растворе составляет 1 к 20, или 0,05:
n(NaCl)/ n(H2O) = 1/20 = 0,5
Молярное соотношение можно задавать отдельным числом, а можно соотношением:
n(NaCl) : n(H2O) = 1:20
А вот выражать молярное соотношение через проценты нельзя. Это безразмерная величина.
Научиться решать задачи на атомистику не очень сложно. В ЕГЭ по химии атомистика станет, скорее всего, лишь частью более сложной комплексной задачи 34. Но я бы рекомендовал не пытаться сразу решать задачи на атомистику уровня ЕГЭ по химии. Занимаясь в спортзале, вы же не пытаетесь на первой тренировке поднять сразу тяжелую штангу. Точнее, попытаться вы можете, но последствия будут плачевными.
Для начала сделайте разминку возьмите простые задачи, чтобы освоить основные приемы и понять логику решения таких заданий. А после легких задач можно постепенно перейти к более сложным. Именно в таком порядке и расположены задачи в данной подборке «Атомистика», которые позволяют понять, как именно удобно работать с такими заданиями.
Публикую подборку задач, в которых используются идеи атомистики. Все задачи взяты из сборника С.А. Пузакова, В.А. Попкова «Пособие по химии. Вопросы. Упражнения. Задачи». В скобках я привожу нумерацию этих задач в задачнике.
1. (66) В смеси оксида меди (I) и оксида меди (II) на 4 атома меди приходится 3 атома кислорода. Вычислите массовые доли веществ в такой смеси.
Пусть n (количество вещества) (Cu2O) = х моль, n(CuO) = y моль, тогда:
количество вещества атомов меди в первом оксиде n1(Cu) = 2х моль, во втором оксиде: n2(Cu) = у моль
количество вещества атомов кислорода в первом оксиде n1(О) = х моль, во втором оксиде: n2(О) = у моль
общее количество вещества атомов меди: n(Cu) = (2x + y) моль, атомов кислорода: n(O) = (x + y) моль.
По условию задачи их отношение равно как 4 : 3, т. е. (2x + y) / (x + y) = 4 / 3.
Преобразуем приведённое выше равенство, получаем y = 2x.
Выразим через х массы соединений:
m(Cu2O) = n(Cu2O) * M(Cu2O) = (144x) г;
m(CuO) = n(CuO) * M(CuO) = 80 * у = 80 * 2x = (160x) г
Масса смеси двух оксидов будет равна:
m(смеси) = (144x + 160x) г = (304x) г
Теперь рассчитываем массовую долю оксидов в смеси:
ω(Cu2O) = m(Cu2O) / m(смеси) = 144x / 304x = 0.4737 (47.37%)
ω(CuO) = m(CuO) / m(смеси) = 160x / 304x = 0.5263 (52.63%)
Ответ: ω(CuO) = 52,6%, ω(Cu2O) = 47,4%
2. (67) В смеси двух хлоридов железа на 5 атомов железа приходится 13 атомов хлора. Вычислите массовые доли веществ в такой смеси.
Железо образует два устойчивых хлорида: FeCl2 и FeCl3.
Пусть n(FeCl2) = х моль, n(FeCl3) = y моль, тогда:
количество вещества атомов железа в первом хлориде n1(Fe) = х моль, во втором хлориде: n2(Fe) = у моль,
количество вещества атомов хлора в первом хлориде n1(Cl) = 2х моль, во втором хлориде: n2(Сl) = 3у моль,
общее количество вещества атомов железа: n(Fe) = (x + y) моль, атомов хлора: n(Cl) = (2x + 3y) моль.
По условию задачи их отношение равно как 5 : 13, т. е. (x + y) / (2x + 3y) = 5 / 13.
Преобразуя приведённое выше равенство, получаем y = 1,5x.
Выразим через х массы соединений:
m(FeCl2) = n(FeCl2) * M(FeCl2) = (127x) г;
m(FeCl3) = n(FeCl3) * M(FeCl3) = 162,5 * у = 162,5 * 1,5x = (243,75x) г
Масса смеси двух хлоридов будет равна:
m(смеси) = (127x + 243,75x) г = (370,75x) г
Теперь рассчитываем массовую долю хлоридов в смеси:
ω(FeCl2) = m(FeCl2) / m(смеси) = 127x / 370,75x = 0,343 (34,3%)
ω(FeCl3) = m(FeCl3) / m(смеси) = 243,75x / 370,75x = 0,657 (65,7%)
Ответ: ω(FeCl2) = 34,3%, ω(FeCl3) = 65,7%
3. (70) В каком молярном соотношении были смешаны карбид кальция и карбонат кальция, если массовая доля углерода в полученной смеси равна 25%?
Формулы карбида и карбоната кальция: CaC2 и CaCO3.
Пусть n(CaC2) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов углерода в карбиде кальция n1(С) = 2х моль, в карбонате: n2(С) = у моль,
общее количество вещества атомов углерода: n(С) = (2x + y) моль.
масса атомов углерода: m(С) = 12(2x + y) г.
Выразим через х массы соединений:
m(CaC2) = n(CaC2) * M(CaC2) = (64x) г;
m(CaCO3) = n(CaCO3) * M(CaCO3) = 100у г
Масса смеси двух веществ будет равна:
m(смеси) = (64x + 100у) г
Теперь записываем выражение для массовой доли атомов углерода в смеси:
ω(C) = m(C) / m(смеси)
0,25 = 12(2x + y) / (64x + 100у)
Преобразуем выражение, выражаем х через у:
х = 1,625у
Это и есть искомое молярное соотношение карбида кальция и карбоната кальция:
n(CaC2)/ n(CaCO3) = х/у = 1,625
Ответ: n(CaC2)/ n(CaCO3) = 1,625
4. (71) В каком молярном соотношении были смешаны гидросульфит натрия и гидросульфид натрия, если массовая доля серы в полученной смеси равна 45%?
Ответ: n(NaHS)/ n(NaHSO3) = 2,18
5. (72) Какую массу сульфата калия следует добавить к 5,5г сульфида калия, чтобы в полученной смеси массовая доля серы стала равной 20%?
6. (73) В смеси нитрата аммония и нитрата свинца (II) массовая доля азота равна 25%. Вычислите массовую долю свинца в этой смеси.
7. (74) В смеси нитрата аммония и нитрата бария массовая доля азота равна 30%. Вычислите массовую долю нитрат-ионов в смеси.
8. (75) В смеси двух оксидов углерода на 5 атомов углерода приходится 7 атомов кислорода. Вычислите объемную долю более тяжелого оксида в этой смеси
9. (619) Через 13,1 г смеси бромида калия и йодида калия, в которой массовая доля брома равна 24,5%, пропустили смесь хлора и брома, в результате чего получилась смесь двух солей, в которой массовая доля брома равна 57%. Вычислите массу смеси галогенов, вступившую в реакцию.
Масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 13,1·0,245 = 3,21 г
Количество вещества атомов брома:
n(Br) = m/M = 3,21 г/80 г/моль = 0,04 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,04 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0.04 моль·119 г/моль = 4,77 г
Масса йодида калия:
m(KI) = m(смеси) — m(KBr) =13,1 — 4,77 = 8,33 г
Количество вещества йодида калия:
n(KI) = m/M = 8,33 г/166 г/моль = 0,05 моль
По условию задачи, смесь йодида калия и бромида калия вступила в реакцию не полностью, но в конечной смеси осталось только две соли. При этом йодид калия, скорее всего, вступил в реакцию полностью, так как иначе конечная смесь будет содержать более двух солей.
Предположим, что сначала прореагируют наиболее активные окислитель и восстановитель — йодид калия и хлор:
2KI + Cl2 = 2KCl + I2
Если весь йодид калия вступил в эту реакцию, то в конечной смеси присутствуют только исходный бромид калия и образовавшийся хлорид калия. Количество хлорида калия:
n(KCl) = n(KI) = 0,05 моль
m(KCl) = n·M = 0,05 моль·74,5 г/моль = 37,25 г
Массовая доля брома в такой смеси:
ω(Br) = m(Br) / m(смеси) = 3,21 г / (3,725 г + 4,77) = 0,378 или 37,8%, что не соответствует условию задачи.
Следовательно, йодид калия реагирует не только с хлором, но и с бромом:
2KI + Cl2 = 2KCl + I2
2KI + Br2 = 2KBr + I2
Пусть с хлором прореагировало х моль йодида калия, тогда с бромом 0,05-х моль
Тогда образуется х моль хлорида калия и 0,05-х моль бромида калия.
Масса образовавшегося хлорида калия:
m(KCl) = n·M = x моль·74,5 г/моль = 74,5x г
Бромида калия:
m2(KBr) = n·M = (0,05-х) моль·119 г/моль = (5,95 — 119x) г
Масса конечной смеси солей:
mсмеси = mисх(KBr) + m2(KBr) + m(KCl) = 4,77 г + (5,95 — 119x) г + 74.5х = (10,72 — 44,5х) г
Количество атомов брома в конечной смеси:
n(Br) = 0,04 моль + (0,05 — х) моль = (0,09 — х) моль
Масса атомов брома:
m(Br) = n·M = (0,09 — х) моль·80 г/моль = (7,2 — 80х) г
Массовая доля брома в конечной смеси:
ω(Br) = (7,2 — 80х) / (10,72 — 44,5х) = 0,57
Решаем полученное уравнение, находим х:
х = 0,02 моль
Количество вещества и масса хлора, который вступил в первую реакцию:
n(Cl2) = 0,5х = 0,5·0,02 = 0,01 моль
m(Cl2) = n·M = 0,01·71 г/моль = 0,71 г
Количество вещества брома, который вступил во вторую реакцию:
n(Br2) = n·M = 0,5(0,05 — 0,02) моль = 0,015 моль
Масса брома:
m(Br2) = n·M =0,015 моль·160 г/моль = 2,4 г
Масса смеси галогенов, которые прореагировали с йодидом калия:
m(смеси) = m(Cl2) + m(Br2) = 0,71 г + 2,4 г = 3,11 г
Ответ: 3,11 г
10. (620) Через смесь натрия и бромида калия, в которой массовая доля брома равна 60%, пропустили хлор, в результате чего масса брома в смеси солей оказалась в 2 раза меньше, чем в исходной смеси. Вычислите массовую долю брома в полученной смеси солей.
Примем массу исходной смеси за 100 г, тогда масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 100·0,6 = 60 г
Количество вещества атомов брома:
n(Br) = m/M = 60 г/80 г/моль = 0,75 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,75 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0,75 моль·119 г/моль = 89,25 г
Масса натрия:
m(Na) = m(смеси) — m(KBr) =100 — 89,25 = 10,75 г
Количество вещества натрия:
n(Na) = m/M = 10,75 г/23 г/моль = 0,467 моль
Поскольку масса брома в смеси уменьшилась в два раза, в реакцию вступила половина исходного бромида калия, то есть 0,375 моль KBr. При этом натрий прореагировал полностью, так как, по условию, образовалась смесь солей:
2Na + Cl2 = 2NaCl
2KBr + Cl2 = 2KCl + Br2
В первой реакции образовался хлорид натрия:
n(NaCl) = n(Na) = 0,467 моль
m(NaCl) = n·M = 0,467 моль ·58,5 г/моль = 27,32 г
Во второй образовался хлорид калия:
n(KCl) = 0,5·n(KBr) = 0,375 моль
m(KCl) = n·M = 0,375 моль ·74,5 г/моль = 27,94 г
И остался бромид калия:
mост(KBr) = n·M = 0,375 моль ·74,5 г/моль = 44,625 г
В конечной смеси масса брома равна:
mост(Br) = n·M = 0,375 моль ·80 г/моль = 30 г
Масса конечной смеси:
mсм = mост(KBr) + m(KCl) + m(NaCl) = 44,625 г + 27,94 г + 27,32 г = 99,89 г
Массовая доля брома в конечной смеси солей:
ω(Br) = mост(Br)=/mсм = 30 г/99,89 г = 0,30 или 30%
Ответ: ω(Br) = 30%
11. (621) К смеси калия и иодида натрия, в которой массовая доля калия равна 40%, добавили бром, в результате чего масса йода в полученной смеси солей уменьшилась в 5 раз по сравнению с исходной. Вычислите массовую долю йода в полученной смеси солей.
12. (827) Аммиак, образовавшийся при гидролизе смеси нитрида кальция и нитрида лития, в которой массовая доля азота равнялась 30%, пропустили через 80 мл бромоводородной кислоты. В результате реакции молярная концентрация кислоты уменьшилась с 2,8 до 1,2 моль/л (изменением объема раствора за счет поглощения газа пренебречь). Вычислите массу исходного образца смеси нитридов.
13. (828) К 1,59%-му раствору карбоната натрия добавили по каплям 40 г 3,78%-го раствора азотной кислоты; в результате в образовавшемся растворе число атомов азота оказалось в 2 раза больше числа атомов углерода. Вычислите массовые доли веществ в получившемся растворе.
Ответ: 1,28% NaNO3, 0,631 NaHCO3.
14. (855)Через 15 г 9,45%-го раствора азотной кислоты пропустили аммиак; в результате в образовавшемся растворе массовая доля азота оказалась равной 3,5%. Вычислите массовые доли веществ в образовавшемся растворе.
Ответ: 2,82% HNO3, 8,21% NH4NO3.
15. (951) К смеси фосфата натрия, дигидрофосфата натрия и гидрофосфата натрия общей массой 15 г (молярное соотношение солей в порядке перечисления 3:2:1) добавили 100 г 4%-го раствора гидроксида натрия. Установите количественный состав раствора (в массовых долях).
Ответ: w(Na3PO4) = 14,7%, w(NaOH) = 34,3%.
16. (952) К 2 г смеси гидрофосфата калия и дигидрофосфата калия, в которой массовая доля фосфора равна 20%, добавили 20 г 2%-го раствора фосфорной кислоты. Вычислите массовые доли всех веществ в получившемся растворе.
Ответ: w(KH2PO4) = 9,05%, w(K2HPO4) = 1,87%.
17. (992) В смеси карбида алюминия и карбида кальция число атомов алюминия равно числу атомов кальция. При гидролизе этой смеси выделяется 1,12 л (н.у.) смеси газов. Вычислите массу исходной смеси карбидов.
18. (1007) Смесь карбоната стронция и гидрокарбоната аммония общей массой 12 г, в которой масса атомов углерода в 12 раз больше массы атомов водорода, добавили к избытку 10%-го раствора серной кислоты. Вычислите массу выпавшего осадка и объем выделившегося газа (н.у.)
19. (1009) Какой объем газа (н.у.) выделится при добавлении к 20 г 20%-го раствора серной кислоты 20 г смеси карбоната калия и гидрокарбоната натрия с одинаковым числом атомов калия и водорода?
20. (1021) В смеси сульфита кальция и гидрокарбоната кальция число атомов кальция в 6 раз больше числа атомов серы. Вычислите плотность по воздуху газовой смеси, образующейся при обработке этой смеси избытком разбавленного раствора серной кислоты.
21. (1059) Массовая доля калия в растворе, содержащем силикат калия и сульфат калия, равна 0,909%, а масса серы равна массе кремния. К этому раствору добавили в 4 раза меньшую массу соляной кислоты с массовой долей хлороводорода 1,46%. Вычислите, во сколько раз масса серы оказалась больше массы кремния в образовавшемся растворе.
22. (1162) Смесь натрия с другим щелочным металлом поместили в воду. По окончании реакции воду полностью испарили. Массовая доля кислорода в полученной смеси веществ оказалась равной 50%. Вычислите массовые доли веществ в полученной смеси.
Ответ: w(NaOH) =62,5%, w(LiOH) = 37,5%
23. (1215) В смеси оксида ванадия (V) и оксида ванадия (III) массовая доля кислорода равна 40%. Какое количество вещества алюминия понадобится для полного восстановления ванадия из 100 г этой смеси?
Задача на атомистику, которую составители ЕГЭ по химии рекомендовали к прорешиванию:
24. Некоторое количество смеси гидрата дигидрофосфата калия и дигидрата гидрофосфата калия с равными массовыми долями веществ растворили в воде, которую взяли в 10 раз больше по массе, чем смеси. Сколько атомов кислорода приходится на один атом фосфора в полученном растворе? (104)
Гидрат дигидрофосфата калия: KH2PO4·H2O
Дигидрат гидрофосфата калия: K2HPO4·2H2O
Пусть количество вещества гидрата дигидрофосфата калия равно х моль, а дигидрата гидрофосфата — у моль.
Масса кристаллогидратов:
m(KH2PO4·H2O) = n·M = 154x г
m(K2HPO4·2H2O) = n·M = 210у г
Поскольку массовые доли кристаллогидратов в исходной смеси равны, массы кристаллогидратов также равны:
m(KH2PO4·H2O) = m(K2HPO4·2H2O)
154х = 210у
Отсюда: х = 1,364у
Масса исходной смеси:
mсм = m(KH2PO4·H2O) + m(K2HPO4·2H2O) = 154x + 210у = 154·1,364у + 210у = 420,056·y г
Количество чистых солей в составе кристаллогидратов:
n(KH2PO4·H2O) = n(KH2PO4) = x моль = 1,36·у моль
n(K2HPO4·2H2O) = n(K2HPO4) = у моль
Масса добавленной воды отличается в 10 раз от массы смеси солей:
m(H2O) = 10mсм = 10·420,056·у = 4200,56у г
Количество вещества добавленной воды:
n(H2O) = 4200,56·у/18 = 233,36·у моль
Определим количество атомов кислорода и фосфора:
в гидрате дигидрофосфата калия KH2PO4·H2O: n1(O) = 5x = 6,82·у моль n(Р) = 1,364·у моль
в дигидрате гидрофосфата калия K2HPO4·2H2O:
n2(O) = 6·у моль = 6·у моль
n(Р) = у моль = у моль
в добавленной воде: n3(O) = 233,36у моль
Общее количество атомов кислорода: n(O) = 233,36у + 6,82у + 6у = 246,18 моль
Атомов фосфора: n(Р) = у + 1,364у = 2,363у моль
Отношение числа атомов кислорода к числу атомов фосфора равно:
246,18х/2,364х ≈ 104
Ответ: n(O)/n(Р) = 104
24. Некоторое количество смеси гидрата дигидрофосфата калия и дигидрата гидрофосфата калия с равными массовыми долями веществ растворили в воде, которую взяли в 10 раз больше по массе, чем смеси. Сколько атомов кислорода приходится на один атом фосфора в полученном растворе? (104)
Гидрат дигидрофосфата калия: KH2PO4·H2O
Дигидрат гидрофосфата калия: K2HPO4·2H2O
Пусть количество вещества гидрата дигидрофосфата калия равно х моль, а дигидрата гидрофосфата — у моль.
Масса кристаллогидратов:
m(KH2PO4·H2O) = n·M = 154x г
m(K2HPO4·2H2O) = n·M = 210у г
Поскольку массовые доли кристаллогидратов в исходной смеси равны, массы кристаллогидратов также равны:
m(KH2PO4·H2O) = m(K2HPO4·2H2O)
154х = 210у
Отсюда: х = 1,364у
Масса исходной смеси:
mсм = m(KH2PO4·H2O) + m(K2HPO4·2H2O) = 154x + 210у = 154·1,364у + 210у = 420,056·y г
Количество чистых солей в составе кристаллогидратов:
n(KH2PO4·H2O) = n(KH2PO4) = x моль = 1,36·у моль
n(K2HPO4·2H2O) = n(K2HPO4) = у моль
Масса добавленной воды отличается в 10 раз от массы смеси солей:
m(H2O) = 10mсм = 10·420,056·у = 4200,56у г
Количество вещества добавленной воды:
n(H2O) = 4200,56·у/18 = 233,36·у моль
Определим количество атомов кислорода и фосфора:
в гидрате дигидрофосфата калия KH2PO4·H2O: n1(O) = 5x = 6,82·у моль n(Р) = 1,364·у моль
в дигидрате гидрофосфата калия K2HPO4·2H2O:
n2(O) = 6·у моль = 6·у моль
n(Р) = у моль = у моль
в добавленной воде: n3(O) = 233,36у моль
Общее количество атомов кислорода: n(O) = 233,36у + 6,82у + 6у = 246,18 моль
Атомов фосфора: n(Р) = у + 1,364у = 2,363у моль
Отношение числа атомов кислорода к числу атомов фосфора равно:
246,18х/2,364х ≈ 104
Ответ: n(O)/n(Р) = 104
Задачи на атомистику из реального ЕГЭ по химии 16 июля 2020 года
1. В смеси оксида магния и фосфида магния массовая доля атомов магния равна 54,4%. Они полностью прореагировала с соляной кислотой массой 365 г 34-% раствора. К полученному раствору добавили раствор фторида калия массой 232 грамма 30-% раствора. Найти массовую долю хлорида калия в конечном растворе.
2. Взяли смесь оксида кальция и карбоната кальция. Массовая доля кальция в смеси 50%. Смесь растворили в 300 г раствора избытка соляной кислоты. Выделившийся газ полностью прореагировал с раствором гидроксида натрия массой 200г и массовой долей 8%. Вычислите массовую долю образовавшейся соли.
3. Взяли смесь Cu и CuO . Массовая доля меди в смеси 96%. Полученную смесь растворили в концентрированной серной кислоте массой 496 г, взятой в избытке. Полученный газ растворили в необходимом количестве раствора гидроксида натрия массой 200 г и массовой долей 10%. Найдите массовую долю соли в растворе после растворения.
4. Смесь из оксида и сульфида алюминия, где массовая доля алюминия 50%, залили 700 г, раствора соляной кислоты, взятой в избытке. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди. Вычислите концентрацию соли после того, как залили соляную кислоту.
5. Смесь оксида кальция и карбоната кальция с массовой долей кальция 62,5% растворили в 300 г раствора соляной кислоты. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
Пусть n(CaO) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов кальция в оксида n1(Ca) = х моль, в карбонате: n2(Са) = у моль,
общее количество вещества атомов кальция: n(Са) = (x + y) моль.
Масса атомов кальция: m(Ca) = n(Са)·M(Ca) = 40(x + y) г.
Масса оксида кальция: m(CaО) = n(СаО)·M(CaО) = 56x г.
Масса карбоната кальция: m(CaCO3) = n(CaCO3)·M(CaCO3) = 100у г.
Масса смеси: mсм = m(CaО) + m(CaCO3) = (56х + 100у) г
Получаем выражение:
40(x + y)/(56х + 100у) = 0,625
Преобразуя приведённое выше равенство, получаем х = 4,5у.
Далее протекают реакции:
CaO + 2HCl = CaCl2 + H2O
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Количество образовавшегося углекислого газа n(CO2) = y моль, масса m(CO2) = 44y г.
Запишем уравнение материального баланса для конечного раствора:
mр-ра = m(CaO) + m(CaCO3) + mр-ра(HCl) — m(CO2)
361,6 = 56х + 100у + 300 — 44у
или
61,6 = 56х + 56у
Получаем систему:
х + у = 1,1
х = 4,5у
5,5у = 1,1
у = 0,2 моль, х = 0,9 моль.
Количество углекислого газа: n(CO2) = 0,2 моль, масса m(CO2) = 44·0,2 = 8,8 г.
При взаимодействии углекислого газа с гидроксидом натрия возможно образование средней или кислой соли:
2NaOH + CO2 = Na2CO3 + H2O (1)
NaOH + CO2 = NaHCO3 (2)
Какие продукты образуются, определяется соотношением количества вещества реагентов.
Масса щелочи: m(NaOH) = mр-ра(NaOH) · ω(NaOH) = 80 · 0,1 = 8 г
Количество вещества: n(NaOH) = m(NaOH) / M(NaOH) = 8/40 = 0,2 моль
Соотношение количества вещества реагентов n(NaOH):n(CO2) = 0,2:0,2 = 1:1
Следовательно, протекает только вторая реакция с образованием кислой соли — гидрокарбоната натрия.
n(NaHCO3) = n(CO2) = 0,2 моль
m(NaHCO3) = n(NaHCO3)·M(NaHCO3) = 0,2·84 = 16,8 г
Масса конечного раствора гидрокарбоната:
mр-ра = m(CO2) + mр-ра(NaOH) = 8,8 + 80 = 88,8 г
Массовая доля гидрокарбоната натрия в конечном растворе:
ω(NaHCO3) = m(NaHCO3)/mр-ра = 16,8/88,8 = 0,1892 или 18,92%
Ответ: ω(NaHCO3) = 18,92%
6. Смесь оксида и пероксида натрия, в которой соотношение атомов натрия к атомам кислорода равно 3:2, нагрели с избытком углекислого газа. Полученное вещество растворили в воде. В результате образовалось 600 г раствора. К полученному раствору добавили 229,6 г раствора хлорида железа(III).Найдите массовую долю оксида натрия в исходной смеси, если масса конечного раствора 795 г и массовая доля карбоната натрия в этом растворе 4%.
7. Смесь карбида алюминия и карбида кальция, в которой массовая доля углерода равна 30%, полностью растворили в 547.5 г соляной кислоте. При этом кислота прореагировала без остатка. К образовавшемуся раствору добавили 1260г 8% раствора гидрокарбоната натрия. Найдите массовую долю кислоты в растворе, в котором растворили исходную смесь.
8. В смесь железной окалины и оксида железа(III) добавили 500 г раствора конц. азотной кислоты, причём соотношение атомов железа к атомам кислорода в смеси равно 7:10. Чтобы полностью поглотить выделившийся газ использовали 20 г раствора NaOH с массовой долей 20%.. Найдите массу соли, образовавшейся при добавлении кислоты в смесь.
9. Дана смесь оксида и пероксида бария, в которой число атомов бария относится к числу атомов кислорода как 5:9. Добавили 490 г 20% холодной серной кислоты при этом смесь прореагировала полностью и раствор стал нейтральным. Определить массовую долю воды в полученном растворе.
10. Смесь из оксида лития и нитрида лития с массовой долей атомов лития 56%, смешали с 265 г раствора соляной кислоты с массовой долей 20%. (все вещества полностью прореагировали). После к образовавшемуся раствору добавили 410г 20%- ного фосфата натрия. Найдите массовую долю образовавшегося хлорида натрия.
11. Дан холодный раствор серной кислоты. К нему добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.
Холодный раствор серной кислоты реагирует с пероксидом бария без ОВР:
H2SO4 + BaO2 = BaSO4 + H2O2
При этом в растворе присутствует пероксид водорода, а сульфат бария выпадает в осадок.
Пусть n(H2O2) = х моль, n(H2O) = y моль, тогда:
количество вещества атомов водорода в пероксиде n1(H) = 2х моль, в воде: n2(Н) = 2у моль,
количество вещества атомов кислорода в пероксиде n1(О) = 2х моль, в воде: n2(О) = у моль,
общее количество вещества атомов водорода: n(Н) = (2x + 2y) моль,
общее количество вещества атомов кислорода: n(О) = (2x + y) моль.
Получаем соотношение:
(2x + 2y)/(2x + y) = 9/5
Упрощаем его:
у = 8х
При добавлении каталитического количества оксида марганца (IV) пероксид водорода разлагается:
2H2O2 = 2H2O + O2
Пусть весь пероксид водорода разложился, тогда изменение массы раствора равно массе выделившегося газа, то есть массе кислорода:
m(O2) = 6,4 г
n(O2) = m(O2)/M(O2) = 6,4 / 32 = 0,2 моль
Отсюда
n(H2O2) = 2·n(O2) = 2·0,2 = 0,4 моль
х = 0,4 моль
у = 3,2 моль
Отсюда количество вещества серной кислоты с исходном растворе:
n(H2SO4) = n(H2O2) = 0,4 моль
m(H2SO4) = n(H2SO4)·M(H2SO4) = 0,4·98 = 39,2 г
Количество и масса воды не изменялись:
m(H2O) = n(H2O)·M(H2O) = 3,2·18 = 57,6 г
Массовая доля серной кислоты в исходном растворе:
ω(H2SO4) = m(H2SO4)/(m(H2O)+ m(H2SO4)) = 39,2/(39,2 + 57,6) = 0,405 или 40,5%
Ответ: ω(H2SO4) = 40,5%
Задачи на «атомистику» из реального ЕГЭ по химии-2020
- Дан раствор массой 200 г, содержащий хлорид железа(II) и хлорид железа(III). В этом растворе соотношение числа атомов железа к числу атомов хлора равно 3 : 8. Через него пропустили хлор до прекращения реакции. К образовавшемуся раствору добавили раствор гидроксида натрия также до полного завершения реакции. При этом образовалось 526,5 г 20%-ного раствора хлорида натрия. Вычислите массовую долю гидроксида натрия в использованном растворе.
2FeCl2 + Cl2 = 2FeCl3
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
Ответ: w(NaOH) = 18,8%
- Смесь цинка и карбоната цинка, в которой соотношение числа атомов цинка к числу атомов кислорода равно 5 : 6, растворили в 500 г разбавленного раствора серной кислоты. При этом все исходные вещества прореагировали полностью, и выделилось 22,4 л смеси газов (н.у.). К этому раствору добавили 500 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю сульфата натрия в конечном растворе.
Zn + H2SO4 = ZnSO4 + H2
ZnCO3 + H2SO4 = ZnSO4 + H2O + CO2
ZnSO4 + 4NaOH = Na2[Zn(OH)4] + Na2SO4
Ответ: w(Na2SO4) = 13,3%
- Смесь пероксида и оксида бария, в которой соотношение числа атомов бария к числу атомов кислорода равно 5 : 9 растворили в 490 г холодного 20%-ного раствора серной кислоты. При этом соединения бария прореагировали полностью и образовался нейтральный раствор. Вычислите массовую долю воды в образовавшемся растворе.
BaO2 + H2SO4 = BaSO4 + H2O2
BaO + H2SO4 = BaSO4 + H2O
Ответ: w(H2O) = 93,6%
- Смесь оксида и пероксида натрия, в которой соотношение числа атомов натрия к числу атомов кислорода равно 3 : 2, нагрели в избытке углекислого газа. Продукт реакции растворили в воде и получили 600 г раствора. К этому раствору добавили 229,6 г раствора хлорида железа(III). После завершения реакции масса раствора составила 795 г, а массовая доля карбоната натрия в нём – 4%. Вычислите массу оксида натрия в исходной смеси.
Na2O + CO2 = Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3 + 6NaCl + 3CO2
Ответ: m(Na2O) = 24,8 г
- Смесь железной окалины и оксида железа(III), в которой соотношение числа атомов железа к числу атомов кислорода равно 7 : 10, растворили в 500 г концентрированной азотной кислоты, взятой в избытке. Для полного поглощения выделившегося при этом газа потребовалось 20 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, образовавшемся после растворения оксидов в кислоте.
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
Ответ: w(Fe(NO3)3) = 30,8%
- Смесь карбида алюминия и карбида кальция, в которой массовая доля атомов углерода равна 30%, полностью растворили в 547,5 г соляной кислоты. При этом соляная кислота прореагировала без остатка. К образовавшемуся раствору добавили 1260 г 8%-ного раствора гидрокарбоната натрия до полного завершения реакции. Вычислите массовую долю кислоты в растворе, в котором растворили исходную смесь.
Al4C3 + 12HCl = 4AlCl3 + 3CH4
CaC2 + 2HCl = CaCl2 + C2H2
AlCl3 + 3NaHCO3 = Al(OH)3 + 3CO2 + 3NaCl
CaCl2 + 2NaHCO3 = CaCO3 + CO2 + H2O + 2NaCl
Ответ: w(HCl) = 8%
- Смесь меди и оксида меди(II), в которой массовая доля атомов меди равна 96%, растворили в 472 г концентрированной серной кислоты, взятой в избытке. Минимальная масса 10%-ного раствора гидроксида натрия, который может прореагировать с выделившимся при этом газом, составляет 200 г. Вычислите массовую долю соли в растворе, образовавшемся после растворения исходной смеси в кислоте.
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2
CuO + H2SO4 = CuSO4 + H2O
SO2 + NaOH = NaHSO3
Ответ: w(CuSO4) = 20%
- Смесь сульфида и оксида алюминия, в которой массовая доля атомов алюминия равна 50%, растворили в 700 г соляной кислоты, взятой в избытке. Для полного поглощения выделившегося при этом газа потребовалось 240 г 20%-ного раствора сульфата меди(II). Вычислите массовую долю соли в растворе, образовавшемся после растворения сульфида и оксида алюминия в кислоте.
Al2S3 + 6HCl = 2AlCl3 + 3H2S
Al2O3 + 6HCl = 2AlCl3 + 3H2O
H2S + CuSO4 = CuS + H2SO4
Ответ: w(AlCl3) = 27,5%
- Смесь карбоната кальция и оксида кальция, в которой массовая доля атомов кальция равна 62,5%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 361,6 г. Выделившийся в результате реакции газ полностью поглотился 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, получившемся в результате реакции.
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CaO + 2HCl = CaCl2 + H2O
CO2 + NaOH = NaHCO3
Ответ: w(NaHCO3) = 18,9%
- Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 330 г. Один из выделившихся в результате реакции газов полностью поглотился 200 г 8%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, получившемся в результате реакции.
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CO2 + NaOH = NaHCO3
Ответ: w(NaHCO3) = 15,4%
- Смесь оксида магния и фосфида магния, в которой массовая доля атомов магния равна 54,4%, растворили в 365 г 34%-ной соляной кислоты. При этом реагирующие вещества вступили в реакцию полностью. К полученному раствору добавили 232 г 30%-ного раствора фторида калия. Вычислите массовую долю хлорида калия в конечном растворе.
MgO + 2HCl = MgCl2 + H2O
Mg3P2 + 6HCl = 3MgCl2 + 2PH3
MgCl2 + 2KF = MgF2 + 2KCl
Ответ: w(KCl) = 14,9%
- Смесь оксида лития и нитрида лития, в которой массовая доля атомов лития равна 56%, растворили в 365 г 20%-ной соляной кислоты. При этом реагирующие вещества вступили в реакцию полностью. К полученному раствору добавили 410 г 20%-ного раствора фосфата натрия. Вычислите массовую долю хлорида натрия в конечном растворе.
Li2O + 2HCl = 2LiCl + H2O
Li3N + 4HCl = 3LiCl + NH4Cl
3LiCl + Na3PO4 = Li3PO4 + 3NaCl
Ответ: w(NaCl) = 11,9%
- В колбу с холодным раствором серной кислоты внесли пероксид бария, при этом оба вещества между собой прореагировали полностью. В образовавшемся растворе соотношение числа атомов водорода и атомов кислорода составило 9 : 5. Затем в колбу добавили каталитическое количество оксида марганца(IV). При этом произошла реакция, в результате которой масса раствора в колбе уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты, которая содержалась в исходном растворе.
BaO2 + H2SO4 = BaSO4 + H2O2
2H2O2 = 2H2O + O2
Ответ: w(H2SO4) = 40,5%
- Железную пластинку полностью растворили в 500 г раствора кислоты. Объем выделившейся смеси оксида азота(II) и оксида азота(IV) составляет 20,16 л (н.у.). В этой смеси соотношение числа атомов кислорода к числу атомов азота равно 5 : 3. Вычислите массовую долю соли в полученном растворе.
Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Ответ: w(Fe(NO3)3) = 24,6%
- Смесь сульфата железа(II) и сульфата железа(III), в которой соотношение числа атомов железа к числу атомов серы равно 3 : 4, поместили в 126,4 г раствора перманганата калия, подкисленного серной кислотой, с массовой долей перманганата калия 5%. Все вещества, участвующие в окислительно-восстановительной реакции, прореагировали полностью. Вычислите массу 20%-ного раствора гидроксида натрия, который требуется добавить к полученному раствору для полного завершения всех реакций.
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
MnSO4 + 2NaOH = Mn(OH)2 + Na2SO4
Ответ: m(раствора NaOH) = 376 г
Задачи на соотношения (атомные, ионные и мольные) и число Авогадро.
Задание №1
Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди (II). Когда соотношение числа катионов водорода и катионов меди в растворе стало равно 1:2, процесс остановили. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди. (Принять, что степень диссоциации сильных электролитов в растворе по всем ступеням равна 100%. Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин)
Решение
Сульфат меди образован катионами металла, расположенного в ряду активности после водорода, а также кислотными остатками кислородсодержащей неорганической кислоты. Для таких солей продуктами электролиза будут являться свободный металл, кислота и кислород:
2CuSO4 + 2H2O →2Сu↓ + 2H2SO4 + O2↑ (I)
Рассчитаем массу и количество вещеcтва сульфата меди (II) в исходном растворе (до электролиза):
mисх.(CuSO4) = mисх.р-ра(CuSO4) ∙ ω(CuSO4)/100% = 500 г ∙ 16%/100% = 80 г;
νисх.(CuSO4) = mисх.(CuSO4)/М(CuSO4) = 80 г/160 г/моль = 0,5 моль.
По условию имеется соотношение числа катионов водорода и меди в момент остановки процесса. Это говорит о том, что процесс не дошел до конца и там остался сульфат меди (II). Обозначим за х количество сульфата меди (II), которое вступило в реакцию. Тогда количество образовавшейся кислоты тоже равно х моль (по уравнению реакции (I)). Из одной молекулы серной кислоты при полной диссоциации получается два катиона водорода, значит количество катионов водорода будет равно 2х моль. При этом в растворе остается (0,5 − х) моль сульфата меди (II). Поскольку нам известно соотношение катионов водорода и катионов меди, можно составить следующее уравнение:
2ν(H2SO4)/νост.(CuSO4) = 2N(H2SO4)/Nост.(CuSO4) = 2N(H2SO4)/N(Cu2+) = N(H+)/N(Cu2+) = 1/2, тогда
2х/(0,5 − х) = 1/2
4х = 0,5 − х
5х = 0,5
х = 0,1 моль.
ν(H2SO4) = 0,1 моль, тогда
νост.(CuSO4) = 0,5 моль – 0,1 моль = 0,4 моль.
В процессе электролиза раствор становится легче за счет выделения из него меди и кислорода. Вычислим их количества и массы:
ν(O2) = ν(H2SO4)/2 = 0,1 моль/2 = 0,05 моль,
m(O2) = 0,05 · 32 г/моль = 1,6 г,
ν(Cu) = ν(H2SO4) = 0,1 моль, m(Cu) = 0,1 моль · 64 г/моль = 6,4 г.
Определим массу раствора после электролиза:
m(конеч. р-ра) = mисх.р-ра(CuSO4) − m(O2) − m(Cu) = 500 г − 1,6 г − 6,4 г = 492 г.
Далее по пропорции вычислим количества сульфата меди (II) и серной кислоты, которые попали в порцию раствора:
492 г − 0,4 моль CuSO4
98,4 г − y моль CuSO4
y = ν(CuSO4) = 0,08 моль
492 г − 0,1 моль H2SO4
98,4 г − z моль H2SO4
z = ν(H2SO4) = 0,02 моль
Далее обратим внимание на то, что осадить из раствора ионы меди не удастся до тех пор, пока в растворе присутствует серная кислота. Таким образом, при добавлении раствора гидроксида натрия будет происходить последовательность из двух реакций:
H2SO4 + 2NaOH = Na2SO4 + 2H2O (II)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 (III)
Вычислим суммарный расход щелочи на оба процесса:
ν(NaOH) = 2ν(H2SO4) + 2ν(CuSO4) = 0,02 моль · 2 + 0,08 моль · 2 = 0,2 моль,
m(NaOH) = 0,2 моль · 40 г/моль = 8 г.
Далее вычислим массу раствора гидроксида натрия:
m(р-ра NaOH) = m(NaOH)/w(NaOH) · 100% = 8 г/20% · 100% = 40 г.
Ответ: m(р-ра NaOH) = 40 г.
Задание №2
Для проведения электролиза (на инертных электродах) взяли 16%-ный раствор сульфата меди (II), содержащий 9,03 · 1023 сульфат-анионов. После того, как на аноде выделилось 3,36 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 10%-ный раствор карбоната натрия, содержащий 4,7859 · 1024 молекул воды. Определите массовую долю сульфата меди (II) в полученном растворе. (Принять, что степень диссоциации сильных электролитов в растворе равна 100%. Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Сульфат меди образован катионами металла, расположенного в ряду активности после водорода, а также кислотными остатками кислородсодержащей неорганической кислоты. Для таких солей продуктами электролиза будут являться свободный металл, кислота и кислород:
2CuSO4 + 2H2O →2Сu↓ + 2H2SO4 + O2↑ (I)
По известному количеству сульфат-анионов можно вычислить исходные количество и массу сульфата меди (II) и массу его раствора:
νисх.(CuSO4) = ν(SO42-) = N(SO42-)/NA = 9,03 · 1023/6,02 · 1023 моль-1 = 1,5 моль;
mисх.(CuSO4) = 1,5 моль · 160 г/моль = 240 г;
mисх(р-ра CuSO4) = m(CuSO4)/16% · 100% = 240 г/16% · 100% = 1500 г.
Далее вычислим количество и массу кислорода, который выделился на аноде:
ν(O2) = V(O2)/Vm = 3,36 л/22,4 л/моль = 0,15 моль;
m(O2) = ν · M = 0,15 моль · 32 г/моль = 4,8 г.
Вычислим количество и массу меди, выделившейся на катоде (по уравнению реакции (I)):
ν(Cu) = 2ν(O2) = 0,15 моль · 2 = 0,3 моль;
m(Cu) = ν · M = 0,3 моль · 64 г/моль = 19,2 г.
Далее необходимо найти массу раствора карбоната натрия и количество карбоната натрия. Это можно сделать, вычислив массу растворителя исходя из количества молекул воды в растворе (с учетом того, что в растворе карбоната натрия содержится 10% соли и 90% воды):
ν(H2O) = N(H2O)/NA = 4,7859 · 1024/6,02 · 1023 моль-1 = 7,95 моль,
m(H2O) = ν · M = 7,95 моль · 18 г/моль = 143,1 г; тогда
m(р-ра Na2CO3) = m(р-ра)/w(H2O) · 100% = 143,1 г/90% · 100% = 159 г;
m(Na2CO3) = m(р-ра Na2CO3) · w(Na2CO3)/100% = 159 · 10%/100% = 15,9 г; тогда
ν(Na2CO3) = m/M = 15,9 г/106 г/моль = 0,15 моль.
Далее необходимо понять, какие реакции будут протекать при добавлении раствора карбоната натрия в раствор после электролиза. Для этого необходимо вычислить количества оставшегося сульфата меди (II) и серной кислоты. По уравнению реакции:
ν(H2SO4) = ν(Cu) = 0,3 моль; отсюда νрасх.(CuSO4) = ν(Cu) = 0,3 моль;
νост.(CuSO4) = νисх.(CuSO4) − νрасх.(CuSO4) = 1,5 моль − 0,3 моль = 1,2 моль.
Обратим внимание на то, что в растворе одновременно присутствуют кислота и соль, способные к обмену с карбонатом натрия. Однако, следует понимать, что никакой карбонат не сможет образоваться, пока в одном растворе с ним будет сильная кислота. В нашем случае серная кислота по количеству значительно превышает карбонат натрия. Поэтому запишем только один процесс:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O (II)
Вычислим количество и массу выделившегося углекислого газа:
ν(CO2) = ν(Na2CO3) = 0,15 моль; m(CO2) = ν · M = 0,15 моль · 44 г/моль = 6,6 г.
Далее вычислим массу сульфата меди (II) после прохождения всех реакций:
mост.(CuSO4) = ν · M = 1,2 моль · 160 г/моль = 192 г.
Масса конечного раствора сложится из начальной массы раствора сульфата меди (II) и раствора карбоната натрия за вычетом кислорода, меди и углекислого газа. Вычислим эту массу:
m(конеч. р-ра) = mисх(р-ра CuSO4) + m(р-ра Na2CO3) − m(O2) − m(Cu) − m(CO2) = 1500 г + 159 г − 4,8 г − 19,2 г − 6,6 г = 1628,4 г.
Вычислим долю сульфата меди (II) в конечном растворе:
ω(CuSO4) = mост.(CuSO4)/m(конеч. р-ра) · 100% = 192 г/1628,4 г · 100% = 11,79%.
Ответ: ω(CuSO4) = 11,79%.
Задание №3
Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. Процесс остановили после того, как в твердое вещество на электроде перешло 1,204 · 1023 атомов. К образовавшемуся раствору добавили 175,5 г раствора хлорида натрия, в котором 1 хлорид-анион приходится на 13 молекул воды. Определите массовую долю хлорида натрия в полученном растворе. (Принять, что степень диссоциации сильных электролитов в растворе равна 100%. Число Авогадро принять равным 6,02 · 1023 моль-1).
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Нитрат серебра образован катионами металла, расположенного в ряду активности после водорода, а также кислотным остатком кислородсодержащей неорганической кислоты. Для таких солей продуктами электролиза будут являться свободный металл, кислота и кислород:
4AgNO3 + 2H2O = 4Ag + O2 + 4HNO3 (I)
Вычислим исходные массу и количество нитрата серебра:
mисх.(AgNO3) = m(р-ра AgNO3) · 20%/100% = 340 г · 20%/100% = 68 г;
νисх.(AgNO3) = m/M = 68 г/170 г/моль = 0,4 моль.
В твердом состоянии на электроде выделилось серебро. Вычислим его количество и массу (по уравнению реакции (I)):
ν(Ag) = N(Ag)/NA = 1,204 · 1023/6,02 · 1023 моль-1 = 0,2 моль;
m(Ag) = ν · M = 0,2 моль · 108 г/моль = 21,6 г.
Вычислим также количество и массу кислорода, выделившегося в ходе процесса (по уравнению реакции (I)):
ν(O2) = ν(Ag)/4 = 0,2 моль/4 = 0,05 моль; m(O2) = ν · M = 0,05 моль · 32 г/моль = 1,6 г.
Далее проходит процесс ионного обмена с участием хлорида натрия:
AgNO3 + NaCl = AgCl + NaNO3 (II)
Для вычисления количества хлорида натрия нужно учесть, что соотношение числа частиц в растворе будет равно соотношению числа моль этих частиц. Тогда справедливо следующее соотношение:
ν(NaCl)/ν(H2O) = N(NaCl)/N(H2O) = N(Cl—)/N(H2O) = 1/13.
Обозначим за х количество хлорида натрия, вступившегося в реакцию, тогда количество воды будет равно 13х моль. Зная общую массу раствора, составим уравнение:
58,5х + 18 · 13х = 175,5;
292,5х = 175,5;
х = 0,6 моль; т.е. ν(NaCl) = 0,6 моль.
Далее вычислим количество нитрата серебра, оставшегося после электролиза.
νрасх.(AgNO3) = ν(Ag) = 0,2 моль;
νост.(AgNO3) = νисх.(AgNO3) − νрасх.(AgNO3) = 0,4 моль − 0,2 моль = 0,2 моль.
Определим количество и массу хлорида натрия, оставшегося после реакции с нитратом серебра.
По уравнению реакции (II) νрасх.(AgNO3) = νрасх.(NaCl):
νост.(NaCl) = ν(NaCl) − νрасх.(NaCl) = 0,6 моль − 0,2 моль = 0,4 моль;
mост.(NaCl) = ν · M = 0,4 моль · 58,5 г/моль = 23,4 г.
Масса конечного раствора сложится из масс растворов нитрата серебра и хлорида натрия за вычетом серебра, кислорода и осадка хлорида серебра. Рассчитаем необходимые количества и массы веществ:
ν(AgCl) = νрасх.(AgNO3) = 0,2 моль; отсюда
m(AgCl) = ν · M = 0,2 моль · 143,5 г/моль = 28,7 г.
Вычислим массу конечного раствора:
m(конеч. р-ра) = m(р-ра AgNO3) + m(р-ра NaCl) – m(Ag) – m(O2) − m(AgCl) = 340 г + 175,5 г − 21,6 г − 1,6 г − 28,7 г = 463,6 г.
Вычислим процентное содержание хлорида натрия в конечном растворе:
ω(NaCl) = mост.(NaCl)/m(конеч. р-ра) · 100% = 23,4 г/463,6 г · 100% = 5,05%.
Ответ: ω(NaCl) = 5,05%.
Задание №4
Для проведения электролиза (на инертных электродах) взяли 360 г раствора хлорида меди (II), в котором на 2 катиона меди приходится 85 молекул воды. После того, как на катоде выделилось 1,204 · 1023 атомов металла, процесс остановили. Из полученного раствора отобрали порцию, число молекул воды в которой в 5 раз меньше, чем в растворе после электролиза. Вычислите массу 10%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора. (Принять, что степень диссоциации сильных электролитов в растворе равна 100%. Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин)
Решение
Хлорид меди (II) меди образован катионами металла, расположенного в ряду активности после водорода. Для такой соли продуктами электролиза будут являться свободный металл и хлор:
CuCl2 = Cu + Cl2 (I)
Для вычисления количества хлорида меди (II) необходимо заметить, что соотношение числа частиц в растворе будет равно соотношению числа моль этих частиц. Тогда справедливо следующее соотношение:
ν(CuCl2)/ν(H2O) = N(CuCl2)/N(H2O) = N(Cu2+)/N(H2O) = 2/85.
Обозначим за 2х количество катионов меди (II) в растворе, тогда количество воды будет равно 85х моль. Зная общую массу раствора, составим уравнение:
135 · 2х + 18 · 85х = 360
1800х = 360
х = 0,2 моль, тогда
ν(CuCl2) = 0,4 моль.
Далее нужно вычислить, какая часть соли вступила в электролиз, а также то, сколько ее осталось. Это можно сделать по данным о количестве атомов металла:
ν(Cu) = N(Cu)/NA = 1,204 · 1023/6,02 · 1023 моль-1 = 0,2 моль;
νрасх.(CuCl2) = ν(Cu) = 0,2 моль,
νост.(CuCl2) = ν(CuCl2) − νрасх.(CuCl2) = 0,4 моль − 0,2 моль = 0,2 моль.
Обратим внимание, что от образовавшегося раствора отбирают порцию, в которой в 5 раз меньше молекул воды, чем в растворе целиком. Из этого легко сделать вывод, что частиц хлорида меди (II) туда попадет тоже в 5 раз меньше:
Nпорц.(H2O)/Nобщ.(H2O) = 1/5;
Nпорц.(CuCl2)/Nобщ.(CuCl2) = Nпорц.(H2O)/Nобщ.(H2O) = 1/5;
νпорц.(CuCl2)/νобщ.(CuCl2) = Nпорц.(CuCl2)/Nобщ.(CuCl2) = 1/5;
νпорц.(CuCl2) = νобщ.(CuCl2)/5 = 0,2 моль/5 = 0,04 моль.
Оставшийся хлорид меди (II) вступает в обменную реакцию с гидроксидом натрия:
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl (II)
Вычислим количество и массу щелочи, необходимые для реакции:
ν(NaOH) = 2νпорц.(CuCl2) = 0,04 моль · 2 = 0,08 моль,
m(NaOH) = ν · M = 0,08 моль · 40 г/моль = 3,2 г.
Далее вычислим массу раствора гидроксида натрия:
m(р-ра NaOH) = m(NaOH)/10% · 100% = 3,2 г/10% · 100% = 32 г.
Ответ: m(р-ра NaOH) = 32 г.
Задание №5
При некоторой температуре приготовили 260,1 г раствора сульфида натрия, в котором на 9 сульфид-анионов приходится 250 молекул воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г раствора соляной кислоты, также взятой в избытке. При этом соотношение числа молекул газов, выделившихся из первой и второй колб, составило 1:2 соответственно. Определите массовую долю хлорида натрия в конечном растворе во второй колбе. (Принять, что степень диссоциации сильных электролитов в растворе равна 100%. Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Запишем уравнения реакций, происходивших в первой и второй колбах соответственно:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3 + 3H2S (I)
Na2S + 2HCl = 2NaCl + H2S (II)
Для вычисления количества сульфида натрия необходимо заметить, что соотношение числа частиц в растворе будет равно соотношению числа моль этих частиц. Составим следующее соотношение:
ν(Na2S)/ν(H2O) = ν(S2-)/ν(H2O) = N(S2-)/N(H2O) = 9/250.
Обозначим за 9х количество сульфида натрия. Тогда количество воды будет равно 250х моль. Зная общую массу раствора, составим уравнение:
78 · 9х + 18 · 250х = 260,1
5202х = 260,1
х = 0,05;
ν(Na2S) = ν · 9 = 0,05 моль · 9 = 0,45 моль.
Далее обратим внимание, что в обеих реакциях количество выделившегося газа равно количеству сульфида натрия. Соотношение количеств молекул газа будет равно соотношению количеств веществ:
νI колб.(H2S)/νII колб.(H2S) = νI колб.(Na2S)/νII колб.(Na2S);
νI колб.(H2S)/νII колб.(H2S) = NI колб.(H2S)/NII колб.(H2S) = 1/2.
Обозначим за х количество сульфида натрия из I колбы, тогда во II колбу попало 2х моль сульфида натрия.
Составим уравнение:
х + 2х = 0,45
3х = 0,45
х = 0,15 моль.
νI колб.(Na2S) = 0,15 моль, тогда
νII колб.(Na2S) = 2 · 0,15 моль = 0,3 моль.
Вычислим количества и массы сероводорода и хлорида натрия во второй колбе.
Поскольку νII колб.(H2S) = 0,3 моль, тогда mII колб.(H2S) = ν · M = 0,3 моль · 34 г/моль = 10,2 г.
νII колб.(NaCl) = 2νII колб.(Na2S) = 0,3 моль · 2 = 0,6 моль,
mII колб.(NaCl) = ν · M = 0,6 моль · 58,5 г/моль = 35,1 г.
Соотношение масс растворов сульфида натрия в I и II колбах будет равно соотношению количеств сульфида натрия в них. Вычислим массу раствора сульфида натрия во II колбе:
mII колб.(р-ра Na2S) = 260,1 г/3 · 2 = 173,4 г.
Вычислим массу конечного раствора во II колбе:
m(конеч. р-ра) = mII колб.(р-ра Na2S) + m(р-ра HCl) − mII колб.(H2S) = 173,4 г + 100 г − 10,2 г = 263,2 г.
Вычислим долю хлорида натрия в конечном растворе:
ω(NaCl) = mII колб.(NaCl)/m(конеч. р-ра) · 100% = 35,1 г/263,2 г · 100% = 13,34%.
Ответ: ω(NaCl) = 13,34%.
Задание №6
Растворимость безводного сульфата железа (II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа (II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом в осадок ушло 1,204 · 1023 атомов серы. К раствору во второй колбе добавили 34% раствор аммиака, содержащий 1,204 · 1024 атомов азота. Определите массовую долю аммиака в конечном растворе во второй колбе. (Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин)
Решение
Запишем уравнения реакций, происходивших в первой и второй колбах, соответственно:
FeSO4 + BaCl2 = FeCl2 + BaSO4 (I)
FeSO4 + 2NH3 + 2H2O = Fe(OH)2 + (NH4)2SO4 (II)
С помощью пропорции определим массу и количество сульфата железа (II) в исходном растворе:
30,4 г FeSO4 − 130,4 г раствора
х г FeSO4 − 326 г раствора
х = 76 г
mисх.(FeSO4) = 76 г, откуда νисх.(FeSO4) = 76 г/152 г/моль = 0,5 моль.
Поскольку в молекуле сульфата бария содержится один атом серы, то количество атомов серы пропорционально количеству вещества сульфата бария.
Вычислим количество этого осадка:
ν(BaSO4) = ν(S) = N(S)/NA = 1,204 · 1023/6,02 · 1023 моль-1 = 0,2 моль.
Вычислим количество вещества сульфата железа (II), которое попало в первую колбу.
По уравнению реакции (I) νI колб.(FeSO4) = ν(BaSO4) = 0,2 моль.
По разности исходного количества сульфата железа (II) с его содержанием в I колбе, вычислим количество сульфата железа (II), которое попало во II колбу:
νII колб.(FeSO4) = νисх.(FeSO4) − νI колб.(FeSO4) = 0,5 моль − 0,2 моль = 0,3 моль.
Количество атомов азота пропорционально количеству вещества аммиака.
Вычислим количество аммиака:
ν(NH3) = ν(N) = N(N)/NA = 1,204 · 1024/6,02 · 1023 моль-1 = 2 моль.
Вычислим массу раствора аммиака:
m(NH3) = ν · M = 2 моль · 17 г/моль = 34 г,
отсюда m(р-ра NH3) = m(NH3)/w(NH3) · 100% = 34 г/34% · 100% = 100 г.
Далее вычислим количество и массу аммиака, вступившего во II реакцию с сульфатом железа (II):
νрасх.(NH3) = 2νII колб.(FeSO4) = 0,3 моль · 2 = 0,6 моль, тогда
νост.(NH3) = ν(NH3) − νрасх.(NH3) = 2 моль − 0,6 моль = 1,4 моль,
mост.(NH3) = ν · M = 1,4 моль · 17 г/моль = 23,8 г.
Масса конечного раствора сложится из масс растворов сульфата железа (II) и аммиака за вычетом осадка гидроксида железа (II). Масса раствора сульфата железа (II) пропорциональна количеству этой соли, попавшему во вторую колбу. Проведем необходимые вычисления:
mII колб.(р-ра FeSO4)/m(р-ра) = νII колб.(FeSO4)/νисх.(FeSO4);
mII колб.(р-ра FeSO4)/326 г = 0,3 моль/0,5 моль, отсюда
mII колб.(р-ра FeSO4) = 326 г · 0,3 моль/0,5 моль = 195,6 г.
Далее вычислим массы выпавшего в осадок гидроксида железа (II) и конечного раствора (по уравнению реакции (II)):
ν(Fe(OH)2) = νII колб.(FeSO4) = 0,3 моль, отсюда m(Fe(OH)2) = ν · M = 0,3 моль · 90 г/моль = 27 г,
m(конеч. р-ра) = mII колб.(р-ра FeSO4) + m(р-ра NH3) − m(Fe(OH)2) = 195,6 г + 100 г − 27 г = 268,6 г.
Вычислим массовую долю аммиака в конечном растворе:
ω(NH3) = mост.(NH3)/m(конеч. р-ра) · 100% = 23,8 г/268,6 г · 100% = 8,86%.
Ответ: ω(NH3) = 8,86%.
Задание №7
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор соли, содержащий 3,01 · 1025 молекул воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата кальция. При этом в осадок перешло 9,03 · 1023 катионов кальция. К раствору во второй колбе добавили 756 г 30%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в конечном растворе. (Принять, что степень диссоциации сильных электролитов в растворе равна 100%. Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Запишем уравнения реакций, происходивших в первой и второй колбах, соответственно:
Na2CO3 + Ca(NO3)2 = CaCO3 + 2NaNO3 (I)
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O (II)
Далее необходимо вычислить исходные количество и массу карбоната натрия. Проведем необходимые вычисления основываясь на числе молекул воды и пропорции:
ν(H2O) = N(H2O)/NA = 3,01 · 1025/6,02 · 1023 моль-1 = 50 моль,
m(H2O) = ν · M = 50 моль · 18 г/моль = 900 г.
Вычислим массу карбоната натрия в 900 г воды:
31,8 г соли − 100 г воды
х г соли − 900 г воды
х = 286,2 г
mисх.(Na2CO3) = 286,2 г; νисх.(Na2CO3) = m/M = 286,2 г/106 г/моль = 2,7 моль,
mисх.(р-ра Na2CO3) = mисх.(Na2CO3) + m(H2O) = 286,2 г + 900 г = 1186,2 г.
Далее вычислим количество осадка карбоната кальция в I колбе и количество прореагировавшего карбоната натрия.
Поскольку в 1 молекуле карбоната кальция содержится 1 атом кальция, вычислим количества веществ карбоната кальция и карбоната натрия:
ν(CaCO3) = ν(Ca2+) = N(Сa2+)/NA = 9,03 · 1023/6,02 · 1023 моль-1 = 1,5 моль,
νI колб.(Na2CO3) = ν(CaCO3) = 1,5 моль.
Вычислим количество карбоната натрия, которое попало во II колбу:
νII колб.(Na2CO3) = νисх.(Na2CO3) – νI колб.(Na2CO3) = 2,7 моль − 1,5 моль = 1,2 моль.
Далее вычислим исходное количество азотной кислоты:
mисх.(HNO3) = ν · M = 0,3 моль · 756 г/моль = 226,8 г,
тогда νисх.(HNO3) = m/M = 226,8 г/63 г/моль = 3,6 моль.
В ходе реакции с карбонатом натрия часть кислоты израсходовалась.
Вычислим количество и массу оставшейся кислоты, а также количество и массу углекислого газа.
По уравнению реакции (II):
νрасх.(HNO3) = 2νII колб.(Na2CO3) = 1,2 моль · 2 = 2,4 моль,
νост.(HNO3) = νисх.(HNO3) – νрасх.(HNO3) = 3,6 моль − 2,4 моль = 1,2 моль,
mост.(HNO3) = ν · M = 1,2 моль · 63 г/моль = 75,6 г.
По уравнению реакции (II) ν(СO2) = νII колб.(Na2CO3) = 1,2 моль,
m(СO2) = ν · M = 1,2 моль · 44 г/моль = 52,8 г.
Масса конечного раствора сложится из масс растворов карбоната натрия и азотной кислоты за вычетом углекислого газа. Масса раствора карбоната натрия пропорциональна количеству этой соли, попавшему во II колбу. Проведем необходимые вычисления:
mII колб.(р-ра Na2CO3)/mисх.(р-ра Na2CO3) = νII колб.(Na2CO3)/νисх.(Na2CO3);
mII колб.(р-ра Na2CO3)/1186,2 г = 1,2 моль/2,7 моль;
mII колб.(р-ра Na2CO3) = mисх.(р-ра Na2CO3) · νII колб.(Na2CO3)/νисх.(Na2CO3) = 1186,2 г · 1,2 моль/2,7 моль = 527,2 г.
m(конеч. р-ра) = mII колб.(р-ра Na2CO3) + m(р-ра HNO3) − m(СO2) = 527,2 г + 756 г − 52,8 г = 1230,4 г.
Вычислим массовую долю кислоты в конечном растворе:
ω(HNO3) = mост.(HNO3)/m(конеч. р-ра) · 100% = 75,6/1230,4· 100% = 6,14%.
Ответ: ω(HNO3) = 6,14%.
Задание №8
При этой некоторой температуре приготовили 474,48 г насыщенного раствора карбоната натрия, в котором на 27 карбонат-анионов приходится 500 молекул воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа (III). К раствору во второй колбе добавили 270 г раствора азотной кислоты, также взятой в избытке. При этом соотношение количеств молекул газа, выделившихся из первой и второй колб, равно 1:2, соответственно. Определите массовую долю нитрата натрия в конечном растворе во второй колбе. (Принять, что степень диссоциации сильных электролитов в растворе равна 100%. Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Запишем уравнения реакций, происходивших в первой и второй колбах, соответственно:
3Na2CO3 + Fe2(SO4)3 + 3H2O = 3Na2SO4 + 2Fe(OH)3 + 3CO2 (I)
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2 (II)
Для вычисления количества карбоната натрия необходимо учесть, что соотношение числа частиц в растворе будет равно соотношению числа моль этих частиц. Тогда справедливо следующее соотношение:
ν(Na2CO3)/ν(H2O) = N(CO32-)/N(H2O) = 27/500.
Обозначим за 27х количество карбоната натрия (или карбонат-анионов), тогда количество воды будет равно 500х моль. Зная общую массу раствора, составим уравнение:
106 · 27х + 18 · 500х = 474,48
11862х = 474,48
х = 0,04
ν(Na2CO3) = 27x = 27·0,04 моль = 1,08 моль
Далее обратим внимание на то, что в обеих реакциях количество выделившегося газа равно количеству карбоната натрия. Соотношение количеств молекул газа будет равно соотношению количеств веществ:
νI колб.(CO2)/νII колб.(CO2) = νI колб.(Na2CO3)/νII колб.(Na2CO3);
νI колб.(CO2)/νII колб.(CO2) = NI колб.(CO2)/NII колб.(CO2) = 1/2
Обозначим за х количество карбоната натрия в I колбе, тогда в колбу II попало 2х моль карбоната натрия.
Составим уравнение:
х + 2х = 1,08;
3х = 1,08;
х = 0,36 моль.
νI колб.(Na2CO3) = 0,36 моль;
νII колб.(Na2CO3) = 0,36 моль · 2 = 0,72 моль.
Вычислим количества и массы нитрата натрия и углекислого газа во второй колбе:
ν(NaNO3) = 2νII колб.(Na2CO3) · 0,72 моль = 1,44 моль.
m(NaNO3) = ν · M = 1,44 моль · 85 г/моль = 122,4 г,
νII колб.(CO2) = νII колб.(Na2CO3) = 0,72 моль,
отсюда mII колб.(CO2) = ν · M = 0,72 моль · 44 г/моль = 31,68 г.
Соотношение масс растворов карбоната натрия в I и II колбах будет равно соотношению количеств карбоната натрия в них. Вычислим массу раствора карбоната натрия во II колбе:
mII колб.(р-ра Na2CO3) = m(р-ра Na2CO3)/3 · 2 = 474,48 г/3 · 2 = 316,32 г.
Вычислим массу конечного раствора во II колбе:
m(конеч. р-ра) = mII колб.(р-ра Na2CO3) + m(р-ра HNO3) − mII колб.(CO2) = 316,32 г + 270 г − 31,68 г = 554,64 г.
Вычислим массовую долю нитрата натрия в конечном растворе:
ω(NaNO3) = m(NaNO3)/m(конеч. р-ра) · 100% = 122,4 г/554,64 г · 100% = 22,07%.
Ответ: ω(NaNO3) = 22,07%.
Задание №9
При нагревании образца нитрата магния часть вещества разложилась. Масса твердого остатка составила 15,4 г. Этот остаток может прореагировать с 20 г раствора гидроксида натрия, содержащего 6,02 · 1022 катионов натрия. Определите массу исходного образца и объем выделившихся газов (в пересчете на н.у.). (Принять, что степень диссоциации сильных электролитов в растворе равна 100%. Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
При разложении нитрата магния образуются оксид магния, диоксид азота и кислород:
2Mg(NO3)2 = 2MgO + 4NO2 + O2 (I)
Оксид магния реагирует с водой только при кипячении, поэтому с водным раствором щелочи взаимодействует только оставшийся нитрат магния:
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3 (II)
Вычислим количество гидроксида натрия, вступившего в реакцию с нитратом магния:
ν(NaOH) = ν(Na+) = N(Na+)/NA = 6,02 · 1022/6,02 · 1023 моль-1 = 0,1 моль.
Далее вычислим количество и массу нитрата магния, оставшихся после разложения. По уравнению реакции (I) ν(NaOH) = 2ν(Mg(NO3)2); следовательно:
νост.(Mg(NO3)2) = ν(NaOH)/2 = 0,1 моль/2 = 0,05 моль;
mост.(Mg(NO3)2) = ν · M = 0,05 моль · 148 г/моль = 7,4 г.
Твердый остаток представляет собой образовавшийся MgO и непрореагировавший Mg(NO3)2.
Вычислим массу и количество оксида магния:
m(MgO) = m(тв. ост.) − mост.(Mg(NO3)2) = 15,4 г − 7,4 г = 8 г;
тогда ν(MgO) = m/M = 8 г/40 г/моль = 0,2 моль.
Далее определим массу разложившегося нитрата магния и суммарную массу образца до прокаливания:
νразл.(Mg(NO3)2) = ν(MgO) = 0,2 моль,
тогда mразл.(Mg(NO3)2) = ν · M = 0,2 моль · 148 г/моль = 29,6 г;
mисх.(Mg(NO3)2) = mразл.(Mg(NO3)2) + mост.(Mg(NO3)2) = 29,6 г + 7,4 г = 37 г.
По уравнению разложения нитрата магния имеем (реакция (I)):
5ν(MgO) = 2ν(NO2 + O2), тогда
ν(NO2 + O2) = 5ν(MgO)/2 = 5 · 0,2 моль/2 = 0,5 моль;
V(NO2 + O2) = ν(NO2 + O2) · Vm = 0,5 моль · 22,4 л/моль = 11,2 л.
Ответ: m(Mg(NO3)2) = 37 г, V(NO2 + O2) = 11,2 л.
Задание №10
При разложении нитрата серебра выделилась смесь газов, содержащая 1,204 · 1023 атомов азота. Масса остатка составила 25 г. После этого остаток поместили в 50 мл воды и добавили 18,25 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе. (Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
При разложении нитрата серебра выделяется серебро, диоксид азота и кислород:
2AgNO3 = 2Ag + 2NO2 + O2 (I)
С раствором соляной кислоты реагирует только оставшийся после реакции (I) нитрат серебра:
AgNO3 + HCl = AgCl + HNO3 (II)
Вычислим количества газов, выделившихся при разложении нитрата серебра:
ν(NO2) = ν(N) = N(N)/NA = 1,204 · 1023/6,02 · 1023 моль-1 = 0,2 моль.
Вычислим количество и массу образовавшегося серебра (по уравнению реакции (I)):
ν(Ag) = ν(NO2) = 0,2 моль; следовательно,
m(Ag) = ν · M = 0,2 моль · 108 г/моль = 21,6 г.
Масса твердого остатка после прокаливания складывается из серебра и оставшегося нитрата серебра. Вычислим массу и количество оставшейся соли:
mост.(AgNO3) = m(тв. остатка) — m(Ag) = 25 г — 21,6 г = 3,4 г;
νост.(AgNO3) = m/M = 3,4 г/170 г/моль = 0,02 моль.
Вычислим исходные массу и количество хлороводорода:
mисх.(HCl) = ν · M = 0,2 моль · 18,25 г/моль = 3,65 г;
νисх.(HCl) = m/M = 3,65 г/36,5 г/моль = 0,1 моль.
По уравнению реакции количества нитрата серебра и хлороводорода равны: νост.(AgNO3) = ν(HCl). Вычислим количество и массу HCl, оставшегося после реакции:
νост.(HCl) = νисх.(HCl) − ν(HCl) = 0,1 моль − 0,02 моль = 0,08 моль;
mост.(HCl) = ν · M = 0,08 моль · 36,5 г/моль = 2,92 г.
Далее вычислим массу выпавшего в осадок хлорида серебра:
νост.(AgNO3) = ν(HCl) = ν(AgCl); m(AgCl) = ν · M = 0,02 моль · 143,5 г/моль = 2,87 г.
Вычислим массу конечного раствора:
m(конеч. р-ра) = m(H2O) + mост.(AgNO3) + m(р-ра HCl) − m(AgCl) = 50 г + 3,4 г + 18,25 г − 2,87 г = 68,78 г.
Вычислим массовую долю HCl в конечном растворе:
ω(HCl) = mост.(HCl)/m(конеч. р-ра) · 100% = 2,92 г/68,78 г · 100% = 4,25%.
Ответ: ω(HCl) = 4,25%.
Задание №11
Порцию фосфида кальция, содержащую 3 моль атомов, подвергли гидролизу. Образовавшийся газ сожгли в избытке кислорода. Полученную кислоту смешали с 25%-ным раствором гидроксида натрия, содержащим 8 моль воды. Определите состав образовавшейся соли и ее массовую долю в растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Фосфид кальция реагирует с водой с образованием гидроксида кальция и фосфина:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3 (I)
Каждая формульная единица фосфида кальция состоит из 5 атомов, поэтому можем вычислить количество вещества, исходя из количества атомов:
ν(Ca3P2) = ν(атомов)/5 = 3 моль/5 = 0,6 моль.
Далее запишем уравнение горения фосфина:
PH3 + 2O2 = H3PO4 (II)
Количество фосфорной кислоты связано с количеством фосфида кальция следующим соотношением (уравнение реакции (II)):
ν(H3PO4) = ν(PH3) = 2ν(Ca3P2) = 0,6 моль · 2 = 1,2 моль,
m(H3PO4) = ν · M = 1,2 моль · 98 г/моль = 117,6 г.
Далее необходимо рассчитать массу и количество щелочи.
Для начала определим массу воды и раствора целиком:
m(H2O) = ν · M = 8 моль · 18 г/моль = 144 г,
w(H2O) = 100% − w(NaOH) = 100% − 25% = 75%, следовательно,
m(р-ра NaOH) = m(р-ра)/w(H2O) · 100% = 144 г/75% · 100% = 192 г.
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра) · w(NaOH)/100% = 192 г · 25%/100% = 48 г, откуда
ν(NaOH) = m/M = 48 г/40 г/моль = 1,2 моль.
Для понимания, какая соль образуется в ходе реакции, сравним количества кислоты и щелочи:
ν(NaOH)/ν(H3PO4) = 1,2 моль/1,2 моль = 1.
Поскольку соотношение кислоты и щелочи равно 1:1, то образуется дигидрофосфат натрия:
NaOH + H3PO4 = NaH2PO4 + H2O (III)
Определим количество и массу образовавшейся соли:
ν(NaH2PO4) = ν(NaOH) = 1,2 моль, следовательно,
m(NaH2PO4) = ν · M = 1,2 моль · 120 г/моль = 144 г.
Далее вычислим массу конечного раствора соли:
m(р-ра NaH2PO4) = m(H3PO4) + m(р-ра NaOH) = 117,6 г + 192 г = 309,6 г.
Определим массовую долю соли в конечном растворе:
ω(NaH2PO4) = m(NaH2PO4)/m(р-ра NaH2PO4) · 100% = 144 г/309,6 г · 100% = 46,51%.
Ответ: ω(NaH2PO4) = 46,51%.
Задание №12
Хлорат калия разложили в присутствии катализатора – оксида марганца (IV), в результате чего выделился кислород объемом 6,72 л (в пересчете на н.у.). В полученном твердом остатке число атомов кислорода равно 3,612 · 1022. Этот остаток прореагировал с 170 г 30%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в образовавшемся растворе. (Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
При каталитическом разложении (в присутствии MnO2) хлората калия выделяется кислород и образуется хлорид калия:
2KClO3 = 2KCl + 3O2 (I)
Вычислим количество кислорода и образовавшегося хлорида калия (уравнение реакции (I)):
ν(O2) = V/Vm = 6,72 л/22,4 л/моль = 0,3 моль;
ν(KCl) = 2ν(O2)/3 = 2 · 0,3 моль/3 = 0,2 моль; откуда
m(KCl) = ν · M = 0,2 моль · 74,5 г/моль = 14,9 г.
Поскольку в твердом остатке после разложения остались атомы кислорода, то можно предположить, что разложение прошло не полностью и осталось некоторое количество хлората калия.
Вычислим количество и массу этой соли:
ν(O) = N(O)/NA = 3,612 · 1022/6,02 · 1023 моль-1 = 0,06 моль;
ν(KClO3) = ν(O)/3 = 0,06 моль/3 = 0,02 моль;
m(KClO3) = ν · M = 0,02 моль · 122,5 г/моль = 2,45 г.
Далее вычислим исходные массу и количество нитрата серебра:
m(AgNO3) = ν · M = 0,3 моль · 170 г/моль = 51 г;
ν(AgNO3) = m/M = 51 г/170 г/моль = 0,3 моль.
Хлорат и хлорид калия растворимы в воде, однако с нитратом серебра будет реагировать только хлорид:
AgNO3 + KCl = AgCl + KNO3 (II)
Хлорид калия в недостатке, поэтому по нему можем определить количество и массу осадка хлорида серебра (по уравнению реакции (II)):
ν(AgCl) = ν(KCl) = 0,2 моль; следовательно,
m(AgCl) = ν · M = 0,2 моль · 143,5 г/моль = 28,7 г.
Далее вычислим количество и массу оставшегося в растворе нитрата серебра:
νост.(AgNO3) = νисх.(AgNO3) − ν(AgNO3) = 0,3 моль − 0,2 моль = 0,1 моль;
mост.(AgNO3) = ν · M = 0,1 моль · 170 г/моль = 17 г.
Масса конечного раствора сложится из масс раствора нитрата серебра, хлорида калия и хлората калия за вычетом массы хлорида серебра. Вычислим массу конечного раствора:
m(конеч. р-ра) = m(р-ра AgNO3) + m(KCl) + m(KClO3) − m(AgCl) = 170 г + 14,9 г + 2,45 г − 28,7 г = 158,65 г.
Определим массовую долю нитрата серебра в конечном растворе:
ω(AgNO3) = m(AgNO3)/m(конеч. р-ра) · 100% = 17 г/158,65 г · 100% = 10,72%.
Ответ: ω(AgNO3) = 10,72%.
Задание №13
Порцию водорода, содержащую 1,806 · 1023 атомов, пропустили при нагревании над порошком оксида меди массой 16 г. Образовавшийся в результате этой реакции остаток растворили в 535,5 г 20%-ной азотной кислоты, в результате выделился бесцветный газ, буреющий на воздухе. Определите массовую долю азотной кислоты в полученном растворе (процессами гидролиза пренебречь). (Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
При взаимодействии водорода и CuO происходит процесс восстановления оксида до металла:
CuO + H2 = Cu + H2O (I)
Вычислим исходное количество водорода. Обратим внимание, что дано число не молекул, а атомов водорода:
ν(H2) = ν(H)/2 = N(H)/2NA = 1,806 · 1023/(2 · 6,02 · 1023 моль-1 = 0,15 моль.
Далее вычислим количество оксида меди (II):
νисх.(CuO) = m/M = 16 г/80 г/моль = 0,2 моль.
По уравнению реакции (I) соотношение оксида и водорода 1:1, следовательно, в нашем случае водород находится в недостатке. Определим количества и массы оставшегося оксида и образовавшейся меди:
ν(Cu) = ν(H2) = 0,15 моль (по уравнению реакции (I));
m(Cu) = ν · M = 0,15 моль · 64 г/моль = 9,6 г;
ν(Cu) = νреаг.(CuO); следовательно,
νост.(CuO) = νисх.(CuO) − νреаг.(CuO) = 0,2 моль − 0,15 моль = 0,05 моль;
mост.(CuO) = ν · M = 0,05 моль · 80 г/моль = 4 г.
Оба компонента образовавшегося твердого остатка будут реагировать с азотной кислотой. Запишем эти реакции:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O (II)
CuO + 2HNO3 = Cu(NO3)2 + H2O (III)
Далее вычислим исходную массу и количество азотной кислоты:
mисх.(HNO3) = m(р-ра HNO3) · w(HNO3)/100% = 535,5 г · 20%/100% = 107,1 г;
νисх.(HNO3) = m/M = 107,1 г/63 г/моль = 1,7 моль.
Определим общий расход азотной кислоты на обе реакции:
νрасх.(HNO3) = 2νост.(CuO) + 8ν(Cu)/3 = 2 · 0,05 моль + 8 · 0,15 моль/3 = 0,5 моль.
Вычислим количество и массу оставшейся азотной кислоты:
νост.(HNO3) = νисх.(HNO3) − νрасх.(HNO3) = 1,7 моль − 0,5 моль = 1,2 моль;
mост.(HNO3) = ν · M = 1,2 моль · 63 г/моль = 75,6 г.
Далее вычислим массу выделившегося NO и массу конечного раствора:
ν(NO) = 2ν(Cu)/3 = 2 · 0,15 моль/3 = 0,1 моль;
m(NO) = ν · M = 0,1 моль · 30 г/моль = 3 г.
m(конеч. р-ра) = m(р-ра HNO3) + m(Cu) + mост.(CuO) − m(NO) = 535,5 г + 9,6 г + 4 г − 3 г = 546,1 г.
Определим массовую долю кислоты в конечном растворе:
ω(HNO3) = ω(HNO3)/m(конеч. р-ра) · 100% = 75,6 г/546,1 г · 100% = 13,84%.
Ответ: ω(HNO3) = 13,84%.
Задание №14
При растворении воде порции медного купороса (CuSO4 · 5H2O) массой 112,5 г был получен раствор, содержащий 9,632 · 1024 молекул воды. К полученному раствору добавили 33,6 г железа. После завершения реакции к полученной смеси добавили 300 г 20%-ного раствора серной кислоты. Определите массовую долю соли в образовавшемся растворе (процессами гидролиза пренебречь). (Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
При взаимодействии железа и раствора сульфата меди (II) протекает реакция замещения (железо как более активный металл вытесняет медь из ее соли):
CuSO4 + Fe = FeSO4 + Cu (I)
Вычислим исходные количества веществ (сульфата меди (II) и железа):
ν(CuSO4) = ν(CuSO4 · 5H2O) = m/M = 112,5 г/250 г/моль = 0,45 моль;
ν(Fe) = m/M = 33,6 г/56 г/моль = 0,6 моль.
Тогда количество и масса образовавшегося по реакции (I) сульфата железа (II) равны:
νI(FeSO4) = ν(CuSO4) = 0,45 моль; mI(FeSO4) = ν · M = 0,45 моль · 152 г/моль = 68,4 г.
Поскольку железо находится в избытке (0,6 моль – исходное количество, 0,45 моль реагирует с солью), оно останется после реакции и далее прореагирует с серной кислотой:
Fe + H2SO4 = FeSO4 + H2 (II)
Вычислим массу и количество серной кислоты в исходном растворе:
mисх.(H2SO4) = m(р-ра H2SO4) · w.(H2SO4)/100% = 300 г · 20%/100% = 60 г;
νисх.(H2SO4) = m/M = 60 г/98 г/моль = 0,612 моль.
Определим количество железа, которое осталось в результате реакции (I):
νост.(Fe) = νисх.(Fe) – νI(Fe) = 0,6 моль − 0,45 моль = 0,15 моль.
Определим количество и массу сульфата железа (II), который образуется по реакции (II):
νII(FeSO4) = νост.(Fe) = 0,15 моль; тогда mII(FeSO4) = ν · M = 0,15 моль · 152 г/моль = 22,8 г.
Масса конечного раствора рассчитывается из масс воды, безводного сульфата меди, железа и раствора серной кислоты за вычетом масс меди и водорода. Вычислим количества и массы веществ, необходимые для расчета:
m(CuSO4) = ν · M = 0,45 моль · 160 г/моль = 72 г;
ν(H2O) = N(H2O)/NA = 9,632 · 1024/6,02 · 1023 моль-1 = 16 моль;
m(H2O) = ν · M = 16 моль · 18 г/моль = 288 г;
ν(Cu) = ν(CuSO4) = 0,45 моль, отсюда
m(Cu) = ν · M = 0,45 моль · 64 г/моль = 28,8 г;
ν(H2) = νост.(Fe) = 0,15 моль, m(H2) = ν · M = 0,15 моль · 2 г/моль = 0,3 г.
Вычислим массу конечного раствора:
m(конеч. р-ра) = m(H2O) + m(CuSO4) + m(Fe) + m(р-ра H2SO4) − m(Cu) − m(H2) = 288 г + 72 г + 33,6 г + 300 г − 28,8 г − 0,3 г = 664,5 г.
Вычислим массовую долю сульфата железа (II) в конечном растворе:
ω(FeSO4) = (mI(FeSO4) + mI(FeSO4))/m(конеч. р-ра) · 100% = (68,4 + 22,8)/664,5 · 100% = 13,72%.
Ответ: ω(FeSO4) = 13,72%.
Задание №15
В 91,25 г раствора соляной кислоты, содержащего 3,01 · 1023 хлорид-анионов, внесли 9,1 г фосфида кальция. Далее к полученному раствору добавили 100,1 г Na2CO3 · 10H2O. Определите массовую долю карбоната натрия в полученном растворе (процессами гидролиза пренебречь). (Принять, что степень диссоциации сильных электролитов в растворе равна 100%. Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
При взаимодействии фосфида кальция и кислоты образуется соль и фосфин:
Ca3P2 + 6HCl = 3CaCl2 + 2PH3 (I)
Вычислим исходные количества веществ, вступающих в реакцию (I):
νисх.(HCl) = ν(Cl−) = N(Cl−)/NA = 3,01 · 1023/6,02 · 1023 моль-1 = 0,5 моль;
ν(Ca3P2) = m/M = 9,1 г/182 г/моль = 0,05 моль.
Соотношение фосфида и кислоты по реакции (I) равно 1:6, поэтому кислота в данном случае находится в избытке. Вычислим количества оставшейся кислоты и образовавшегося хлорида кальция.
По уравнению реакции (I) νреаг.(HCl) = 6ν(Ca3P2), следовательно:
νост.(HCl) = νисх.(HCl) − 6ν(Ca3P2) = 0,5 моль – 6 · 0,05 моль = 0,2 моль;
ν(CaCl2) = 3ν(Ca3P2) = 0,05 моль · 3 = 0,15 моль.
При добавлении к образовавшемуся раствору карбоната натрия будут протекать обменные реакции с остатком соляной кислоты и хлоридом кальция:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O (II)
Na2CO3 + CaCl2 = CaCO3 + 2NaCl (III)
Вычислим исходное количество карбоната натрия:
νисх.(Na2CO3) = ν(Na2CO3 · 10H2O) = m/M = 100,1 г/286 г/моль = 0,35 моль.
По уравнению реакции (II) νII(Na2CO3) = 1/2νост.(HCl);
по уравнению реакции (III) νIII(Na2CO3) = ν(CaCl2),
далее вычисляем общий расход карбоната натрия на обе реакции:
νрасх.(Na2CO3) = νост.(HCl)/2 + ν(CaCl2) = 0,2 моль/2 + 0,15 моль = 0,25 моль.
Вычислим количество и массу оставшегося карбоната натрия:
νост.(Na2CO3) = νисх.(Na2CO3) − νрасх.(Na2CO3) = 0,35 моль − 0,25 моль = 0,1 моль, следовательно,
mост.(Na2CO3) = ν · M = 0,1 моль · 106 г/моль = 10,6 г.
Масса конечного раствора сложится из раствора соляной кислоты, фосфида кальция и карбоната натрия за вычетом масс фосфина, углекислого газа и карбоната кальция.
Вычислим количества и массы, необходимые для расчета.
По уравнению реакции (I) ν(PH3) = 2ν(Ca3P2), то ν(PH3) = ν · M = 0,05 моль · 2 = 0,1 моль,
m(PH3) = ν · M = 0,1 моль · 34 г/моль = 3,4 г,
ν(CO2) = νост.(HCl)/2 = 0,2 моль/2 = 0,1 моль,
m(CO2) = ν · M = 0,1 моль · 44 г/моль = 4,4 г.
По уравнению реакции (II) ν(CaCO3) = ν(CaCl2) = 0,15 моль, следовательно,
m(CaCO3) = ν · M = 0,15 моль · 100 г/моль = 15 г.
Вычислим массу конечного раствора:
m(конеч. р-ра) = m(р-ра HCl) + m(Ca3P2) + m(Na2CO3 · 10H2O) − m(PH3) − m(CO2) − m(CaCO3) = 91,25 г + 9,1 г + 100,1 г − 3,4 г − 4,4 г − 15 г = 177,65 г.
Вычислим массовую долю карбоната натрия в конечном растворе:
ω(Na2CO3) = m(Na2CO3)/m(конеч. р-ра) · 100% = 10,6 г/177,65 г · 100% = 5,97%.
Ответ: ω(Na2CO3) = 5,97%.
Задание №16
При прокаливании 20,5 г смеси оксида магния и карбоната магния до постоянной массы выделилось 7,525 · 1022 молекул газа. Полученный твердый остаток полностью прореагировал с раствором серной кислоты с массовой долей 28% и плотностью 1,2 г/мл. Вычислите объем раствора серной кислоты, необходимый для растворения этого остатка. (Число Авогадро принять равным 6,02 · 1023 моль-1.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
При прокаливании исходной смеси разложится карбонат магния:
MgCO3 = MgO + CO2 (I)
Вычислим количество и массу углекислого газа, который выделился в результате реакции (I):
ν(CO2) = N(CO2)/NA = 7,525 · 1022/6,02 · 1023 моль-1 = 0,125 моль;
m(CO2) = ν · M = 0,125 моль · 44 г/моль = 5,5 г.
Далее вычислим массу и количество вещества образовавшегося оксида магния:
m(MgO) = m(смеси) − m(CO2) = 20,5 г − 5,5 г = 15 г;
ν(MgO) = m/M = 15 г/40 г/моль = 0,375 моль.
Оксид магния реагирует с серной кислотой с образованием соли и воды:
MgO + H2SO4 = MgSO4 + H2O (II)
Вычислим количество и массу серной кислоты, прореагировавшей с MgO:
ν(H2SO4) = ν(MgO) = 0,375 моль (по уравнению реакции (II));
m(H2SO4) = ν · M = 0,375 моль · 98 г/моль = 36,75 г.
Далее вычислим массу и объем раствора серной кислоты:
m(р-ра H2SO4) = m(H2SO4)/ m(H2SO4) · 100% = 36,75 г/28% · 100% = 131,25 г;
V(р-ра H2SO4) = m(р-ра H2SO4)/ρ(р-ра H2SO4) = 131,25 г/1,2 г/мл = 109,4 мл.
Ответ: V(р-ра H2SO4) = 109,4 мл.
Задание №17
К навеске оксида меди (II) массой 25 г добавили 350 г 14%-ного раствора серной кислоты, после чего образовавшуюся смесь нагрели. Реакцию прекратили, когда в растворе соотношение числа ионов водорода к числу ионов меди стало равно 4 : 3. Оставшийся осадок отфильтровали, а фильтрат разлили в две колбы. Для полного осаждения ионов меди в первой колбе потребовалось 125 г 8%-ного раствора гидроксида натрия. Во вторую колбу добавили 206,875 г раствора хлорида бария, при этом в образовавшемся растворе не осталось сульфат-анионов и катионов бария. Вычислите массовые доли веществ в образовавшемся растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин). (Принять, что степень диссоциации сильных электролитов в растворе по всем ступеням равна 100%.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Запишем уравнения протекающих реакций:
CuO + H2SO4 = CuSO4 + H2O (I)
2NaOH + H2SO4 = Na2SO4 + 2H2O (II)
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 (III)
BaCl2 + H2SO4 = BaSO4 + 2HCl (IV)
BaCl2 + CuSO4 = BaSO4 + CuCl2 (V)
Вычислим исходные массу и количество серной кислоты:
mисх.(H2SO4) = m(р-ра H2SO4) · ω(H2SO4)/100% = 350 г · 14%/100% = 49 г;
νисх.(H2SO4) = m/M = 49 г/98 г/моль = 0,5 моль.
Далее обратим внимание на соотношение катионов меди и катионов водорода в образовавшемся растворе. Поскольку при диссоциации одной молекулы серной кислоты образуется два катиона водорода, справедливо следующее выражение:
N(H+)/N(Cu2+) = 4/3;
N(H+) = 2Nост.(H2SO4);
2Nост.(H2SO4)/N(Cu2+) = 4/3;
Nост.(H2SO4)/N(Cu2+) = 2/3;
νост.(H2SO4)/ν(Cu2+) = Nост.(H2SO4)/N(Cu2+) = 2/3;
νост.(H2SO4)/ν(CuSO4) = Nост.(H2SO4)/N(Cu2+) = 2/3.
По уравнению реакции количество образовавшегося сульфата меди (II) будет равно количеству затраченной серной кислоты. Пусть х моль серной кислоты была затрачено на реакцию. Если изначально серной кислоты было 0,5 моль, затрачено х моль, тогда осталось (0,5 − х) моль. Справедливо следующее уравнение:
(0,5 − х)/х = 2/3;
2х = 3 · (0,5 − х);
2х = 1,5 − 3х;
5х = 1,5;
х = 0,3 моль;
νреаг.(CuSO4) = 0,3 моль.
По уравнению реакции (I) νреаг.(H2SO4) = νреаг.(CuSO4) = 0,3 моль; следовательно,
νост.(H2SO4) = νисх.(H2SO4) − νреаг.(H2SO4) = 0,5 моль − 0,3 моль = 0,2 моль;
νобщ. = νреаг.(CuSO4) + νост.(H2SO4) = 0,3 моль + 0,2 моль = 0,5 моль.
Убедимся также, что вычисленное количество прореагировавшего сульфата меди (II) не противоречит данным о массе исходного оксида меди (II). Для этого вычислим количество исходного оксида:
ν(CuO) = m/M = 25 г/80 г/моль = 0,3125 моль; отсюда
0,3125 моль > 0,3 моль;
ν(CuO) > νреаг.(CuSO4).
Условие справедливо и выполняется, оксида меди (II) достаточно.
Вычислим массу раствора после отделения остатка оксида меди (II):
νреаг.(CuO) = νреаг.(CuSO4) = 0,3 моль;
mреаг.(CuO) = ν · M = 0,3 моль · 80 г/моль = 24 г.
Масса раствора после реакции I равна:
m(р-ра) = mреаг.(CuO) + m(р-ра H2SO4) = 24 г + 350 г = 374 г.
Далее вычислим исходные массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH) · ω(NaOH)/100% = 125 г · 8%/100% = 10 г;
ν(NaOH) = m/M = 10 г/40 г/моль = 0,25 моль.
Поскольку количество щелочи, необходимое для реакций с кислотой и солью меди вдвое больше (реакции II и III в 1 колбе), чем у второго реагента (реакции IV и V во 2 колбе), можно вычислить общее количество серной кислоты и сульфата меди (II) в первой колбе:
ν(NaOH) = 2νI колб.(CuSO4) + 2νII колб.(H2SO4);
νI колб.(CuSO4) + νI колб.(H2SO4) = ν(NaOH)/2 = 0,25 моль/2 = 0,125 моль.
Если изначально в растворе находилось суммарно 0,5 моль кислоты и соли меди, то можно вычислить, сколько их попало во вторую колбу:
νII колб.(CuSO4) + νII колб.(H2SO4) = ν(суммарно) − (νI колб.(CuSO4) + νI колб.(H2SO4)) = 0,5 моль − 0,125 моль = 0,375 моль.
Используя известное соотношение между веществами, найдем их количества по отдельности. Обозначим за 2х количество серной кислоты, тогда количество сульфата меди (II) будет 3х. Составим уравнение:
2х + 3х = 0,375;
5х = 0,375;
х = 0,075 моль;
νII колб.(H2SO4) = 2 · 0,075 моль = 0,15 моль;
νII колб.(CuSO4) = 3 · 0,075 = 0,225 моль.
Обратим также внимание, что соотношение количества хлорида бария к количеству любого из этих веществ в реакции равно 1:1. Тогда справедливо следующее выражение:
ν(BaCl2) = νII колб.(CuSO4) + νII колб.(H2SO4) = 0,225 моль + 0,15 моль = 0,375 моль.
Вычислим количество и массу образовавшегося при этом осадка сульфата бария:
ν(BaSO4) = ν(BaCl2) = 0,375 моль (по уравнению реакции IV и V);
m(BaSO4) = ν · M = 0,375 моль · 233 г/моль = 87,375 г.
Далее вычислим массу раствора, попавшего во вторую колбу. Она будет пропорциональна количеству веществ, которые в ней оказались:
mII колб.(р-ра)/m(р-ра) = (νII колб.(CuSO4) + νII колб.(H2SO4))/ νобщ.;
mII колб.(р-ра)/374 = 0,375/0,5;
mII колб.(р-ра) = 280,5 г.
Масса конечного раствора сложится из масс растворов хлорида бария и 2 части исходного раствора за вычетом массы осадка сульфата бария. Проведем необходимые вычисления:
mконеч.(р-ра) = m(р-ра BaCl2) + mII колб.(р-ра) – m(BaSO4) = 206,875 г + 280,5 г − 87,375 г = 400 г.
Далее вычислим количества и массы хлороводорода и хлорида меди (II) в конечном растворе:
ν(HCl) = 2νII колб.(H2SO4) = 2 · 0,15 моль = 0,3 моль;
m(HCl) = ν · M = 0,3 моль · 36,5 г/моль = 10,95 г;
ν(CuCl2) = νII колб.(CuSO4) = 0,225 моль (по уравнению реакции V);
m(CuCl2) = ν · M = 0,225 моль · 135 г/моль = 30,375 г.
Вычислим доли этих веществ в конечном растворе:
ω(HCl) = m(HCl)/mконеч.(р-ра) · 100% = 10,95 г/400 г · 100% = 2,74%;
ω(CuCl2) = m(CuCl2)/mконеч.(р-ра) · 100% = 30,375 г/400 г · 100% = 7,59 %.
Ответ: ω(HCl) = 2,74%, ω(CuCl2) = 7,59%.
Чтобы поделиться, нажимайте
На самом деле, понятия «атомистика» не существует, но в интернете стали так говорить, поэтому и я не буду исключением.
Задачи на «атомистику» — это задачи на соотношения частиц (атомов, молекул, ионов и т.д.) в гомогенных и гетерогенных системах (растворах, твердых и газообразных смесях). Это могут быть массовые соотношения (например, массовая доля элемента в смеси), мольные соотношения (например, соотношение числа атомов водорода и кислорода или мольная доля), объемные соотношения (объемная доля и др.).
Задачи разделены по уровню сложности: от простых до сложных. А также предлагаю вам порешать задачи на удобрения, в которых без «атомистики» не обойтись. Как показывает моя практика, если вы умеете решать задачи на удобрения, то вы полностью понимаете тему «атомистика».
И, конечно же, после каждой задачи вы найдёте подробные видео-объяснения, а ответы в конце страницы.
- Простые задачи
- Задачи средней сложности
- Сложные задачи
- Задачи на удобрения
- Задачи из реального ЕГЭ 2020 на атомистику
Простые задачи
-
Укажите число атомов водорода в одной формульной единице гидросульфита аммония NH4HSO3.
-
Рассчитайте химическое количество азота в порции простого вещества, содержащей 6,02∙1025 молекул.
-
Имеется сосуд, в котором содержится 8,428∙1022 молекул некоторого газа. Укажите объём сосуда (в литрах).
-
Рассчитайте химическое количество (моль) поваренной соли, в которой содержится такое же химическое количество натрия, как и в карбонате натрия химическим количеством 4 моль.
-
В каком объёме (л) бурого газа содержится столько же атомов, сколько и в аргоне объёмом 2 л (объёмы измерены при одинаковых условиях)?
-
Рассчитайте количество (моль) CO2, в котором содержится столько же атомов углерода, сколько их содержится в СО массой 1,4 г.
-
Рассчитайте количество (моль) атомов водорода в аммиаке, объёмом (н.у.) 32,48 л.
-
Укажите объём (л) порции метана СН4 (н.у.), в которой содержится 0,1 моль атомов углерода.
-
Рассчитайте объём оксида азота (IV) (л, н.у.), в котором содержится столько же атомов азота и кислорода в сумме, как и общее число атомов в азотной кислоте массой 56,7 г.
-
Рассчитайте массу (г) порции азотной кислоты, содержащей столько же атомов водорода, сколько в аммиаке объёмом 3,36 л (н.у.).
-
Укажите число атомов водорода в образце дигидата ацетата цинка ((CH3COO)2Zn∙2H2O) массой 131,4 г.
-
Вычислите число атомов в образце фтора (н.у.) объёмом 30,24 дм3.
-
Укажите количество (моль) оксида серы (VI), содержащего столько же атомов кислорода, как и в оксиде серы (IV) массой 76,8 г.
-
Вычислите число атомов азота в порции гидросульфата аммония массой 16,1.
-
Рассчитайте массу (г) соли Na2S, содержащей столько же атомов серы, сколько их содержится в сероводороде массой 48,96 г.
-
Укажите число моль воды в 1 моль кристаллогидрата сульфата натрия с Mr равной 322.
-
Каков объём кислорода (л, н.у.), содержащего столько же атомов кислорода, сколько их содержится в алебастре массой 87 г?
-
Рассчитайте количество (моль) ионов в навеске селенида калия массой 39,25.
-
В порции газа массой 26,4 г содержится 3,612∙1023 молекул. Укажите относительную плотность этого газа по водороду.
-
Вычислите количество (моль) всех анионов, содержащихся в Ca3(PO4)2 массой 372 г.
-
Какое число электронов содержится в образце массой 6,4 г, состоящем из нуклида меди-64?
Задачи средней сложности
-
Образец сплава железа-56 с медью-63 содержит электроны и нейтроны химическим количеством 2,77 моль и 3,21 моль соответственно. Рассчитайте массовую долю (%) меди в сплаве.
-
Какую массу (г) гидросульфата аммония надо добавить к гидросульфиту натрия массой 15,6 г для получения смеси, содержащей равное число атомов водорода и кислорода?
-
Какую массу (г) сульфата натрия следует добавить к сульфиду натрия массой 3,9 г, чтобы в полученной смеси массовая доля натрия стала равной 51,9%?
-
В порции кристаллогидрата сульфата железа (II) содержится 1,204∙1024 атомов железа и 1,3244∙1025 атомов кислорода. Укажите число атомов водорода в данной порции кристаллогидрата.
-
В смеси оксида железа (II) и оксида железа (III) на 4 атома железа приходится 5 атомов кислорода. Вычислите массовую долю (%) оксида железа (II) в такой смеси.
-
Газовая смесь содержит 6,02∙1022 молекул и имеет массу 2,3 г. Укажите относительную плотность этой газовой смеси по кислороду.
-
Для получения бронзы массой 567 г (массовая доля меди 79,01%) использовали минералы медный блеск Cu2S и касситерит SnO2. Укажите общую массу (г) израсходованных минералов, если считать, что минералы не содержали примесей.
-
Образец минерала браунита массой 100 состоит из вещества, формула которого 3Mn2O3∙MnCO3, и примесей, которые не содержат в своём составе металлы. Массовая доля этих примесей 1,5%. Вычислите массу (г) марганца в исходном образце минерала.
-
Одна таблетка биологически активных добавок (БАВ) к пище содержит медь массой 2 мг, где медь находится в форме ацетата меди (II). Укажите массу (г) ацетата меди (II), который поступает в организм за неделю при ежедневном приёме 1 таблетки БАВ.
-
Алюминиевая руда (боксит) состоит из оксида алюминия и других веществ, не содержащих алюминий. Массовая доля алюминия в боксите составляет 21,6%. Вычислите массу (г) оксида алюминия в образце боксита массой 100 г.
Сложные задачи
-
Для анализа смеси массой 3,125 г, состоящей из хлорида калия и бромида калия, её растворили в воде и к полученному раствору добавили раствор нитрата серебра (I) массой 42,5 г с массовой долей соли 20%. В результате чего образовался осадок массой 5,195 г. Рассчитайте массовую долю (%) ионов калия в исходной смеси.
-
Твёрдое вещество массой 116 г, состоящее из атомов железа и кислорода, восстановили избытком углерода при нагревании. После полного завершения реакции получили смесь оксидов углерода общим объёмом 33,6 л с массовой долей кислорода 64%. Рассчитайте массу (г) железа в исходном веществе.
-
Сера, содержащаяся в неизвестном веществе массой 51,2 г, была полностью переведена в соль сульфит натрия массой 100,8 г. Укажите массовую долю (%) серы в неизвестном веществе
-
Массовая доля трёхвалентного металла в смеси, состоящей из его оксида и гидроксида, составляет 45%. Химические количества веществ равны между собой. Укажите молярную массу (г/моль) металла.
-
Укажите число электронов, переходящих к окислителю от восстановителя при полном разложении нитрата хрома и нитрита аммония общим химическим количеством 0,2 моль.
-
Кусочек цинка погрузили в концентрированный раствор гидроксида натрия. В результате образовалась соль массой 1074 г. Рассчитайте химическое количество электронов, которые атомы цинка отдали атомам водорода в результате описанного взаимодействия.
-
При взаимодействии цинка с избытком концентрированного раствора гидроксида калия от атомов цинка к атомам водорода перешло 4 моль электронов. Укажите массу (г) образовавшейся при этом соли.
-
Имеется твёрдый образец массой 291,195 г, содержащий только элементы Cu и O. Этот образец полностью восстановили углеродом, в результате чего получили смесь СО и СО2 объёмом 40,32 л (н.у.) с массовой долей кислорода 65,82%. Рассчитайте массу восстановленной меди.
-
Некоторый металл массой 11,8 г прокалили на воздухе, в результате чего образовалась смесь оксидов массой 16,067 г. Затем эти оксиды растворили в соляной кислоте. Через образовавшийся раствор пропустили газообразный хлор массой 2,345 г, который полностью поглотился. Затем раствор выпарили и получили единственный кристаллогидрат, представляющий собой гексагидрат хлорида металла в степени окисления +3. Рассчитайте массу кристаллогидрата.
-
В карбоновую трубку поместили порошок металла Х массой 15,36 г и пропустили по трубке ток очищенного хлора при нагревании до 700С и повышенном давлении. Через некоторое время металл полностью прореагировал, а в конце трубки накопились коричневые кристаллы вещества Y массой 26,72 г. Длительное нагревание Y в токе водорода приводит к образованию X и газа Z, который при растворении в воде даёт сильную неорганическую кислоту. Вещество Y состоит из пятиатомных молекул, содержащих один атом металла. Укажите химический символ металла X.
-
Имеется вещество, состоящее из атомов четырёх химических элементов. Массовые доли серы, водорода и кислорода соответственно равны 13,4%, 5,03% и 67,04%. Порцию этого вещества массой 71,6 г растворили в воде массой 100 г. Массовая доля воды в полученном растворе составила 77,16%. Затем к полученному раствору добавили избыток раствора нитрата бария. В результате этого образовался осадок массой 69,9 г. Укажите относительную молекулярную (формульную) массу неизвестного элемента, входящего в состав исходного вещества.
-
Имеется смесь оксида кобальта (II), оксида кобальта (III) и оксида кобальта (II, III). Эту смесь массой 0,782 г полностью восстановили водородом, в результате чего было получено твёрдое вещество массой 0,590 г. Эту же смесь массой 1,564 г полностью растворили в бромоводородной кислоте массой 48,6 г с массовой долей растворённого вещества 10%. Рассчитайте максимальную массу кобальта (мг), которую можно ещё растворить в полученном растворе, чтобы в нём содержалась только одна соль.
Задачи на удобрения
-
Потребность редиски в химическом элементе азот составляет в среднем 195 кг/га. Масса аммиачной селитры (кг), которую необходимо внести на 3 га почвы для подкормки редиски азотом, равна
-
Для подкормки растений на 1 м2 почвы необходимо внести азот массой 4,2 г и натрий массой 4,6 г. Укажите массу (г) смеси, состоящей из аммиачной селитры и чилийской селитры, которая потребуется, чтобы растения получили необходимое количество азота и натрия на приусадебном участке площадью 10 м2.
-
При поглощении аммиака объёмом (н.у.) 1,2 м3 азотной кислотой с выходом 86% получено удобрение под названием аммиачная селитра. Учитывая, что для удобрения 1 га почвы необходим азот массой 28 г, рассчитайте количество гектаров, которые можно удобрить, используя полученную селитру.
-
На одном дачном участке использовалось удобрение чилийская селитра массой 136 г, содержащая 6,25% примесей. Рассчитайте массу (г) аммиачной селитры, не содержащей примесей, которую нужно внести на другой такой же по размеру дачный участок, чтобы в почву поступило такое же количество азота, что и на первый дачный участок.
-
Имеется смесь кальциевой селитры и аммофоски (массовая доля оксида фосфора (V) составляет 23%) в таком количестве, чтобы при внесении в почву поступило по 10 кг калия, азота и оксида фосфора (V). Определите массу (кг) исходной смеси удобрений (примесями пренебречь, округления производить до четырех знаков после запятой).
-
На дачный участок было внесено 10 кг золы, в которой массовая доля поташа 13,8%. Вычислите массу (кг) органического удобрения, содержащего калий в виде примесей представленных хлоридом калия, которое необходимо дополнительно внести в почву, чтобы втрое увеличить содержание калия в почве. Учтите, что массовая доля хлорида калия в органическом удобрении всего лишь 0,4%.
-
Имеется смесь нитрата аммония и нитрата калия, которая необходима для удобрения территории площадью 10 м2. Рассчитайте массу этой смеси, если известно, что в почву необходимо внести азот массой 4,368 г и калий массой 5,616 г в расчёте на м2.
-
Вычислите массу (г) смеси, состоящей из аммиачной селитры и аммофоса, которая потребуется для удобрения участка для выращивания льна площадью 100 м2, если массовая доля оксида фосфора (V) в аммофосе составляет 59,97%, а на 1 м2 почвы требуется 1,55 г фосфора и 4,2 г азота.
Задачи из реального ЕГЭ 2020 на атомистику
-
52. Железную пластину полностью растворили в 500г раствора азотной кислоты. При этом выделилась смесь оксида азота(II) и оксида азота (IV) общим объемом 20,16л. Соотношение атомов кислорода к атомам азота в этой газовой смеси соответственно равно 5:3. Вычислите массовую долю соли в полученном растворе.
-
53. Смесь оксида алюминия и сульфида алюминия, в которой массовая доля алюминия составляет 50%, растворили в избытке 700г соляной кислоты. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди (II), причём исходные вещества прореагировали без остатка. Вычислите массовую долю соли, образовавшейся при взаимодействии исходной твёрдой смеси с соляной кислотой.
-
54. Смесь меди и оксида меди (II), в которой массовая доля атомов меди составляет 96%, растворили в концентрированной серной кислоте массой 472 г, взятой в избытке. Полученный газ растворили в минимальном количестве раствора гидроксида натрия массой 200 г с массовой долей щёлочи 10%. Вычислите массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой.
-
55. К смеси пероксида и оксида бария, где отношение количества атомов бария к количеству атомов кислорода равно 5:9, добавили 490г холодного 20%-го раствора серной кислоты. В результате соединения бария прореагировали полностью, а полученный раствор оказался нейтральным. Найдите массовую долю воды в образовавшемся растворе.
-
56. Смесь цинка и карбоната цинка, в которой соотношение атомов цинка и кислорола 5:6, обработали 500 г раствора разбавленной серной кислоты. В результате исходная смесь и кислота прореагировали без остатка и выделилось 2,24 л газов (н.у.). К получившемуся раствору прилили 500 г раствора гидроксида натрия с массовой долей 40%. Найдите массовую долю сульфата натрия в получившемся растворе.
-
57. Смесь твёрдых сульфата железа (II) и сульфата железа (III), в которой соотношение атомов серы и железа 4:3, добавили в подкисленный 5% раствор перманганата калия массой 126,4 г. Все вещества, участвовавшие в окислительно-восстановительной реакции, прореагировали полностью. Расчитайте максимальную массу 20%-го раствора гидроксида натрия, который прореагирует с полученным раствором.
-
58. В холодный раствор серной кислоты добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.
-
59. Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в избытке соляной кислоты массой 300 г. После завершения всех реакций масса раствора составила 330 г, а выделившуюся газовую смесь пропустили через 200 г 8%-ного раствор гидроксида натрия. В результате чего один из газов полностью поглотился. Определите массовую долю соли в конечном растворе.
-
60. Смесь оксида кальция и карбоната кальция, в которой массовая доля кальция 62,5%, растворили в 300 г соляной кислоты, которая была в избытке. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
-
61. Смесь карбида кальция и карбида алюминия, в которой массовая доля углерода 30%, растворили в 547,5 г соляной кислоты, взятой в необходимом стехиометрическом количестве. В полученный раствор добавляли 1260 г 8%-ного раствора гидрокарбоната натрия до завершения реакции. Найдите массовую долю хлороводорода в растворе, в котором растворяли смесь карбидов.
-
62. Смесь железной окалины и оксида железа (III), в которой отношение числа атомов железа к числу атомов кислорода 7/10, полностью растворили в 500 г концентрированной азотной кислоты. Для поглощения полученного газа необходимо 20 г 20%-ного раствора гидроксида натрия. Найдите массовую долю соли железа в растворе, полученном после растворения смеси оксидов в кислоте.
-
63. Смесь оксида и пероксида натрия, в которой соотношение атомов натрия к атомам кислорода равна 3:2, нагрели с избытком углекислого газа. Образовавшееся вещество растворили в воде и получили раствор массой 600 г. К полученному раствору добавили 229,6 г раствора хлорида железа (III). При этом получился раствор массой 795 г, а массовая доля карбоната натрия в этом растворе составила 4%. Найдите массу оксида натрия в исходной смеси.
-
64. В смеси оксида магния и фосфида магния массовая доля атомов магния составляет 54,4%. Для полного растворения этой смеси потребовалось 365 г 34% соляной кислоты. К полученному раствору добавили 232 г 30% раствора фторида калия. Найдите массовую долю хлорида калия в конечном растворе.
-
65. Смесь оксида лития и нитрида лития с массовой долей атомов лития 56%, растворили в 365 г 20% соляной кислоты, причём все вещества полностью прореагировали. Затем к образовавшемуся раствору добавили 410г 20% раствора фосфата натрия. Найдите массовую долю хлорида натрия в конечном растворе.
-
66. В растворе хлоридов железа (II) и (III) на 3 иона железа приходится 8 хлорид-ионов. Через 200 г этого раствора пропустили хлор до прекращения реакции. К полученному раствору добавили раствор гидроксида натрия, в результате чего вещества прореагировали без остатка и получили 526,5 г 20% раствора соли. Рассчитайте массовую долю щёлочи в добавленном растворе.
Ответы:
- 5
- 100
- 3,136
- 8
- 0,672
- 0,05
- 4,35
- 2,24
- 34
- 28,35
- 3,612∙1024
- 1,625∙1024
- 0,8
- 8,4∙1022
- 112,32
- 10
- 30
- 0,75
- 22
- 2,4
- 2∙1024
- 27
- 35
- 1,415
- 2∙1025
- 47
- 0,72
- 711
- 64,3
- 0,04
- 40,8
- 37,44
- 84
- 50
- 27
- 3,612∙1023
- 12
- 422
- 250
- 54,71
- Ir
- 52
- 590
- 1671
- 210
- 46
- 60
- 62,78
- 745
- 213
- 1552
- 24,6
- 27,52
- 20
- 93,57
- 1,4
- 376
- 40,5
- 15,44
- 18,92
- 10
- 30,77
- 24,8
- 14,88
- 11,96
- 18,8
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ и ЦТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Больше заданий РТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЦТ вы можете найти здесь, нажав на эту строку
- Посмотреть все пробные варианты ЦТ вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Если вы сдаёте ЦТ по химии, то посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
7935. Смесь оксида алюминия и сульфида алюминия, в которой массовая доля алюминия составляет 50%, растворили в избытке 700 г соляной кислоты. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди (II), причём исходные вещества прореагировали без остатка. Вычислите массовую долю соли, образовавшейся при взаимодействии исходной твёрдой смеси с соляной кислотой.

1) Уравнения реакций
Al2O3 + 6HCl = 2AlCl3 + 3H2O (1)
Al2S3 + 6HCl = 2AlCl3 + 3H2S↑ (2)
H2S + CuSO4 = CuS↓ + H2SO4 (3)
2) Вычислим количество Al2O3
m(CuSO4) = 240 ⋅ 0,2 = 48 г
n(CuSO4) = 48 : 160 = 0,3 моль
n(CuSO4) = n(H2S) = 0,3 моль (по уравнению 3)
n(Al2S3) = 1/3 ⋅ n(H2S) = 1/3 ⋅ 0,3 = 0,1 моль (по уравнению 2)
m(Al2S3) = 0,1 ⋅ 150 = 15 г
n(Al)в Al2S3 = n(Al2S3) ⋅ 2 = 0,1 ⋅ 2 = 0,2 моль
m(Al)в Al2S3 = 0,2 ⋅ 27 = 5,4 г
Примем x = n(Al2O3)
n(Al)в Al2O3 = n(Al) ⋅ 2 = 2x моль
m(Al2O3) = x ⋅ 102 = 120x (г)
m(Al)в Al2O3 = 2x ⋅ 27 = 54x (г)
Решив уравнение получим x = 0,7 = n(Al2O3)
3) Рассчитаем массовую долю хлорида алюминия
n1(AlCl3) = 2n(Al2O3) = 2 ⋅ 0,7 = 1,4 моль (по уравнению 1)
n2(AlCl3) = 2n(Al2S3) = 2 ⋅ 0,1 = 0,2 моль (по уравнению 2)
n(AlCl3)общ = 1,4 + 0,2 = 1,6 моль
m(AlCl3)общ = 1,6 ⋅ 133,5 = 213,6 г
m(Al2O3) = 0,7 ⋅ 102 = 71,4 г
m(H2S) = 0,3 ⋅ 34 = 10,2 г
Ответ: ω(AlCl3) = 27,52%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7935.
7900. Смесь меди и оксида меди (II), в которой массовая доля атомов меди составляет 96%, растворили в концентрированной серной кислоте массой 472 г, взятой в избытке. Полученный газ растворили в минимальном количестве раствора гидроксида натрия массой 200 г с массовой долей щёлочи 10%. Вычислите массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой.

1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O (1)
CuO + H2SO4 = CuSO4 + H2O (2)
NaOH + SO2 = NaHSO3 (3)
2) Вычислим массу CuO
m(NaOH) = 200 ⋅ 0,1 = 20 г
n(NaOH) = 20 : 40 = 0,5 моль
n(NaOH) = n(SO2) = n(Cu) = 0,5 по уравнению 1 и 3
m(Cu) = 0,5 ⋅ 64 = 32 г
Примем x = n(CuO) = n(Cu)в CuO, тогда
m(Cu)в CuO = x ⋅ 64 = 64x (г)
m(CuO) = x ⋅ 80 = 80x (г)
В результате вычислений x = 0,1 моль = n(CuO)
m(CuO) = 0,1 ⋅ 80 = 8 г
3) Рассчитаем массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой
n(Cu) = n(SO2) = n1(CuSO4) = 0,5 моль (по уравнению 1)
n(CuO) = n2(CuSO4) = 0,1 моль (по уравнению 2)
n(CuSO4)общ = 0,5 + 0,1 = 0,6 моль
m(CuSO4) = 0,6 ⋅ 160 = 96 г
m(SO2) = 0,5 ⋅ 64 = 32 г
Ответ: ω(CuSO4) = 20%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7900.
7865. К смеси пероксида и оксида бария, где отношение количества атомов бария к количеству атомов кислорода равно 5:9, добавили 490 г холодного 20%-го раствора серной кислоты. В результате соединения бария прореагировали полностью, а полученный раствор оказался нейтральным. Найдите массовую долю воды в образовавшемся растворе.

1) Уравнения реакций
BaO2 + H2SO4 = BaSO4↓ + H2O2 (1)
BaO + H2SO4 = BaSO4↓ + H2O (2)
2) Вычислим количество вещества оксида бария и пероксида бария
m(H2SO4) = 490 ⋅ 0,2 = 98 г
n(H2SO4) = 98 : 98 = 1 моль
n(H2SO4) = n(исх. смеси) = 1 моль (по уравнению 1)
n(H2SO4) = n(BaO2) (по уравнению 1)
n(H2SO4) = n(BaSO4) (по уравнению 2)
m(H2O)исх = 490 — 98 = 392 г
Решив данную систему получаем y = 0,2 моль = n(BaO), x = 0,8 моль = n(BaO2)
3) Вычислим массовую долю воды в образовавшемся растворе
n(BaO) = n(H2O)образов. в ур-нии 2 = 0,2 моль (по уравнению 2)
n(H2O)образов. = 0,2 ⋅ 18 = 3,6 г
m(BaO2) = 0,8 ⋅ 169 = 135,2 г
m(BaO) = 0,2 ⋅ 153 = 30,6 г
n(BaO2) = n1(BaSO4) = 0,8 моль (по уравнению 1)
n(BaO) = n2(BaSO4) = 0,2 моль (по уравнению 2)
n(BaSO4)общ = 0,8 + 0,2 = 1 моль
m(BaSO4)общ = 1 ⋅ 233 = 233 г
Ответ: ω(H2O) = 93,57%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7865.
7830. Смесь цинка и карбоната цинка, в которой соотношение атомов цинка и кислорода 5:6, обработали 500 г раствора разбавленной серной кислоты. В результате исходная смесь и кислота прореагировали без остатка и выделилось 2,24 л газов (н.у.). К получившемуся раствору прилили 500 г раствора гидроксида натрия с массовой долей 40%. Найдите массовую долю сульфата натрия в получившемся растворе.

1) Уравнения реакций
Zn + H2SO4 = ZnSO4 + H2↑ (1)
ZnCO3 + H2SO4 = ZnSO4 + H2O + CO2↑ (2)
2) Найдем количество вещества цинка и карбоната цинка
n(CO2+H2) = 2,24 : 22,4 = 0,1 моль
Решив данную систему получим y = n(CO2) = 0,04 моль, x = n(Zn) = 0,06 моль
3) Вычислим количество вещества сульфата цинка и гидроксида натрия
n(Zn) = n1(ZnSO4) = 0,06 моль (по уравнению 1)
n(ZnCO3) = n2(ZnSO4) = 0,04 моль (по уравнению 2)
n(ZnSO4)общ = 0,06 + 0,04 = 0,1 моль
m(NaOH) = 500 ⋅ 0,2 = 200 г
n(NaOH) = 200 : 40 = 5 моль
Сравнивая количество вещества сульфата цинка и гидроксида натрия, можно сделать вывод о том, что гидроксид натрия в избытке — реакция 3 идет с образованием комплексной соли
Zn(SO4) + 4NaOH = Na2[Zn(OH)4] + Na2SO4
4) Вычислим массовую долю сульфата натрия в получившемся растворе
n(ZnSO4)общ = n(Na2SO4) = 0,1 моль (по уравнению 3)
m(Na2SO4) = 0,1 ⋅ 142 = 14,2 г
m(Zn) = 0,06 ⋅ 65 = 3,9 г
m(ZnCO3) = 0,04 ⋅ 125 = 5 г
m(H2) = 0,06 ⋅ 2 = 0,12 г
m(CO2) = 0,04 ⋅ 44 = 1,76 г
Ответ: ω(Na2SO4) = 1,4%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7830.
7795. Смесь твёрдых сульфата железа (II) и сульфата железа (III), в которой соотношение атомов серы и железа 4:3, добавили в подкисленный 5% раствор перманганата калия массой 126,4 г. Все вещества, участвовавшие в окислительно-восстановительной реакции, прореагировали полностью. Рассчитайте максимальную массу 20%-го раствора гидроксида натрия, который прореагирует с полученным раствором.

1) Уравнения реакций
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O (1)
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4 (2)
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4 (3)
2) Вычислим массу исходного сульфата железа (III)
m(KMnO4) = 126,4 ⋅ 0,05 = 6,32 г
n(KMnO4) = 6,32 : 158 = 0,04 моль
n(FeSO4)исх = 5n(KMnO4) = 5 ⋅ 0,04 = 0,2 (по уравнению 1)
По итогу вычислений получаем x = 0,2 моль = n(Fe2(SO4)3)исх
3) Найдем количество вещества MnSO4
n(Fe2(SO4)3)обр = 1/2 ⋅ n(FeSO4) = 1/2 ⋅ 0,2 = 0,1 моль (по уравнению 1)
n(Fe2(SO4)3)общ = 0,2 + 0,1 = 0,3 моль
n(NaOH) = 6n(Fe2(SO4)3)общ = 6 ⋅ 0,3 = 1,8 моль
n(MnSO4) = n(KMnO4) = 0,04 моль
4) Вычислим массу 20%-ного раствора NaOH
n(NaOH) = 2n(MnSO4) = 2 ⋅ 0,04 = 0,08 моль (по уравнению 3)
n(NaOH)общ = 1,8 моль + 0,08 моль = 1,88 моль
m(NaOH) = 1,88 ⋅ 40 = 75,2 г
m(NaOH)р-ра = 75,2 : 0,2 = 376 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7795.
7760. В холодный раствор серной кислоты добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.

1) Уравнения реакций
H2SO4 + BaO2 = BaSO4↓ + H2O2 (1)
2H2O2 = (кат. MnO2) 2H2O + O2↑ (2)
2) Вычислим количество воды в исходном растворе
Δm = m(O2) = 6,4 г
n(O2) = 6,4 : 32 = 0,2 моль
2n(O2) = n(H2O2) = n(H2SO4) = 0,4 моль (по уравнению 1 и 2)
m(H2SO4) = 0,4 ⋅ 98 = 39,2 г
Примем n(H2O) = x моль
В результате вычислений получаем x = 3,2 моль = n(H2O) в исходном растворе
m(H2O)исх = 3,2 ⋅ 18 = 57,6 г
3) Вычислим массовую долю серной кислоты в исходном растворе
Ответ: ω(H2SO4) = 40,5%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7760.
7725. Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в избытке соляной кислоты массой 300 г. После завершения всех реакций масса раствора составила 330 г, а выделившуюся газовую смесь пропустили через 200 г 8%-ного раствор гидроксида натрия. В результате чего один из газов полностью поглотился. Определите массовую долю соли в конечном растворе.

1) Уравнения реакций
Ca + 2HCl = CaCl2 + H2↑ (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
(?) 2NaOH + CO2 = Na2CO3 + H2O (3)
(?) CO2 + NaOH = NaHCO3 (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m(р-ра после реакций 1 и 2) = m(Ca) + m(CaCO3) + m(HCl)р-ра — m(H2) — m(CO2)
3) Примем n(Ca) = x моль, n(CaCO3) = y моль
m(Ca) = 40x (г)
m(CaCO3) = 100y (г)
n(Ca) = n(H2)по ур-нию 1 = x моль; m(H2) = 2x (г)
n(CaCO3) = n(CO2)по ур-нию 2 = y моль; m(CO2) = 44y (г)
Подставим все найденные значения в формулу массы раствора, записанную в пункте 2
330 = 40x + 100y + 300 — 2x — 44y
В результате решения системы получим: x = 0,2 моль = n(Ca), y = 0,4 моль = n(CaCO3)
4) Вычислим количество гидроксида натрия, массу и массовую долю гидрокарбоната натрия
n(CaCO3) = n(CO2) = 0,4 моль (по уравнению 2)
m(NaOH) = 200 ⋅ 0,08 = 16 г
n(NaOH) = 16 : 40 = 0,4 моль
n(CO2) : n(NaOH) = 0,4 моль : 0,4 моль = 1 : 1 (уравнение 4)
n(CO2) = n(NaOH) = n(NaHCO3) = 0,4 моль (по уравнению 4)
m(NaHCO3) = 0,4 ⋅ 84 = 33,6 г
m(CO2) = 0,4 ⋅ 44 = 17,6 г
Ответ: ω(NaHCO3) = 15,44%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7725.
7690. Смесь оксида кальция и карбоната кальция, в которой массовая доля кальция 62,5%, растворили в 300 г соляной кислоты, которая была в избытке. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.

1) Уравнения реакций
CaO + 2HCl = CaCl2 + H2O (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
CO2 + NaOH = NaHCO3 (3)
CO2 + 2NaOH = Na2CO3 + H2O (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m (р-ра после реакции 1, 2) = m(CaO) + m(CaCO3) + m(HCl)р-ра — m(CO2)
3) Примем n(CaO) = x моль, n(CaCO3) = y моль
m(CaO) = 56x (г)
m(CaCO3) = 100y (г)
n(CaCO3) = n(CO2) = y моль (по уравнению 2)
m(CO2) = 44y (г)
Составим систему уравнений:
361,6 = 56x + 100y + 300 — 44y
x + y = 1,1
Решая систему получаем y = 0,2 = n(CaCO3) = n(CO2)
n(CO2) = n(CaCO3) = 0,2 моль
m(NaOH) = 80 ⋅ 0,1 = 8 г
n(NaOH) = 8 : 40 = 0,2 моль
n(NaOH) = n(CO2) (по уравнению 3)
n(CO2) = n(NaOH) = n(NaHCO3) = 0,2 моль
4) Вычислим массовую долю гидрокарбоната натрия в растворе
m(CO2) = 0,2 ⋅ 44 г/моль = 8,8 г
Ответ: ω(NaHCO3) = 18,92%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7690.
7655. Смесь карбида кальция и карбида алюминия, в которой массовая доля углерода 30%, растворили в 547,5 г соляной кислоты, взятой в необходимом стехиометрическом количестве. В полученный раствор добавляли 1260 г 8%-ного раствора гидрокарбоната натрия до завершения реакции. Найдите массовую долю хлороводорода в растворе, в котором растворяли смесь карбидов.

1) Уравнения реакций
CaC2 + 2HCl = CaCl2 + C2H2↑ (1)
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑ (2)
AlCl3 + 3NaHCO3 = Al(OH)3↓ + 3CO2↑ + 3NaCl (3)
CaCl2 + 2NaHCO3 = CaCO3 + CO2 + H2O + 2NaCl (4 — данная реакция не идет, так как ее обязательным условием является нагревание, о котором в тексте задачи не упоминается)
2) Вычислим массу карбида алюминия
m(NaHCO3) = 1260 ⋅ 0,08 = 100,8 г
n(NaHCO3) = 100,8 : 84 = 1,2 моль
n(AlCl3) = 1/3 ⋅ n(NaHCO3) = 1/3 ⋅ 1,2 = 0,4 моль (по уравнению 3)
n(Al4C3) = 1/4 ⋅ n(AlCl3) = 1/4 ⋅ 0,4 = 0,1 моль (по уравнению 2)
m(Al4C3) = 0,1 моль ⋅ 144 г/моль = 14,4 г
3) Вычислим количество вещества карбида кальция
Примем n(CaC2) = x моль
В результате вычислений получим x = 0,15 моль = n(CaC2)
4) Вычислим массовую долю HCl в растворе
n1(HCl) = 2 ⋅ n(CaC2) = 2 ⋅ 0,15 = 0,3 моль (по уравнению 1)
n2(HCl) = 12 ⋅ n(Al4C3) = 12 ⋅ 0,1 = 1,2 моль (по уравнению 2)
n(HCl)общ. = 0,3 + 1,2 = 1,5 моль (уравнение 1 + уравнение 2)
m(HCl) = 1,5 ⋅ 36,5 = 54,75 г
ω(HCl) = 54,75 : 547,5 = 0,1 * 100% = 10%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7655.
7620. Смесь железной окалины и оксида железа (III), в которой отношение числа атомов железа к числу атомов кислорода 7/10, полностью растворили в 500 г концентрированной азотной кислоты. Для поглощения полученного газа необходимо 20 г 20%-ного раствора гидроксида натрия. Найдите массовую долю соли железа в растворе, полученном после растворения смеси оксидов в кислоте.

1) Уравнения реакций
Fe3O4 + 10HNO3(к) = 3Fe(NO3)3 + NO2 + 5H2O (1)
Fe2O3 + 6HNO3(к) = 2Fe(NO3)3 + 3H2O (2)
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O (3)
2) Вычислим количество Fe3O4
m(NaOH) = 20 ⋅ 0,2 = 4 г
n(NaOH) = 4 : 40 = 0,1 моль
n(NaOH) = n(NO2) = 0,1 моль (по уравнению 3)
n(Fe3O4) = n(NO2) = 0,1 моль (по уравнению 1)
3) Пусть n(Fe2O3) = x моль
В результате решения системы получаем x = 0,2 моль = n(Fe2O3)
4) Запишем формулу массовой доли нитрата железа (III) в конечном растворе и проведем необходимые вычисления
n1(Fe(NO3)3) = 3 ⋅ n(Fe3O4) = 3 ⋅ 0,1 = 0,3 моль (по уравнению 1)
n2(Fe(NO3)3) = 2 ⋅ n(Fe2O3) = 2 ⋅ 0,2 = 0,4 моль (по уравнению 2)
n(Fe(NO3)3)общ. = 0,3 + 0,4 = 0,7 моль (уравнение 1 + уравнение 2)
m(Fe(NO3)3)общ. = 0,7 ⋅ 242 = 169,4 г
m(Fe3O4) = 0,1 ⋅ 232 = 23,2 г
m(Fe2O3) = 0,2 ⋅ 160 = 32 г
m(NO2) = 0,1 ⋅ 46 = 4,6 г
Подставим все вычисленные значения в формулу, записанную в пункте 4
Ответ: ω(Fe(NO3)3) = 30,77%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7620.
Для вас приятно генерировать тесты, создавайте их почаще
Записаться на бесплатную онлайн-игру «7 шагов к 34 задаче»:
https://ndlr.cc/huGgl6dWO
____________________________
Соц.сети:
📌Подписывайся на мой Instagram: https://www.instagram.com/sergey_himoda/?hl=ru
📌Подписывайся на Группу ВК: https://ndlr.cc/huGgl59oc
____________________________
Подпишись на канал, чтобы каждую неделю получать самые полезные вебинары по химии!
👇Давай знакомиться)
Меня зовут Сергей Химода
Я основатель и преподаватель онлайн-школы химии Himodus! Со мной ты всегда будешь заряжен на победу и высокие баллы
— В 2019 году сдал химию на 100 баллов
— Готовлю к ЕГЭ по химии уже 2-ой год
— Выпустил 60 учеников в 2020
— Моими материалами доверилось более 1000 учеников в 2020
— Написал 2 книги по подготовке к ЕГЭ
— Делаю простые и доступные таблицы и шпаргалки по химии в группе
📌 Со мной ты точно полюбишь химию и начнешь Действовать!
💥 Отзывы моих учеников: https://ndlr.cc/huGgl57By
Я точно знаю, ты все сможешь! Подпишись на канал!
00:00 — ожидание
2:27 — Сережа появился!
3:40 — Что даст это видео?
5:20 — Кто такой Химода?
9:55 — Как появились задачи на атом
13:07 — Типы задач на атомы
15:00 — Начинаем решать задачу
58:15 — Игра «7 шагов к 34 задаче»
#34задача #атомистика #разборзадания
Видео 34 задача на атомистику | ХИМИЯ ЕГЭ 2021 | Разбор заданий канала Сергей Карпов | SunSkill ЕГЭ: онлайн-школа химии
Показать
За это задание ты можешь получить 3 балла. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 28.1%
Ответом к заданию 34 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Задача 1
При полном сгорании углеводорода образовалось 8,96 л (н. у.) диоксида углерода и 5,4 г воды. Молярная масса углеводорода в 27 раз больше молярной массы водорода. При исследовании химических свойств этого вещества установлено, что оно обесцвечивает бромную воду, присоединяя атомы брома по четырем разным атомам углерода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с недостатком бромной воды (используйте структурные формулы органических веществ).
Решение
1) Находим количественный состав вещества.
Формула вещества — $C_xH_y$.
а) n(C) = n($CO_2$) = 8.96 / 22.4 = 0.4 моль
б) n(H) = 2n($H_2O$) = 2 · 5.4 / 18 = 0.6 моль
2) Определяем молекулярную формулу вещества:
а) $M_{ист.}(C_xH_y) = D(по H_2) · M(H_2)$ = 27 · 2 = 54 г/моль
б) x : y = n(C) : n(H) = 0.4 : 0.6 = 2 : 3 = 4 : 6
Вычисленная формула — $C_4H_6$.
$M_{выч.}(C_4H_6)$ = 54 г/моль
в) $M_{ист.}(C_xH_y)$ / $M_{выч.}(C_4H_6)$ = 54 / 54 = 1
Молекулярная формула исходного вещества — $C_4H_6$.
3) Структурная формула вещества — $CH_2=CH–CH=CH_2$ — бутадиен-1,3.
4) Записываем уравнение реакции вещества с бромом:
$CH_2=CH–CH=CH_2 + Br_2 → CH_2Br–CH=CH–CH_2Br$
Ответ:
Показать решение
Полный курс
Задача 2
При сгорании монобромпроизводного органического вещества массой 6,15 г образовался углекислый газ, 2,7 мл воды и бромоводород объёмом 1,12 л (н. у.). Известно, что данное вещество было получено при взаимодействии органического вещества с бромом при освещении.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу монобромпроизводного органического вещества;
- составьте структурную формулу этого органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции этого вещества с водным раствором гидроксида натрия (используйте структурные формулы органических веществ).
Решение
Допустим, что в веществе не содержится кислород, т. е. формула — $C_xH_yBr$.
1) Находим количественный состав образца:
а) n(Br) = n(H) = n(HBr) = 1.12 / 22.4 = 0.05 моль
m(Br) = 0.05 · 80 = 4 г
б) m($H_2O$) = 2.7 · 1 = 2.7 г; n(H) = 2n($H_2O$) = 2 · 2.7 / 18 = 0.3 моль
$n(H)_{общее}$ = 0.05 + 0.3 = 0.35 моль
m(H) = 1 · 0.35 = 0.35 г
в) m(C) = 6.15 – (4 + 0.35) = 1.8 г; n(C) = 1.8 / 12 = 0.15 моль
2) Находим молекулярную формулу вещества:
а) $M(C_xH_yBr)$ = 6.15 / 0.05 = 123 г/моль
б) x : y : z = n(C) : n(H) : n(Br) = 0.15 : 0.35 : 0.05 = 3 : 7 : 1
Вычисленная формула — $C_3H_7Br$.
$M(C_3H_7Br)$ = 36 + 7 + 80 = 123 г/моль
$M(C_xH_yBr)$ / $M(C_3H_7Br)$ = 123 / 123 = 1
Формула галогенпроизводного — $C_3H_7Br$
3) Структурная формула — $CH_3–CH(Br)–CH_3$
4) Уравнение реакции вещества с водным раствором гидроксида натрия:
$CH_3–CHBr–CH_3 + NaOH → NaBr + CH_3–CH(OH)–CH_3$
Ответ:
Показать решение
Полный курс
Задача 3
В результате сплавления органического вещества с гидроксидом калия был получен углеводород, 1,17 г паров которого занимают объём 336 мл (н. у.). Известно, что исходное вещество относится к классу солей. В этом соединении число атомов кислорода равно числу атомов водорода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом калия при сплавлении (используйте структурные формулы органических веществ).
Решение
1) Находим молярную массу углеводорода.
Пусть формула полученного углеводорода $C_xH_y$.
$n = V_г$ / $V_M$; $n(C_xH_y)$ = 0.336 / 22.4 = 0.015 моль
$M(C_xH_y) = m_{в-ва}$ / n = 1.17 / 0.015 = 78 г/моль
2) Находим молекулярную формулу углеводорода:
12x + y = 78
если x = 6, y = 6
Формула углеводорода — $C_6H_6$, молекулярная формула исходного вещества $C_8H_4O_4K_2$.
3) Составляем структурную формулу соли:
4) Уравнение реакции:
$KOOC–C_6H_4–COOK + 2KOH → 2K_2CO_3 + C_6H_6$
Ответ:
Показать решение
Полный курс
Задача 4
Вещество, которое содержит 61,54 % кислорода, 34,62 % углерода и 3,84 % водорода по массе, было получено при взаимодействии углеводорода состава $С_5H_8$ с раствором перманганата калия в присутствии серной кислоты.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного углеводорода с подкисленным раствором перманганата калия (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав вещества.
Пусть $m_{в-ва}$ = 100 г, тогда:
а) m(C) = 34.62 г, n(C) = 34.62 / 12 ≈ 2.89 моль
б) m(H) = 3.84 г, n(H) = 3.84 / 1 = 3.84 моль
в) m(O) = 61.54 г, n(O) = 61.54 / 16 ≈ 3.85 моль
2) Находим молекулярную формулу вещества:
x : y : z = n(C) : n(H) : n(O) = 2.89 : 3.84 : 3.85 ≈ 1 : 1.33 : 1. 33 ≈ 3 : 4 : 4.
Молекулярная формула — $C_3H_4O_4$.
3) Структурная формула —
4) Уравнение реакции окисления углеводорода:
$CH_2=CH–CH_2–CH=CH_2 + 4KMnO_4 + 6H_2SO_4 → 2K_2SO_4 + 4MnSO_4 + 8H_2O + 2CO_2 +$
Ответ:
Показать решение
Полный курс
Задача 5
При сгорании 1,8 г органического вещества, не содержащего кислорода, получили углекислый газ, 2,52 г воды и 448 мл (н. у.) азота. Известно, что вещество не может быть получено восстановлением соответствующего нитросоединения, но вступает в реакцию c хлорэтаном.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с хлорэтаном (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yN_z$.
1) Количественный состав образца:
М(C) = 12 г/моль, М(H) = 1 г/моль, М(N) = 14 г/моль, M($H_2O$) = 18 г/моль
n(H) = 2n($H_2O$) = 2 · 2.52 / 18 = 0.28 моль; m(H) = 0.28 · 1 = 0.28 г
n(N) = 2n($N_2$) = 2 · 0.448 / 22.4 = 0.04 моль; m(N) = 0.04 · 14 = 0.56 г
m(C) = 1.8 – 0.28 – 0.56 = 0.96 г; n(C) = 0.96 / 12 = 0.08 моль
2) Вычисленная формула:
x : y : z = n(C) : n(H) : n(N) = 0.08 : 0.28 : 0.04 = 2 : 7 : 1
Вычисленная формула — $C_2H_7N$.
3) Структурная формула — $CH_3–NH–CH_3$
4) Уравнение реакции: $CH_3–NH–CH_3 + C_2H_5Cl → [(CH_3)_2NH(C_2H_5)]^{+}Cl^{–}$
Ответ:
Показать решение
Полный курс
Задача 6
Некоторое вещество было получено при окислении циклического углеводорода, не содержащего заместителей в цикле, перманганатом калия в присутствии серной кислоты. Это вещество содержит 40,68 % углерода, 54,24 % кислорода и 5,08 % водорода по массе.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного органического вещества с перманганатом калия в присутствии серной кислоты (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца.
Пусть $m_{в-ва}$ = 100 г, тогда
m(C) = 40.68 г; n(C) = 40.68 / 12 = 3.39 моль
m(H) = 5.08 г; n(H) = 5.08 / 1 = 5.08 моль
m(O) = 54.24 г; n(O) = 54.24 / 16 = 3.39 моль
2) Находим молекулярную формулу:
x : y : z = n(C) : n(H) : n(O) =
= 3.39 : 5.08 : 3.39 =
= 1 : 1.5 : 1 = (умножаем на 2)
= 2 : 3 : 2 = (умножаем на 2)
= 4 : 6 : 4
Вычисленная формула — $C_4H_6O_4$.
3) Структурная формула вещества —
4) Уравнение реакции окисления циклического углеводорода:
5 
Ответ:
Показать решение
Полный курс
Задача 7
При сгорании 11,6 г органического вещества выделилось 13,44 л (н. у.) углекислого газа и 10,8 мл воды. Плотность паров этого вещества равна 2,59 г/л. Вещество реагирует с гидроксидом меди(II).
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с свежеосажденным гидроксидом меди(II) (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца:
а) n(C) = n($CO_2$) = 13.44 / 22.4 = 0.6 моль
m(C) = 0.6 · 12 = 7.2 г
б) m($H_2O$) = 1 · 10.8 = 10.8 г; n(H) = 2n($H_2O$) = 2 · 10.8 / 18 = 1.2 моль
m(H) = 1 · 1.2 = 1.2 г
в) m(O) = 11.6 – 7.2 – 1.2 = 3.2 г; n(O) = 3.2 / 16 = 0.2 моль
2) Находим молекулярную формулу вещества:
а) x : y : z = n(C) : n(H) : n(O) = 0.6 : 1.2 : 0.2 = 3 : 6 : 1
Вычисленная формула — $C_3H_6O$.
M($C_3H_6O$) = 12 · 3 + 6 + 16 = 58 г/моль
б) M($C_xH_yO_z$) = 2.59 · 22.4 / 1 = 58,016 ≈ 58 г/моль
в) M($C_xH_yO_z$) / M($C_3H_6O$) = 58 : 58 = 1
Молекулярная формула — $C_3H_6O$.
3) Структурная формула вещества — $CH_3–CH_2–CHO$
4) Составляем уравнение реакции окисления пропаналя:
$CH_3–CH_2CHO + 2Cu(OH)_2 → CH_3–CH_2–COOH + Cu_2O + 2H_2O$
Ответ:
Показать решение
Полный курс
Задача 8
Массовая доля водорода 2,06, углерода 24,74 %, кислорода 32,99 %, калия 40,21 %. Вещество реагирует с гидроксидом калия с образованием углеводорода.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом калия (используйте структурные формулы органических веществ).
Решение
1) Находим молекулярную формулу вещества.
Пусть формула вещества — $C_xH_yO_zK_t$ и $m_{образца}$ = 100 г, тогда
а) m(C) = 24.74 г, n(C) = 24.74 / 12 ≈ 2.06 моль
m(H) = 2.06 г, n(H) = 2.06 / 1 = 2.06 моль
m(O) = 32.99 г, n(O) = 32.99 / 16 ≈ 2.06 моль
m(K) = 40.21 г, n(K) = 40.21 / 39 ≈ 1.03 моль
б) x : y : z : t = n(C) : n(H) : n(O) : n(K) = 2.06 : 2.06 : 2.06 : 1.03 =
= (2.06 / 1.03) : (2.06 / 1.03) : (2.06 / 1.03) : (1.03 / 1.03) ≈ 2 : 2 : 2 : 1 =
= 4 : 4 : 4 : 2
Молекулярная формула — $C_4H_4O_4K_2$.
2) Структурная формула — $KO–CO–CH_2–CH_2–CO–OK$ или $(KOOC–CH_2CH_2–COOK)$
3) Уравнение реакции:
$KO–CO–CH_2–CH_2–CO–OK + 2KOH → 2K_2CO_3 + CH_3–CH_3$
Ответ:
Показать решение
Полный курс
Задача 9
Органическое вещество содержит 45,45 % углерода, 6,06 % водорода и 48,48 % кислорода. Известно, что при нагревании с раствором гидроксида натрия образуется несколько новых веществ, причём одно из них имеет разветвлённое строение. На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия (используйте структурные формулы органических веществ).
Решение
Вариант ответа:
Пусть формула вещества $C_xH_yO_z$ и $m_{образца}$ = 100 г, тогда:
а) m(C) = 45,45 г, n(C) = 45,45/12 ≈ 3,79 моль
m(H) = 6,06 г, n(H) = 6,06/1 = 6,06 моль
m(O) = 48,48 г, n(O) = 48,48/16 ≈ 3,03 моль
б) x : y : z = n(C) : n(H) : n(O) = 3,79 : 6,06 : 3,03 = (3,79/3,03) : (6,06/3,03) : (3,03/3,03) ≈ 1,25 : 2 : 1 = 5 : 8 : 4
Молекулярная формула вещества: $C_5H_8O_4$.
Структурная формула: $HO–CO–CO–OCH(CH_3)_2$
$(HOOC–COO–CH(CH_3)_2)$
Уравнение щелочного гидролиза сложного эфира:
$HO–CO–CO–OCH(CH_3)_2 + 2NaOH_{(водн.)} → CH_3–CH(OH)–CH_3 + NaO–CO–CO–ONa + H_2O$
Ответ:
Показать решение
Полный курс
Типы задач, встречающиеся в 34 задании:
- Вычисление массовой доли реагентов в исходном растворе или смеси веществ
- Вычисление массовой доли продуктов в полученном после цепочки реакций растворе (реакции могут быть разные: как обменные, так и окислительно-восстановительные)
- Задача, в которой требуется составить материальный баланс (чаще всего там встречаются реакции на электролиз и вытеснение металлов из растворов солей (так называемые задачи «на пластинку»))
- Задача на растворимость (появилась в КИМах ЕГЭ в 2019 году)
По факту, для решения этих задач достаточно уметь пользоваться лишь четырьмя формулами: нахождение количества вещества, плотности, массовой доли и выхода реакции.
Основные формулы для решения задания 13
Самое сложное — это понять логику задачи, построить верный ход решения и только потом применить нужные формулы.
За полностью верное решение задачи можно получить 4 первичных балла. Правильный и полный ответ должен содержать следующие элементы, каждый из которых оценивается в 1 первичный балл:
- правильно записаны уравнения реакций, соответствующих условию задания;
- правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания;
- продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которых проводятся расчёты;
- в соответствии с условием задания определена искомая физическая величина.
Поэтому на экзамене, даже если не удается решить задачу полностью, стоит попытаться хотя бы составить уравнения реакций и найти количества вещества реагентов. Уже это может принести несколько баллов в общую копилку.
Отношения молей реагирующих веществ и продуктов следует включать в ход решения задачи, даже если они кажутся очевидными и понятными просто по уравнению реакции. За это эксперт может также добавить дополнительный балл, даже если задача не решена полностью.
В качестве примеров рассмотрим задачи из пробных вариантов ЕГЭ:
Имеется смесь нитрата алюминия и кристаллогидрата нитрата хрома (III) Cr(NO3)3•9H2O. Образец этой смеси массой 22,35 г растворили в воде и добавили гидроксид натрия и избыток бромной воды. К полученному раствору прилили избыток раствора гидроксида бария. Образовался осадок массой 5,06 г. Определите массовые доли солей в исходной смеси.
В этом типе задач на смеси на одной из стадий, как правило, в реакцию вступает только один из реагентов, благодаря чему по разнице можно вычислить количество вещества другого реагента, не вступившего в реакцию.
Так и здесь: с гидроксидом натрия прореагируют обе исходные соли
Al(NO3)3 + 4NaOH = 3NaNO3 + Na[Al(OH)4] (1)
Cr(NO3)3 + 6NaOH = 3NaNO3 + Na3[Cr(OH)6] (2)
Добавляемый в реакционную смесь бром вступит в реакцию только с одним из образовавшихся веществ — комплексом хрома
4NaOH + 2Na3[Cr(OH)6] + 3Br2 = 6NaBr + 2Na2CrO4 + 8H2O (3)
Из присутствующих в растворе веществ только хромат натрия прореагирует с гидроксидом бария:
Na2CrO4 + Ba(OH)2 = BaCrO4 + 2NaOH (4)
Зная массу образовавшегося хромата бария (осадка), можно вычислить его количество вещества. Затем по уравнению реакции (4) можно определить количество вещества полученного хромата натрия, а значит по уравнениям (2 и 3) и нитрата хрома. Находим массу кристаллогидрата нитрата хрома и по разнице с массой смеси легко вычисляется масса нитрата алюминия, благодаря чему можно получить ответ на поставленный в задаче вопрос.
Второй тип задач: на вычисление массовой доли соли в полученном после цепочки реакций растворе.
При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н.у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Это самый легкий тип задач. По количеству образовавшего в реакции (1) углекислого газа можно вычислить количество образовавшегося оксида кальция:
CaCO3 = CaO + CO2 (1)
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O (2)
CaO + 2HCl = CaCl2 + H2O (3)
Вычислив массу оксида кальция в реакции (1), по разности с массой твердого остатка вычисляем массу и количество вещества не прореагировавшего карбоната, который вступает в реакцию (2). Зная количество вещества карбоната и оксида кальция в твердом остатке, несложно получить массу полученной в реакциях (2) и (3) соли. Вычислив массу полученного раствора, учитывая массу улетевшего углекислого газа, достаточно просто определить массовую долю соли в конечном растворе, что и требуется по условию задачи.
Чтобы научиться решать 34 задание необходимо иметь не только глубокие и уверенные знания в области неорганической химии, но и много практиковаться, так как только практика и упорная работа могут научить выстраивать логику решения задачи и получать верный ответ.
4 мая 2021
В закладки
Обсудить
Жалоба
В данной брошюре собраны задания 34 из второй части экзаменационной работы по химии.
По итогам ЕГЭ по химии 2020 года возникло много вопросов при решении 34 задания. Это задания повышенной сложности. Правильно выполненное 34 задание дает выпускнику 4 балла. Выполнить такое задание выпускник должен за 10-15 минут. Выпускник выполняет следующие расчеты при решении 34 задачи: «Расчеты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного. Расчеты массовой доли (массы) химического соединения в смеси» (из спецификации КИМа 2020 года). При этом выпускник должен учитывать, что продукты реакции могут покидать сферу реакции в виде осадка или газа, чтобы правильно рассчитать массу конечного раствора. Задачи, решенные в данной брошюре, помогут выпускникам понять логические приемы при решении задач и быстрее выполнить подобное задание на ЕГЭ. Данный материал помогает выпускникам освоить некоторые типы задач повышенного уровня сложности.
34himiya.docx
34himiya.pdf
Автор: Наталья Алексеевна Черноиванова.
Консультация по английскому языку
Английский | Сегодня, 10:14
Разработчики экзаменационных материалов, учителя и выпускники, расскажут, как подготовиться к экзамену, об особенностях заданий в ЕГЭ и ответят на вопросы старшеклассников.
Этапы закрепощения крестьян в России
Крепостное право на Руси появилось позже, чем во многих средневековых европейских королевствах. Это было связано с объективными причинами – низкая плотность населения, зависимость от ордынского ига.
Задания 12-18 досрочного ЕГЭ по математике
3 примера по каждому заданию. Досрочный ЕГЭ по математике прошёл 28 марта.
Заброшенные оборонительные сооружения — времен ВОВ
Такой сохранившийся объект — это настоящий свидетель далеких военных событий. Сегодня можно было бы этот бункер использовать для военно-патриотичес…
Читать >>>
2021-04-14 18:25:24
149
15

Фото подборка. Интересное фото ушедших лет
Настоящие Винни-Пух и Кристофер Робин. 1927 Последние заключенные Алькатраса, 1963 год Расплавленные и… Читать >>>
2019-05-13 23:10:08
246
27

Немецкая лопата для рытья окопов
Немецкая лопата для рытья окоповНемецкая лопата, используемая солдатами пехотных отделений, для рытья… Читать >>>
2019-12-16 22:50:59
228
7

Сокровища, найденные в автомобилях. ТОП-10
Сокровища, найденные в автомобилях. ТОП-10 При покупке автомобиля, особенно подержанного, вас может ожидать… Читать >>>
2019-12-17 09:21:07
166
25
Уважаемый посетитель!
Если у вас есть вопрос, предложение или жалоба, пожалуйста, заполните короткую форму и изложите суть обращения в текстовом поле ниже. Мы обязательно с ним ознакомимся и в 30-дневный срок ответим на указанный вами адрес электронной почты
Статус Абитуриент Студент Родитель Соискатель Сотрудник Другое Филиал Абакан Актобе Алагир Алматы Алушта Анапа Ангарск Армавир Архангельск Асбест Астрахань Атырау Баку Балхаш Барановичи Барнаул Белая Калитва Белгород Бельцы Берлин Бишкек Благовещенск Бобров Бобруйск Борисов Боровичи Бронницы Брянск Бузулук Видное Владивосток Владикавказ Владимир Волгоград Волгодонск Волжск Воркута Воронеж Вёшенская Гомель Гродно Грозный Дамаск Дербент Димитровград Дмитров Долгопрудный Домодедово Дубай Дубна Душанбе Евпатория Екатеринбург Елец Ереван Жлобин Жуковский Звенигород Златоуст Зубова Поляна Иваново Ижевск Иркутск Истра Казань Калининград Карабулак Караганда Каракол Кашира Кемерово Киев Кизляр Кинешма Киров Королев Кострома Красноармейск Красногорск Краснодар Краснознаменск Красноярск Курган Курск Кызыл Липецк Лобня Магадан Майкоп Махачкала Минеральные Воды Минск Могилев Моздок Мозырь Москва Мурманск Набережные Челны Нальчик Наро-Фоминск Нижневартовск Нижний Новгород Нижний Тагил Новодвинск Новокузнецк Новосибирск Новоуральск Новый Уренгой Ногинск Норильск Ноябрьск Нур-Султан Обнинск Одинцово Озёры Омск Орел Оренбург Орехово-Зуево Ош Павлодар Пенза Пермь Петропавловск Подольск Полоцк Псков Пушкино Пятигорск Радужный Ржев Ростов-на-Дону Рыбинск Рязань Сальск Самара Самарканд Санкт-Петербург Саратов Светлогорск Севастополь Северодвинск Сергиев Посад Серпухов Слоним Смоленск Солигорск Солнечногорск Ставрополь Сургут Сызрань Сыктывкар Тамбов Ташкент Тбилиси Тверь Терек Тихорецк Тобольск Тольятти Томск Троицк Тула Тюмень Улан-Удэ Ульяновск Ургенч Усть-Каменогорск Уфа Ухта Хабаровск Ханты-Мансийск Хива Челябинск Череповец Черкесск Чехов Шымкент Щербинка Электросталь Элиста Якутск Ярославль Тип обращения Вопрос Предложение Благодарность Жалоба Тема обращения Поступление Трудоустройство Обучение Оплата Кадровый резерв Внеучебная деятельность Работа автоматических сервисов университета Другое
* Все поля обязательны для заполнения
Согласен на обработку персональных данных, получение рассылок, а также с политикой конфиденциальности.
Слайд 1
Подготовка к успешной сдаче ЕГЭ по химии. «Задание 34»
Слайд 2
Задачи на атомистику — это задачи на соотношения частиц (атомов, молекул, ионов и т.д.) в гомогенных и гетерогенных системах (растворах, твердых и газообразных смесях). Это могут быть массовые соотношения (например, массовая доля элемента в смеси), мольные соотношения (например, соотношение числа атомов водорода и кислорода или мольная доля), объемные соотношения (объемная доля и др.).
Слайд 3
Для решения задач на атомистику используются знакомые всем , изучающим химию , понятия.. Во-первых, понятие массовой доли. Во-вторых, умение выражать число атомов через число молекул или других структурных единиц. Например, в молекуле оксида серы SO 3 на 1 молекулу приходится один атом серы и три атома кислорода: 1 молекула SO 3 — 1 атом серы, 3 атома кислорода Несложно пропорцией определить, что на две молекулы оксида серы будет приходиться два атома серы и шесть атомов кислорода: 2 молекулы SO 3 — 2 атома S, 6 атомов О То есть индексы в формуле вещества показывают не только, как соотносится количество атомов между собой, но и какое число атомов приходится на 1 молекулу или другую структурную единицу вещества. Если так соотносится число атомов и молекул, то также будет соотноситься и количество вещества атомов и молекул, выраженное в молях. Потому что 1 моль — это не что иное, как порция, состоящая из одинакового числа данных частиц. То есть на х моль оксида серы приходится: х моль SO 3 — х моль атомов S, 3х моль атомов О Получается, в молекуле число атомов всегда больше или равно количества молекул.
Слайд 4
Задание 34. Железную пластину полностью растворили в 500г раствора азотной кислоты. При этом выделилась смесь оксида азота(II) и оксида азота (IV) общим объемом 20,16л. Соотношение атомов кислорода к атомам азота в этой газовой смеси соответственно равно 5:3. Вычислите массовую долю соли в полученном растворе. Ответ 24,6%
Слайд 5
Решение. Записываем уравнения химических реакций взаимодействия железа с азотной кислотой. Fe+4HNO 3 →Fe(NO 3) ) 3 +NO+2H 2 O Fe+6HNO 3 →Fe(NO 3) ) 3 +3NO 2 +3H 2 O Нужно найти массовую долю Fe ( NO 3) ) 3 в растворе, который складывается их смешанных веществ с учетом газообразных, которые выделились из раствора. Пусть : ⱱ NO = x моль, тогда : ⱱ N = x моль и : ⱱ O = x моль. ⱱ NO 2 = y моль, тогда : ⱱ N = y моль и : ⱱ O =2 y моль Тогда весь кислород в смеси газов это: x +2 y , а весь азот это : x + y . Составляем первое уравнение , зная что соотношение атомов
Слайд 6
кислорода к атомам азота в этой газовой смеси соответственно равно 5:3. x +2 y / x + y = 5/3 Для второго уравнения находим ⱱ смеси газов :20,16 / 22,4 =0,9 моль . x + y =0,9 Составляем систему уравнений : x +2 y / x + y = 5/3 x + y =0,9 Решаем систему уравнений и находим: 2 x = y x = 0,3 подставляем в первое уравнение и находим y =0,6 моль.
Слайд 7
Возвращаемся к уравнениям реакций , ведем расчет NO , так как X = 0,3 моль, это количество вещества NO . Значит и соли 0,3 моль. Это в первом уравнении. Во втором уравнении ⱱ NO 2 =0,6 моль, значит Fe ( NO 3) ) 3 0,6/3=0,2 моль.
Слайд 8
Находим массу соли Fe ( NO 3) ) 3 . m =( 0,3 +0,2)∙ M Fe ( NO 3) ) 3 =0,5∙242 = 121 г Находим массу раствора. Он будет состоять из железа, раствора азотной кислоты и из раствора выделяются газообразные NO и NO 2 . Количество вещества железа находим через количество вещества NO и NO 2 . В первом уравнении железа будет 0,3 моль, во втором 0, 2 моль . Всего 0,5 моль. Находим массу железа . m Fe = 0,5 моль ∙ 56 г/моль = 28 г. m NO = 0,3 моль ∙ M NO = 0,3 ∙30 = 9 г. m NO 2 = 0,6 моль ∙ M NO 2 = 0,6 ∙46 = 27,6 г. Итак масса раствора равна: m р- ра = 28 +500 -9 -27,6 = 491,4 г. Находим массовую долю соли в растворе: w Fe ( NO 3) ) 3 = 121/491,4∙ 100% = 24,6% Ответ: 24,6 %
Слайд 9
Задание 34. Смесь оксида алюминия и сульфида алюминия, в которой массовая доля алюминия составляет 50%, растворили в избытке 700г соляной кислоты. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди (II), причём исходные вещества прореагировали без остатка. Вычислите массовую долю соли, образовавшейся при взаимодействии исходной твёрдой смеси с соляной кислотой.
Слайд 10
Решение Записываем уравнения химических реакций. 0,7 1,4 1.Al 2 O 3 +6HCl = 2AlCl 3 +3H 2 O 0,1 0,2 0,3 2. Al 2 S 3 +6HCl = 2AlCl 3 +3H 2 S↑ 0,3 0,3 3 . H 2 S + CuSO 4 = CuS ↓ + H 2 SO 4 Находим массу сульфата меди, m CuSO 4 = 240∙0,2 =48 г. ⱱ CuSO 4 = 48/160= 0,3 моль. По третьему уравнению находим ⱱ H 2 S = 0,3моль. Значит во втором уравнении количество вещества Al 2 S 3 0,1 моль. Можем найти массу m Al 2 S 3 = 0,1 ∙150 = 15 г. Количества вещества алюминия в сульфиде алюминия 0,2 моль так как здесь два атома алюминия.
Слайд 11
У нас нет количества вещества оксида алюминия. Обозначаем его через x , ⱱ Al =2 x моль.Зная массовую долю алюминия в смеси, составляем уравнение. 0,5 = 27∙(0,2 + 2 x ) / 15 + 102 x , где 102 это молярная масса оксида алюминия. Решаем уравнение и находим x =0,7 моль, тогда масса оксида алюминия равна 0,7∙102= 71,4 г Находим массу хлорида алюминия по 1 и 2 уравнению 1,4 + 0,2 моль =1,6 моль Находим массу соли 1, 6 ∙ M AlCl 3 = 1,6 ∙133,5= 213,6 г. Находим массовую доли соли в растворе: w AlCl 3 = 213,6 / m Al 2 O 3 + m Al 2 S 3 +m раствора — mH 2 S = 213,6/ 71,4+ 15 +700 – 0,3∙34= 213,6/776,2 = 0,2752, 27,52% Ответ. 27, 52%
Слайд 12
Задание 34. Смесь оксида лития и нитрида лития с массовой долей атомов лития 56%, растворили в 365 г 20% соляной кислоты, причём все вещества полностью прореагировали. Затем к образовавшемуся раствору добавили 410г 20% раствора фосфата натрия. Найдите массовую долю хлорида натрия в конечном растворе.
Слайд 13
Решение: Уравнения реакций: Li 2 O +2HCl = 2LiCl + H 2 O Li 3 N + 4 HCl = 3 LiCl + NH 4 Cl 3LiCl + Na 3 PO 4 = 3 NaCl + Li 3 PO 4 ↓ 1 Находим массу соляной кислоты , исходя из раствора. mHCl =365 ∙0,2 = 73 г, находим ⱱ HCl = 73/36,5 = 2 моль. Находим ⱱ Na 3 PO 4 = 410 ∙ 0,2/ 164 = 0,5 моль.
Слайд 14
2. Пусть количество вещества оксида лития x моль, количество вещества нитрида лития – y моль. Тогда по первому уравнению количество вещества соляной кислоты 2 x , а по второму уравнению 4 y / Составляем первое уравнение для системы уравнений : 2 x + 4 y = 2 Составляем второе уравнение : m Li 2 O = M Li 2 O ∙ x =30 x m Li 3 N = M Li 3 N ∙ y = 35 y , зная, что все атомы азота составляют 56 % записываем в числитель: 7∙ (2 x + 3 y ). Уравнение : 7∙ (2 x + 3 y ) / 30 x + 35 y = 0,56. Решаем систему уравнений :
Слайд 15
2 x + 4 y = 2 7∙ (2 x + 3 y ) / 30 x + 35 y = 0,56 Находим x = 0,2 моль Li 2 O y = 0,4 моль Li 3 N По 1 и 2 уравнению находим количество вещества хлорида лития. В первом уравнении ⱱ LiCl =0,4 моль, во втором 1,2 моль. Всего 1.6 моль. По 3 уравнению находим, что хлорид лития в избытке и расчет ведем по недостатку , по Na 3 PO 4 0,5 / 1 = x / 3.Отсюда ⱱ NaCl =1,5 моль, а масса равна 87,8 г. Находим массовую долю хлорида натрия w NaCl = 87,8 / 737 = 0,119. Или 11,9 %. Чтобы найти массу раствора , мы суммируем массу оксида и нитрида лития, раствора соляной кислоты, раствора фосфата натрия и отнимаем массу фосфата лития. (737 г ) Ответ: 11,9%
Слайд 16
Задачи для самостоятельного решения. Задание 34. Вариант 1. Смесь меди и оксида меди (II), в которой массовая доля атомов меди составляет 96%, растворили в концентрированной серной кислоте массой 472 г, взятой в избытке. Полученный газ растворили в минимальном количестве раствора гидроксида натрия массой 200 г с массовой долей щёлочи 10%. Вычислите массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой. Ответ . 20%
Семинар для учителей химии
Практикумы по решению задач высокого уровня сложности в КИМах ЕГЭ
«Решение задачи №34 с использованием в условии условия на атомистику».
Подготовила: Яшина Ю.А.
Учитель химии МБОУ Вольгинская СОШ им.академика Бакулова И.А.
18 февраля 2021 год
Задачи на атомистику — это задачи на соотношения частиц (атомов, молекул, ионов и т.д.) в гомогенных и гетерогенных системах (растворах, твердых и газообразных смесях). Это могут быть массовые соотношения (например, массовая доля элемента в смеси), мольные соотношения (например, соотношение числа атомов водорода и кислорода или мольная доля), объемные соотношения (объемная доля и др.).
Для решения задач на атомистику используются довольно простые идеи. Во-первых, понятие массовой доли. Во-вторых, умение выражать число атомов через число молекул или других структурных единиц.
Например , в молекуле триоксида серы SO3 на 1 молекулу приходится один атом серы и три атома кислорода:
1 молекула SO3 — 1 атом серы, 3 атома кислорода
Несложно пропорцией определить, что на две молекулы триоксида серы будет приходиться два атома серы и шесть атомов кислорода:
2 молекулы SO3 — 2 атома S, 6 атомов О
На 20 молекул триоксида:
20 молекул SO3 — 20 атомов S, 60 атомов О
А вот сколько атомов приходится на х молекуле триоксида? Это также легко определить через пропорцию:
х молекул SO3 — х атомов S, 3х атомов О
Иначе говоря, количество атомов кислорода в молекуле SO3 в три раза больше, чем количество молекул . А количество атомов серы равно количеству молекул триоксида сер ы. Это простая, но не всегда очевидная идея. То есть индексы в формуле вещества показывают не только, как соотносится количество атомов между собой, но и какое число атомов приходится на 1 молекулу или другую структурную единицу вещества.
Если так соотносится число атомов и молекул, то также будет соотноситься и количество вещества атомов и молекул, выраженное в молях . Потому что 1 моль — это не что иное, как порция, состоящая из одинакового числа данных частиц.
То есть на х моль трикосида серы приходится:
х моль SO3 — х моль атомов S, 3х моль атомов О
Представьте себе, что атомы — это элементы изделия, а молекула состоит из некоторого числа таких деталей. Таким образом, число деталей разного типа всегда больше или равно числа изделий. Получается, в молекуле число атомов всегда больше или равно количества молекул.
И, наоборот, число молекул триоксида серы в 3 раза меньше ,чем число атомов кислорода в составе SO3. И число молекул равно количеству атомов серы.
Рассмотрим решение от простой к более сложным вариантам задач:
1. В порции нитрата бария содержится 1,0836*20 ²⁴ ионов. Вычислите массу этой порции.
Решение: 1 формульная единица Ba(NO3)₂ ͢ Ba²+ +2NO3-
3 иона
n( ионов ) = 1,0836*20 ²⁴/6,02*20 ²³=1,8 моль (ионов)
количество вещества нитрата бария равно 1,8/3=0,6моль
m(Ba(NO3)₂)=n*M= 0 ,6 моль*261 г/моль=156,6 г.
Ответ: 156,6 г.
2. Через 21%-ный раствор сульфата хрома (III) массой 280 г пропускали электрический ток до тех пор, пока его масса не стала равна 267 г. Газообразные продукты, выделившиеся на катоде и аноде, смешали. В полученной смеси на 4 атома водорода приходится 3 атома кислорода. Вычислите массовые доли веществ в растворе, образовавшемся после электролиза
Решение:
Запишем уравнения реакций:
(1) 2 Cr2(SO4)3 + 6H2O = 4Cr + 3O2 + 6H2SO4
(2) 2H2O = 2H2 + O2
2. Вычислим количество исходного сульфата хрома
m(Cr2(SO4)3) = m( р-ра) · ω = 280 · 0,21 = 58,8 г
n(Cr2(SO4)3) = m : M = 58,8 : 392 = 0,15 моль
3. Вычислим количества веществ в полученном растворе
n(O) : n(H) = n(O2) : n(H2) = 3 : 4
Пусть n1(Cr) = x моль, n2(H2) = y моль
- (1,5 x + 0,5y) : y = 3 : 4
Масса раствора изменилась на 280 – 267 = 13 г
(2) 52 · 2х + 32 · 1,5 x + 18y = 13
Уравнения (1) и (2) объединим в систему и решим ее
x = 0,05 моль, y = 0,3 моль n(H2SO4) = 0,15 моль
n ост.( Cr2(SO4)3) = 0,15 – 0,05 = 0,1 моль
4. Вычислим массовые доли веществ
m(H2SO4) = n · M = 0,15 · 98 = 14,7 г
m(Cr2(SO4)3) = n · M = 0,1 · 392 = 39,2 г
ω( H2SO4) = 14,7 : 267 · 100% = 5,51%
ω( Cr2(SO4)3) = 39,2 : 267 · 100% = 14,68% Ответ: 14,68%
3 . Смесь оксида кремния(IV) и карбоната кальция общей массой 94 г с молярным соотношением 4 : 7 прокалили до постоянной массы. Получившийся при этом газ пропустили через 100 г 10%-ного раствора гидроксида натрия. Определите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение: Записаны уравнения реакций:
1) SiO2 + CaCO3 = CaSiO3 + CO2
2 ) CaCO3 = CaO + CO2
3 ) CO2 + NaOH = NaHCO3
Приведены необходимые вычисления:
Пусть в исходной смеси было 4 x моль SiO2
n(CaCO3) = 7/4n(SiO2) = 7x моль
m(SiO2) = 240x г
m(CaCO3) = 700x г 240 x + 700x = 94
x = 0,1 моль
n(SiO2) = 0,4 моль
n(CaCO3) = 0,7 моль
CaCO3 в избытке по 1
n(CaCO3 прореаг.)
1= n(SiO2 исх.)(1) = 0,4 моль
n(CaCO3 ост.)(1) = 0,7 – 0,4 = 0,3 моль
n(CO2 полученного) (1) = n(SiO2 исх.)[1] = 0,4 моль
n(CO2 полученного)(2) = n(CaCO3 ост.)[1] = 0,3 моль
n(CO2 исх.)(3) = n(CO2 полученного)(1) и (2) = 0,4 + 0,3 = 0,7 моль
m(NaOH исх.)(3) = 100 ∙ 0,1 = 10 г
n(NaOH исх.)(3) = 10 / 40 = 0,25 моль
CO2 в избытке по (3)
n(NaHCO3 полученного)(3) = n(NaOH исх.)(3) = 0,25 моль
m(NaHCO3 полученного)(3) = 0,25 · 84 = 21 г
n(CO2 прореаг.)(3) = n(NaOH исх.)(3) = 0,25 моль
m(CO2 прореаг.)(3) = 0,25 · 44 = 11 г
m( р-ра) = 11 + 100 = 111 г
W%( NaHCO3) = 21 / 111 = 0,189, или 18,9%
Ответ: 18,9%

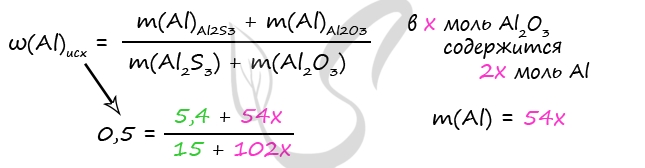

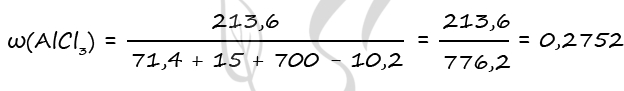
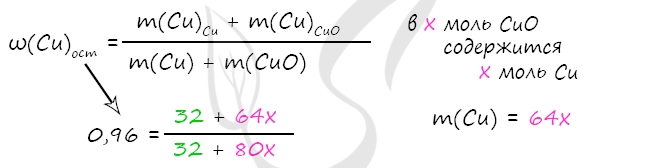
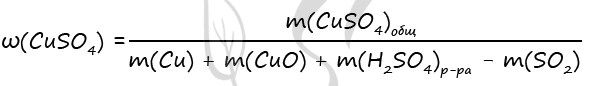
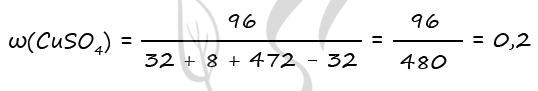
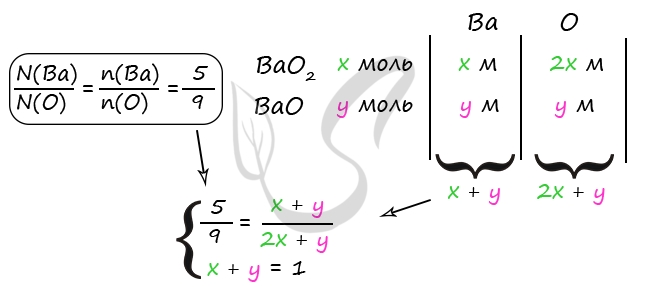
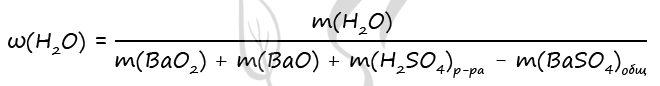
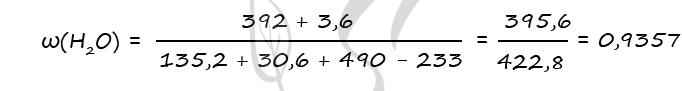

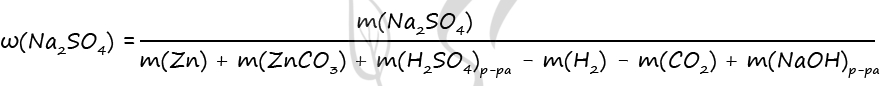
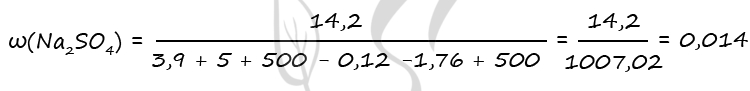

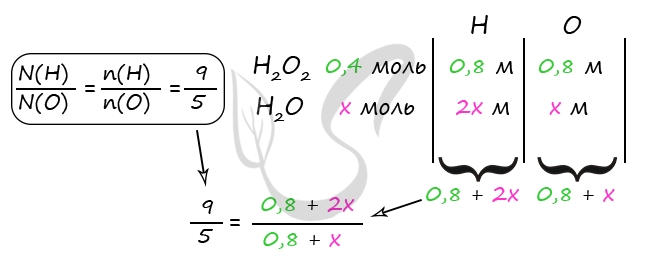
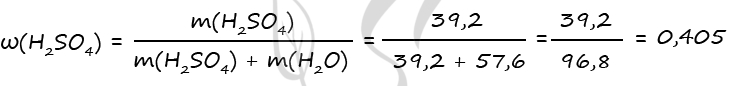
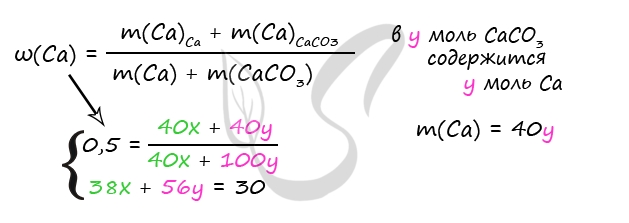
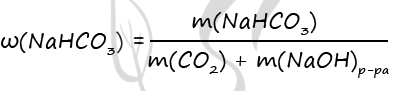
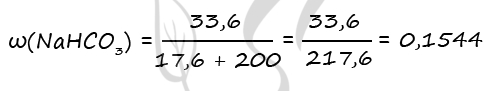
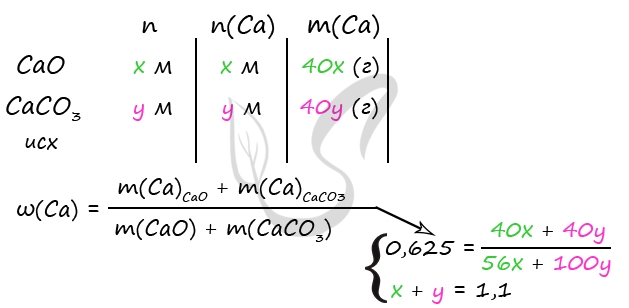


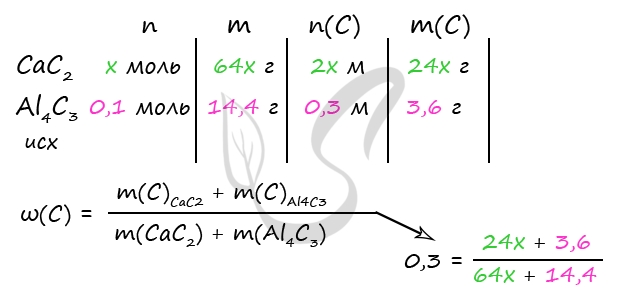
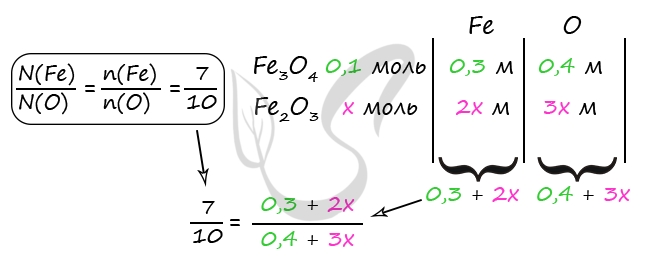
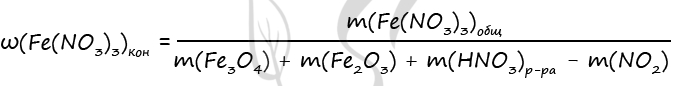
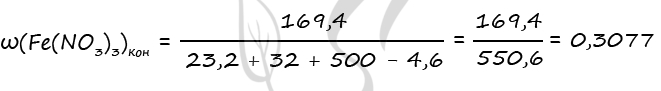
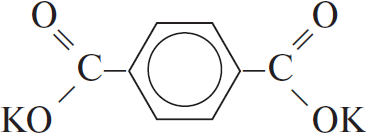
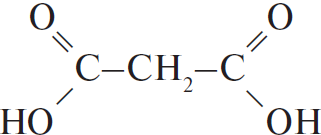
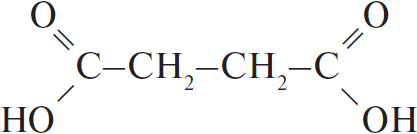







![n(SiO2) = 0,4 моль n(CaCO3) = 0,7 моль CaCO3 в избытке по 1 n(CaCO3 прореаг.) 1= n(SiO2 исх.)(1) = 0,4 моль n(CaCO3 ост.)(1) = 0,7 – 0,4 = 0,3 моль n(CO2 полученного) (1) = n(SiO2 исх.)[1] = 0,4 моль n(CO2 полученного)(2) = n(CaCO3 ост.)[1] = 0,3 моль n(CO2 исх.)(3) = n(CO2 полученного)(1) и (2) = 0,4 + 0,3 = 0,7 моль m(NaOH исх.)(3) = 100 ∙ 0,1 = 10 г n(NaOH исх.)(3) = 10 / 40 = 0,25 моль CO2 в избытке по (3) n(NaHCO3 полученного)(3) = n(NaOH исх.)(3) = 0,25 моль m(NaHCO3 полученного)(3) = 0,25 · 84 = 21 г n(CO2 прореаг.)(3) = n(NaOH исх.)(3) = 0,25 моль m(CO2 прореаг.)(3) = 0,25 · 44 = 11 г m( р-ра) = 11 + 100 = 111 г W%( NaHCO3) = 21 / 111 = 0,189, или 18,9% Ответ: 18,9%](https://fsd.mir-olymp.ru/html/2021/02/18/i_602ea14da804f/img_phptMXCUe_1_6.jpg)