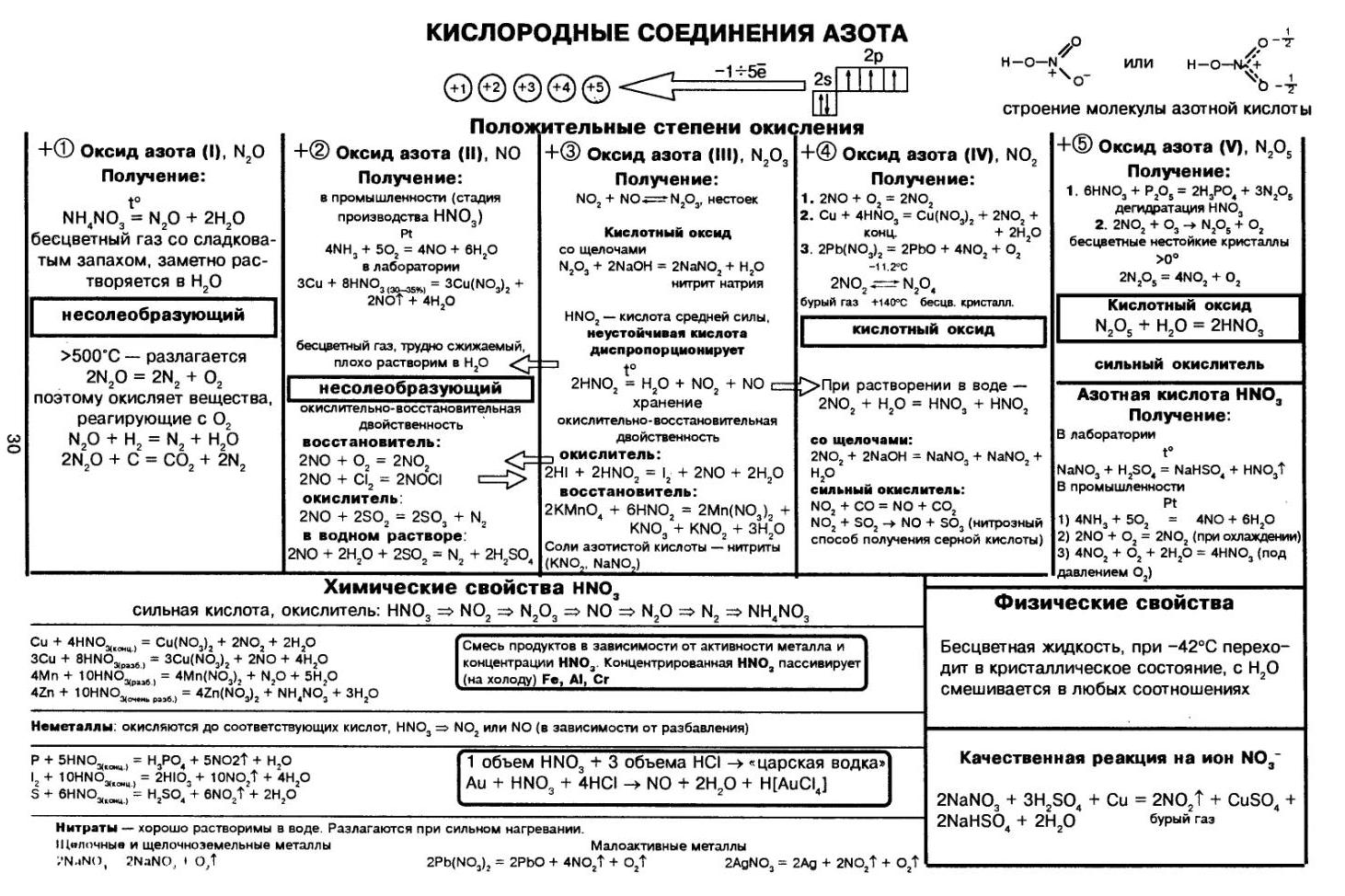
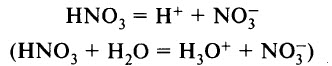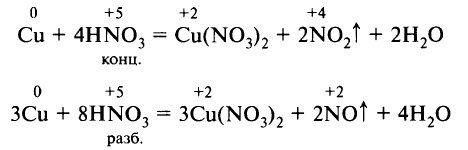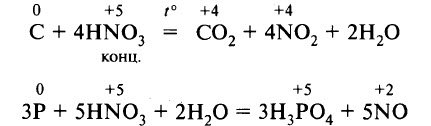Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары
желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной
кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

Получение
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
NH3 + O2 → (кат. Pt) NO + H2O
NO + O2 → NO2
NO2 + H2O + O2 → HNO3
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
Химические свойства
- Кислотные свойства
- Термическое разложение
- Реакции с неметаллами
- Реакции с металлами
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии
выпадения осадка, выделения газа или образования слабого электролита.
CaO + HNO3 → Ca(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в
темном месте.
HNO3 → (hv) NO2 + H2O + O2
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2,
если разбавленная — до NO.
HNO3(конц.) + C → CO2 + H2O + NO2
HNO3(конц.) + S → H2SO4 + NO2 + H2O
HNO3(разб.) + S → H2SO4 + NO + H2O
HNO3(конц.) + P → H3PO4 + NO2 + H2O

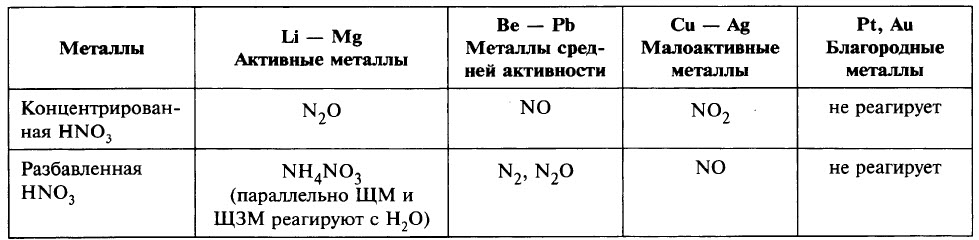
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой
именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием
нитрата и преимущественно NO2.
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2,
NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка
с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит
за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так
как оксидная пленка на поверхности металлов разрушается.
Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Соли азотной кислоты — нитраты NO3—
Получение
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
MgO + HNO3 → Mg(NO3)2 + H2O
Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O

Нитрат аммония получают реакция аммиака с азотной кислотой.
NH3 + HNO3 → NH4NO3
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная
кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
Химические свойства
- Реакции с металлами, основаниями и кислотами
- Разложение нитратов
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате
реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
AgNO3 + KCl → AgCl↓ + KNO3

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.

Pb(NO3)2 → (t) PbO + NO2 + O2
NaNO3 → (t) NaNO2 + O2
Cu(NO3)2 → (t) CuO + NO2 + O2
PtNO3 → (t) Pt + NO2 + O2

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
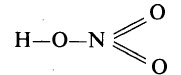
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO + 2HNO3 → Cu(NO3)2 + H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 + P → H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 + C → CO2 + 4NO2 + 2H2O
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 + SO2 → H2SO4 + 2NO2
Еще пример: азотная кислота окисляет иодоводород:
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
2.6. Характерные химические свойства кислот.
Классификация кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные |
двухосновные |
трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH |
H2SO4, H2SO3, H2CO3, H2SiO3 |
H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
|
H2S, HCl, CH3COOH, HCOOH |
H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
|
хорошо диссоциирующие (сильные) |
малодиссоциирующие (слабые) |
|
H2SO4, HCl, HBr, HI, HNO3, HClO4 |
H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
|
слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) |
сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
|
практически все кислоты кроме HNO3 и H2SO4 (конц.) |
HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H+ + Cl—
либо в таком: HCl → H+ + Cl—
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки
. Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
H3PO4 H+ + H2PO4—
H2PO4— H+ + HPO42-
HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
H2SO4 + ZnO ZnSO4 + H2O
6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
2H2S + SO2 3S↓+ 2H2O
Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде.
ткип. = 83oC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
4HNO
3
= 4NO
2
+ 2H
2
O + O
2
.
Азотная кислота ядовита.
В растворе — сильная кислота; нейтрализуется щелочами, гидратом аммиака, реагирует с основными оксидами и гидроксидами, солями слабых кислот. Сильный окислитель; реагирует с металлами, неметаллами, типичными восстановителями. Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th, U; не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. Не разрушает диоксид кремния. Смесь концентрированных HNO3 и HCl («царская водка») обладает сильным окислительным действием (превосходит чистую HNO
3
), переводит в раствор золото и платину. Еще более активна смесь концентрированных HNO3 и HF.
M
r
= 63, 01; d = 1, 503
(25)
; t
пл
= -41, 6
o
C; t
кип
+82,6
o
C (разл.).
Химические свойства азотной кислоты
1. Типичные свойства кислот:
1) Взаимодействует с основными и амфотерными оксидами:
2HNO
3
+ CuO = Cu(NO
3
)
2
+ H
2
O
6HNO
3
+ Al
2
O
3
= 2Al(NO
3
)
3
+ 3H
2
O
2) С основаниями, амфотерными гидроксидами:
HNO
3
+ NaOH = NaNO
3
+ H
2
O
2HNO
3
+ Zn(OH)
2
= Zn(NO
3
)
2
+ 2H
2
O
3) Вытесняет слабые кислоты из их солей:
2HNO
3
+ Na
2
CO
3
= 2NaNO
3
+ H
2
O + CO
2
2HNO
3
+ Na
2
SiO
3
= H
2
SiO
3
↓+ 2NaNO
3
2. Специфические свойства азотной кислоты как окислителя
1) Взаимодействие азотной кислоты с металлами
В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода. Глубина восстановления нитрат-иона зависит от концентрации кислоты и от положения металла в электрохимическом ряду напряжений металлов. Возможные продукты взаимодействия металлов с азотной кислотой приведены в таблице ниже.
Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты
.
4 HN
+5
O
3(
конц
.)
+ Cu
0
= Cu
+2
(NO
3
)
2
+ 2 N
+4
O
2
+ 2 H
2
O
N
+5
+ 1e → N
+4
2 окислитель, пр-с восстановления
Cu
0
– 2e → Cu
+2
1 восстановитель, пр-с окисления
8 HN
+5
O
3(
разб
.)
+ 3 Cu
0
= 3 Cu
+2
(NO
3
)
2
+ 2 N
+2
O + 4 H
2
O
N
+5
+ 3e → N
+2
2 окислитель, пр-с восстановления
Cu
0
– 2e → Cu
+2
3 восстановитель, пр-с окисления
2) Проявляет окислительные свойства при взаимодействии с неметаллами:
S + 6HNO
3
(конц) = H
2
SO
4
+ 6NO
2
+ 2H
2
O;
B + 3HNO
3
= H
3
BO
3
+ 3NO
2
;
3P + 5HNO
3
+ 2H
2
O = 5NO + 3H
3
PO
4
.
3) Азотная кислота окисляет сложные вещества:
6HI + 2HNO
3
= 3I
2
+ 2NO + 4H
2
O;
FeS + 12HNO
3
= Fe(NO
3
)
3
+ H
2
SO
4
+ 9NO
2
+ 5H
2
O.
4) Ксантопротеиновая реакция:
Азотная кислота окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук – «ксантопротеиновая реакция»).
Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляют концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака (в щелочной среде) окраска переходит в оранжевую. Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка.
5) Окислительные свойства «царской водки»:
Смесь концентрированных азотной и соляной кислот в объемном соотношении 1 : 3 обладает еще большей окислительной активностью, они могут растворять даже золото и платину:
HNO
3
+ 4HCl + Au = H[AuCl
4
] + NO + 2H
2
O;
4HNO
3
+ 18HCl + Pt = 3H
2
[PtCl
6
] + 4NO + 8H
2
O
Химические реакции с азотной кислотой
4HNO
3
= 4NO
2
+ 2H
2
O + O
2
(комн., на свету).
HNO
3
+ H
2
O = NO
3
–
+ H
3
O
+
.
HNO
3
(разб.) + NaOH = NaNO
3
+ H
2
O ,
HNO
3
(разб.) + NH
3
· H
2
O = NH
4
NO
3
+ H
2
O.
2HNO
3
(2-3%-я) + 8H
0
(Zn, разб. H
2
SO
4
) = NH
4
NO
3
+ 3H
2
O,
2HNO
3
(5%-я) + 8H
0
(Mg, разб. H
2
SO
4
) = N
2
O ↑ + 5H
2
O,
HNO
3
(30%-я) + 3H
0
(Zn, разб. H
2
SO
4
) = NO
2
↑ H
2
O,
HNO
3
(60%-я) + 2H
0
(Zn, разб. H
2
SO
4
) = HNO
2
+ H
2
O. (кат Pd)
2HNO
3
(конц.) +Ag = AgNO
3
+ NO
2
↑ + H
2
O.
8HNO
3
(разб.) + 3Cu = 3Cu(NO
3
)
2
+ 2NO↑ + 4H
2
O
10HNO
3
(разб.) + 4Mg = 4Mg(NO
3
)
2
+N
2
O↑ + 5H
2
O (примесь H
2
)
12HNO
3
(разб.) + 5Sn —
t
—5Sn(NO
3
)
2
+ N
2
↑ + 6H
2
O (примесь NO)
30HNO
3
(оч. разб.) + 8Al = 8Al(NO
3
)
3
+ 3 NH
4
NO
3
+ 9H
2
O (примесь H
2
)
12HNO
3
(оч. разб.) + 5Fe = 5Fe(NO
3
)
2
+ N
2
↑ + 6H
2
O (0-10
o
C),
4HNO
3
(разб.) + Fe = Fe(NO
3
)
3
+ NO↑ + 2H
2
O.
4HNO
3
(конц., гор.) + Hg = Hg(NO
3
)
2
+ 2NO
2
↑
+ 2H
2
O,
8HNO
3
(разб., хол) + 6Hg = 3Hg
2
(NO
3
)
2
+ 2NO ↑ + 4H
2
O.
6HNO
3
(конц.) + S = H
2
SO
4
+ 6NO
2
↑ + 2H
2
O (кип.),
2HNO
3
(конц.) + 6HCl(конц.) = 2NO↑ + 3Cl
2
↑ + 4H
2
O (100-150
o
C).
HNO
3
(конц.) + 4HCl(конц.) + Au = H[AuCl
4
] + NO↑ + 2H
2
O.
4HNO
3
(конц.) + 18HCl(конц.) + 3Pt = 3H
2
[PtCl
6
] + 4NO↑ + 8H
2
O
4HNO
3
(конц.) + 18HF(конц.) + 3Si = 3H
2
[SiF
6
] + 4NO↑ + 8H
2
O.
4HNO
3
(дымящ.) + P
4
O
10
= 2N
2
O
5
+ 4HPO
3
(в атмосфере O
2
+O
3
)
Азотная кислота
Ключевые слова конспекта: азотная кислота, строение молекулы, физические и химические свойства, получение, применение азотной кислоты.
СТРОЕНИЕ МОЛЕКУЛЫ И
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Высшим гидроксидом азота является азотная кислота HNO3. Азотная кислота – вещество молекулярного строения. В молекуле HNO3 химические связи ковалентные полярные. Графическая формула азотной кислоты:
В азотной кислоте степень окисления азота равна +5, а его валентность – IV. Азот не может быть пятивалентным, так как на втором энергетическом уровне нет вакантных орбиталей, необходимых в этом случае для возбуждения атома. Одна из электронных пар атома азота принадлежит одновременно трём атомам: двум атомам кислорода и атому азота – трёхцентровая связь.
При обычных условиях азотная кислота – бесцветная жидкость, примерно в 1,5 раза тяжелее воды, летуча, «дымит» на воздухе, смешивается с водой в любых соотношениях. Часто концентрированный раствор азотной кислоты окрашен в жёлтый цвет, который придаёт раствору оксид азота (IV) NO2, выделяющийся вследствие частичного разложения HNO3.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота является сильной одноосновной кислотой, в водном растворе диссоциирует на ионы:
Ион Н3O+ можно обнаружить в растворе с помощью индикатора: лакмус меняет цвет с фиолетового на красный, метиловый оранжевый – с оранжевого на красный.
Азотная кислота проявляет общие свойства кислот. Она реагирует:
- а) со щелочами (реакция нейтрализации):
КОН + HNO3 = KNO3 + H2O
OH– + Н+ = H2O
- б) с нерастворимыми в воде основаниями:
Mn(OH)2 + 2HNO3 = Mn(NO3)2 + 2H2O
Mn(OH)2 + 2Н+ = Mg2+ + 2H2O
- в) с амфотерными гидроксидами:
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + 2Н+ = Zn2+ + 2H2O
- г) с основными и амфотерными оксидами:
CuO + 2HNO3 = Cu(NO3)2 + 2H2O
CuO + 2Н+ = Cu2+ + H2O
- д) с солями слабых и летучих кислот:
К2СO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O
СО32– + 2Н+ = CO2↑ + H2O
В то же время в молекуле азотной кислоты содержится атом азота в высшей степени окисления, что обусловливает специфические свойства азотной кислоты.
- Реакция с металлами. Азотная кислота взаимодействует со многими металлами, окисляя их не за счёт Н+, а за счёт азота в высшей степени окисления (+5). В результате таких реакций водород не образуется. Продуктами реакции являются нитрат металла, продукт восстановления азота и вода. Реакция идёт по схеме:
где Me – металл.
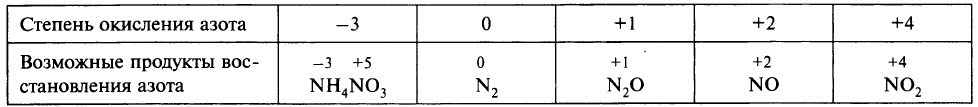
В ходе реакции обычно образуется смесь продуктов восстановления азота, и, как правило, один из них преобладает. Глубину восстановления азота иллюстрирует схема:
Восстановление азота до NO2 является менее глубоким по сравнению с восстановлением до NO и т. д.
Глубина восстановления азота зависит:
- от природы металла (от восстановительной способности металла; чем левее положение металла в электрохимическом ряду напряжений металлов, тем глубже восстановление азота);
- от концентрации азотной кислоты (в более концентрированных растворах происходит менее глубокое восстановление азота);
- от температуры (понижение температуры способствует более глубокому восстановлению);
- от чистоты азотной кислоты.
С азотной кислотой не реагируют:
- а) благородные металлы Au, Ru, Rh, Os, Ir, Pt вследствие слишком малой их восстановительной способности;
- б) некоторые металлы (Al, Сг, Fe) не реагируют с концентрированной (> 68%) азотной кислотой вследствие образования на поверхности металла плотной защитной оксидной плёнки – эти металлы пассивируются. Тем не менее при нагревании может происходить реакция окисления данных металлов.
Чтобы определить, какой из продуктов восстановления азота преобладает, при записи уравнения реакции можно ориентироваться данными таблицы.
Ещё раз обратим внимание, что в ходе реакции образуется смесь продуктов восстановления и преобладание того или иного продукта зависит от многих факторов.
Классическими примерами взаимодействия азотной кислоты с металлами является растворение меди в азотной кислоте:
- Реакции с неметаллами. Азотная кислота реагирует с некоторыми неметаллами, способными проявлять восстановительные свойства. Например, концентрированная азотная кислота реагирует с углём, фосфором, йодом. В результате восстановления образуются NO или NO2:
- Реакции со сложными веществами-восстановителями. Концентрированная азотная кислота является сильным окислителем, вступает в реакции с различными веществами, обладающими восстановительными способностями.
- Разложение при нагревании. При хранении, на свету или при нагревании концентрированная азотная кислота разлагается:
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТНОЙ КИСЛОТЫ
В лаборатории чистую азотную кислоту получают нагреванием кристаллической натриевой или калиевой селитры (KNO3, NaNO3) с концентрированной серной кислотой:
Образующиеся пары HNO3 конденсируют и собирают полученный продукт.
В основе промышленного получения азотной кислоты находится цепь синтезов:
N2 → NH3 → NO → NO2 → HNO3
Сырьём является азот, получаемый разделением жидкого воздуха на фракции. Сначала осуществляется синтез аммиака:
Аммиак окисляют кислородом на платиновом катализаторе:
Оксид азота (II) легко окисляется кислородом воздуха:
В заключение проводят поглощение диоксида азота водой в присутствии избытка кислорода:
Азотная кислота является одной из важнейших неорганических кислот. Её мировое производство достигает десятков миллионов тонн в год. Азотная кислота применяется для производства минеральных удобрений, нитрования органических веществ во многих органических синтезах (чаще всего для синтеза взрывчатых веществ, красителей и лекарств). Примерами органических продуктов нитрования являются нитробензол (требуется для синтеза анилина), тринитротолуол (тротил, тол), тринитроглицерин (для получения динамита), тринитрофенол (пикриновая кислота – взрывчатое вещество), тринитроцеллюлоза и т. д. Азотная кислота используется для травления металлов.
Всё про азотную кислоту кратко в одной таблице
Всё про азотную кислоту кратко в одной таблице
Конспект урока «Азотная кислота: строение, свойства, получение, применение».
Следующая тема: «».
Чтобы поделиться, нажимайте
Опытным путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые – полуторные связи. Степень окисления азота +5, а валентность равна IV.
Физические свойства
Азотная кислота HNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет:
N2 + O2 грозовые эл.разряды→ 2NO
2NO + O2 → 2NO2
4НNО3 свет→ 4NО2↑(бурый газ) + 2Н2О + О2
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Получение
1. Лабораторный способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
2. Промышленный способ
Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 → 4NO + 6H2O (Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)
Применение
- в производстве минеральных удобрений;
- в военной промышленности;
- в фотографии — подкисление некоторых тонирующих растворов;
- в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
- в производстве взрывчатых и отравляющих веществ
Химические свойства азотной кислоты
Для азотной кислоты характерны свойства: общие с другими кислотами и специфические:
ХИМИЧЕСКИЕ СВОЙСТВА ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ
1. Очень сильная кислота. Индикаторы в её растворе изменяют цвет на красный.
Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3—
2. Реагирует с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
K2O + 2H+ + 2NO3— → 2K+ + 2NO3— + H2O
K2O + 2H+ → 2K+ + H2O
3. Реагирует с основаниями
HNO3 + NaOH → NaNO3 + H2O
H+ + NO3— + Na+ + OH— → Na+ + NO3— + H2O
H+ + OH— → H2O
4. Реагирует с солями, вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
2H+ + 2NO3— + 2Na+ + СO32- → 2Na+ + 2NO3— + H2O + CO2
2H+ + СO32- → H2O + CO2
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота — сильный окислитель
N+5 → N+4→ N+2→ N+1→ No → N-3
N+5 + 8e—→N-3 окислитель, восстанавливается.
1. Разлагается на свету и при нагревании
4HNO3 t˚C→ 2H2O + 4NO2 + O2
Образуется бурый газ
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук — «ксантопротеиновая реакция»)
3. Реагирует с металлами.
В зависимости от концентрации кислоты и положения металла в электрохимическом ряду напряжений могут образовываться разные азотсодержащие продукты.
При взаимодействии с металлами никогда не выделяется водород
HNO3 + Me = соль + H2O + Х
| Щелочные и щелочноземельные | Fe, Cr, Al, Ni, Co | Металлы до водорода | Металлы после водорода
(Cu и др) |
Благородные
Au, Pt, Os, Ir, Ta |
|
| HNO3 (конц.ω>60%) | N2O | пассивация (при обычных условиях);
NO2 (при нагревании) |
NO2 | NO2 | Нет реакции |
| HNO3 (разбавл.) | NH3, NH4NO3 | Основной NO, но в зависимости от разбавления могут образовываться N2, N2O, NH3, NH4NO3. Чем больше разбавлена кислота, тем ниже степень окисления азота. | NO |
Таблица. Продукты реакции взаимодействия азотной кислоты с металлами
Упрощенная схема «Продукты реакции взаимодействия азотной кислоты с металлами»
Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
4. Реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO3 (конц.) + неметалл = окисление неметалла до кислоты в высшей степени окисления + NO2 + вода
HNO3 (разбав.) + неметалл + вода = окисление неметалла до кислоты в высшей степени окисления + NO