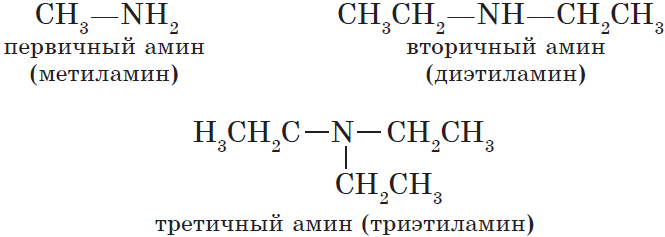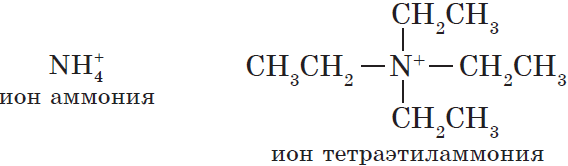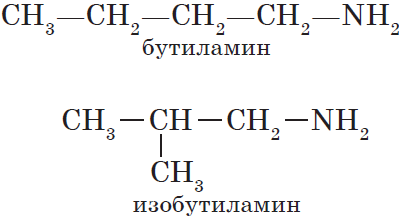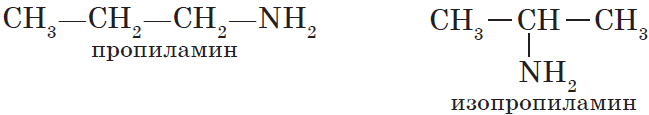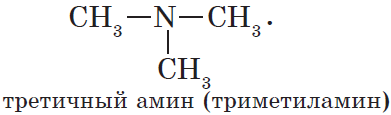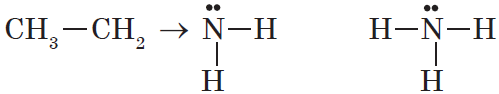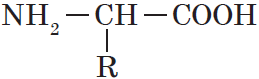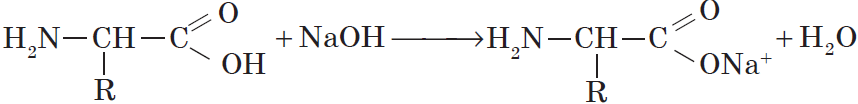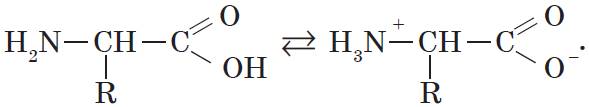Амины
Амины — органические производные аммиака, в молекуле которого один, два или все три атома водорода замещены углеродным остатком.
Соответственно, обычно выделяют три типа аминов:
Можно также считать, что первичные амины являются производными углеводородов, в молекулах которых атом водорода замещен на функциональную группу $NH^{2—}$, аминогруппу.
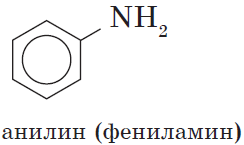
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или анилин:
Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары. Это приводит к тому, что амины проявляют свойства оснований.
Существуют ионы, которые являются продуктом формального замещения на углеводородный радикал всех атомов водорода в ионе аммония:
Эти ионы входят в состав солей, похожих на соли аммония. Они называются четвертичными аммонийными солями.
Изомерия и номенклатура
Для аминов характерна структурная изомерия:
— изомерия углеродного скелета:
— изомерия положения функциональной группы:
Первичные, вторичные и третичные амины изомерны друг другу (межклассовая изомерия):
${CH_3-CH_2-CH_2-NH_2}↙{text»первичный амин (пропиламин)»}$
${CH_3-CH_2-NH-CH_3}↙{text»вторичный амин (метилэтиламин)»}$
Как видно из приведенных примеров, для того, чтобы назвать амин, перечисляют заместители, связанные с атомом азота (по порядку старшинства), и добавляют суффикс -амин.
Физические и химические свойства аминов
Физические свойства.
Простейшие амины (метил амин, диметиламин, триметиламин) — газообразные вещества. Остальные низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но не способными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре $184°С$.
Химические свойства.
Химические свойства аминов определяются в основном наличием у атома азота неподеленной электронной пары.
1. Амины как основания. Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т.е. выступать в роли основания:
$NH_3+H^{+}→{NH_4^{+}}↙{text»ион аммония»}$
$CH_3CH_2—NH_2+H^{+}→CH_3—{CH_2—NH_3^{+}}↙{text»ион этиламмония»}$
Известно, что реакция аммиака с водой приводит к образованию гидроксид-ионов:
$NH_3+H_2O⇄NH_3·H_2O⇄NH_4^{+}+OH^{-}$.
Раствор амина в воде имеет щелочную реакцию:
$CH_3CH_2-NH_2+H_2O⇄CH_3-CH_2-NH_3^{+}+OH^{-}$.
Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами:
$2NH_3+H_2SO_4→{(NH_4)_2SO_4}↙{text»сульфат аммония»}$,
$CH_3—CH_2—NH_2+H_2SO_4→{(CH_3—CH_2—NH_3)_2SO_4}↙{text»сульфат этиламмония»}$.
Основные свойства алифатических аминов выражены сильнее, чем у аммиака. Повышение электронной плотности превращает азот в более сильного донора пары электронов, что повышает его основные свойства:
2. Амины горят на воздухе с образованием углекислого газа, воды и азота:
$4CH_3NH_2+9O_2→4CO_2↑+10H_2O+2N_2↑$
Аминокислоты
Аминокислоты — гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу $—NH_2$ и карбоксильную группу $—СООН$, связанные с углеводородным радикалом.
Общую формулу простейших аминокислот можно записать так:
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа $—NH_2$ определяет основные свойства аминокислот, т.к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа $—СООН$ (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения.
Со щелочами они реагируют как кислоты:
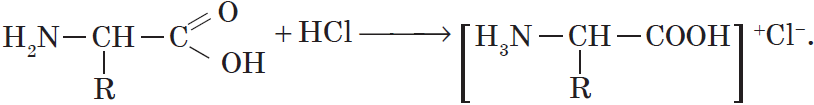
С сильными кислотами — как основания-амины:
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше $200°С$. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала $R—$ они могут быть сладкими, горькими или безвкусными.
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около $150$) выделяют протеиногенные аминокислоты (около $20$), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым, т.к. они не синтезируются в организме человека. Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин.
Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки $—NH—CO—$, например:
${nNH_2—(CH_2)_5—COOH}↙{text»аминокапроновая кислота»}→{(…—NH—(CH_2)_5—COO—…)_n}↙{text»капрон»}+(n+1)H_2O$.
Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полиамидов.
Для получения синтетических волокон пригодны аминокислоты с расположением аминои карбоксильной групп на концах молекул.
Полиамиды $α$-аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиды, пептиды, полипептиды. В таких соединениях группы $—NH—CO—$ называют пептидными.
Некоторые аминокислоты, входящие в состав белков.
| Название аминокислоты | Формула |
| Глицин (аминоуксусная) | $NH_2-CH_2-COOH$ |
| Аланин ($α$-аминопропионовая) | 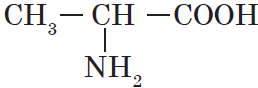 |
| Цистеин ($α$-амино-$β$меркаптопропионовая) | 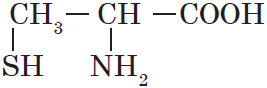 |
| Лизин ($α$, $ε$-диаминокапроновая) | 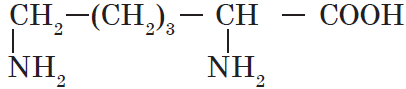 |
| Фенилаланин ($α$-амино-$β$фенилпропионовая) | 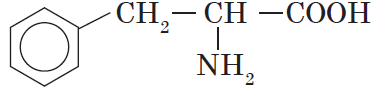 |
Белки
Белками, или белковыми веществами, называют высокомолекулярные (молекулярная масса варьируется от $5–10$ тыс. до $1$ млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки также называют протеинами (от греч. protos — первый, важный). Число остатков аминокислот в молекуле белка очень сильно колеблется и иногда достигает нескольких тысяч. Каждый белок обладает своей, присущей ему, по следовательностью расположения аминокислотных остатков.
Белки выполняют разнообразные биологические функции: каталитические (ферменты), регуляторные (гормоны), структурные (коллаген, фиброин), двигательные (миозин), транспортные (гемоглобин, миоглобин), защитные (иммуноглобулины, интерферон), запасные (казеин, альбумин, глиадин) и другие.
Белки — основа биомембран, важнейшей составной части клетки и клеточных компонентов. Они играют ключевую роль в жизни клетки, составляя как бы материальную основу ее химической деятельности.
Исключительное свойство белка — самоорганизация структуры, т.е. его способность самопроизвольно создавать определенную, свойственную только данному белку пространственную структуру. По существу, вся деятельность организма (развитие, движение, выполнение им различных функций и многое другое) связана с белковыми веществами. Без белков невозможно представить себе жизнь.
Белки — важнейшая составная часть пищи человека и животных, поставщик необходимых аминокислот.
Строение белков
Все белки образованы двадцатью разными $α$-аминокислотами, общую формулу которых можно представить в виде
$R-CHNH_2-COOH$
где радикал R может иметь самое разнообразное строение.
Белки представляют собой полимерные цепи, состоящие из десятков тысяч, миллионов и более остатков $α$-аминокислот, связанных между собой пептидными связями. Последовательность аминокислотных остатков в молекуле белка называют его первичной структурой.
Для белковых тел характерны огромные молекулярные массы (до миллиарда) и почти макроразмеры молекул. Такая длинная молекула не может быть строго линейной, поэтому ее участки изгибаются и сворачиваются, что приводит к образованию водородных связей с участием атомов азота и кислорода. Образуется регулярная спиралевидная структура, которую называют вторичной структурой.
В белковой молекуле могут возникать ионные взаимодействия между карбоксильными и аминогруппами различных аминокислотных остатков и образование дисульфидных мостиков. Эти взаимодействия приводят к появлению третичной структуры.
Белки с $M_r > 50000$ состоят, как правило, из нескольких полипептидных цепей, каждая из которых уже имеет первичную, вторичную и третичную структуры. Говорят, что такие белки обладают четвертичной структурой.
Свойства белков
Белки — амфотерные электролиты. При определенном значении $рН$ среды (оно называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково.
Это одно из основных свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения из растворов, например, в технологии получения белковых продуктов.
Гидратация. Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличиваются. Набухание отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные ($—СО—NH—$, пептидная связь), аминные ($—NH_2$) и карбоксильные ($—СООН$) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации и осаждению, а следовательно, способствует устойчивости растворов белка. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например этилового спирта. Это приводит к выпадению белков в осадок. При изменении $рН$ среды макромолекула белка становится заряженной, и его гидратационная способность меняется.
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не текучи, упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму.
Различная гидрофильность клейковинных белков — один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет важную роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, представляет собой набухший в воде белок, концентрированный студень, содержащий зерна крахмала.
Денатурация белков. При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и ряда других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т.е. ее нативной пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых химических групп, облегчается воздействие на белки протеолитических ферментов, а следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработки пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий. Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). Наконец, к денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приемы широко используются в пищевой и биотехнологии.
Пенообразование. Под процессом пенообразования понимают способность белков образовывать высококонцентрированные системы «жидкость — газ», называемые пенами. Устойчивость пены, в которой белок является пенообразователем, зависит не только от его природы и от концентрации, но и от температуры. Белки в качестве пенообразователей широко используются в кондитерской промышленности (пастила, зефир, суфле). Структуру пены имеет хлеб, а это влияет на его вкусовые качества.
Молекулы белков под влиянием ряда факторов могут разрушаться или вступать во взаимодействие с другими веществами с образованием новых продуктов. Для пищевой промышленности можно выделить два важных процесса: 1) гидролиз белков под действием ферментов; 2) взаимодействие аминогрупп белков или аминокислот с карбонильными группами восстанавливающих сахаров. Под влиянием протеаз-ферментов, катализирующих гидролитическое расщепление белков, последние распадаются на более простые продукты (поли- и дипептиды) и в итоге на аминокислоты. Скорость гидролиза белка зависит от его состава, молекулярной структуры, активности фермента и условий.
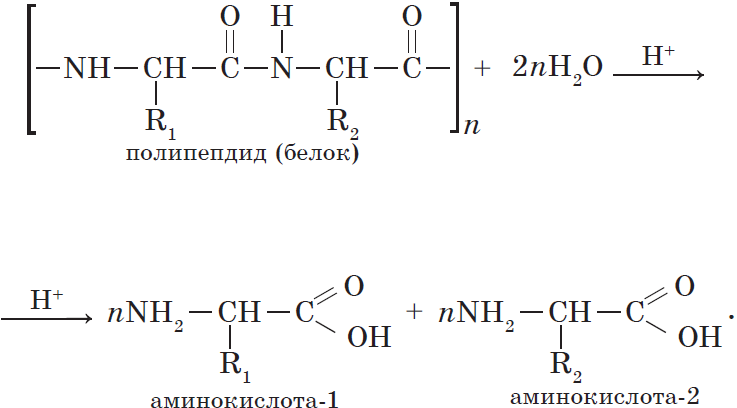
Гидролиз белков. Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:
Горение. Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.
Цветные реакции. Используют следующие реакции:
— ксантопротеиновую, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски;
— биуретовую, при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди (II) с образованием комплексных соединений между ионами $Cu^{2+}$ и полипептидами. Реакция сопровождается появлением фиолетово-синей окраски.
Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная
группой аминов является аминогруппа — NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом,
у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин,
пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина
и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.

Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.

При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая
температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 143 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Какое азотсодержащее соединение может реагировать и с кислотами, и с щелочами?
1) аланин
2) анилин
3) нитробензол
4) этиламин
Какое азотсодержащее соединение может реагировать с кислотами, но не реагирует с щелочами?
1) глицин
2) аланин
3) нитрометан
4) диметиламин
Из предложенного перечня выберите два утверждения, характерные для диметиламина.
1) твердое вещество
2) плохо растворим в воде
3) взаимодействует с серной кислотой
4) проявляет кислотные свойства
5) горит на воздухе
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми взаимодействует .
1) толуол
2) гидроксид калия
3) аминоуксусная кислота
4) циклогексан
5) оксид кремния(IV)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два утверждения, характерные для фенилаланина.
1) имеет формулу
2) относится к ароматическим аминам
3) взаимодействует со спиртами
4) не реагирует со щелочами
5) не взаимодействует с азотной кислотой
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два утверждения, характерные для вещества, формула которого .
1) не реагирует с кислотами
2) не реагирует со щелочами
3) образует сильно кислый водный раствор
4) образует сложные эфиры
5) проявляет амфотерные свойства
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два утверждения, характерные для диметиламина.
1) имеет специфический запах
2) относится к третичным аминам
3) является жидкостью при комнатной температуре
4) реагирует с кислотами
5) является более слабым основанием, чем аммиак
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два утверждения, характерные как для бутиламина, так и для анилина.
1) окисляются кислородом
2) образуют белый осадок с бромной водой
3) являются сильными основаниями
4) взаимодействуют с серной кислотой
5) реагируют с бензолом
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1
Из предложенного перечня выберите два вещества, с которыми взаимодействует .
1) бензол
2) гидроксид натрия
3) циклогексан
4) азотная кислота
5) оксид кремния (IV)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми взаимодействует аминоуксусная кислота.
1) калий
2) пропан
3) иодоводород
4) хлороформ
5) толуол
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два утверждения, характерные для метилэтиламина.
1) является газообразным веществом при нормальных условиях
2) плохо растворим в воде
3) взаимодействует с азотной кислотой
4) взаимодействует с сульфатом натрия
5) проявляет основные свойства
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, которые реагируют с аминопропановой кислотой.
1) водород
2) нитрат калия
3) метанол
4) иодоводород
5) бензол
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два утверждения, которые справедливы для фенилаланина.
1) имеет формулу
2) относится к ароматическим аминам
3) взаимодействует со спиртами
4) не реагирует со щелочами
5) взаимодействует с аминокислотами
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми взаимодействует аминоуксусная кислота.
1) оксид бария
2) бутан
3) хлороформ
4) хлороводород
5) толуол
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми реагирует метиламин.
1) бутан
2) водород
3) кислород
4) бромоводород
5) алюминий
Запишите номера выбранных соединений.
Из предложенного перечня выберите два вещества, с которыми реагирует диметиламин.
1)
2)
3)
4)
5)
Запишите номера выбранных соединений.
Из предложенного перечня выберите два вещества, с которыми реагирует пропиламин.
1) вода
2) хлороводород
3) водород
4) железо
5) гидроксид алюминия
Запишите номера выбранных соединений.
Из предложенного перечня выберите два утверждения, которые справедливы для диметиламина.
1) водный раствор диметиламина имеет слабокислую среду
2) реагирует с бромоводородной кислотой
3) при нагревании реагирует с
4) пары диметиламина тяжелее воздуха
5) как и другие амины, не имеет запаха
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, которые могут реагировать и с метиламином, и с глицином.
1) гидроксид алюминия
2) уксусная кислота
3) хлороводород
4) нитрат натрия
5) гидроксид калия
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два утверждения, характерные и для метиламина, и для фениламина.
1) хорошо растворяются в воде
2) реагируют со щелочами
3) реагируют с азотной кислотой
4) взаимодействуют с
5) горят в атмосфере кислорода
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
Всего: 143 1–20 | 21–40 | 41–60 | 61–80 …
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
R-NH2, R1-NH-R2, R1-N(R2)-R3
Строение аминов
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
Классификация аминов
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин
CH3-NH2 |
Диметиламин
CH3-NH-CH3 |
Триметиламин
(CH3)3N |
| Ароматические | Фениламин
C6H5-NH2 |
Дифениламин
(C6H5)2NH |
Трифениламин
(C6H5)3N |
| Смешанные | Метилфениламин
CH3-NH-C6H5 |
Диметилфениламин
(CH3)2N-C6H5 |
Номенклатура аминов
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин
СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Изомерия аминов
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Например. Формуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета.
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Например.Формуле С4Н11N соответствуют амины положения аминогруппы.
| 1-Аминобутан (н-бутиламин) |
2-Аминобутан (втор-бутиламин) |
 |
Изомерия между типами аминов
Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины.
| Пропиламин
(первичный амин) |
Метилэтиламин (вторичный амин) | Триметиламин
(третичный амин) |
 |
 |
 |
Физические свойства аминов
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Химические свойства аминов
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
|
Аммиак :NH3 |
Первичный амин R–:NH2 |
 |
 |
Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства аминов
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми.
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
Основные свойства аминов возрастают в ряду:
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II):
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
Это качественная реакция на первичные амины – выделение азота.
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется.
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Видеоопыт изучения среды раствора анилина можно посмотреть здесь.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).
Видеоопыт бромирования анилина можно посмотреть здесь.
Получение аминов
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
- Восстановление сульфидом аммония:
- Алюминий в щелочной среде.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
Видеоопыт взаимодействия хлорида диметиламмония с щелочью с образованием диметиламина можно посмотреть здесь.
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
Амины
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н+.
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H+.
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
C6H5-NO2 + 3Fe + 7HCl = [C6H5-NH3]+Cl- + 3FeCl2 + 2H2O
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
[C6H5-NH3]+Cl— + NaOH = C6H5-NH2 + NaCl + H2O
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
С6H5−Cl + 2NH3 → C6H5NH2 + NH4Cl
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
NH2CH2COOH + CH3OH → NH2CH2COOCH3+ H2O
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
NH2CH2COOH + HCl → [NH3CH2COOH]+Cl—
2. Взаимодействие с азотистой кислотой
NH2-CH2-COOH + HNO2 → НО-CH2-COOH + N2↑ + H2O
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
3. Алкилирование
NH2CH2COOH + CH3I → [CH3NH2CH2COOH]+I—
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
И аланина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
Cl-CH2-COOH + 2NH3 = NH2-CH2-COOH + NH4Cl
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
Азотсодержащие органические соединения. ЕГЭ по химии: теория и практика
- 23.03.2014
Публикуем теоретические и практические задания, которые необходимы при подготовке к ЕГЭ по химии.
Тема: Азотсодержащие органические соединения
Весь материал соответствует кодификатору ЕГЭ по химии. В конце каждого теоретического блока публикуются практические задания с правильными ответами. Вы можете сразу же проверять качество пройденного материала.
Смотреть в PDF:
Или прямо сейчас: Скачайте в pdf файле.
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Азотсодержащие
органические соединения – задачи 35
1.
Некоторое
органическое соединение, помимо углерода и водорода, содержит азот, массовая
доля которого 23,7 %. Это соединение обладает нециклическим строением,
взаимодействует с соляной кислотой с образованием соли, молекула его содержит
два углеводородных радикала. На основании этих данных:
1)
произведите вычисления, необходимые для установления молекулярной формулы
органического вещества;
2)
запишите молекулярную формулу исходного органического вещества;
3)
составьте структурную формулу этого вещества, которая однозначно отражает
порядок связи атомов в его молекуле;
4)
приведите уравнение реакции его взаимодействия с соляной кислотой.
Пояснение.
1)
Нециклическое соединение, содержащее азот и дающее соль при реакции с соляной
кислотой, — это амин. Так как имеется 2 углеводородных радикала, то амин
вторичный.
2)
молекулярная формула
3)
структурная формула
4)
уравнение реакции →
2.
При
сгорании некоторого органического вещества массой 20,6 г получили 17,92 л
углекислого газа (н. у.), 2,24 л азота (н. у.) и 16,2 г воды. При нагревании с
раствором гидроксида калия данное вещество подвергается гидролизу, продуктами
которого являются соль природной аминокислоты и этанол.
На основании
данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы исходного
органического вещества;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу этого вещества, которая отражает порядок связей атомов
в молекуле;
4)
напишите уравнение реакции гидролиза этого вещества в присутствии гидроксида
калия.
Пояснение.
1)
Вычислим количества веществ углекислого газа, азота и воды, образующихся при
сгорании органического вещества, а также количества и массы входящих в них
элементов:
отсюда
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав органического
соединения:
Обозначим
молекулярную формулу органического вещества как CxHyNzOw,
тогда
2) Молекулярная
формула органического соединения – C4H9NO2.
3)
Поскольку исходное органическое вещество подвергается гидролизу и при гидролизе
в присутствии гидроксида калия образуются соль природной аминокислоты и этанол,
то этим веществом является этиловый эфир аминоуксусной кислоты:
4) В
присутствии гидроксида калия этиловый эфир аминоуксусной кислоты гидролизуется
с образованием аминоацетата калия и этанола:
3.
При
сгорании некоторого органического вещества массой 35,1 г получили 33,6 л углекислого
газа (н. у.), 3,36 л азота (н. у.) и 29,7 г воды. При нагревании с раствором
гидроксида калия данное вещество подвергается гидролизу, продуктами которого
являются соль природной аминокислоты и вторичный спирт.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы исходного
органического вещества;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу этого вещества, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции гидролиза этого вещества в присутствии гидроксида
калия.
Пояснение.
1)
Вычислим количества веществ углекислого газа, азота и воды, образующихся при
сгорании органического вещества, а также количества и массы входящих в них
элементов:
отсюда
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав органического
соединения:
Обозначим
молекулярную формулу органического вещества как CxHyNzOw,
тогда
2)
Молекулярная формула органического соединения – C5H11NO2.
3)
Поскольку исходное органическое вещество подвергается гидролизу и при гидролизе
в присутствии гидроксида калия образуется соль природной аминокислоты
(аминоацетат калия) и вторичный спирт (изопропанол), то этим соединением
является изопропиловый эфир аминоуксусной кислоты:
4) В
присутствии гидроксида калия изопропиловый эфир аминоуксусной кислоты
гидролизуется с образованием аминоацетата калия и изопропанола:
4.
При
сгорании некоторого органического вещества массой 17,55 г получили 16,8 л
углекислого газа (н. у.), 1,68 л азота (н. у.) и 14,85 г воды. При нагревании с
раствором гидроксида натрия данное вещество подвергается гидролизу, продуктами
которого являются соль природной аминокислоты и вторичный спирт.
На основании
данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы исходного
органического вещества;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу этого вещества, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции гидролиза этого вещества в присутствии гидроксида
натрия.
Пояснение.
1)
Вычислим количества веществ углекислого газа, азота и воды, образующихся при
сгорании органического вещества, а также количества и массы входящих в них
элементов:
отсюда
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав органического
соединения:
Обозначим
молекулярную формулу органического вещества как CxHyNzOw,
тогда
2)
Молекулярная формула органического соединения — C5H11NO2.
3)
Поскольку исходное органическое вещество подвергается гидролизу и при гидролизе
в присутствии гидроксида натрия образуется соль природной аминокислоты
(аминоацетат натрия) и вторичный спирт (изопропанол), то этим соединением
является изопропиловый эфир аминоуксусной кислоты:
4) В
присутствии гидроксида натрия изопропиловый эфир аминоуксусной кислоты
гидролизуется с образованием аминоацетата натрия и изопропанола:
4.
При
сгорании некоторого органического вещества массой 4,68 г получили 4,48 л
углекислого газа (н. у.), 448 мл азота (н. у.) и 3,96 г воды. При нагревании с
раствором гидроксида натрия данное вещество подвергается гидролизу, продуктами
которого являются соль природной аминокислоты и вторичный спирт.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы исходного
органического вещества;
2) установите
его молекулярную формулу;
3)
составьте структурную формулу этого вещества, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции гидролиза этого вещества в присутствии гидроксида
натрия.
Пояснение.
1)
Вычислим количества веществ углекислого газа, азота и воды, образующихся при
сгорании органического вещества, а также количества и массы входящих в них
элементов:
отсюда
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав органического
соединения:
Обозначим
молекулярную формулу органического вещества как CxHyNzOw,
тогда
2)
Молекулярная формула органического соединения — C5H11NO2.
3)
Поскольку исходное органическое вещество подвергается гидролизу и при гидролизе
в присутствии гидроксида натрия образуются соль природной аминокислоты
(аминоацетат натрия) и вторичный спирт (изопропанол), то этим соединением
является изопропиловый эфир аминоуксусной кислоты:
4) В
присутствии гидроксида натрия изопропиловый эфир аминоуксусной кислоты
гидролизуется с образованием аминоацетата натрия и изопропанола:
6.
При
сгорании некоторого органического вещества массой 4,12 г получено 3,584 л
углекислого газа (н. у.), 448 мл азота (н. у.) и 3,24 г воды. При нагревании с соляной
кислотой данное вещество подвергается гидролизу, продуктами которого являются
соединения состава и
спирт.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы исходного
органического вещества;
2) установите
его молекулярную формулу;
3)
составьте структурную формулу этого вещества, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции гидролиза этого вещества в присутствии соляной
кислоты.
Пояснение.
1)
Вычислим количества веществ углекислого газа, азота и воды, образующихся при
сгорании органического вещества, а также количества и массы входящих в них
элементов:
отсюда
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав органического
соединения:
Обозначим
молекулярную формулу органического вещества CxHyNzOw,
тогда
2)
Молекулярная формула органического соединения — C4H9NO2.
3)
Поскольку исходное органическое вещество подвергается гидролизу и при гидролизе
в присутствии соляной кислоты образует соединение C2H6NO2Cl
(гидрохлорид аминоуксусной кислоты) и спирт (этанол), то этим соединением
является этиловый эфир аминоуксусной кислоты:
4) В
присутствии соляной кислоты этиловый эфир аминоуксусной кислоты гидролизуется с
образованием гидрохлорида аминоуксусной кислоты и этанола (помимо гидролиза
хлороводород образует соль с молекулой глицина):
7.
При
сжигании дипептида природного происхождения массой 6,4 г получено 5,376 л
углекислого газа (н. у.), 896 мл азота (н. у.) и 4,32 г воды. При
гидролизе этого вещества в присутствии соляной кислоты образовалась только одна
соль.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы дипептида;
2) установите
его молекулярную формулу;
3)
составьте структурную формулу дипептида, которая отражает порядок связей атомов
в молекуле;
4)
напишите уравнение реакции гидролиза этого дипептида в присутствии соляной
кислоты.
Пояснение.
1)
Вычислим количества веществ углекислого газа, азота и воды, образующихся при
сгорании дипептида, а также количества и массы входящих в них элементов:
отсюда
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав дипептида:
Обозначим
молекулярную формулу дипептида как CxHyNzOw,
тогда
2)
Молекулярная формула дипептида – C6H12N2O3.
3)
Поскольку при гидролизе дипептида в присутствии соляной кислоты образуется
только одна соль, то этой солью является гидрохлорид метиламиноуксусной
кислоты. Структурная формула дипептида представляет собой:
4) В
присутствии соляной кислоты дипептид аланилаланин гидролизуется с образованием
соли — гидрохлорида метиламиноуксусной кислоты:
8.
При
сжигании дипептида природного происхождения массой 3,2 г получено 2,688 л
углекислого газа (н. у.), 448 мл азота (н. у.) и 2,16 г воды. При гидролизе
этого вещества в присутствии гидроксида калия образовалась только одна соль.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы дипептида;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу дипептида, которая отражает порядок связей атомов
в молекуле;
4)
напишите уравнение реакции гидролиза этого дипептида в присутствии гидроксида
калия.
Пояснение.
1)
Вычислим количества веществ углекислого газа, азота и воды, образующихся при
сгорании дипептида, а также количества и массы входящих в них элементов:
отсюда
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав дипептида:
Обозначим
молекулярную формулу дипептида как CxHyNzOw,
тогда
2)
Молекулярная формула дипептида – C6H12N2O3.
3)
Поскольку при гидролизе дипептида в присутствии гидроксида калия образуется
только одна соль, то этой солью является метиламиноацетат калия. Структурная
формула дипептида представляет собой:
4) В
присутствии гидроксида калия дипептид аланилаланин гидролизуется с образованием
соли — метиламиноацетата калия:
———————————————————————————————————
Примечание: по
данным, приведенным в условии задачи, невозможно однозначно определить структурную
формулу вещества. Кроме предложенного пептида, образованного 2-аминопропановой
кислотой (-аланин),
условию задачи соответствует и пептид, образованный 3-аминопропановой кислотой
(-аланин)
9.
Некоторое
вещество, представляющее собой соль органического происхождения, содержит по
массе 12,79 % азота, 43,84 % углерода и 32,42 % хлора и
образуется при взаимодействии первичного амина с хлорэтаном.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы исходного
органического вещества;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу этого вещества, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции получения этого вещества из первичного амина и
хлорэтана.
Пояснение.
1)
Обозначим молекулярную формулу органического вещества как CxHyNzClw и
вычислим процентное содержание водорода:
Количества
атомов в молекуле вещества соотносятся между собой следующим образом:
2)
Молекулярная формула исходного органического вещества – C4H12NCl.
3)
Первичным амином является этиламин
Солью,
образующейся из этиламина и этилхлорида, является хлорид диэтиламмония
4)
Получить хлорид диэтиламмония можно реакцией присоединения этиламина с
хлорэтаном:
10.
Некоторое
органическое вещество А содержит по массе 10,68 % азота, 54,94 %
углерода и 24,39 % кислорода и образуется при взаимодействии вещества Б с
пропанолом-1 в молярном отношении 1 : 1. Известно, что вещество Б является
природной аминокислотой.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы вещества А;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу вещества А, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции получения вещества А из вещества Б и н-пропанола.
Пояснение.
1)
Обозначим молекулярную формулу вещества А как CxHyNzOw и
вычислим процентное содержание водорода:
Атомы в
молекуле вещества А соотносятся между собой следующим образом:
2)
Молекулярная формула вещества — C6H13NO2.
3)
Природной аминокислотой (веществом Б) является аланин
Веществом
А является н-пропиловый эфир метиламиноуксусной кислоты, структурная формула
которого
4)
Получить н-пропиловый эфир метилуксусной кислоты можно реакцией этерификации
н-пропанола с аланином в присутствии катализатора — серной кислоты:
—————————
Примечание: по
данным, приведенным в условии задачи, невозможно однозначно определить
структурную формулу вещества Б. Кроме предложенной 2-аминопропановой кислоты (-аланин),
условию задачи соответствует и 3-аминопропановая кислота (-аланин)
11.
Некоторое
органическое вещество А содержит по массе 13,58 % азота, 46,59 %
углерода и 31,03 % кислорода и образуется при взаимодействии вещества Б с
этанолом в молярном отношении 1:1. Известно, что вещество Б имеет природное
происхождение.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы вещества А;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу вещества А, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции получения вещества А из вещества Б и этанола.
Пояснение.
1)
Обозначим молекулярную формулу органического вещества А как CxHyNzOw и
вычислим процентное содержание водорода:
Атомы в
молекуле вещества А соотносятся между собой следующим образом:
2)
Молекулярная формула вещества А – C4H9NO2.
3)
Веществом Б природного происхождения является аминокислота глицин
Веществом
А является этиловый эфир аминоуксусной кислоты, структурная формула которого
4)
Получить этиловый эфир аминоуксусной кислоты можно реакцией этерификации
этилового спирта с глицином в присутствии катализатора — серной кислоты:
12.
При
сжигании дипептида природного происхождения массой 2,64 г получено 1,792 л
углекислого газа (н. у.), 1,44 г воды и 448 мл азота (н. у.). При гидролизе
этого вещества в присутствии соляной кислоты образовалась только одна соль.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы дипептида;
2) установите
его молекулярную формулу;
3)
составьте структурную формулу дипептида, которая отражает порядок связей атомов
в молекуле;
4)
напишите уравнение реакции гидролиза этого дипептида в присутствии соляной
кислоты.
Пояснение.
1)
Вычислим количества веществ углекислого газа, азота и воды, образующихся при
сгорании дипептида, а также количества и массы входящих в них элементов:
отсюда
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав дипептида:
Обозначим
молекулярную формулу дипептида как CxHyNzOw,
тогда
2)
Молекулярная формула дипептида — C4H8N2O3.
3)
Поскольку при гидролизе дипептида в присутствии соляной кислоты образуется
только одна соль, то этой солью является гидрохлорид аминоуксусной кислоты.
Структурная формула дипептида представляет собой:
4) В
присутствии соляной кислоты дипептид глицилглицин гидролизуется с образованием
соли — гидрохлорида аминоуксусной кислоты:
13.
Соль
первичного амина прореагировала с нитратом серебра, в результате чего выделился
осадок и
образовалось органическое вещество А, содержащее по массе 29,79 % азота,
51,06 % кислорода и 12,77 % углерода.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы вещества А;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу этого вещества А, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции получения вещества А из соли первичного амина
и .
Пояснение.
1) Запишем
уравнение реакции получения вещества А из соли первичного амина с нитратом
серебра:
Обозначим
органическое вещество А как CxHyNzOw и
вычислим процентное содержание водорода:
ω(H)% = 100% – 29,79% – 51,06% – 12,77% = 6,38%.
x : y : z : w = 12,77/12 : 6,38/1 : 29,79/14 : 51,06/16 = 1,064 :
6,380 : 2,128 : 3,191 = 1 : 6 : 2 : 3.
2)
Молекулярная формула вещества А — CH6N2O3.
3) Солью
первичного амина является гидробромид метиламина [CH3-NH3]+Br−.
Веществом
А является азотнокислая соль метиламина [CH3-NH3]+NO3−.
4)
Получить азотнокислую соль метиламина можно реакцией гидробромида метиламина с
нитратом серебра (в осадок выпадает бромид серебра):
.
14.
При
сгорании 40,95 г органического вещества получили 39,2 л углекислого газа (н.
у.), 3,92 л азота (н. у.) и 34,65 г воды. При нагревании с соляной кислотой
данное вещество подвергается гидролизу, продуктами которого являются соединения
состава и
вторичный спирт.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы исходного
органического вещества;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу этого вещества, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции гидролиза этого вещества в присутствии соляной
кислоты.
Пояснение.
1)
Вычислим количества веществ углекислого газа, азота и воды, образующихся при
сгорании органического вещества, а также количества и массы входящих в них
элементов:
отсюда
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав органического
соединения:
Обозначим
молекулярную формулу органического вещества CxHyNzOw,
тогда
2)
Молекулярная формула органического соединения — C5H11NO2.
3)
Поскольку исходное органическое вещество подвергается гидролизу и при гидролизе
в присутствии соляной кислоты образует соединение C2H6NO2Cl
(гидрохлорид глицина) и вторичный спирт (изопропанол), то этим соединением
является изопропиловый эфир аминоуксусной кислоты:
4) В
присутствии соляной кислоты изопропиловый эфир аминоуксусной кислоты
гидролизуется с образованием гидрохлорида глицина и изопропанола (помимо
гидролиза хлороводород образует соль с молекулой глицина):
15.
Некоторое
органическое вещество А содержит по массе 11,97 % азота, 51,28 %
углерода, 27,35 % кислорода, и водород. А образуется при взаимодействии
вещества Б с пропанолом-2 в молярном соотношении 1 : 1. Известно, что
вещество Б имеет природное происхождение.
На
основании данных условия задачи:
1)
Произведите вычисления, необходимые для нахождения формулы вещества А;
2)
Установите его молекулярную формулу;
3)
Составьте структурную формулу вещества А, которая отражает порядок связей
атомов в молекуле;
4)
Напишите уравнение реакции получения вещества А из вещества Б и пропанола-2.
Пояснение.
1)
Обозначим молекулярную формулу органического вещества А как и
вычислим процентное содержание водорода:
Атомы в
молекуле вещества А соотносятся между собой следующим образом:
2)
Молекулярная формула вещества А —
3)
Веществом Б природного происхождения является аминокислота глицин:
Веществом
А является изопропиловый эфир аминоуксусной кислоты, структурная формула
которого
4)
Получить изопропиловый эфир аминоуксусной кислоты можно реакцией этерификации
изопропилового спирта с глицином (в присутствии катализатора — серной кислоты):
16.
При восстановлении
20,6 г мононитроалкана водородом в газовой фазе образовалось
10,95 г амина. Выход продукта составил 75 %. Установите молекулярную
формулу мононитроалкана. Изобразите его структурную формулу, если
известно, что он имеет оптические изомеры. Напишите уравнение реакции
этого вещества с цинком в солянокислой среде.
Пояснение.
1) Написано
уравнение или схема реакции в общем виде.
или
2) Установлена
молекулярная формула мононитроалкана.
Молекулярная
формула —
3) Изображена
структурная формула.
Из четырёх
структурных изомеров оптические
изомеры имеет только 2-нитробутан, в составе которого есть асимметрический
атом углерода:
4) Написано
уравнение реакции с цинком в солянокислой среде:
или