Вирус (лат. virus — яд) — неклеточная форма жизни, мельчайшие болезнетворные микроорганизмы, не видимые в микроскоп.
Они значительно меньше бактерий: легко проходят через бактериальные фильтры.
Вирусы способны размножаться только внутри живых клеток, до проникновения в них вирусы не имеют признаков жизни: пассивно перемещаются во
внешней среде, ожидая встречи с клеткой-мишенью.
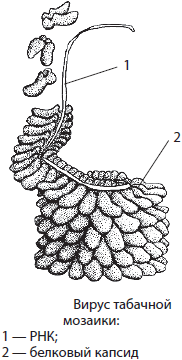
В 1892 году Ивановский Д.И. в ходе изучения мозаичной болезни табака обнаружил, что болезнь вызывается мельчайшими субстанциями, которые проходят через бактериальный фильтр, то есть были меньше бактерий. Вирусы
впервые увидели в электронный микроскоп в 1939 году (спустя 19 лет со смерти Ивановского), однако считается, что именно Ивановский
положил начало вирусологии как науке.

Вирусы выделяют в отдельное, пятое царство. Несмотря на их кажущуюся безжизненность, от неживой материи их отличают следующие черты:
- Наличие наследственности и изменчивости
- Способность к репродукции (воспроизведению себе подобных)
Рекомендую обратить особое внимание на черты, которые отличают вирусы от живых организмов:
- Неживое (инертное) состояние
- Обмен веществ
- Неклеточное строение
- Не делятся, не размножаются половым путем
- Не растут
Вне клетки хозяина находятся в неживом состоянии, ожидая внедрения. Вирусы — облигатные внутриклеточные паразиты.
У вирусов отсутствует обмен веществ с внешней средой (метаболизм).
Не имеют клеточной мембраны, ограничивающих их от внешней среды, и, соответственно, клеточного строения.
У вирусов отсутствует половое размножение и деление. Попав в живую клетку, вирус встраивает свою нуклеиновую кислоту (РНК/ДНК) в наследственный
материал клетки-мишени. В результате клетка начинает синтезировать вирусные белки (новые вирусы): так увеличивается численность вирусов.
Вирусы не растут, не увеличиваются в размерах. Стратегия их жизни — безудержное размножение.
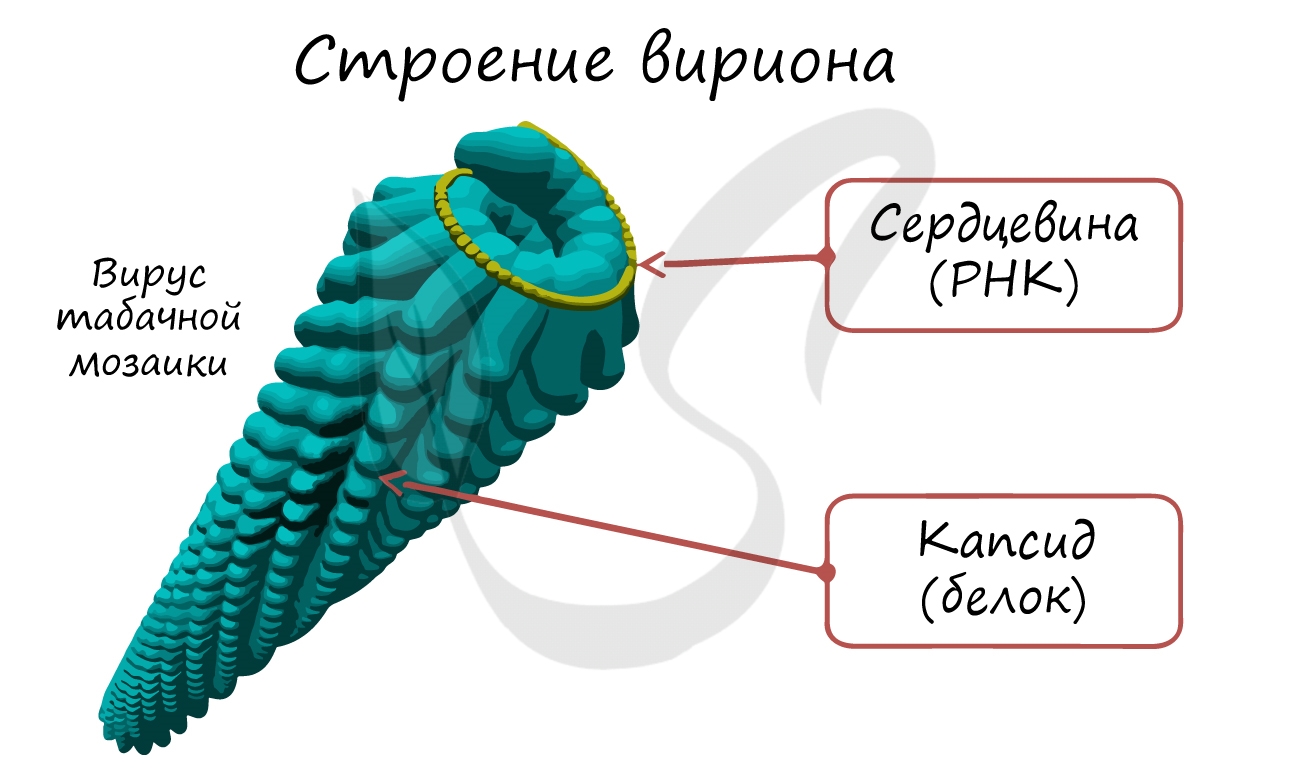
Если мы заглянем в клетку, инфицированную вирусом, то от вируса мы увидим только один элемент — его нуклеиновую кислоту (ДНК/РНК). Во внешней
среде вирусы существуют в виде вирионов — полностью сформированных вирусных частиц, состоящих из белковой оболочки (капсида) и нуклеиновой
кислоты внутри.
Носителем наследственной информации у вирусов может быть ДНК, РНК. В связи с этим все вирусы подразделяются на ДНК- и РНК-содержащие.
Взаимодействие вируса с клеткой
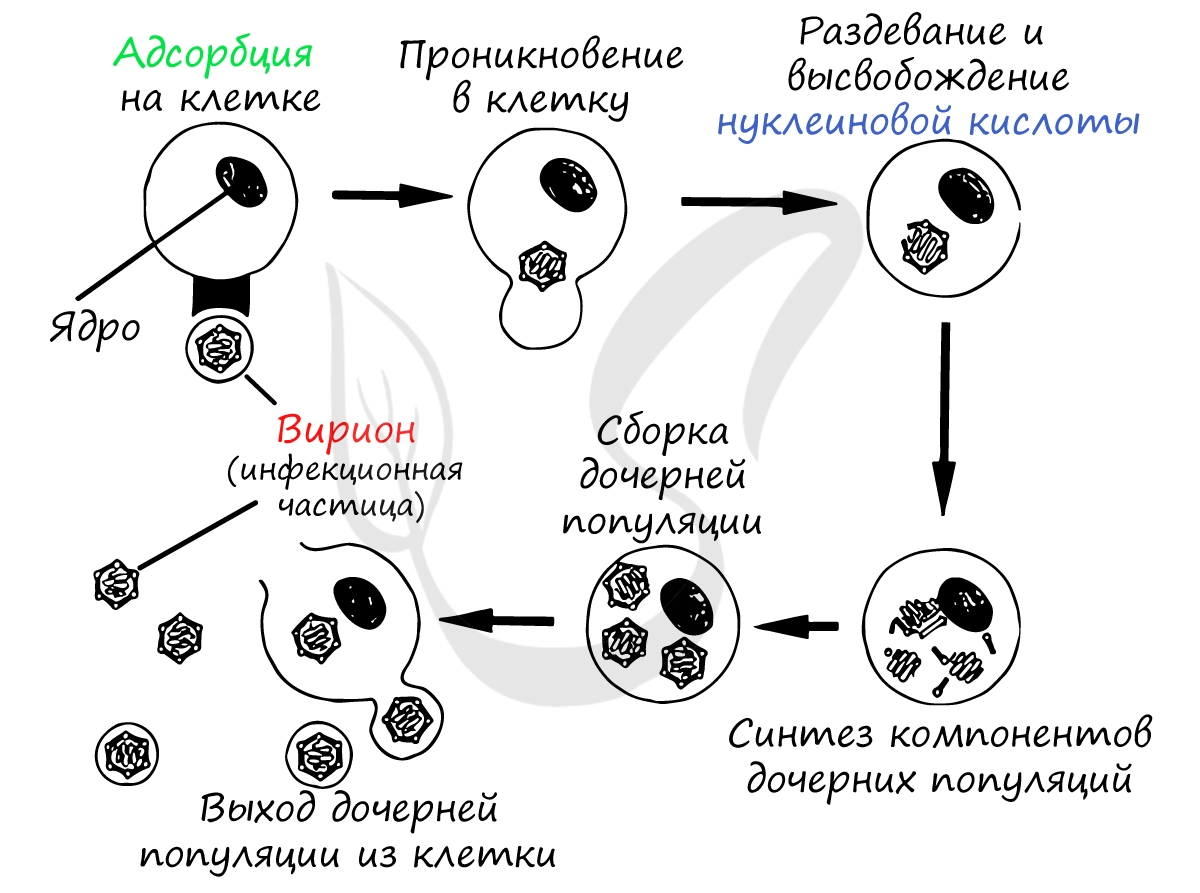
Найдя клетку, на поверхности которой есть подходящий рецептор, вирус взаимодействует с ним и прикрепляется к мембране клетки. Путем эндоцитоза (образование вакуоли) вирус
проникает внутрь клетки, выходит из вакуоли в цитоплазму. Наследственный материал (ДНК/РНК) вируса реализуется по схеме: ДНК ↔ РНК → белок.
Проникнув внутрь клетки (инфицировав ее), вирус реализует собственный генетический материал (ДНК/РНК) путем синтеза вирусного белка на рибосомах клетки хозяина. Клетка даже и не подозревает, что вирус встроил в ее РНК/ДНК свой генетический код — она принимает его как свой собственный, а в результате синтезирует вирусные белки.
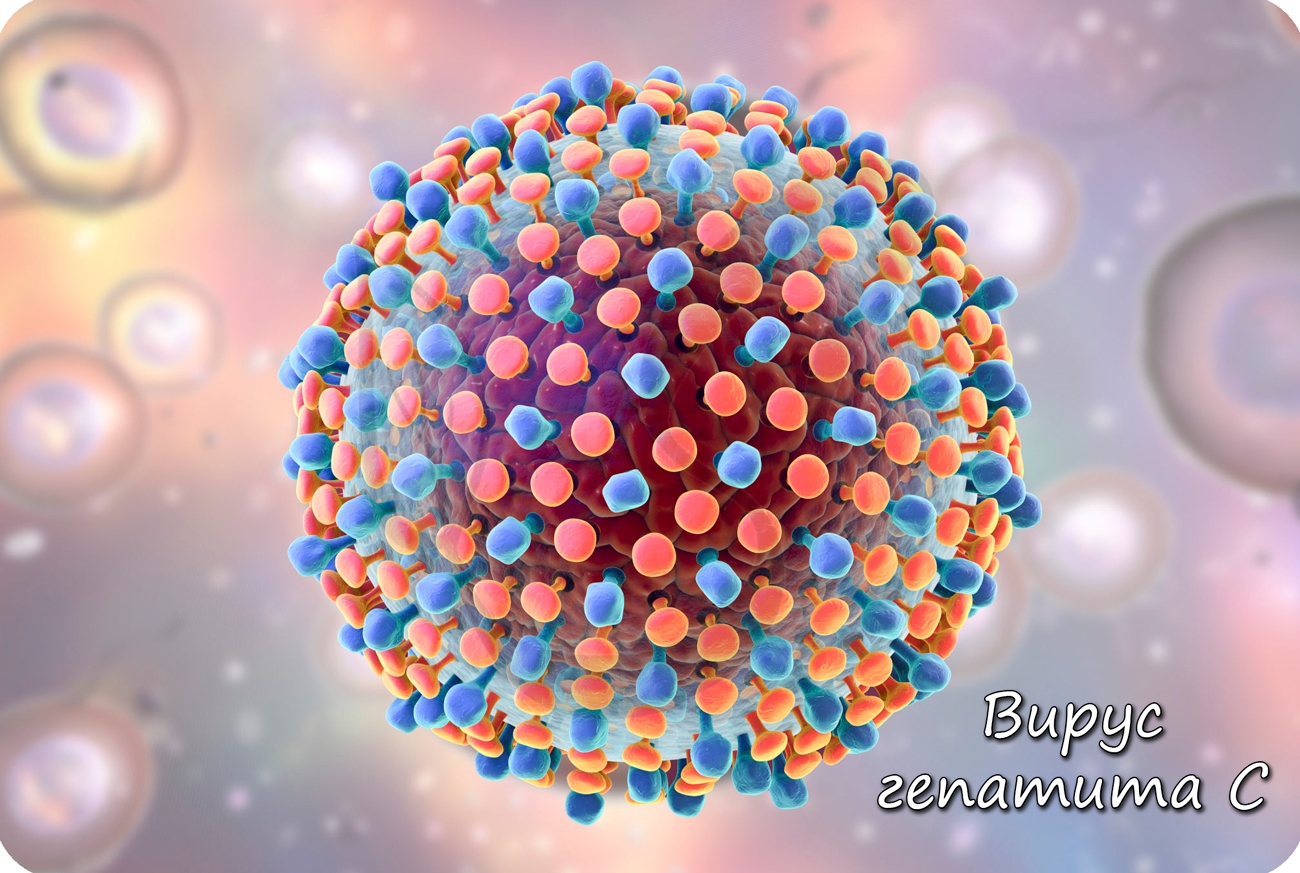
Образовавшиеся белки объединяются в вирусные частицы, которые могут выходить из клетки разными путями. Вирионы вирусов гепатита C выходят из
клетки путем почкования (экзоцитозом), при таком варианте клетка долгое время остается живой и служит для продукции новых вирионов.
Известен и другой механизм выхода вирионов из клетки: взрывной, при котором оболочка клетки разрывается, и тысячи вирионов отправляются
инфицировать новые клетки. Такой способ характерен для аденовирусов, ротавирусов.
Бактериофаги («бактерия» + греч. phag(os) — пожирающий)
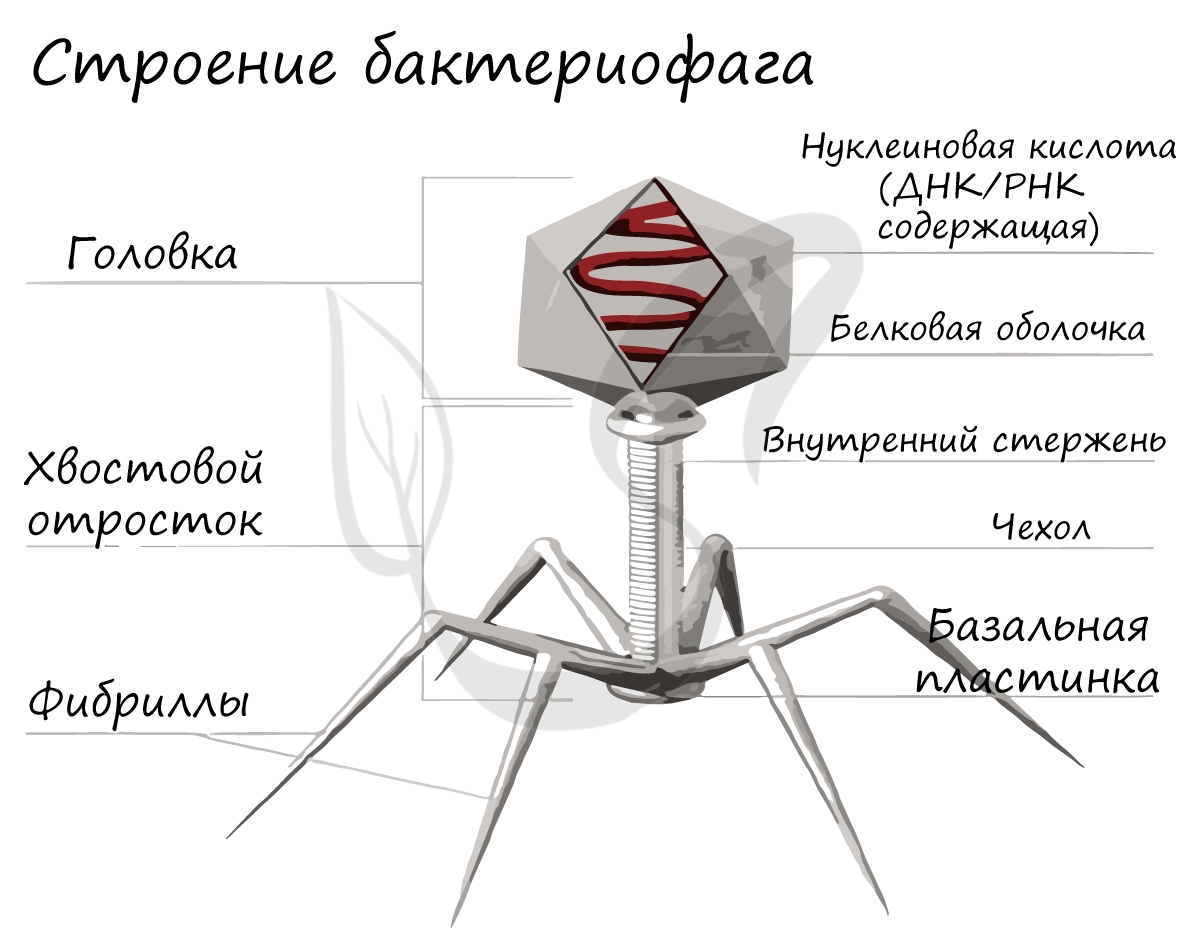
Это уникальная группа вирусов, инфицирующая только бактерии. Бактериофаг имеет капсид, с содержащимся внутри наследственным материалом — ДНК (реже РНК),
протеиновым хвостом. Бактериофаги открыты в 1915 году и с тех пор активно применяются в ходе генетических исследований.
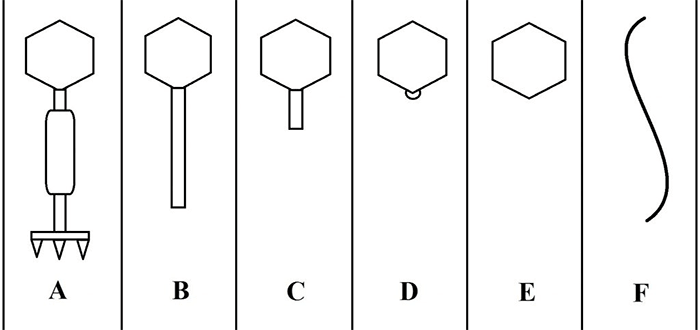
Ниже вы можете видеть типичное строение бактериофага. Бактериофаг напоминает шприц, который протыкает стенку бактерии и впрыскивает внутрь нее
свою нуклеиновую кислоту.
Бактериофаги успешно применяются в медицине для лечения многих заболеваний. Это высокоэффективные, дорогостоящие препараты, которые помогают, например, нормализовать микрофлору кишечника при бактериальных инфекциях.
Вирусные инфекции
Вирусы вызывают множество заболеваний человека и животных. Некоторые из них неизлечимы даже на современном этапе развития медицины,
например бешенство. К вирусным инфекциям относятся грипп, корь, свинка, СПИД (вызванный ВИЧ), полиомиелит, желтая лихорадка, онковирусы.
Такая группа, как онковирусы, потенцируют развитие опухолей в организме. К ВИЧ и онкогенным вирусам не существует специфических антител, что
затрудняет процесс создания вакцины. В то же время против ряда вирусных инфекций: корь, ветряная оспа созданы вакцины, создающие
стойкий пожизненный иммунитет.
Клетки вырабатывают защитный белок — интерферон. Это вещество подавляет синтез новых вирусных частиц, приводит к повышению температуры
тела (например, при гриппе).

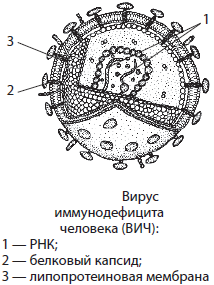
Вирус иммунодефицита человека (ВИЧ) представляет для организма большую опасность. Он размножается в T-лимфоцитах — клетках крови, которые
выполняют иммунную функцию. С гибелью T-лимфоцитов разрушается иммунная система, становится невозможным сопротивление организма бактериями, вирусам и грибам, что в отсутствии лечения приводит к вторичным инфекциям.
Риск заражения ВИЧ присутствует при гемотрансфузии (переливании крови), половом акте. Инфекция также может быть передана
от ВИЧ инфицированной матери к плоду.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 30 1–20 | 21–30
Добавить в вариант
В 1952 году А. Херши и М. Чейз проведен эксперимент, вошедший в историю молекулярной биологии. Они
получили две группы бактериофагов Т2: первые имели в составе радиоактивную серу S35, а вторые — радиоактивный фосфор P32. Когда фагами из первой группы заражали культуру бактерий, все радиоактивные изотопы серы оказывались в питательной среде, но не проникали в клетки бактерий. При заражении бактерий фагами из второй группы радиоактивный фосфор обнаруживался внутри клеток бактерий, а не в питательной среде. Объясните результаты эксперимента. Какой метод применили ученые? В состав каких органических веществ и компонентов бактериофага включались радиоактивные изотопы серы и фосфора? Какие параметры задавались самими экспериментаторами (независимые переменные), а какие параметры менялись в зависимости от этого (зависимые переменные)?
Источник/автор: Ольга Саблина
Задания Д1 № 104
Клеточное строение — важный признак живого — характерен для
Какие объекты не имеют клеточного строения?
1) дизентерийная амёба
2) возбудитель СПИДа
3) вирус табачной мозаики
4) кишечная палочка
5) вибрион холеры
6) бактериофаг
К неклеточным формам жизни относятся
Источник: Демонстрационная версия ЕГЭ—2013 по биологии
На рисунке изображен
Источник: Яндекс: Тренировочная работа ЕГЭ по биологии. Вариант 1.
Митотическое деление наиболее характерно для клеток
1) зрелых эритроцитов крови человека
4) бактериофагов
Выберите три правильных ответа из шести. В надцарство Эукариоты входят
1) инфузория-туфелька
2) стафиллококки
3) бактериофаги
4) дизентерийная амёба
5) холерный вибрион
6) малярийный плазмодий
Источник: ЕГЭ по биологии 30.05.2013. Основная волна. Дальний Восток. Вариант 2.
Источник: ЕГЭ по биологии 30.05.2013. Основная волна. Дальний Восток. Вариант 3.
Что из перечисленного изображено на рисунке?
2) клетка кишечной палочки
3) бактериофаг
4) холерный вибрион
Укажите пример автотрофного организма.
Безъядерные клетки характерны для
1) бактериофагов
2) бацилл
3) одноклеточных водорослей
4) дизентерийной амёбы
Неклеточное строение имеет
1) бактериофаг
2) чумная бацилла
3) эритроцит
4) малярийный плазмодий
Клеточная мембрана отсутствует у
1) клеток тополя
2) палочки Коха
3) бактериофагов
4) клеток мыши
Хозяином бактериофага является
1) кишечная палочка
2) домашняя муха
3) собака
4) дизентерийная амёба
Выберите два верных ответа из пяти и запишите цифры, под которыми они указаны. Клеточный уровень организации совпадает с организменным у
1) бактериофагов
2) амёбы дизентерийной
3) вируса полиомиелита
4) кролика дикого
5) эвглены зелёной
Источник: РЕШУ ЕГЭ
Установите соответствие между признаками биологического объекта и объектом, к которому относится данный признак: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
ПРИЗНАКИ ОБЪЕКТА
А) состоит из нуклеиновой кислоты и капсида
Б) клеточная стенка из муреина
В) вне организма находится в виде кристаллов
Г) может находиться в симбиозе с человеком
Д) имеет рибосомы
Е) имеет хвостовой канал
ОБЪЕКТ
1) бактериофаг
2) кишечная палочка
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| А | Б | В | Г | Д | Е |
Рассмотрите таблицу «Биологические науки». Запишите в ответе пропущенный термин, обозначенный в таблице вопросительным знаком.
Биологические науки
| Наука | Области применения |
|---|---|
| Таксономия | создание принципов классификации и
систематизации организмов |
| ? | изучение морфологии и физиологии
бактериофагов, возбудителей гриппа и ОРВИ |
Задания Д9 № 608
К прокариотам относятся
2) бактерии и синезеленые
3) водоросли и простейшие
4) грибы и лишайники
Всего: 30 1–20 | 21–30
На этой странице Вы узнаете
- Жизнь в постоянном анабиозе: что позволяет вирусным частицам не выходить из “спячки”?
- Вирусы vs бактерии: кто кого заражает?
- Что общего имеют раковые заболевания с вирусными инфекциями?
Вирусы знакомы нам с самого детства: именно они виноваты в том, что приходится неделями лежать дома вместо того, чтобы гулять с друзьями. Но вирусы могут быть не только вредными. Некоторые представители группы даже используются в медицине для лечения других инфекций. О том, кто такие вирусы и как их победить, вы узнаете в этой статье.
Общая характеристика вирусов
Вирусы были открыты в 1892 году ученым Д. И. Ивановским, который стал основоположником вирусологии.
Вирусы – неклеточная форма жизни.
Они являются внутриклеточными паразитами и могут проявлять свойства живого только внутри клетки-хозяина. В остальное время они будто спят: летают в воздухе в виде маленьких частиц и в буквальном смысле бездельничают.
Вирусы:
— не имеют клеточного строения;
— являются облигатными внутриклеточными паразитами;
— не имеют собственных систем метаболизма;
— имеют особый способ размножения.
Рассмотрим все эти особенности подробнее.
Формы вирусов
Вирусы существуют в двух формах: внеклеточной (или покоящейся) и внутриклеточной. Внеклеточная форма представлена вирионом. Вирион – это частица, которая не проявляет никаких свойств живого. Поэтому говорят, что вирусы – неклеточная форма жизни.

Облигатные внутриклеточные паразиты
Это организмы, которые просто не могут нормально жить вне организма хозяина. Вирусы совсем не умеют жить самостоятельно. Запомнить термин можно, используя ассоциацию. “Облигатный” схож по звучанию со словом “облачиться”: вирусы “облачились” в клетку хозяина, как в предмет нижнего белья, – и без него “в свет” ни в коем случае не выходят.
Отсутствие метаболизма
Метаболизм – это обмен веществ. Вне клетки хозяина вирусы не могут получать вещества из внешней среды и выделять продукты обмена. Вирионы не размножаются, не питаются, не вырабатывают тепло и не двигаются.
Просыпаются вирусы только тогда, когда попадают в благоприятные условия – в клетку хозяина. Вирус сразу заражает клетку и начинает в ней размножаться. Про размножение надо поговорить отдельно.
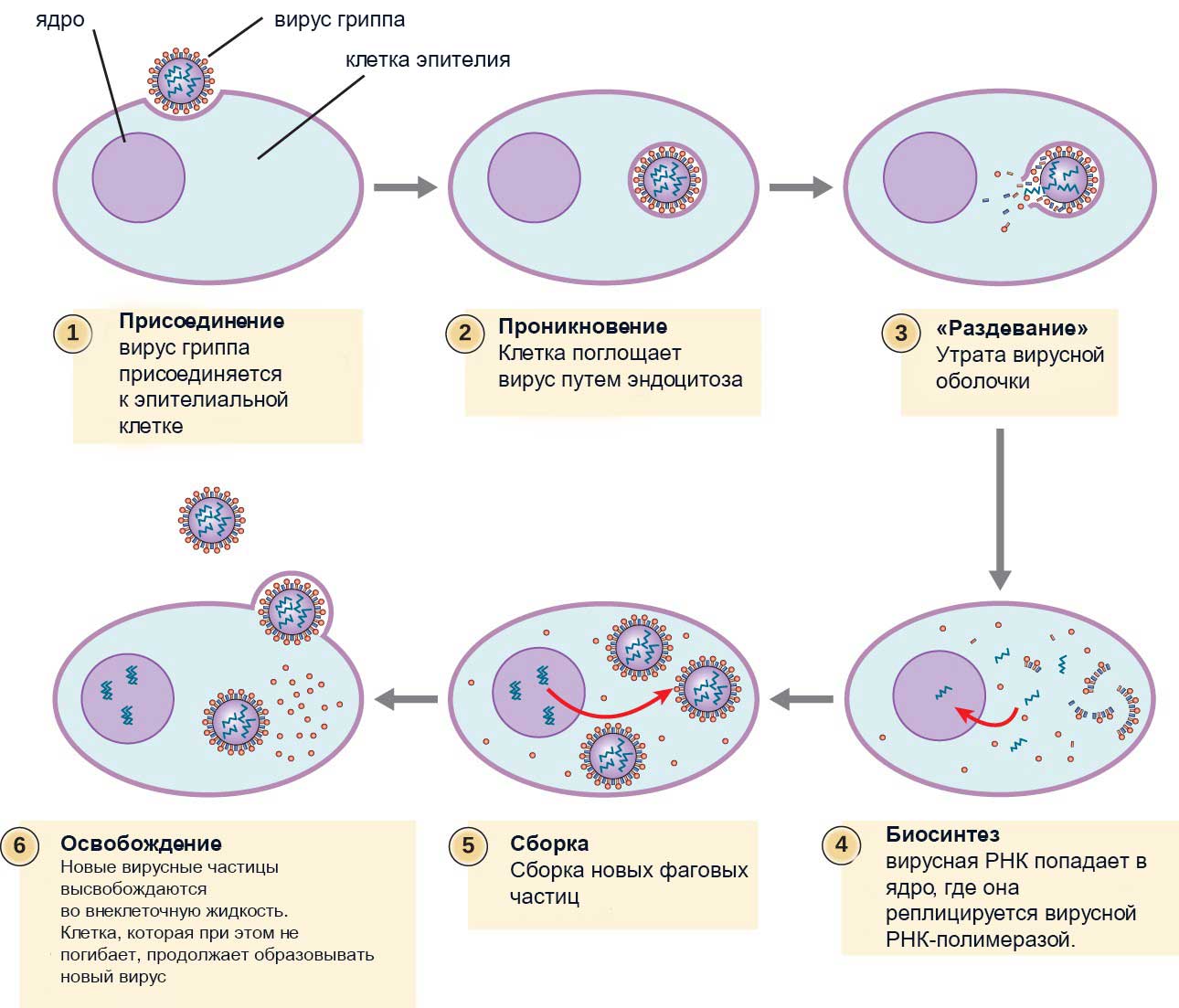
Размножение вирусов
Представим, что клетка – завод по производству необходимых для организма белков. Вирусы обманывают её и приносят “рабочим” – рибосомам – другую инструкцию. Так клетка перестает выполнять свои обычные функции и начинает производить вирусные белки. Получается, главная задача вируса – пройти через все этапы защиты клетки и принести неправильную инструкцию на место.
Как это происходит?
- При проникновении вируса внутрь клетки, сначала происходит связывание белков вирусной частицы с белками оболочки клетки.
- Затем происходит слияние клеточной мембраны и вирусной оболочки.
- Вирус проникает в клетку. Здесь содержимое вируса (ДНК или РНК и различные ферменты) освобождается.

- Если вирус содержит РНК, то репликация вирусного генома происходит с помощью фермента обратной транскриптазы. Благодаря ей идет процесс обратной транскрипции: образование вирусной ДНК по вирусной РНК. После этого достраивается вторая цепь ДНК, которая после будет внедряться в геном клетки-хозяина.
Если вирус содержит ДНК, то он сразу внедряет свой генетический материал в ДНК клетки-хозяина с помощью фермента интегразы. Запомним термин: интеграция – это внедрение. Фермент интеграза “разрезает” ДНК клетки-хозяина и “вклеивает” в нее ДНК вируса.
Благодаря всем этим событиям, в клетке начинается процесс синтеза вирусных белков. Таким образом клетка, вместо того, чтобы синтезировать нормальные для ее жизнедеятельности вещества, начинает производить вирусные белки. После этого они будут собираться в новые вирусы и высвобождаться из клетки хозяина.
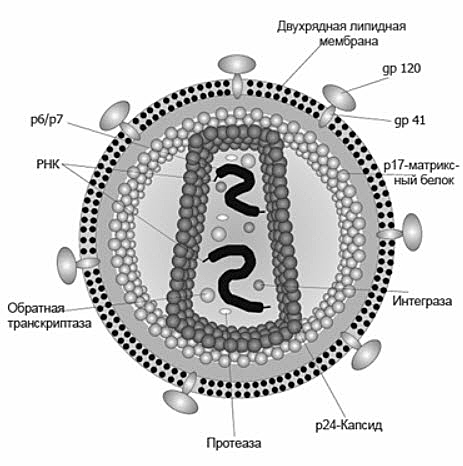
Строение вирусной частицы
В общем плане вирион (вирусная частица) состоит из:
- генетического материала — молекулы ДНК или РНК,
- и капсида (оболочки).
Однако есть более сложно устроенные вирусы, например, бактериофаги.
Бактериофаги (в переводе с греческого – «пожиратели бактерий») – вирусы, поражающие клетки бактерий. Это значит, что вирусы могут заразить и истребить целую колонию бактерий! Бактериофаги используют в медицине для лечения бактериальных инфекций.
Бактериофаги, или просто фаги – абсолютно естественные природные живые организмы. Благодаря тому, что они существуют практически в равном количестве с бактериями, численность последних строго сдерживается. Иначе, гипотетически, бактерии уже бы захватили весь мир.
Бактериофаги, используемые в медицине, имеют минимум побочных эффектов. Они воздействуют исключительно на клетки патогенных (вредных, опасных) бактерий, не затрагивая клетки человеческого организма.

Разберем строение бактериофага подробнее.
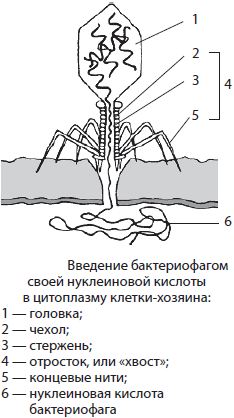
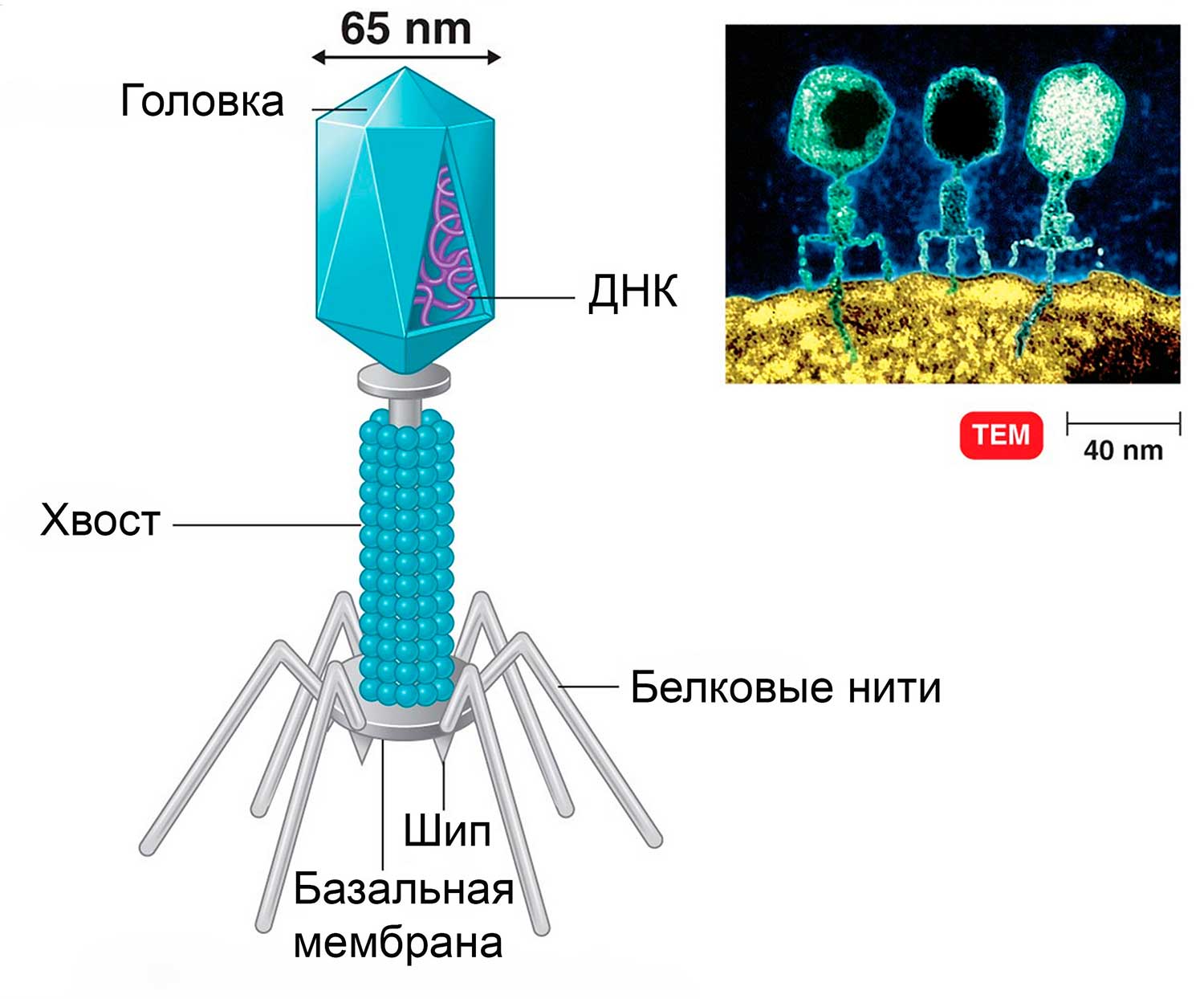
- Головка состоит из генетического материала и защитной оболочки – капсида. Эта часть примерно такая же, как классический вирион, изученный нами чуть раньше.
- Нити (фибриллы), как шасси у лунохода, первыми контактируют с поверхностью посадки – живой клеткой.
- Происходит “стыковка” – базальная пластинка прислоняется к клетке, приоткрывается и между клеткой и бактериофагом образуется проход для генетического материала. ДНК непременно должна поступить в клетку для последующего размножения.
- Стержневидный отросток покрыт сократительным чехлом. Эта часть нужна для того, чтобы ввести генетический материал в клетку хозяина. Стержневидный отросток – это своеобразный шприц, а сократительный чехол в ней действует как поршень, который своим движением проталкивает ДНК или РНК в клетку.
Разнообразие вирусов
Выделяют просто организованные вирусы и сложно организованные. Просто организованные вирусы, такие как бактериофаг, нам уже известны, а сложно организованные вирусы (например, вирус гриппа) имеют дополнительную защитную оболочку – суперкапсид.
В зависимости от нуклеиновой кислоты, входящей в состав вируса, различают ДНК-содержащие и РНК-содержащие вирусы.
Большинство вирусов животных и человека (около 80%) являются РНК-содержащими. Хранить наследственную информацию в молекуле РНК – это их уникальная способность. Геном вирусов может быть представлен различными видами нуклеиновых кислот: одно- или двухцепочечными, линейными или кольцевыми.

Вирусные инфекции
Вирусы способны поражать различные живые организмы. Сегодня известно множество инфекционных заболеваний вирусной природы, поражающих животных и человека.
К вирусным заболеваниям относят:
- натуральную оспу,
- бешенство,
- энцефалиты,
- инфекционные гепатиты,
- полиомиелит,
- грипп,
- герпес,
- паротит (свинку),
- корь,
- краснуху и многие другие инфекции.
Было выяснено, что существует ряд вирусов, способных вызывать процессы, приводящие к новообразованиям, к которым и относится рак. Вирусы, или по-другому онковирусы, вызывают мутации в клетке, из-за которых нормальные гены превращаются в онкогены. Онкогены при определенных условиях и вызывают развитие злокачественных опухолей.
Против некоторых вирусов разработаны вакцины, позволяющие предохранять население от развития инфекционных заболеваний. Например, благодаря изобретению вакцины от натуральной оспы людям удалось полностью искоренить это заболевание. Летом 1978 года был зафиксирован последний известный случай оспы.
Применение вакцин основано на введении мертвого или ослабленного антигена в организм для выработки организмом антител и создания искусственного активного иммунитета. К сожалению, не ко всем вирусам вырабатываются антитела, что создает трудности для синтеза новых вакцин.
Механизм выработки иммунитета:
- Встреча антигена (вредоносной частицы) с Т-лимфоцитами – клетками иммунной системы.
- Обезвреживание антигена.
- Передача информации Т-клеткам памяти.
- Выработка антител – белков, убивающих антигены.
Вирус иммунодефицита человека (ВИЧ) представляет особую опасность. Он паразитирует преимущественно в Т-лимфоцитах организма человека, выполняющих иммунную функцию. Вирус вызывает гибель Т-лимфоцитов, и, как следствие, снижение иммунитета, что приводит к развитию других инфекций.
ВИЧ можно заразиться при гемотрансфузиях (переливании крови) или незащищенном половом акте. Также инфекция может передаваться от матери к ребенку при родах, такой путь передачи инфекции называется трансплацентарным.
Для лечения вирусных заболеваний используют специальные противовирусные препараты.
Иногда к терапии противовирусными препаратами могут добавляться антибиотики. Это делается с целью профилактики бактериальных осложнений. Например, на фоне гриппозной инфекции часто может развиваться пневмония, вызванная шаровидной бактерией – пневмококком.
В качестве профилактики антибиотики, как правило, назначают лицам, находящимся в группе риска (пожилым людям, людям с хроническими заболеваниями или пониженным иммунитетом).
Термины
ДНК – дезоксирибонуклеиновая кислота, молекула, обеспечивающая хранение, реализацию и передачу из поколения в поколение генетической информации.
Паразиты – это тип взаимоотношения организмов, при котором один организм живет за счет другого организма и тем самым вредит ему.
РНК – рибонуклеиновая кислота, играет важную роль в хранении и передаче наследственной информации клетки.
Фактчек
- Вирусы были открыты в 1892 году ученым Д. И. Ивановским, ставшим основоположником вирусологии.
- Вирусы не имеют клеточного строения.
- Они являются облигатными внутриклеточными паразитами.
- Не имеют собственных систем метаболизма.
- Вирусы существуют в двух формах: внеклеточной (или покоящейся) и внутриклеточной.
- Вирусы способны истреблять колонии бактерий, эту их способность используют для борьбы с вирусными заболеваниями.
Проверь себя
Задание 1.
К вирусным инфекциям относится…
- сальмонеллез
- дизентерия
- СПИД
- сифилис
Задание 2.
Какое свойство живого характерно для вириона?
- размножение
- дыхание
- метаболизм
- дискретность
Задание 3.
Почему вирусы считаются представителями отдельной империи?
- они имеют ядро
- в клетке находится РНК
- в клетке отсутствуют мембранные органоиды
- они имеют неклеточное строение
Задание 4.
Бактериофаг – это…
- вирус бактерий
- вирус бешенства
- вирус гриппа
- вирус кори
Задание 5.
Из перечисленных ниже заболеваний выберите те, которые вызывают вирусы.
- сальмонеллез
- дифтерия
- паротит
- тонзиллит
Ответы: 1 – 3; 2 – 4; 3 – 4; 4 – 1; 5 – 3.
Статья на конкурс «био/мол/текст»: Сегодня в связи с нарастающей проблемой антибиотикорезистентности ученые всего мира ведут поиски новых антибиотиков и способов борьбы с инфекционными заболеваниями. И всё больше ученые оглядываются на естественный, но почти забытый метод — фаготерапию. Бактериофаги — природные враги бактерий, существовавшие задолго до появления человека. Почему же мы не используем их вместо антибиотиков, которые привели к такой глобальной проблеме, как резистентность бактерий, ну или хотя бы в дополнение к ним? Что это за диковинные создания и могут ли они быть полезны человеку? Безопасны ли они? В этом обзоре мы попытались собрать воедино имеющиеся данные о бактериофагах и показать вам, насколько красив и многообразен их невидимый мир.
ХХ столетие называют веком атома, нейлона и антибиотиков. С началом массового применения пенициллина в 1943 году медики всего мира получили мощнейший механизм для защиты организма от атак, казалось бы, всех болезнетворных бактерий. И ученые, подхватив знамя антибиотикотерапии, ринулись на поиски и разработку новых антибактериальных средств. Но если мирный атом и синтетические материалы с лихвой оправдали возложенные на них ожидания, то надежды на всемогущество антибиотиков, увы, постепенно тают: резистентность бактерий к ним становится всё шире. 16 сентября 2000 года на Всемирном дне резистентности в Торонто была принята Декларация по борьбе с бактериальной резистентностью [1], а годом позже ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, в тексте которой есть такие строки: «Без согласованных действий всех стран многие великие открытия, сделанные учеными-медиками за последние 50 лет, могут утратить свое значение из-за распространения антибиотикорезистентности» [2]. Означает ли это, что мы в скором времени вновь окажемся бессильны перед бактериями? Существуют ли альтернативные подходы к борьбе с инфекционными заболеваниями? К счастью, да. Один из них — применение бактериофагов, самых многочисленных, древних и распространенных на нашей планете вирусов [3], существующих на Земле свыше 3 млрд лет и неоправданно заброшенных исследователями в 1960–1970-е годы на фоне успехов антибиотикотерапии.
Открытие
Несомненно, многие бактериологи наблюдали и описывали проявления действия фага на бактериальные культуры. В 1896 году английский бактериолог Э. Ханкин, исследуя антибактериальное действие воды индийских рек, пришел к выводу о существовании агента, проходящего через бактериальные фильтры и вызывающего лизис холерных вибрионов. По некоторым данным, российский микробиолог Н.Ф. Гамалея в 1897 году наблюдал лизис бацилл сибирской язвы. Однако первая научная публикация о фагах — статья 1915 года английского микробиолога Ф. Туорта, в которой он описал инфекционное поражение стафилококков, значительно изменявшее морфологию колоний. Инфекционный агент свободно проходил через бактериальные фильтры, и его можно было переносить из одной колонии в другую. Туорт выдвинул несколько гипотез, объясняющих это явление, в частности — гипотезу о фильтрующемся вирусе, подобном вирусам растений и животных. Однако его работа не привлекла внимания ученых, а Туорт забросил ее из-за службы в армии: началась Первая мировая.
В 1917 году канадский бактериолог Ф. Д’Эрелль независимо от Туорта сообщил об открытии вируса, «пожирающего» бактерий, — бактериофага [4]. Микробиологи того времени считали, что чума свиней вызывается совместным действием микроба и вируса. Д’Эрелль предположил, что схожая этиология и у дизентерии. С помощью свечей Шамберлана он отфильтровал фекалии больных дизентерией и добавил их в пробирки с культурами шигелл, намереваясь ввести смесь бактерий и предполагаемого вируса экспериментальным животным. Однако на следующие сутки он обнаружил, что бульон, в котором росли шигеллы, стал прозрачным, что свидетельствовало о гибели бактерий. Профильтровав бульон из этих пробирок, он снова заразил полученными фильтратами культуры шигелл. И вновь на следующие сутки он обнаружил, что бульон стал прозрачным. Полученное «литическое начало» можно было бесконечно пассировать от одной культуры к другой, что привело Д’Эрелля к мысли о существовании вируса, разрушающего бактерии. В дальнейшем он обнаружил фаги стафилококка, холерного вибриона и сальмонеллы. Учитывая эффективность фагов против патогенных микроорганизмов и их широкое распространение в природе, Д’Эрелль предположил, что они играют определенную роль в развитии иммунитета к инфекционным заболеваниям и выздоровлении.
В 1920–1940-е годы было проведено множество исследований по клиническому применению бактериофагов, однако стабильных результатов получено не было, и на Западе бактериофаги стали в основном объектом изучения биологов. В 1931 году Совет фармации и химии Американской медицинской ассоциации опубликовал обзор 150 работ по фаготерапии, в котором M. Итон и С. Бэйн-Джонс [5] утверждали, что природа фага неживая; возможно, это фермент, и ошибочно связывать воздействие фага на бактерии или его терапевтический эффект с его жизнедеятельностью. Такие выводы способствовали существенному сокращению капиталовложений в исследования по медицинскому применению фагов на Западе.
В СССР в ранние годы бактериофагам уделяли достаточно внимания. В 1923 грузинский микробиолог Г.Г. Элиава, ученик Д’Эрелля, основал в Тбилиси Институт бактериофагов, ставший впоследствии Всесоюзным центром фаготерапии, коллекция которого на сегодняшний день составляет около 3000 фаговых штаммов. Однако успешное применение антибиотиков в 1960–1970-е годы практически похоронило идеи фаготерапии. Так, например, в Большой советской энциклопедии указано: «Антибиотики и другие химиотерапевтические средства оказались эффективнее фагов, в связи с чем их применение с лечебной целью сузилось».
Происхождение
Вопросом о природе бактериофага задавался еще Туорт в своей первой статье. Д’Эрелль в своем фундаментальном труде выдвинул несколько теорий (гипотез) происхождения фагов, из которых две сохранили значение до настоящего времени: «теория вируса» и «регрессивная теория».
В рамках вирусной теории бактериофаги, подобно вирусам растений и животных, рассматриваются как прямые потомки неких очень примитивных форм, существовавших еще до появления клеток, и представляют собой автономные агенты, являющиеся облигатными паразитами бактерий. Этой теории придерживался Д’Эрелль в самом начале своих исследований, и ее принимало как нечто само собой разумеющееся большинство вирусологов. Но эта концепция, по сути, мало что дает, так как в применении к вирусам такие термины, как автономность и паразитизм, трудно поддаются определению, а сама гипотеза сложно доказуема, поскольку нет ископаемых останков вирусов, а их родственные связи можно изучать только методами молекулярной филогенетики [6].
Согласно регрессивной теории, фаги постепенно развивались из более сложных форм жизни путем утраты всей протоплазмы, ненужной для присущего бактериофагу способа существования. Эта гипотеза лучше вписывается в современную биологию, так как промежуточные стадии процесса дегенерации довольно легко себе представить, а постепенную утрату бактериями способности к синтезу можно изучать экспериментально.
Вполне возможно, что бактериофаги произошли из примитивного полового аппарата бактерий, первоначально развившегося для передачи генетического материала от одной бактериальной клетки к другой. Это могло бы объяснить, почему некоторые фаги и в настоящее время способны выполнять эту функцию путем лизогенной конверсии. Теория предполагает, что генетический материал фагов — это редуцированный и модифицированный нуклеоид бактерий, сохранивший гомологию с «прародителем» и потому способный с ним рекомбинировать или даже частично замещать его. Это могло бы объяснить свойства умеренных фагов, способных встраиваться в определенные локусы ДНК клетки-хозяина, становясь частью бактериального наследственного аппарата. В процессе эволюции умеренные фаги могли путем дальнейших мутаций, влияющих на спектр литического действия [7], необратимо превращаться в вирулентные, поражающие хозяев, с которыми они не имели генетического родства. Согласно этой теории, различные штаммы фагов филогенетически не связаны друг с другом, и определенный фаг даже может быть филогенетически ближе клетке-хозяину, нежели другим фагам. Отсюда следует, что если данная теория верна, то между бактериофагами и вирусами животных и растений нет никакого родства, а фенотипическое сходство — чисто внешнее, обусловленное сходной экологией.
Тем не менее биоинформатические подходы — сравнения огромных массивов геномов и фолдингов белков, а особенно «архитектуры» фаговых частиц — всё же позволяют находить у бактериофагов, фагов архей и вирусов в целом филогенетически общие признаки [3], [8].
Строение и классификация
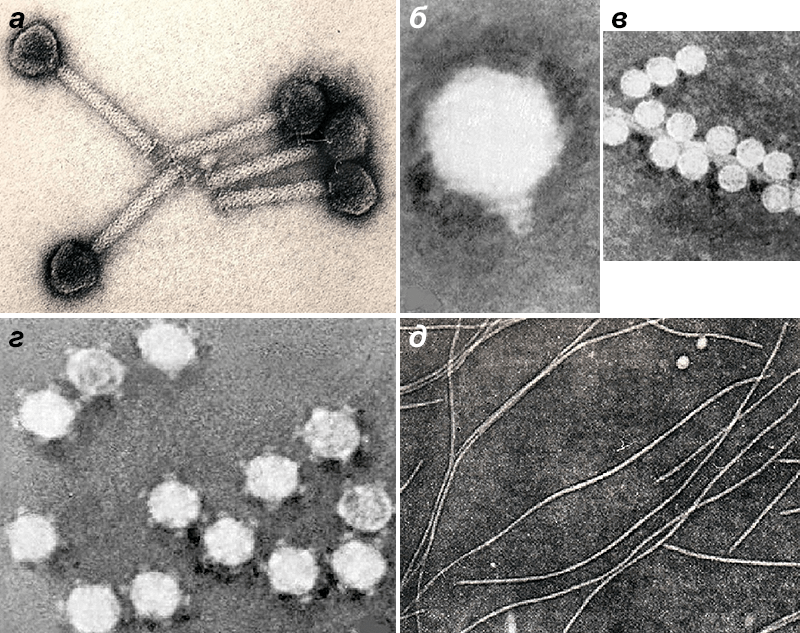
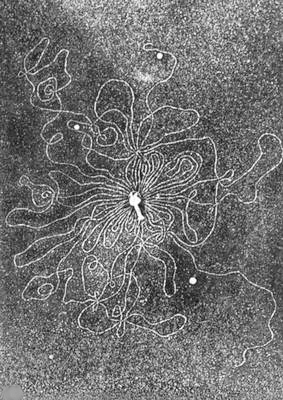
На протяжении почти 70 лет бактериофаги, как и другие вирусы, были для биологов такими же невидимыми, как атомы для физиков, в силу их субмикроскопических размеров. И только в 1942 году, с помощью недавно изобретенного (М. Кнолль, Э. Руска, 1931 г.) электронного микроскопа, будущий нобелевский лауреат С. Лурия (Колумбийский университет) и Т. Андерсон (RCA-лаборатория, Камден, Нью-Джерси) получили первые фотографии бактериофага Т2, или «анти-коли РС», как его называли Лурия и Андерсон (рис. 1).
Рисунок 1. Изображения бактериофага Т2, полученные С. Лурия и Т. Андерсоном с помощью просвечивающего электронного микроскопа: а — первая в мире фотография бактериофага (2 марта 1942 г.); б — бактериофаг Т2 в культуре Escherichia coli (2 марта 1942 г.); в — Т2 «крупным планом» (29 марта 1962 г.).
[42] (фото а и б)
Рисунок 2. Микрофотография фага Т2, полученная с помощью сканирующего электронного микроскопа.
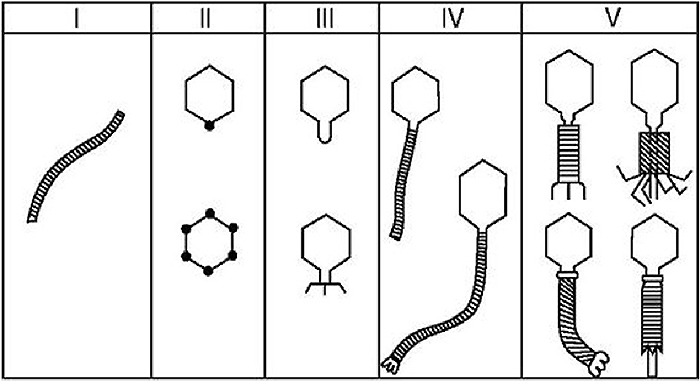
Фаги весьма разнообразны по морфологии — в отличие от вирусов животных и растений. Все известные в настоящее время вирусы эукариот имеют либо форму многогранника (икосаэдра), либо спиралевидный тип симметрии. Что же касается фагов, то среди них тоже встречаются формы со спиралевидным или кубическим типами симметрии, но подавляющее число изученных к настоящему времени фагов сочетает в одной частице оба типа: кубический — у головки, а спиралевидный — у отростка (рис. 2). Столь своеобразное строение фагов, отличающее их от других вирусов, объясняется наличием у бактерий ригидной клеточной стенки, которая исключает возможность проникновения вирионов в клетку путем пиноцитоза или виропексиса. Такая структурная особенность бактерий способствовала формированию у фагов других способов инфицирования, что и нашло отражение в их облике.
Именно морфология легла в основу современной классификации бактериофагов. Казалось бы, целесообразнее разделять фаги по принципу их связи с определенным видом микроорганизма, который они поражают, — что и легло в основу первых классификаций. Но этот принцип не обеспечивает необходимой точности, так как один штамм фага может поражать разные микроорганизмы, то есть иметь широкий литический спектр. И наоборот, один вид бактерий может поражаться несколькими фагами, различающимися между собой по целому ряду свойств, в том числе морфологически, тогда как фаги, активные в отношении разных видов и даже родов микроорганизмов, могут быть морфологически тождественны.
Были попытки классифицировать фаги и по сумме признаков (антигенных, физиологических, биохимических, физико-химических, морфологии негативных колоний, спектру литического действия и т. п.).
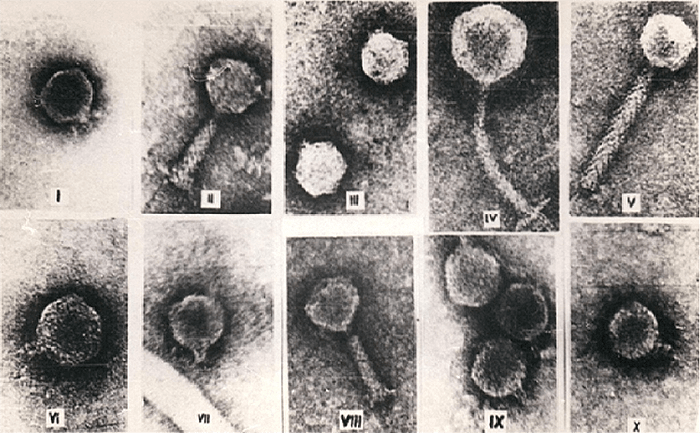
С развитием электронной микроскопии появилась возможность классифицировать фаги по морфологии. Дэвид Бредли в 1967 году предложил разделить фаги на шесть морфологических групп: с A по F (табл. 1, рис. 3). Вторая используемая классификация, предложенная А.С. Тихоненко в 1968, объединяет фаги групп D и E в одну (табл. 1, рис. 4). Микрофотографии фагов, относящихся к разным морфогруппам, представлены на рисунках 5 и 6.
| Группа по Бредли | Группа по Тихоненко | Морфология | Тип нуклеиновой кислоты |
|---|---|---|---|
| A | V | С сокращающимся отростком | Двухцепочечная ДНК |
| B | IV | С длинным несокращающимся отростком | Двухцепочечная ДНК |
| C | III | С коротким несокращающимся отростком | Двухцепочечная ДНК |
| D | II | Без отростка, с капсомерами | Одноцепочечная ДНК |
| E | II | Без отростка и капсомеров | Одноцепочечная РНК |
| F | I | Нитевидные | Одноцепочечная ДНК |
Рисунок 3. Схематическое изображение фаговых морфогрупп по Бредли (1967).
рисунок автора статьи
Рисунок 4. Схематическое изображение фаговых морфогрупп по Тихоненко (1968)
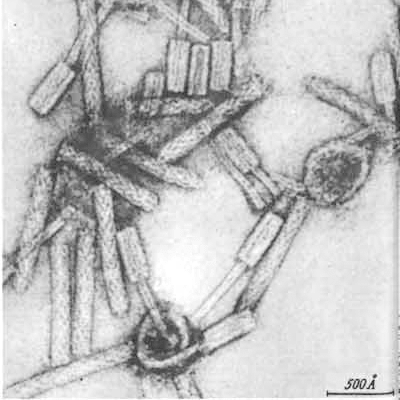
Рисунок 5. Различные морфоварианты бактериофагов.
микрофотографии автора статьи
Рисунок 6. Микрофотографии бактериофагов из разных морфогрупп: а — фаг 1997 Yersinia enterocolitica с длинным несокращающимся чехлом; б — фаг Т3 с коротким отростком; в — фаг МS2 без отростка; г — фаг Х174 без отростка, с капсомерами; д — нитчатый фаг Fd.
микрофотографии автора статьи
Рисунок 7. Схема строения вириона фага семейства Myoviridae
Большинство фагов состоит из головки диаметром 45–140 нм и отростка («хвоста») толщиной 10–40 нм и длиной 100–200 нм (рис. 7). Так выглядят представители порядка Caudovirales («хвостатых фагов»), и именно их образ обычно извлекается из памяти при упоминании термина «бактериофаг». Содержимое головки состоит преимущественно из плотно упакованной молекулы ДНК или (реже) РНК, длина которой во много раз превышает размеры головки и достигает 60–70 мкм (рис. 8), и иногда небольшого количества белка — например, ферментов, которые осуществляют первичную транскрипцию генетического материала фага или способствуют ей. Капсид представляет собой белковую или (не у Caudovirales) липопротеиновую оболочку, собранную из множества копий одного или двух белков. Капсид может быть икосаэдрическим, сферическим, лимоновидным или плеоморфным [9], и именно он, по сути, определяет размер фагового генома.
Рисунок 8. Микрофотография бактериофага с высвободившейся нитью ДНК.
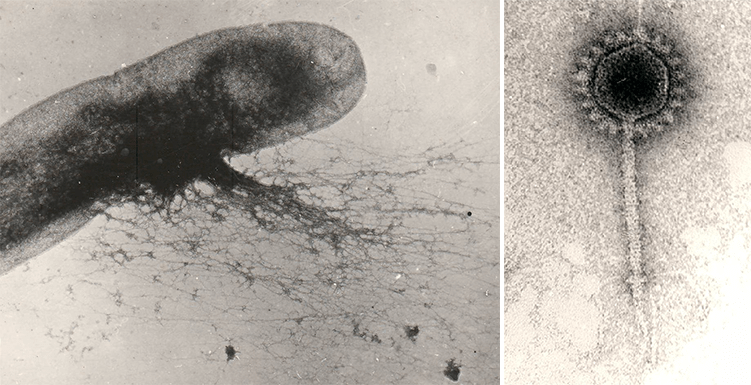
Отросток представляет собой белковую трубку, окруженную у ряда бактериофагов (семейства Myoviridae, типовой представитель которого — фаг Т4) чехлом, состоящим из сократительных белков, подобных мышечным, благодаря чему он способен сокращаться, обнажая часть стержня. С головкой отросток стыкуется с помощью белкового кольца — «портала» («воротничка»). На противоположном конце, в основании, отросток содержит лизоцим (как домен белка, пронзающего клеточную стенку), служащий для точечного растворения пептидогликана. Возможно и нахождение в основании отростка АТФазы, обеспечивающей энергией инъекции нуклеиновой кислоты в бактерию [10]. Там же у фагов такого типа имеется гексагональная базальная пластинка с несколькими шиповидными выростами и тонкими длинными нитями, с помощью которых фаг распознает рецепторы «своих» бактерий и прикрепляется к ним.
Нитевидные фаги имеют размеры 8×800 нм и лишены выраженных «органов».
Бактериофаги довольно устойчивы к воздействию различных химических и физических факторов. Они выдерживают колебания рН в пределах 5,0–8,0; большинство резистентно к действию холодных водных растворов глицерина и этанола, а также цианидов, фторидов, динитрофенола, хлороформа, тимола и фенола. Бактериофаги хорошо сохраняются в лиофилизированном состоянии, но разрушаются при кипячении, УФ-облучении, действии некоторых химических дезинфектантов (в частности, кислот и формалина). Фаги хорошо сохраняются при низких температурах (до −200 °С в глицерине), но быстро инактивируются при 65–70 °С [10].
Взаимодействие с бактериями
Фаги — облигатные внутриклеточные паразиты, так как у них нет механизмов для выработки энергии и рибосом для синтеза белка. Размножение фага происходит только внутри бактерии-хозяина и посредством ее синтетической машинерии. Важным свойством бактериофагов является их специфичность: фаги могут поражать определенный вид бактерий (моновалентные фаги) или же только избранные штаммы/варианты внутри вида (типовые фаги, например, фаги V. cholerae classica и El Tor), но некоторые не столь разборчивы и поражают бактерий разных видов и даже родов (поливалентные фаги) [11]. Тем не менее очень сложно судить о специфичности фагов в природных условиях, поскольку там действуют многочисленные методологические ограничения и популяционные закономерности, и порой один и тот же фаг можно принять как за «генералиста», так и за «специалиста» [12].
По характеру действия на бактерии различают вирулентные и умеренные фаги.
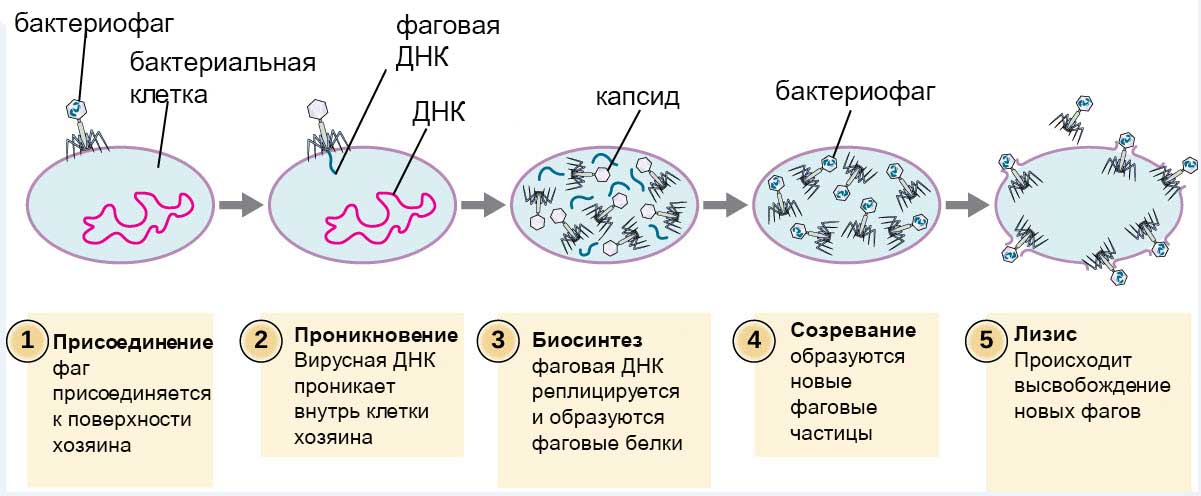
- Взаимодействие вирулентного бактериофага с клеткой происходит по литическому пути и складывается из нескольких стадий: его адсорбции на клетке, проникновения в клетку, биосинтеза компонентов фага и их сборки и выхода вирионов из клетки [13].
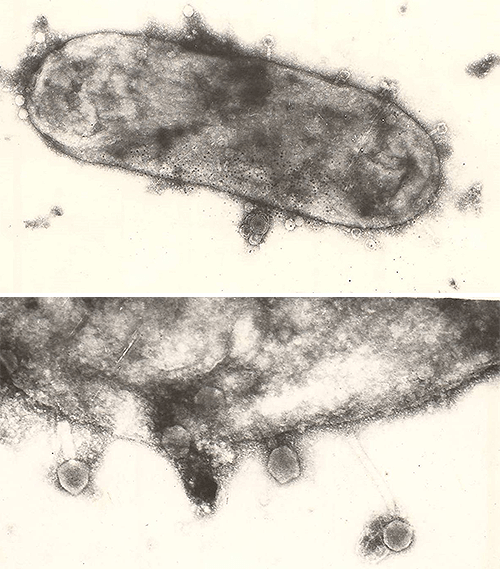
Рисунок 9. Адсорбция фага PIcmlclr 100ts на поверхности Yersinia pestis.
микрофотографии автора статьи
Первоначально фаг обратимо, а затем и необратимо прикрепляется к фагоспецифическим рецепторам на поверхности бактериальной клетки (рис. 9). Ими могут быть компоненты пептидогликана и тейхоевых кислот грамположительных бактерий или внешней мембраны (порины, молекулы липополисахарида) грамотрицательных, белки капсул, половых пилей и жгутиков [14]. Например, фаги Т3 и Т7 распознают липополисахарид энтеробактерий, а Т4 — еще и порин OmpC, фаг λ «неравнодушен» к мальтопорину (LamB). Бактериофаги Т2 и Т6 взаимодействуют с поринами OmpF и Tsx соответственно, а многие нитчатые и РНК-содержащие (P17, M12, f2) фаги — с пилями. Помимо рецепторов, адсорбция фага зависит от рН среды, температуры, наличия катионов и некоторых соединений (например, триптофана для Т2). При избытке фага в окружающей среде на одной клетке может адсорбироваться до 200–300 вирусных частиц [10].
В случае Т4 и подобных энтеробактериальных фагов после необратимой адсорбции в чехле отростка высвобождаются ионы Са2+, активирующие АТФазу [10], что вызывает сокращение чехла, проталкивание стержня отростка сквозь внешнюю мембрану бактерии, локальное растворение лизоцимом пептидогликана (муреина) и инъецирование в клетку ДНК вириона. С момента попадания фаговой нуклеиновой кислоты в бактериальную клетку и до полного созревания в ней вирусных частиц проходит определенный отрезок времени, называемый латентным. Он уникален для каждой системы «бактерия — фаг» и может составлять от нескольких минут до нескольких часов [15].
Введенная ДНК фага вызывает полную перестройку метаболизма бактерии: прекращается синтез ее собственных ДНК, РНК и белков. ДНК бактериофага может начинать транскрибироваться его же РНК-полимеразой — например, фаг N4 впрыскивает этот фермент вместе с ДНК [16]. Или же, как в случае Т4, фаг впрыскивает фермент АДФ-рибозилтрансферазу (продукт гена alt), модифицирующий хозяйскую РНК-полимеразу так, что та переключается на транскрипцию исключительно фаговых генов [17]. Синтезирующиеся мРНК поступают на рибосомы бактерии, которые послушно производят белки бактериофага: ранние (ДНК-полимеразу, нуклеазы) и поздние (белки капсида, отростка, базальной пластинки и др.). Репликация ДНК бактериофага осуществляется его собственной ДНК-полимеразой. Поздние белки и копии фаговой ДНК объединяются, образуя зрелые инфекционные фаговые частицы [18]. Затем происходит лизис клетки-хозяина: фаговые лизины (гидролазы, а не аминокислоты!) и холины изнутри пробивают отверстия в ее мембране и пептидогликане, и в клетку начинает поступать вода. В итоге бактерия лопается с выходом зрелых бактериофагов (рис. 10). При этом в зависимости от типа фага количество образовавшихся вирионов будет различным — от единичных частиц до нескольких тысяч. - Умеренные фаги проникают в клетку так же, как и вирулентные. Например, фаг Mu инъецирует генетический материал очень схоже с Т4, но базальная пластинка Mu устроена проще, и гомологи ее компонентов обнаружены в инъекционных аппаратах большинства фагов с сократимым чехлом. Более того, подобные компоненты характерны и для бактериальных наномашин вроде системы секреции VI типа и R-тейлоцинов (рис. 11) [19]. Умеренный фаг инициирует лизогенный цикл, при котором он вместо репликации обратимо взаимодействует с геномом бактерии-хозяина, интегрируясь в хромосому (фаг λ), либо поддерживается в клетке в виде низкокопийной плазмиды (фаги P1 и N15) [15]. В первом случае ДНК фага пассивно реплицируется в составе хромосомы. Так или иначе при делении бактерии фаговый геном передается дочерним клеткам. Такое состояние фага называется профагом, в нём вирус может находиться во многих поколениях потомства первой зараженной им клетки. Бактерия, содержащая профаг, лизогенна до тех пор, пока при определенных условиях профаг не активируется и не вступит в литический цикл. Переход от лизогении к лизису называется лизогенной индукцией, или индукцией профага. На индукцию фага оказывают влияние условия внешней среды, состояние клетки хозяина, наличие питательных веществ и т.д.
Рисунок 10. Лизис E. coli и выход фаговых частиц. Справа — зрелая форма бактериофага.
микрофотографии автора статьи
Но некоторые фаги способны покидать клетку без лишнего шума. Так делает, например, фаг L2, паразитирующий в бактериях рода Acholeplasma, лишенных клеточной стенки (их знаменитые родственники — микоплазмы). Вначале он проходит все стадии, соответствующие определению «литический цикл» — но за исключением собственно лизиса хозяина: вирионы как бы отпочковываются от бактерии, захватывая небольшие участки ее мембраны, которые становятся оболочкой фага. После такого деликатного литического цикла L2 может приступить к лизогенизации [20].
Рисунок 11. Дефектные фаги — пиоцины (бактериоцины Pseudomonas aeruginosa). Многие бактерии (особенно γ-протеобактерии) экспонируют на своей поверхности тейлоцины (tailocins) — «перевернутых безголовых фагов». Эти фаговые хвосты незаменимы в конкурентной борьбе бактерий с близкими родственниками (такие структуры называют бактериоцинами), а иногда служат для поражения эукариотических клеток (PLTS, фагоподобные структуры для транслокации белков). Гены тейлоцинов бактерии заимствовали у различных профагов семейств Myoviridae и Podoviridae, причем ДНК одной бактерии может содержать несколько генетических кластеров разных тейлоцинов наряду с полноценными родственными либо неродственными профагами, кодирующими все «запчасти» вириона [43]. Размножаться «дефектные фаги» не могут из-за отсутствия головки с ДНК, однако множественные отростки на поверхности клетки-хозяина способны подобно шприцам с токсичным содержимым повреждать клетки жертв.
микрофотография автора статьи
Бактериальный иммунитет
Казалось бы: если бактериофаги атакуют любых бактерий и их численность настолько велика (фаги — самые многочисленные вирусные формы в биосфере Земли, их общее количество — 1030–1032 фаговых частиц [21], что примерно равно количеству бактерий, 4–6×1030), то почему они до сих пор не уничтожили всех бактерий? Ответ очевиден: в процессе эволюционного соразвития бактерии выработали своего рода иммунитет против фагов. Причем иммунитет многослойный. Во-первых, бактерия может быть изначально лишена рецепторов к тому или иному фагу или лишиться их посредством мутаций. Во-вторых, бактерия может быть иммунизирована уже «прописавшимися» в ней профагами, которые с помощью специфических репрессоров просто не дадут вновь прибывшим сородичам размножиться. В-третьих, бактерия (или ее мобильные генетические элементы) кодирует рестрикционно-модификационные системы, которые просто рубят на кусочки нуклеиновые кислоты, не содержащие особых метильных меток — подписей «я свой».
А в-четвертых… В 2005 году стало известно, что функциональной основой бактериального иммунитета является система CRISPR [22], двумя годами позже — что для ее работы критически важен белок Cas, а в 2012-м уже появилась возможность создания инженерных систем на основе CRISPR-Cas9 Streptococcus pyogenes [23]. Работа системы CRISPR-Cas основана на том, что небольшой фрагмент, вырезанный из проникшей в бактериальную клетку фаговой ДНК, вставляется в специальный участок (локус CRISPR) генома бактерии. Каждый локус CRISPR содержит множество таких вставок (спейсеров, разделенных особыми короткими нуклеотидными повторами), представляющих собой фрагменты ДНК встреченных когда-либо фагов и плазмид. На основе спейсеров синтезируются молекулы РНК, комплементарные соответствующему участку фагового (или плазмидного) генома. Эти РНК в комплексе с белками Cas затем опознают и обезвреживают мишень — чужеродную ДНК с комплементарной последовательностью нуклеотидов. Таким образом, если в клетку однажды проникла фаговая ДНК, но клетка выжила и встроила фрагмент чужеродного генома в свой нуклеоид, то последующие попытки таких же фагов эксплуатировать клетку или ее потомков будут неэффективны [24].
О том, как CRISPR-система из иммунной превратилась в редактирующую и служит человечеству, а также каких успехов добились другие технологии редактирования генома, читайте в статьях: «А не замахнуться ли нам на… изменение генома?» [25], «Мутагенная цепная реакция: редактирование геномов на грани фантастики» [26], «Успех в борьбе с лейкозом: на шаг ближе к клиническому применению геномного редактирования» [27]. — Ред.
Впрочем, бактериофаги за счет случайных мутаций и отбора умеют обходить системы CRISPR-Cas. Чтобы конкретный спейсер потерял эффективность, достаточно даже незначительного изменения комплементарного ему фрагмента фагового генома. Поэтому фаги успешно и довольно быстро преодолевают приобретенный иммунитет бактерий за счет точечных мутаций. С другой стороны, системы CRISPR очень широко распространены у бактерий и, судя по всему, обеспечивают своим обладателям надежную защиту. Эффективность CRISPR обеспечивается тем, что даже две разные бактерии одного и того же штамма встраивают в свой геном разные спейсеры, соответствующие разным участкам генома фага. В результате популяция бактерий быстро приобретает генетическое разнообразие, что значительно повышает их шансы на выживание. Точечные мутации, «обезвреживающие» один спейсер, позволят фагам заразить только небольшую часть бактериальной популяции. К тому же, бактериофаг не может определить заранее, какие спейсеры имеются у конкретной клетки. Поэтому большинство фагов в полиморфной популяции бактерий погибает даже при высокой скорости появления точечных мутаций.
Такой феномен коллективного бактериального иммунитета был продемонстрирован на бактериях P. aeruginosa и фагах DMS3vir [28]. Для начала ученые убедились, что система CRISPR действительно защищает бактерий от данной разновидности фагов, а культуры бактерий с отключенной CRISPR-системой активно этим фагом поражаются, хотя и выработали иную форму защиты: у них распространились мутации, меняющие рецептор, к которому прикрепляется фаг. Такой способ защиты оказался менее эффективным, так как по истечении 30 суток эксперимента бактериофаги всё еще находились в популяции. Чтобы доказать, что разнообразие спейсеров системы CRISPR-Cas — основа эффективности коллективной иммунной защиты, ученые сравнили устойчивость к фагам у бактериальных популяций с разным уровнем разнообразия спейсеров. Оказалось, что фаги в монокультурах бактерий уже в первые сутки приобретали мутации, нейтрализующие соответствующие спейсеры. У фагов же в популяциях, составленных из нескольких клонов бактерий с различными спейсерами, устойчивость формировалась лишь в немногих случаях. В популяциях, сформированных из 24–48 клонов, фаги не смогли преодолеть защиту CRISPR-Cas.
Отсюда следует, что в монокультуре единичная мутация фаговой ДНК, обеспечивающая защиту от конкретного спейсера, позволяет фагу заразить любую бактерию, а в полиморфной культуре из 48 клонов точно такая же мутация обеспечивает успех с вероятностью лишь 1/48. Даже при условии, что ДНК фага встроится в бактерию, защиту которой он преодолел, его потомки снова столкнутся с той же проблемой, и она будет усугубляться по мере снижения численности бактерий, чувствительных к этому фагу.
Таким образом, точечные мутации и отбор — недостаточно эффективная для вирусов эволюционная стратегия, что объясняет успешность систем CRISPR-Cas и их широкое распространение у бактерий. Но тогда почему бактериофаги до сих пор не «вымерли» — раз эта система так эффективна? Не так давно у них обнаружили особые гены, подавляющие работу CRISPR [29]. А что же могут противопоставить бактерии? Ответ, опять же, в разнообразии: существует много разных вариантов системы CRISPR, каждый из которых уязвим только для некоторых анти-CRISPR-генов и защищен от других. Содержать же в своем геноме множество подобных генов бактериофаги не могут, так как отбор у них ведется преимущественно в направлении компактизации генома — в угоду увеличению скорости размножения.
Такая антагонистическая коэволюция фагов и бактерий, протекающая параллельно на разных уровнях и в разных временных масштабах (формирование новых спейсеров бактериями — точечные мутации фагов, выработка новых генов анти-CRISPR — формирование новых вариантов системы CRISPR) позволяет соблюдать баланс в системе «бактериофаг — бактерия» на уровне одной популяции и биоценоза в целом [28], [30].
Получение бактериофагов
Рисунок 12. Фаговые бляшки (зоны лизиса на культуре E. coli).
Бактериофаги широко распространены в природе. Везде, где есть бактерии — есть фаги. Их можно выделить из открытых полостей организма человека и животных, водоемов, сточных вод, почвы, из соответствующих культур бактерий и т.д. Большое количество бактериофагов находится в выделениях больных людей и животных, особенно в период выздоровления от инфекционных заболеваний.
Таким образом, поиск и выделение новых фагов не представляет трудности. Для выделения бактериофага исследуемый материал (воду, испражнения, гной, почву и др.) засевают в жидкую питательную среду, инкубируют в термостате, и через сутки помутневшую жидкость пропускают через бумажный, а затем через бактериальный фильтры, асбестовые пластины, керамические свечи. Полученный фильтрат исследуют на наличие бактериофага путем совместного посева с подходящей микробной культурой на плотные или в жидкие питательные среды. Если бактериофаг выделился, то после 18-часовой инкубации на поверхности агара вырастает сплошной газон культуры с прозрачными бляшками — зонами лизиса (рис. 12). В бульоне бактериофаг обусловливает просветление среды.
Для выделения чистой культуры бактериофага материал из отдельной бляшки переносят бактериологической иглой в суспензию молодой микробной культуры.
Материал из вновь возникшего стерильного пятна засевают вместе с фагочувствительными микробами в жидкую питательную среду. После 6–18 часов инкубации среду фильтруют и получают чистую культуру бактериофага.
Для изготовления серийного препарата бактериофага применяют только апробированные штаммы и культуры микробов, обладающие типичными морфологическими, биохимическими и серологическими свойствами. Штаммы бактериофагов должны быть музейными и рабочими. Музейные производственные штаммы ежегодно обновляются путем выделения новых или пассажами имеющихся фаговых штаммов через организм больного, а также адаптацией к свежевыделенным, резистентным к данному бактериофагу культурам.
Промышленное получение бактериофага в настоящее время осуществляют в специальных аппаратах — реакторах емкостью 250–1000 л, с применением аэрации как фактора, стимулирующего развитие микроорганизмов. В реактор наливают жидкую питательную среду, которую стерилизуют при температуре 110 °С в течение 40 минут. После стерилизации среду охлаждают до 39 °С и засевают соответствующей микробной культурой и бактериофагом одновременно. Для засева используют 18-часовые агаровые культуры, которые прибавляют из расчета 50 млн микробных клеток на миллилитр среды. Бактериофаг добавляют в количестве не более 0,3 % по отношению к объему питательной среды. Среду с бактериальной культурой и фагом оставляют при температуре 37 °С на 6–18 часов. Фаги активно размножаются внутри бактериальных клеток и вызывают их лизис, что внешне проявляется полным просветлением среды. К полученному лизату добавляют в качестве консерванта хинозол (0,01 %) или фенол (0,25 %) и не позже чем через два часа после этого фильтруют содержимое реактора через бактериальные фильтры для удаления оставшихся микробных клеток.
Полученный препарат бактериофага должен иметь вид совершенно прозрачной жидкости желтого цвета. Он проходит контроль на стерильность, безвредность и литическую активность. Безвредность препарата проверяют путем введения животным. Например, брюшнотифозный и дизентерийный бактериофаги вводят подкожно трем мышам по 1 мл, либо внутривенно одному кролику 5 мл. За животными наблюдают в течение 3–4 суток. Литическую активность бактериофага определяют титрованием в жидкой питательной среде методом Аппельмана, на плотной питательной среде — методом Отто. За титр бактериофага при определении методом Аппельмана принимают то его наибольшее разведение, которое вызывает полный лизис тестовой культуры микроорганизмов.
После проведения контрольных исследований препарат разливают во флаконы нейтрального стекла. Помимо жидких препаратов бактериофага могут изготавливать и сухие. Для их получения фаголизат осаждают сернокислым аммонием, осадок отделяют от жидкой части, добавляют к нему стабилизатор (9 % глюконат кальция), смесь тщательно растирают и лиофилизируют [31].
Биологическое значение бактериофагов
Бактериофаги играют важную роль в круговороте углерода и энергии, контроле численности микробных популяций и эволюции бактерий. Бактериофаги, будучи подвижными генетическими элементами, служат мощным фактором изменчивости бактерий. Например, они осуществляют процесс трансдукции — перенос бактериальных генов из одной клетки в другую: вырезаясь из генома одной бактерии, они могут прихватывать с собой в капсид ее гены и, инфицируя другую клетку, передавать их новому хозяину. Есть все основания предполагать, что большинство бактерий содержит профаги. Многие культуры несут 2–4 и даже более умеренных фагов, то есть являются полилизогенными. Например, многие актиномицеты и клубеньковые бактерии содержат в геноме четырех и более профагов.
Способность фагов менять фенотип бактерий путем привнесения чужеродных (и фаговых в том числе) генов может быть одновременно залогом процветания для бактерий и источником больших проблем для человечества: так бактерии могут приобретать факторы вирулентности и устойчивости — к другим фагам, антибиотикам и прочим воздействиям (если фаг, например, награждает бактерию способностью формировать биопленки) [32]. В 1951 году была описана фаговая конверсия Corinebacterium diphtheriae: оказалось, что ген tox, кодирующий дифтерийный токсин, в геном нетоксигенных бактериальных штаммов привносится умеренным фагом β. В результате коринебактерия производит сильнейший токсин, инактивирующий в человеческих клетках один из компонентов трансляционного аппарата — EF-2 (эукариотический фактор элонгации 2). Подавление синтеза белка проявляется своеобразной дифтерийной симптоматикой. Аналогичные механизмы приобретения патогенных свойств позже выявили у холерных вибрионов, сальмонелл, клостридий и др.
Лабораторное и промышленное применение бактериофагов
Способность фагов к внесению в клетку определенного количества генетического материала, упакованного в капсид, широко эксплуатируется в генной инженерии: их часто используют в качестве векторов различного назначения. Например, для создания библиотек генов нередко конструируют векторы на основе бактериофага λ, содержащего двухцепочечную ДНК. Левое и правое плечи ДНК фага содержат гены, необходимые для литического цикла, а среднюю — несущественную для размножения — часть молекулы можно заменять крупным (примерно до 24 т.п.н.) фрагментом чужеродной ДНК, включая эукариотическую. Такую рекомбинантную ДНК упаковывают в вирионы и заражают ими подходящую культуру бактерий, которая затем многократно воспроизводит фаговую ДНК с интересующими человека фрагментами.
Из-за высокой специфичности многие фаги служат диагностическими инструментами для идентификации бактериальных культур в медицинской, ветеринарной, технической микробиологии и фитопатологии. Метод фаготипирования, основанный на исключительной специфичности определенных фаговых штаммов, позволил распределить на фаготипы ряд штаммов бактерий, неотличимых друг от друга по другим признакам. Фаготипирование с успехом применяют для идентификации типов кишечной палочки, сальмонелл (включая возбудителя брюшного тифа), стафилококков и др. Этот метод дает эпидемиологам возможность отследить цепочку случаев заболевания и определить источник инфекции.
Бактериофаги прекрасно подходят для быстрого обнаружения небольших количеств патогенных бактерий во внешней среде: появляются и множатся хозяева — нарастает титр специфического бактериофага. Определение колифагов стало одним из ключевых мероприятий в санитарном контроле вод, поскольку позволяет выявить фекальное загрязнение даже при малом количестве кишечной палочки, не определяемом бактериологическими методами.
Фаги применяются и в борьбе с бактериальными вредителями различных технических брожений, и в производстве ферментов с помощью бактериальных культур. В то же время, заражая промышленные культуры, бактериофаг вредит «полезным» производственным штаммам (вакцинным, продуцентам антибиотиков, возбудителям молочнокислого, ацетонобутилового и некоторых других брожений), чем вызывает серьезные нарушения технологического процесса.
Применение бактериофагов в медицине
Первый отчет об успешной фаготерапии был опубликован в 1921 году фламандцами Р. Бранохе и Ж. Майсином, которые использовали бактериофаг для лечения кожной стафилококковой инфекции [33].
Как уже было упомянуто, западная медицина c середины ХХ века практически отказалась от использования бактериофагов в терапевтических целях [5], однако в СССР фаги довольно широко применялись. Одним из самых, пожалуй, масштабных примеров практического применения фагов является использование комплексного препарата бактериофагов в Сталинграде во время Великой Отечественной войны. З.В. Ермольева во время работы в Ташкентском институте вакцин и сывороток разработала препарат, содержащий 19 видов бактериофагов, в том числе холерный, брюшнотифозный и дифтерийный. Во время Сталинградской битвы в связи с угрозой эпидемии холеры было налажено производство холерного фага в самом Сталинграде, и препарат ежедневно принимали около 50 тысяч человек [34].
После войны в СССР приступили к промышленному производству фаговых препаратов, которое действует и в настоящее время. В России производством бактериофагов занимаются в основном филиалы НПО «Микроген»: «Иммунопрепарат» (г. Уфа), «ИмБио» (г. Нижний Новгород), «Биомед» (г. Пермь).
На данный момент в РФ зарегистрировано и производится 13 фаговых препаратов (табл. 2).
| Препарат | Применение* | Состав |
|---|---|---|
| Секстафаг®, пиобактериофаг поливалентный жидкий | Для лечения и профилактики заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками | Стерильный фильтрат фаголизатов бактерий Staphylococcus, Streptococcus, Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, Klebsiella pneumoniae, энтеропатогенных Escherichia coli |
| Интести-бактериофаг | Для лечения и профилактики заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками | Смесь стерильных фильтратов фаголизатов Shigella flexneri (сероваров 1, 2, 3, 4, 6), Shigella sonnei, Salmonella enterica (сероваров Paratyphi A, Paratyphi B, Typhimurium, Infantis, Choleraesuis, Oranienburg, Enteritidis), энтеропатогенных Escherichia coli (серогрупп, наиболее значимых в этиологии кишечных инфекций), Proteus vulgaris, Proteus mirabilis, Enterococcus, Staphylococcus, Pseudomonas aeruginosa |
| Пиобактериофаг поливалентный очищенный | Для лечения и профилактики различных форм гнойно-воспалительных заболеваний и инфекций ЖКТ | Стерильный фильтрат фаголизатов Staphylococcus, Streptococcus, Proteus mirabilis, Proteus vulgaris, Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae |
| Пиобактериофаг комплексный жидкий | Для лечения гнойно-воспалительных заболеваний, обработки операционных и свежеинфицированных ран | Смесь стерильных фильтратов фаголизатов Staphylococcus, Streptococcus, Enterococcus, Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, энтеропатогенных Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca |
| Бактериофаг стрептококковый | Для лечения и профилактики заболеваний, вызванных стрептококками | Стерильные фаголизаты Streptococcus spp. |
| Бактериофаг дизентерийный | Для лечения и профилактики дизентерии | Смесь стерильных фильтратов фаголизатов Shigella flexneri (сероваров 1, 2, 3, 4, 6) и Shigella sonnei |
| Бактериофаг стафилококковый | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний, вызванных стафилококками | Стерильные фаголизаты Staphylococcus spp. |
| Бактериофаг псевдомонас аеругиноза (синегнойный) | Для лечения и профилактики заболеваний, вызванных синегнойной палочкой | Стерильные фаголизаты Pseudomonas aeruginosa |
| Бактериофаг сальмонеллезный групп A,B,C,D,E | Для лечения заболеваний, вызванных сальмонеллами | Стерильный фильтрат фаголизатов наиболее распространенных сероваров Salmonella enterica (Paratyphi А и В, Typhimurium, Choleraesuis, Infantis, Oranienburg, Enteritidis) |
| Бактериофаг клебсиелл поливалентный очищенный | Для лечения и профилактики заболеваний, вызванных клебсиеллами | Стерильная смесь очищенных фильтратов фаголизатов Klebsiella (K. pneumoniae, K. ozaenae, K. rhinoscleromatis) |
| Бактериофаг коли | Для лечения и профилактики заболеваний, вызванных кишечной палочкой | Стерильный фильтрат фаголизатов патогенных штаммов Escherichia coli |
| Бактериофаг протейный жидкий | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний, вызванных протеями | Стерильный фильтрат фаголизатов Proteus vulgaris и Proteus mirabilis |
| Бактериофаг колипротейный | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний | Смесь стерильных фильтратов фаголизатов Proteus vulgaris, Proteus mirabilis и энтеропатогенных серогрупп Escherichia coli |
| * Производитель предупреждает, что препараты должны применяться после оценки чувствительности возбудителей болезни к фагам, что означает еще и необходимость идентификации бактерии-возбудителя. Кроме того, в случае тяжелых инфекций фаготерапия допустима только как часть комплексного лечения |
Отдельно стоит осветить вопрос применения фаготерапии в странах Запада. Как известно, после открытия антибиотиков работы, связанные с медицинским применением фагов, там были полностью свернуты. Однако в последние годы в связи с тревожной динамикой распространения внутрибольничных инфекций, резистентных к большинству известных антибиотиков, многие биотехнологические компании сделали резкий поворот к изучению возможности создания лекарств на основе бактериофагов. Однако, несмотря на существенные технологические преимущества, для создания эффективных препаратов необходима коллекция бактериофагов, действующих на клинически значимые штаммы возбудителей, и соответствующий опыт их клинического применения, чем эти компании пока не обладают.
В начале 2000-х Гленн Моррис, сотрудник Мэрилендского университета, совместно с НИИ бактериофагов, микробиологии и вирусологии в Тбилиси начал испытания фаговых препаратов для получения лицензии на их применение в США. В итоге в 2006 году использование бактериофагов в США было одобрено — в качестве пищевой антилистерийной добавки (спрей для обработки мяса), а вице-президент США Альберт Гор назвал их «новым оружием для борьбы с болезнетворными бактериями». В некоторых штатах фаготерапию разрешено применять натуропатам или же в качестве дополнительного метода в комплексном лечении, например, ран [35], [36]. В настоящее время на Западе проходят доклинические испытания ряда препаратов природных и генетически модифицированных штаммов бактериофагов, активных в отношении таких коварных бактерий, как Clostridium difficile и Pseudomonas aeruginosa, правда, выход препаратов в продажу планируется только к 2023 году [37]. Есть информация и о прохождении клинических испытаний фаговых препаратов [38].
С терапевтической целью бактериофаги применяют, например, в России, Грузии и Польше, причем самыми разными способами. Для коррекции кишечных дисбиозов жидкие препараты применяют внутрь или per rectum при помощи клизмы. Таблетированные формы принимают внутрь, возможно использование бактериофагов и в составе ректальных свечей. При кожных и раневых инфекциях их применяют в виде примочек на очаги поражения. При фарингитах, ларингитах и тонзиллитах препараты используют для орошения или полосканий, при отитах — закапывают в уши. Для лечения абсцессов в их полость вводят ватный шарик, пропитанный препаратом. Больным, страдающим хроническими остеомиелитами, препарат вводят непосредственно в пораженный участок кости. Также препараты можно вносить в брюшную, плевральную и суставные полости, а также применять в форме аэрозолей при поражениях легких. При инфекциях мочевыводящих путей бактериофаги вливают непосредственно в пораженный орган с помощью зонда. При гинекологических заболеваниях препарат вливают в матку либо применяют влагалищные тампоны, пропитанные фаговым раствором.
А еще их используют в методике под названием фаговый дисплей, которая, в частности, позволяет находить новые антитела для диагностики и терапии заболеваний: «Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека» [39]. — Ред.
Преимущества бактериофагов перед антибиотиками достаточно очевидны.
- Способны уничтожать бактерий, устойчивых к антибиотикам и защищенных биопленками.
- Свободно проникают в кровь и лимфу и выводятся через почки с мочой. Как показано в ряде исследований, после приема 30 мл бактериофага уже через два часа фаговые частицы обнаруживают в моче, их концентрация в ней достигает максимума спустя 6–8 часов после приема [40], [41].
- Не вызывают побочных эффектов и аллергии. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий (такое явление — реакция Яриша-Герксгеймера — может наблюдаться и при применении антибиотиков).
- Не подавляют рост нормофлоры, не ослабляют иммунитет.
- Подходят для пациентов любого возраста, нет противопоказаний.
- Можно применять как в виде монотерапии, так и в сочетании с антибиотиками, что значительно снижает риск селекции резистентных штаммов бактерий.
- Можно использовать для санации лечебно-профилактических учреждений и для борьбы с госпитальными инфекциями.
- Можно применять для предупреждения инфекционных болезней в эпидемических очагах —вводить лицам с высоким риском заражения и имевшим контакт с больными.
К сожалению, недостатков бактериофаги тоже не лишены.
- Каждый бактериофаг инфицирует только строго определенный вид бактерий или даже определенный штамм, что требует проведения бактериологического исследования биологического материала больного с целью фаготипирования, а следовательно, отсрочивает начало фаготерапии; и хотя в последнее время разрабатываются ускоренные методики определения фаготипа с помощью ПЦР или масс-спектрометрии, внедряются они медленно из-за высокой стоимости и требований к квалификации специалистов.
- Для поддержания активности бактериофаги требуют особых условий хранения и транспортировки.
- Бактериофаги не действуют на внутриклеточных микроорганизмов.
- Многие бактериофаги инактивируются в условиях низкого рН желудка при пероральном применении препаратов, а также ингибируются неспецифическим действием различных факторов в жидкостях организма.
Заключение
Прошло уже 100 лет с момента открытия бактериофагов. Неоправданно забытые на Западе и чудом сохранившиеся в России, они полвека пребывали в тени успеха антибиотиков. Но эпоха триумфа антибиотиков выявила и важнейшую проблему их активного применения — угрожающий рост резистентности к ним среди опасных патогенов, и многие ученые и врачи видят именно в фагах альтернативу антибиотикам. Если на сегодняшний день мы имеем штаммы бактерий, устойчивые даже к антимикробным препаратам «последней надежды», то фаги, благодаря описанным выше механизмам коэволюции с бактериями, никогда не утратят актуальности. За 100 лет они были детально изучены, признаны безопасными и стали незаменимым инструментом в генетике и биоинженерии, санитарной микробиологии и эпидемиологии, промышленности, медицине и даже в космической сфере (да-да, бактерии с профагом используют для оценки защиты обшивки космических кораблей от радиации). И как нельзя лучше характеризует значение фагов для человека древняя пословица: «Враг моего врага — мой друг».
Первоначальный вариант статьи опубликован на сайте Medach.pro.
- Rubinstein E. and Ronald A.R. (2000). Toronto declaration to combat antimicrobial resistance. Proceedings of the Global Resistance Day, 40th Interscience Conference on Antimicrobial Agents and Chemotherapy, Toronto, Ontario, Canada;
- Стратегия ВОЗ по сдерживанию резистентности к антимикробным препаратам. (2001);
- Koonin E.V., Senkevich T.G., Dolja V.V. (2016). The ancient Virus World and evolution of cells. Biol. Direct. 1, 29;
- d’Hérelles F. (1917). Sur un microbe invisible antagoniste des bacilles dysentériques. Comptes rendus de l’Académie des Sciences, Paris. 165, 373–375;
- Eaton M.D. and Bayne-Jones S. (1934). Bacteriophage therapy. Review of the principles and results of use of bacteriophage in the treatment of infection. JAMA. 103, 1769–1776, 1847–1853, 1934–1939;
- Sanjuán R., Nebot M.R., Chirico N., Mansky L.M., Belshaw R. (2010). Viral mutation rates. J. Virol. 84 (19), 9733–9748;
- Fernandez B., Haas F.L., Wyss O. (1953). Induced host-range mutations in bacteriophage. PNAS. 39 (10), 1052–1057;
- Krupovic M., Prangishvili D., Hendrix R.W., Bamford D.H. (2011). Genomics of bacterial and archaeal viruses: dynamics within the prokaryotic virosphere. Microbiol. Mol. Biol. Rev. 75 (4), 610–635;
- Ackermann H.-W. (2003). Bacteriophage observations and evolution. Res. Microbiol. 154, 245–251;
- Поздеев О.К., Федорова Е.Р., Валеева Ю.В. Микробиология. Методическое пособие — Бактериофаги / Учебно-методическое пособие для студентов медицинских вузов. Казань, 2012;
- Адамс М. Бактериофаги. М.: Медгиз, 1961. — 521 с.;
- Koskella B. and Meaden S. (2013). Understanding bacteriophage specificity in natural microbial communities. Viruses. 5 (3), 806–823;
- Raya R.R. and Hébert E.M. (2009). Isolation of phage via induction of lysogens. Methods Mol. Biol. 501, 23–32;
- Rakhuba D.V., Kolomiets E.I., Dey E.S., Novik G.I. (2010). Bacteriophage receptors, mechanisms of phage adsorption and penetration into host cell. Pol. J. Microbiol. 59 (3), 145–155;
- Guttman B., Raya R., Kutter E. Basic phage biology / In: Bacteriophages: Biology and Applications. Eds. Kutter E., Sulakvelidze A. USA, Boca Raton FL: CRC Press, 2005. — P. 29–66;
- Lenneman B.R. and Rothman-Denes L.B. (2015). Structural and biochemical investigation of bacteriophage N4-encoded RNA polymerases. Biomolecules. 5 (2), 647–667;
- Hinton D.M. (2010). Transcriptional control in the prereplicative phase of T4 development. Virology J. 7, 289;
- Лысак В.В. Микробиология: учебное пособие. Минск: БГУ, 2007. — 430 с.;
- Büttner C.R., Wu Y., Maxwell K.L., Davidson A.R. (2016). Baseplate assembly of phage Mu: Defining the conserved core components of contractile-tailed phages and related bacterial systems. PNAS. 113 (36), 10174–10179;
- Dybvig K., Nowak J.A., Sladek T.L., Maniloff J. (1985). Identification of an enveloped phage, mycoplasma virus L172, that contains a 14-kilobase single-stranded DNA genome. J. Virol. 53 (2), 384–390;
- Suttle C.A. (2005). Viruses in the sea. Nature. 437, 356–361;
- Mojica F.J., Díez-Villaseñor C., García-Martínez J., Soria E. (2005). Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements. J. Mol. Evol. 60 (2), 174–182;
- Sontheimer E.J. and Barrangou R. (2015). The Bacterial origins of the CRISPR genome-editing revolution. Hum. Gene Ther. 26 (7), 413–424;
- CRISPR-системы: иммунизация прокариот;
- А не замахнуться ли нам на… изменение генома?;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Успех в борьбе с лейкозом: на шаг ближе к клиническому применению геномного редактирования;
- van Houte S., Ekroth A.K., Broniewski J.M., Chabas H., Ashby B., Bondy-Denomy J. et al. (2016). The diversity-generating benefits of a prokaryotic adaptive immune system. Nature. 532 (7599), 385–388;
- Bondy-Denomy J., Pawluk A., Maxwell K.L., Davidson A.R. (2013). Bacteriophage genes that inactivate the CRISPR/Cas bacterial immune system. Nature. 493 (7432), 429–432;
- Элементы: «Ученые выяснили, почему бактериофагам трудно бороться с иммунной системой бактерий»;
- Перетрухина А.Т. и Блинова Е.И. Бактерийные и вирусные препараты: учебник. М.: Академия Естествознания, 2010. — 241 с.;
- Fortier L.-C. and Sekulovic O. (2013). Importance of prophages to evolution and virulence of bacterial pathogens. Virulence. 4 (5), 354–365;
- Roy S. and Yusuf M.A. (2013). Bacteriophage therapy: issues and controversies. Bangladesh J. Med. Microbiol. 07 (01), 25–28;
- Волкова О. Смерть обходит задворки науки. «Гамма»;
- Faltys D. (2013). Evergreen researcher Dr. Kutter announces «There’s a Phage for That». Thurston Talk;
- Kuchment A. In Treatment / In: The Forgotten cure. The Past and future of phage therapy. Springer New York, 2012;
- Czaplewski L., Bax R., Clokie M., Dawson M., Fairhead H., Fischetti V.A. et al. (2016). Alternatives to antibiotics — a pipeline portfolio review. Lancet. Infect. Dis. 16, 239–251;
- Sansom C. (2015). Phage therapy for severe infections tested in the first multicentre trial. Lancet Infect. Dis. 15 (12), 1384–1385;
- Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека;
- Smith H.W., Huggins M.B., Shaw K.M. (1987). The control of experimental Escherichia coli diarrhoea in calves by means of bacteriophages. J. Gen. Microbiol. 33, 1111–1126;
- Kaczkowski H., Weber-Dabrowska B., Dabrowski M., Zdrojewicz Z., Cwioro F. (1990). Use of bacteriophages in the treatment of chronic bacterial diseases. Wiad. Lek. 43, 136–141;
- Luria S.E. and Anderson T.F. (1942). The Identification and characterization of bacteriophages with the electron microscope. PNAS. 28 (4), 127–130;
- Ghequire M.G. and De Mot R. (2015). The Tailocin tale: Peeling off phage tails. Trends Microbiol. 23 (10), 587–590.
Вирусы — неклеточные формы жизни
Характеристика вирусов
Наряду с клеточной формой жизни существуют также и неклеточные ее формы — вирусы, вироиды и прионы. Вирусами (от лат. вира — яд) называют мельчайшие живые объекты, неспособные к проявлению каких-либо признаков жизни вне клеток. Факт их существования был доказан еще в 1892 году русским ученым Д. И. Ивановским, установившим, что болезнь растений табака — так называемая табачная мозаика — вызывается необычным возбудителем, который проходит через бактериальные фильтры, однако только в 1917 году Ф. Д’Эррель выделил первый вирус — бактериофаг. Вирусы изучает наука вирусология (от лат. вира — яд и греч. логос — слово, наука).
Вирусы существуют в двух формах: покоящейся, или внеклеточной, и воспроизводящейся, или внутриклеточной. Свободноживущих вирусов не существует, все они внутриклеточные паразиты на генетическом уровне.
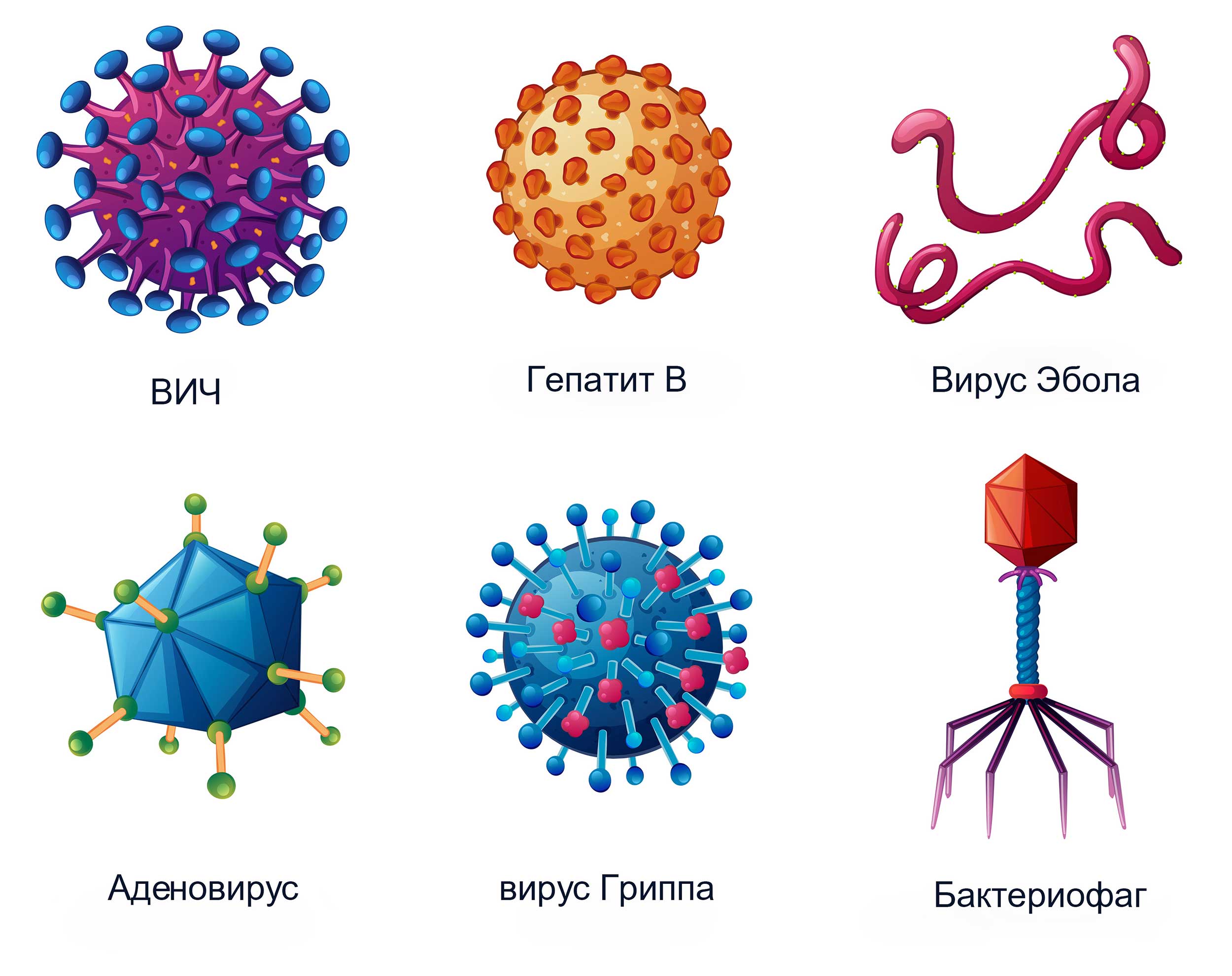
В наше время известно уже около 1 000 вирусов, которые классифицируют по объектам поражения, форме и другим признакам, однако наиболее распространенной является классификация по особенностям химического состава и строения вирусов.
Особенности объектов поражения предопределяют подразделение вирусов на две большие группы: собственно вирусы и бактериофаги. Первые являются паразитами эукариотических клеток (животных, растений и грибов), а вторые — только клеток бактерий.
В отличие от клеточных организмов, вирусы состоят только из органических веществ — в основном нуклеиновых кислот и белка, однако часть вирусов содержит также липиды и углеводы.
Все вирусы условно делят на простые и сложные. Простые вирусы состоят из нуклеиновой кислоты и белковой оболочки — капсида. Капсид не монолитен, он собран из субъединиц белка — капсомеров. У сложных вирусов капсид покрыт липопротеиновой мембраной — суперкапсидом, в состав которого входят также гликопротеины и неструктурные белки-ферменты.
Несмотря на принадлежность к простым вирусам, наиболее сложное строение имеют вирусы бактерий — бактериофаги (от греч. бактерион — палочка и фагос — пожиратель), у которых выделяют головку и отросток, или «хвост». Головка бактериофага образована белковым капсидом и заключенной в нее нуклеиновой кислотой. В хвосте различают белковый чехол и спрятанный внутри него полый стержень. В нижней части стержня имеется специальная пластинка с шипами и нитями, ответственными за взаимодействие бактериофага с поверхностью клетки.
В отличие от клеточных форм жизни, у которых имеется и ДНК, и РНК, в вирусах присутствует только один вид нуклеиновой кислоты (либо ДНК, либо РНК), поэтому их делят на ДНК- (вирусы оспы, простого герпеса, аденовирусы, некоторые вирусы гепатита и бактериофаги) и РНК-содержащие вирусы (вирусы табачной мозаики, ВИЧ, энцефалита, кори, краснухи, бешенства, гриппа, остальные вирусы гепатита, бактериофаги и др.). У вирусов ДНК может быть представлена одноцепочечной молекулой, а РНК — двухцепочечной.
Так как вирусы лишены органоидов движения, заражение происходит при непосредственном контакте вируса с клеткой. В основном это происходит воздушно-капельным путем (грипп), через пищеварительную систему (гепатиты), кровь (ВИЧ) или переносчика (вирус энцефалита).
Непосредственно в клетку вирусы могут попадать случайно, с жидкостью, поглощаемой путем пиноцитоза, однако чаще их проникновению предшествует контакт с мембраной клетки-хозяина, в результате которого нуклеиновая кислота вируса или вся вирусная частица оказывается в цитоплазме. Большинство вирусов проникает не в любую клетку организма-хозяина, а в строго определенную, например, вирусы гепатита поражают клетки печени, а вирусы гриппа — клетки слизистой оболочки верхних дыхательных путей, так как они способны взаимодействовать со специфическими белками-рецепторами на поверхности мембраны клетки-хозяина, которые отсутствуют в других клетках.
В связи с тем, что у растений, бактерий и грибов клетки имеют прочные клеточные стенки, у вирусов, поражающих эти организмы, сформировались соответствующие приспособления к проникновению. Так, бактериофаги после взаимодействия с поверхностью клетки-хозяина «прокалывают» ее своим стержнем и вводят в цитоплазму клетки-хозяина нуклеиновую кислоту. У грибов заражение происходит в основном при повреждении клеточных стенок, у растений возможен как вышеупомянутый путь, так и проникновение вируса по плазмодесмам.
После проникновения в клетку происходит «раздевание» вируса, то есть утрата капсида. Дальнейшие события зависят от характера нуклеиновой кислоты вируса: ДНК-содержащие вирусы встраивают свою ДНК в геном клетки-хозяина (бактериофаги), а на РНК либо сначала синтезируется ДНК, которая затем встраивается в геном клетки-хозяина (ВИЧ), либо на ней может непосредственно происходить синтез белка (вирус гриппа). Воспроизведение нуклеиновой кислоты вируса и синтез белков капсида с использованием белоксинтезирующего аппарата клетки являются обязательными компонентами вирусной инфекции, после чего происходят самосборка вирусных частиц и их выход из клетки. Вирусные частицы в одних случаях покидают клетку, постепенно отпочковываясь от нее, а в других случаях происходит микровзрыв, сопровождающийся гибелью клетки.
Вирусы не только угнетают синтез собственных макромолекул в клетке, но и способны вызывать повреждение клеточных структур, особенно во время массового выхода из клетки. Это приводит, например, к массовой гибели промышленных культур молочнокислых бактерий в случае поражения некоторыми бактериофагами, нарушения иммунитета вследствие уничтожения ВИЧ Т4-лимфоцитов, представляющих собой одно из центральных звеньев защитных сил организма, к многочисленным кровоизлияниям и гибели человека в результате заражения вирусом Эбола, к перерождению клетки и образованию раковой опухоли и т. д.
Несмотря на то, что проникшие в клетку вирусы часто быстро подавляют ее системы репарации и вызывают гибель, вероятен также и иной сценарий развития событий — активация защитных сил организма, которая связана с синтезом противовирусных белков, например интерферона и иммуноглобулинов. При этом размножение вируса прерывается, новые вирусные частицы не образуются, а остатки вируса выводятся из клетки.
Происхождение вирусов не совсем ясно, однако полагают, что вирусы и бактериофаги — это обособившиеся генетические элементы клеток (например, плазмиды бактерий), которые эволюционировали вместе с клеточными формами жизни. Существуют также гипотезы упрощения прокариотических организмов вследствие паразитирования, доклеточного происхождения вирусов и занесения их из космоса.
Вирусы вызывают многочисленные заболевания человека, животных и растений. У растений это мозаичность табака и тюльпанов, у человека — грипп, краснуха, корь, СПИД и др. В истории человечества вирусы черной оспы, «испанки», а теперь и ВИЧ унесли жизни сотен миллионов человек. Однако инфицирование способно и повышать устойчивость организма к разнообразным возбудителям заболеваний (иммунитет), и таким образом способствовать их эволюционному прогрессу. Кроме того, вирусы способны «прихватывать» части генетической информации клетки-хозяина и переносить их следующей жертве, обеспечивая тем самым так называемый горизонтальный перенос генов, образование мутаций и, в конце концов, поставку материала для процесса эволюции.
В наше время вирусы широко используют в изучении строения и функций генетического аппарата, а также принципов и механизмов реализации наследственной информации, они применяются как инструмент генетической инженерии и биологической борьбы с возбудителями некоторых заболеваний растений, грибов, животных и человека.
Заболевание СПИД и ВИЧ-инфекция
ВИЧ (вирус иммунодефицита человека) был обнаружен только в начале 80-х годов ХХ века, однако скорость распространения вызываемого им заболевания и невозможность излечения на данном этапе развития медицины заставляют уделять ему повышенное внимание. В 2008 году Ф. Барре-Синусси и Л. Монтанье за исследование ВИЧ была присуждена Нобелевская премия в области физиологии и медицины.
ВИЧ — сложный РНК-содержащий вирус, который поражает главным образом Т4-лимфоциты, координирующие работу всей иммунной системы. На РНК вируса при помощи фермента РНК-зависимой ДНК-полимеразы (обратной транскриптазы) синтезируется ДНК, которая встраивается в геном клетки-хозяина, превращается в провирус и «затаивается» на неопределенное время. Впоследствии с этого участка ДНК начинается считывание информации о вирусной РНК и белках, которые собираются в вирусные частицы и практически одновременно покидают ее, обрекая на гибель. Вирусные частицы поражают все новые клетки и приводят к снижению иммунитета.
ВИЧ-инфекция имеет несколько стадий, при этом длительный период человек может быть носителем заболевания и заражать других людей, однако сколько бы ни длился этот период, все равно наступает последняя стадия, которая называется синдромом приобретенного иммунодефицита, или СПИДом.
Заболевание характеризуется снижением, а затем и полной потерей иммунитета организма ко всем возбудителям заболеваний. Признаками СПИДа являются хроническое поражение слизистых оболочек полости рта и кожи возбудителями вирусных и грибковых заболеваний (герпесом, дрожжевыми грибами и т. д.), тяжелая пневмония и другие СПИДассоциированные заболевания.
ВИЧ передается половым путем, через кровь и другие жидкости организма, но не передается через рукопожатия и бытовые предметы. В первое время в нашей стране инфицирование ВИЧ чаще было сопряжено с неразборчивыми половыми контактами, особенно гомосексуальными, инъекционной наркоманией, переливанием зараженной крови, в настоящее же время эпидемия вышла за пределы групп риска и быстро распространяется на другие категории населения.
Основными средствами профилактики распространения ВИЧ-инфекции являются использование презервативов, разборчивость в половых связях и отказ от употребления наркотиков.
Меры профилактики распространения вирусных заболеваний
Основным средством профилактики вирусных заболеваний у человека является ношение марлевых повязок при контакте с больными заболеваниями дыхательных путей, мытье рук, овощей и фруктов, протравливание мест обитания переносчиков вирусных заболеваний, вакцинация от клещевого энцефалита, стерилизация медицинских инструментов в лечебных учреждениях и др. Во избежание заражения ВИЧ следует также отказаться от употребления алкоголя, наркотиков, иметь единственного полового партнера, использовать индивидуальные средства защиты при половых контактах и т. д.
Вироиды
Вироиды (от лат. вирус — яд и греч. эйдос — форма, вид) — это мельчайшие возбудители болезней растений, в состав которых входит только низкомолекулярная РНК.
Их нуклеиновая кислота, вероятно, не кодирует собственные белки, а только воспроизводится в клетках растения-хозяина, используя ее ферментные системы. Нередко она может также разрезать ДНК клетки-хозяина на несколько частей, обрекая тем самым клетку и растение в целом на гибель. Так, несколько лет назад вироиды вызвали гибель миллионов кокосовых пальм на Филиппинах.
Прионы
Прионы (сокр. англ. proteinaceous infectious и —on) — это небольшие инфекционные агенты белковой природы, имеющие форму нити или кристалла.
Такие же по составу белки имеются и в нормальной клетке, однако прионы обладают особой третичной структурой. Попадая в организм с пищей, они помогают соответствующим «нормальным » белкам приобретать свойственную самим прионам структуру, что приводит к накоплению «ненормальных» белков и дефициту нормальных. Естественно, что это вызывает нарушения функций тканей и органов, в особенности центральной нервной системы, и развитие неизлечимых в настоящий момент заболеваний: «коровьего бешенства», болезни Крейтцфельдта – Якоба, куру и др.
Царство бактерий, строение, жизнедеятельность, размножение, роль в природе.
Бактерии — возбудители заболеваний растений, животных, человека. Профилактика
заболеваний, вызываемых бактериями
Царство бактерий
Бактерии — типичные прокариоты, представленные в основном одноклеточными и колониальными, реже многоклеточными формами. Среди них есть как автотрофы, так и гетеротрофы. Бактерии появились на Земле около 3,5 млрд лет назад и сыграли ключевую роль в преобразовании атмосферы и литосферы планеты. Обитают они во всех средах, от ледниковой минусовой температуры до кипящих источников, их находят даже на метеоритах, упавших на Землю, в атмосфере над ее поверхностью и в океанских глубинах. В настоящее время известно более 100 000 видов бактерий, однако только около 3000 из них изучены в той или иной степени. Изучением бактерий занимается наука бактериология, являющаяся разделом микробиологии. Впервые бактерии были описаны в XVII веке выдающимся микроскопистом А. ван Левенгуком.
Строение бактерий
Средние размеры клетки бактерий составляют 0,5–10 мкм. Бактериальная клетка имеет типичное для прокариот строение: кольцевая молекула ДНК, или хромосома бактерий, не отделена от цитоплазмы мембраной, а располагается в особом ее участке — нуклеоиде. Хромосома может быть не единственной молекулой ДНК в клетке — дополнительные маленькие кольцевые молекулы ДНК, способные встраиваться в хромосому, называются плазмидами. Плазмиды могут нести гены болезнетворности или устойчивости к антибиотикам.
Органоиды бактерий представлены в основном рибосомами, на которых происходит синтез белков. Все ферменты этих организмов находятся либо в цитоплазме, либо на немногочисленных мембранах, например, впячивании плазмалеммы — мезосоме.
Запасные вещества бактерий чаще всего откладываются в виде зерен крахмала или гликогена, капель жира и гранул волютина. У ряда бактерий, особенно у синезеленых водорослей, клетки содержат также вакуоли с белковыми оболочками, выполняющие функцию связывания атмосферного азота.
Так как многие бактерии подвижны, они имеют органоиды движения — жгутики. Кроме того, у них могут быть другие образования — ворсинки, служащие для прикрепления к субстрату или обмена наследственной информацией.
Как и эукариотические клетки, клетка бактерий окружена плазмалеммой, поверх которой чаще всего расположены клеточная стенка и капсула или облако слизи. Основу клеточной стенки большинства бактерий составляет сложное органическое вещество — муреин, цианобактерии имеют целлюлозные клеточные стенки. Муреин расщепляется компонентом слюны человека — лизоцимом, на чем и основывается его бактерицидное действие.
Капсула бактерий представляет собой уплотненный слой слизи, тогда как облако не имеет четко очерченных границ. Бактериальная слизь в основном имеет углеводную природу.
Компоненты поверхностного аппарата выполняют целый ряд функций: защищают бактериальную клетку от воздействия факторов окружающей среды, в том числе от проникновения бактериофагов, придают ей форму, помогают удерживать воду и принимают участие в транспорте веществ, служат резервуаром питательных веществ, объединяют клетки в колонии и цепочки, а также обеспечивают их прикрепление к субстрату.
Некоторые бактерии не образуют ни клеточной стенки, ни капсулы, тогда как другие утратили их в результате воздействия антибиотиков и факторов окружающей среды.
В зависимости от формы клетки бактерии делят на кокки, бациллы, вибрионы, спириллы и спирохеты. Кокки — это бактерии сферической формы, бациллы — палочковидной, спириллы — спиральной, вибрионы имеют вид запятой, тогда как спирохетами называют тонкие, длинные и извитые бактерии, способные к движению. Отдельные сферические бактерии называются микрококками, их группы по две — диплококками, гроздевидные скопления — стафилококками, а вытянутые цепочки — стрептококками. Эти морфологические особенности учитываются в классификации бактерий.
Большинство бактерий, вызывающих заболевания человека, имеют палочковидную форму, например дизентерийная, ботулиническая, дифтерийная, чумная, сибиреязвенная и столбнячная палочки, палочка Коха (туберкулез) и сальмонеллы (сальмонеллез и брюшной тиф). Реже это могут быть вибрионы, как хеликобактерии (язва желудка и двенадцатиперстной кишки) и холерный вибрион, а также спирохеты (сифилис) или диплококки (гонорея).
Если настоящие бактерии представлены одиночными клетками или колониальными формами, то среди цианобактерий (синезеленых водорослей) встречаются также многоклеточные формы, у которых клетки могут различаться по строению и выполняемым функциям. Так, у водоросли анабены среди вегетативных клеток встречаются и большие по размерам клетки — гетероцисты, имеющие общий чехол со всеми остальными клетками. Гетероцисты выполняют функции связывания атмосферного азота и вегетативного размножения, так как именно по этим клеткам происходит разрыв нити водоросли. Цианобактерии содержат хлорофилл и другие пигменты фотосинтеза (каротиноиды и фикобилины), что обусловливает их окраску. К ним принадлежат носток, анабена, осциллятория и др. Особенности строения и процессов жизнедеятельности синезеленых водорослей способствовали их выделению в отдельное подцарство цианобактерий (синезеленых водорослей), тогда как остальные представители царства относятся к подцарству бактерий.
Современная классификация бактерий учитывает не только морфологические их особенности, но и строение их клеточной стенки и процессы жизнедеятельности. По этим критериям бактерии предлагают разделить на два царства: археи и бактерии. Археи составляют сравнительно малоизученную группу прокариотических организмов, одни из которых обитают в экстремальных условиях среды, например в горячих гейзерах и сильно засоленных водоемах, а другие способны выделять метан в процессе жизнедеятельности. Археи присутствуют и в кишечнике человека, где синтезируют витамин В12. По организации наследственной информации и ряду других признаков археи ближе к эукариотическим организмам, чем бактерии.
Жизнедеятельность бактерий
Бактериям присущи все признаки живого, в том числе обмен веществ и превращения энергии, способность к самовоспроизведению и др. По способу питания бактерии относят к гетеротрофам и автотрофам. Среди гетеротрофных бактерий есть сапротрофы, паразиты, мутуалисты и даже хищники. Большинство бактерий поглощают пищу в растворенном виде из-за наличия клеточной стенки, а не заглатывают ее.
Сапротрофы обеспечивают расщепление органических веществ до минеральных, способствуя круговороту веществ в природе. Паразитические бактерии вызывают многочисленные заболевания, например чуму, холеру, туберкулез, пневмонию и другие. Мутуалистами являются бактерии кожи и слизистых оболочек человека, а также кишечника. Они не только защищают человека от других болезнетворных бактерий, но и могут синтезировать витамины, которые не образуются в организме человека. Следует отметить, что попадание мутуалистических бактерий в несвойственные им места приводит к развитию воспалительных процессов, например, стафилококк эпидермальный, в норме обитающий на нашей коже, может вызвать цистит, а стафилококк золотистый со слизистых оболочек — образование нарывов на месте ранок.
Не менее важен симбиоз клубеньковых бактерий с корнями растений. Эти бактерии связывают атмосферный азот в доступной для растений форме, а взамен получают от растений воду и органические вещества.
Автотрофные бактерии получают энергию за счет фотосинтеза или хемосинтеза. Значительная часть фотосинтезирующих бактерий относится к цианобактериям, или синезеленым водорослям, которые представлены свободноживущими формами, компонентами лишайников и мутуалистами, как синезеленая водоросль анабена, образующая симбиоз с водным папоротником азоллой.
Среди автотрофных бактерий, не относящихся к цианобактериям, можно найти как фототрофов, так и хемотрофов. Последние относятся к серо-, железо-, нитрифицирующим и водородным бактериям.
По потребности в кислороде бактерии делят на анаэробов (не нуждающихся в кислороде) и аэробов (требующих кислорода для своей жизнедеятельности). Соотношение этих форм бактерий зависит от особенностей среды обитания.
При неблагоприятных условиях бактерии образуют споры и цисты, имеющие плотные капсулы. Споры способны находиться в неактивном состоянии в течение многих лет (например, споры сибирской язвы — свыше 30 лет), однако при благоприятных условиях «спящая» бактерия возобновляет свою жизнедеятельность.
Размножение бактерий
Бактерии размножаются в основном делением клетки надвое, которому предшествует удвоение ДНК. При благоприятных условиях среды бактерии способны делиться каждые 20–30 мин. Нетрудно подсчитать, какое количество бактерий дает одна-единственная материнская клетка в течение суток.
Вегетативное размножение характерно только для многоклеточных цианобактерий, у которых образуются и отделяются специальные нити для размножения, однако нити могут разрываться и по гетероцистам.
У бактерий наблюдаются также процессы одностороннего переноса наследственной информации. В одних случаях происходит передача плазмиды от одной бактерии к другой с помощью специальной ворсинки — это конъюгация. В других случаях определенный участок ДНК от одной зараженной клетки к другой переносит бактериофаг — это трансдукция. Однако одним из наиболее интересных способов передачи наследственной информации является трансформация, при которой клетка не только поглощает ДНК другой бактерии из окружающей среды, но и встраивает ее в собственную хромосому, приобретая закодированные признаки. Открытие явления трансформации бактерий-пневмококков Ф. Гриффитом в 1928 году позволило вскоре установить функции нуклеиновых кислот как основного носителя наследственной информации, а в наше время широко используется в генетике бактерий и генной инженерии.
Роль бактерий в природе
В 1 г сельскохозяйственных почв содержится до 2,5 млрд бактерий, несколько меньше их в воде и в воздухе, до 2 кг этих организмов могут находиться на коже, слизистых оболочках и в кишечнике человека, тогда как не связанные напрямую с окружающей средой органы практически лишены бактериальной микрофлоры.
Бактерии играют исключительную роль в круговороте углерода, кислорода, водорода, азота, фосфора, серы, кальция и других элементов. Они возвращают в почву неорганические вещества (совместно с грибами), разлагая органические, в результате их деятельности образовались кислород земной атмосферы, залежи железной руды, карбонатов и других полезных ископаемых, они связывают азот в почве, образуя симбиоз с корнями бобовых и других растений (клубеньковые бактерии), переводя его в доступную для растений форму. Бактерии принимают активное участие и в биологической очистке водоемов. В отсутствие этих организмов существенно замедляются процессы почвообразования.
Бактерии нашли широкое применение в хозяйственной деятельности человека. Так, молочнокислые бактерии используются не только в производстве молочнокислых продуктов, но и в процессе квашения овощей и силосования кормов. Кишечная палочка с помощью методов генной инженерии «освоила» производство инсулина, она также является индикатором загрязнения воды. Другие бактерии благодаря способности концентрировать металлы используются для их добычи из бедных руд и отвалов.
Вред, наносимый бактериями, не менее значителен. Так, массовое размножение цианобактерий приводит к «цветению» воды, при этом в воду выделяется значительное количество токсических веществ, которые способны вызвать гибель самих синезеленых водорослей и других организмов. При нарушении санитарных норм бактерии портят продукты питания и загрязняют лекарственные препараты, что может приводить к негативным последствиям для здоровья человека, не говоря уже о том, что сами по себе многие бактерии являются болезнетворными организмами.
Бактерии — возбудители заболеваний растений, животных, человека
Паразитические бактерии вызывают заболевания человека, животных и растений, называемые бактериозами. У растений широко распространены такие бактериальные заболевания, как кольцевая гниль и парша картофеля, бактериальный ожог, рак и увядание томатов и др., которые наносят значительный вред сельскому хозяйству.
Животные не менее растений подвержены бактериальным заболеваниям, например чуме, туляремии, сальмонеллезу, сибирской язве, бруцеллезу и др. Больные животные представляют опасность и для человека, так как при контакте с ними или через переносчика (блох, клещей, комаров и др.) может происходить инфицирование. Чаще всего источниками инфекции являются грызуны, домашний скот и птица. В связи с этим необходимо строго придерживаться гигиенических норм и правил при контакте с животными.
Заражение человека возбудителями бактериальных инфекций происходит через пищеварительную систему, органы дыхания, при укусах переносчиков, а также через слизистые оболочки и повреждения кожи. В связи с этим бактериозы делят на кишечные (язва желудка, холера, дизентерия, сальмонеллез, брюшной тиф, ботулизм), респираторные (дифтерия, коклюш, туберкулез), кровяные инфекции (чума, сыпной тиф) и инфекции наружных покровов (сибирская язва, столбняк, сифилис и гонорея).
Механизм болезнетворного влияния бактерий в корне отличается от такового у вирусов, поскольку бактерии выделяют токсические вещества, оказывающие комплексное неблагоприятное воздействие на организм. При этом они могут даже не размножаться в тканях, как при столбняке и ботулизме. Последний вызывается ботулиническим токсином, который вырабатывается бактерией рода клостридиум в неправильно приготовленных и длительное время хранившихся консервах.
К категории особо опасных инфекций бактериальной природы относятся чума, бруцеллез, сибирская язва, сап и холера, так как их возбудители способны заразить почти каждого человека, протекают в тяжелой форме и вызывают как эпидемии, так и пандемии.
Несмотря на четкую организацию санитарно-эпидемиологической службы в Российской Федерации и других странах мира, постоянно сохраняется опасность возникновения эпидемий чумы и холеры, в последнее время вызывают также тревогу и темпы распространения туберкулеза.
Профилактика заболеваний, вызываемых бактериями
Основным средством профилактики бактериальных заболеваний у человека является повышение санитарной культуры населения, своевременное выявление и лечение больных, ношение марлевых повязок при контакте с больными, мытье рук, овощей и фруктов, протравливание мест обитания переносчиков соответствующих заболеваний, вакцинация и др. Например, если профилактика дифтерии заключается в периодической вакцинации, то от туберкулеза вакцины не существует, поэтому требуется своевременное выявление заболевших. Для этого в детском и подростковом возрасте делают пробу Манту, а взрослые обязаны ежегодно проходить флюорографическое исследование. При подозрении на туберкулез берутся дополнительные анализы, по результатам которых ставится окончательный диагноз. Поскольку туберкулезная палочка может поражать не только легкие, но и другие внутренние органы, а в последнее время наблюдается рост заболеваемости туберкулезом и выявлены чрезвычайно опасные его формы, требуется изоляция больных, соблюдение гигиенического режима и длительное лечение в специальных лечебницах и санаториях.
Для лечения бактериальных заболеваний чаще всего применяются антибиотики — сложные химические вещества, выделяемые микроорганизмами и способные подавлять развитие других микроорганизмов и раковых клеток или даже убивать их. Первый пригодный для клинического применения антибиотик — пенициллин — был получен в 1929 году А. Флемингом. Во время Великой Отечественной войны благодаря применению пенициллина были спасены жизни многих солдат. В настоящее время антибиотики применяют для лечения большого количества заболеваний человека, животных и растений, однако длительное применение приводит к появлению устойчивых к ним форм микроорганизмов. Поэтому во всем мире поднимается вопрос об отказе от антибиотиков как от лекарственного средства. Антибиотики применяются также в животноводстве для повышения продуктивности и для исследования тонких механизмов жизнедеятельности, поскольку они способны прерывать некоторые процессы, например образование клеточной стенки или синтез белка.
Вирусы
Вирусы (от лат. вирус — яд) – представляют собой мельчайшие неклеточные формы жизни. Вирусы имеют размеры 2-5*10-7см, что значительно меньше, чем бактериальная клетка (от 0,2 до 10 мкм). Рассмотреть вирусы возможно только с помощью электронного микроскопа, увеличивающий в 100 тысяч и более раз. Вирусы относятся к отдельному царству.
Вирусология – наука изучающая вирусы. Становление вирусологии как науки начинается с 30-х годов 20 века.
История открытия вирусов
Впервые вирус табачной мозаики (рис.1) был открыт русским ученым Д.И.Ивановским (1892г.) (рис.2).
Рис.1 Листья табака (слева) пораженные вирусом табачной мозаики (справа)
Студент Петербургского университета Дмитрий Ивановский выезжал на Украину и в Бессарабию для определения причин болезни табака. В листьях табака будущий ученый не обнаружил клеток бактерий, однако было замечено, что сок зараженного растения поражал здоровые листья. Используя свечу Шамберлана Ивановский профильтровал сок больного растения, тем самым исключив прохождение через фильтр мелких бактерий. Полученный фильтрат все равно вызывал заражение листьев табака. Это еще раз доказывало «невиновность» бактерий. Д.И.Ивановский попробовал культивировать возбудителя на питательной среде, однако это не дало результата. После проведенных опытов Дмитрий Иосифович пришел к выводу, что возбудитель является необычной природы и имеет размеры в разы меньше чем клетка бактерии. В последствие возбудитель был назван «фильтрующиеся бактерии».
Рис.2 Д.И.Ивановский — первооткрыватель вирусов
Свои выводы ученый изложил в труде «О двух болезнях табака» в 1892 году. Именно этот год считается годом открытия вирусов.
Наряду с Д.И.Ивановским изучением вирусов занимался голландский микробиолог Мартин Бейеринк, который в 1898 году повторив опыты русского ученого, назвал вирусный раствор – «заразной живой жидкостью» или «жидкий живой контагий».
Первый вирус животных (вирус ящура) был описан в 1897 году Лёффером и Фрошем. В 1901 году вирус желтой лихорадки был открыт англичанами У. Ридом и Д. Кэрроллом.
В 1917 году Ф.д’Эррелем был открыт бактериофаг – вирус, поражающий бактерии.
Удивительно то, что первая вакцина от оспы была предложена за 100 лет до открытия вирусов, в 1796 году английским врачом Э.Дженнером. Второй по открытию стала – антирабическая вакцина, представленная французским ученым микробиологом Л.Пастером в 1885 году.
Названия «ультравирус» и «фильтрующий вирус» использовались в науке до укоренившегося ныне краткого термина — «вирус», который впервые применил Л.Пастер.
Строение и формы вирусов
Вирусы — неклеточные частицы, состоящие из белковой оболочки (капсид) и собственного генетического материала в виде нуклеиновой кислоты (ДНК или РНК) (рис.3).
Рис.3 Строение вируса иммунодефицита человека (ВИЧ)
Вирусы могут обладать разнообразными формами: шаровидные, овальные, палочковидные, нитевидные, цилиндры, тетраэдры, октаэдры и др.(рис.4).
Рис.4 Разнообразные формы и виды вирусов
Более сложные вирусы имеют в своем составе дополнительные белковые или липопротеидные оболочки. Вирусы гриппа и герпеса кроме белковой оболочки могут содержать и углеводы.
| ДНК-содержащие вирусы | РНК-содержащие вирусы |
|---|---|
| оспы | бешенства |
| герпеса | кори |
| бактериофаги Т-группы | СПИДа и лейкоза |
| гепатита В | гепатита А |
| паповавирусы | гриппа |
| аденовирусы | полимиелита |
| цитомегаловирус | ОРЗ |
| Эпштейн-Бара | желтой лихорадки |
| и др. | краснухи и др. |
Геном вирусов может быть представлен однонитчатыми и двунитчатыми молекулами ДНК (вирус оспы человека, овец, свиней, аденовирус человека) и РНК (матрица для вирусов насекомых и других животных). Вирусы с однонитчатой молекулой РНК (энцефалит, краснуха, корь, бешенство, грипп и др.).
Вне живой клетки вирус не питается, не передвигается, не растет, не размножается и не проявляет других свойств живого.
Размножение вирусов
Вирусы способны размножаться только внутри живой клетки. Вирус проникает внутрь клетки путем связывания его с особым протеином – рецептором, расположенным на поверхности клетки. На поверхности чувствительной клетки происходит связывание с рецептором, после чего присоединившейся участок погружается в цитоплазму и превращается в вакуоль. Стенки вакуоли, состоящей из цитоплазматической мембраны способны сливаться с другими вакуолями или даже ядром. В результате вирус достигает любой участок клетки.
Основные этапы заражения вирусом:
1.Присоединение вируса к мембране клетки-хозяина.
2.Впрыскивание своей нуклеиновой кислоты (НК) в цитоплазму клетки-хозяина. Капсид остается снаружи.
3. ДНК вируса у эукариотической клетки проникает в ядро клетки и встраивается в ДНК хозяина. В бактериальной клетке ДНК вируса встраивается в ДНК бактерии. РНК содержащие вирусы вначале делают из нее копию в виде ДНК, а затем полученную ДНК встраивают в хромосому или нуклеотид клетки-хозяина.
4. Генетический материал клетки хозяина перестает функционировать. В ядре осуществляется синтез копий вирусной НК, а в цитоплазме на рибосомах – синтез копий вирусного капсида.
5. Образуются функциональные вирусы. НК «одевается» в капсид, происходит сборка вирусных частиц.
6. Образовавшиеся вирусы выходят из клетки-хозяина, так как первая исчерпала свои ресурсы. Вирусы продолжают проникать в новые клетки, расположенные поблизости.
Описанные этапы характерны для литических (от греч. «лизис» — растворение, разрушение, распад) вирусов, вызывающие разрушение или гибель клетки. Существует так же второй вид, так называемых «умеренных» вирусов. Они встраиваю свою нуклеиновую кислоту в ДНК клетки.
Паразитируя на генетическом уровне живой клетки, они встраиваются в ее геном. Внедрив свой генетический код в молекулу ДНК, вирус становится частью живой клетки. В такой форме он может не проявлять себя неопределенно долгое время. В какой-то момент вирусные частицы ДНК «включаются» одновременно во всех зараженных клетках, вызывая их гибель.
Данный процесс до конца не изучен, и возможно именно он мог бы решить вопрос возникновения онкологических заболеваний.
Быстрая способность адаптироваться и видоизменяться, подстраиваясь к геному клетки, делает некоторые вирусные заболевания практически неизлечимыми. Таким образом, вирусы представляют паразитизм на генетическом уровне (рис.5).
Рис.5 Размножение вируса гриппа
Бактериофаги
Совсем по-другому проникает в клетку вирус бактерий – бактериофаг (от греч. фагос – «пожирающий»)(рис.6).
Рис.6 Строение бактериофага
Бактериофаг состоит из головки, хвостика и нескольких хвостовых отростков (белковых нитей). Наружная часть головки покрыта белковой оболочкой. Во внутренней части головки расположена ДНК, а внутри хвоста проходит центральный канал. Из-за толстых клеточных стенок бактерий белок-рецептор бактериофага не может погрузиться в цитоплазму.
Удерживаясь на поверхности клетки за счет шипов, расположенных под базальной мембраной, бактериофаг пронзает стенку бактерии и вводит внутрь полый стержень. По этому стержню в цитоплазму поступает ДНК (или РНК). Геном бактериофага проникает внутрь клетки, а оболочка остается снаружи. Спустя время, сформировавшиеся зрелые фаговые частицы разрушают бактерию изнутри и выходят наружу (рис.7).
Рис.7 Размножение бактериофага
Обладая способностью полного уничтожения бактериальной клетки, бактериофаги могут быть использованы для лечения разнообразных бактериальных заболеваний (холеры, дизентерии, брюшного тифа и др.).
Отмечено, что отделение от вирусной частицы нуклеиновой кислоты приводит к потере инфекционной способности к репродукции. Это говорит о том, что нуклеиновая кислота играет важную роль в размножении вируса.
При благоприятных условиях вирус очень быстро размножается. Так, за 30 минут в одной клетке появляются сотни новых вирусов.
Вирусы могут продолжительно сохраняться в почве, воде и другим средах. Некоторые представители устойчивы к высоким температурам (свыше +100С) и высушиванию.
Виды вирусных заболеваний
В настоящее время известно около 400 видов вирусов растений и около 500 видов вирусов животных.Вирусы растений вызывают поражение листьев и других органов, вызывая появление разноцветных или бесцветных пятен и полосок. Вирусы вызывают замедление роста растений, изменяет их форму и снижает урожайность.
Наиболее опасными для человека являются вирусы гепатита – А, В, С. Вирус способен сильно повреждать ткани печени, вызвав необратимые последствия.
ВИЧ.СПИД
Более опасную для человечества форму представляет вирус иммунодефицита человека или сокращенно ВИЧ (HIV). Попав в кровь, ВИЧ, поражает иммунную систему человека, приводя к развитию болезни под названием СПИД (синдром приобретенного иммунодефицита человека). РНК-содержащий ВИЧ атакует белые кровяные клетки – лимфоциты, отвечающие за иммунитет, делая человека уязвимым для других болезней.
Внедренный в лимфоциты РНК вирус начинает синтезировать фермент – ревертазу. Этот фермент служит матрицей для последующего синтеза молекулы ДНК. Синтезированная вирусная ДНК встраивается в хромосому лимфоцита. После чего вирус долгое время может не проявлять себя. Это может длиться от 1 до 2 лет, а иногда и более. Спустя время вирусная ДНК начинает проявлять себя, синтезируя сотни тысяч вирусов, что в итоге приводит к разрушению лимфоцита.
Вероятность заражения ВИЧ увеличивается при прямом контакте с кровью больного человека. Распространенные пути передачи вируса; незащищенный половой контакт с инфицированным человеком, инъекции шприцом, переливание крови. ВИЧ не передается воздушно-капельным путем, через укусы насекомых, посуду, при рукопожатиях и пользовании общественными местами (туалеты, бассейны, бани и т.п.).
В настоящее время вакцины против СПИДа нет, но существуют медицинские препараты на основе азотимидина и ингибиторов протеаз, способные подавить синтез вирусной ДНК. Это облегчает течение болезни и значительно удлиняет жизнь человека.
Хочется отметить, что ВИЧ инфицированный человек, вовремя обратившийся в центр СПИДа, может контролировать развитие этой тяжелой болезни и в принципе жить полноценной жизнью с соблюдением определенных мер. При отсутствии строгого контроля и лечения, стадия инфицирования переходит в стадию СПИДа, которая неминуемо ведет к гибели. Человек на стадии СПИДа, из-за «иммунной беспомощности», может погибнуть от ряда инфекционных болезней.
Симптомами СПИДа является температура, постоянный озноб, легкая простужаемость, резкое похудение.
Чтобы предупредить СПИД необходимо соблюдать следующие правила;
— избегать прямого контакта с кровью неизвестного человека (зараженными так же могут быть лимфа, сперма, влагалищные выделения, грудное молоко и др.);
— избегать случайные половые связи;
— использовать презервативы;
— пользоваться одноразовыми шприцами;
— пользоваться личными бритвенными приборами, при этом не разрешать пользоваться своими.
Природным очагом СПИДа по мнению ученых считается Центральная Африка, а носителем вируса являются зеленые мартышки.
Грипп
Всем известный вирус гриппа не менее опасный, наряду с корью, гепатитом и полиомиелитом.
Грипп – болезнь, угрожающая человеческой жизни. В 1918-1919 годах весь земной шар трижды был охвачен волнами гриппа, во время которых погибли 20 млн человек. В США в зиму 1968-1969 годов 50 млн человек перенесли грипп, 70 тыс. из них скончались.
Наиболее распространенные вирусные инфекции, пути заражения и меры профилактики
Инфекция |
Пути заражения |
Меры профилактики |
Гепатит (А) |
«Болезнь грязных рук». | Мыть руки перед едой, овощи и фрукты — перед употреблением. При хранении продуктов соблюдать гигиенические требования |
СПИД |
Половой путь и через кровь | Исключение половых контактов с инфицированными |
Энцефалит |
Переносчики — кровососущие клещи | Исключить укусы клещей, особенно в природных очагах (хвойные леса) и в период активизации (март-май) |
КГЛ — конго-крымская геморрагическая лихорадка |
||
Бешенство |
При укусе больных животных | Исключать контакты с животными, не привитыми от бешенства. При контакте с подозрительным животным немедленно обращаться к врачу |
Грипп (ОРВИ) |
Воздушно-капельный | Марлевые повязки, влажная уборка, дезинфекция и проветривание помещений |
Корь, краснуха |
Воздушно, но не капельный | Соблюдать правила личной гигиены. Не вступать в контакт с инфицированными, применять ватно-марлевые повязки |
Ветряная оспа |
||
Ящур |
Болеют парнокопытные животные (коровы, козы, овцы) | Исключение контакта и срочное обращение к ветеринарному врачу при появлении характерных пятен на слизистых и коже животных |
Полиомиелит |
Чаще через грязные руки, воду, пищевые продукты. Возможно и воздушно-капельное заражение. | Предупредительные прививки |
|
Комплексные инфекции, либо инфекции, вызываемые как бактериями так и вирусами |
||
Пневмония |
Воздушно-капельный | Марлевые повязки, влажная уборка с дезинфицирующими средствами и проветривание помещений. |
Эпидемия — прогрессируемое во времени и пространстве инфекционное заболевание.
Пандемия — инфекционное заболевание захватывающее большие территории (мирового значения). В настоящее время к ряду таких заболеваний относится коронавирусная инфекция (COVID-19) вызванная коронавирусом (SARS-CoV-2).
Профилактика и методы борьбы с вирусами
Основные методы борьбы с вирусными инфекциями — профилактические прививки (вакцины), Ослабленные возбудители болезни, введенные в организм, позволяют выработать иммунитет. Благодаря вакцинам исчезло такое опасное вирусное заболевание, как оспа. Следует помнить, что без оболочки (капсида) вирусная НК сама попасть в клетку не может. Поэтому дезинфекция, вызывающая разрушение белков оболочки вируса (кипячение, хлорирование, обработка карболовой кислотой и др.), — эффективное профилактическое мероприятие. Наш организм тоже обладает защитными механизмами. Так, иммунный белок интерферон способен защищать организм человека от проникновения вирусов гриппа. В целях профилактики воздушно-капельных вирусных инфекций эффективно обрабатывать защитными средствами носовую полость.
Кроме того, сейчас создано несколько видов антивирусных препаратов как на основе неорганических веществ (ремантадин), так и на основе синтетических антител (виферон, биферон и т. д.). Несмотря на то что фармакология и вирусология ведут постоянные успешные исследования, не надо забывать, что соблюдение мер личной гигиены является надежным методом профилактики вирусных инфекций.
Происхождение вирусов
Ученые полагают, что вирусы и бактериофаги представляют собой обособившиеся генетические элементы клеток, подвергшиеся эволюции вместе с клеточными формами жизни.
Биологический русско-английский глоссарий
Вирус — virus |ˈvʌɪrəs|
Бактериофаг — bacteriophage |bakˈtɪərɪə(ʊ)feɪdʒ|
Капсид — capsid |ˈkapsɪd|
ДНК — DNA |ˌdi:ˌenˈeɪ|
РНК — RNA |ɑːrɛnˈeɪ|
Тест: Вирусы — неклеточные формы жизни
Инструкция: «Вам предлагаются задания с одним и несколькими правильными ответами из пяти и более предложенных».
Источники:
Изображения: freepik.com
Терминология на английском языке: wooordhunt.ru
Видеоматериалы: InternetUrok.ru