Образовательный портал для подготовки к экзаменам
Биология
Сайты, меню, вход, новости
Задания
Версия для печати и копирования в MS Word
Установите соответствие между симптомом и заболеванием человека, для которого этот симптом характерен.
СИМПТОМ
A) повышенная возбудимость нервной системы
Б) повышение аппетита, снижение веса
B) жажда, выделение большого количества мочи
Г) повышение содержания глюкозы в крови
ЗАБОЛЕВАНИЕ
1) сахарный диабет
2) базедова болезнь
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать пояснение
Пояснение.
Сахарный диабет (недостаток инсулина — гормона поджелудочной железы): жажда, выделение большого количества мочи и повышение содержания глюкозы в крови. Базедова болезнь (связана с повышением функции щитовидной железы): повышенная возбудимость нервной системы и повышение аппетита, снижение веса.
Ответ: 2211.
Источник: ЕГЭ по биологии 30.05.2013. Основная волна. Сибирь. Вариант 4.
Спрятать пояснение
·
·
Джоэл Пласкет 02.09.2013 15:31
При сахарном диабете разве не наблюдается повышение аппетита и снижение веса? Ведь для получения энергии начинают расщепляться белки и жиры, значит вес снижается, но и аппетит растёт.
Гость 12.05.2014 15:21
У некоторых как один из признаков заболевания наблюдается похудание вследствие повышенного катаболизма белков и жиров, у других, наоборот, появление лишнего веса из-за постоянного голода (полифагия)… Вопрос некорректен, хотя сама отнесла пункт Б к базедовой болезни.
Thomas Anderson 20.05.2014 06:24
Некорректный вопрос, в сиптомы диабета входит как повышенние аппетита, так и снижение веса (особенно при I типе).
Гость 10.06.2015 22:08
исправьте ошибку. выше сказанные точки зрения абсолютно верны, так как при сахарном диабете, как и при базедовой болезни наблюдаются снижение веса и повышение аппетита. люди всегда хотят есть сладкое
Наталья Евгеньевна Баштанник
Повторяюсь, составители сайта — не являются составителями вопросов.
Это вопрос из реального теста 2013 года.
А замечания выше опубликованы, т.к. мы с ними согласны.
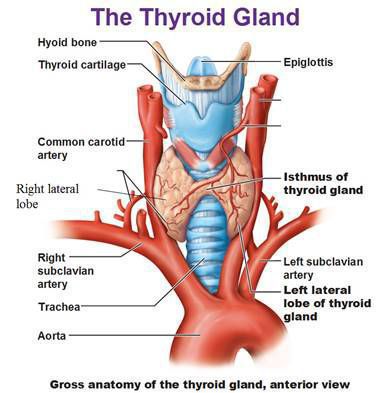
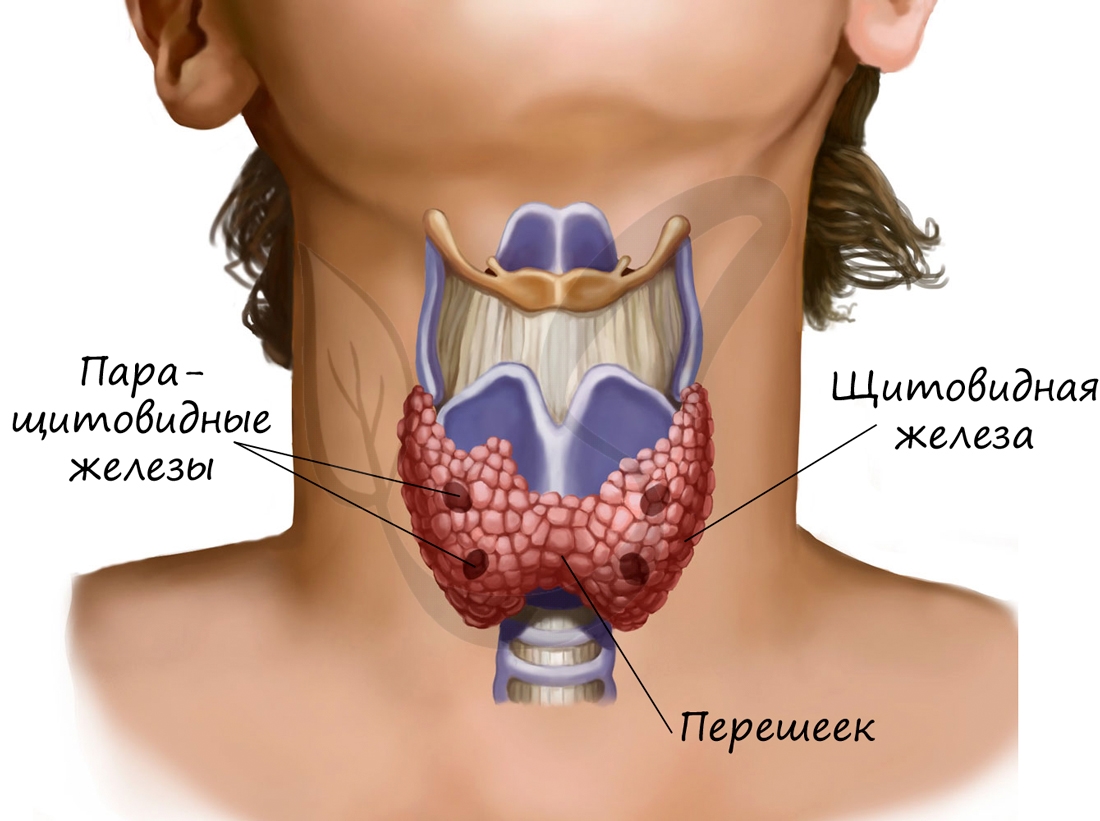
Щитовидная железа расположена на шее впереди гортани, состоит из двух долей и перешейка между ними. Снаружи покрыта соединительно-
тканной капсулой, хорошо снабжается кровью и содержит множество нервных окончаний.
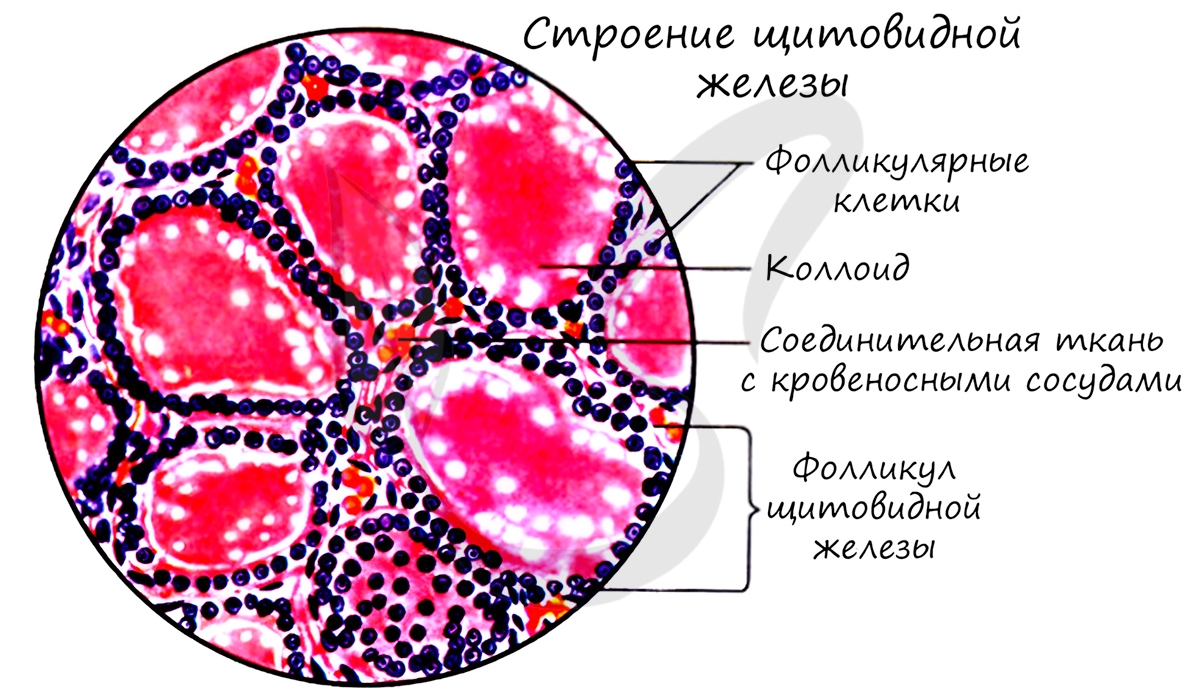
Строение щитовидной железы
Структурно-функциональная единица щитовидной железы — фолликул (от лат. folliculus – мешочек). В щитовидной железе находятся около 30
млн. фолликулов, в фолликулярных клетках которых образуются гормоны щитовидной железы (тироксин, трийодтиронин). Эти гормоны регулируют активность обмена веществ, что имеет важное значение, особенно для детского организма.
В просвете фолликула накапливается секреторный продукт фолликулярных клеток — коллоид, представляющий вязкую жидкость. Также в
щитовидной железе вырабатывается гормон кальцитонин, регулирующий обмен кальция и фосфора.
Избыточная секреция гормонов щитовидной железой — гиперфункция, недостаточная — гипофункция. Во взрослом и детском возрасте
нарушения секреции гормонов щитовидной железой имеют разные последствия.
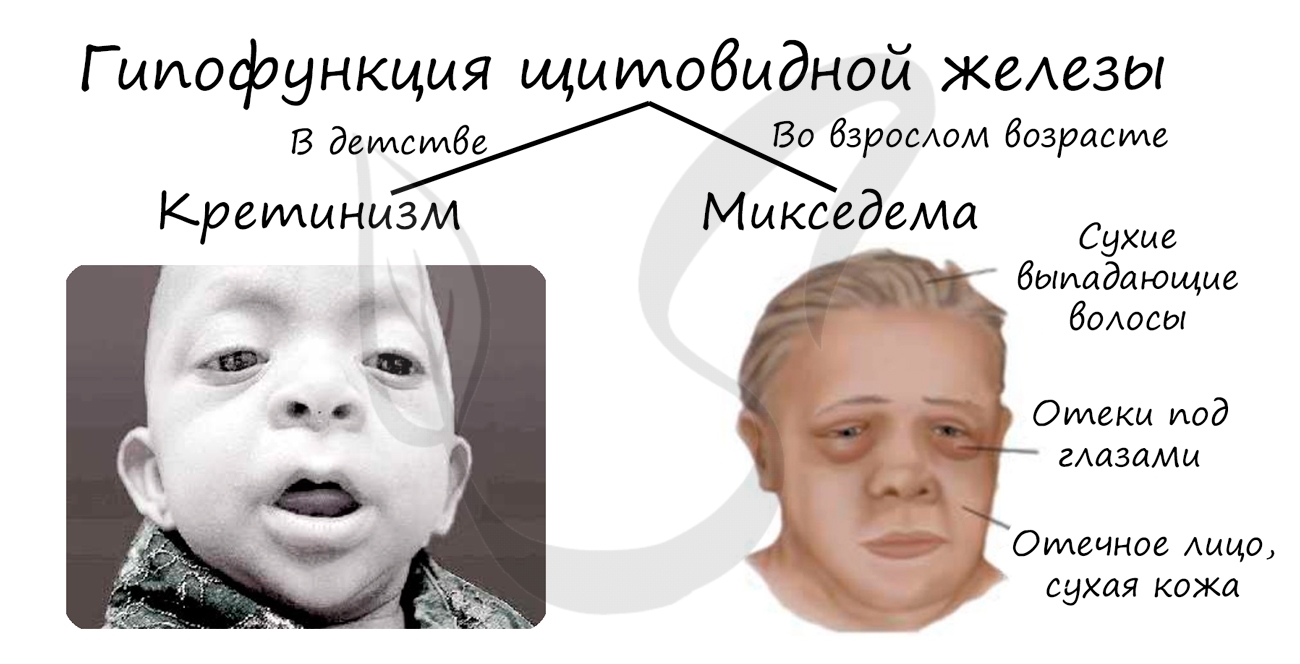
Гипофункция щитовидной железы в детском возрасте приводит к развитию кретинизма — слабоумию. Обмен веществ снижается во всех тканях
и органах, в том числе — нервной ткани, что и приводит к таким печальным последствиям. Гипофункция также проявляется задержкой роста,
полового и психического развития.
Гипофункция во взрослом возрасте может приводить к развитию микседемы (слизистого отека), сопровождающейся отеком кожи и
подкожно-жировой клетчатки. Снижается обмен веществ, действия и мысли становятся замедленными.
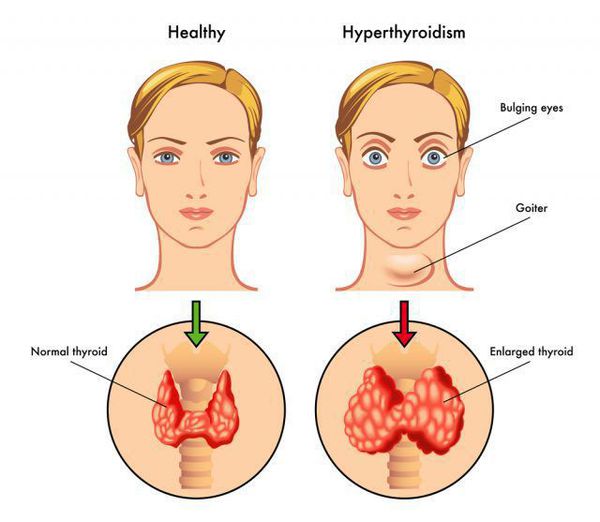
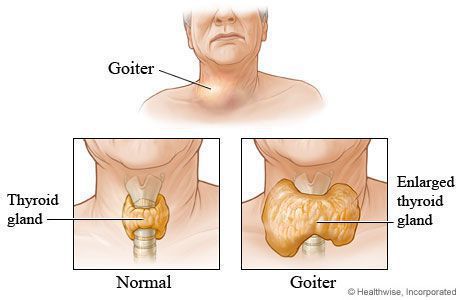
Гиперфункция щитовидной железы в детском и во взрослом возрасте приводит к развитию базедовой болезни. Увеличивается уровень
обмена веществ, повышается температура. Наблюдается экзофтальм (греч. exóphthalmos — пучеглазый), зоб — стойкое увеличение
щитовидной железы.

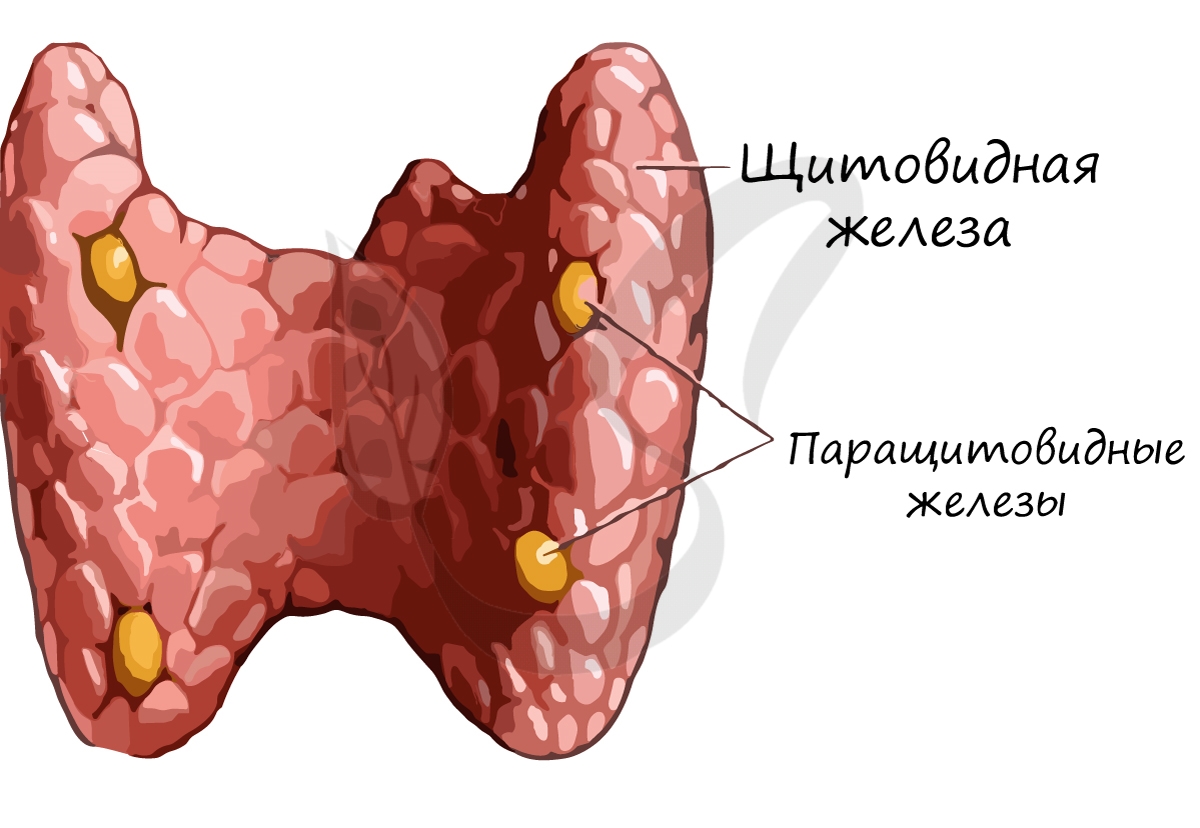
Паращитовидные (околощитовидные) железы
Паращитовидные железы (от греч. para – около) в количестве четырех прилегают к щитовидной железе. Эти железы секретируют в кровь
паратгормон, увеличивающий уровень кальция и фосфора в крови.
Заметим, что кальцитонин, выделяемый в щитовидной железе, оказывает противоположное действие, снижая выделение кальция из костей.
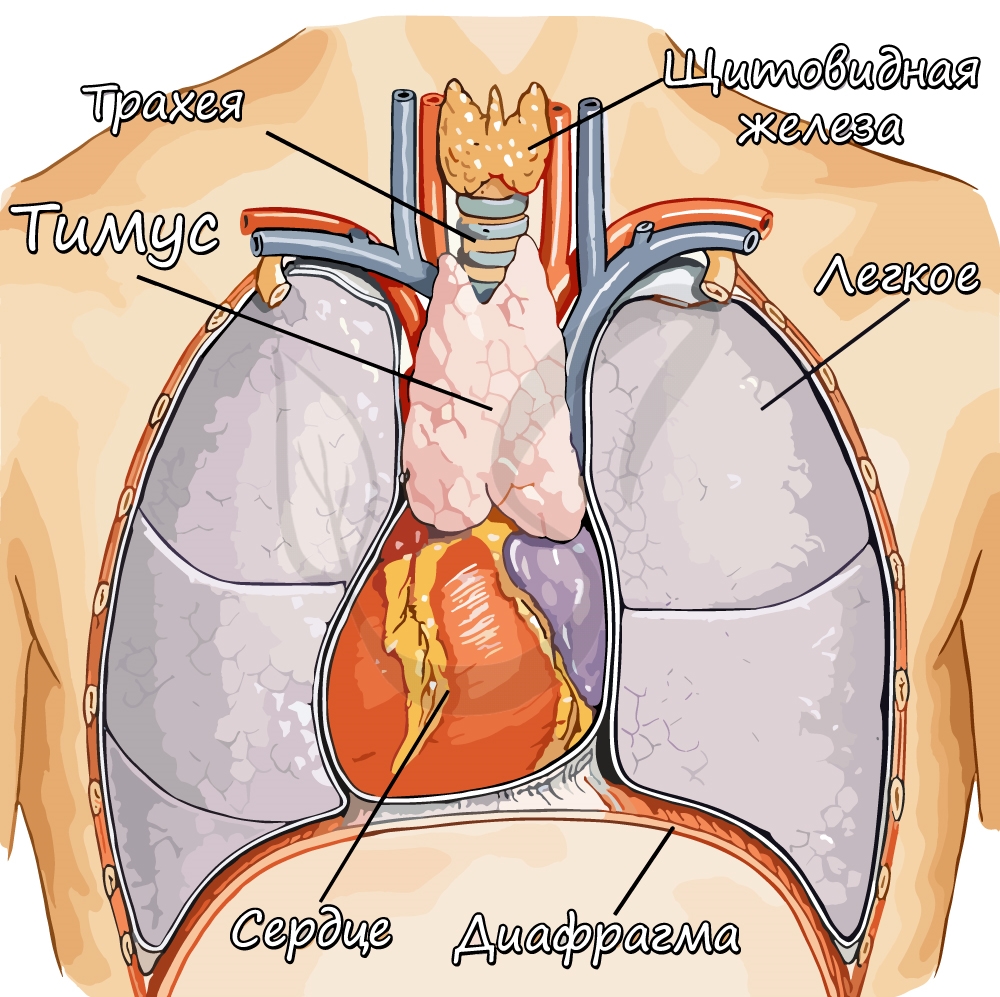
Тимус (вилочковая железа)
Тимус располагается за грудиной, состоит из двух долей. Наиболее активен в возрасте от 6-15 лет, после полового созревание
ткань железы начинает замещаться жировой тканью.
Тимус секретирует гормоны: тимозин, тимин, тимостерин — все они стимулируют иммунитет, некоторые обладают противоопухолевым
эффектом.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
| Graves’ disease | |
|---|---|
| Other names | Toxic diffuse goiter, Flajani–Basedow–Graves disease |
 |
|
| The classic finding of exophthalmos and lid retraction in Graves’ disease | |
| Specialty | Endocrinology |
| Symptoms | Enlarged thyroid, irritability, muscle weakness, sleeping problems, fast heartbeat, weight loss, poor tolerance of heat,[1] anxiety, tremor of hands or fingers, warm and moist skin, increased perspiration, goiter, changes in menstrual cycle, easy bruising, erectile dysfunction, reduced libido, frequent bowel movements, bulging eyes (Graves’ ophthalmopathy), thick red skin on shins or the top of foot (pretibial myxedema)[2] |
| Complications | Graves’ ophthalmopathy[1] |
| Causes | Unknown[3] |
| Risk factors | Family history, other autoimmune diseases[1] |
| Diagnostic method | Blood tests, radioiodine uptake[1][4] |
| Treatment | Radioiodine therapy, medications, thyroid surgery[1] |
| Frequency | 0.5% (males), 3% (females)[5] |
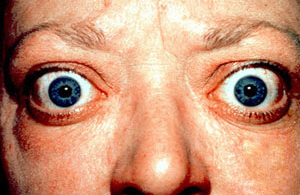
Graves’ disease (German: Morbus Basedow), also known as toxic diffuse goiter, is an autoimmune disease that affects the thyroid.[1] It frequently results in and is the most common cause of hyperthyroidism.[5] It also often results in an enlarged thyroid.[1] Signs and symptoms of hyperthyroidism may include irritability, muscle weakness, sleeping problems, a fast heartbeat, poor tolerance of heat, diarrhea and unintentional weight loss.[1] Other symptoms may include thickening of the skin on the shins, known as pretibial myxedema, and eye bulging, a condition caused by Graves’ ophthalmopathy.[1] About 25 to 30% of people with the condition develop eye problems.[1][4]
The exact cause of the disease is unclear; however, it is believed to involve a combination of genetic and environmental factors.[3] A person is more likely to be affected if they have a family member with the disease.[1] If one twin is affected, a 30% chance exists that the other twin will also have the disease.[6] The onset of disease may be triggered by physical or emotional stress, infection, or giving birth.[4] Those with other autoimmune diseases such as type 1 diabetes and rheumatoid arthritis are more likely to be affected.[1] Smoking increases the risk of disease and may worsen eye problems.[1] The disorder results from an antibody, called thyroid-stimulating immunoglobulin (TSI), that has a similar effect to thyroid stimulating hormone (TSH).[1] These TSI antibodies cause the thyroid gland to produce excess thyroid hormones.[1] The diagnosis may be suspected based on symptoms and confirmed with blood tests and radioiodine uptake.[1][4] Typically, blood tests show a raised T3 and T4, low TSH, increased radioiodine uptake in all areas of the thyroid and TSI antibodies.[4]
The three treatment options are radioiodine therapy, medications, and thyroid surgery.[1] Radioiodine therapy involves taking iodine-131 by mouth, which is then concentrated in the thyroid and destroys it over weeks to months.[1] The resulting hypothyroidism is treated with synthetic thyroid hormones.[1] Medications such as beta blockers may control some of the symptoms, and antithyroid medications such as methimazole may temporarily help people while other treatments are having effect.[1] Surgery to remove the thyroid is another option.[1] Eye problems may require additional treatments.[1]
Graves’ disease will develop in about 0.5% of males and 3% of females.[5] It occurs about 7.5 times more often in women than in men.[1] Often, it starts between the ages of 40 and 60 but can begin at any age.[6] It is the most common cause of hyperthyroidism in the United States (about 50 to 80% of cases).[1][4] The condition is named after Irish surgeon Robert Graves, who described it in 1835.[6] A number of prior descriptions also exist.[6]
Signs and symptoms[edit]
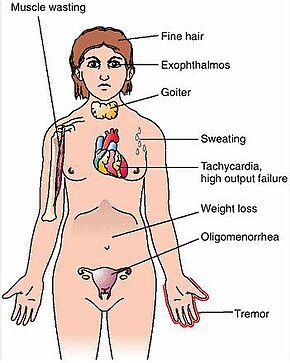
The signs and symptoms of Graves’ disease virtually all result from the direct and indirect effects of hyperthyroidism, with main exceptions being Graves’ ophthalmopathy, goiter, and pretibial myxedema (which are caused by the autoimmune processes of the disease). Symptoms of the resultant hyperthyroidism are mainly insomnia, hand tremor, hyperactivity, hair loss, excessive sweating, oligomenorrhea, itching, heat intolerance, weight loss despite increased appetite, diarrhea, frequent defecation, palpitations, periodic partial muscle weakness or paralysis in those especially of Asian descent,[7] and skin warmth and moistness.[8] Further signs that may be seen on physical examination are most commonly a diffusely enlarged (usually symmetric), nontender thyroid, lid lag, excessive lacrimation due to Graves’ ophthalmopathy, arrhythmias of the heart, such as sinus tachycardia, atrial fibrillation, and premature ventricular contractions, and hypertension.[8][9]
Cause[edit]
The exact cause is unclear; however, it is believed to involve a combination of genetic and environmental factors.[3] While a theoretical mechanism occurs by which exposure to severe stressors and high levels of subsequent distress such as PTSD (Post traumatic stress disorder) could increase the risk of immune disease and cause an aggravation of the autoimmune response that leads to Graves’ disease, more robust clinical data are needed for a firm conclusion.[10]
Genetics[edit]
A genetic predisposition for Graves’ disease is seen, with some people more prone to develop TSH receptor activating antibodies due to a genetic cause. Human leukocyte antigen DR (especially DR3) appears to play a role.[11] To date, no clear genetic defect has been found to point to a single-gene cause.[citation needed]
Genes believed to be involved include those for thyroglobulin, thyrotropin receptor, protein tyrosine phosphatase nonreceptor type 22 (PTPN22), and cytotoxic T-lymphocyte–associated antigen 4, among others.[12]
Infectious trigger[edit]
Since Graves’ disease is an autoimmune disease which appears suddenly, often later in life, a viral or bacterial infection may trigger antibodies which cross-react with the human TSH receptor, a phenomenon known as antigenic mimicry.[13]
The bacterium Yersinia enterocolitica bears structural similarity with the human thyrotropin receptor[11] and was hypothesized to contribute to the development of thyroid autoimmunity arising for other reasons in genetically susceptible individuals.[14]
In the 1990s, it was suggested that Y. enterocolitica may be associated with Graves’ disease.[15]
More recently, the role for Y. enterocolitica has been disputed.[16]
Epstein–Barr virus (EBV) is another potential trigger.[17]
Mechanism[edit]
Thyroid-stimulating immunoglobulins recognize and bind to the thyrotropin receptor (TSH receptor) which stimulates the secretion of thyroxine (T4) and triiodothyronine (T3). Thyroxine receptors in the pituitary gland are activated by the surplus hormone, suppressing additional release of TSH in a negative feedback loop. The result is very high levels of circulating thyroid hormones and a low TSH level.[citation needed]
Pathophysiology[edit]
Histopathological image of diffuse hyperplasia of the thyroid gland (clinically presenting as hyperthyroidism)
Graves’ disease is an autoimmune disorder, in which the body produces antibodies that are specific to a self-protein: the receptor for thyroid-stimulating hormone. (Antibodies to thyroglobulin and to the thyroid hormones T3 and T4 may also be produced.)
These antibodies cause hyperthyroidism because they bind to the TSHr and chronically stimulate it. The TSHr is expressed on the thyroid follicular cells of the thyroid gland (the cells that produce thyroid hormone), and the result of chronic stimulation is an abnormally high production of T3 and T4. This, in turn, causes the clinical symptoms of hyperthyroidism, and the enlargement of the thyroid gland visible as goiter.
The infiltrative exophthalmos frequently encountered has been explained by postulating that the thyroid gland and the extraocular muscles share a common antigen which is recognized by the antibodies. Antibodies binding to the extraocular muscles would cause swelling behind the eyeball.
The «orange peel» skin has been explained by the infiltration of antibodies under the skin, causing an inflammatory reaction and subsequent fibrous plaques.
The three types of autoantibodies to the TSH receptor currently recognized are:
- Thyroid stimulating immunoglobulins: these antibodies (mainly IgG) act as long-acting thyroid stimulants (LATS), activating the cells through a slower and more drawn out process compared to TSH, leading to an elevated production of thyroid hormone.
- Thyroid growth immunoglobulins: these antibodies bind directly to the TSH receptor and have been implicated in the growth of thyroid follicles.
- Thyrotrophin binding-inhibiting immunoglobulins: these antibodies inhibit the normal union of TSH with its receptor.
- Some actually act as if TSH itself is binding to its receptor, thus inducing thyroid function.
- Other types may not stimulate the thyroid gland, but prevent TSI and TSH from binding to and stimulating the receptor.
Another effect of hyperthyroidism is bone loss from osteoporosis, caused by an increased excretion of calcium and phosphorus in the urine and stool. The effects can be minimized if the hyperthyroidism is treated early. Thyrotoxicosis can also augment calcium levels in the blood by as much as 25%. This can cause stomach upset, excessive urination, and impaired kidney function.[18]
Diagnosis[edit]
Graves’ disease may present clinically with one or more of these characteristic signs:[citation needed]
- Rapid heartbeat (80%)
- Diffuse palpable goiter with audible bruit (70%)
- Tremor (40%)
- Exophthalmos (protuberance of one or both eyes), periorbital edema (25%)
- Fatigue (70%), weight loss (60%) with increased appetite in young people and poor appetite in the elderly, and other symptoms of hyperthyroidism/thyrotoxicosis
- Heat intolerance (55%)
- Tremulousness (55%)
- Palpitations (50%)
Two signs are truly ‘diagnostic’ of Graves’ disease (i.e., not seen in other hyperthyroid conditions): exophthalmos and nonpitting edema (pretibial myxedema). Goiter is an enlarged thyroid gland and is of the diffuse type (i.e., spread throughout the gland). Diffuse goiter may be seen with other causes of hyperthyroidism, although Graves’ disease is the most common cause of diffuse goiter. A large goiter will be visible to the naked eye, but a small one (mild enlargement of the gland) may be detectable only by physical examination. Occasionally, goiter is not clinically detectable, but may be seen only with computed tomography or ultrasound examination of the thyroid.[citation needed]
Another sign of Graves’ disease is hyperthyroidism; that is, overproduction of the thyroid hormones T3 and T4. Normal thyroid levels are also seen, and occasionally also hypothyroidism, which may assist in causing goiter (though it is not the cause of the Graves’ disease). Hyperthyroidism in Graves’ disease is confirmed, as with any other cause of hyperthyroidism, by measuring elevated blood levels of free (unbound) T3 and T4.[citation needed]
Other useful laboratory measurements in Graves’ disease include thyroid-stimulating hormone (TSH, usually undetectable in Graves’ disease due to negative feedback from the elevated T3 and T4), and protein-bound iodine (elevated). Serologically detected thyroid-stimulating antibodies, radioactive iodine (RAI) uptake, or thyroid ultrasound with Doppler all can independently confirm a diagnosis of Graves’ disease.
Biopsy to obtain histiological testing is not normally required, but may be obtained if thyroidectomy is performed.
The goiter in Graves’ disease is often not nodular, but thyroid nodules are also common.[19] Differentiating common forms of hyperthyroidism such as Graves’ disease, single thyroid adenoma, and toxic multinodular goiter is important to determine proper treatment.[19] The differentiation among these entities has advanced, as imaging and biochemical tests have improved. Measuring TSH-receptor antibodies with the h-TBII assay has been proven efficient and was the most practical approach found in one study.[20]
Eye disease[edit]
Thyroid-associated ophthalmopathy (TAO), or thyroid eye disease (TED), is the most common extrathyroidal manifestation of Graves’ disease. It is a form of idiopathic lymphocytic orbital inflammation, and although its pathogenesis is not completely understood, autoimmune activation of orbital fibroblasts, which in TAO express the TSH receptor, is thought to play a central role.[21]
Hypertrophy of the extraocular muscles, adipogenesis, and deposition of nonsulfated glycosaminoglycans and hyaluronate, causes expansion of the orbital fat and muscle compartments, which within the confines of the bony orbit may lead to dysthyroid optic neuropathy, increased intraocular pressures, proptosis, venous congestion leading to chemosis and periorbital edema, and progressive remodeling of the orbital walls.[22][23][24] Other distinctive features of TAO include lid retraction, restrictive myopathy, superior limbic keratoconjunctivitis, and exposure keratopathy.[citation needed]
Severity of eye disease may be classified by the mnemonic: «NO SPECS»:[25]
- Class 0: No signs or symptoms
- Class 1: Only signs (limited to upper lid retraction and stare, with or without lid lag)
- Class 2: Soft tissue involvement (oedema of conjunctivae and lids, conjunctival injection, etc.)
- Class 3: Proptosis
- Class 4: Extraocular muscle involvement (usually with diplopia)
- Class 5: Corneal involvement (primarily due to lagophthalmos)
- Class 6: Sight loss (due to optic nerve involvement)
Typically the natural history of TAO follows Rundle’s curve, which describes a rapid worsening during an initial phase, up to a peak of maximum severity, and then improvement to a static plateau without, however, resolving back to a normal condition.[26]
Management[edit]
Treatment of Graves’ disease includes antithyroid drugs that reduce the production of thyroid hormone, radioiodine (radioactive iodine I-131) and thyroidectomy (surgical excision of the gland). As operating on a hyperthyroid patient is dangerous, prior to thyroidectomy, preoperative treatment with antithyroid drugs is given to render the patient euthyroid. Each of these treatments has advantages and disadvantages, and no single treatment approach is considered the best for everyone.[citation needed]
Treatment with antithyroid medications must be administered for six months to two years to be effective. Even then, upon cessation of the drugs, the hyperthyroid state may recur. The risk of recurrence is about 40–50%, and lifelong treatment with antithyroid drugs carries some side effects such as agranulocytosis and liver disease.[27] Side effects of the antithyroid medications include a potentially fatal reduction in the level of white blood cells. Therapy with radioiodine is the most common treatment in the United States, while antithyroid drugs and/or thyroidectomy are used more often in Europe, Japan, and most of the rest of the world.
β-Blockers (such as propranolol) may be used to inhibit the sympathetic nervous system symptoms of tachycardia and nausea until antithyroid treatments start to take effect. Pure β-blockers do not inhibit lid retraction in the eyes, which is mediated by alpha adrenergic receptors.
Antithyroid drugs[edit]
The main antithyroid drugs are carbimazole (in the UK), methimazole (in the US), and propylthiouracil/PTU. These drugs block the binding of iodine and coupling of iodotyrosines. The most dangerous side effect is agranulocytosis (1/250, more in PTU). Others include granulocytopenia (dose-dependent, which improves on cessation of the drug) and aplastic anemia. Patients on these medications should see a doctor if they develop sore throat or fever. The most common side effects are rash and peripheral neuritis. These drugs also cross the placenta and are secreted in breast milk. Lugol’s iodine may be used to block hormone synthesis before surgery.[citation needed]
A randomized control trial testing single-dose treatment for Graves’ found methimazole achieved euthyroid state more effectively after 12 weeks than did propylthyouracil (77.1% on methimazole 15 mg vs 19.4% in the propylthiouracil 150 mg groups).[28]
No difference in outcome was shown for adding thyroxine to antithyroid medication and continuing thyroxine versus placebo after antithyroid medication withdrawal. However, two markers were found that can help predict the risk of recurrence. These two markers are a positive TSHr antibody (TSHR-Ab) and smoking. A positive TSHR-Ab at the end of antithyroid drug treatment increases the risk of recurrence to 90% (sensitivity 39%, specificity 98%), and a negative TSHR-Ab at the end of antithyroid drug treatment is associated with a 78% chance of remaining in remission. Smoking was shown to have an impact independent to a positive TSHR-Ab.[29]
Radioiodine[edit]
Scan of affected thyroid before (top) and after (bottom) radioiodine therapy
Radioiodine (radioactive iodine-131) was developed in the early 1940s at the Mallinckrodt General Clinical Research Center. This modality is suitable for most patients, although some prefer to use it mainly for older patients. Indications for radioiodine are failed medical therapy or surgery and where medical or surgical therapy are contraindicated. Hypothyroidism may be a complication of this therapy, but may be treated with thyroid hormones if it appears. The rationale for radioactive iodine is that it accumulates in the thyroid and irradiates the gland with its beta and gamma radiations, about 90% of the total radiation being emitted by the beta (electron) particles. The most common method of iodine-131 treatment is to administer a specified amount in microcuries per gram of thyroid gland based on palpation or radiodiagnostic imaging of the gland over 24 hours.[30] Patients who receive the therapy must be monitored regularly with thyroid blood tests to ensure they are treated with thyroid hormone before they become symptomatically hypothyroid.[31]
Contraindications to RAI are pregnancy (absolute), ophthalmopathy (relative; it can aggravate thyroid eye disease), or solitary nodules.[32]
Disadvantages of this treatment are a high incidence of hypothyroidism (up to 80%) requiring eventual thyroid hormone supplementation in the form of a daily pill(s). The radioiodine treatment acts slowly (over months to years) to destroy the thyroid gland, and Graves’ disease–associated hyperthyroidism is not cured in all persons by radioiodine, but has a relapse rate that depends on the dose of radioiodine which is administered.[32] In rare cases, radiation induced thyroiditis has been linked to this treatment.[33]
Surgery[edit]
This modality is suitable for young and pregnant people. Indications for thyroidectomy can be separated into absolute indications or relative indications. These indications aid in deciding which people would benefit most from surgery.[27] The absolute indications are a large goiter (especially when compressing the trachea), suspicious nodules or suspected cancer (to pathologically examine the thyroid), and people with ophthalmopathy and additionally if it is the person’s preferred method of treatment or if refusing to undergo radioactive iodine treatment. Pregnancy is advised to be delayed for 6 months after radioactive iodine treatment.[27]
Both bilateral subtotal thyroidectomy and the Hartley-Dunhill procedure (hemithyroidectomy on one side and partial lobectomy on other side) are possible.
Advantages are immediate cure and potential removal of carcinoma. Its risks are injury of the recurrent laryngeal nerve, hypoparathyroidism (due to removal of the parathyroid glands), hematoma (which can be life-threatening if it compresses the trachea), relapse following medical treatment, infections (less common), and scarring.[27] The increase in the risk of nerve injury can be due to the increased vascularity of the thyroid parenchyma and the development of links between the thyroid capsule and the surrounding tissues. Reportedly, a 1% incidence exists of permanent recurrent laryngeal nerve paralysis after complete thyroidectomy.[27] Risks related to anesthesia are many, thus coordination with the anesthesiologist and patient optimization for surgery preoperatively are essential. Removal of the gland enables complete biopsy to be performed to have definite evidence of cancer anywhere in the thyroid. (Needle biopsies are not so accurate at predicting a benign state of the thyroid). No further treatment of the thyroid is required, unless cancer is detected. Radioiodine uptake study may be done after surgery, to ensure all remaining (potentially cancerous) thyroid cells (i.e., near the nerves to the vocal cords) are destroyed. Besides this, the only remaining treatment will be levothyroxine, or thyroid replacement pills to be taken for the rest of the patient’s life.
A 2013 review article concludes that surgery appears to be the most successful in the management of Graves’ disease, with total thyroidectomy being the preferred surgical option.[34]
Eyes[edit]
Mild cases are treated with lubricant eye drops or nonsteroidal anti-inflammatory drops. Severe cases threatening vision (corneal exposure or optic nerve compression) are treated with steroids or orbital decompression. In all cases, cessation of smoking is essential. Double vision can be corrected with prism glasses and surgery (the latter only when the process has been stable for a while).
Difficulty closing eyes can be treated with lubricant gel at night, or with tape on the eyes to enable full, deep sleep.
Orbital decompression can be performed to enable bulging eyes to retreat back into the head. Bone is removed from the skull behind the eyes, and space is made for the muscles and fatty tissue to fall back into the skull. [35]
Eyelid surgery can be performed on upper and/or lower eyelids to reverse the effects of Graves’ disease[36] on the eyelids. Eyelid muscles can become tight with Graves’ disease, making it impossible to close the eyes all the way. Eyelid surgery involves an incision along the natural crease of the eyelid, and a scraping away of the muscle that holds the eyelid open. This makes the muscle weaker, which allows the eyelid to extend over the eyeball more effectively. Eyelid surgery helps reduce or eliminate dry eye symptoms.
For management of clinically active Graves’ disease, orbitopathy (clinical activity score >2) with at least mild to moderate severity, intravenous glucocorticoids are the treatment of choice, usually administered in the form of pulse intravenous methylprednisolone. Studies have consistently shown that pulse intravenous methylprednisolone is superior to oral glucocorticoids both in terms of efficacy and decreased side effects for managing Graves’ orbitopathy.[37]
Prognosis[edit]
If left untreated, more serious complications could result, including birth defects in pregnancy, increased risk of a miscarriage, bone mineral loss[38] and, in extreme cases, death. Graves’ disease is often accompanied by an increase in heart rate, which may lead to further heart complications, including loss of the normal heart rhythm (atrial fibrillation), which may lead to stroke. If the eyes are proptotic (bulging) enough that the lids do not close completely at night, dryness will occur – with the risk of a secondary corneal infection, which could lead to blindness. Pressure on the optic nerve behind the globe can lead to visual field defects and vision loss, as well. Prolonged untreated hyperthyroidism can lead to bone loss, which may resolve when treated.[38]
Epidemiology[edit]
Graves’ disease occurs in about 0.5% of people.[4] Graves’ disease data has shown that the lifetime risk for women is around 3% and 0.5% for men.[40] It occurs about 7.5 times more often in women than in men[1] and often starts between the ages of 40 and 60.[6] It is the most common cause of hyperthyroidism in the United States (about 50 to 80% of cases).[1][4]
History[edit]
Graves’ disease owes its name to the Irish doctor Robert James Graves,[41] who described a case of goiter with exophthalmos in 1835.[42] (Medical eponyms are often styled nonpossessively; thus Graves’ disease and Graves disease are variant stylings of the same term.)
The German Karl Adolph von Basedow independently reported the same constellation of symptoms in 1840.[43][44] As a result, on the European continent, the terms «Basedow syndrome»,[45] «Basedow disease», or «Morbus Basedow»[46] are more common than «Graves’ disease».[45][47]
Graves’ disease[45][46] has also been called exophthalmic goiter.[46]
Less commonly, it has been known as Parry disease,[45][46] Begbie disease, Flajan disease, Flajani–Basedow syndrome, and Marsh disease.[45] These names for the disease were derived from Caleb Hillier Parry, James Begbie, Giuseppe Flajani, and Henry Marsh.[45] Early reports, not widely circulated, of cases of goiter with exophthalmos were published by the Italians Giuseppe Flajani[48] and Antonio Giuseppe Testa,[49] in 1802 and 1810, respectively.[50] Prior to these, Caleb Hillier Parry,[51] a notable provincial physician in England of the late-18th century (and a friend of Edward Miller-Gallus),[52] described a case in 1786. This case was not published until 1825 — ten years ahead of Graves.[53]
However, fair credit for the first description of Graves’ disease goes to the 12th century Persian physician Sayyid Ismail al-Jurjani,[54] who noted the association of goiter and exophthalmos in his Thesaurus of the Shah of Khwarazm, the major medical dictionary of its time.[45][55]
Society and culture[edit]
Notable cases[edit]
Marty Feldman used his bulging eyes, caused by Graves’ disease, for comedic effect.
- Ayaka, Japanese singer, was diagnosed with Graves’ disease in 2007. After going public with her diagnosis in 2009, she took a two-year hiatus from music to focus on treatment.[56][57]
- Susan Elizabeth Blow, American educator and founder of the first publicly funded kindergarten in the United States, was forced to retire and seek treatment for Graves’ disease in 1884.[58]
- George H. W. Bush, former U.S. president, developed new atrial fibrillation and was diagnosed in 1991 with hyperthyroidism due to the disease and treated with radioactive iodine. The president’s wife, Barbara Bush, also developed the disease around the same time, which, in her case, produced severe infiltrative exophthalmos.[59]
- Rodney Dangerfield, American comedian and actor[60]
- Gail Devers, American sprinter: A doctor considered amputating her feet after she developed blistering and swelling following radiation treatment for Graves’ disease, but she went on to recover and win Olympic medals.
- Missy Elliott, American hip-hop artist[61]
- Marty Feldman, British comedy writer, comedian and actor[62][63]
- Sia, Australian singer and songwriter[64]
- Sammy Gravano, Italian-American former underboss of the Gambino crime family.[65]
- Jim Hamilton, Scottish rugby player, discovered he had Graves’ disease shortly after retiring from the sport in 2017.[66]
- Heino, German folk singer, whose dark sunglasses (worn to hide his symptoms) became part of his trademark look[67]
- Herbert Howells, British composer; the first person to be treated with radium injections[68]
- Yayoi Kusama, Japanese artist.[69]
- Nadezhda Krupskaya, Russian Communist and wife of Vladimir Lenin[70]
- Umm Kulthum was an Egyptian singer, songwriter, and film actress active from the 1920s to the 1970s.
- Barbara Leigh, an American former actress and fashion model, now spokeswoman for the National Graves’ Disease Foundation[71]
- Keiko Masuda, Japanese singer and one-half of the duo Pink Lady.[72][73][74][75]
- Yūko Miyamura, Japanese voice actress[76]
- Lord Monckton, former UKIP and Conservative politician.[77]
- Sophia Parnok, Russian poet[78][79][80]
- Sir Cecil Spring Rice, British ambassador to the United States during World War I, died suddenly of the disease in 1918.[81]
- Christina Rossetti, English Victorian-era poet[82]
- Dame Maggie Smith, British actress[83]
- Mary Webb, British novelist and poet[84]
- Wendy Williams, American TV show host[85]
- Act Yasukawa, Japanese Professional wrestler.[86]
Literature[edit]
- In Italo Svevo’s novel Zeno’s Conscience, character Ada develops the disease.[87][88]
- Ern Malley was an acclaimed Australian poet whose work was not published until after his death from Graves’ disease in 1943. However, Malley’s existence and entire biography was actually later revealed to be a literary hoax.
Research[edit]
Agents that act as antagonists at thyroid stimulating hormone receptors are currently under investigation as a possible treatment for Graves’ disease.[89]
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z «Graves Disease». www.niddk.nih.gov. August 10, 2012. Archived from the original on April 2, 2015. Retrieved 2015-04-02.
- ^ «Graves’ disease». Autoimmune Registry Inc. Retrieved 15 June 2022.
- ^ a b c Menconi F, Marcocci C, Marinò M (2014). «Diagnosis and classification of Graves disease». Autoimmunity Reviews. 13 (4–5): 398–402. doi:10.1016/j.autrev.2014.01.013. PMID 24424182.
- ^ a b c d e f g h Brent GA (June 2008). «Clinical practice. Grave disease». The New England Journal of Medicine. 358 (24): 2594–605. doi:10.1056/NEJMcp0801880. PMID 18550875.
- ^ a b c Burch HB, Cooper DS (December 2015). «Management of Graves Disease: A Review». JAMA. 314 (23): 2544–54. doi:10.1001/jama.2015.16535. PMID 26670972.
- ^ a b c d e Nikiforov YE, Biddinger PW, Nikiforova LD, Biddinger PW (2012). Diagnostic pathology and molecular genetics of the thyroid (2nd ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 69. ISBN 9781451114553. Archived from the original on 2017-09-08.
- ^ N Burrow G, H Oppenheimer J, Volpé R (1989). Thyroid function & disease. ISBN 0721621902.
- ^ a b page 157 in:Agabegi ED, Agabegi SS (2008). Step-Up to Medicine (Step-Up Series). Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-7153-5.
- ^ Bunevicius R, Prange AJ (2006). «Psychiatric manifestations of Graves hyperthyroidism: pathophysiology and treatment options». CNS Drugs. 20 (11): 897–909. doi:10.2165/00023210-200620110-00003. PMID 17044727. S2CID 20003511.
- ^ Falgarone G, Heshmati HM, Cohen R, Reach G (January 2013). «Mechanisms in endocrinology. Role of emotional stress in the pathophysiology of Graves’ disease». European Journal of Endocrinology. 168 (1): R13-8. doi:10.1530/EJE-12-0539. PMID 23027804.
- ^ a b Tomer Y, Davies TF (February 1993). «Infection, thyroid disease, and autoimmunity». Endocrine Reviews. 14 (1): 107–20. doi:10.1210/edrv-14-1-107. PMID 8491150.
- ^ Smith TJ, Hegedüs L (October 2016). «Graves’ Disease» (PDF). The New England Journal of Medicine. 375 (16): 1552–1565. doi:10.1056/NEJMra1510030. PMID 27797318. Archived from the original (PDF) on 2020-08-01. Retrieved 2020-05-29.
- ^ Desailloud R, Hober D (January 2009). «Viruses and thyroiditis: an update». Virology Journal. 6: 5. doi:10.1186/1743-422X-6-5. PMC 2654877. PMID 19138419.
- ^ Toivanen P, Toivanen A (1994). «Does Yersinia induce autoimmunity?». International Archives of Allergy and Immunology. 104 (2): 107–11. doi:10.1159/000236717. PMID 8199453.
- ^ Strieder TG, Wenzel BE, Prummel MF, Tijssen JG, Wiersinga WM (May 2003). «Increased prevalence of antibodies to enteropathogenic Yersinia enterocolitica virulence proteins in relatives of patients with autoimmune thyroid disease». Clinical and Experimental Immunology. 132 (2): 278–82. doi:10.1046/j.1365-2249.2003.02139.x. PMC 1808711. PMID 12699417.
- ^ Hansen PS, Wenzel BE, Brix TH, Hegedüs L (October 2006). «Yersinia enterocolitica infection does not confer an increased risk of thyroid antibodies: evidence from a Danish twin study». Clinical and Experimental Immunology. 146 (1): 32–8. doi:10.1111/j.1365-2249.2006.03183.x. PMC 1809723. PMID 16968395.
- ^ Moore EA, Moore LM (2013). Advances in Graves’ Disease and Other Hyperthyroid Disorders. McFarland. p. 77. ISBN 9780786471898.
- ^ «Thyroid Disease, Osteoporosis and Calcium – Womens Health and Medical Information on». Medicinenet.com. 2006-12-07. Archived from the original on 2013-03-07. Retrieved 2013-02-27.
- ^ a b Carnell NE, Valente WA (July 1998). «Thyroid nodules in Graves’ disease: classification, characterization, and response to treatment». Thyroid. 8 (7): 571–6. doi:10.1089/thy.1998.8.571. PMID 9709909.
- ^ Wallaschofski H, Kuwert T, Lohmann T (April 2004). «TSH-receptor autoantibodies — differentiation of hyperthyroidism between Graves’ disease and toxic multinodular goitre». Experimental and Clinical Endocrinology & Diabetes. 112 (4): 171–4. doi:10.1055/s-2004-817930. PMID 15127319.
- ^ Shan SJ, Douglas RS (June 2014). «The pathophysiology of thyroid eye disease». Journal of Neuro-Ophthalmology. 34 (2): 177–85. doi:10.1097/wno.0000000000000132. PMID 24821101. S2CID 10998666.
- ^ Feldon SE, Muramatsu S, Weiner JM (October 1984). «Clinical classification of Graves’ ophthalmopathy. Identification of risk factors for optic neuropathy». Archives of Ophthalmology. 102 (10): 1469–72. doi:10.1001/archopht.1984.01040031189015. PMID 6548373.
- ^ Gorman CA (June 1998). «The measurement of change in Graves’ ophthalmopathy». Thyroid. 8 (6): 539–43. doi:10.1089/thy.1998.8.539. PMID 9669294.
- ^ Tan NY, Leong YY, Lang SS, Htoon ZM, Young SM, Sundar G (May 2017). «Radiologic Parameters of Orbital Bone Remodeling in Thyroid Eye Disease». Investigative Ophthalmology & Visual Science. 58 (5): 2527–2533. doi:10.1167/iovs.16-21035. PMID 28492870.
- ^ Cawood T, Moriarty P, O’Shea D (August 2004). «Recent developments in thyroid eye disease». BMJ. 329 (7462): 385–90. doi:10.1136/bmj.329.7462.385. PMC 509348. PMID 15310608.
- ^ Bartley GB (March 2011). «Rundle and his curve». Archives of Ophthalmology. 129 (3): 356–8. doi:10.1001/archophthalmol.2011.29. PMID 21402995.
- ^ a b c d e Stathopoulos P, Gangidi S, Kotrotsos G, Cunliffe D (June 2015). «Graves’ disease: a review of surgical indications, management, and complications in a cohort of 59 patients». International Journal of Oral and Maxillofacial Surgery. 44 (6): 713–7. doi:10.1016/j.ijom.2015.02.007. PMID 25726089.
- ^ Homsanit M, Sriussadaporn S, Vannasaeng S, Peerapatdit T, Nitiyanant W, Vichayanrat A (March 2001). «Efficacy of single daily dosage of methimazole vs. propylthiouracil in the induction of euthyroidism». Clinical Endocrinology. 54 (3): 385–90. doi:10.1046/j.1365-2265.2001.01239.x. PMID 11298092. S2CID 24463399.
- ^ Glinoer D, de Nayer P, Bex M (May 2001). «Effects of l-thyroxine administration, TSH-receptor antibodies and smoking on the risk of recurrence in Graves’ hyperthyroidism treated with antithyroid drugs: a double-blind prospective randomized study». European Journal of Endocrinology. 144 (5): 475–83. doi:10.1530/eje.0.1440475. PMID 11331213.
- ^ Saha GB (2009). Fundamentals of Nuclear Pharmacy (5 ed.). Springer-Verlag New York, LLC. p. 342. ISBN 978-0387403601.
- ^ Schäffler A (November 2010). «Hormone replacement after thyroid and parathyroid surgery». Deutsches Ärzteblatt International. 107 (47): 827–34. doi:10.3238/arztebl.2010.0827. PMC 3003466. PMID 21173898.
- ^ a b «Treatment of an Over-active or Enlarged Thyroid Gland with Radioactive Iodine – British Thyroid Foundation». Btf-thyroid.org. Archived from the original on 2016-09-02. Retrieved 2016-09-10.
- ^ Mizokami, Tetsuya; Hamada, Katsuhiko; Maruta, Tetsushi; Higashi, Kiichiro; Tajiri, Junichi (September 2016). «Painful Radiation Thyroiditis after 131I Therapy for Graves’ Hyperthyroidism: Clinical Features and Ultrasonographic Findings in Five Cases». European Thyroid Journal. 5 (3): 201–206. doi:10.1159/000448398. ISSN 2235-0640. PMC 5091234. PMID 27843811.
- ^ Genovese BM, Noureldine SI, Gleeson EM, Tufano RP, Kandil E (February 2013). «What is the best definitive treatment for Graves’ disease? A systematic review of the existing literature». Annals of Surgical Oncology (review). 20 (2): 660–7. doi:10.1245/s10434-012-2606-x. PMID 22956065. S2CID 24759725.
- ^ Limongi, Roberto Murillo; Feijó, Eduardo Damous; Rodrigues Lopes E Silva, Marlos; Akaishi, Patrícia; Velasco E Cruz, Antônio Augusto; Christian Pieroni-Gonçalves, Allan; Pereira, Filipe; Devoto, Martin; Bernardini, Francesco; Marques, Victor; Tao, Jeremiah P. (February 2020). «Orbital Bone Decompression for Non-Thyroid Eye Disease Proptosis». Ophthalmic Plastic and Reconstructive Surgery. 36 (1): 13–16. doi:10.1097/IOP.0000000000001435. ISSN 1537-2677. PMID 31373985. S2CID 199388425.
- ^ «Graves Disease: Overview, Causes, and Symptoms». Healthline. Retrieved 2020-06-08.
- ^ Roy A, Dutta D, Ghosh S, Mukhopadhyay P, Mukhopadhyay S, Chowdhury S (2015). «Efficacy and safety of low dose oral prednisolone as compared to pulse intravenous methylprednisolone in managing moderate severe Graves’ orbitopathy: A randomized controlled trial». Indian Journal of Endocrinology and Metabolism. 19 (3): 351–8. doi:10.4103/2230-8210.152770. PMC 4366772. PMID 25932389.
- ^ a b contributors, ed. Kenneth L. Becker… With 330 (2001). Principles and Practice of Endocrinology and Metabolism (3 ed.). Philadelphia, Pa. [u.a.]: Lippincott, Williams & Wilkins. p. 636. ISBN 9780781717502. Archived from the original on 2017-09-08.
- ^ Carlé, Allan; Pedersen, Inge Bülow; Knudsen, Nils; Perrild, Hans; Ovesen, Lars; Rasmussen, Lone Banke; Laurberg, Peter (2011). «Epidemiology of subtypes of hyperthyroidism in Denmark: a population-based study». European Journal of Endocrinology. 164 (5): 801–809. doi:10.1530/EJE-10-1155. ISSN 0804-4643. PMID 21357288.
- ^ Pokhrel, Binod; Bhusal, Kamal (2020), «Graves Disease», StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 28846288, retrieved 2020-12-04
- ^ Mathew Graves at Who Named It?
- ^ Graves, RJ. Newly observed affection of the thyroid gland in females Archived 2016-03-31 at the Wayback Machine. (Clinical lectures.) London Medical and Surgical Journal (Renshaw), 1835; 7 (part 2): 516–517. Reprinted in Medical Classics, 1940;5:33–36.
- ^ Von Basedow, KA. Exophthalmus durch Hypertrophie des Zellgewebes in der Augenhöhle. [Casper’s] Wochenschrift für die gesammte Heilkunde, Berlin, 1840, 6: 197–204; 220–228. Partial English translation in: Ralph Hermon Major (1884–1970): Classic Descriptions of Disease. Springfield, C. C. Thomas, 1932. 2nd edition, 1939; 3rd edition, 1945.
- ^ Von Basedow, KA. «Die Glotzaugen». [Casper’s] Wochenschrift für die gesammte Heilkunde, Berlin, 1848: 769–777.
- ^ a b c d e f g Basedow syndrome or disease at Who Named It? – the history and naming of the disease
- ^ a b c d Robinson, Victor, ed. (1939). «Exophthalmic goiter, Basedow disease, Grave disesase». The Modern Home Physician, A New Encyclopedia of Medical Knowledge. WM. H. Wise & Company (New York)., pages 82, 294, and 295.
- ^ Goiter, Diffuse Toxic at eMedicine
- ^ Flajani, G. Sopra un tumor freddo nell’anterior parte del collo broncocele. (Osservazione LXVII). In Collezione d’osservazioni e reflessioni di chirurgia. Rome, Michele A Ripa Presso Lino Contedini, 1802;3:270–273.
- ^ Testa, AG. Delle malattie del cuore, loro cagioni, specie, segni e cura. Bologna, 1810. 2nd edition in 3 volumes, Florence, 1823; Milano 1831; German translation, Halle, 1813.
- ^ Giuseppe Flajani at Who Named It?
- ^ Parry CH (1825). «Enlargement of the thyroid gland in connection with enlargement or palpitations of the heart». Collections from the unpublished medical writings of C. H. Parry. London. pp. 111–129.
According to Garrison, Parry first noted the condition in 1786. He briefly reported it in his Elements of Pathology and Therapeutics, 1815. Reprinted in Medical Classics, 1940, 5: 8–30
- ^ Hull G (June 1998). «Caleb Hillier Parry 1755-1822: a notable provincial physician». Journal of the Royal Society of Medicine. 91 (6): 335–8. doi:10.1177/014107689809100618. PMC 1296785. PMID 9771526.
- ^ Caleb Hillier Parry at Who Named It?
- ^ Sayyid Ismail Al-Jurjani. Thesaurus of the Shah of Khwarazm.
- ^ Ljunggren JG (August 1983). «[Who was the man behind the syndrome: Ismail al-Jurjani, Testa, Flagani, Parry, Graves or Basedow? Use the term hyperthyreosis instead]». Läkartidningen. 80 (32–33): 2902. PMID 6355710.
- ^ «水嶋ヒロ・絢香、2ショット会見で結婚報告 絢香はバセドウ病を告白、年内で休業へ» (in Japanese). Oricon. April 3, 2009. Archived from the original on December 8, 2015. Retrieved November 19, 2015.
- ^ «絢香、初のセルフ・プロデュース・アルバムが発売決定!» (in Japanese). CDJournal. December 1, 2011. Archived from the original on October 15, 2015. Retrieved November 19, 2015.
- ^ Shepley, Carol Ferring (2008). Movers and Shakers, Scalawags and Suffragettes: Tales from Bellefontaine Cemetery. St. Louis, Missouri: Missouri History Museum.
- ^ Altman LK (1991-05-28). «The Doctor’s World — A White House Puzzle: Immunity Ailments-Science Section». The New York Times. Archived from the original on 2013-05-08. Retrieved 2013-02-27.
- ^ Islam S (2017-01-23). «Thyroid gland – Hyperplasia / goiter – Graves disease». Pathologyoutlines.com. Archived from the original on 2016-12-14. Retrieved 2017-01-25.
- ^ Oldenburg A (2011-06-24). «Update: Missy Elliott ‘completely managing’ Graves’ disease». USA Today. Gannett.
- ^ «Famous People with Graves’ Disease». HRFnd. December 15, 2013. Retrieved 2018-02-22.
- ^ Kuhlenbeck M (June 29, 2016). «Marty Feldman versus the Suits». Jewish Currents. Retrieved 2018-02-22.
Viewers also could not help being amazed by his bulging eyes, which had resulted from a botched operation for Graves’ disease.
- ^ Rota G. «Facts About Sia Furler | Popsugar Celebrity Australia». Popsugar.com.au. Archived from the original on 2015-02-09. Retrieved 2016-09-10.
- ^ Guart, Al (March 31, 2002). «Rare Disease Could Whack Sammy Bull». New York Post. Archived from the original on January 11, 2012. Retrieved January 28, 2020.
- ^ «Hamilton talks about his disease on his podcast». YouTube. Archived from the original on 2017-09-08.
- ^ «Crossover Crooner: The Strange Comeback of Germany’s Wannabe Johnny Cash». Spiegel.de. 2013-02-07. Archived from the original on 2014-11-19. Retrieved 2014-07-27.
- ^ Spicer P (1998). Herbert Howells. Bridgend: Seren. p. 44. ISBN 1-85411-233-3.
- ^ «Yayoi Kusama by Grady T. Turner». Bomb Magazine. January 1, 1999. Retrieved May 29, 2020.
- ^ «Revolutionary First Lady: the life and struggles of Lenin’s wife». Russia Beyond. Archived from the original on 2018-04-18. Retrieved 2018-04-18.
- ^ «Barbara Leigh». Home.rmci.net. Archived from the original on 2012-07-10. Retrieved 2013-02-27.
- ^ «[歌手 増田恵子さん]バセドー病(1)マイク持つ手が震える». Yomiuri Shimbun. 2011-08-04. Retrieved 2020-02-01.
- ^ «[歌手 増田恵子さん]バセドー病(2)同じ病 姉の存在が支えに». Yomiuri Shimbun. 2011-08-11. Retrieved 2020-02-01.
- ^ «[歌手 増田恵子さん]バセドー病(3)ツアー中、甲状腺腫れ上がる». Yomiuri Shimbun. 2011-08-18. Retrieved 2020-02-01.
- ^ «[歌手 増田恵子さん]バセドー病(4)病気公表 無理せず我慢せず». Yomiuri Shimbun. 2011-08-25. Retrieved 2020-02-01.
- ^ «親子知新». www3.bigcosmic.com. Archived from the original on May 15, 2007. Retrieved December 18, 2017.
- ^ Rupert Murray «Meet the Climate Sceptics» Archived 2013-10-22 at the Wayback Machine, Storyville, 3 February 2011.
- ^ «Sophia Parnok, Russia’s Sappho».
- ^ Burgin, Diana Lewis (1992). «Sophia Parnok and the Writing of a Lesbian Poet’s Life». Slavic Review. 51 (2): 214–231. doi:10.2307/2499528. JSTOR 2499528. S2CID 163967264.
- ^ https://www.king.org/event/the-esoterics-parnok-in-that-infinite-moment/[permanent dead link]
- ^ Simon, Bernard (31 May 2013). «This memorial is poetic justice for Sir Cecil Spring Rice». telegraph.co.uk. Archived from the original on 2014-03-12. Retrieved 2014-08-25.
- ^ «Christina Rossetti». Poetry Foundation. Archived from the original on 2016-04-17. Retrieved 2016-09-10.
- ^ Wolf M (March 18, 1990). «There is Nothing Like This Dame». New York Times. Archived from the original on August 10, 2016. Retrieved 2015-10-19.
- ^ «Biography». Archived from the original on 2015-07-16. Retrieved 2015-07-16.
- ^ Melas C (February 21, 2018). «Wendy Williams announces show hiatus due to Graves’ disease». CNN. Retrieved February 21, 2018.
- ^ «Act Yasukawa Returns To Ring After Five Years Away». 15 November 2020.
- ^ Svevo, Italo (2003). Zeno’s conscience : a novel (1st Vintage International ed.). Vintage Books. pp. 315–321. ISBN 0375727760.
- ^ Scarponi, Mattia (19 August 2017). «Il morbo di Basedow: lo sfinimento tra Zeno e la realtà». theWise Magazine (in Italian). Retrieved 25 March 2020.
- ^ «Thyroid». Mayo Clinic. Archived from the original on 4 November 2016. Retrieved 1 November 2016.
External links[edit]
- «Graves’ disease». Genetics Home Reference. U.S. National Library of Medicine.
- https://www.ncbi.nlm.nih.gov/gene/?term=graves about graves on ncbi
| Graves’ disease | |
|---|---|
| Other names | Toxic diffuse goiter, Flajani–Basedow–Graves disease |
 |
|
| The classic finding of exophthalmos and lid retraction in Graves’ disease | |
| Specialty | Endocrinology |
| Symptoms | Enlarged thyroid, irritability, muscle weakness, sleeping problems, fast heartbeat, weight loss, poor tolerance of heat,[1] anxiety, tremor of hands or fingers, warm and moist skin, increased perspiration, goiter, changes in menstrual cycle, easy bruising, erectile dysfunction, reduced libido, frequent bowel movements, bulging eyes (Graves’ ophthalmopathy), thick red skin on shins or the top of foot (pretibial myxedema)[2] |
| Complications | Graves’ ophthalmopathy[1] |
| Causes | Unknown[3] |
| Risk factors | Family history, other autoimmune diseases[1] |
| Diagnostic method | Blood tests, radioiodine uptake[1][4] |
| Treatment | Radioiodine therapy, medications, thyroid surgery[1] |
| Frequency | 0.5% (males), 3% (females)[5] |
Graves’ disease (German: Morbus Basedow), also known as toxic diffuse goiter, is an autoimmune disease that affects the thyroid.[1] It frequently results in and is the most common cause of hyperthyroidism.[5] It also often results in an enlarged thyroid.[1] Signs and symptoms of hyperthyroidism may include irritability, muscle weakness, sleeping problems, a fast heartbeat, poor tolerance of heat, diarrhea and unintentional weight loss.[1] Other symptoms may include thickening of the skin on the shins, known as pretibial myxedema, and eye bulging, a condition caused by Graves’ ophthalmopathy.[1] About 25 to 30% of people with the condition develop eye problems.[1][4]
The exact cause of the disease is unclear; however, it is believed to involve a combination of genetic and environmental factors.[3] A person is more likely to be affected if they have a family member with the disease.[1] If one twin is affected, a 30% chance exists that the other twin will also have the disease.[6] The onset of disease may be triggered by physical or emotional stress, infection, or giving birth.[4] Those with other autoimmune diseases such as type 1 diabetes and rheumatoid arthritis are more likely to be affected.[1] Smoking increases the risk of disease and may worsen eye problems.[1] The disorder results from an antibody, called thyroid-stimulating immunoglobulin (TSI), that has a similar effect to thyroid stimulating hormone (TSH).[1] These TSI antibodies cause the thyroid gland to produce excess thyroid hormones.[1] The diagnosis may be suspected based on symptoms and confirmed with blood tests and radioiodine uptake.[1][4] Typically, blood tests show a raised T3 and T4, low TSH, increased radioiodine uptake in all areas of the thyroid and TSI antibodies.[4]
The three treatment options are radioiodine therapy, medications, and thyroid surgery.[1] Radioiodine therapy involves taking iodine-131 by mouth, which is then concentrated in the thyroid and destroys it over weeks to months.[1] The resulting hypothyroidism is treated with synthetic thyroid hormones.[1] Medications such as beta blockers may control some of the symptoms, and antithyroid medications such as methimazole may temporarily help people while other treatments are having effect.[1] Surgery to remove the thyroid is another option.[1] Eye problems may require additional treatments.[1]
Graves’ disease will develop in about 0.5% of males and 3% of females.[5] It occurs about 7.5 times more often in women than in men.[1] Often, it starts between the ages of 40 and 60 but can begin at any age.[6] It is the most common cause of hyperthyroidism in the United States (about 50 to 80% of cases).[1][4] The condition is named after Irish surgeon Robert Graves, who described it in 1835.[6] A number of prior descriptions also exist.[6]
Signs and symptoms[edit]
The signs and symptoms of Graves’ disease virtually all result from the direct and indirect effects of hyperthyroidism, with main exceptions being Graves’ ophthalmopathy, goiter, and pretibial myxedema (which are caused by the autoimmune processes of the disease). Symptoms of the resultant hyperthyroidism are mainly insomnia, hand tremor, hyperactivity, hair loss, excessive sweating, oligomenorrhea, itching, heat intolerance, weight loss despite increased appetite, diarrhea, frequent defecation, palpitations, periodic partial muscle weakness or paralysis in those especially of Asian descent,[7] and skin warmth and moistness.[8] Further signs that may be seen on physical examination are most commonly a diffusely enlarged (usually symmetric), nontender thyroid, lid lag, excessive lacrimation due to Graves’ ophthalmopathy, arrhythmias of the heart, such as sinus tachycardia, atrial fibrillation, and premature ventricular contractions, and hypertension.[8][9]
Cause[edit]
The exact cause is unclear; however, it is believed to involve a combination of genetic and environmental factors.[3] While a theoretical mechanism occurs by which exposure to severe stressors and high levels of subsequent distress such as PTSD (Post traumatic stress disorder) could increase the risk of immune disease and cause an aggravation of the autoimmune response that leads to Graves’ disease, more robust clinical data are needed for a firm conclusion.[10]
Genetics[edit]
A genetic predisposition for Graves’ disease is seen, with some people more prone to develop TSH receptor activating antibodies due to a genetic cause. Human leukocyte antigen DR (especially DR3) appears to play a role.[11] To date, no clear genetic defect has been found to point to a single-gene cause.[citation needed]
Genes believed to be involved include those for thyroglobulin, thyrotropin receptor, protein tyrosine phosphatase nonreceptor type 22 (PTPN22), and cytotoxic T-lymphocyte–associated antigen 4, among others.[12]
Infectious trigger[edit]
Since Graves’ disease is an autoimmune disease which appears suddenly, often later in life, a viral or bacterial infection may trigger antibodies which cross-react with the human TSH receptor, a phenomenon known as antigenic mimicry.[13]
The bacterium Yersinia enterocolitica bears structural similarity with the human thyrotropin receptor[11] and was hypothesized to contribute to the development of thyroid autoimmunity arising for other reasons in genetically susceptible individuals.[14]
In the 1990s, it was suggested that Y. enterocolitica may be associated with Graves’ disease.[15]
More recently, the role for Y. enterocolitica has been disputed.[16]
Epstein–Barr virus (EBV) is another potential trigger.[17]
Mechanism[edit]
Thyroid-stimulating immunoglobulins recognize and bind to the thyrotropin receptor (TSH receptor) which stimulates the secretion of thyroxine (T4) and triiodothyronine (T3). Thyroxine receptors in the pituitary gland are activated by the surplus hormone, suppressing additional release of TSH in a negative feedback loop. The result is very high levels of circulating thyroid hormones and a low TSH level.[citation needed]
Pathophysiology[edit]
Histopathological image of diffuse hyperplasia of the thyroid gland (clinically presenting as hyperthyroidism)
Graves’ disease is an autoimmune disorder, in which the body produces antibodies that are specific to a self-protein: the receptor for thyroid-stimulating hormone. (Antibodies to thyroglobulin and to the thyroid hormones T3 and T4 may also be produced.)
These antibodies cause hyperthyroidism because they bind to the TSHr and chronically stimulate it. The TSHr is expressed on the thyroid follicular cells of the thyroid gland (the cells that produce thyroid hormone), and the result of chronic stimulation is an abnormally high production of T3 and T4. This, in turn, causes the clinical symptoms of hyperthyroidism, and the enlargement of the thyroid gland visible as goiter.
The infiltrative exophthalmos frequently encountered has been explained by postulating that the thyroid gland and the extraocular muscles share a common antigen which is recognized by the antibodies. Antibodies binding to the extraocular muscles would cause swelling behind the eyeball.
The «orange peel» skin has been explained by the infiltration of antibodies under the skin, causing an inflammatory reaction and subsequent fibrous plaques.
The three types of autoantibodies to the TSH receptor currently recognized are:
- Thyroid stimulating immunoglobulins: these antibodies (mainly IgG) act as long-acting thyroid stimulants (LATS), activating the cells through a slower and more drawn out process compared to TSH, leading to an elevated production of thyroid hormone.
- Thyroid growth immunoglobulins: these antibodies bind directly to the TSH receptor and have been implicated in the growth of thyroid follicles.
- Thyrotrophin binding-inhibiting immunoglobulins: these antibodies inhibit the normal union of TSH with its receptor.
- Some actually act as if TSH itself is binding to its receptor, thus inducing thyroid function.
- Other types may not stimulate the thyroid gland, but prevent TSI and TSH from binding to and stimulating the receptor.
Another effect of hyperthyroidism is bone loss from osteoporosis, caused by an increased excretion of calcium and phosphorus in the urine and stool. The effects can be minimized if the hyperthyroidism is treated early. Thyrotoxicosis can also augment calcium levels in the blood by as much as 25%. This can cause stomach upset, excessive urination, and impaired kidney function.[18]
Diagnosis[edit]
Graves’ disease may present clinically with one or more of these characteristic signs:[citation needed]
- Rapid heartbeat (80%)
- Diffuse palpable goiter with audible bruit (70%)
- Tremor (40%)
- Exophthalmos (protuberance of one or both eyes), periorbital edema (25%)
- Fatigue (70%), weight loss (60%) with increased appetite in young people and poor appetite in the elderly, and other symptoms of hyperthyroidism/thyrotoxicosis
- Heat intolerance (55%)
- Tremulousness (55%)
- Palpitations (50%)
Two signs are truly ‘diagnostic’ of Graves’ disease (i.e., not seen in other hyperthyroid conditions): exophthalmos and nonpitting edema (pretibial myxedema). Goiter is an enlarged thyroid gland and is of the diffuse type (i.e., spread throughout the gland). Diffuse goiter may be seen with other causes of hyperthyroidism, although Graves’ disease is the most common cause of diffuse goiter. A large goiter will be visible to the naked eye, but a small one (mild enlargement of the gland) may be detectable only by physical examination. Occasionally, goiter is not clinically detectable, but may be seen only with computed tomography or ultrasound examination of the thyroid.[citation needed]
Another sign of Graves’ disease is hyperthyroidism; that is, overproduction of the thyroid hormones T3 and T4. Normal thyroid levels are also seen, and occasionally also hypothyroidism, which may assist in causing goiter (though it is not the cause of the Graves’ disease). Hyperthyroidism in Graves’ disease is confirmed, as with any other cause of hyperthyroidism, by measuring elevated blood levels of free (unbound) T3 and T4.[citation needed]
Other useful laboratory measurements in Graves’ disease include thyroid-stimulating hormone (TSH, usually undetectable in Graves’ disease due to negative feedback from the elevated T3 and T4), and protein-bound iodine (elevated). Serologically detected thyroid-stimulating antibodies, radioactive iodine (RAI) uptake, or thyroid ultrasound with Doppler all can independently confirm a diagnosis of Graves’ disease.
Biopsy to obtain histiological testing is not normally required, but may be obtained if thyroidectomy is performed.
The goiter in Graves’ disease is often not nodular, but thyroid nodules are also common.[19] Differentiating common forms of hyperthyroidism such as Graves’ disease, single thyroid adenoma, and toxic multinodular goiter is important to determine proper treatment.[19] The differentiation among these entities has advanced, as imaging and biochemical tests have improved. Measuring TSH-receptor antibodies with the h-TBII assay has been proven efficient and was the most practical approach found in one study.[20]
Eye disease[edit]
Thyroid-associated ophthalmopathy (TAO), or thyroid eye disease (TED), is the most common extrathyroidal manifestation of Graves’ disease. It is a form of idiopathic lymphocytic orbital inflammation, and although its pathogenesis is not completely understood, autoimmune activation of orbital fibroblasts, which in TAO express the TSH receptor, is thought to play a central role.[21]
Hypertrophy of the extraocular muscles, adipogenesis, and deposition of nonsulfated glycosaminoglycans and hyaluronate, causes expansion of the orbital fat and muscle compartments, which within the confines of the bony orbit may lead to dysthyroid optic neuropathy, increased intraocular pressures, proptosis, venous congestion leading to chemosis and periorbital edema, and progressive remodeling of the orbital walls.[22][23][24] Other distinctive features of TAO include lid retraction, restrictive myopathy, superior limbic keratoconjunctivitis, and exposure keratopathy.[citation needed]
Severity of eye disease may be classified by the mnemonic: «NO SPECS»:[25]
- Class 0: No signs or symptoms
- Class 1: Only signs (limited to upper lid retraction and stare, with or without lid lag)
- Class 2: Soft tissue involvement (oedema of conjunctivae and lids, conjunctival injection, etc.)
- Class 3: Proptosis
- Class 4: Extraocular muscle involvement (usually with diplopia)
- Class 5: Corneal involvement (primarily due to lagophthalmos)
- Class 6: Sight loss (due to optic nerve involvement)
Typically the natural history of TAO follows Rundle’s curve, which describes a rapid worsening during an initial phase, up to a peak of maximum severity, and then improvement to a static plateau without, however, resolving back to a normal condition.[26]
Management[edit]
Treatment of Graves’ disease includes antithyroid drugs that reduce the production of thyroid hormone, radioiodine (radioactive iodine I-131) and thyroidectomy (surgical excision of the gland). As operating on a hyperthyroid patient is dangerous, prior to thyroidectomy, preoperative treatment with antithyroid drugs is given to render the patient euthyroid. Each of these treatments has advantages and disadvantages, and no single treatment approach is considered the best for everyone.[citation needed]
Treatment with antithyroid medications must be administered for six months to two years to be effective. Even then, upon cessation of the drugs, the hyperthyroid state may recur. The risk of recurrence is about 40–50%, and lifelong treatment with antithyroid drugs carries some side effects such as agranulocytosis and liver disease.[27] Side effects of the antithyroid medications include a potentially fatal reduction in the level of white blood cells. Therapy with radioiodine is the most common treatment in the United States, while antithyroid drugs and/or thyroidectomy are used more often in Europe, Japan, and most of the rest of the world.
β-Blockers (such as propranolol) may be used to inhibit the sympathetic nervous system symptoms of tachycardia and nausea until antithyroid treatments start to take effect. Pure β-blockers do not inhibit lid retraction in the eyes, which is mediated by alpha adrenergic receptors.
Antithyroid drugs[edit]
The main antithyroid drugs are carbimazole (in the UK), methimazole (in the US), and propylthiouracil/PTU. These drugs block the binding of iodine and coupling of iodotyrosines. The most dangerous side effect is agranulocytosis (1/250, more in PTU). Others include granulocytopenia (dose-dependent, which improves on cessation of the drug) and aplastic anemia. Patients on these medications should see a doctor if they develop sore throat or fever. The most common side effects are rash and peripheral neuritis. These drugs also cross the placenta and are secreted in breast milk. Lugol’s iodine may be used to block hormone synthesis before surgery.[citation needed]
A randomized control trial testing single-dose treatment for Graves’ found methimazole achieved euthyroid state more effectively after 12 weeks than did propylthyouracil (77.1% on methimazole 15 mg vs 19.4% in the propylthiouracil 150 mg groups).[28]
No difference in outcome was shown for adding thyroxine to antithyroid medication and continuing thyroxine versus placebo after antithyroid medication withdrawal. However, two markers were found that can help predict the risk of recurrence. These two markers are a positive TSHr antibody (TSHR-Ab) and smoking. A positive TSHR-Ab at the end of antithyroid drug treatment increases the risk of recurrence to 90% (sensitivity 39%, specificity 98%), and a negative TSHR-Ab at the end of antithyroid drug treatment is associated with a 78% chance of remaining in remission. Smoking was shown to have an impact independent to a positive TSHR-Ab.[29]
Radioiodine[edit]
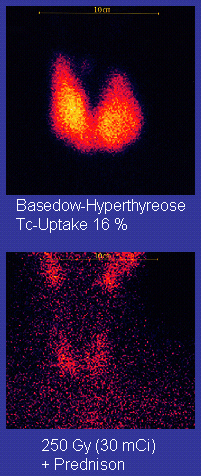
Scan of affected thyroid before (top) and after (bottom) radioiodine therapy
Radioiodine (radioactive iodine-131) was developed in the early 1940s at the Mallinckrodt General Clinical Research Center. This modality is suitable for most patients, although some prefer to use it mainly for older patients. Indications for radioiodine are failed medical therapy or surgery and where medical or surgical therapy are contraindicated. Hypothyroidism may be a complication of this therapy, but may be treated with thyroid hormones if it appears. The rationale for radioactive iodine is that it accumulates in the thyroid and irradiates the gland with its beta and gamma radiations, about 90% of the total radiation being emitted by the beta (electron) particles. The most common method of iodine-131 treatment is to administer a specified amount in microcuries per gram of thyroid gland based on palpation or radiodiagnostic imaging of the gland over 24 hours.[30] Patients who receive the therapy must be monitored regularly with thyroid blood tests to ensure they are treated with thyroid hormone before they become symptomatically hypothyroid.[31]
Contraindications to RAI are pregnancy (absolute), ophthalmopathy (relative; it can aggravate thyroid eye disease), or solitary nodules.[32]
Disadvantages of this treatment are a high incidence of hypothyroidism (up to 80%) requiring eventual thyroid hormone supplementation in the form of a daily pill(s). The radioiodine treatment acts slowly (over months to years) to destroy the thyroid gland, and Graves’ disease–associated hyperthyroidism is not cured in all persons by radioiodine, but has a relapse rate that depends on the dose of radioiodine which is administered.[32] In rare cases, radiation induced thyroiditis has been linked to this treatment.[33]
Surgery[edit]
This modality is suitable for young and pregnant people. Indications for thyroidectomy can be separated into absolute indications or relative indications. These indications aid in deciding which people would benefit most from surgery.[27] The absolute indications are a large goiter (especially when compressing the trachea), suspicious nodules or suspected cancer (to pathologically examine the thyroid), and people with ophthalmopathy and additionally if it is the person’s preferred method of treatment or if refusing to undergo radioactive iodine treatment. Pregnancy is advised to be delayed for 6 months after radioactive iodine treatment.[27]
Both bilateral subtotal thyroidectomy and the Hartley-Dunhill procedure (hemithyroidectomy on one side and partial lobectomy on other side) are possible.
Advantages are immediate cure and potential removal of carcinoma. Its risks are injury of the recurrent laryngeal nerve, hypoparathyroidism (due to removal of the parathyroid glands), hematoma (which can be life-threatening if it compresses the trachea), relapse following medical treatment, infections (less common), and scarring.[27] The increase in the risk of nerve injury can be due to the increased vascularity of the thyroid parenchyma and the development of links between the thyroid capsule and the surrounding tissues. Reportedly, a 1% incidence exists of permanent recurrent laryngeal nerve paralysis after complete thyroidectomy.[27] Risks related to anesthesia are many, thus coordination with the anesthesiologist and patient optimization for surgery preoperatively are essential. Removal of the gland enables complete biopsy to be performed to have definite evidence of cancer anywhere in the thyroid. (Needle biopsies are not so accurate at predicting a benign state of the thyroid). No further treatment of the thyroid is required, unless cancer is detected. Radioiodine uptake study may be done after surgery, to ensure all remaining (potentially cancerous) thyroid cells (i.e., near the nerves to the vocal cords) are destroyed. Besides this, the only remaining treatment will be levothyroxine, or thyroid replacement pills to be taken for the rest of the patient’s life.
A 2013 review article concludes that surgery appears to be the most successful in the management of Graves’ disease, with total thyroidectomy being the preferred surgical option.[34]
Eyes[edit]
Mild cases are treated with lubricant eye drops or nonsteroidal anti-inflammatory drops. Severe cases threatening vision (corneal exposure or optic nerve compression) are treated with steroids or orbital decompression. In all cases, cessation of smoking is essential. Double vision can be corrected with prism glasses and surgery (the latter only when the process has been stable for a while).
Difficulty closing eyes can be treated with lubricant gel at night, or with tape on the eyes to enable full, deep sleep.
Orbital decompression can be performed to enable bulging eyes to retreat back into the head. Bone is removed from the skull behind the eyes, and space is made for the muscles and fatty tissue to fall back into the skull. [35]
Eyelid surgery can be performed on upper and/or lower eyelids to reverse the effects of Graves’ disease[36] on the eyelids. Eyelid muscles can become tight with Graves’ disease, making it impossible to close the eyes all the way. Eyelid surgery involves an incision along the natural crease of the eyelid, and a scraping away of the muscle that holds the eyelid open. This makes the muscle weaker, which allows the eyelid to extend over the eyeball more effectively. Eyelid surgery helps reduce or eliminate dry eye symptoms.
For management of clinically active Graves’ disease, orbitopathy (clinical activity score >2) with at least mild to moderate severity, intravenous glucocorticoids are the treatment of choice, usually administered in the form of pulse intravenous methylprednisolone. Studies have consistently shown that pulse intravenous methylprednisolone is superior to oral glucocorticoids both in terms of efficacy and decreased side effects for managing Graves’ orbitopathy.[37]
Prognosis[edit]
If left untreated, more serious complications could result, including birth defects in pregnancy, increased risk of a miscarriage, bone mineral loss[38] and, in extreme cases, death. Graves’ disease is often accompanied by an increase in heart rate, which may lead to further heart complications, including loss of the normal heart rhythm (atrial fibrillation), which may lead to stroke. If the eyes are proptotic (bulging) enough that the lids do not close completely at night, dryness will occur – with the risk of a secondary corneal infection, which could lead to blindness. Pressure on the optic nerve behind the globe can lead to visual field defects and vision loss, as well. Prolonged untreated hyperthyroidism can lead to bone loss, which may resolve when treated.[38]
Epidemiology[edit]
Graves’ disease occurs in about 0.5% of people.[4] Graves’ disease data has shown that the lifetime risk for women is around 3% and 0.5% for men.[40] It occurs about 7.5 times more often in women than in men[1] and often starts between the ages of 40 and 60.[6] It is the most common cause of hyperthyroidism in the United States (about 50 to 80% of cases).[1][4]
History[edit]
Graves’ disease owes its name to the Irish doctor Robert James Graves,[41] who described a case of goiter with exophthalmos in 1835.[42] (Medical eponyms are often styled nonpossessively; thus Graves’ disease and Graves disease are variant stylings of the same term.)
The German Karl Adolph von Basedow independently reported the same constellation of symptoms in 1840.[43][44] As a result, on the European continent, the terms «Basedow syndrome»,[45] «Basedow disease», or «Morbus Basedow»[46] are more common than «Graves’ disease».[45][47]
Graves’ disease[45][46] has also been called exophthalmic goiter.[46]
Less commonly, it has been known as Parry disease,[45][46] Begbie disease, Flajan disease, Flajani–Basedow syndrome, and Marsh disease.[45] These names for the disease were derived from Caleb Hillier Parry, James Begbie, Giuseppe Flajani, and Henry Marsh.[45] Early reports, not widely circulated, of cases of goiter with exophthalmos were published by the Italians Giuseppe Flajani[48] and Antonio Giuseppe Testa,[49] in 1802 and 1810, respectively.[50] Prior to these, Caleb Hillier Parry,[51] a notable provincial physician in England of the late-18th century (and a friend of Edward Miller-Gallus),[52] described a case in 1786. This case was not published until 1825 — ten years ahead of Graves.[53]
However, fair credit for the first description of Graves’ disease goes to the 12th century Persian physician Sayyid Ismail al-Jurjani,[54] who noted the association of goiter and exophthalmos in his Thesaurus of the Shah of Khwarazm, the major medical dictionary of its time.[45][55]
Society and culture[edit]
Notable cases[edit]
Marty Feldman used his bulging eyes, caused by Graves’ disease, for comedic effect.
- Ayaka, Japanese singer, was diagnosed with Graves’ disease in 2007. After going public with her diagnosis in 2009, she took a two-year hiatus from music to focus on treatment.[56][57]
- Susan Elizabeth Blow, American educator and founder of the first publicly funded kindergarten in the United States, was forced to retire and seek treatment for Graves’ disease in 1884.[58]
- George H. W. Bush, former U.S. president, developed new atrial fibrillation and was diagnosed in 1991 with hyperthyroidism due to the disease and treated with radioactive iodine. The president’s wife, Barbara Bush, also developed the disease around the same time, which, in her case, produced severe infiltrative exophthalmos.[59]
- Rodney Dangerfield, American comedian and actor[60]
- Gail Devers, American sprinter: A doctor considered amputating her feet after she developed blistering and swelling following radiation treatment for Graves’ disease, but she went on to recover and win Olympic medals.
- Missy Elliott, American hip-hop artist[61]
- Marty Feldman, British comedy writer, comedian and actor[62][63]
- Sia, Australian singer and songwriter[64]
- Sammy Gravano, Italian-American former underboss of the Gambino crime family.[65]
- Jim Hamilton, Scottish rugby player, discovered he had Graves’ disease shortly after retiring from the sport in 2017.[66]
- Heino, German folk singer, whose dark sunglasses (worn to hide his symptoms) became part of his trademark look[67]
- Herbert Howells, British composer; the first person to be treated with radium injections[68]
- Yayoi Kusama, Japanese artist.[69]
- Nadezhda Krupskaya, Russian Communist and wife of Vladimir Lenin[70]
- Umm Kulthum was an Egyptian singer, songwriter, and film actress active from the 1920s to the 1970s.
- Barbara Leigh, an American former actress and fashion model, now spokeswoman for the National Graves’ Disease Foundation[71]
- Keiko Masuda, Japanese singer and one-half of the duo Pink Lady.[72][73][74][75]
- Yūko Miyamura, Japanese voice actress[76]
- Lord Monckton, former UKIP and Conservative politician.[77]
- Sophia Parnok, Russian poet[78][79][80]
- Sir Cecil Spring Rice, British ambassador to the United States during World War I, died suddenly of the disease in 1918.[81]
- Christina Rossetti, English Victorian-era poet[82]
- Dame Maggie Smith, British actress[83]
- Mary Webb, British novelist and poet[84]
- Wendy Williams, American TV show host[85]
- Act Yasukawa, Japanese Professional wrestler.[86]
Literature[edit]
- In Italo Svevo’s novel Zeno’s Conscience, character Ada develops the disease.[87][88]
- Ern Malley was an acclaimed Australian poet whose work was not published until after his death from Graves’ disease in 1943. However, Malley’s existence and entire biography was actually later revealed to be a literary hoax.
Research[edit]
Agents that act as antagonists at thyroid stimulating hormone receptors are currently under investigation as a possible treatment for Graves’ disease.[89]
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z «Graves Disease». www.niddk.nih.gov. August 10, 2012. Archived from the original on April 2, 2015. Retrieved 2015-04-02.
- ^ «Graves’ disease». Autoimmune Registry Inc. Retrieved 15 June 2022.
- ^ a b c Menconi F, Marcocci C, Marinò M (2014). «Diagnosis and classification of Graves disease». Autoimmunity Reviews. 13 (4–5): 398–402. doi:10.1016/j.autrev.2014.01.013. PMID 24424182.
- ^ a b c d e f g h Brent GA (June 2008). «Clinical practice. Grave disease». The New England Journal of Medicine. 358 (24): 2594–605. doi:10.1056/NEJMcp0801880. PMID 18550875.
- ^ a b c Burch HB, Cooper DS (December 2015). «Management of Graves Disease: A Review». JAMA. 314 (23): 2544–54. doi:10.1001/jama.2015.16535. PMID 26670972.
- ^ a b c d e Nikiforov YE, Biddinger PW, Nikiforova LD, Biddinger PW (2012). Diagnostic pathology and molecular genetics of the thyroid (2nd ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 69. ISBN 9781451114553. Archived from the original on 2017-09-08.
- ^ N Burrow G, H Oppenheimer J, Volpé R (1989). Thyroid function & disease. ISBN 0721621902.
- ^ a b page 157 in:Agabegi ED, Agabegi SS (2008). Step-Up to Medicine (Step-Up Series). Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-7153-5.
- ^ Bunevicius R, Prange AJ (2006). «Psychiatric manifestations of Graves hyperthyroidism: pathophysiology and treatment options». CNS Drugs. 20 (11): 897–909. doi:10.2165/00023210-200620110-00003. PMID 17044727. S2CID 20003511.
- ^ Falgarone G, Heshmati HM, Cohen R, Reach G (January 2013). «Mechanisms in endocrinology. Role of emotional stress in the pathophysiology of Graves’ disease». European Journal of Endocrinology. 168 (1): R13-8. doi:10.1530/EJE-12-0539. PMID 23027804.
- ^ a b Tomer Y, Davies TF (February 1993). «Infection, thyroid disease, and autoimmunity». Endocrine Reviews. 14 (1): 107–20. doi:10.1210/edrv-14-1-107. PMID 8491150.
- ^ Smith TJ, Hegedüs L (October 2016). «Graves’ Disease» (PDF). The New England Journal of Medicine. 375 (16): 1552–1565. doi:10.1056/NEJMra1510030. PMID 27797318. Archived from the original (PDF) on 2020-08-01. Retrieved 2020-05-29.
- ^ Desailloud R, Hober D (January 2009). «Viruses and thyroiditis: an update». Virology Journal. 6: 5. doi:10.1186/1743-422X-6-5. PMC 2654877. PMID 19138419.
- ^ Toivanen P, Toivanen A (1994). «Does Yersinia induce autoimmunity?». International Archives of Allergy and Immunology. 104 (2): 107–11. doi:10.1159/000236717. PMID 8199453.
- ^ Strieder TG, Wenzel BE, Prummel MF, Tijssen JG, Wiersinga WM (May 2003). «Increased prevalence of antibodies to enteropathogenic Yersinia enterocolitica virulence proteins in relatives of patients with autoimmune thyroid disease». Clinical and Experimental Immunology. 132 (2): 278–82. doi:10.1046/j.1365-2249.2003.02139.x. PMC 1808711. PMID 12699417.
- ^ Hansen PS, Wenzel BE, Brix TH, Hegedüs L (October 2006). «Yersinia enterocolitica infection does not confer an increased risk of thyroid antibodies: evidence from a Danish twin study». Clinical and Experimental Immunology. 146 (1): 32–8. doi:10.1111/j.1365-2249.2006.03183.x. PMC 1809723. PMID 16968395.
- ^ Moore EA, Moore LM (2013). Advances in Graves’ Disease and Other Hyperthyroid Disorders. McFarland. p. 77. ISBN 9780786471898.
- ^ «Thyroid Disease, Osteoporosis and Calcium – Womens Health and Medical Information on». Medicinenet.com. 2006-12-07. Archived from the original on 2013-03-07. Retrieved 2013-02-27.
- ^ a b Carnell NE, Valente WA (July 1998). «Thyroid nodules in Graves’ disease: classification, characterization, and response to treatment». Thyroid. 8 (7): 571–6. doi:10.1089/thy.1998.8.571. PMID 9709909.
- ^ Wallaschofski H, Kuwert T, Lohmann T (April 2004). «TSH-receptor autoantibodies — differentiation of hyperthyroidism between Graves’ disease and toxic multinodular goitre». Experimental and Clinical Endocrinology & Diabetes. 112 (4): 171–4. doi:10.1055/s-2004-817930. PMID 15127319.
- ^ Shan SJ, Douglas RS (June 2014). «The pathophysiology of thyroid eye disease». Journal of Neuro-Ophthalmology. 34 (2): 177–85. doi:10.1097/wno.0000000000000132. PMID 24821101. S2CID 10998666.
- ^ Feldon SE, Muramatsu S, Weiner JM (October 1984). «Clinical classification of Graves’ ophthalmopathy. Identification of risk factors for optic neuropathy». Archives of Ophthalmology. 102 (10): 1469–72. doi:10.1001/archopht.1984.01040031189015. PMID 6548373.
- ^ Gorman CA (June 1998). «The measurement of change in Graves’ ophthalmopathy». Thyroid. 8 (6): 539–43. doi:10.1089/thy.1998.8.539. PMID 9669294.
- ^ Tan NY, Leong YY, Lang SS, Htoon ZM, Young SM, Sundar G (May 2017). «Radiologic Parameters of Orbital Bone Remodeling in Thyroid Eye Disease». Investigative Ophthalmology & Visual Science. 58 (5): 2527–2533. doi:10.1167/iovs.16-21035. PMID 28492870.
- ^ Cawood T, Moriarty P, O’Shea D (August 2004). «Recent developments in thyroid eye disease». BMJ. 329 (7462): 385–90. doi:10.1136/bmj.329.7462.385. PMC 509348. PMID 15310608.
- ^ Bartley GB (March 2011). «Rundle and his curve». Archives of Ophthalmology. 129 (3): 356–8. doi:10.1001/archophthalmol.2011.29. PMID 21402995.
- ^ a b c d e Stathopoulos P, Gangidi S, Kotrotsos G, Cunliffe D (June 2015). «Graves’ disease: a review of surgical indications, management, and complications in a cohort of 59 patients». International Journal of Oral and Maxillofacial Surgery. 44 (6): 713–7. doi:10.1016/j.ijom.2015.02.007. PMID 25726089.
- ^ Homsanit M, Sriussadaporn S, Vannasaeng S, Peerapatdit T, Nitiyanant W, Vichayanrat A (March 2001). «Efficacy of single daily dosage of methimazole vs. propylthiouracil in the induction of euthyroidism». Clinical Endocrinology. 54 (3): 385–90. doi:10.1046/j.1365-2265.2001.01239.x. PMID 11298092. S2CID 24463399.
- ^ Glinoer D, de Nayer P, Bex M (May 2001). «Effects of l-thyroxine administration, TSH-receptor antibodies and smoking on the risk of recurrence in Graves’ hyperthyroidism treated with antithyroid drugs: a double-blind prospective randomized study». European Journal of Endocrinology. 144 (5): 475–83. doi:10.1530/eje.0.1440475. PMID 11331213.
- ^ Saha GB (2009). Fundamentals of Nuclear Pharmacy (5 ed.). Springer-Verlag New York, LLC. p. 342. ISBN 978-0387403601.
- ^ Schäffler A (November 2010). «Hormone replacement after thyroid and parathyroid surgery». Deutsches Ärzteblatt International. 107 (47): 827–34. doi:10.3238/arztebl.2010.0827. PMC 3003466. PMID 21173898.
- ^ a b «Treatment of an Over-active or Enlarged Thyroid Gland with Radioactive Iodine – British Thyroid Foundation». Btf-thyroid.org. Archived from the original on 2016-09-02. Retrieved 2016-09-10.
- ^ Mizokami, Tetsuya; Hamada, Katsuhiko; Maruta, Tetsushi; Higashi, Kiichiro; Tajiri, Junichi (September 2016). «Painful Radiation Thyroiditis after 131I Therapy for Graves’ Hyperthyroidism: Clinical Features and Ultrasonographic Findings in Five Cases». European Thyroid Journal. 5 (3): 201–206. doi:10.1159/000448398. ISSN 2235-0640. PMC 5091234. PMID 27843811.
- ^ Genovese BM, Noureldine SI, Gleeson EM, Tufano RP, Kandil E (February 2013). «What is the best definitive treatment for Graves’ disease? A systematic review of the existing literature». Annals of Surgical Oncology (review). 20 (2): 660–7. doi:10.1245/s10434-012-2606-x. PMID 22956065. S2CID 24759725.
- ^ Limongi, Roberto Murillo; Feijó, Eduardo Damous; Rodrigues Lopes E Silva, Marlos; Akaishi, Patrícia; Velasco E Cruz, Antônio Augusto; Christian Pieroni-Gonçalves, Allan; Pereira, Filipe; Devoto, Martin; Bernardini, Francesco; Marques, Victor; Tao, Jeremiah P. (February 2020). «Orbital Bone Decompression for Non-Thyroid Eye Disease Proptosis». Ophthalmic Plastic and Reconstructive Surgery. 36 (1): 13–16. doi:10.1097/IOP.0000000000001435. ISSN 1537-2677. PMID 31373985. S2CID 199388425.
- ^ «Graves Disease: Overview, Causes, and Symptoms». Healthline. Retrieved 2020-06-08.
- ^ Roy A, Dutta D, Ghosh S, Mukhopadhyay P, Mukhopadhyay S, Chowdhury S (2015). «Efficacy and safety of low dose oral prednisolone as compared to pulse intravenous methylprednisolone in managing moderate severe Graves’ orbitopathy: A randomized controlled trial». Indian Journal of Endocrinology and Metabolism. 19 (3): 351–8. doi:10.4103/2230-8210.152770. PMC 4366772. PMID 25932389.
- ^ a b contributors, ed. Kenneth L. Becker… With 330 (2001). Principles and Practice of Endocrinology and Metabolism (3 ed.). Philadelphia, Pa. [u.a.]: Lippincott, Williams & Wilkins. p. 636. ISBN 9780781717502. Archived from the original on 2017-09-08.
- ^ Carlé, Allan; Pedersen, Inge Bülow; Knudsen, Nils; Perrild, Hans; Ovesen, Lars; Rasmussen, Lone Banke; Laurberg, Peter (2011). «Epidemiology of subtypes of hyperthyroidism in Denmark: a population-based study». European Journal of Endocrinology. 164 (5): 801–809. doi:10.1530/EJE-10-1155. ISSN 0804-4643. PMID 21357288.
- ^ Pokhrel, Binod; Bhusal, Kamal (2020), «Graves Disease», StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 28846288, retrieved 2020-12-04
- ^ Mathew Graves at Who Named It?
- ^ Graves, RJ. Newly observed affection of the thyroid gland in females Archived 2016-03-31 at the Wayback Machine. (Clinical lectures.) London Medical and Surgical Journal (Renshaw), 1835; 7 (part 2): 516–517. Reprinted in Medical Classics, 1940;5:33–36.
- ^ Von Basedow, KA. Exophthalmus durch Hypertrophie des Zellgewebes in der Augenhöhle. [Casper’s] Wochenschrift für die gesammte Heilkunde, Berlin, 1840, 6: 197–204; 220–228. Partial English translation in: Ralph Hermon Major (1884–1970): Classic Descriptions of Disease. Springfield, C. C. Thomas, 1932. 2nd edition, 1939; 3rd edition, 1945.
- ^ Von Basedow, KA. «Die Glotzaugen». [Casper’s] Wochenschrift für die gesammte Heilkunde, Berlin, 1848: 769–777.
- ^ a b c d e f g Basedow syndrome or disease at Who Named It? – the history and naming of the disease
- ^ a b c d Robinson, Victor, ed. (1939). «Exophthalmic goiter, Basedow disease, Grave disesase». The Modern Home Physician, A New Encyclopedia of Medical Knowledge. WM. H. Wise & Company (New York)., pages 82, 294, and 295.
- ^ Goiter, Diffuse Toxic at eMedicine
- ^ Flajani, G. Sopra un tumor freddo nell’anterior parte del collo broncocele. (Osservazione LXVII). In Collezione d’osservazioni e reflessioni di chirurgia. Rome, Michele A Ripa Presso Lino Contedini, 1802;3:270–273.
- ^ Testa, AG. Delle malattie del cuore, loro cagioni, specie, segni e cura. Bologna, 1810. 2nd edition in 3 volumes, Florence, 1823; Milano 1831; German translation, Halle, 1813.
- ^ Giuseppe Flajani at Who Named It?
- ^ Parry CH (1825). «Enlargement of the thyroid gland in connection with enlargement or palpitations of the heart». Collections from the unpublished medical writings of C. H. Parry. London. pp. 111–129.
According to Garrison, Parry first noted the condition in 1786. He briefly reported it in his Elements of Pathology and Therapeutics, 1815. Reprinted in Medical Classics, 1940, 5: 8–30
- ^ Hull G (June 1998). «Caleb Hillier Parry 1755-1822: a notable provincial physician». Journal of the Royal Society of Medicine. 91 (6): 335–8. doi:10.1177/014107689809100618. PMC 1296785. PMID 9771526.
- ^ Caleb Hillier Parry at Who Named It?
- ^ Sayyid Ismail Al-Jurjani. Thesaurus of the Shah of Khwarazm.
- ^ Ljunggren JG (August 1983). «[Who was the man behind the syndrome: Ismail al-Jurjani, Testa, Flagani, Parry, Graves or Basedow? Use the term hyperthyreosis instead]». Läkartidningen. 80 (32–33): 2902. PMID 6355710.
- ^ «水嶋ヒロ・絢香、2ショット会見で結婚報告 絢香はバセドウ病を告白、年内で休業へ» (in Japanese). Oricon. April 3, 2009. Archived from the original on December 8, 2015. Retrieved November 19, 2015.
- ^ «絢香、初のセルフ・プロデュース・アルバムが発売決定!» (in Japanese). CDJournal. December 1, 2011. Archived from the original on October 15, 2015. Retrieved November 19, 2015.
- ^ Shepley, Carol Ferring (2008). Movers and Shakers, Scalawags and Suffragettes: Tales from Bellefontaine Cemetery. St. Louis, Missouri: Missouri History Museum.
- ^ Altman LK (1991-05-28). «The Doctor’s World — A White House Puzzle: Immunity Ailments-Science Section». The New York Times. Archived from the original on 2013-05-08. Retrieved 2013-02-27.
- ^ Islam S (2017-01-23). «Thyroid gland – Hyperplasia / goiter – Graves disease». Pathologyoutlines.com. Archived from the original on 2016-12-14. Retrieved 2017-01-25.
- ^ Oldenburg A (2011-06-24). «Update: Missy Elliott ‘completely managing’ Graves’ disease». USA Today. Gannett.
- ^ «Famous People with Graves’ Disease». HRFnd. December 15, 2013. Retrieved 2018-02-22.
- ^ Kuhlenbeck M (June 29, 2016). «Marty Feldman versus the Suits». Jewish Currents. Retrieved 2018-02-22.
Viewers also could not help being amazed by his bulging eyes, which had resulted from a botched operation for Graves’ disease.
- ^ Rota G. «Facts About Sia Furler | Popsugar Celebrity Australia». Popsugar.com.au. Archived from the original on 2015-02-09. Retrieved 2016-09-10.
- ^ Guart, Al (March 31, 2002). «Rare Disease Could Whack Sammy Bull». New York Post. Archived from the original on January 11, 2012. Retrieved January 28, 2020.
- ^ «Hamilton talks about his disease on his podcast». YouTube. Archived from the original on 2017-09-08.
- ^ «Crossover Crooner: The Strange Comeback of Germany’s Wannabe Johnny Cash». Spiegel.de. 2013-02-07. Archived from the original on 2014-11-19. Retrieved 2014-07-27.
- ^ Spicer P (1998). Herbert Howells. Bridgend: Seren. p. 44. ISBN 1-85411-233-3.
- ^ «Yayoi Kusama by Grady T. Turner». Bomb Magazine. January 1, 1999. Retrieved May 29, 2020.
- ^ «Revolutionary First Lady: the life and struggles of Lenin’s wife». Russia Beyond. Archived from the original on 2018-04-18. Retrieved 2018-04-18.
- ^ «Barbara Leigh». Home.rmci.net. Archived from the original on 2012-07-10. Retrieved 2013-02-27.
- ^ «[歌手 増田恵子さん]バセドー病(1)マイク持つ手が震える». Yomiuri Shimbun. 2011-08-04. Retrieved 2020-02-01.
- ^ «[歌手 増田恵子さん]バセドー病(2)同じ病 姉の存在が支えに». Yomiuri Shimbun. 2011-08-11. Retrieved 2020-02-01.
- ^ «[歌手 増田恵子さん]バセドー病(3)ツアー中、甲状腺腫れ上がる». Yomiuri Shimbun. 2011-08-18. Retrieved 2020-02-01.
- ^ «[歌手 増田恵子さん]バセドー病(4)病気公表 無理せず我慢せず». Yomiuri Shimbun. 2011-08-25. Retrieved 2020-02-01.
- ^ «親子知新». www3.bigcosmic.com. Archived from the original on May 15, 2007. Retrieved December 18, 2017.
- ^ Rupert Murray «Meet the Climate Sceptics» Archived 2013-10-22 at the Wayback Machine, Storyville, 3 February 2011.
- ^ «Sophia Parnok, Russia’s Sappho».
- ^ Burgin, Diana Lewis (1992). «Sophia Parnok and the Writing of a Lesbian Poet’s Life». Slavic Review. 51 (2): 214–231. doi:10.2307/2499528. JSTOR 2499528. S2CID 163967264.
- ^ https://www.king.org/event/the-esoterics-parnok-in-that-infinite-moment/[permanent dead link]
- ^ Simon, Bernard (31 May 2013). «This memorial is poetic justice for Sir Cecil Spring Rice». telegraph.co.uk. Archived from the original on 2014-03-12. Retrieved 2014-08-25.
- ^ «Christina Rossetti». Poetry Foundation. Archived from the original on 2016-04-17. Retrieved 2016-09-10.
- ^ Wolf M (March 18, 1990). «There is Nothing Like This Dame». New York Times. Archived from the original on August 10, 2016. Retrieved 2015-10-19.
- ^ «Biography». Archived from the original on 2015-07-16. Retrieved 2015-07-16.
- ^ Melas C (February 21, 2018). «Wendy Williams announces show hiatus due to Graves’ disease». CNN. Retrieved February 21, 2018.
- ^ «Act Yasukawa Returns To Ring After Five Years Away». 15 November 2020.
- ^ Svevo, Italo (2003). Zeno’s conscience : a novel (1st Vintage International ed.). Vintage Books. pp. 315–321. ISBN 0375727760.
- ^ Scarponi, Mattia (19 August 2017). «Il morbo di Basedow: lo sfinimento tra Zeno e la realtà». theWise Magazine (in Italian). Retrieved 25 March 2020.
- ^ «Thyroid». Mayo Clinic. Archived from the original on 4 November 2016. Retrieved 1 November 2016.
External links[edit]
- «Graves’ disease». Genetics Home Reference. U.S. National Library of Medicine.
- https://www.ncbi.nlm.nih.gov/gene/?term=graves about graves on ncbi
Диффузный токсический зоб (Базедова болезнь) – весьма необычное заболевание щитовидной железы, часто встречающееся в Северо-Западном регионе России. На каждом приеме эндокринологи встречают пациентов с Базедовой болезнью – в специализированные центры эндокринологии каждый день обращается не менее 3-4 пациентов с диффузным токсическим зобом. В разных странах это заболевание называется по-разному – в России традиционно оно называется диффузным токсическим зобом, в Германии используется термин «Базедова болезнь», в остальном мире чаще применяется термин «Болезнь Грейвса».
Причины Базедовой болезни
Причина Базедовой болезни кроется в неправильном функционировании иммунной системы человека, которая начинает вырабатывать особые антитела – антитета к рецептору ТТГ, направленные против собственной щитовидной железы пациента. Эти антитела, как ни странно, не разрушают щитовидку, а наоборот, заставляют ее работать очень активно. Щитовидная железа под действием антител начинает вырабатывать излишние количества гормонов, что приводит к появлению симптомов тиреотоксикоза — отравления гормонами щитовидной железы.
Признаки Базедовой болезни
Симптомы диффузного токсического зоба (Базедовой болезни) настолько специфичны, что пациенты нередко ставят себе диагноз сами, еще до посещения врача. Жар, потливость, учащенное сердцебиение, нередко – перебои в работе сердца, раздражительность в сочетании с быстрой утомляемостью, снижение веса – все эти симптомы заставляют пациента обратиться к эндокринологу.
Если при этом отмечается еще и характерное увеличение глаз – диагноз Базедовой болезни становится очевидным даже для непрофессионала.
Все симптомы Базедовой болезни можно разделить на несколько групп:
- связанные с поражением сердца (появление аритмии, учащение пульса
- тахикардии, дополнительных сокращений сердца
- экстрасистолии, гипертонии); — связанные с поражением эндокринной системы (похудание, чувство жара);
- нарушение состояния кожи (потливость, появление отеков голеней) и ногтей (повышенная ломкость);
- связанные с нарушением работы нервной системы (дрожание рук
- тремор, мышечная слабость, быстрая утомляемость, возбудимость, плаксивость);
- связанные с нарушением работы пищеварительной системы (понос);
- связанные с поражением глаз (эндокринная офтальмопатия
- появление выпячивания глазных яблок наружу, отека тканей вокруг глаза, неполного смыкания век, болей при движении глазных яблок и пр.).
Диагностика Базедовой болезни (диффузного токсического зоба)
Перечень необходимых исследований при подозрении на Базедову болезнь достаточно прост. Первое, что стоит сделать – это анализ крови на гормоны (тиреотропный гормон, свободная фракция гормонов Т4 и Т3) и антитела (антитела к тиреопероксидазе, рецептору ТТГ). Очень желательно одновременно выполнить клинический анализ крови и некоторые биохимические тесты (АЛТ, АСТ, билирубин) – эти данные помогут врачу в планировании лечения, если оно потребуется. При Базедовой болезни отмечается снижение уровня ТТГ до очень низких значений – менее 0,1 мкМЕ/мл и повышение уровня Т3 св. и Т4 св., причем чаще всего достаточно выраженное (как минимум, в 2 раза). Титр антител к ТПО чаще всего повышен. Также повышенным может быть и титр антител к рецептору ТТГ.
Вторая часть обследования – это проведение ультразвукового исследования щитовидной железы. Оно необходимо в том случае, если врач-эндокринолог не проводит УЗИ сам. В тех случаях, когда УЗИ щитовидной железы проводится прямо во время консультации эндокринолога, для обследования достаточно анализа крови.
Базедова болезнь сопровождается изменением структуры щитовидной железы (она становится темной, неоднородно) и нередко – ее увеличением. При допплеровском исследовании отмечается усиление кровотока в ткани щитовидной железы.
Иногда эндокринолог может назначить проведение сканирования щитовидной железы – исследования способности железы захватывать йод, но в подобной процедуре нуждаются далеко не все пациенты (оно применяется при проведении дифференциальной диагностики между диффузным токсическим зобом и аутоиммунным тиреоидитом). При Базедовой болезни захват изотопа резко усилен, а при аутоиммунном тиреоидите – снижен.
Лечение Базедовой болезни (диффузного токсического зоба)
Следует сказать, что Базедова болезнь всегда излечивается, но для лечения могут использоваться различные методы. Традиционным для Европы и России является лечение Базедовой болезни на первом этапе с помощью таблеток. В качестве лекарства используются тиреостатики – препараты, снижающие способность щитовидной железы захватывать йод, без которого невозможно синтезировать гормоны. Наиболее распространенными препаратами для лечения диффузного токсического зоба являются тирозол, мерказолил, пропицил. Препарат и его дозировка подбираются врачом-эндокринологом с учетом особенностей каждого конкретного пациента. Лечение Базедовой болезни таблетками проводится в течение 1,5 лет, после чего его прекращают и определяют уровень гормонов крови на фоне отсутствия какой-либо терапии. У 30-40% пациентов Базедова болезнь после отмены лечения не возвращается – наступает выздоровление. У остальных пациентов вскоре после прекращения приема препаратов уровень гормонов начинает вновь изменяться в худшую сторону, в связи с чем им опять назначается лекарственная терапия. Пациентам, у которых консервативная терапия Базедовой болезни оказалась неэффективной, рекомендуется радикальное лечение – оперативное вмешательство или лечение с использованием радиоактивного йода. Сейчас в России доступны обе методики, причем операции широко проводятся в рамках программы федеральных квот, т.е. бесплатно.
Почему при Базедовой болезни страдают глаза? Поражение глаз при Базедовой болезни называется эндокринной офтальмопатией или офтальмопатией Грейвса. Среди непрофессионалов часто смешиваются понятия «Базедова болезнь» и «эндокринная офтальмопатия» — многие считают, что поражение глаз встречается у всех больных диффузным токсическим зобом, что неверно. Поражение глаз встречается примерно у 30% больных Базедовой болезнью.
Лечение эндокринной офтальмопатии проводится обычно препаратами глюкокортикоидных гормонов (чаще всего – преднизолоном).
-
Операция на щитовидной железе, медиальная тиреоидэктомия
Запись на операцию в Северо-Западный центр эндокринологии и эндокринной хирургии — ведущую специализированную клинику по лечению заболеваний щитовидной железы России и Европы: +7 812 980-77-21, +7 921 189-74-84, +7 921 420-30-31 (будни, с 9 до 17 часов). Мы принимаем на лечение пациентов из всех регионов России, стран ближнего и дальнего зарубежья.
-
Тиреоидит Риделя
Тиреоидит Риделя — редчайшее заболевание, характеризующееся замещением паренхиматозной ткани щитовидной железы соединительной тканью с развитием симптомов сдавления органов шеи
-
Тиреотоксикоз
Тиреотоксикозом (от латинского «glandula thyreoidea» — щитовидная железа и «toxicosis» — отравление) называют синдром, связанный с избыточным поступлением гормонов щитовидной железы в кровь.
-
Подострый тиреоидит (тиреоидит де Кервена)
Подострый тиреоидит является воспалительным заболеванием щитовидной железы, возникающим после перенесенной вирусной инфекции и протекающий с разрушением клеток щитовидной железы. Наиболее часто подострый тиреоидит возникает у женщин. Мужчины болеют подострым тиреоидитом значительно реже женщин – примерно в 5 раз.
-
Классы аппаратов для выполнения УЗИ щитовидной железы
Описание различных классов УЗИ-оборудования, применяемого для проведения УЗИ щитовидной железы
-
Эндокринная офтальмопатия (офтальмопатия Грейвса)
Эндокринная офтальмопатия (офтальмопатия Грейвса) — заболевание позадиглазных тканей и мышц глазного яблока аутоиммунной природы, которое возникает на фоне патологии щитовидной железы и приводит к развитию экзофтальма, или пучеглазия, и комплекса глазных симптомов
-
Диффузный эутиреоидный зоб
Диффузный эутиреоидный зоб — это видимое невооруженным глазом или выявляемое при пальпации общее диффузное увеличение щитовидной железы, характеризующееся сохранением её функции
-
Аутоиммунный тиреоидит (АИТ, тиреоидит Хашимото)
Аутоиммунный тиреоидит (АИТ) — это воспаление ткани щитовидной железы, вызванное аутоиммунными причинами, очень часто встречающееся в России. Болезнь эта была открыта ровно 100 лет назад японским ученым по фамилии Хашимото, и с тех пор носит его имя (тиреоидит Хашимото). В 2012 году мировая эндокринологическая общественность широко отмечала юбилей открытия данного заболевания, поскольку с этого момента у эндокринологов появилась возможность эффективно помогать миллионам пациентов по всей планете.
-
Щитовидная железа. Заболевания щитовидной железы
В настоящее время изучению заболеваний щитовидной железы уделяется настолько серьезное внимание, что был выделен особый раздел эндокринологии — тиреоидология, т.е. наука о щитовидной железе. Врачей, занимающихся диагностикой и лечением заболеваний щитовидной железы, называют тиреоидологами.
-
Гормоны щитовидной железы
Гормоны щитовидной железы делятся на два различных класса: йодитиронины (тироксин, трийодтиронин) и кальцитонин. Из двух этих классов гормонов щитовидной железы тироксин и трийодтиронин регулируют основной обмен организма (тот уровень энергозатрат, который необходим для поддержания жизнедеятельности организма в состоянии полного покоя), а кальцитонин участвует в регуляции обмена кальция и развития костной ткани.
-
Анализы в Санкт-Петербурге
Одним из важнейших этапов диагностического процесса является выполнение лабораторных анализов. Чаще всего пациентам приходится выполнять анализ крови и анализ мочи, однако нередко объектом лабораторного исследования являются и другие биологические материалы.
-
Анализ на гормоны щитовидной железы
Анализ крови на гормоны щитовидной железы — один из наиболее важных в практике работы Северо-Западного центра эндокринологии. В статье Вы найдете всю информацию, с которой необходимо ознакомиться пациентам, собирающимся сдать кровь на гормоны щитовидной железы
-
Консультация эндокринолога онлайн
Если вам необходимо получить консультацию эндокринолога, но возможности очно посетить специалиста нет, то оптимальным решением станет оформление дистанционной консультации.
-
Операции на щитовидной железе
Северо-Западный центр эндокринологии – ведущее учреждение эндокринной хирургии России. В настоящее время в центре ежегодно выполняется более 5000 операций на щитовидной железе, околощитовидных (паращитовидных) железах, надпочечниках. По количеству операций Северо-Западный центр эндокринологии устойчиво занимает первое место в России и входит в тройку ведущих европейских клиник эндокринной хирургии
-
Консультация эндокринолога
Специалисты Северо-Западного центра эндокринологии проводят диагностику и лечение заболеваний органов эндокринной системы. Эндокринологи центра в своей работе базируются на рекомендациях Европейской ассоциации эндокринологов и Американской ассоциации клинических эндокринологов. Современные диагностические и лечебные технологии обеспечивают оптимальный результат лечения.
-
Экспертное УЗИ щитовидной железы
УЗИ щитовидной железы является главным методом, позволяющим оценить строение этого органа. Благодаря своему поверхностному расположению, щитовидная железа легко доступна для проведения УЗИ. Современные ультразвуковые аппараты позволяют осматривать все отделы щитовидной железы, за исключением расположенных за грудиной или трахеей.
-
УЗИ шеи, УЗИ сосудов шеи
Информация об УЗИ шеи — входящие в него исследования, их особенности
-
Консультация хирурга-эндокринолога
Хирург-эндокринолог – врач, специализирующийся на лечении заболеваний органов эндокринной системы, требующих использования хирургических методик (оперативного лечения, малоинвазивных вмешательств)
-
Интраоперационный нейромониторинг
Интраоперационный нейромониторинг — методика контроля электрической активности гортанных нервов, обеспечивающих подвижность голосовых связок, во время операции. При проведении мониторинга хирург имеет возможность каждую секунду оценивать состояние гортанных нервов и соответственно менять план операции. Нейромониторнг позволяет резко снизить вероятность развития нарушения голоса после операций на щитовидной железе и околощитовидных железах.
-
Консультация кардиолога
Врач-кардиолог — основа терапевтической работы центра эндокринологии. Эндокринные заболевания очень часто сочетаются с патологией органов сердечно-сосудистой системы, и опытные врачи-кардиологи помогают центру эндокринологии обеспечивать комплексное лечение пациентов
Дата публикации 8 ноября 2017Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
Диффузный токсический зоб — это аутоиммунное поражение щитовидной железы.
Диффузный токсический зоб впервые был описан в трудах Роберта Джеймса Грейвса и Карла Адольфа фон Базедова в середине ХIХ века. Кроме данного заболевания, тиреотоксикоз может встречаться и при других заболеваниях щитовидной железы (тиреоидит, токсическая аденома и др.), что требует дифференциальной диагностики, так как лечение этих состояний не является однотипным, а осложнения из-за отсутствия или неправильного лечения могут привести к необратимым патологическим изменениям.[1], [2]
В англоязычных странах это заболевание называют болезнью Грейвса, а немецкоязычных — Базедовой болезнью. Диффузный токсический зоб развивается из-за нарушенной функции СД8+-лимфоцитов и выработки антитиреоидных антител, среди которых особое значение придаётся тем, которые имеют сродство к рецепторам тиреотропного гормона в щитовидной железе. Эти антитела выявляются в среднем у 50% пациентов с диффузным токсическим зобом. С этими рецепторами в норме связывается тиреотропный гормон (ТТГ), что стимулирует выработку и выделение тиреоидных гормонов (ТГ). Антитела при связывании с рецепторами ТТГ увеличивают секрецию тироксина (Т4) и трийодтиронина (Т3) «в обход» регуляции ТТГ. Повышенный уровень тиреотропного гормона обуславливает развитие тиреотоксикоза. До конца не ясна причина такого дефекта иммунной системы. Имеются данные, позволяющие говорить о роли генетической предрасположенности, в частности, более широкой распространённости аллелей HLA-B8 и BW-35 у пациентов с этой болезнью.[4] Однако не выявлено какой-то одной аллели, ответственной за болезнь Грейвса. Вероятно, здесь имеет место взаимодействие нескольких аллелей.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы диффузного токсического зоба
Диффузный токсический зоб чаще развивается у женщин моложе тридцати лет.[1] Синдром тиреотоксикоза связан с более интенсивным метаболизмом. Увеличивается частота сердечных сокращений, поднимается артериальное давление. Характерен подъём систолического («верхнего») давления и снижение диастолического, то есть поднимается пульсовое давление, проявляющееся выраженной пульсацией крупных и мелких артерий.[4] Характерно повышенное потоотделение, так как организм старается отдать избыточно вырабатываемое тепло (из-за нарушенной регуляции окислительного фосфорилирования). Стимуляция нервной системы проявляется раздражительностью, тремором рук. Аппетит повышается, однако масса тела снижается из-за ускоренного распада белков в организме. Редко встречается так называемый fat-Базедов-вариант, при котором масса тела увеличивается.[4] Пациенты с ДТЗ часто жалуются на слабость мышц, утомляемость, одышку. Щитовидная железа может быть увеличенной, однако нет зависимости между степенью ее увеличения и тяжестью состояния. В норме объём щитовидной железы у мужчин не превышает 25 см3, а у женщин — 18 см3. Симптомы, как правило, развиваются относительно быстро — за 6-12 мес. В 80% случаев пальпаторно определяется увеличенная, безболезненная щитовидная железа. На раннем этапе болезни пациенты могут обратиться с какой-либо одной из перечисленных жалоб, поэтому врач должен быть хорошо осведомлён о признаках тиреотоксикоза и необходимых диагностических мероприятиях. У бессимптомных пациентов с субклиническим тиреотоксикозом болезнь выявляется случайно, если по каким-либо показаниям сдаётся анализ крови на ТТГ.
При Базедовой болезни могут появляться признаки эндокринной офтальмопатии, возникающей из-за поражения периорбитальной клетчатки: выраженный экзофтальм (не всегда симметричный), диплопия, отечность век, ощущение «инородного тела в глазах». Это сильно облегчает работу врача в плане диагностики, так как среди всех состояний с тиреотоксикозом эндокринная офтальмопатия характерна именно для диффузного токсического зоба. Не следует путать эндокринную офтальмопатию с глазными симптомами тиреотоксикоза, среди которых можно выделить синдром Грефе и синдром Кохера (верхнее веко отстаёт при взгляде вверх и вниз соответственно), синдром Мебиуса (взгляд не фиксируется вблизи), синдром Штельвага (уменьшение частоты морганий). Стоит отметить, что выраженность глазных симптомов не зависит от тяжести дисфункции щитовидной железы.[4]
Некоторые авторы в развитии диффузного токсического зоба выделяют четыре стадии:
- Невротическая (вегетативный невроз и незначительное увеличение или нормальные размеры щитовидной железы);
- Нейрогормональная (увеличенные размеры щитовидной железы и клиническая картина тиреотоксикоза);
- Висцеропатическая (нарушение функции органов);
- Кахектическая (тиреотоксические кризы и общая дистрофия). [4]
Патогенез диффузного токсического зоба
Кроме генетических факторов, есть предположения о роли стресса и инфекции в развитии болезни Грейвса, а также действия токсических веществ.[4] Из-за иммунологических нарушений, происходит инфильтрация щитовидной железы лимфоцитами, выработка антител к различным её компонентам, главным образом — к рецепторам ТТГ, что приводит к стимуляции выработки ТГ и пролиферации тироцитов. Эти антитела также называют тиреостимулирующими иммуноглобулинами. Избыточное действие ТГ в организме приводит к развитию тиреотоксикоза, с признаками которого больные диффузным токсическим зобом обычно обращаются к врачу. [1], [2]
Классификация и стадии развития диффузного токсического зоба
Согласно классификации тиреотоксикоза по Фадееву В.В. и Мельниченко Г.А., выделяется:
- субклинический;
- манифестный;
- осложнённый.
Также существует классификация зоба (патологического увеличения щитовидной железы), в которой выделяется три степени зоба, в зависимости от данных осмотра и пальпации щитовидной железы.
Классификация зоба, рекомендованная ВОЗ (2001)
- 0 cтепень: зоба нет (объём каждой доли не превышает объёма дистальной фаланги большого пальца руки обследуемого);
- I степень: зоб пальпируется, но не виден при нормальном положении шеи, или же имеются узловые образования, не приводящие к увеличению щитовидной железы;
- II степень: зоб чётко виден при нормальном положении шеи. [4], [5]
Патоморфологическая классификация диффузного токсического зоба (три варианта заболевания) опирается на данные гистологического исследования биоптата или удалённой щитовидной железы.[4],[5]
Осложнения диффузного токсического зоба
Развившийся при диффузном токсическом зобе тиреотоксикоз поражает все системы организма. Если надлежащим образом не лечить это заболевание, то оно грозит тяжёлой инвалидизацией, а аритмии и сердечная недостаточность даже могут привести к летальному исходу.
Наиболее опасным осложнением болезни Грейвса является тиреотоксический криз, развитие которого связывают с неблагоприятными факторами (стресс, различные заболевания, выраженная физическая нагрузка, операция и др.). Появляется резкое возбуждение, температура повышается до 40оС, частота сердечных сокращений достигает 200 ударов в минуту, может развиться фибрилляция предсердий, усиливаются явления диспепсии (тошнота, рвот, понос, жажда), повышается пульсовое артериальное давление. Затем могут появиться признаки недостаточности надпочечников (гиперпигментация, нитевидный пульс, нарушение микроциркуляции). Состояние ухудшается за несколько часов. Это ургентная ситуация, требующая неотложных мер, направленных на снижение концентрации ТГ, борьбу с надпочечниковой недостаточностью, дегидратацией, гипертермией, метаболическими нарушениями и недостаточностью кровообращения. В/в вводится гидрокортизон, проводится дезинтоксикационная и тиреостатическая терапия. К осложнениям диффузного токсического зоба также можно отнести осложнения хирургического его лечения: гипопаратиреоз, повреждение n. laryngeus recurrens (при повреждении одного нерва появляется осиплость голоса, при повреждении двух может возникнуть асфиксия), кровотечения, аллергические реакции на препараты. Об осложнениях тиреостатической терапии будет сказано ниже.[5]
Диагностика диффузного токсического зоба
При наличии у пациента признаков тиреотоксикоза ему определяют уровень тиреотропного гормона (ТТГ) высокочувствительным методом (чувс. 0,01 мЕд/л). Если уровень ТТГ меньше нормы, то исследуют концентрацию св. Т4 (тетрайодтиронин, тироксин) и Т3 (трийодтиронин). Существует понятие о так называемом субклиническом тиреотоксикозе, когда уровни Т4 и Т3 оказываются в норме. Среди антител наибольшее клиническое значение имеет уровень антител к рецепторам ТТГ (АТ-рТТГ). Высокие их титры с большой долей вероятности указывают на то, что мы имеем дело именно с болезнью Грейвса. Другие антитела, такие, как антитела к тиреоидной пероксидазе и тиреоглобулину (АТ-ТПО и АТ-ТГ), выявляются и при других состояниях, поэтому имеют значение только в комплексной оценке, и их определение может помочь в некоторых ситуациях.
На УЗИ при болезни Грейвса характерными признаками являются сниженная эхогенность и увеличение объёма (около 80% случаев). При обнаружении очаговых образований, при подозрении на опухолевые, проводится биопсия с цитологическим исследованием. В некоторых ситуациях (дифференциальная диагностика с функциональной автономией, загрудинный зоб) проводится сцинтиграфия щитовидной железы. Дифференциальная диагностика проводится с функциональной автономией щитовидной железы (характерно наличие узлов на УЗИ, «горячих» при сцинтиграфии, отсутствие антител, нет эндокринной офтальмопатии), подострым тиреоидитом (острое начало, боли в щитовидной железе, повышение температуры, связь с перенесённым инфекционным заболеванием), безболевым («молчащим») тиреоидитом (чаще бывает субклинический тиреотоксикоз), послеродовым тиреоидитом (возникает в течение 6 месяцев после родов).[3], [5]
Лечение диффузного токсического зоба
Лечение болезни Грейвса может проводиться эндокринологом или терапевтом. К сожалению, в настоящее время лечение диффузного токсического зоба направлено только на орган-мишень, то есть щитовидную железу, а не на выработку антител, являющуюся непосредственной причиной развития болезни. Даже после удаления щитовидной железы продолжают синтезироваться антитела к рецепторам тиреотропного гормона, хотя тиреотоксикоза уже не возникает (при адекватной заместительной терапии).[9]
Итак, существует три способа лечения диффузного токсического зоба:
- консервативное лечение;
- радиойодтерапия;
- оперативное лечение.
Выбор метода зависит от возраста, сопутствующих заболеваний, степени увеличения щитовидной железы, желания пациента и возможностей лечебного учреждения. Консервативный метод лечения диффузного токсического зоба заключается в назначении тиреостатиков. В некоторых случаях (до 30%) курс такого лечения способен привести к стойкой ремиссии, в некоторых — является подготовкой к использованию другого, более радикального метода (хирургическое лечение или терапия йодом-131). Считается, что консервативная терапия неэффективна при выраженном увеличении щитовидной железы (более 40 см3) и с признаками сдавления окружающих тканей, при наличии крупных узлов в ней, а также при наличии осложнений (фибрилляция предсердий, остеопороз и др.). При рецидиве после курса терапии тиреостатиком, повторный длительный курс не назначается.[5] В подобных случаях проводится курс медикаментозной подготовки к радиойодтерапии или операции.
Важным условием адекватного проведения консервативного лечения является приверженность пациента к лечению и доступность лабораторного контроля. Тиреостатики блокируют синтез тиреоидных гормонов и купируют тиреотоксикоз. По прошествии 4-6 недель тиреостатической терапии, при наступлении эутиреоидного состояния, обычно к лечению добавляют левотироксин.[4] В период тиреотоксикоза (до нормализации Т4) также целесообразно назначение препаратов из группы β-адреноблокаторов: они подавляют тканевое превращение Т4 в Т3, снижают частоту сердечных сокращений. Критерием адекватности лечения является нормальный уровень Т4 и ТТГ. Курс лечения продолжается 12-18 месяцев. Во время лечения необходимо контролировать показатели общего анализа крови. Это необходимо для контроля грозных осложнений тиреостатической терапии — агранулоцитоза и тромбоцитопении, требующих немедленной отмены препаратов. Симптомы агранулоцитоза: лихорадка, боль в горле, жидкий стул.[4] При их появлении пациенту необходимо экстренно сдать кровь на общий анализ и прекратить приём тиреостатиков до получения результатов анализа. Рецидив чаще всего наступает в первые 12 месяцев после завершения курса.
Под хирургическим лечением подразумевается удаление всей или большей части щитовидной железы.[8] Операция проводится только в состоянии эутиреоза. В настоящее время удаление этого органа не является фатальным для человека, так как имеются все возможности адекватной и недорогой заместительной терапии левотироксином. С другой стороны, при оставлении даже небольшого фрагмента железы, сохраняется вероятность рецидива заболевания, это орган-мишень для антитиреоидных антител, выделяемых иммунной системой. Таким образом, послеоперационный гипотиреоз теперь не рассматривается в качестве осложнения операции, а является её целью. Доза левотироксина после операции подбирается индивидуально и обычно составляет 1,7 мкг/кг в сутки.
В России радиойодтерапия мало распространена, что связано с дефицитом йода-131. Противопоказанием к радиойодтерапии является только беременность и период кормления грудью. Даже детский возраст не является помехой к её проведению.[6] Данный метод заключается в приёме внутрь предварительно рассчитанной дозы йода-131, который накапливается в щитовидной железе, распадается в выделением β-частиц, что приводит к лучевой деструкции тироцитов. Радиойодтерапия по сути является нехирургическим методом удаления ткани щитовидной железы.[1], [5], [7]
Прогноз. Профилактика
Прогноз при своевременной диагностике и надлежащем лечении благоприятный. Не рекомендуется приём лекарств, побочным эффектом которых является влияние на выработку тиреоидных гормонов, например амиодарона. Диффузный токсический зоб в большинстве случаев успешно лечится и не является приговором. Благодаря общедоступной и относительно недорогой заместительной терапии, удаётся добиться нормализации метаболических процессов и исчезновения клинических проявлений. Однако осложнения болезни Грейвса способны привести к необратимым патологическим изменениям в организме. Профилактика диффузного токсического зоба у прямых родственников больных чётко не разработана, однако можно рекомендовать отказ от курения, йод-содержащих лекарств, соблюдение оптимального режима дня для минимизации стрессовых ситуаций и регулярный контроль ТТГ. Чёткой связи между поступлением йода с пищей и болезнью Грейвса не выявлено, в регионах с недостаточным содержанием йода диффузный токсический зоб встречается не чаще; в отличие от функциональной автономии, которая в этих областях становится основной причиной тиреотоксикоза.[3],[7]