Кислоты, содержащие хлор
11-Янв-2015 | Нет комментариев | Лолита Окольнова
Кислоты, содержащие хлор
Кислоты-окислители и их соли.
В ЕГЭ по этой теме не очень много спрашивают. Названия кислот и солей надо знать. И некоторые реакции. Я постарался написать в этой статье как можно больше каноничных ЕГЭ-шных реакций. Но на экзамене может попасться и то, чего здесь нет. Поэтому важно для ЕГЭ развить «химическую интуицию», чтобы предсказывать продукты реакций. Если посмотреть на ОВР очень внимательно, то можно вывести основные закономерности. То есть не все сводится к зубрежке, главное понять принцип. А чтобы у себя в голове вывести принцип, нужно прорешать много реакций. Ну и читать наши статьи.
Автор Статьи — Саид Лутфуллин
Вы, наверное, уже знаете, что у хлора очень много кислот. Все кислородсодержащие кислоты хлора и их соли – сильные окислители, и все они нестабильны.
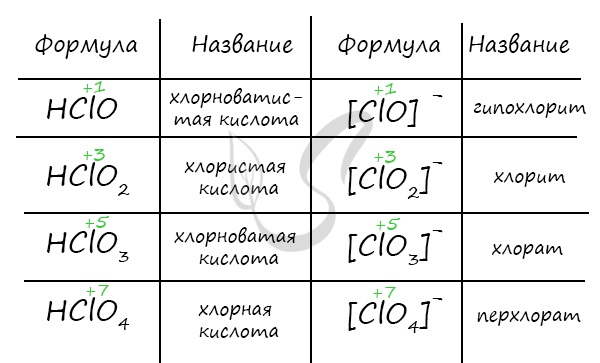
Сила кислот возрастает со степенью окисления:
|
Степень окисления хлора |
Формула кислоты |
Название кислоты |
Сила кислоты |
Название соли |
|
+1 |
HClO |
Хлоноватистая |
Слабая |
Гипохлорит |
|
+3 |
HClO2 |
Хлористая |
Средней силы |
Хлорит |
|
+5 |
HClO3 |
Хлорноватая |
Сильная |
Хлорат |
|
+7 |
HClO4 |
Хлорная |
Очень сильная |
Перхлорат |
Хлорноватистая кислота образуется при пропускании хлора через воду.
При этом происходит диспропорционирование: хлор и окисляется (до +1) и восстанавливается (до +1), образуются хлороводородная (соляная) и хлорноватистая кислоты:
Cl2 + H2O → HCl + HClO
Если хлор пропускать не через воду, а через водный раствор щелочи, то образуются соли этих кислот: хлорид и гипохлорит:
Cl2 + 2KOH → KCl + KClO + H2O
А если хлор пропускать через ГОРЯЧИЙ раствор щелочи, то вместо гипохлорита, будет образовываться хлорат:
3Cl2 + 6KOH (t˚)→ 5KCl + KClO3 + 3H2O
Если полученный раствор остудить, то выпадут в осадок белые кристаллы хлората калия KClO3.
Запомните тривиальное название этой соли: бертолетова соль, а так же этот исторический способ ее получения. Именно этим способом был впервые получен хлорат калия французским ученым Клодом Луи Бертолле (отсюда и название соли).
Бертолетова соль – очень сильный окислитель.
При нагревании бертолетова соль разлагается, опять таки с диспропорционированием хлора. Он восстанавливается (до -1) и окисляется (до +7, дальше ему некуда):
4KClO3 (t˚)→ KCl + 3KClO4
Полученный перхлорат калия тоже не очень стабильный, и тоже разлагается:
KClO4 (t˚)→ KCl + 2O2↑
Хлорноватистая кислота окисляет галогеноводороды (иодоводороды и бромоводороды) до свободных галогенов:
2HI + HClO → I2↓ + HCl + H2O
2HBr + HClO → Br2 + HCl + H2O
Кислоты-окислители хлора окисляют серу в сернистом газе до высшей степени окисления +6 (образуется серная кислота), при этом, в зависимости от условий, хлор восстанавливается до простого вещества (0) или до хлороводорода (-1):
HClO3 + 3SO2 + 3H2O → 3H2SO4 + HCl
И имейте в виду, что некоторые из этих свойств так же могут подойти и для аналогичных кислот брома.
Обсуждение: «Кислоты, содержащие хлор»
(Правила комментирования)
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород
не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее — оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным
элементом.
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к
брому, и к йоду. Так например HBrO — бромноватистая кислота (соли гипобромиты), HIO — иодноватистая кислота (соли гипоиодиты).
HIO3 — иодноватая кислота (соли иодаты), HBrO3 — бромноватая кислота (соли броматы). По аналогии несложно
составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
- Хлорноватистая кислота
- Хлористая кислота
- Хлорноватая кислота
- Хлорная кислота
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
Cl2 + H2O ⇄ HCl + HClO

KClO + H2O + CO2 → KHCO3 + HClO
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Ca(OCl)2 + CO2 + H2O → CaCl2 + CaCO3 + HClO

Хлористая кислота может быть получена из собственных солей — хлоритов, а также в реакции с оксидом хлора IV.
Ba(ClO2)2 + H2SO4 → BaSO4 + HClO2
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
H2SO4 + Ba(ClO3)2 → BaSO4↓ + HClO3
Самая сильная кислота в природе — хлорная кислота — может быть получена реакцией перхлората калия или натрия с концентрированной серной
кислотой.
KClO4 + H2SO4 → K2SO4 + HClO4

Химические свойства
- Кислотные свойства
- Разложение кислот и солей
- Окислительные свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная — к сильным. Кислоты образуют соли в
реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
HClO3 + NaOH → NaClO3 + H2O
HClO4 + KOH → KClO4 + H2O
И кислоты, и их соли разлагаются схожим образом.
HClO → HCl + O2
HClO2 → ClO2 + HClO3 + HCl + O2
KClO2 → (t) KClO3 + KCl
KClO2 → KCl + O2
KClO3 → KCl + O2

NaClO3 → (t) NaCl + NaClO4
NaClO3 → (кат.) NaCl + O2↑
KI + HClO → KIO3 + HCl
P + HClO3 → P2O5 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и
галогеном.
KOH + Cl2 → KCl + KClO + H2O
KOH + Cl2 → (t) KCl + KClO3 + H2O

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Разложение веществ
Материал по химии
- Реакции разложения солей
- Разложение нитратов
- Особые реакции разложения нитратов
- Разложение солей аммония
- Разложение карбонатов
- Разложение гидрокарбонатов
- Разложение гидросульфитов
- Разложение сульфитов
- Разложение сульфатов
- Уравнения реакций разложения комплексных солей
- Реакция разложения дихромата калия и перманганата калия
- Разложение бертолетовой соли
- Разложение гидроксидов
- Разложение органических веществ
- Разложение кислот
Реакции разложения солей
Термическому разложению подвергаются многие соли – карбонаты, нитраты, нитриты, сульфаты, кислые, основные и комплексные соли. Рассмотрим наиболее популярные уравнения разложения солей. Разложение солей часто встречается в ЕГЭ по химии в линии заданий 31, это задание считается одним из самых сложных заданий экзамена.
Разложение нитратов
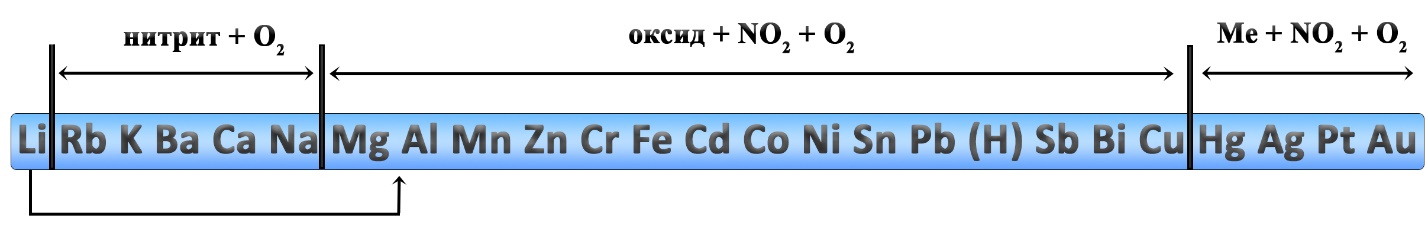
При установлении продуктов термического разложения нитратов удобно пользоваться рядом активности металлов, однако к нему следует добавить некоторые уточнения: литий и магний, обычно относятся к активным металлам, но разложение нитратов этих двух металлов происходит как у металлов средней активности. Медь относится к неактивным металлам, но разложение нитрата меди II идёт как разложение нитрата металла средней активности. Данные реакции являются весьма популярными в химии. На ЕГЭ задачи по разложению нитратов встречаются в заданиях линии 7 и 31.
Уравнения разложения нитратов активных металлов (кроме лития и магния):
- 2KNO3 → 2KNO2 + O2↑ ‒ разложение нитрата калия
- 2NaNO3 → 2NaNO2 + O2↑ ‒ разложение нитрата натрия
- 2CsNO3 → 2CsNO2 + O2↑ ‒ разложение нитрата цезия
- 2RbNO3 → 2RbNO2 + O2↑ ‒ разложение нитрата рубидия
- Ca(NO3)2 → Ca(NO2)2 + O2↑ ‒ разложение нитрата кальция
- Ba(NO3)2 → Ba(NO2)2 + O2↑ ‒ разложение нитрата бария
- Sr(NO3)2 → Sr(NO2)2 + O2↑ ‒ разложение нитрата стронция
Уравнения разложения нитратов металлов средней активности, нитрата лития и нитрата меди II:
- 4LiNO3 → 2Li2O + 4NO2↑ + O2↑ ‒ разложение нитрата лития
- 2Mg(NO3)2 → 2MgO + 4NO2↑ + O2↑ ‒ разложение нитрата магния
- 2Zn(NO3)2 → 2ZnO + 4NO2↑ + O2↑ ‒ разложение нитрата цинка
- 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ ‒ разложение нитрата меди II
- 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата алюминия
- 4Fe(NO3)3 → 2Fe2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата железа III
- 4Cr(NO3)3 → 2Cr2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата хрома III
Во всех приведенных реакциях степень окисления металла не изменяется. Это характерно для нитратов, содержащих металл в высшей или наиболее устойчивой степени окисления. Если же нитрат образован переходным металлом в низшей степени окисления, то при разложении этого нитрата происходит окисление еще и металла.
Особые реакции разложения нитратов
Разложение нитрата железа II:
- 4Fe(NO3)2 → 2Fe2O3 + 8NO2↑ + O2↑
В данной реакции два восстановителя – железа поднимает степень окисления с +2 до +3, кислород с ‒2 до 0. Окислитель – азот +5.
Аналогично идет реакция термического разложения нитрата хрома II:
- 4Cr(NO3)2 → 2Cr2O3 + 8NO2↑ + O2↑
Разложение нитрата марганца II идет иначе, так как для марганца следующей после +2 устойчивой степенью окисления является не +3, а +4:
- Mn(NO3)2 → MnO2 + 2NO2↑
Обратите внимание на то, что кислород в этой реакции не выделяется!
Задание в формате ЕГЭ с ответом:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрат железа II
- нитрат меди II
- нитрат ртути II
- нитрат магния
- нитрат калия
- нитрат серебра
- MeNO2 + O2
- MeO + NO2 + O2
- Me + NO2 + O2
- Me2O3 + NO2 + O2
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- LiNO3
- Cu(NO3)2
- RbNO2
- Zn(NO3)2
- Hg(NO3)2
- Al(NO2)3
- MeNO2 + O2
- MeO + NO2 + O2
- Me + NO2 + O2
- Me2O + NO2 + O2
- Me2O3 + NO2 + O2
Разложение нитрата аммония будет рассмотрено ниже, в реакциях разложения солей аммония.
Разложение солей аммония
При разложении солей аммония чаще всего образуется аммиак, исключения составляют соли, в которых анион проявляет окислительные свойства. Например, хлорид, бромид, йодид, сульфиды, карбонаты и фосфаты разлагаются без изменения степеней окисления (без ОВР). Процессы идут при нагревании:
- NH4Cl → NH3↑ + HCl↑ ‒ разложение хлорида аммония
- NH4Br → NH3↑ + HBr↑ ‒ разложение бромида аммония
- NH4I → NH3↑ + HI↑ ‒ разложение йодида аммония
- (NH4)2S → 2NH3↑ + H2S↑ ‒ разложение сульфида аммония
- NH4HS → NH3↑ + H2S↑ ‒ разложение гидросульфида аммония
- (NH4)3PO4 → 3NH3↑ + H3PO4 ‒ разложение фосфата аммония
- (NH4)2HPO4 → 2NH3↑ + H3PO4 ‒ разложение гидрофосфата аммония
- NH4H2PO4 → NH3↑ + H3PO4 ‒ разложение дигидрофосфата аммония
- (NH4)2CO3 → 2NH3↑ + CO2↑ + H2O↑ ‒ разложение карбоната аммония
- NH4HCO3 → NH3↑ + CO2↑ + H2O↑ ‒ разложение гидрокарбоната аммония
Разложение солей аммония с изменением степени окисления:
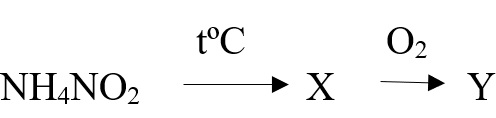
Разложение нитрита и нитрата аммония легко запомнить вместе, отнимите от этих солей всю воду и получите нужный продукт:
- NH4NO3 → 2H2O + N2O ‒ разложение нитрата аммония
- NH4NO2 → 2H2O + N2 ‒ разложение нитрита аммония
Задание по образцу ФИПИ:
Задана следующая схема превращений веществ. Определите, какие из указанных веществ являются веществами X и Y. В ответ запишите соответствующую последовательность цифр без пробелов и дополнительных знаков, сначала вещество Х, затем вещество Y.
- NH3
- NO
- NH4NO3
- N2
- N2O
Азот окисляется до NO
Удобно запоминать вместе и разложение дихромата и перманганата аммония, так как образуются сходные продукты – азот, оксид и соль:
- (NH4)2Cr2O7 → N2↑ + Cr2O3 + 4H2O↑ ‒ разложение дихромата аммония
- 2NH4MnO4 → N2↑ + 2MnO2 + 4H2O↑ ‒ разложение перманганата аммония
Попробуйте решить задание ЕГЭ:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрит аммония
- нитрат аммония
- дихромат аммония
- хлорид аммония
- N2 + Cr2O3 + H2O
- NH3 + Cl2 + H2
- N2 + H2O
- NO2 + Cr2O3 + H2O
- NH3 + HCl
- N2O + H2O
Разложение карбонатов
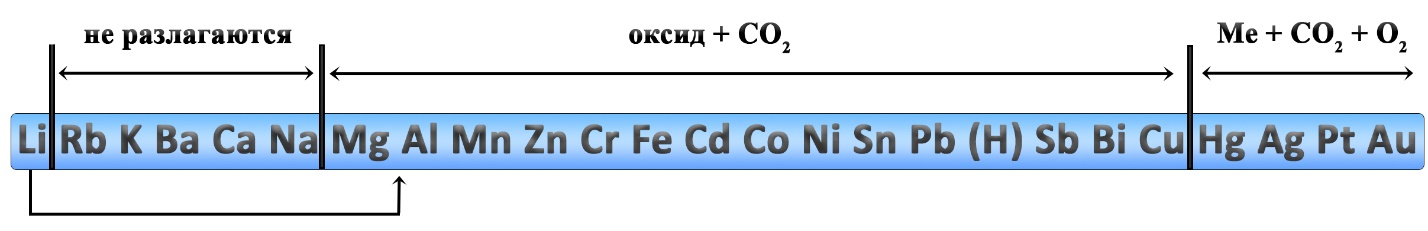
Реакции разложения карбонатов также происходит при нагревании. Карбонаты щелочных металлов (IА-группа), кроме карбоната лития, не разлагаются. Большинство других карбонатов разлагаются до оксидов, карбонат серебра и карбонат ртути разлагаются с выделением свободного металла.
- Li2CO3 → Li2O + CO2↑ ‒ разложение карбоната лития
- MgCO3 → MgO + CO2↑ ‒ разложение карбоната магния
- CaCO3 → CaO + CO2↑ ‒ разложение карбоната кальция
- CuCO3 → CuO + CO2↑ ‒ разложение карбоната меди II
- 2HgCO3 → 2Hg + 2CO2↑ + O2↑ ‒ разложение карбоната ртути II
- 2Ag2CO3 → 4Ag + 2CO2↑ + O2↑ ‒ разложение карбоната серебра
Какие из перечисленных карбонатов разлагаются?
- Na2CO2
- MgCO3
- CaCO3
- K2CO3
- Cs2CO3
- CuCO3
При разложении каких карбонатов образуется оксид металла?
- Na2CO3
- HgCO3
- Li2CO3
- CaCO3
- Ag2CO3
- FeCO3
Разложение гидрокарбонатов
Гидрокарбонаты разлагаются до соответствующих карбонатов:
- 2NaHCO3 → Na2CO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната натрия
- Ca(HCO3)2 → CaCO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната кальция
При длительном нагревании происходит более глубокое разложение (это не качается гидрокарбонатов щелочных металлов, они в любом случае остаются карбонатами).
Например, в некоторых задачах может встретиться следующая фраза «гидрокарбонат нагревали до постоянной массы» или «смесь гидрокарбоната и карбоната нагревали до постоянной массы», какие реакции следует указать?
Если нагревают гидрокарбонат щелочного металла, то реакция одна:
- 2KHCO3 → K2CO3 + CO2↑ + H2O↑
Если нагревают другие гидрокарбонаты, то нужно писать две реакции:
- Ba(HCO3)2 → BaCO3 + CO2↑ + H2O↑ ‒ нагревание
- BaCO3 → BaO + CO2↑ ‒ при продолжении нагревания
Разложение гидросульфитов
Идет сходным с разложением гидрокарбонатов образом, при термическом размножении этих солеи образуются сульфиты и выделяется газ:
- 2KHSO3 → K2SO3 + SO2↑ + H2O↑ ‒ разложение гидросульфита калия
- Ba(HSO3)2 → BaSO3 + SO2↑ + H2O↑ ‒ разложение гидросульфита бария
Разложение сульфитов
В отличие от реакция термического разложения карбонатов, большинство сульфитов разлагаются при нагревании со сменой степени окисления (происходит реакция самоокисления-самовосстановления или диспропорционирования). При нагревании сульфита образуется смесь сульфидов и сульфатов:
- 4Na2SO3 → 3Na2SO4 + Na2S ‒ термическое разложение сульфита натрия
- 4CaSO3 → 3CaSO4 + CaS ‒ термическое разложение сульфита кальция
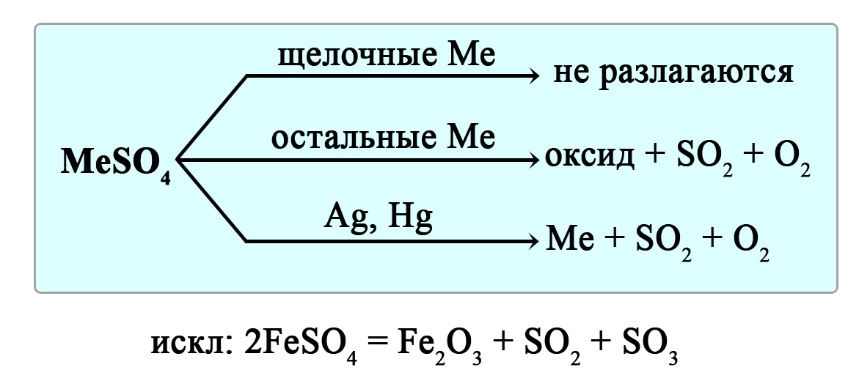
Разложение сульфатов
Сульфаты щелочных металлов не разлагаются при нагревании. Сульфаты серебра и ртути разлагаются до свободного металла, сульфаты остальных металлов разлагаются до оксида металла, сернистого газа и кислорода.
Уравнения реакция разложения сульфатов:
- 2CaSO4 → 2CaO + 2SO2↑ + O2↑ ‒ реакция разложения сульфата кальция
- Ag2SO4 → 2Ag + 2SO2↑ + O2↑ ‒ реакция разложения сульфата серебра
Уравнения реакций разложения комплексных солей
При нагревании комплексные соли теряют воду, превращаясь в средние соли, степени окисления при этом не изменяются:
- Na[Al(OH)4] → NaAlO2 + 2H2O↑ ‒ разложение тетрагидроксоалюмината натрия
- K2[Zn(OH)4] → K2ZnO2 + 2H2O↑ ‒ разложение тетрагидроксоцинката калия
- Ca[Be(OH)4] → CaBeO2 + 2H2O↑ ‒ разложение тетрагидроксобериллата кальция
- Ba[Al(OH)4]2 → Ba(AlO2)2 + 4H2O↑ ‒ разложение тетрагидроксоалюмината бария
Реакция разложения дихромата калия и перманганата калия
На ЕГЭ по химии реакции разложения дихромата калия и перманганата калия часто встречаются в заданиях линии 29 и 31.Эти две реакции похожи, поэтому их удобно запоминать сразу парой:
- 4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3O2↑ ‒ уравнение термического разложения дихромата калия
- 2KMnO4 → K2MnO4 + MnO2 + O2↑ ‒ уравнение термического разложение перманганата калия
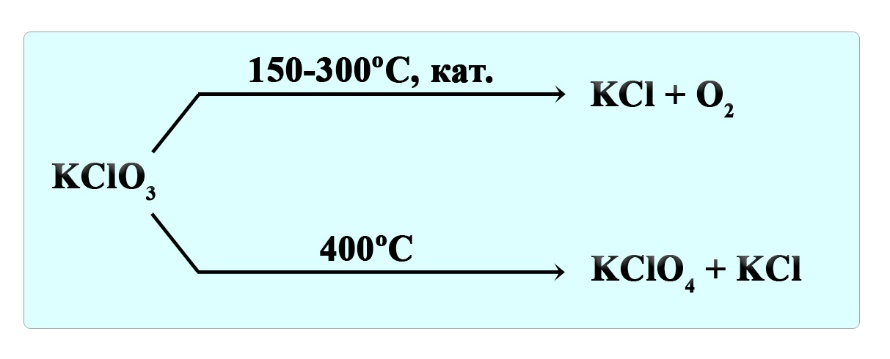
Разложение бертолетовой соли
Бертолетова соль или хлорат калия разлагается на разные продукты в зависимости от условий. При нагревании до 150-300ºС в присутствие катализатора образуется хлорид калия и кислород:
- 2KClO3 → 2KCl + 3O2↑
Сходным образом разлагается перхлорат калия:
- KClO4 → KCl + 2O2↑
При температуре 400ºС бертолетова соль разлагается на перхлорат калия и хлорид калия:
- 4KClO3 → 3KClO4 + KCl
Флэш-карточки с разложением солей. Перед Вами лицевая сторона карточки с формулой соли, попробуйте вспомнить основные продукты разложения этой соли и нажмите на карточку, чтобы проверить реакцию:
-
-
-
KClO3 (400 градусов)
KClO4 + KCl
-
-
K2Cr2O7
K2CrO4 + Cr2O3 + O2
-
-
-
(NH4)2Cr2O7
N2 + Cr2O3 + H2O
-
-
Разложение гидроксидов
Еще одна популярная тема в разложении веществ – термическое разложение гидроксидов. Большинство нерастворимых гидроксидов неустойчивы, разлагаются на оксид и воду. При этом степень окисления металла не меняется. Растворимые гидроксиды (щелочи) не разлагаются, за исключением неустойчивого гидроксида аммония (который не является щелочью).
- 2Al(OH)3 → Al2O3 + 3H2O ‒ разложение гидроксида алюминия
- Zn(OH)2 → ZnO + H2O ‒ разложение гидроксида цинка
- Cu(OH)2 → CuO + H2O ‒ разложение гидроксида меди II
- 2Fe(OH)3 → Fe2O3 + 3H2O ‒ разложение гидроксида железа III
- NH4OH → NH3↑ + H2O или NH3·H2O → NH3↑ + H2O ‒ разложение гидроксида аммония
Разложение органических веществ
Сходным образом происходит и разложение органических веществ – гидроксидов метиламмония, диметиламмония, триметиламмония и некоторых других.
- [CH3-NH3]OH → CH3-NH2↑ + H2O ‒ разложение гидроксида метиламмония
- [(CH3)2-NH2]OH → (CH3)2-NH↑ + H2O ‒ разложение гидроксида диметиламмония
- [(CH3)3-NH]OH → (CH3)3-N↑ + H2O ‒ разложение гидроксида триметиламмония
Разложение кислот
Неустойчивыми кислотами являются угольная, сернистая кислота и азотистая кислота, они разлагаются даже при небольшом нагревании:
- H2CO3 → CO2↑ + H2O ‒ разложение угольной кислоты
- H2SO3 → SO2↑ + H2O ‒ разложение сернистой кислоты
- 2HNO2 → NO↑ + NO2↑ + H2O ‒ разложение азотистой кислоты без нагревания
- 3HNO2 → HNO3 + 2NO↑ + H2O – разложение азотистой кислоты при нагревании
Разложение остальных кислот требует нагревания:
- 4HNO3 → 4NO2 + O2↑ + 2H2O ‒ разложение азотной кислоты
- H2SiO3 → SiO2 + H2O – разложение кремниевой кислоты
Тематический тест на химию водорода и галогенов.
Задание №1
Из предложенного списка простых веществ выберите те, которые являются газами при обычных условиях. Число верных ответов может быть любым.
1) йод
2) хлор
3) фтор
4) бром
5) водород
Решение
Ответ: 235
Задание №2
Из предложенного списка простых веществ выберите те, которые являются твердыми при обычных условиях. Число верных ответов может быть любым.
1) водород
2) хлор
3) йод
4) фтор
5) бром
Решение
Ответ: 3
Задание №3
Из предложенного списка простых веществ выберите те, которые не являются газами при обычных условиях. Число верных ответов может быть любым.
1) бром
2) водород
3) фтор
4) йод
5) хлор
Решение
Ответ: 14
Задание №4
Из предложенного списка соединений выберите те, в которых атомы водорода находятся в низшей степени окисления. Число верных ответов может быть любым.
- 1. NaHCO3
- 2. KHS
- 3. CaH2
- 4. Fe(OH)SO4
- 5. NH3
Решение
Ответ: 3
Задание №5
Из предложенного списка соединений выберите те, в которых атомы водорода находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. LiNH2
- 2. NaH
- 3. BaH2
- 4. RbHS
- 5. NH4Cl
Решение
Ответ: 145
Задание №6
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. KClO
- 2. Mg(ClO4)2
- 3. NaBrO3
- 4. KIO4
- 5. Cl2O5
Решение
Ответ: 24
Задание №7
Из предложенного списка соединений выберите те, в которых атомы галогенов не находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. Ca(ClO4)2
- 2. HBrO3
- 3. NF3
- 4. NH4Cl
- 5. I2O5
Решение
Ответ: 2345
Задание №8
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления +1. Число верных ответов может быть любым.
- 1. NF3
- 2. PBr3
- 3. Ca(ClO)Cl
- 4. HClO2
- 5. S2Cl2
Решение
Ответ: 3
Задание №9
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления +5. Число верных ответов может быть любым.
- 1. PCl5
- 2. KClO3
- 3. FeCl2
- 4. KBrO3
- 5. I2O5
Решение
Ответ: 245
Задание №10
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления -1. Число верных ответов может быть любым.
- 1. NH4I
- 2. Cl2
- 3. BF3
- 4. S2Br2
- 5. Ca(ClO)Cl
Решение
Ответ: 1345
[adsp-pro-3]
Задание №11
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. Al2O3
- 2. FeO
- 3. MgO
- 4. NiO
- 5. Na2O
Решение
Ответ: 24
Задание №12
Из предложенного списка оксидов выберите два, с которыми не может взаимодействовать водород.
- 1. CuO
- 2. Fe2O3
- 3. Cu2O
- 4. Cs2O
- 5. SO2
Решение
Ответ: 45
Задание №13
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. P2O5
- 2. MgO
- 3. Li2O
- 4. ZnO
- 5. Fe3O4
Решение
Ответ: 45
Задание №14
Из предложенного списка оксидов выберите два, с которыми не может взаимодействовать водород.
- 1. PbO
- 2. H2O
- 3. BaO
- 4. ZnO
- 5. FeO
Решение
Ответ: 23
Задание №15
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. CO
- 2. CaO
- 3. SrO
- 4. Rb2O
- 5. Cu2O
Решение
Ответ: 15
Задание №16
Из предложенного списка веществ выберите два, с которыми может взаимодействовать водород.
1) хлор
2) железо
3) вода
4) литий
5) ртуть
Решение
Ответ: 14
Задание №17
Из предложенного списка веществ выберите два, с которыми может взаимодействовать фтор.
1) фторид серы(VI)
2) хлорид фосфора(V)
3) фтороводород
4) бромоводород
5) фторид алюминия
Решение
Ответ: 24
Задание №18
Из предложенного списка веществ выберите два, с которыми может взаимодействовать хлор.
1) хлорид серебра
2) азот
3) хлорид железа(II)
4) сероводород
5) хлорид магния
Решение
Ответ: 34
Задание №19
Из предложенного списка веществ выберите два, с которыми может взаимодействовать бром.
1) азот
2) едкое кали
3) азотная кислота
4) бромид железа(III)
5) фосфор
Решение
Ответ: 25
Задание №20
Из предложенного списка веществ выберите два, с которыми может взаимодействовать йод.
1) бромоводород
2) гашеная известь
3) песок
4) едкий натр
5) аргон
Решение
Ответ: 24
[adsp-pro-3]
Задание №21
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать водород.
1) оксид натрия
2) оксид цинка
3) оксид меди(II)
4) оксид бария
5) оксид хрома(II)
Решение
Ответ: 14
Задание №22
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать хлор.
1) алмаз
2) водород
3) хлорид меди(I)
4) кислород
5) бромоводород
Решение
Ответ: 14
Задание №23
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать бром.
1) алюминий
2) оксид цинка
3) гидроксид рубидия
4) фосфор
5) кислород
Решение
Ответ: 25
Задание №24
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать йод.
1) бромид калия
2) йодид меди(I)
3) йодид хрома(II)
4) водород
5) едкое кали
Решение
Ответ: 12
Задание №25
Из предложенного списка веществ выберите два, с которыми может взаимодействовать хлор.
1) нитрат меди
2) серная кислота
3) азотная кислота
4) сероводородная кислота
5) йодоводородная кислота
Решение
Ответ: 45
Задание №26
Из предложенного списка веществ выберите два, с которыми может взаимодействовать водород.
1) литий
2) платина
3) ртуть
4) цезий
5) песок
Решение
Ответ: 14
Задание №27
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать хлор.
1) бромид цинка
2) йодид никеля
3) хлорид фосфора(III)
4) фторид натрия
5) бертолетова соль
Решение
Ответ: 45
Задание №28
Из предложенного списка веществ выберите два, с которыми может взаимодействовать бром.
1) сера
2) оксид азота(IV)
3) негашеная известь
4) вода
5) неон
Решение
Ответ: 14
Задание №29
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать йод.
1) сульфат магния
2) гидроксид цезия
3) фосфат натрия
4) гидроксид стронция
5) едкий натр
Решение
Ответ: 13
Задание №30
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать водород.
1) железная окалина
2) поташ
3) негашеная известь
4) сажа
5) угарный газ
Решение
Ответ: 23
[adsp-pro-3]
Задание №31
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид алюминия + бром
2) нитрат магния + хлор
3) бромид свинца(II) + хлор
4) фторид калия + сера
5) бромид цинка + йод
Решение
Ответ: PbBr2 + Cl2 = PbCl2 + Br2
Задание №32
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) бертолетова соль + бромат калия
2) поваренная соль + нитрат серебра
3) йод + кислород
4) хлорид фосфора(III) + йод
5) хлорид натрия + бром
Решение
Ответ: NaCl + AgNO3 = AgCl + NaNO3
Задание №33
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлор + кислород
2) бром + азот
3) литий + водород
4) йод + кислород
5) водород + песок
Решение
Ответ: 2Li + H2 = 2LiH
Задание №34
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) гидроксид алюминия + водород
2) гидроксид натрия + кислород
3) гидроксид калия + поваренная соль
4) гидроксид цезия + йод
5) гидроксид лития + азот
Решение
Ответ: 6CsOH + 3I2 = 5CsI + CsIO3 + 3H2O
Задание №35
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) серная кислота + хлор
2) азотная кислота + водород
3) фосфорная кислота + бром
4) сероводородная кислота + бром
5) плавиковая кислота + бром
Решение
Ответ: H2S + Br2 = 2HBr + S
Задание №36
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) соляная кислота + сульфид меди(II)
2) плавиковая кислота + фторид серебра
3) бромоводородная кислота + гашеная известь
4) йодоводородная кислота + медь
5) хлороводородная кислота + серебро
Решение
Ответ: Ca(OH)2 + 2HBr = CaBr2 + 2H2O
Задание №37
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид натрия + фосфор
2) бромид калия + сера
3) фторид лития + цинк
4) хлорат калия + сера
5) бромат калия + бром
Решение
Ответ: 2KClO3 + 3S = 2KCl + 3SO2
Задание №38
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид фосфора(III) + хлор
2) бромид кремния(IV) + бром
3) йодид железа(II) + йод
4) хлорид натрия + бром
5) бромид цинка + йод
Решение
Ответ: PCl3 + Cl2 = PCl5
Задание №39
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид натрия + вода
2) бромид калия + вода
3) гидрид лития + вода
4) иодид серебра + вода
5) хлорид цезия + вода
Решение
Ответ: LiH + H2O = LiOH + H2
Задание №40
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) алмаз + бром
2) азот + хлор
3) аргон + йод
4) фосфор + йод
5) железо + водород
Решение
Ответ: 2P + 3I2 = 2PI3
[adsp-pro-3]
Задание №41
В заданной схеме превращений
CuSO4 CuI
Y
Веществами X и Y являются соответственно
1) хлорид меди(I)
2) йодид свинца
3) хлороводород
4) хлорид меди(II)
5) йодид натрия
Решение
Ответ: 54
Задание №42
В заданной схеме превращений
MnO2 X
KClO3
Веществами X и Y являются соответственно
1) хлорид марганца(IV)
2) калий
3) едкое кали
4) оксид калия
5) хлор
Решение
Ответ: 53
Задание №43
В заданной схеме превращений
X Br2
Y
Веществами X и Y являются соответственно
1) бромат калия
2) нитрат калия
3) бромид фосфора(V)
4) фосфор
5) бромид натрия
Решение
Ответ: 53
Задание №44
В заданной схеме превращений
X Y
X
Веществами X и Y являются соответственно
1) бромид калия
2) бром
3) бромоводород
4) бромат калия
5) бертолетова соль
Решение
Ответ: 24
Задание №45
В заданной схеме превращений
KClO3 X
Y
Веществами X и Y являются соответственно
1) перхлорат калия
2) кислород
3) оксид хлора(V)
4) хлорид калия
5) хлор
Решение
Ответ: 45
Задание №46
В заданной схеме превращений
Fe3O4 Fe
FeCl2
Веществами X и Y являются соответственно
1) хлороводород
2) водород
3) хлор
4) хлорид натрия
5) хлорат калия
Решение
Ответ: 21
Задание №47
В заданной схеме превращений
X Y
CuBr2
Веществами X и Y являются соответственно
1) йодид калия
2) йодид стронция
3) йод
4) йодид меди(I)
5) йодид меди(II)
Решение
Ответ: 34
Задание №48
В заданной схеме превращений
KOH X
P2O5
Веществами X и Y являются соответственно
1) бертолетова соль
2) поваренная соль
3) фосфорная кислота
4) фосфор
5) кислород
Решение
Ответ: 14
Задание №49
В заданной схеме превращений
AgF KF
HF
Веществами X и Y являются соответственно
1) нитрат калия
2) йодид калия
3) азотная кислота
4) кремниевая кислота
5) водород
Решение
Ответ: 23
Задание №50
В заданной схеме превращений
KI X
NaIO3
Веществами X и Y являются соответственно
1) кислород
2) едкий натр
3) углекислый газ
4) йод
5) йодоводород
Решение
Ответ: 42
[adsp-pro-3]
Задание №51
Запишите уравнение взаимодействия между водородом и цезием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Cs + H2 = 2CsH
Задание №52
Запишите уравнение взаимодействия между водородом и кальцием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Ca + H2 = CaH2
Задание №53
Запишите уравнение взаимодействия между водородом и хлором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2 + Cl2 = 2HCl
Задание №54
Запишите уравнение взаимодействия между водородом и оксидом железа(III). В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Fe2O3 + 3H2 = 2Fe + 3H2O
Задание №55
Запишите уравнение взаимодействия между водородом и оксидом меди(I). В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Cu2O + H2 = 2Cu + H2O
Задание №56
Запишите уравнение взаимодействия между фтором и кремнием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Si + 2F2 = SiF4
Задание №57
Запишите уравнение взаимодействия между избытком хлора и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 5Cl2 = 2PCl5
Задание №58
Запишите уравнение взаимодействия между недостатком хлора и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 3Cl2 = 2PCl3
Задание №59
Запишите уравнение взаимодействия между хлором и железом. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Fe + 3Cl2 = 2FeCl3
Задание №60
Запишите уравнение взаимодействия между хлором и медными опилками. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Cu + Cl2 = CuCl2
[adsp-pro-3]
Задание №61
Запишите уравнение взаимодействия между хлором и холодным раствором едкого натра. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaOH + Cl2 = NaCl + NaClO + H2O
Задание №62
Запишите уравнение взаимодействия между хлором и горячим раствором гидроксида цезия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 6CsOH + 3Cl2 = 5CsCl + CsClO3 + 3H2O
Задание №63
Запишите уравнение взаимодействия между бромом и алюминием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Al + 3Br2 = 2AlBr3
Задание №64
Запишите уравнение взаимодействия между избытком брома и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 5Br2 = 2PBr5
Задание №65
Запишите уравнение взаимодействия между бромом и горячим раствором гашеной извести.
Решение
Ответ: 6Ca(OH)2 + 6Br2 = 5CaBr2 + Ca(BrO3)2 + 6H2O
Задание №66
Запишите уравнение взаимодействия между бромом и йодидом алюминия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2AlI3 + 3Br2 = 2AlBr3 + 3I2
Задание №67
Запишите уравнение взаимодействия между хлором и раствором сероводорода. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
Задание №68
Запишите уравнение взаимодействия между бромом и раствором сероводорода. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2S + Br2 = S + 2HBr
Задание №69
Запишите уравнение взаимодействия между йодом и медью. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Cu + I2 = 2CuI
Задание №70
Запишите уравнение взаимодействия между избытком йода и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 3I2 = 2PI3
[adsp-pro-3]
Задание №71
Запишите уравнение взаимодействия между бертолетовой солью и избытком концентрированной соляной кислоты.
Решение
Ответ: KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
Задание №72
Запишите уравнение взаимодействия между бертолетовой солью и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 5KClO3 + 6P = 5KCl + 3P2O5
Задание №73
Запишите уравнение каталитического разложения хлората натрия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaClO3 = 2NaCl + 3O2
Задание №74
Запишите уравнение термического разложения бертолетовой соли. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 4KClO3 = KCl + 3KClO4
Задание №75
Запишите уравнение взаимодействия между хлоратом калия, оксидом хрома(III) и едким кали при сплавлении. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: KClO3 + Cr2O3 + 4KOH = KCl + 2K2CrO4 + 2H2O
Задание №76
Запишите уравнение взаимодействия между перманганатом калия и концентрированной соляной кислотой. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Задание №77
Запишите уравнение взаимодействия между оксидом марганца(IV) и бромоводородной кислотой. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: MnO2 + 4HBr = MnBr2 + Br2 + 2H2O
Задание №78
Запишите уравнение взаимодействия между дихроматом калия и концентрированной соляной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2 + 7H2O
Задание №79
Запишите уравнение взаимодействия между перекисью водорода и йодидом калия в присутствии серной кислоты. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KI + H2O2 + H2SO4 = K2SO4 + I2 + 2H2O
Задание №80
Запишите уравнение взаимодействия между йодидом калия и раствором медного купороса. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 4KI + 2CuSO4 = 2K2SO4 + 2CuI + I2
[adsp-pro-3]
Задание №81
Запишите уравнение взаимодействия между йодидом натрия и раствором хлорного железа. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaI + 2FeCl3 = 2FeCl2 + I2 + 2NaCl
Задание №82
Запишите уравнение взаимодействия между твердой поваренной солью и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaCl + H2SO4 = Na2SO4 + 2HCl
или
NaCl + H2SO4 = NaHSO4 + HCl
Задание №83
Запишите уравнение взаимодействия между твердым бромидом калия и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KBr + 2H2SO4 = K2SO4 + SO2 + Br2 + 2H2O
Задание №84
Запишите уравнение взаимодействия между твердым йодидом калия и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 8KI + 5H2SO4 → 4K2SO4 + H2S + 4I2 + 4H2O
Задание №85
Запишите уравнение взаимодействия кварцевого песка и избытка плавиковой кислоты. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: SiO2 + 4HF = SiF4 + 2H2O
Задание №86
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) водород Б) хлор В) негашеная известь |
1) калий, фосфор, вода 2) стронций, сера, кислород 3) цинк, натрий, ксенон 4) соляная кислота, вода, углекислый газ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 214
Задание №87
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) плавиковая кислота Б) соляная кислота В) азотная кислота |
1) едкий натр, медь, сера 2) гидроксид цезия, нитрат серебра, оксид алюминия 3) гидроксид рубидия, оксид свинца(II), кварц 4) гашеная известь, азот, фосфорная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 321
Задание №88
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) поваренная соль Б) бертолетова соль В) бром |
1) фосфор, азот, вода 2) нитрат серебра, серная кислота (конц.), фтор 3) сера, графит, соляная кислота 4) железо, водород, вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 234
Задание №89
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) гидрид кальция Б) фторид серебра В) йодид лития |
1) хлор, вода, бром 2) фосфат калия, хлор, бром 3) соляная кислота, нитрат бария, медь 4) вода, аргон, хлор |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №90
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) бромид лития Б) йодид калия В) фторид аммония |
1) нитрат магния, едкое кали, гашеная известь 2) нитрат свинца, фторид серебра, сульфат меди 3) нитрат калия, сульфат алюминия, цинк 4) нитрат серебра, хлор, фосфат натрия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 421
[adsp-pro-3]
Задание №91
Рассчитайте суммарный объем газов (н.у.), которые выделятся при полном разложении смеси 12,6 г дихромата аммония и 24,5 г бертолетовой соли в присутствии катализатора. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 7,84
Пояснение:
Запишем уравнения реакций:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O (I)
2KClO3 = 2KCl + 3O2 (II)
ν((NH4)2Cr2O7) = m/M = 12,6 / 252 = 0,05 моль
Исходя из уравнения реакции (I):
ν(N2) = ν((NH4)2Cr2O7) = 0,05 моль
ν(KClO3) = m/M = 24,5 / 122,5 = 0,2 моль
Исходя из уравнения реакции (II):
ν(O2) = 3⋅ν(KClO3)/2 = 3⋅0,2/2 = 0,3 моль
Рассчитаем суммарное количество молей азота и кислорода:
ν(N2+O2) = ν(N2) + ν(O2) = 0,05 моль + 0,3 моль = 0,35 моль
Тогда,
V(N2+O2) = ν(N2+O2) ⋅ Vm = 0,35⋅22,4 = 7,84 л
Задание №92
Вычислите массу воды, необходимую для реакции с 21 г гидрида кальция. Ответ приведите в граммах и округлите до целых.
Решение
Ответ: 18
Задание №93
Определите массовую долю хлорида калия в растворе, полученном при пропускании 2,24 л хлора через 280 г горячего 20%-ного раствора едкого кали. Ответ приведите в процентах и округлите до десятых.
Решение
Ответ: 4,3
Задание №94
Навеску йода массой 12,7 г смешали с 28 г железных опилок и нагревали до прекращения реакции. Полученную смесь обработали 300 мл воды, осадок отделили. Вычислите массовую долю вещества в полученном растворе. Ответ приведите в процентах и округлите до сотых.
Решение
Ответ: 4,91
Пояснение:
Йод, в отличие от других галогенов окисляет железо до степени окисления +2. То есть протекает реакция:
Fe + I2 = FeI2
ν(I2) = m/M = 12,7/254 = 0,05 моль
ν(Fe) = m/M = 28/56 = 0,5 моль
В избытке железо, поэтому считаем количество продукта (йодида железа) по йоду:
ν(FeI2) = ν(I2) = 0,05 моль
Йодид железа не реагирует с водой, а просто растворяется в ней. Поэтому осадок в условии задачи – это просто непрореагировавшее железо.
Таким образом, после добавления воды мы просто получаем водный раствор йодида железа (II).
Рассчитаем массу йодида железа (II):
m(FeI2) = ν ⋅ M = 0,05 ⋅ 310 = 15,5 г
Тогда, масса полученного раствора будет равна:
mр-ра(FeI2) = m(FeI2) + m(H2O) = 15,5 г + 300 г = 315,5 г,
а массовая доля йодида железа будет составлять:
ω(FeI2) = 100 ⋅ m(FeI2) /mр-ра(FeI2) = 100% ⋅ 15,5/315,5 = 4,91 %
Задание №95
Навеску бертолетовой соли обработали избытком концентрированной соляной кислоты. Объем выделившегося газа составил 6,72 л. Рассчитайте объем кислорода, который можно получить при каталитическом разложении такой же навески исходного вещества. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 3,36
Задание №96
Навеску бертолетовой соли массой 2,45 г полностью разложили в присутствии катализатора. Полученный твердый остаток смешали с 100 г 8,5% раствора нитрата серебра. Определите суммарную массовую долю солей в полученном растворе. Ответ приведите в процентах и округлите до сотых.
Решение
Ответ: 7,22
Задание №97
Навеску смеси железных и алюминиевых опилок массой 8,3 г нагревали в токе хлора до прекращения реакции. Полученный твердый остаток растворили в воде и обработали избытком раствора питьевой соды. Рассчитайте объем выделившегося газа, если массовая доля алюминия в исходной смеси равна 32,53. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 13,44
Задание №98
При взаимодействии навески оксида меди(II) и избытка водорода при нагревании образовался твердый остаток. Данное вещество нагревали в токе хлора, полученный продукт растворили в 100 мл воды. При пропускании в раствор сероводорода выпало 9,6 г осадка. Определите массовую долю кислоты в растворе над осадком. Ответ приведите в процентах и округлите до десятых.
Решение
Ответ: 6,8
Задание №99
Вычислите объем хлора, необходимый для полного окисления 100 мл 5%-ного раствора сульфида натрия (плотность 1,05 г/см3). Ответ приведите в литрах и округлите до целых.
Решение
Ответ: 6
Задание №100
Рассчитайте массу простого вещества, образующегося при взаимодействии 160 г 10% раствора сульфата меди и 200 мл 20% раствора йодида калия (плотность 1,15 г/см3). Ответ приведите в граммах и округлите до десятых.
Решение
Ответ: 12,7
[adsp-pro-10]
Задания
Версия для печати и копирования в MS Word
Установите соответствие между названием вещества и его формулой.
НАЗВАНИЕ ВЕЩЕСТВА
А) хлорная известь
Б) бертолетова соль
В) железный купорос
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
В данном задании представлены тривиальные названия веществ, которые ученику стоит просто запомнить.
1. Дисульфид железа (II) имеет название пирит.
2. Семиводный кристаллогидрат сульфата железа — это железный купорос.
3. Хлорат калия — это бертолетова соль.
4. — это хлорная известь.
Ответ: 432.
Гидролиз солей — это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Катионы сильных оснований и анионы сильных кислот существуют в растворе в виде ионов и в реакцию с молекулами воды не вступают. Вступают в реакцию катионы слабых оснований и анионы слабых кислот. В результате реакции образуется слабый электролит и ионы H+ или ОН— . Эти ионы и определяют кислотность водного раствора соли. Мы представляем соль продуктом реакции кислоты и основания и смотрим из чего образована соль.
Возможные 4 варианта:
- сильная кислота + слабое основание — гидролиз по катиону — кислая среда
- сильное основание + слабая кислота — гидролиз по аниону — щелочная среда
- слабое основание + слабая кислота — гидролиз по катиону и аниону. А вот тут все зависит от того, что же из слабых слабее, кислота или основание. «Слабее» означает — что этот ион будет лучше реагировать с молекулами воды и лучше образовывать слабый электролит (слабое основание или кислоту). А значит давать больше ионов H+ или ОН—.
- сильное основание + сильная кислота — гидролизу не подвергается — нейтральная среда
A) фторид аммония NH4F
Соль образована слабым основанием NH4OH и слабой плавиковой кислотой (фтороводородной) HF.
Гидролизуется и по катиону, и по аниону; (напишем уравнения гидролиза):
NHX4X++HOH→NHX4OH+HX+ce{NH4+ + HOH -> NH4OH + H+}
FX−+HOH→HF+OHX−ce{F- + HOH -> HF + OH-}
Б) фосфат цезия Cs3PO4
Соль образована сильным основанием CsOH и слабой ортофосфорной кислотой H3PO4.
Гидролиз по аниону; (напишем уравнение только для первой стадии гидролиза):
POX4X3−+HOH→HPOX4X2−+OHX−ce{PO4^3- + HOH -> HPO4^2- + OH-}
B) бертолетова соль KClO3
Данная соль образована сильным основанием KOH и сильной хлорноватой кислотой HClO3.
Гидролизу не подвергается.
Г) сульфат марганца (II) MnSO4
Соль образована слабым основанием Mn(OH)2 и сильной серной кислотой H2SO4.
Гидролизуется по катиону; (напишем уравнение только для первой стадии гидролиза):
MnX2++HOH→MnOHX++HX+ce{Mn^2+ + HOH -> MnOH+ + H+}