Задания переводного экзамена по химии в 8 классе
Вариант 2
1. Знак Cl имеет химический элемент:
|
А) хром |
В) медь |
|
Б) хлор |
Г) кальций |
2. Число протонов в ядре фосфора:
3. Неметаллом является:
|
А) бром |
В) барий |
|
Б) калий |
Г) железо |
4. Немолекулярное строение у вещества:
|
А) водород |
В) кислород |
|
Б) вода |
Г) медь |
5. Раствором является:
|
А) вода с глиной |
В) вода с речным песком |
|
Б) морская вода |
Г) дистиллированная вода |
6. К химическим явлениям относится:
|
А) плавление льда |
В) ковка металлов |
|
Б) испарение воды |
Г) сгорание угля |
7. К сложным веществам относится:
|
А) кислород |
В) хлороводород |
|
Б) сера |
Г) алмаз |
8. Условная запись состава вещества — это
|
А) химический символ |
В) химическое уравнение |
|
Б) химическая формула |
Г) химический знак |
9. Вокруг ядра атома движутся
|
А) протоны |
В) электроны |
|
Б) нейтроны |
Г) протоны и электроны |
10. В состав сульфидов обязательно входит химический элемент
|
А) кислород |
В) хлор |
|
Б) водород |
Г) сера |
11. Переменную валентность, равную IV, имеет
|
А) углерод |
В) фосфор |
|
Б) кислород |
Г) водород |
12. Для разделения воды и поваренной соли надо использовать
|
А) выпаривание |
В) фильтрование |
|
Б) отстаивание |
Г) кристаллизацию |
13. Метану соответствует химическая формула
14. В химической реакции 2H2O 2H2 + O2 происходит
|
А) соединение |
В) обмен |
|
Б) замещение |
Г) разложение |
15. Обозначение Ar имеет
|
А) объем вещества |
В) относительная атомная масса |
|
Б) масса вещества |
Г) относительная молекулярная масса |
16. Молярный объем газа имеет значение
|
А) 22,4 г/моль |
В) 18 л/моль |
|
Б) 22,4 л/моль |
Г) 6,02 *1023 моль-1 |
17. Относительная атомная масса хлора равна
18. Относительная молекулярная масса воды равна
19. К химическим приборам относится
|
А) пробирка |
В) химический стакан |
|
Б) колба |
Г) пробирконагреватель |
20. В химической лаборатории разрешается
|
А) употреблять пищу |
В) сливать растворы в раковину |
|
Б) хранить ядовитые вещества |
Г) использовать битую посуду |
21. Указать название химического вещества:
MgCl2 _________________________
22. Провести соответствие между химическими формулами и классами веществами:
|
А) гидроксид натрия |
1) оксиды |
|
Б) карбонат алюминия |
2) основания |
|
В) оксид цинка |
3) кислоты |
|
Г) азотная кислота |
4) соли |
23. Провести соответствие между химическими уравнениями и типами реакций:
|
А) Сu(OH)2 СuO + H2О |
1) обмен |
|
Б) H2 + Cl2 2HCl |
2) замещение |
|
В) Fe + CuSO4 FeSO4 + Cu |
3) разложение |
|
Г) KOH + HCl KCl + H2O |
4) соединение |
24. Закончить схемы химических реакций:
|
А) Al + О2 |
|
Б) К + Cl2 |
25. Решить задачу:
Вычислить объем водорода, вступающего в реакцию с 6 г углерода.
Дано: Решение.
С + 2H2 СН4
Ответ:
Экзаменационную работу по химии за 20__-20__ учебный год
выполнил__ учени___ 8 класса
______________________________________________
Количество набранных баллов: ___________
Оценка: ____________
Экзаменующий учитель: ______________
Ассистент: ________________
Примерный план экзаменационной работы для учащихся 8 класса по химии
Проверяемые элементы содержания
Атомы химических элементов.
Закономерности Периодической системы
Типы химических связей. Степень окисления
Соединения химических элементов
Типы химических реакций. Изменения
происходящие с веществами
Растворение. Растворы. Свойства растворов
электролитов
Химические свойства классов
неорганических соединений
Количественные отношения в химии
Закономерности периодической системы
Химические свойства классов химических
соединений
Окислительно—восстановительные реакции
Химические свойства классов
неорганических соединений
Химические свойства веществ
Количественные отношения в химии (задачи)
Обозначения типов задания:
ВО— с выбором ответа
КО— с кратким ответом
РО— с развернутым ответом
Оценивание заданий и работы в целом
Верное выполнение каждого задания части 1 работы оценивается одним
баллом. Задания с выбором ответа считается выполненным, если учащимся
указан код правильного ответа. Во всех остальных случаях (выбран другой
ответ; выбрано два или более ответа, среди которых может быть и
правильный; ответ на вопрос отсутствует) задание считается невыполненным.
Учащийся получает 0 баллов.
Задание с кратким ответом на установление соответствия или на
множественный выбор считается выполненным верно, если из шести
предлагаемых ответов учащийся выбирает 3 правильных. В других случаях
(выбран один правильный ответ; среди двух выбранных ответов один
неправильный; выбрано более двух ответов, вреди которых один правильный)
выполнение задания оценивается 1 баллом. Если же среди выбранных ответов
нет ни одного правильного, задание считается невыполненным. Учащийся
получает 0 баллов.
Каждое из двух заданий с развернутым ответом предусматривает
проверку усвоения трех элементов содержания (устанавливать взаимосвязи
между понятиями и фактами, самостоятельно и осознанно использовать знания
при ответе, использовать дополнительные знания при ответе). Следовательно,
выполнение задания с развернутым ответом оценивается 3,2,1 и 0 баллами.
Экзаменационная оценка ученика по пятибалльной шкале определяется
на основе суммарного числа баллов, полученных за выполнения задания:
«5» 25-30 баллов
«4» 19-24 баллов
«3» 10-18 баллов
«2» 1-9 баллов
Организация и проведение промежуточной аттестации
Время выполнения работы: Примерное время, отводимое на выполнение
отдельных заданий, составляется для каждого задания:
Части 1— 1-2 минуты
Части 2— 2-3 минуты
Части 3— до 5 минут
Общая продолжительность работы 60—70 минут
Экзаменационная работа по химии 8 класс
Демонстрационная версия
Инструкция:
Работа состоит из 3 частей
1 часть— тестовая (с выбором одного правильного ответа), состоящая из
16 вопросов. Правильный ответ оценивается 1 баллом
2 часть— задания на соответствие, состоящая из 4 вопросов. Полностью
правильный ответ оценивается 2 баллами, 2 из 4—ых соответствий
оцениваются 1 баллом.
3 часть— задание со свободным ответом, состоящая из 2 вопросов.
Полностью правильный ответ оценивается 3 баллами
ЧАСТЬ 1
Внимательно прочитай вопрос и предложенные к нему варианты
ответов и выбери только один правильный.
Внимательно прочитай задание выбери один правильный ответ и
перенеси в бланк ответов, обметив его «крестиком»
соответствующим правильному ответу
А 1. Число нейтронов в ядре атома марганца равно
1) 45 2) 55 3) 30 4) 25
А 2. Основные свойства оксидов в ряду: Al
2
O
3
→ MgO → Na
2
O
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
А 3. В хлориде натрия химическая связь
1) ковалентная полярная 2) ковалентная неполярная
3) ионная 4) металлическая
А 4. Степень окисления —3 азот имеет в соединении
1) N
2
O
3
2) KNO
3
3) NaNO
2
4) NH
4
NO
3
А 5. К основному оксиду относится
1) CO
2
2) Р
2
О
5
3) SiО
2
4) Na
2
O
А 6. Признаком реакции между сульфатом меди (II) и гидроксидом
калия является
1) выделение газа 2) изменение цвета раствора
3) выпадение осадка 4) появление запаха.
А 7. Серная кислота вступает в реакцию замещения с
1) серебром
2) гидроксидом натрия
3) хлороводородной кислотой
4) магнием
А 8. Реакция ионного обмена возможна между:
1) гидроксидом натрия и хлоридом железа (III)
2) железом и соляной кислотой
3) кальцием и водой
4) оксидом магния и водой
А 9. Электролитом является
1) оксид цинка
2) сахар
3) этиловый спирт
4) хлороводородная кислота
А 10. Наибольшее число ионов образуется при полной диссоциации
1) FeCl
2
2) FeCl
3
3) Fe (NO
3
)
2
4) Fe
2
(SO
4
)
3
А 11. Соляная кислота не способна взаимодействовать:
1) гидроксидом калия
2) оксидом цинка
3) оксидом углерода (IV)
4) силикат натрия
А 12. Са(ОН)
2
может про взаимодействовать с каждым из двух
веществ:
1) НСl и СuО
2) Н
2
SО
4
и СО
2
3) НNО
3
и Н
2
О
4) O
2
и Nа
2
О
А 13. Какие из пар оксидов могут про взаимодействовать:
1) СuО и СаО 2) SiО
2
, и Н
2
О 3) СаО и Н
2
О 4) SО
2
и СО
2
А 14. Какие из всех солей ряда относятся к кислым:
1) К
2
SO
4
, СаНSO
4
, СаОНСl
2) КНSО
3
, СаНSO
4
, ВаНРО
4
3) KNO
3
, ВаНРО
4
, К
3
РО
4
4) NaCl, КНSО
3
, FеСl
3
.
А 15. Смесь воды и бензина можно разделить с помощью
1) перегонки 2) фильтрования
3) выпаривания 4) делительной воронки
А16. Массовая доля серы в сульфите натрия равна
1) 25,4% 2) 36,5% 3) 50,0% 4) 28,6%
ЧАСТЬ 2
Внимательно прочитай вопрос и варианты ответов и выбери только
правильные 2 ответа
В1. В ряду химических элементов Rb → K → Na → Li
1) увеличивается число электронов во внешнем слое
2) ослабевают металлические свойства
3) увеличивается радиус атомов
4) уменьшается число протонов в ядре
5) увеличиваются заряды ядер атомов
В2. Натрий вступает в реакцию с
1) водой
2) раствором соляной кислоты
3) алюминием
4) хлором
5) оксидом кальция
В3. Выберите уравнения реакций, которые относятся к
окислительно—восстановительным:
1) 2NO + 4CuO = N
2
+ 2Cu
2
O
2) NаОН + НСl = NаСl + Н
2
О
3) СuСl
2
+ 2LiОН = 2LiСl + Сu(ОН)
2
4) N
2
+ 3Ca = Ca
3
N
2
5) NH
4
Сl + КОН = NН
3
+ Н
2
O + КСl
В задании В4 на установление соответствия запишите в таблицу
цифры выбранных вами ответов. Получившуюся
последовательность цифр запишите в строку ответа.
В4. Установите соответствие между исходными веществами и
продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) CаО + H
2
SО
4
→ 1) → Са(NО
3
)
2
+ АgСl
Б) Са + H
2
SО
4
→ 2) → СаSО
4
+Н
2
В) СаСl
2
+ АgNО
3
3) → СаSО
4
4) → СаSО
4
+Н
2
О
Ответ: _________________ .
ЧАСТЬ 3
С1. Напишите уравнения реакций, с помощью которых можно
осуществить следующие превращения:
Ва → ВаО → ВаСl
2
→ ВаSО
4
С2. К 100 г 48% — ного раствора сульфата меди (II) прилили избыток
раствора фосфата натрия. Определите массу выпавшего осадка.
Экзаменационная работа по химии 8 класс
Вариант 1
Инструкция:
Работа состоит из 3 частей
1 часть— тестовая (с выбором одного правильного ответа), состоящая из
16 вопросов. Правильный ответ оценивается 1 баллом
2 часть— задания на соответствие, состоящая из 4 вопросов. Полностью
правильный ответ оценивается 2 баллами, 2 из 4—ых соответствий
оцениваются 1 баллом.
3 часть— задание со свободным ответом, состоящая из 2 вопросов.
Полностью правильный ответ оценивается 3 баллами
ЧАСТЬ 1
Внимательно прочитай вопрос и предложенные к нему варианты
ответов и выбери только один правильный.
Внимательно прочитай задание выбери один правильный ответ и
перенеси в бланк ответов, обметив его «крестиком»
соответствующим правильному ответу
А 1. Число протонов в ядре атома ванадия равно
1) 51 2) 50 3) 23 4) 28
А 2. Основные свойства оксидов в ряду: Na
2
O→ MgO → Al
2
O
3
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
А 3. В оксиде кремния химическая связь
1) ковалентная полярная 2) ковалентная неполярная
3) ионная 4) металлическая
А 4. Степень окисления +5 азот имеет в соединении
1) N
2
O
3
2) KNO
3
3) NaNO
2
4) NH
4
NO
2
А 5. К кислотному оксиду относится
1) CаO 2) Р
2
О
5
3) К
2
О 4) Na
2
O
А 6. Признаком реакции между силикатом натрия и соляной
кислотой является
1) выделение газа 2) изменение цвета раствора
3) выпадение осадка 4) появление запаха.
А 7. Соляная кислота вступает в реакцию замещения с
1) железом
2) серебром
3) хлороводородной кислотой
4) гидроксидом натрия
А 8. Реакция ионного обмена возможна между:
1) кальцием и водой
2) железом и соляной кислотой
3) карбонатом натрия и серной кислотой
4) оксидом магния и водой
А 9. Электролитом является
1) оксид железа (III)
2) натрий
3) этиловый спирт
4) фосфорная кислота
А 10. Наибольшее число ионов образуется при полной диссоциации
1) FeCl
2
2) FeCl
3
3) Fe (NO
3
)
2
4) Fe
2
(SO
4
)
3
А 11. Фосфорная кислота не способна взаимодействовать:
1) оксидом цинка
2) гидроксидом натрия
3) оксидом серы (IV)
4) хлоридом бария
А 12. Ва(ОН)
2
может про взаимодействовать с каждым из двух
веществ:
1) НСl и СuО
2) O
2
и Nа
2
О
3) НNО
3
и Н
2
О
4) Н
2
SО
4
и СО
2
А 13. Какие из пар оксидов могут провзаимодействовать при
обычных условиях:
1) ВаО и СаО 2) SО
2
, и Н
2
О 3) МgО и Н
2
О 4) SiО
2
и СО
2
А 14. Какие из всех солей ряда относятся к основным:
1) КНSО
3
, СаНSO
4
, ВаНРО
4
2) KNO
3
, ВаНРО
4
, К
3
РО
4
3) NaCl, КНSО
3
, FеСl
3
.
4) (ВаОН)
2
SO
4
, (МgОН)NО
3
, СаОНСl
А 15. Смесь воды и песка можно разделить с помощью
1) перегонки 2) фильтрования
3) выпаривания 4) делительной воронки
А16. Массовая доля азота в нитрате натрия равна
1) 25,4% 2) 36,5% 3) 16,5% 4) 28,6%
ЧАСТЬ 2
Внимательно прочитай вопрос и варианты ответов и выбери только
правильные 2 ответа
В1. В ряду химических элементов Li → Na → K → Rb
1) увеличивается число электронов во внешнем слое
2) ослабевают металлические свойства
3) увеличивается радиус атомов
4) уменьшается число протонов в ядре
5) увеличиваются заряды ядер атомов
В2. Оксид серы (VI) вступает в реакцию с
1) водой
2) раствором соляной кислоты
3) алюминием
4) хлором
5) оксидом кальция
В3. Выберите уравнения реакций, которые относятся к
окислительно—восстановительным:
1) NаОН + НСl = NаСl + Н
2
О
2) NH
4
Сl + КОН = NН
3
+ Н
2
O + КСl
3) 2N
2
O + C = 2N
2
+ CO
2
4) СuСl
2
+ 2LiОН = 2LiСl + Сu(ОН)
2
5) 4NH
3
+ 5O
2
= 4NO + 6H
2
O
В задании В4 на установление соответствия запишите в таблицу
цифры выбранных вами ответов. Получившуюся
последовательность цифр запишите в строку ответа.
В4. Установите соответствие между исходными веществами и
продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) CаО + H
2
SО
4
→ 1) → Са(NО
3
)
2
+ АgСl
Б) Са + H
2
SО
4
→ 2) → СаSО
4
+Н
2
В) СаСl
2
+ АgNО
3
3) → СаSО
4
4) → СаSО
4
+Н
2
О
ЧАСТЬ 3
С1. Напишите уравнения реакций, с помощью которых можно
осуществить следующие превращения:
Р → Р
2
О
5
→ Н
3
РО
4
→ Са
3
(РО
4
)
2
С2. К 100 г 50% — ного раствора гидроксида бария прилили избыток
раствора серной кислоты. Определите массу выпавшего осадка.
Экзаменационная работа по химии 8 класс
Вариант 2
Инструкция:
Работа состоит из 3 частей
1 часть— тестовая (с выбором одного правильного ответа), состоящая из
16 вопросов. Правильный ответ оценивается 1 баллом
2 часть— задания на соответствие, состоящая из 4 вопросов. Полностью
правильный ответ оценивается 2 баллами, 2 из 4—ых соответствий
оцениваются 1 баллом.
3 часть— задание со свободным ответом, состоящая из 2 вопросов.
Полностью правильный ответ оценивается 3 баллами
ЧАСТЬ 1
Внимательно прочитай вопрос и предложенные к нему варианты
ответов и выбери только один правильный.
Внимательно прочитай задание выбери один правильный ответ и
перенеси в бланк ответов, обметив его «крестиком»
соответствующим правильному ответу
А 1. Число электронов в ядре атома железа равно
1) 26 2) 55 3) 56 4) 30
А 2. Кислотные свойства оксидов в ряду: SiO
2
→ Р
2
O
5
→ SO
3
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
А 3. В оксиде алюминия химическая связь
1) ковалентная полярная 2) ковалентная неполярная
3) ионная 4) металлическая
А 4. Степень окисления +3 азот имеет в соединении
1) N
2
O
3
2) KNO
3
3) NaNO
3
4) NH
4
NO
3
А 5. К основному оксиду относится
1) CO
2
2) Р
2
О
5
3) SiО
2
4) Na
2
O
А 6. Признаком реакции между карбонатом натрия и соляной
кислотой является
1) выделение газа 2) изменение цвета раствора
3) выпадение осадка 4) появление запаха.
А 7. Серная кислота вступает в реакцию замещения с
1) серебром
2) гидроксидом натрия
3) хлороводородной кислотой
4) магнием
А 8. Реакция ионного обмена возможна между:
1) гидроксидом натрия и хлоридом железа (III)
2) железом и соляной кислотой
3) кальцием и водой
4) оксидом магния и водой
А9. Электролитом не является
1) серная кислота
2) сахар
3) гидроксид натрия
4) хлороводородная кислота
А 10. Наименьшее число ионов образуется при полной диссоциации
1) FeCl
2
2) FeCl
3
3) Fe (NO
3
)
3
4) Fe
2
(SO
4
)
3
А 11. Соляная кислота способна взаимодействовать:
1) гидроксидом калия
2) оксидом серы (IV)
3) оксидом углерода (IV)
4) серной кислотой
А 12. Са(ОН)
2
может про взаимодействовать с каждым из двух
веществ:
1) НСl и СuО
2) Н
2
SО
4
и СО
2
3) НNО
3
и Н
2
О
4) O
2
и Nа
2
О
А 13. Какие из пар оксидов могут про взаимодействовать:
1) СuО и СаО 2) SiО
2
, и Н
2
О 3) СаО и Н
2
О 4) SО
2
и СО
2
А 14. Какие из всех солей ряда относятся к средним:
1) К
2
SO
4
, СаНSO
4
, СаОНСl
2) КНSО
3
, СаНSO
4
, ВаНРО
4
3) KNO
3
, ВаНРО
4
, К
3
РО
4
4) NaCl, К
2
SО
3
, FеСl
3
.
А 15. Смесь железа и песка можно разделить с помощью
1) перегонки 2) фильтрования
3) выпаривания 4) действия магнита
А16. Массовая доля кислорода в оксиде алюминия равна
1) 25,4% 2) 36,5% 3) 50,0% 4) 47,0%
ЧАСТЬ 2
Внимательно прочитай вопрос и варианты ответов и выбери только
правильные 2 ответа
В1. В ряду химических элементов Сl → Вr → I → Аt
1) увеличивается число электронов во внешнем слое
2) ослабевают неметаллические свойства
3) увеличивается радиус атомов
4) уменьшается число протонов в ядре
5) уменьшаются заряды ядер атомов
В2. Оксид калия вступает в реакцию с
1) водой
2) соляной кислотой
3) алюминием
4) хлором
5) оксидом кальция
В3. Выберите уравнения реакций, которые относятся к
окислительно—восстановительным:
1) 2NO + 4CuO = N
2
+ 2Cu
2
O
2) NаОН + НСl = NаСl + Н
2
О
3) СuСl
2
+ 2LiОН = 2LiСl + Сu(ОН)
2
4) N
2
+ 3Ca = Ca
3
N
2
5) NH
4
Сl + КОН = NН
3
+ Н
2
O + КСl
В задании В4 на установление соответствия запишите в таблицу
цифры выбранных вами ответов. Получившуюся
последовательность цифр запишите в строку ответа.
В4. Установите соответствие между исходными веществами и
продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) ВаО + SО
3
→ 1) → Ва(NО
3
)
2
+ АgСl
Б) Ва(ОН)
2
+ H
2
SО
4
→ 2) → ВаSО
4
+Н
2
В) ВаСl
2
+ АgNО
3
3) → ВаSО
4
4) → ВаSО
4
+Н
2
О
ЧАСТЬ 3
С1. Напишите уравнения реакций, с помощью которых можно
осуществить следующие превращения:
Сu → СuО → СuСl
2
→ Сu(ОН)
2
С2. К 50 г 20% — ного раствора гидроксида натрия прилили избыток
раствора сульфата меди (II). Определите массу выпавшего осадка.
Экзаменационная работа по химии 8 класс
Вариант 3
Инструкция:
Работа состоит из 3 частей
1 часть— тестовая (с выбором одного правильного ответа), состоящая из
16 вопросов. Правильный ответ оценивается 1 баллом
2 часть— задания на соответствие, состоящая из 4 вопросов. Полностью
правильный ответ оценивается 2 баллами, 2 из 4—ых соответствий
оцениваются 1 баллом.
3 часть— задание со свободным ответом, состоящая из 2 вопросов.
Полностью правильный ответ оценивается 3 баллами
ЧАСТЬ 1
Внимательно прочитай вопрос и предложенные к нему варианты
ответов и выбери только один правильный.
Внимательно прочитай задание выбери один правильный ответ и
перенеси в бланк ответов, обметив его «крестиком»
соответствующим правильному ответу
А 1. Число протонов в ядре атома алюминия равно
1) 13 2) 14 3) 27 4) 26
А 2. Кислотные свойства оксидов в ряду: СO
2
→ SiO
2
→ GeO
2
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
А 3. В молекуле хлора химическая связь
1) ковалентная полярная 2) ковалентная неполярная
3) ионная 4) металлическая
А 4. Степень окисления +7 хлор имеет в соединении
1) НСlO 2) НСlO
2
3) НСlO
3
4) НСlO
4
А 5. К кислотному оксиду относится
1) CO 2) СО
2
3) Nа
2
O 4) N
2
O
А 6. Признаком реакции между сульфидом натрия и соляной
кислотой является
1) выделение газа 2) изменение цвета раствора
3) выпадение осадка 4) появление запаха.
А 7. Азотная кислота вступает в реакцию нейтрализации с
1) серебром
2) гидроксидом натрия
3) хлороводородной кислотой
4) магнием
А 8. Реакция ионного обмена возможна между:
1) цинком и серной кислотой
2) натрий и водой
3) гидроксидом калия и хлоридом меди (II)
4) оксидом магния и водой
А 9. Электролитом является
1) оксид железа (III)
2) кальций
3) этиловый спирт
4) серная кислота
А 10. Наименьшее число ионов образуется при полной диссоциации
1) Na
2
SO
4
2) NaNO
3
3) Na
3
PO
4
4) Na
2
SiO
3
А 11. Гидроксид натрия не способен взаимодействовать:
1) оксидом серы
2) оксидом углерода (IV)
3) гидроксидом калия
4) сульфат меди (II)
А 12. НСl может про взаимодействовать с каждым из двух веществ:
1) НNO
3
и СuО
2) Н
2
SО
4
и СО
2
3) AgNО
3
и NaOH
4) O
2
и Nа
2
О
А 13. Какие из пар оксидов могут про взаимодействовать:
1) СuО и СаО 2) SiО
2
, и Н
2
О 3) SiО
2
и СО 4) K
2
О и Н
2
О
А 14. Какие из всех солей ряда относятся к основным:
1) NaCl, КНSО
3
, FеСl
3
.
2) (МgОН)
2
SО
3
, (СаОН)
2
SO
4
, (ВаОН)
3
РО
4
3) KNO
3
, ВаНРО
4
, К
3
РО
4
4) К
2
SO
4
, СаНSO
4
, СаОНСl
А 15. Смесь воды и масла можно разделить с помощью
1) перегонки 2) фильтрования
3) выпаривания 4) делительной воронки
А16. Массовая доля кислорода в фосфате натрия равна
1) 49% 2) 39% 3) 59% 4) 29%
ЧАСТЬ 2
Внимательно прочитай вопрос и варианты ответов и выбери только
правильные 2 ответа
В1. В ряду химических элементов F → Cl → Br → I
1) увеличивается число электронов во внешнем слое
2) ослабевают металлические свойства
3) увеличивается радиус атомов
4) уменьшается число протонов в ядре
5) увеличиваются заряды ядер атомов
В2. Оксид натрия вступает в реакцию с
1) оксидом кальция
2) раствором соляной кислоты
3) алюминием
4) хлором
5) водой
В3. Выберите уравнения реакций, которые относятся к
окислительно—восстановительным:
1) N
2
+ 3Ca = Ca
3
N
2
2) NH
4
Сl + КОН = NН
3
+ Н
2
O + КСl
3) NаОН + НСl = NаСl + Н
2
О
4) 2NO + 4CuO = N
2
+ 2Cu
2
O
5) СuСl
2
+ 2LiОН = 2LiСl + Сu(ОН)
2
В задании В4 на установление соответствия запишите в таблицу
цифры выбранных вами ответов. Получившуюся
последовательность цифр запишите в строку ответа.
В4. Установите соответствие между исходными веществами и
продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) SO
3
+ NaOH
→ 1) → H
2
SO
4
+ H
2
O
Б) S + О
2
→ 2) → Na
2
SO
4
+Н
2
В) SO
3
+ H
2
O →
3) → Nа
2
SО
4
+ H
2
O
4) → SO
2
5) → H
2
SO
4
ЧАСТЬ 3
С1. Напишите уравнения реакций, с помощью которых можно
осуществить следующие превращения:
Li → Li
2
O → LiOH → Li
3
PO
4
С2. К раствору карбоната калия массой 110,4 г и массовой долей 5%
прилили избыток раствора нитрата кальция. Вычислите массу образо—
вавшегося осадка
.
Экзаменационная работа по химии 8 класс
Вариант 4
Инструкция:
Работа состоит из 3 частей
1 часть— тестовая (с выбором одного правильного ответа), состоящая из
16 вопросов. Правильный ответ оценивается 1 баллом
2 часть— задания на соответствие, состоящая из 4 вопросов. Полностью
правильный ответ оценивается 2 баллами, 2 из 4—ых соответствий
оцениваются 1 баллом.
3 часть— задание со свободным ответом, состоящая из 2 вопросов.
Полностью правильный ответ оценивается 3 баллами
ЧАСТЬ 1
Внимательно прочитай вопрос и предложенные к нему варианты
ответов и выбери только один правильный.
Внимательно прочитай задание выбери один правильный ответ и
перенеси в бланк ответов, обметив его «крестиком»
соответствующим правильному ответу
А 1. Число электронов в атоме хлора равно
1) 17 2) 19 3) 35 4) 18
А 2. Основные свойства оксидов в ряду: МgO → CaO → BaO
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
А 3. В молекуле хлороводорода химическая связь
1) ковалентная полярная 2) ковалентная неполярная
3) ионная 4) металлическая
А 4. Степень окисления +6 сера имеет в соединении
1) Н
2
SO
3
2) SO
3
3) SO
2
4) H
2
S
А 5. К основному оксиду относится
1) CO 2) СаО
3) NO 4) N
2
O
А 6. Признаком реакции между сульфидом натрия и хлоридом
свинца (II) является
1) выделение газа 2) изменение цвета раствора
3) выпадение осадка 4) появление запаха.
А 7. Оксид калия вступает в реакцию присоединения с
1) серной кислотой
2) водой
3) хлороводородной кислотой
4) магнием
А 8. Реакция ионного обмена возможна между:
1) соляной кислотой и алюминием
2) хлорид алюминия и гидроксидом натрия
3) серой и кислородом
4) оксидом кальция и водой
А 9. Неэлектролитом является
1) хлорид натрия (раствор)
2) гидроксид кальция (раствор)
3) этиловый спирт
4) серная кислота
А 10. Наибольшее число ионов образуется при полной диссоциации
1) Na
2
SO
4
2) NaNO
3
3) Na
3
PO
4
4) Na
2
SiO
3
А 11. Соляная кислота не способна взаимодействовать:
1) оксидом натрия
2) оксидом углерода (IV)
3) гидроксидом калия
4) нитратом серебра
А 12. NaOH может про взаимодействовать с каждым из двух
веществ:
1) НNO
3
и СuО
2) O
2
и Nа
2
О
3) КNО
3
и КOH
4) Н
2
SО
4
и СО
2
А 13. Какие из пар оксидов могут про взаимодействовать:
1) Na
2
O и СаО 2) SО
2
и Н
2
О 3) SiО
2
и СО 4) CuО и Н
2
О
А 14. Какие из всех солей ряда относятся к средним:
1) NaCl, К
2
SО
3
, FеСl
3
2) KNO
3
, ВаНРО
4
, К
3
РО
4
3) (МgОН)
2
SО
3
, (СаОН)
2
SO
4
, (ВаОН)
3
РО
4
4) К
2
SO
4
, СаНSO
4
, СаОНСl
А 15. Смесь воды и чернил можно разделить с помощью
1) перегонки 2) фильтрования
3) выпаривания 4) делительной воронки
А16. Массовая доля калия в гидроксиде калия равна
1) 69,6% 2) 79,4% 3) 59,4% 4) 29,4%
ЧАСТЬ 2
Внимательно прочитай вопрос и варианты ответов и выбери только
правильные 2 ответа
В1. В ряду химических элементов С → N → O → F
1) увеличивается число электронов во внешнем слое
2) ослабевают неметаллические свойства
3) увеличивается радиус атомов
4) уменьшается число протонов в ядре
5) увеличиваются заряды ядер атомов
В2. Оксид серы (IV) вступает в реакцию с
1) оксидом кальция
2) раствором соляной кислоты
3) алюминием
4) хлором
5) водой
В3. Выберите уравнения реакций, которые относятся к
окислительно—восстановительным:
1) СuСl
2
+ 2LiОН = 2LiСl + Сu(ОН)
2
2)NН
3
+ CuO = N
2
+ Cu + Н
2
О
3) NаОН + НСl = NаСl + Н
2
О
4) NH
4
Сl + КОН = NН
3
+ Н
2
O + КСl
5) N
2
+ Н
2
= NН
3
В задании В4 на установление соответствия запишите в таблицу
цифры выбранных вами ответов. Получившуюся
последовательность цифр запишите в строку ответа.
В4. Установите соответствие между исходными веществами и
продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) NaOH +НСl
→ 1) → NaOH
Б) Na + Cl
2
→ 2) → NaOH +Н
2
В) Na
2
O + H
2
O →
3) → NaCl +Н
2
O
4) → NaCl
5) → NaCl + H
2
ЧАСТЬ 3
С1. Напишите уравнения реакций, с помощью которых можно
осуществить следующие превращения:
Si → SiO
2
→ Na
2
SiO
3
→ H
2
SiO
3
С2. Через 40 г раствора с массовой долей гидроксида натрия 8% пропу—
стили оксид серы (IV). При этом образовался сульфит натрия. Вычисли—
те объём (н. у.) вступившего в реакцию газа.
.
Бланк ответов для промежуточной аттестации по химии
Фамилия учащегося
Бланк ответов для промежуточной аттестации по химии
Фамилия учащегося
ЧАСТЬ 3
С1
1. 4Р+ 5О
2
=2Р
2
О
5
2. Р
2
О
5
+ 3Н
2
О= 2Н
3
РО
4
3. 2Н
3
РО
4
+ 2Са(ОН)
2
= Са
3
(РО
4
)
2
+ Н
2
О
С2 _______________________________________________
Ва(ОН)
2
+ Н
2
SО
4
= ВаSО
4
+ 2Н
2
О
m (Ba(OH)2 вещества)= 100*50/100= 50г
n (Ba(OH)2= 50/171=0,29 моль
n (Ba(OH)2) = n (ВаSО
4
)= 0,29 моль
m (ВаSО
4
)= 0,29 моль* 233 г/моль= 68,13 г
__________________________________________________
ЧАСТЬ 3
С1
1. 2Сu + O2 = 2CuO
2. CuO + 2HCl = CuCl2 + H2O
3. CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
С2 _______________________________________________
2NaOH + CuSO
4
= Cu(OH)
2
+ Na
2
SO
4
m (NaOH вещества)= 50*20/100= 10г
n (NaOH)= 10/40= 0,25 моль
n (Cu(OH)
2
)= 1/2n (NaOH)=0,125 моль
m (Cu(OH)
2
)=0,125*98= 34,125 г
__________________________________________________
Бланк ответов для промежуточной аттестации по химии
Фамилия учащегося
Бланк ответов для промежуточной аттестации по химии
Фамилия учащегося
Бланк ответов для промежуточной аттестации по химии
Фамилия учащегося
Бланк ответов для промежуточной аттестации по химии
Фамилия учащегося
ЧАСТЬ 3
С1 ________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
С2 _______________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
ЧАСТЬ 3
С1 ________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
С2 _______________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
ЧАСТЬ 3
С1 ________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
С2 _______________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
ЧАСТЬ 3
С1 ________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
С2 _______________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
__________________________________________________
Анализ выполнения работы
Работу выполняло _________ учащихся, ________ класса
Замечания и анализ:
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
________________________________________________________________________________________________________________
Вариант 1
1. Во 2-м периоде VIA группе Периодической системы находится химический элемент, схема строения атома которого
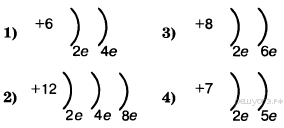
2. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
3. В соединении натрия с кислородом химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
4. В каком соединении степень окисления фосфора равна +3?
1)
2)
3)
4)
5. Сложным является каждое из двух веществ:
1) кислород и озон
2) белый фосфор и азотная кислота
3) серная кислота и вода
4) вода и барий
6. К какому типу реакций относится уравнение реакции между гидроксидом алюминия и серной кислотой
1) соединение
2) замещение
3) обмен
4) разложение
7. Наибольшее количество положительных ионов образуется при диссоциации 1 моль
1) фосфата натрия
2) серной кислоты
3) нитрата железа(III)
4) сульфида калия
8. При взаимодействии хлорида железа(III) и гидроксида калия образуется
1) вода
2) газ
3) осадок
4) реакция не идет
9. Оксид меди(II) взаимодействует с водным раствором
1) хлорида калия
2) хлороводорода
3) карбоната натрия
4) сульфата магния
10. Определите формулу неизвестного вещества в схеме реакции:
1)
2)
3)
4)
11. Практически осуществимой является реакция между
1) и
2) и
3) и
4) и
12. К окислительно-восстановительным относят реакцию, уравнение которой
1)
2)
3)
4)
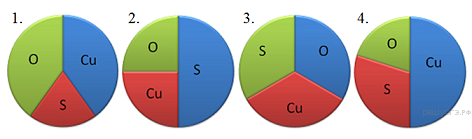
13. На какой диаграмме распределение массовых долей элементов соответствует ?
14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Среди химических элементов
1) наибольший радиус имеют атомы серы
2) наибольшую электроотрицательность имеет магний
3) степень окисления −4 и +4 характерны только для кремния
4) только сера образует высший оксид с кислотными свойствами
5) простое вещество-металл образует только магний
15. Используя метод электронного баланса, составьте уравнение реакции.
Mg + HCl =
Определите окислитель и восстановитель.
16. К 106 г раствора карбоната натрия c массовой долей 10% добавляли соляную кислоту до прекращения выделения газа. Найти массу необходимой кислоты.
Вариант 2
1. Элемент имеет два электрона на 3-м энергетическом уровне. Порядковый номер элемента
1) 2
2) 3
3) 12
4) 16
2. Кислотные свойства высших оксидов ослабевают в ряду:
1)
2)
3)
4)
3. Какой вид химической связи характерен для меди?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
4. Степень окисления -2 атом серы проявляет в каждом из соединений:
1) и
2) и
3) и
4) и
5. Простым является каждое из двух веществ:
1) кислород и метан
2) аммиак и ртуть
3) алмаз и хлор
4) медь и вода
6. Какое уравнение соответствует реакции обмена?
1)
2)
3)
4)
7. К сильным электролитам относится каждое из двух веществ:
1) и
2) и
3) и
4) и
8. Вода образуется при действии азотной кислоты на
1)
2)
3)
4)
9. Оксид калия реагирует
1) только с оснóвными оксидами
2) только с кислотными оксидами
3) как с кислотными, так и с оснóвными оксидами
4) как с кислотными, так и с амфотерными оксидами
10. Соляная кислота вступает в окислительно-восстановительную реакцию с
1)
2)
3)
4)
11. Раствор хлорида цинка реагирует с каждым из двух веществ:
1) и
2) и
3) и
4) и
12. Элемент азот является окислителем в реакции
1)
2)
3)
4)
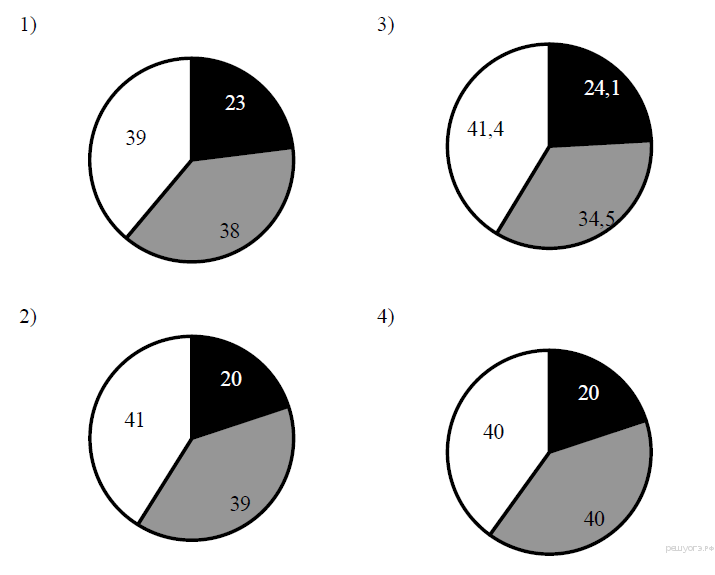
13. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата кальция?
14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Значения высших степеней окисления элементов увеличиваются в рядах:
1)
2)
3)
4)
5)
15 . Используя метод электронного баланса, составьте уравнение реакции.
Al + O2=
Определите окислитель и восстановитель.
16. Через 80 г раствора гидроксида натрия с массовой долей растворённого вещества 10% пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н.у.), затраченного на реакцию газа.
Вариант 3
1. В атоме химического элемента содержится 15 электронов. Сколько из них находятся на внешнем энергетическом уровне?
1) 1
2) 3
3) 5
4) 7
2. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
3. Ковалентная полярная связь имеется в молекуле
1) серной кислоты
2) пластической серы
3) хлора
4) сульфида рубидия
4. В каком из соединений степень окисления азота равна −3?
1) N2O3
2) KNO2
3) NH4Cl
4) HNO3
5. Формулам и
соответствуют названия
1) оксид азота(I) и гидроксид меди(I)
2) оксид азота(II) и гидроксид меди(I)
3) оксид азота(II) и гидроксид меди(II)
4) оксид aзотa(IV) и гидроксид меди(II)
6. Какое уравнение соответствует реакции замещения?
1)
2)
3)
4)
7. Хорошо растворимым в воде сильным электролитом является каждое из двух веществ:
1) и
2) и
3) и
4) и
8. В реакцию и с гидроксидом кальция, и с нитратом серебра вступает
1) карбонат магния
2) хлорид аммония
3) нитрат натрия
4) сульфат бария
9. Оксид серы(IV) может реагировать с каждым веществом пары
1)
2)
3)
4)
10. Гидроксид кальция реагирует с
1) углекислым газом
2) кислородом
3) водородом
4) поваренной солью
11. С раствором сульфата меди (II) реагирует
1)
2)
3)
4)
12. Установите соответствие между схемой химической реакции и элементом-восстановителем в этой реакции.
|
СХЕМА РЕАКЦИИ |
ВОССТАНОВИТЕЛЬ |
|
A) |
1) |
|
Б) |
2) |
|
B) |
3) |
|
4) |
|
|
5) |
|
13. На какой диаграмме распределение массовых долей элементов соответствует ?

14. Сходство бора, углерода и азота проявляется в том, что
1) в ядрах их атомов одинаковое число протонов
2) в их атомах одинаковое число электронных слоёв
3) простые вещества проявляют неметаллические свойства
4) в соединениях проявляют только положительные степени окисления
5) образуемые ими высшие оксиды относятся к основным оксидам
15. Используя метод электронного баланса, составьте уравнение реакции по схеме:
Са + HCl =
Определите окислитель и восстановитель
16. К раствору карбоната калия массой 110,4 г и массовой долей 5% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
Вариант 4
1. Число электронов во внешнем электронном слое атома, ядро которого содержит 10 протонов, равно
1) 8
2) 2
3) 6
4) 4
2. Валентность элемента в водородном соединении уменьшается в ряду
1)
2)
3)
4)
3. Такой же вид химической связи, как и в молекуле H2S, характерен для
1) K2O
2) S8
3) Na2S
4) СО2
4. В каком соединении хлор проявляет высшую возможную степень окисления?
1)
2)
3)
4)
5. Кислоте соответствует оксид
1)
2)
3)
4)
6. Какое уравнение соответствует реакции обмена?
1)
2)
3)
4)
7. Сульфат-анион при диссоциации в водном растворе образует каждое из двух веществ:
1) и
2) и
3) и
4) и
8. При взаимодействии карбоната кальция и соляной кислоты происходит образование
1) воды
2) газа
3) осадка
4) реакция не идет
9. Оксид натрия реагирует с каждым из двух веществ:
1) и
2) и
3) и
4) и
10. Соль и вода образуются в результате взаимодействия гидроксида меди(II) c
1) серой
2) водородом
3) соляной кислотой
4) сульфидом натрия
11. Среди веществ: ,
,
в реакцию с раствором
вступает(-ют)
1) только
2) и
3) и
4) и
12. Установите соответствие между схемой химической реакции и элементом-окислителем в этой реакции.
|
СХЕМА РЕАКЦИИ |
ОКИСЛИТЕЛЬ |
|
A) |
1) |
|
Б) |
2) |
|
B) |
3) |
|
4) |
|
|
5) |
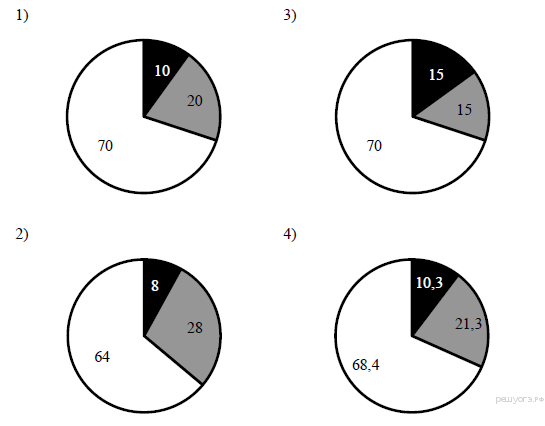
13. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата бария?
14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов уменьшается
1) заряд ядра атома
2) радиус атома
3) электроотрицательность элемента
4) валентность в летучем водородном соединении
5) число заполненных электронами энергетических уровней
15. Используя метод электронного баланса, составьте уравнение реакции по схеме:
Li + O2 =
Определите окислитель и восстановитель.
16. К 106 г раствора карбоната натрия c массовой долей 10% добавляли раствор хлорида кальция до прекращения выделения осадка. Вычислите массу осадка.
Ответы к экзаменационному материалу по химии в 8 классе.
Вариант 1
1) 3
2) 1
3) 1
4) 2
5) 3
6) 3
7) 1

9) 2
10) 2
11) 3
12) 2
13) 1
14) 35
15)
Mg0 + 2H+Cl— = Mg+2Cl—2 + Н20
Mg0 – 2е = Mg+2 восстановитель
2H+ +2е = Н20 окислитель
16)
1. Рассчитаем массу вещества карбоната натрия
m(Na2CO3)=106*0,1=10,6 г
2. Составим уравнение реакции:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
3. Найдем молярные массы веществ и составим пропорцию
10,6/106=х/2*71
х= 14,2 г
Ответ: m(HCl)= 14,2 г
Вариант 2
1) 3
2) 1
3) 2
4) 4
5) 3
6) 1
7) 2

9) 4
10) 4
11) 2
12) 1
13) 2
14) 14
15) 4Al0 + 3O20 = 2Al2+3O3-2
Al0 -3e = Al+3 восстановитель
O20 +4e = 2O-2 окислитель
16) 1. Рассчитаем массу вещества гидроксида натрия
m(NaOH)=80*0,1=8 г
2. Составим уравнение реакции:
2NaOH + CO2 = Na2CO3 + H2O
3. Найдем молярные массы веществ и составим пропорцию
8/2*40=х/22,4
х= 2,24 л
Ответ: m(CO2)= 2,24 л
Вариант 3
1) 3
2) 1
3) 1
4) 3
5) 4
6) 1
7) 2

9) 1
10)1
11) 2
12) 235
13) 1
14) 23
15. Са0 + 2H+Cl— = Са+2Cl—2 + Н20
Са0 – 2е = Са+2 восстановитель
2H+ +2е = Н20 окислитель
16) 1. Рассчитаем массу вещества карбоната калия
m(K2CO3)=110,4*0,05=5,52 г
2. Составим уравнение реакции:
K2CO3 + Ca(NO3)2 = 2KNO3 + CaCO3
3. Найдем молярные массы веществ и составим пропорцию
5,52/138=х/100
х= 4
Ответ: m(CaCO3)= 4 г
Вариант 4
1) 1
2) 4
3) 4
4) 2
5) 3
6) 3
7) 2

9) 3
10) 3
11) 1
12) 143
13) 4
14) 24
15) 2Li0 + O20 = 2Li2+ O-2
Li0 -1e = Li+ восстановитель
O20+ 4е = 2O-2 окислитель
16) 1. Рассчитаем массу вещества карбоната натрия
m(Na2CO3)=106*0,1=10,6 г
2. Составим уравнение реакции:
3. Найдем молярные массы веществ и составим пропорцию
10,6/106=х/100
х= 1
Ответ: m(CaCO3)= 1 г
Вариант 5
1. Число электронов во внешнем электронном слое атома, ядро которого содержит 10 протонов, равно
1) 8
2) 2
3) 6
4) 4
2. Среди перечисленных элементов наименьшей электроотрицательностью обладает
1) сера
2) кислород
3) углерод
4) кремний
3. Вещество, образованное посредством ионных связей:
1) оксид серы(IV)
2) оксид бария
3) сероводород
4) аммиак
4. Степень окисления азота уменьшается в ряду:
1)
2)
3)
4)
5. Кислоте соответствует оксид
1)
2)
3)
4)
6. Горение сероводорода
является реакцией
1) соединения
2) окислительно-восстановительной
3) замещения
4) обмена
7. При диссоциации 1 моль соли в растворе образовалось 4 моль положительных и отрицательных ионов. Формула соли —
1)
2)
3)
4)
8. Практически полностью в водном растворе взаимодействуют вещества:
1) нитрат серебра и хлороводород
2) нитрат кальция и хлорид калия
3) хлороводород и нитрат натрия
4) хлороводород и нитрат калия
9. Оксид серы(IV) может реагировать с каждым веществом пары
1)
2)
3)
4)
10. Гидроксид магния реагирует с
1) оксидом углерода (II)
2) сульфатом натрия
3) алюминием
4) азотной кислотой
11. Среди веществ: — в реакцию с соляной кислотой вступает(-ют)
1) и
2) и
3) только
4) и
12. Фосфор является окислителем в реакции
1)
2)
3)
4)
13. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата кальция?

14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов происходит уменьшение (ослабление)
1) числа протонов в ядрах атомов
2) числа электронных слоев в атомах
3) радиуса атомов
4) металлических свойств
5) кислотного характера свойств высших оксидов
15. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
Zn + HNO3 =
Определите окислитель и восстановитель.
16. К 89 г раствора хлорида алюминия с массовой долей 15% добавили избыток раствора нитрата свинца. Определите массу выпавшего осадка.
Тесты к переводному экзамену по химии в 8 классе
Вариант 1
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома алюминия равен
1) +2;
2) +13;
3) +12;
4) +20; А 2 В ряду Ca(OH)2 → AI(OH)3→ H2SO4свойства гидроксидов изменяются от
1) амфотерных к основным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к кислотным;
А 3. Химическая связь в оксиде фосфора (Y)
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность азота в соединениях NO2 и N2O5 соответственно равно
1) I и II
2) II и I
3) YIи II
4) IY и Y
А 5. К амфотерным оксидам относится вещество, формула которого
1) Mg(OH)2
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между магнием и серной кислотой коэффициент перед формулой
серной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции обмена
1) Mg O+HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3H2O
А 8. Алюминий реагирует с
1) оксидом магния
2) гидроксидом калия
3) цинком
4) хлоридом калия
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, H2О — с гидроксидом алюминия
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) оксидом кальция
3) серой
4) хлоридом калия
А 11. Раствор гидроксида натрия реагирует с
1) оксидом серы(IY)
2) водой
3) оксидом кальция
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении Na2SO3 окисления серы
1) +4;
2) +6;
3) +2;
4) +1;
А 14. Наименьший радиус у атома
1) AI;
2) В;
3) Ga;
4) Sr;
А 15. Вещество H3PO4-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (I)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль кислорода (O2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, 8.1 имеет атом
1) Mg
2) S
3) Ca
4) К
А 19. 24,5г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 5
А 20. Запись 2 H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная неполярная связь осуществляется в веществе
1) H2SO4
2) Р
3) SО2
4) NaBr
А 22. В веществе состава ЭO элемент Э – это
1) K
2) AI
3) H
4) Ca
А 23. Кислотные оксиды – это
1) P2O5 и СO2
2) Li2O и H2O
3) CaO и NO2
47) SO3 и CuO
А 24. В уравнении реакции между оксидом железа (III) и серной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома фосфора
1) 12
2) 4
3) 5
4) 1
А 26. В формуле сульфата алюминия индексы при символе алюминия и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 1
А 27.Магний реагирует с
1) серной кислотой
2) медью
3) сульфатом натрия
4) оксидом углерода(IY)
А 28Ядро состоит из
1) протонов, нейтронов и электронов
2) протонов и электронов
3) нейтронов и электронов
4) протонов и нейтронов
А 29. Массовая кислорода в воде равна
1) 10,5%
2) 88,88
3) 33,2%
4) 44,1%
А 30 Соли калия, имеющие формулы K3PO4, KNO3 , KCI, называются
1) нитрит, хлорид, фосфид
2) нитрат, хлорат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и H2SO4
2) CaO и NaOH
3) CuO и MgO
4) SO2 и H2O
5) Cu и H2S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
-
медь
-
алюминий
-
оксид калия
-
оксид углероды (IY)
-
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид фосфора (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ:_____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Na→Na2O→X→Na3PO4
C 2. Какая масса нитрата магния образуется при взаимодействии оксида магния и 196 г азотной кислоты.
Тесты к переводному экзамену по химии в 8 классе.
Вариант 2
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома калия равен
1) +19;
2) +13;
3) +12;
4) +20; А 2 В ряду AI(OH) →3 Ca(OH)2 → H2SO4свойства гидроксидов изменяются от
1) амфотерных к кислотным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к;
А 3. Химическая связь в оксиде магния
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность углерода в соединениях СO2 и Na2CО3соответственно равно
1) I и II
2) II и I
3) IYи IY
4) IY и II
А 5. К солям относится вещество, формула которого
1) SO3
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между гидроксидом магния и фосфорной кислотой коэффициент перед формулой фосфорной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции разложения
1) MgO +2HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3H2O
А 8. Медь реагирует с
1) оксидом магния
2) соляной кислотой
3) цинком
4) хлоридом ртути
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, K2O, H2O— с оксидом серы(YI)
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) оксидом кальция
3) серой
4) хлоридом натрия
А 11. Раствор гидроксида кальция реагирует с
1) гидроксидом магния
2) водой
3) оксидом серы(YI)
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении К3PO4 окисления фосфора
1) +4;
2) +6;
3) +5;
4) +1;
А 14. Наименьший радиус у атома
1) AI;
2) Mg;
3) P;
4) Si;
А 15. Вещество Mg3(PO4)2-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (II)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль кислорода (N2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, 2 имеет атом
1) Mg
2) S
3) Ca
4) К
А 19. 24,5г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 5
А 20. Запись 2 H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная полярная связь осуществляется в веществе
1) H2SO4
2) Р
3) SО2
4) NaBr
А 22. В веществе состава ЭO3 элемент Э – это
1) K
2) AI
3) S
4) Ca
А 23. Кислотные оксиды – это
1) P2O5 и СaO
2) Li2O и H2O
3) CaO и NO2
4) SO3 и P2O5
А 24. В уравнении реакции между оксидом железа (II) и азотной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома кремния
1) 12
2) 4
3) 5
4) 1
А 26. В формуле фосфата калия индексы при символе калия и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 1
А 27.Ртуть реагирует с
1) серной кислотой
2) медью
3) хлоридом серебра
4) оксидом углерода(IY)
А 28. Массовая кислорода в воде равна
1) 88,88
2) 10,5%
3) 33,2%
4) 44,1%
А 29. Соли калия, имеющие формулы K2SO4, KNO3,3PO4 называются
1) нитрит, хлорид, фосфид
2) сульфат, нитрат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
А 30. Число электронных слоёв в атоме равно
1) номеру группы
2) порядковому номеру
3) номеру периода
4) 8- номер группы
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и MgO
2) CaO и H2SO4
3) Cu(OH)2 и MgO
4) SO2 и K2O
5) Cu и H2S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
-
медь
-
алюминий
-
оксид углероды (IY)
-
оксид магния
-
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид азота (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ: _____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Mg→ Х→ Mg(OH)→MgO
C 2. Какая масса сульфата алюминия образуется при взаимодействии гидроксида алюминия и
24,5 г серной кислоты.
Тесты к переводному экзамену по химии в 8 классе.
Вариант 3
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома хлора равен
1) +19;
2) +13;
3) +17;
4) +20; А 2 В ряду NaOH → Zn(OH)2 → H2SO3свойства гидроксидов изменяются от
1) амфотерных к кислотным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к кислотным;
А 3. Химическая связь в азотной кислоте
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность углерода в соединениях SO2 и SO3 соответственно равно
1) I и II
2) II и I
3) YIи II
4) IY и YI
А 5. К кислотным оксидам относится вещество, формула которого
1) SO3
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между оксидом магния и серной кислотой коэффициент перед
формулой серной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции замещения
1) MgO +2HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3H2O
А 8. Медь реагирует с
1) оксидом магния
2) гидроксидом калия
3) цинком
4) хлоридом серебра
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, CuО — с гидроксидом натрия
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) гидроксидом кальция
3) серой
4) хлоридом натрия
А 11. Раствор гидроксида кальция реагирует с
1) азотной кислотой
2) водой
3) оксидом кальция
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении Na3PO4 окисления фосфора
1) +4;
2) +6;
3) +5;
4) +1;
А 14. Наибольший радиус у атома
1) AI;
2) Mg;
3) P;
4) Si;
А 15. Вещество Mg(OH)2-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (II)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль азота (N2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, имеет атом
1) Ne
2) S
3) Ca
4) К
А 19. 196 г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 2
А 20. Запись H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная неполярная связь осуществляется в веществе
1) H2SO4
2) O2
3) SО2
4) NaBr
А 22. В веществе состава ЭO2 элемент Э – это
1) K
2) AI
3) S
4) C
А 23. Кислотные оксиды – это
1) P2O5 и СaO
2) Li2O и H2O
3) CaO и NO2
4) SO3 и P2O5
А 24. В уравнении реакции между оксидом железа (II) и соляной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома натрия
1) 12
2) 4
3) 5
4) 1
А 26. В формуле фосфата магния индексы при символе магния и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 2
А 27.Ртуть реагирует с
1) серной кислотой
2) медью
3) хлоридом серебра
4) оксидом углерода(IY)
А 28 Ядро состоит из
1) протонов, нейтронов и электронов
2) протонов и электронов
3) нейтронов и электронов
4) протонов и нейтронов
А 29. Массовая кислорода в воде равна
1) 10,5%
2) 88,88
3) 33,2%
4) 44,1%
А 30. Соли калия, имеющие формулы KCI, KNO3, К3PO4 называются
1) нитрит, хлорид, фосфид
2) хлорид, нитрат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и MgO
2) CaO и H2SO4
3) Cu(OH)2 и MgO
4) SO2 и Mg
5) Cu и H2S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
-
медь
-
алюминий
-
оксид углероды (IY)
-
оксид магния
-
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид азота (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ: _____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
P→P2O5 →X→Na3PO4
C 2. Какая масса нитрата алюминия образуется при взаимодействии гидроксида алюминия и
32,5 г азотной кислоты.
|
Билет №1
|
|
Билет №2
|
|
Билет № 3
|
|
Билет №4
|
|
Билет №5
|
|
Билет №6
|
|
Билет №7
|
|
Билет №8
|
|
Билет №9
|
|
Билет №10
активный металл + кислота = соль + водород. Напишите уравнения реакций. |
|
Билет №11
|
|
Билет №12
|
|
Билет №13
|
|
Билет №14
|
|
Билет №15
|
|
Билет №16
S +O2→ ? C4H10 + O2→ ?+? H2CO3→ H2O +? MgCO3→ ?+? |
|
Билет №17
|
|
Билет №18
|
|
Билет №19
|
|
Билет №20
CaCO3 = CaO + CO2 – 180 кДж 2С4Н10 + 13О2 = 8СО2 + 10Н2О – 575кДж рассчитайте объем С4Н10, который нужно сжечь, чтобы выделившегося тепла было достаточно для получения 280 кг СаО |
|
Билет № 21
CaO→CaCl2→Ca(OH)2→Ca(NO3)2 |
|
Билет №22
|
|
Билет №23
|
|
Билет №24
|
|
Билет №25
2FeO+C=2Fe+CO2 CaO+H2=Ca+H2O SO2 + 2Mg=2MgO+S Fe+CuSO4=FeSO4 + Cu |
Пояснительная записка
Экзаменационные билеты по химии устной итоговой аттестации учащихся 8 класса составлены на основе государственного стандарта химического образования.
Основная цель: проверить выполнение государственного стандарта уровня подготовки учащихся.
Главные задачи: выявить подготовку химически и экологически грамотной личности, понимающей, что жизнь – это наивысшая ценность, овладевшей химическим и экологическим мышлением, освоившей основы химической культуры, овладевшей необходимыми методами изучения окружающих веществ, умеющей их применять на практике: ведения здорового образа жизни, охраны окружающей среды.
Требования к уровню подготовленности:
Знать / понимать
• химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
• важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
• основные законы химии: сохранения массы веществ, постоянства состава, периодический закон.
Уметь
называть: химические элементы, соединения изученных классов;
• объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов
и главных подгрупп; сущность реакций ионного обмена;
• характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов;
связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
• определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
• составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева; уравнения химических реакций;
• обращаться с химической посудой и лабораторным оборудованием;
• распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид -, сульфат -, карбонат — ионы;
• вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции.
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека;
критической оценки информации о веществах, используемых в быту;
приготовления растворов заданной концентрации.
В нашей школе с углубленным изучением
предметов естественно-математического цикла
изучение химии начинается в 7 классе с
пропедевтического курса Габриеляна О.С.
«Введение в химию». Школьники, изучающие химию
углубленно, после 8 класса сдают письменный
переводной экзамен. Время проведения работы – 90
минут. Учащиеся могут использовать калькулятор и
справочные таблицы (периодическую систему
химических элементов Д.И.Менделеева, таблицу
растворимости и электрохимический ряд
напряжений металлов). Задания тестовой части
оцениваются 22 баллами (с № 1- №16 оцениваются по 1
баллу, с №17- № 19 по 2 балла). Задания со свободным
ответом оцениваются 15 баллами (№ 20 – 11 баллов, №
21 – 4 балла). Критерии отметки: «2» – до 13 баллов
(до 34% выполнения работы), «3» – 14-20 баллов (35%-54%
выполнения работы), «4» – 21-29 баллов (55%-79%), «5» –
30-37 баллов (80%-100% выполнения работы).
Экзаменационная работа по химии за 8
класс
Вариант 1
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) гранит
2) фосфор
3) известняк
4) вода
2. Ряд чисел 2,8,5 соответствует распределению
электронов по энергетическим уровням атома
1) алюминия
2) азота
3) фосфора
4) хлора
3. Наиболее ярко неметаллические свойства
выражены у
1) Sn
2) Ge
3) Si
4) С
4. Степень окисления хрома в оксиде CrO3
равна
1) + 2
2) – 4
3) + 3
4) + 6
5. Химическая связь в молекуле брома Br2
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
6. Формулы оксида, основания, соли
соответственно
1) BaO, Fe(OH)2, NaNO3
2) SiO2, CaO, K2CO3
3) P2O5, Na2O, CaCl2
4) SO3, P2O5, KOH
7. Уравнение реакции замещения
1) Zn + 2HCl = ZnCl2 + H2
2) ZnO + H2SO4 = ZnSO4 + H2O
3) Cu(OH)2 = CuO + H2O
4) Fe + S = FeS
8. Коэффициент перед формулой углекислого газа
в уравнении реакции горения этана, схема которой
C2H6 + O2 ––> CO2 + H2O
1) 2
2) 3
3) 4
4) 5
9. Соль и водород образуются при взаимодействии
соляной кислоты с
1) металлами (не всеми)
2) основаниями
3) основными оксидами
4) кислотными оксидами
10. Гидроксид меди(II) реагирует c
1) H2O
2) HNO3
3) Al2O3
4) Au
11.Оксид кальция реагирует с
1) Li2O
2) Cu
3) HNO3
4) MgO
12. Формула вещества X в схеме превращений FeO
––> X ––> FeCl2
1) Fe2O3
2) FeCl3
3) Fe
4) Fe(OH)3
13. Фенолфталеин изменяет окраску при
добавлении к
1) H2SO4 (р-р)
2) NaOH (р-р )
3) H2O
4) Cu(OH)2
14. К электролитам относится каждое из веществ в
ряду
1) Na2O, KOH, Na2CO3
2) CuCl2, HCl, Na2SO4
3) Ba(OH)2, NH3, H2SiO3
4) CaCl2, Fe(OH)3, CO
15. К реакциям ионного обмена относится
1) 2NaOH + CO2 = Na2CO3 + H2O
2) CuO + H2SO4 = CuSO4 + H2O
3) NaCl + AgNO3 = NaNO3 + AgCl
4) 2HNO3 + Na2O = 2NaNO3 + H2O
16. В соответствии с сокращенным ионным
уравнением Cu2+ + 2OH– = Cu(OH)2
взаимодействуют электролиты
1) CuSO4 и Fe(OH)2
2) CuC2 и KOH
3) CuO и KOH
4) Cu2S и KOH
17. Массовая доля кислорода в серной кислоте H2SO4
равна приблизительно
1) 16%
2) 33%
3) 65%
4) 2%
18. Количество водорода, выделившегося при
взаимодействии 325 г цинка с соляной кислотой,
равно
1) 1 моль
2) 3 моль
3) 5 моль
4) 7 моль
19. Для приготовления 5%-ного раствора необходимо
2 г сахара растворить в воде, массой
1) 19 г
2) 20 г
3) 38 г
4) 40 г
Запишите полностью ход решения
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения кальций
––> оксид кальция ––> X ––> хлорид кальция.
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. Определите массу осадка, образовавшегося при
взаимодействии 50 г 18%-ного раствора гидроксида
бария с серной кислотой.
Вариант 2
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) хлороводород
2) иод
3) метан
4) поваренная соль
2. Ряд чисел 2,6 соответствует распределению
электронов по энергетическим уровням атома
1) серы
2) углерода
3) кремния
4) кислорода
3. С увеличением заряда ядер атомов в ряду F
––> Cl ––> Br ––> I неметаллические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
4. Степень окисления +6 сера имеет в веществе
1) SO2
2) H2S
3) H2SO3
4) H2SO4
5. Ионную кристаллическую решетку имеет
1) оксид натрия
2) вода
3) алюминий
4) алмаз
6. Формулы растворимого основания, соли ,
кислоты , соответственно
1) Zn(OH)2, CaCl2, HCl
2) BaO, Ca(OH)2, H2SO4
3) Mn2O7, CaO, ZnO
4) Ba(OH)2, NaNO3, HNO3
7. Уравнение реакции обмена
1) Zn + 2HCl = ZnCl2 + H2
2) ZnO + H2SO4 = ZnSO4 + H2O
3) Cu(OH)2 = CuO + H2O
4) Fe + S = FeS
8. Коэффициент перед формулой водорода в
уравнении реакции, схема которой Fe2O3 +
H2 = Fe + H2O равен
1) 1
2) 2
3) 3
4) 4
9. Формулы продуктов реакции алюминия с соляной
кислотой и коэффициенты перед ними в
соответствующем уравнении реакции
1) AlCl3 и 3H2
2) AlCl3 и H2
3) 2AlCl3 и 2H2
4) 2AlCl3 и 3H2
10. Основания могут реагировать
1) только с кислотами
2) с кислотами и основными оксидами
3) только с основными оксидами
4) с кислотами и кислотными оксидами
11. Оксид серы (IV) не реагирует с
1) NaOH
2) CaO
3) H2O
4) CO2
12. Формула вещества X в схеме превращений C ––>
СO2 ––> X
1) СO
2) CH4
3) C
4) H2CO3
13. Метилоранж изменяет окраску при добавлении к
1) соляной кислоте
2) гидроксиду железа (III)
3) воде
4) гидроксиду меди (II)
14. Сульфат-ионы образуются при диссоциации
1) сульфида натрия
2) сернистой кислоты
3) серной кислоты
4) сульфата бария
15. К реакциям ионного обмена относится реакция
1) Ca + 2H2O = Ca(OH)2 + H2
2) Na2CO3 + 2HNO3 = 2NaNO3 + CO2 +
H2O
3) Zn + H2SO4 = ZnSO4 + H2
4) 3H2O + P2O5 = 2 H3PO4
16. Соли, при взаимодействии которых с
растворами, содержащими ионы Ag+, образуется
осадок белого цвета, называются
1) нитратами
2) фторидами
3) хлоридами
4) сульфитами
17. Массовая доля серы в оксиде серы(VI) SO3
равна
1) 40%
2) 60%
3) 20%
4) 10%
18. Масса серы, необходимой для получения 4 моль
оксида серы(IV), равна
1) 32 г
2) 64 г
3) 128 г
4) 16 г
19. Массовая доля растворенного вещества в
растворе, приготовленном из 120 г воды и 40 г соли,
равна
1) 20%
2) 25%
3) 30%
4) 35%
Запишите полностью ход решения
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения медь
––> оксид меди(II) ––> X ––> гидроксид меди(II)
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. Определите массу соли, образовавшейся при
взаимодействии азотной кислоты и 50 г 12%-ного
раствора гидроксида натрия.
Вариант 3
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) серная кислота
2) спирт
3) оксид калия
4) кислород
2. Четыре электрона на внешнем электронном
уровне имеет атом
1) гелия
2) бериллия
3) углерода
4) кислорода
3. Наиболее ярко выражены металлические
свойства у
1) Li
2) C
3) N
4) O
4.Степень окисления + 6 хром имеет в веществе
1) Cr
2) CrO
3) CrCl3
4) H2CrO4
5.Формула вещества с ковалентной неполярной
связью
1) SO3
2) Br2
3) H2O
4) NaCl
6. Формулы нерастворимого основания, соли,
кислоты, соответственно
1) Zn(OH)2, CaCl2, HCl
2) BaO, Ba(OH)2, H2SO4
3) Mn2O7, CaO, ZnO
4) Ca(OH)2, NaNO3, HNO3
7. Уравнение реакции разложения
1) Zn + 2HCl = ZnCl2 + H2
2) ZnO + H2SO4 = ZnSO4 + H2O
3) Cu(OH)2 = CuO + H2O
4) Fe + S = FeS
8. Коэффициент перед формулой кислорода в
уравнении реакции горения пропана, схема которой
C3H8 + O2 ––> CO2 + H2O
равен
1) 3
2) 5
3) 7
4) 9
9. Формулы продуктов реакции и коэффициенты
перед ними в уравнении реакции гидроксида натрия
с серной кислотой
1) Na2SO4 и H2
2) Na2SO4 и H2O
3) Na2SO4 и 2H2O
4) Na2SO3 и H2
10. Гидроксид калия не взаимодействует с
1) соляной кислотой
2) оксидом железа(II)
3) оксидом серы (VI)
4) азотной кислотой
11. Оксид серы (IV) реагирует с
1) кислотами
2) щелочами
3) кислотными оксидами
4) сульфатом натрия
12. Формула вещества X в схеме превращений C ––>
CO2 ––> X
1) СО
2) СН4
3) Н2СО3
4) С
13. В растворе кислот
1) метилоранж желтеет
2) лакмус синеет
3) лакмус краснеет
4) фенолфталеин становится малиновым
14. Гидроксид-ионы образуются в процессе
диссоциации
1) хлорида калия
2) гидроксида железа(III)
3) хлороводорода
4) гидроксида лития
15. Реакции ионного обмена соответствует
уравнение
1) 2H2S + 3O2 = 2SO2 + 2H2O
2) CaCO3 = CaO + CO2
3) Zn + H2SO4 = ZnSO4 + H2
4) 2KOH + H2SO4 = K2SO4 + 2H2O
16. В растворе одновременно не могут содержаться
ионы
1) Ba2+ и SO42–
2) Na+ и SO42–
3) Ba2+ и OH–
4) Ag+ и NO3–
17. Массовая доля кислорода в оксиде углерода(IV)
СО2 равна приблизительно
1) 73%
2) 50%
3) 30%
4) 20%
18. Масса фосфора необходимого для получения 0,1
моль оксида фосфора(V) – Р2О5
1) 31 г
2) 3,1 г
3) 6,2 г
4) 0,2 г
19. При растворении 10 г щелочи в 30 г воды
получается раствор с массовой долей щелочи
1) 5%
2) 10%
3) 20%
4) 25%
Запишите полный ответ
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения алюминий
––> оксид алюминия ––> X ––> гидроксид
алюминия
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. К 50 г 20%-ного раствора силиката натрия
добавили азотной кислоты. Рассчитайте массу
образовавшегося осадка.
Вариант 4
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) бром
2) углекислый газ
3) азотная кислота
4) гранит
2. Распределению электронов по энергетическим
уровням атома хлора соответствует ряд чисел
1) 2, 8, 7
2) 2, 7
3) 2. 8, 5
4) 2, 5
3. Наиболее выражены металлические свойства у
1) кремния
2) алюминия
3) натрия
4) магния
4. Степень окисления +5 азот проявляет в
соединении
1) NO
2) N2O3
3) NO2
4) N2O5
5. Химическая связь в молекуле аммиака NH3
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
6. Формулы нерастворимого основания, соли,
кислоты соответственно
1) Cu(OH)2, NaCl, H2SO4
2) Ba(OH)2, BaCl2, HNO3
3) Mg(OH)2, H2, Ca(NO3)2
4) NaOH, Na2SO4, H2SO4
7. Взаимодействие соляной кислоты с оксидом
магния относится к реакции
1) разложения
2) соединения
3) замещения
4) обмена
8. Коэффициент перед формулой кислорода в
уравнении реакции, схема которой С2Н2
+ О2 ––> СО2 + Н2О, равен
1) 2
2) 3
3) 4
4) 5
9. Формулы продуктов реакции и коэффициенты
перед ними в уравнении реакции азотной кислоты с
гидроксидом меди (II)
1) Cu(NO3)2 и 2H2O
2) Cu(NO3)2 и H2
3) CuO и 2H2O
4) CuO и H2O
10. Гидроксид кальция реагирует с
1) HCl
2) Fe(OH)2
3) MgO
4) Ag
11. Большинство кислотных оксидов реагирует
1) только с водой
2) только с кислотами
3) со щелочами и кислотами
4) с водой и щелочами
12. Формула вещества Х в схеме превращений Сu
––> X ––> CuCl2
1) CuO
2) Cu(OH)2
3) Cu2O
4) CuOH
13. Лакмусом можно распознать
1) соляную кислоту
2) гидроксид железа(III)
3) воду
4) оксид кремния (IV)
14. Ионы металла и гидроксогрупп при
электролитической диссоциации образует
1) гидроксид меди(II)
2) азотная кислота
3) гидроксид калия
4) нитрат кальция
15. Сокращенное ионное уравнение Сu2+ + 2OH–
= Cu(OH)2 cоответствует реакции между
1) CuCl2 и AgNO3
2) Cu(OH)2 и H2SO4
3) CuSO4 и Ba(NO3)2
4) Cu(NO3)2 и Ca(OH)2
16. В растворе одновременно не могут содержаться
ионы
1) Ag+ и NO3–
2) Ag+ и Cl–
3) Ba2+ и OH–
4) K+ и SO42–
17. Массовая доля углерода в карбонате кальция
СаСО3 равна
1) 12%
2) 40%
3) 48%
4) 100%
18. Масса цинка, расходуемого для получения 6
моль водорода, при взаимодействии с соляной
кислотой
1) 65 г
2) 130 г
3) 260 г
4) 390 г
19. Для приготовления 400 г 2%-ного раствора соли
необходима масса соли
1) 2 г
2) 4 г
3) 8 г
4) 10 г
Запишите полный ответ.
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения литий
––> Х ––> гидроксид лития ––> хлорид лития
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. Определите массу осадка, образовавшегося при
взаимодействии 50 г 20%-ного раствора серной
кислоты с хлоридом бария.
5
Муниципальное казенное общеобразовательное учреждение
Куйбышевского района
«Средняя общеобразовательная школа № 4»
Билеты
для промежуточной аттестации
по химии
8 класс
Лукьянова Елена Алексеевна
учитель химии
(в соответствии занимаемой должности),
биологии и географии
г. Куйбышев
2017 г.
Пояснительная записка к билетам по промежуточной аттестации
(химия 8 класс)
В результате изучения химии в 8 классе ученик должен:
называть изученные вещества по «тривиальной» или международной номенклатуре;
определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, принадлежность веществ к различным классам органических соединений;
характеризовать: элементы малых периодов по их положению в периодической системе Д.И.Менделеева; строение и химические свойства изученных органических соединений;
объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической); роль химии в формировании современной естественнонаучной картины мира, в практической деятельности людей и самого ученика
выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ;
проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах.
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека;
критической оценки информации о веществах, используемых в быту;
приготовления растворов заданной концентрации.
Специальные умения, навыки и способы деятельности по учебному предмету «Химия», 8 класс:
Учащиеся должны знать:
химическую символику: знаки химических элементов, формулы химических веществ;
важнейшие химические понятия: химический элемент, атом, молекула, относительная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций;
основные законы химии: сохранение массы веществ, постоянство состава, периодический закон.
Должны уметь:
называть: химические элементы, соединения изученных классов;
объяснять: физический смысл атомного (порядного) номера химического элемента, номер
группы и периода, к которым элемент принадлежит в периодической системе Д.И.Менделеева: закономерности изменения свойств элементов в пределах малых периодов и главных групп;
характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
определять: состав веществ по формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соотношениях;
составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева, уравнения химических реакций;
вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количества вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции.
Билеты для промежуточной аттестации по химии, 8 класс
Билет 1
1)Предмет химии. Тела и вещества
2)Назовите 10 физических тел и 10 химических веществ.
Билет 2
1)Химические формулы. Относительная молекулярная масса вещества.
2)Определите молекулярную массу вещества карбонат кальция
Билет 3
1)Массовая доля элемента в веществе.
2)Определите, какова массовая доля элемента Са в карбонате кальция.
Билет 4
1)Валентность
2)Атомы, каких элементов имеют постоянные валентности? Назовите их.
Билет 5
1)Составление химических формул по валентности
2)Составьте химические формулы оксидов железа (II) и железа (III)
Билет 6
1)Количество вещества. Моль – единица количества вещества.
2)Определите количество вещества, которое соответствует 1 молекуле воды?
Билет 7
1)Молярная масса. Молярный объем газа. Закон Авогадро
2)Определите массу и объем углекислого газа количеством вещества в 2 моль?
Билет 8
1)Растворы
2)Определите массовую долю 15 г соли в растворе массой 300 г?
Билет 9
1)Химические реакции. Закон сохранения массы веществ. Химические уравнения.
2)Что надо сделать, чтобы выполнялся закон сохранения массы вещества в уравнении горения магния?
Билет 10
1)Оксиды
2)Приведите примеры образования 5 кислотных и 5 основных оксидов.
Билет 11
1) Соляная кислота.
2)Определите массу фосфорной кислоты, образующейся при взаимодействии 36 г воды с оксидом фосфора (V).
Билет 12
1)Кислоты. Свойства кислот.
2)Напишите образование 5 солей, которые может образовывать серная кислота?
Билет 13
1)Основания. Свойства оснований.
2)Напишите образование 5 солей, которые может образовывать гидроксид натрия?
Билет 14
1) Водород.
2)Определите массу оксида кальция и объем углекислого газа, которые потребуются для образования 25 г карбоната кальция?
Билет 15
1)Амфотерность. Амфотерные основания.
2)Определите массу оксида алюминия, получающегося при термическом разложении 78 г гидроксида алюминия?
Билет 16
1)Классификация веществ
2) Массовая доля элемента Са в фосфиде кальция составляет 66%. Определите молекулярную формулу фосфида кальция?
Билет 17
1)Типы химических реакций
2)Напишите уравнение реакции взаимодействия основания с кислотой и укажите тип этой химической реакции?
Билет 18
1) Кислород
2)Какой объем водорода выделится при взаимодействии 2,3 г Na с водой?
Билет 19
1)Галогены
2)Определите массу и объем хлора, которые потребуются для образования
Билет 20
1) Периодический закон Д.И. Менделеева
2)Рассчитайте массу одной молекулы воды? Можно ли вскипятить 1 молекулу воды? А две?
