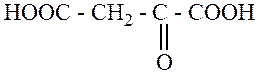7
Министерство
здравоохранения Республики Беларусь
Учреждение
образования
«Гомельский
государственный медицинский университет»
Кафедра
общей и биоорганической химии
ВОПРОСЫ
для
подготовки к экзамену по биоорганической
химии
для
студентов
1 курса лечебного факультет и ФПСЗС
в
2009-2010 учебном году
Гомель
ВОПРОСЫ
ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ
ПО
БИООРГАНИЧЕСКОЙ ХИМИИ
1.
Биоорганическая химия как область
науки, изучающая строение и механизм
функционирования биологически активных
молекул с позиций теоретической
органической химии.
2.
Органическая химия природных соединений
– фундаментальная основа биоорганической
химии. Предмет и задачи биоорганической
химии.
3.
Теория строения органических соединений
А.М.Бутлерова и ее развитие на современном
этапе. Специфическое явление органической
химии – изомерия – и обусловленное ею
многообразие органических соединений.
Структурная изомерия.
4.
Принципы номенклатуры органических
соединений. Основные правила систематической
номенклатуры органических соединений:
заместительная и радикало-функциональная
номенклатура.
1.
Пространственное строение органических
соединений, его связь с типом гибридизации
атома углерода: sp3,
sp2,
sp. Стереохимические формулы. Важнейшие
понятия стереохимии – конфигурация и
конформация.
2.
Конформации открытых цепей. Вращение
вокруг одинарной связи как причина
возникновения различных конформаций.
Энергетическая характеристика
конформационных состояний: заслоненные,
заторможенные, скошенные конформации.
Проекционные формулы Ньюмена.
3.
Конформации (кресло, ванна) циклических
соединений (циклогексан, тетрагидропиран);
их относительная потенциальная энергия.
Аксиальные и экваториальные связи.
Связь пространственного строения с
биологической активностью.
4. Сопряжение (π,π- и р,π-сопряжение).
Сопряженные системы с открытой цепью:
1,3-диены (бутадиен, изопрен, аллильный
карбкатион); полиены (каротиноиды,
витамин А); гетеросопряженные системы
(α,β-непредельные карбонильные соединения,
карбоксильная группа).
5.
Сопряженные
системы с замкнутой цепью. Ароматичность.
Критерии ароматичности, правило
ароматичности Хюккеля.
6.
Ароматичность бензоидных (бензол,
нафталин, фенантрен), небензоидных
(циклопентадиенильный анион) и
гетероциклических (фуран, тиофен, пиррол,
имидазол, пиридин, пиримидин, пурин)
соединений. Энергия сопряжения
(делокализации).
7.
Пиррольный и пиридиновый атомы азота,
π-избыточные и π-не-достаточные
ароматические системы. Делокализация
электронов как один из важных факторов
повышения устойчивости молекул и ионов,
ее широкая распространенность в
биологически важных молекулах (порфин,
гем, хлорофилл, гемоглобин и др.).
8.
Поляризация связей. Электронные
эффекты – индуктивный и мезомерный –
как причина неравномерного распределения
электронной плотности и возникновения
реакционных центров в молекуле.
Электронодонорные и электроноакцепторные
заместители.
9. Теория Бренстеда. Общие закономерности
в изменении кислотных или основных
свойств во взаимосвязи с природой атомов
в кислотном или основном центре,
электронными эффектами заместителей
при этих центрах и сольватационными
эффектами.
10. Стабильность аниона кислоты –
качественный показатель кислотных
свойств. Кислотные свойства органических
соединений с водородсодержащими
функциональными группами (спирты,
фенолы, тиолы, карбоновые кислоты,
амины).
11. Основные свойства нейтральных молекул,
содержащих гетероатомы с неподеленными
парами электронов (спирты, тиолы, простые
эфиры, сульфиды, карбонильные соединения,
амины).
12.
Кислотно-основные
свойства азотсодержащих гетероциклов
(пиррол, имидазол, пиридин).
13.
Классификация
органических реакций по результату
(замещения, присоединения, элиминирования,
перегруппировки, окислительно-восстановительные)
и по механизму – радикальные, ионные
(электрофильные, нуклеофильные),
согласованные.
14.
Типы
реагентов: радикальные, кислотные,
основные, электрофильные, нуклеофильные.
Способы разрыва ковалентной связи в
органических соединениях и образующиеся
при этом частицы: свободные радикалы
(гомолитический разрыв), карбкатионы и
карбанионы (гетеролитический разрыв).
Электронное и пространственное строение
этих частиц и факторы, обусловливающие
их относительную устойчивость.
15. Реакционная способность углеводородов.
Реакции свободнорадикального замещения:
гомолитические реакции с участием С-Н
связей sp3—
гибридизированного атома углерода.
Механизм свободнорадикального замещения
на примере реакции галогенирования
алканов. Региоселективность реакций
свободнорадикального замещения. Понятие
о цепных процессах.
16. Реакции электрофильного присоединения
в ряду алкенов и алкадиенов: гетеролитические
реакции с участием π-связи между
гибридизированными атомами углерода.
Механизм реакций гидрогалогенирования
и гидратации. Кислотный катализ. Правило
Марковникова.
17. Особенности электрофильного
присоединения к сопряженным системам:
гидратация α,β-ненасыщенных карбоновых
кислот на примере акриловой кислоты.
18. Реакции электрофильного замещения:
гетеролитические реакции с участием
π-электронного облака ароматической
системы. Механизм реакций галогенирования,
нитрования, сульфирования и алкилирования
ароматических соединений. π- и σ-
комплексы. Роль катализаторов в
образовании электрофильной частицы.
19.
Влияние заместителей в бензольном ядре
и гетероатомов ароматических гетероциклов
на реакционную способность. Ориентирующее
влияние заместителей и гетероатомов.
20. Реакции нуклеофильного замещения у
sp3-гибридизованного
атома углерода: гетеролитические
реакции, обусловленные поляризацией
связи углерод – гетероатом
(галогенопроизводные, спирты). Легко и
трудно уходящие группы; связь легкости
ухода группы с ее строением.
21. Реакции гидролиза галогенопроизводных.
Реакции алкилирования спиртов, фенолов,
тиолов, аммиака и аминов. Роль кислотного
катализа в нуклеофильном замещении
гидроксильной группы. Галогенопроизводные,
спирты, эфиры серной и фосфорной кислот
как алкилирующие реагенты. Биологическая
роль реакций алкилирования.
22.
Реакции элиминирования (дегидрогалогенирование,
дегидратация). Повышенная СН-кислотность
как причина реакций элиминирования,
сопровождающих нуклеофильное замещение
у sp3—
гибридизованного атома углерода.
23.
Реакции
нуклеофильного замещения в ряду
карбоновых кислот (карбоновые кислоты
и их функциональные производные).
Электронное и пространственное строение
карбоксильной группы.
24. Характеристика кислотных свойств
карбоновых кислот: одно-, двухосновных,
предельных, непредельных, ароматических.
25. Реакции ацилирования – образования
ангидридов, сложных эфиров, сложных
тиоэфиров, амидов – и обратные им реакции
гидролиза.
26. Ацилирующие реагенты (ангидриды,
галогенангидриды, карбоновые кислоты,
сложные эфиры, сложные тиоэфиры),
сравнительная активность этих реагентов.
Ацилфосфаты и ацилкофермент А – природные
макроэргические ацилирующие реагенты.
Биологическая роль реакций ацилирования.
Понятие о реакциях фосфорилирования.
27. Реакции нуклеофильного присоединения:
гетеролитические реакции с участием
π-связи углерод-кислород (альдегиды и
кетоны).
28. Механизм реакций карбонильных
соединений с водой, спиртами, тиолами,
первичными аминами.
29. Реакции альдольного присоединения.
Основной катализ. Альдольное расщепление
как реакция обратная альдольному
присоединению. Биологическое значение
этих процессов.
30.
Реакции окисления и восстановления
органических соединений. Специфика
окислительно-восстановительных реакций
органических соединений. Понятие об
одноэлектронном переносе. Перенос
гидрид-иона в системе НАД+–НАДН.
31.
Реакции окисления спиртов, тиолов,
сульфидов, карбонильных соединений,
аминов. Дисмутация
формальдегида (реакция Канницаро-Тищенко),
ее механизм. Реакции
восстановления карбонильных соединений,
дисульфидов, иминов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Привет! Многие студенты медицинских вузов сейчас разбирают биоорганическую химию (сокращённо-БОХ).
В некоторых вузах этот предмет заканчивается зачётом, в некоторых – экзаменом. Иногда бывает, что зачёт в одном вузе сравним по сложности с экзаменом в другом.
В моём университете биоорганическая химия сдавалась как раз экзаменом во время летней сессии — это был самый конец первого курса. Надо сказать, что БОХ относится к тем предметам, которые поначалу ужасают и могут вселять мысль — «это сдать невозможно». Особенно это касается людей со слабой базой органической химии (а таких в медицинских университетах, как ни странно, довольно много).
Программы изучения биоорганической химии в разных университетах могут очень сильно отличаться, а методики преподавания – ещё сильнее.
Однако, требования к студентам везде примерно одинаковые. Если очень упростить, то чтобы сдать биоорганическую химию на 5, вы должны знать названия, свойства, особенности строения и типичные реакции ряда органических веществ.
Наш преподаватель, уважаемый профессор, подавал материал так, будто бы каждый студент был самым лучшим в школе по органической химии (а биоорганическая химия по сути представляет собой усложнённый курс школьной органической химии). Наверное, он был прав в своём подходе, все должны тянуться наверх и стараться быть лучшими. Однако это привело к тому, что некоторые студенты, которые на первых 2-3 парах не понимали материал частично, ближе к середине семестра вообще перестали понимать всё.
Я решил написать этот материал по большей части из-за того, что я как раз и был таким студентом. В школе я очень любил неорганическую химию, а вот с органикой у меня всегда не складывалось. Даже во время подготовки к ЕГЭ я выбрал стратегию усиления всех своих знания по неорганике, в то же время закрепляя только базу органики. Мне кстати это чуть не вышло боком в плане вступительных баллов, но это другая история.
Я не зря сказал про методику преподавания, потому что у нас она была тоже весьма необычная. Нам сразу же, чуть ли не на первой паре, продемонстрировали методички, по которым мы должны были сдавать зачёты и затем экзамен.
Биоорганическая химия — зачёты и экзамен
Весь курс у нас делился на 4 крупных темы, каждая из которых заканчивалась зачётным занятием. Вопросы к каждому из четырёх зачётов у нас уже были с первых пар. Они, конечно же, пугали, однако в то же время они служили своеобразной картой, по которой следует двигаться.
Первый зачёт был совсем элементарный. Он был посвящён, в основном, номенклатуре, тривиальным (бытовым) и международным названиям, и, конечно же, классификации веществ. Также в том или ином виде затрагивались признаки ароматичности.
Второй зачёт после первого казался значительно более сложным. Там необходимо было расписывать свойства и реакции таких веществ, как кетоны, альдегиды, спирты, карбоновые кислоты. Например, одна из типичнейших реакций альдегидов — это реакция серебряного зеркала. Довольно красивое зрелище, скажу я вам. Если к какому-либо альдегиду вы добавите реактив Толленса, то есть [Ag(NH3)2]ОН, то на стенке пробирки вы увидите осадок, напоминающий зеркало, вот как это выглядит:
Третий зачёт на фоне второго не казался таким грозным. Все уже привыкли писать реакции и запоминать свойства по классификациям. В третьем зачёте речь шла о соединениях с двумя функциональными группами – аминофенолы, аминоспирты, оксокислоты и другими. Также в каждом билете был минимум один билет про углеводы.
Четвёртый зачёт по биоорганической химии был почти целиком и полностью посвящён белкам, аминокислотам и пептидным связям. Особой изюминкой были вопросы, на которых требовалось собрать РНК и ДНК.
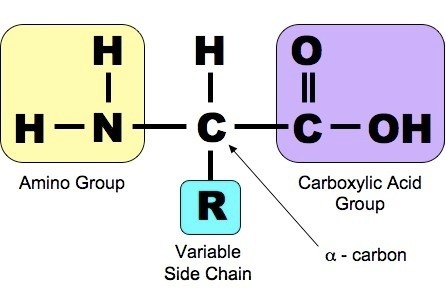
Кстати, как раз вот так выглядит аминокислота — вы можете увидеть аминогруппу (она подкрашена жёлтым на этом рисунке) и группу карбоксильной кислоты (она сиреневая). Именно с веществами этого класса приходилось иметь дело в четвертом зачёте.
Каждый зачёт сдавался у доски – студент должен без подсказок расписать и пояснить все необходимые свойства в виде реакций. Например, если вы сдаёте второй зачёт, и первым вопросом вашего билета указаны свойства спиртов. Преподаватель предлагает расписать свойства спиртов на примере пропанола. Вы пишете формулу пропанола и 4-5 типичных реакций, чтобы проиллюстрировать его свойства. Могла быть и экзотика, вроде серосодержащих соединений. Ошибка даже в индексе одного продукта реакции зачастую отправляла дальше учить этот материал до следующей попытки (которая была через неделю). Страшно? Сурово? Конечно!
Однако у такого подхода есть очень приятный побочный эффект. Во время регулярных семинарских занятий приходилось тяжко. Многие сдавали зачёты по 5-6 раз. Но зато на экзамене было очень легко, ведь каждый билет содержал 4 вопроса именно по одному из каждого уже выученного и решённого зачёта.
Поэтому я даже не буду расписывать тонкости подготовки к экзамену по биоорганической химии. В нашем случае вся подготовка сводилась к тому, как мы готовились к самим зачётам. Уверенно сдал каждый из четырёх зачётов – перед экзаменом просто просмотри свои же черновики, распиши ещё самые основные реакции и сразу всё восстановится. Дело в том, что органическая химия — это очень логичная наука. Запоминать нужно не огромные строки реакций, а сами механизмы.
Да, отмечу, что это работает далеко не со всеми предметами. Грозную анатомию не получится сдать, просто почитав свои записи накануне. Ряд других предметов также имеет свои особенности. Даже если в вашем медицинском университете биоорганическая химия преподаётся как-то иначе, возможно, вам нужно будет скорректировать вашу подготовку и осуществлять её немного не так, как делал я. В любом случае, удачи вам, понимайте и любите науку!
Вопросы для подготовки к экзамену по биоорганической химии для студентов ФМБФ
I.
Номенклатура органических
соединений
1.
Правила построения названия
органических соединений по номенклатуре ИЮПАК
2.
Построение названий
ациклических соединений.
3.
Построение названий
функциональных соединений.
4.
Структурная изомерия,
изомерия положения, мета- изомерия.
II.
Химическая
связь
1.
Индуктивный и мезомерный
эффект. Элекронодонорные и электроноакцепторные группы.
2.
Делокализованная химическая
связь. π
—
π
и π -Р
сопряжение.
3.
Метод резонанса. Построение
резонансных структур. Энергия сопряжения.
4.
Ароматичность органических
соединений. Правило ароматичности Хюккеля. Применение методов ВС и МО Хюккеля
для описания структуры бензола. Соединения, обладающие
ароматичностью.
III. Стериоизомерия
1.
Оптическая изомерия.
Хиральность. Энантиомеры.
2.
Правила построения проекции
Фишера для соединений с одним хиральным центром.
3.
Система
Кона-Ингольда-Прелога. R-S-номенклатура.
4.
Соединения с двумя хиральными
центрами Мезо-форма, Дихастереомеры.
5.
Прохиральность. Гомотопные,
энантиотопные и диастериотопные атомы или группы. Энантиотопные и
диастереотопные поверхности.
6.
Конформационный анализ.
Конформеры.
7.
Геометрическая изомерия.
Z,E-номенклатура. Физические свойства и устойчивость
Z,E-изомеров.
IV. Кислотность и основность органических
соединений.
1.
Кислотность и основность по
теории Бренстеда-Лоури. Определение рКа и рКаВН+
2.
Кислотность и основность по
теории Льюиса. Жесткие и мягкие кислоты и основания
3. Факторы,
определяющие кислотность карбоновых кислот, спиртов и
тиолов.
4. С-Н кислоты.
Устойчивость карбоанионов. Таутомерия.
5. Факторы,
определяющие основность аминов и
простых эфиров.
6.
Кислотно-основное равновесие α-аминокислот. Изолектрическая
точка.
V. Реакции органических соединений.
1. Классификация
реакций органических соединений
2. Нуклеофильное
замещение у насыщенного атома углерода. Общая характеристика механизма
моно-(SN1) и бимолекулярной-(SN2) реакции. Влияние заместителей в субстрате на
реакционную способность. Устойчивость карбокатионов. Влияние на скорость реакции
нуклеофила и уходящей группы. Влияние растворителей на скорость реакций
SN1 и SN2.
3.
Реакция элиминирования.
Классификация реакций элиминирования. Механизм β – элиминирования. Механизм
реакции Е2-элимирования, стериоспецифичность реакции. Правило
Зайцева. Правило Гофмана. Механизм реакции Е1. Механизм реакции
Е1св, Конкуренция замещения и элиминирования.
4.
Электрофильное замещение в
ароматическом ядре. Механизм реакции. Ориентация электрофильного замещения и
реакционная способность замещенных бензолов. Ориентация электрофильного
замещения дизамещенных бензолов.
5.
Электрофильное присоединение
к двойной связи углерод-углерода. Механизм реакции бромирования. Стериоизомерия
образовавшихся продуктов. Реакция присоединения хлористого водорода. Правило
Марковникова.
6.
Нуклеофильное присоединение к
двойной связи углерод-гетероатом. Влияние строения субстрата на скорость
реакции. Механизм катализированный кислотами и основаниями. Взаимодействие кетонов и альдегидов с
кислород и азот содержащими нуклеофилами. Альдольная и кротоновая
конденсация. Взаимодействие кислот
с кислород и азот содержащими нуклеофилами. Гидролиз производных карбоновых
кислот. Сложноэфирная конденсация.
Рекомендуемая литература
1 В.Л. Флорентьев. Органическая химия (ч I) МБ 1990г
2. Методические указания к практическим работам по
органической химии. МФТИ, М.1989
3. А. Терней. Современная органическая химия т.1,2, Изд.
«Мир».М.1981г
4. О.А. Реутов, А.Л. Курц, К.П. Бутин « Органическая
химия» т.1,2,3. Москва.2004
5. В.Л. Белобородов, С.Э.Зурабян, А.П. Лузин, Н.А.
Тюкавкина. Органическая химия. Основной курс т.1, Москва,
2004г.
6. И.И. Грандберг Органическая химия, ДРОФА, Москва
2001.
Экзаменационный тестовый контроль по биоорганической
химии
Для студентов 1 курса лечебного факультета
1. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
1. Пиррол является соединением:
— 1. ациклическим;
— 2. карбоциклическим;
+ 3. гетероциклическим;
+ 4. ароматическим;
— 5. насыщенным.
2.
2–Изопропил–5–метилциклогексанол по строению углеродного скелета является
соединением:
+
1. карбоциклическим;
— 2. гетероциклическим;
— 3. непредельным;
— 4. ароматическим;
— 5. ациклическим.
3. Пропантриол-1,2,3 является соединением:
— 1. монофункциональным;
— 2. ароматическим;
— 3. непредельным;
+ 4. полифункциональным;
— 5. гетерофункциональным.
4.
По функциональным группам анестезин (этиловый эфир n-аминобензойной кислоты)
является:
— 1. амидом;
+ 2. сложным эфиром;
— 3. кетоном;
+ 4. амином;
— 5. простым эфиром.
5.
По функциональным группам норадреналин (2-амино-1-[3′, 4′-дигидроксифенил]
этанол) является:
— 1. нитрилом;
+ 2. спиртом;
+ 3. фенолом;
— 4. амидом;
+ 5. амином.
6. По функциональным группам 4 — гидрокси — 3 —
этоксибензальдегид является:
+ 1. фенолом;
+ 2. простым эфиром;
— 3. сложным эфиром;
+ 4. альдегидом;
— 5. спиртом.
7. В состав 2 — гидрокси — 4 — метилбензойной кислоты
входит следующее количество функциональных групп:
— 1. 1;
+ 2. 2;
— 3. 3;
— 4. 4;
— 5. 5.
8.
По заместительной номенклатуре соединение фенилэтилкетон называется:
— 1. метиловый эфир бензойной кислоты;
— 2. фенилэтилкетон;
+ 3. 1 – фенилпропанон-1;
— 4. метилбензоат;
— 5. бензилэтилкетон.
 |
9. По заместительной номенклатуре соединение
называется:
+
1. 3 – гидрокси – 3 – карбоксипентандиовая кислота;
—
2. 3 – гидрокси – 3 – формилпентандиовая кислота;
—
3. лимонная кислота;
—
4. 3 – оксопентандиовая – 1,5 – кислота;
—
5. 3,5 – диоксопентановая кислота.
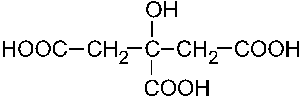
10. По заместительной номенклатуре соединение
называется:
— 1. 2 — формилбутандикарбоновая кислота;
— 2. 2 — оксоэтандиовая кислота;
— 3. 2 — оксобутановая кислота;
— 4.1,4 — дигидроксибутанон — 2;
+ 5. 2 — оксобутандиовая — 1,4 кислота.
2. ЭЛЕКТРОННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
11. sp2 – Гибридных атомов нет в составе:
+ 1. глицерина;
— 2. пропановой кислоты;
+ 3.
бутана;
+ 4. этилового спирта;
— 5. анилина.
12. Пиррольные гетероатомы входят в состав следующих
соединений:
+ 1. анилин;
— 2. этанол;
+ 3. фенол;
— 4. бензальдегид;
— 5. 3-метилбутанамин-1.
13. π-π – сопряжение есть в структуре:
+ 1. бензола;
+ 2. пентадиена – 1,3
— 3. пентадиена – 1,4
— 4. пропаналя;
— 5. пропановой кислоты.
14. p-π – сопряжение есть в структуре:
+ 1. уксусной кислоты;
+ 2. 2-гидроксипропановой кислоты;
— 3. этиленгликоля;
— 4. пиридина;
— 5. пропен-2-аля.
15. Ароматическими являются следующие соединения:
— 1. циклогексан;
— 2. циклооктатетраен;
+ 3. нафталин;
+ 4. пиррол;
+ 5. бензол
16. Ароматическими не являются следующие соединения:
— 1. пиридин;
+ 2. циклогексен-1;
— 3. антрацен;
+ 4. циклопентадиен-1,3
— 5. фуран.
17. У функциональной группы есть отрицательный
мезомерный эффект в соединениях:
— 1. этанол;
— 2. глицерин;
— 3. ацетон;
+ 4. бутен-2-аль-1;
— 5. 4-метиланилин.
18. У функциональной группы есть только отрицательный
индуктивный эффект в соединениях:
— 1. фенол;
+ 2. этиленгликоль;
+ 3. уксусная кислота;
— 4. этандиовая кислота;
— 5. метилфенилкетон.
19. Все функциональные группы являются
электроноакцепторными в соединениях:
+ 1. 2-аминоэтанол-1;
— 2. 2-гидроксибензойная кислота;
— 3. 4-аминобензолсульфоновая кислота.
— 4. 4-гидрокси-3-метоксибензальдегид;
+ 5. 2,3-дигидроксипропаналь.
20. В соединении:
Электронодонорами являются следующие функциональные
группы:
— 1. аминогруппа;
— 2. гидроксильная спиртовая группа;
+ 3. гидроксильные фенольные группы;
— 4. бензольное кольцо и аминогруппа;
— 5. все гидроксильные группы.
3. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ.
21.
Проекционные формулы Ньюмена записывают, чтобы показать различия:
— 1. в химическом строении соединений;
+ 2. в конформациях молекулы;
— 3. структурных изомеров;
— 4. в конфигурационном строении энантиомеров;
— 5. в строении Е и Z π –
диастереомеров.
22.
Энергия пропанола–1 в анти-конформации меньше, чем в скошенной, т.к. в анти–конформации:
— 1. меньше угловое напряжение;
— 2. изменилась конфигурация;
+ 3. уменьшилось Ван-дер-Ваальсово отталкивание;
— 4. стало меньше торсионное напряжение;
— 5. изменилось химическое строение.
23.
Энергия 2–хлорбутана в заслоненной конформации больше, чем в скошенной, т.к. в
заслоненной конформации:
— 1. у молекулы другая конфигурация;
— 2. больше торсионное напряжение;
— 3. у молекулы другое электронное строение;
— 4. больше угловое напряжение;
+ 5. увеличивается Ван-дер-Ваальсово отталкивание.
Ставлю 10/10
Все нравится, очень удобный сайт, помогает в учебе. Кроме этого, можно заработать самому, выставляя готовые учебные материалы на продажу здесь. Рейтинги и отзывы на преподавателей очень помогают сориентироваться в начале нового семестра. Спасибо за такую функцию. Ставлю максимальную оценку.
Отлично
Лучшая платформа для успешной сдачи сессии
Познакомился со СтудИзбой благодаря своему другу, очень нравится интерфейс, количество доступных файлов, цена, в общем, все прекрасно. Даже сам продаю какие-то свои работы.
Отлично
Студизба ван лав ❤
Очень офигенный сайт для студентов. Много полезных учебных материалов. Пользуюсь студизбой с октября 2021 года. Серьёзных нареканий нет. Хотелось бы, что бы ввели подписочную модель и сделали материалы дешевле 300 рублей в рамках подписки бесплатными.
Отлично
Отличный сайт
Лично меня всё устраивает — и покупка, и продажа; и цены, и возможность предпросмотра куска файла, и обилие бесплатных файлов (в подборках по авторам, читай, ВУЗам и факультетам). Есть определённые баги, но всё решаемо, да и администраторы реагируют в течение суток.
Отлично
Маленький отзыв о большом помощнике!
Студизба спасает в те моменты, когда сроки горят, а работ накопилось достаточно. Довольно удобный сайт с простой навигацией и огромным количеством материалов.
Хорошо
Студ. Изба как крупнейший сборник работ для студентов
Тут дофига бывает всего полезного. Печально, что бывают предметы по которым даже одного бесплатного решения нет, но это скорее вопрос к студентам. В остальном всё здорово.
Отлично
Спасательный островок
Если уже не успеваешь разобраться или застрял на каком-то задание поможет тебе быстро и недорого решить твою проблему.
Отлично
Всё и так отлично
Всё очень удобно. Особенно круто, что есть система бонусов и можно выводить остатки денег. Очень много качественных бесплатных файлов.
Отлично
Отзыв о системе «Студизба»
Отличная платформа для распространения работ, востребованных студентами. Хорошо налаженная и качественная работа сайта, огромная база заданий и аудитория.
Хорошо
Отличный помощник
Отличный сайт с кучей полезных файлов, позволяющий найти много методичек / учебников / отзывов о вузах и преподователях.
Отлично
Отлично помогает студентам в любой момент для решения трудных и незамедлительных задач
Хотелось бы больше конкретной информации о преподавателях. А так в принципе хороший сайт, всегда им пользуюсь и ни разу не было желания прекратить. Хороший сайт для помощи студентам, удобный и приятный интерфейс. Из недостатков можно выделить только отсутствия небольшого количества файлов.
Отлично
Спасибо за шикарный сайт
Великолепный сайт на котором студент за не большие деньги может найти помощь с дз, проектами курсовыми, лабораторными, а также узнать отзывы на преподавателей и бесплатно скачать пособия.
Отлично