Таблицы качественных реакций
21-Дек-2013 | комментариев 9 | Лолита Окольнова
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
| Описание | Формула |
Реакции |
| Бурый газ |
NO2 |
1) N2 + 2O2 = 2NO2 2) взаимодействие металлов с азотной кислотой (концентрированной) 3) разложение нитратов |
| Запах тухлых яиц |
H2S |
Взаимодействие активных металлов с концентрированной серной кислотой: |
|
Газ с резким запахом. Растворимый в воде |
SO2 |
1) взаимодействие серасодежащих веществ с кислородом
2) взаимодействие некоторых металлов с концентрированной серной кислотой |
| Газ с резким характерным запахом, растворимый в воде |
NH3 |
1) N2 + 3H2 = 2NH3 2) обменные реакции солей аммония |
| Газ, не поддерживающий горение, малорастворимый в воде, не ядовитый |
N2 |
1) горение азотсодержащих веществ; NH4NO2 = N2 + 2H2O |
|
Газы, поддерживающие горение: (для NO2 – бурый цвет) |
O2 O3 NO2 |
3C + 2O3 = 3CO2 С + 2NO2 = CO2 + 2NO |
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
|
желто-зеленое |
фиолетовое |
кирпично-красное |
ярко-красное |
желтое |
карминово-красное |
|
Ba2+ |
K+ |
Са2+ |
Li+ |
Na+ |
Sr2+ |
Таблица качественных реакций
— цвета осадков
|
Осадки белого цвета |
Качественная реакция |
|
Белый творожистый нерастворимый в воде; нерастворимый в HNO3 |
Ag+ + Cl— → AgCl↓ качественная реакция на соли серебра; качественная реакция на хлорид-ионы; |
|
Белый осадок нерастворимый в кислотах |
Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария; качественная реакция на сульфат-ионы; |
|
Белый осадок образуется при пропускании газа без цвета с резким запахом через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + SO2 = CaSO3↓ + H2O
|
|
Белый осадок образуется при добавлении щелочи; растворяется в избытке щелочи |
Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓
|
|
Белый осадок образуется при пропускании газа без цвета и запаха через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2H+ → CO2↑ + H2O + Ca2+ |
|
Осадок светло-желтого цвета (осадок кремового цвета) образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + Br— → AgBr↓ качественная реакция на бромид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + I— → AgJ↓ качественная реакция на иодид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; растворим в кислотах; |
3Ag+ + PO43- → Ag3PO4↓ |
|
Осадки коричневых цветов |
Качественная реакция |
|
Осадок бурого цвета образуется при взаимодействии с растворами щелочей; |
Fe3+ +3OH— → Fe(OH)3↓ качественная реакция на соли железа |
|
Осадки синих и зеленых цветов |
Качественная реакция |
|
Осадки зеленого цвета |
Fe2+ +2OH— → Fe(OH)2↓ |
|
Осадок голубого цвета (осадок синего цвета) образуется при взаимодействии с растворами щелочей |
Cu2+ +2OH— → Cu(OH)2↓ качественная реакция на соли меди (II) |
|
Осадок синего цвета образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли |
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ качественная реакция на соли железа (II) — с красной кровяной солью; 4Fe3+ + 3[Fe(CN)6]-4 → Fe4[Fe(CN)6]3↓ качественная реакция на соли железа (III) — с желтой кровяной солью; |
|
Осадки черного цвета |
Качественная реакция |
|
Осадок черного цвета Образуется при взаимодействии с сульфидами или с H2S |
Fe2+ + S2- → FeS↓ Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ качественная реакция на сульфид-ионы |
Обсуждение: «Таблицы качественных реакций»
(Правила комментирования)
Цвета соединений, знание которых необходимо для сдачи ЕГЭ
1. Медь – мягкий пластичный металл розового цвета. Степени окисления: +1, +2.
Cu2O – кристаллическое, нерастворимое в воде вещество кирпично-красного цвета.
CuO – кристаллы чёрного цвета, практически нерастворимые в воде.
CuS — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
Cu2S — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
CuOH — желтое вещество; не растворимо в воде; является неустойчивым и разлагается при нагревании на Cu2O и H2O.
Cu(OH)2 – голубое аморфное или кристаллическое вещество; практически не растворимо в воде.
CuSO4 – кристаллическое вещество белого цвета, хорошо растворяется в воде. Из водных растворов кристаллизуется пентагидрат CuSO4·5H2O – медный купоро́с, кристаллы голубого цвета (при нагревании снова теряет воду и становится белым). Водный раствор CuSO4 также голубого цвета.
2. Цинк – металл голубовато-белого цвета, мягкий, хрупкий. Степень окисления: +2.
ZnO, Zn(OH)2, ZnS – белые твердые вещества, нерастворимые в воде.
3. Алюминий – легкий металл серебристо-белого цвета. Степень окисления: +3.
Al2O3, Al(OH)3 – белые твердые вещества, нерастворимые в воде.
AlPO4 — твёрдое, белое кристаллическое вещество, нерастворимое в воде.
4. Серебро – блестящий белый мягкий пластичный металл. Степень окисления: +1.
AgCl – белое твердое нерастворимое в воде вещество.
AgBr – светло-желтое твердое нерастворимое в воде вещество.
AgI – твердое нерастворимое в воде вещество желтого цвета.
Ag2S — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
Ag2O — твердое нерастворимое в воде вещество черного цвета.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
5. Железо – серебристо-серый мягкий ковкий металл. Степени окисления: +2, +3, +6.
FeO – твердое нерастворимое в воде вещество черного цвета.
Fe(OH)2 – серо-зеленый осадок, студенистый осадок зеленого цвета. Не растворяется в воде.
Fe2O3, Fe(OH)3 – твердые красно-коричневые (бурые), нерастворимые в воде соединения.
Fe3O4 – твердое черное вещество. Не растворяется в воде.
FeCl3 – раствор желтого цвета.
6. Сера – желтое нерастворимое в воде вещество. Степени окисления: -2, +4, +6.
SO2 – бесцветный газ с неприятным запахом; газ, образующийся в момент зажигания спички
H2SO4 – тяжелая бесцветная жидкость, растворяется в воде с сильным разогреванием раствора.
7. Хром — твёрдый металл голубовато-белого цвета.
CrO — твердое вещество ченого цвета.
Cr2O3 — твердое вещество темно-зеленого цвета.
CrO3 — твердое вещество красного цвета.
Na2Cr2O7 и другие дихроматы — соединения оранжевого цвета.
Na2CrO4 и другие хроматы — соединения желтого цвета.
Cr2(SO4)3 — в растворе сине-фиолетового цвета (кислотная среда).
K3[Cr(OH)6] — в растворе зеленого цвета (щелочная среда).
8. Марганец — металл серебристо-белого цвета.
MnO2 — твердое нерастворимое в воде вещество бурого цвета.
Mn(OH)2 — белый осадок.
KMnO4 — пурпурные кристаллы, растворяется в воде с образованием фиолетового раствора.
K2MnO4 — растворимая соль темно-зеленого цвета.
Mn(NO3)2, MnCl2, MnBr2 и некоторые другие соли Mn+2 — как правило, розовые растворимые в воде соединения.
9. Фосфор — неметалл. Основные модификации: белый, красный и черный фосфор.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
AlPO4 — твердое нерастворимое в воде вещество белого цвета.
Li3PO4 — твердое нерастворимое в воде вещество белого цвета.
Ba3(PO4)2 — осадок белого цвета
10. Свинец — ковкий, тяжёлый металл серебристо-белого цвета.
PbS — осадок черного цвета.
PbSO4 — осадок белого цвета.
PbI2 – осадок ярко-желтого цвета.
11. Соединения бария:
BaSO4 – белый осадок нерастворимый в кислотах
BaSO3 – белый осадок растворимый в кислотах
Ba3(PO4)2 — осадок белого цвета
BaCrO4 — осадок желтого цвета
12. Другие соединения:
CaCO3 – осадок белого цвета
NH3 – аммиак, бесцветный газ с резким запахом
CO2 – газ тяжелее воздуха, без цвета и запаха, играющий важную роль в процессе фотосинтеза.
NO2 – газ бурого цвета (лисий хвост)
H2SiO3 – бесцветный студенистый осадок
30 октября 2022
В закладки
Обсудить
Жалоба
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.
priznaki-him-r.pdf
Автор: Фрундина Дарья Андреевна, учитель химии.
Цвета некоторых неорганических соединений.
Для успешного выполнения заданий ЕГЭ требуется помнить внешний вид и цвета соединений. Проще всего их запомнить, один раз увидев. Ниже приводятся фотографии наиболее «популярных» соединений. В подписях под картинками указаны те цвета, которыми в ЕГЭ чаще всего обозначают эти вещества.
| Соединения меди | |
 |
 |
| Металлическая медь, (красный или золотисто-красный) |
Оксид меди (II), (чёрный порошок) |
 |
 |
| Медный купорос, (синее кристаллическое вещество) |
Малахит, (сине-зелёный осадок) |
 |
|
| Гидроксид меди (II), (синий студенистый осадок) |
|
| Соединения железа | |
 |
|
| Оксид железа (III), (красный порошок) |
|
| Соединения хрома | |
 |
 |
| Оксид хрома (III), (зелёный порошок) |
Оксид хрома (VI), (Красные кристаллы) |
 |
 |
| Дихромат калия, (оранжевый порошок или раствор) |
Хромат калия, (жёлтый порошок или раствор) |
| Соединения серебра | |
 |
 |
| Хлорид серебра, (белый творожистый осадок) |
Бромид серебра, (бледно-желтый творожистый осадок) |
 |
 |
| Йодид серебра, (желтый творожистый осадок) |
Фосфат серебра, (жёлтый осадок) |
| Соединения марганца | |
 |
 |
| Перманганат калия, (фиолетовые кристаллы или раствор) |
Манганат калия, (зелёный раствор или кристаллы) |
 |
 |
| Диоксид марганца, (чёрно-коричневый порошок) |
Сульфат марганца (II), (бледно-розовый порошок или раствор) |
| Прочие вещества | |
 |
 |
| Диоксид азота, (бурый газ) |
Бром, (коричневая жидкость с красными парами) |
 |
 |
| Йод, (серо-коричневые кристаллы с фиолетовыми парами) |
Сера, (жёлтый порошок) |
 |
 |
| Красный фосфор, (красный порошок) |
Белый фосфор, (бледно-жёлтое воскообразное вещество) |
Если вам понравился наш материал — записывайтесь на курсы подготовки к ЕГЭ по химии онлайн
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Цвета некоторых неорганических соединений.» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
09.03.2023
Качественные реакции на неорганические вещества и ионы
Теория к заданию 24 из ЕГЭ по химии
Разбор сложных заданий в тг-канале:
Качественные реакции на катионы и анионы некоторых неорганических веществ
Качественные реакции на анионы.
| Анион | Условие, реактив, катион | Признаки и сокращенное ионное уравнение реакции |
| $Cl^{-}$ | Нитрат серебра $Ag^{+}$ | Белый творожистый осадок:$Ag^{+}+Cl^{-}→AgCl↓$ |
| $Br^{-}$ | Нитрат серебра $Ag^{+}$ | Желтоватый творожистый осадок: $Ag^{+}+Br^{-}→AgBr↓$ |
| $I^{-}$ | Нитрат серебра $Ag^{+}$ | Желтый творожистый осадок: $Ag^{+}+I^{–}→AgI↓$ |
| $SO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Белый осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ |
| $NO_3^{-}$ | $H_2SO_4(конц)$ и $Cu$ | Выделение бурого газа: $Cu+NO_3^{-}+2H^{+}=Cu^{2+}+NO_2↑+H_2O$ |
| $PO_4^{3-}$ | Нитрат серебра $Ag^{+} | Ярко-желтый осадок:$3Ag^{+}+PO_4^{3-}→Ag_3PO_4↓$ |
| $CrO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Желтый осадок: $Ba^{2+}+CrO_4^{2-}=BaCrO_4↓$ |
| $S^{2-}$ | Растворимые соли меди $Cu^{2+}$ | Черный осадок: $Cu^{2+}+S^{2–}=CuS↓$ |
| $CO_3^{2-}$ | Кислоты $H^{+}$ | Выделение газа без запаха: $2H^{+}+CO_3^{2-}=H_2O+CO_2↑$ |
| $OH^{-}$ | Лакмус | Синий цвет раствора |
| Фенолфталеин | Малиновый цвет раствора | |
| Метиловый оранжевый | Желтый цвет раствора |
Качественные реакции на катионы.
| Катион | Условие, реактив, анион | Признаки, сокращенное ионное уравнение реакции |
| $H^{+}$ | Лакмус | Красный цвет раствора |
| Метиловый оранжевый | Розовый цвет раствора | |
| $NH_4^{+}$ | Щелочь, $OH^{–}$, $t°$ | Выделение газа с резким запахом: $NH_4^{+}+OH^{-}=NH_3↑+H_2O$ |
| $Ag^{+}$ | Соляная кислота, растворы хлоридов, $Cl^{–} | Белый творожистый осадок: $Ag^{+}+Cl^{–}→AgCl↓$ |
| $Li^{+}$ | Пламя | Красное окрашивание |
| $Na^{+}$ | Пламя | Желтое окрашивание |
| $K^{+}$ | Пламя | Фиолетовое окрашивание |
| $Ca^{2+}$ | Пламя | Кирпично-красное окрашивание |
| Растворы карбонатов, $CO_3^{2−}$ | Белый осадок: $Ca^{2+}+CO_3^{2-}→CaCO_3↓$ | |
| $Ba^{2+}$ | Пламя | Желто-зеленое окрашивание |
| Серная кислота, растворы сульфатов, $SO_4^{2−}$ | Белый (мелкокристаллический) осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ | |
| $Cu^{2+}$ | Пламя | Зеленое окрашивание |
| Вода | Гидратированные ионы $Cu^{2+}$ имеют голубую окраску | |
| Щелочь, $OH^{–}$ | Синий осадок: $Cu^{2+}+2OH^{-}=Cu(OH)_2↓$ | |
| $Fe^{2+}$ | Щелочь, $OH^{–}$ | Зеленоватый осадок: $Fe^{2+}+2OH^{–}=Fe(OH)_2↓$ |
| Красная кровяная соль $K_3[Fe(CN)_6], Fe(CN)_6^{3−}$ | Синий осадок (турнбулева синь): $3Fe^{2+}+2[Fe(CN)_6]^{3-}=Fe_3[Fe(CN)_6]_2↓$ | |
| $Fe^{3+}$ | Щелочь, $OH^{–}$ | Бурый осадок: $Fe^{3+}+3OH^{–}=Fe(OH)_3↓$ |
| Роданид аммония $NH_4SCN, SCN^{–}$ | Кроваво-красный осадок: $3Fe^{3+}+3CNS^{-}⇄Fe(SCN)_3↓$ | |
| $Fe^{3+}$ | Желтая кровяная соль $K_4[Fe(CN)_6]$ | Темно-синий осадок (берлинская лазурь): $4Fe^{3+}+3[Fe(CN)_6]^{4–}=Fe_4[(CN)_6]_3↓$ |
| $Al^{3+}$ | Щелочь, $OH^{–}$ | Желеобразный осадок белого цвета, растворяется в избытке раствора щелочи: $Al^{3+}+3OH^{–}=Al(OH)_3↓$ |
Что такое качественная реакция
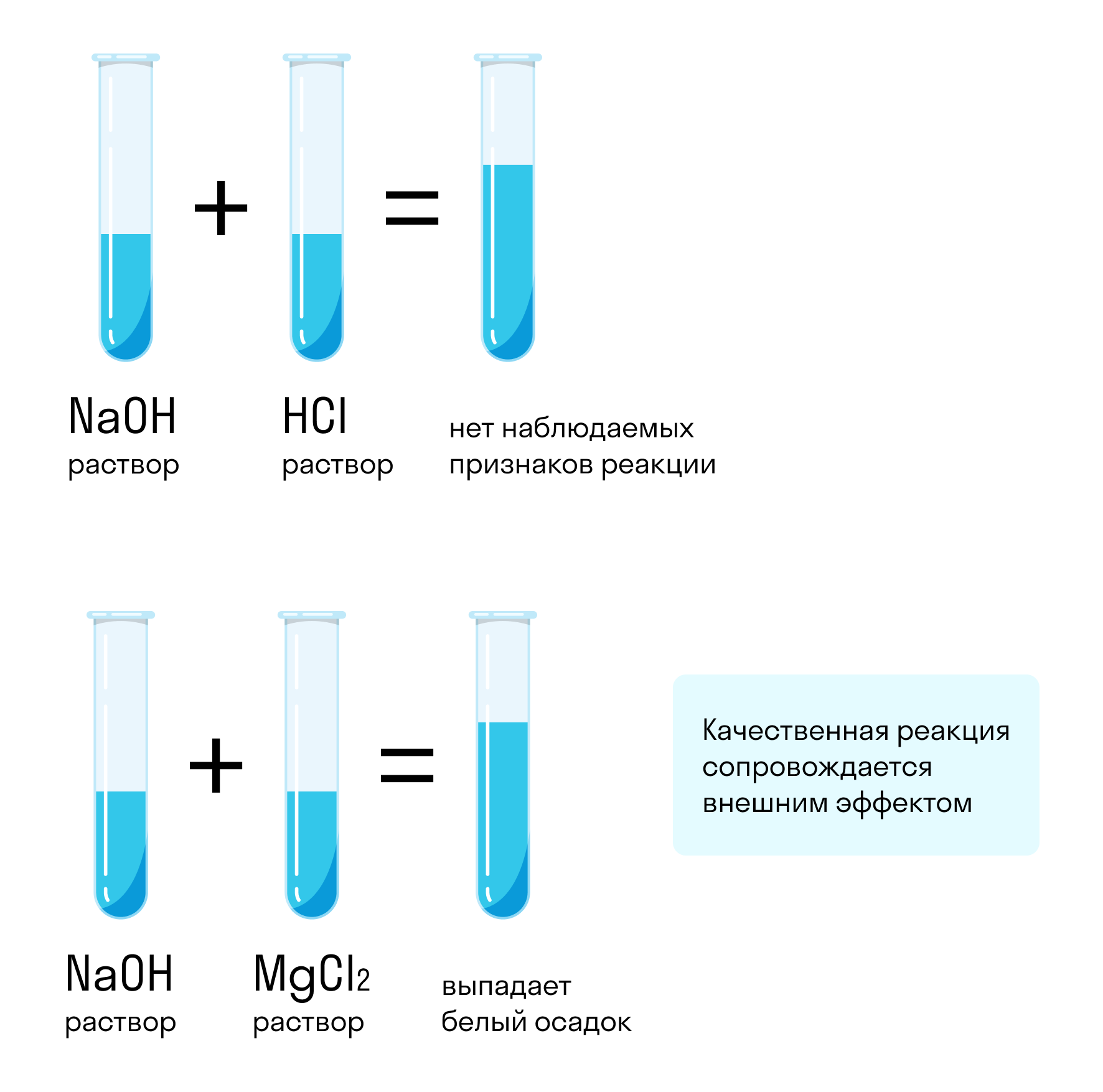
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
-
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
-
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
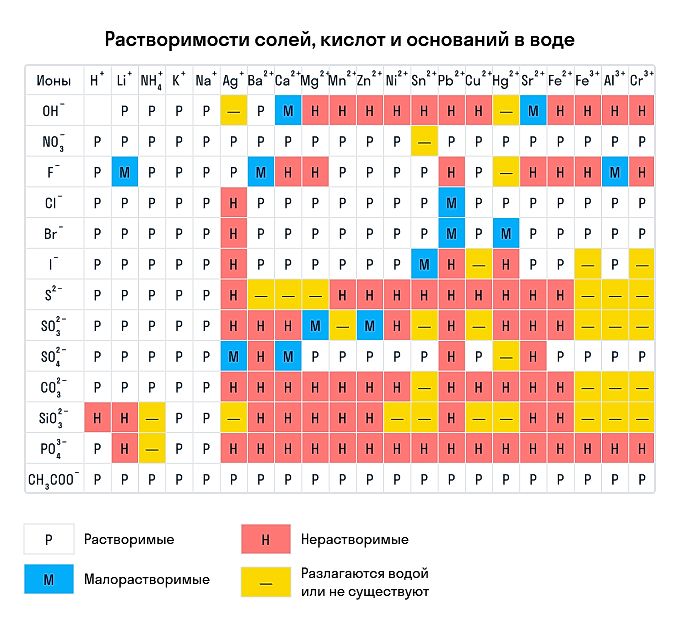
Правила растворимости химических соединений
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
-
абсолютно все нитраты;
-
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
-
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
-
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
-
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
-
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
-
любые карбонаты, фосфаты и сульфиты, кроме K2CO3, K2SO3, K3PO4, Na2CO3, Na2SO3, Na3PO4, (NH4)2CO3, (NH4)2SO3, (NH4)3PO4.
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
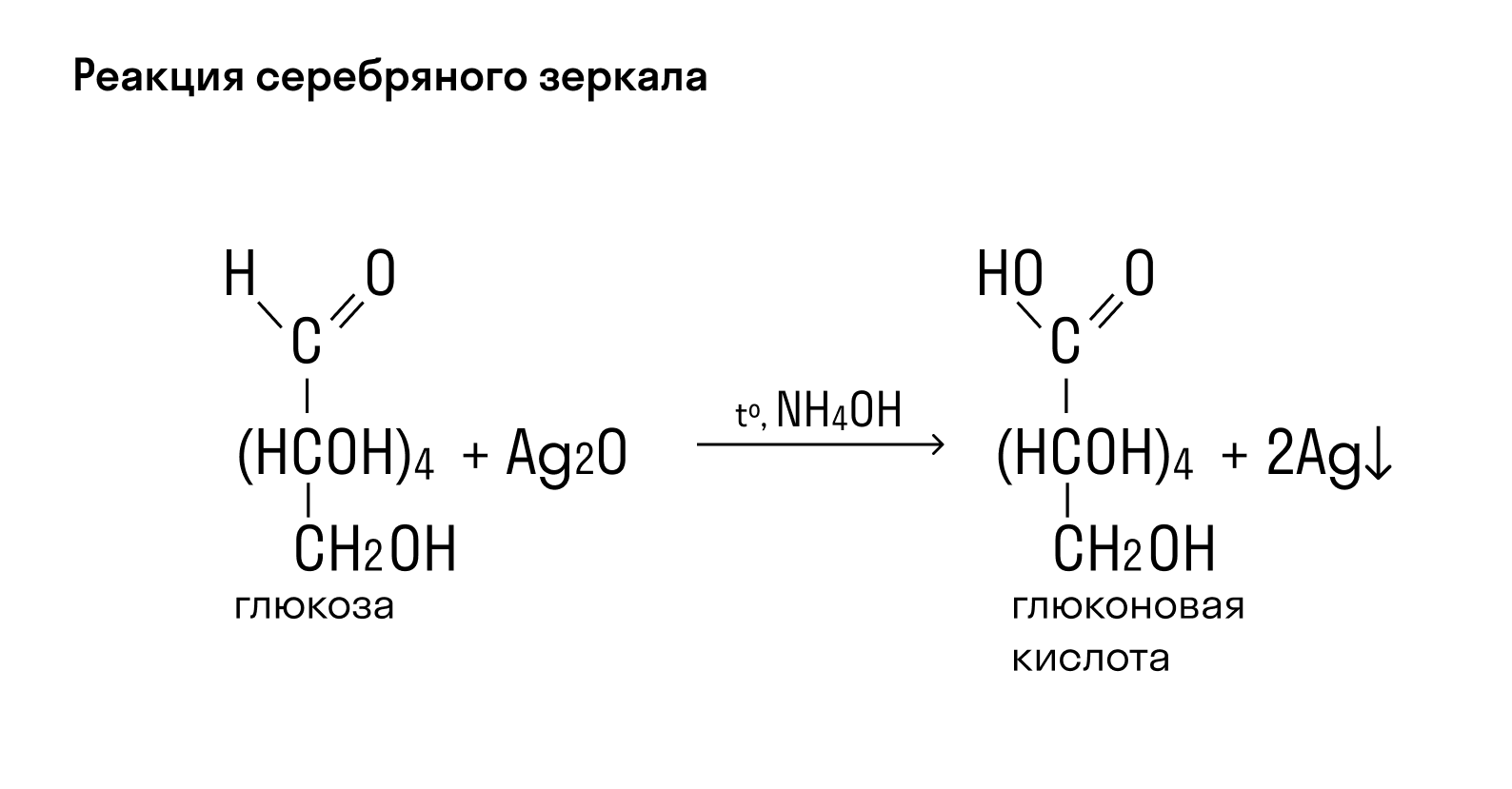
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
C6H5OH + 2Br2 ⇒ C6H2Br3OH + 3HBr — реакция с бромной водой.
3C6H5OH + FeCl3 ⇒ (C6H5O)3Fe + 3HCl — реакция с хлоридом железа (III).
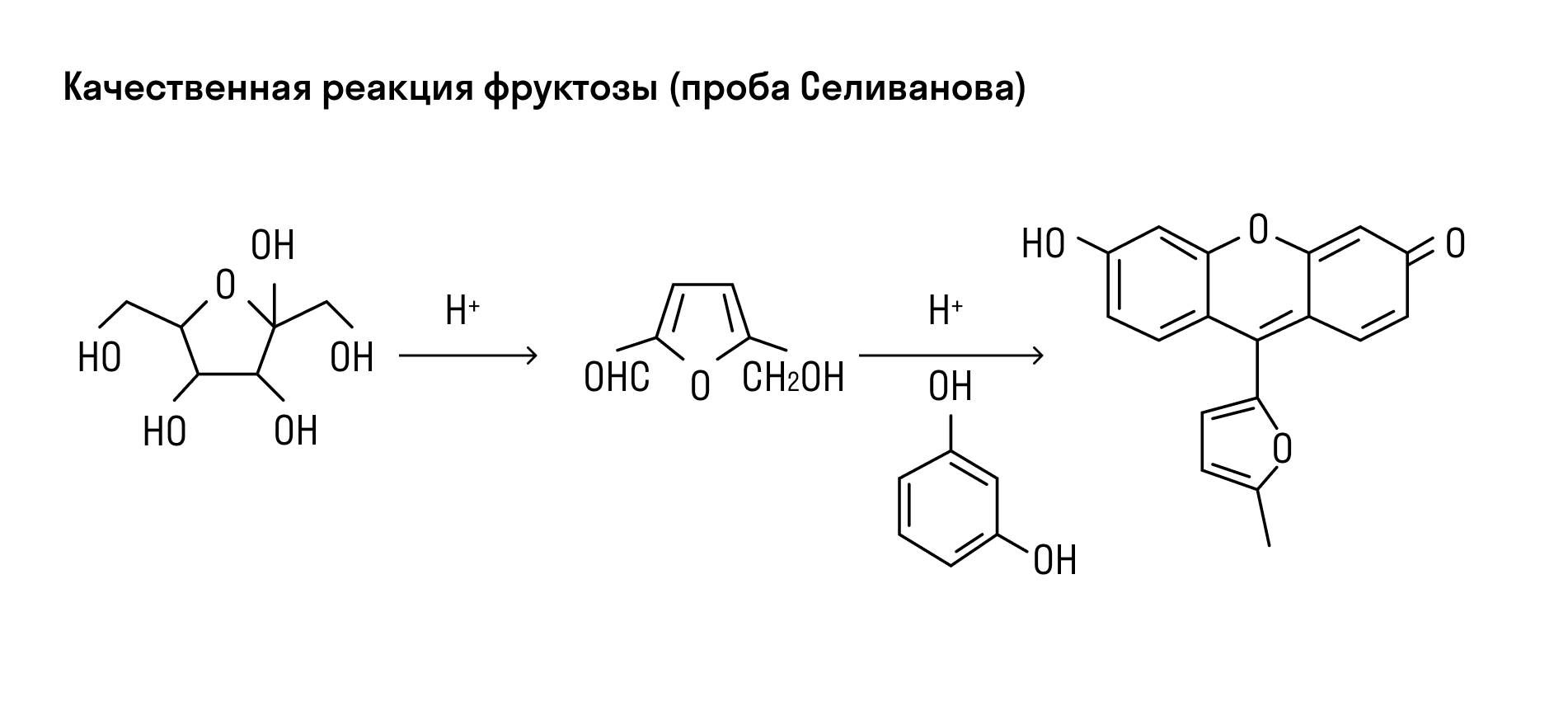
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
I2 + (C6H10O5)n ⇒ I2(C6H10O5)n— качественная реакция крахмала с йодом.
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
4.1.4. Качественные реакции на неорганические вещества и ионы.
Представим себе такую ситуацию:
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:

Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
- Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2NaOH + MgCl2 = Mg(OH)2 ↓+ 2NaCl
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
а с нитратом серебра с образованием белого творожистого осадка AgCl
HCl + AgNO3 = HNO3 + AgCl↓
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
| Катион | Реактив | Признак реакции |
| Ba2+ | SO42- |
Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
| Cu2+ |
1) OH− 2) S2- |
1) Выпадение осадка голубого цвета: Cu2+ + 2OH− = Cu(OH)2↓ 2) Выпадение осадка черного цвета: Cu2+ + S2- = CuS↓ |
| Pb2+ | S2- |
Выпадение осадка черного цвета: Pb2+ + S2- = PbS↓ |
| Ag+ | Cl− |
Выпадение белого осадка, не растворимого в HNO3, но растворимого в аммиаке NH3·H2O: Ag+ + Cl− → AgCl↓ |
| Fe2+ |
1) OH− 2) Гексацианоферрат (III) калия (красная кровяная соль) K3[Fe(CN)6] |
1) Выпадение белого осадка, зеленеющего на воздухе: Fe2+ + 2OH− = Fe(OH)2↓ 2) Выпадение синего осадка (турнбулева синь): K+ + Fe2+ + [Fe(CN)6]3- = KFe[Fe(CN)6]↓ |
| Fe3+ |
1) OH− 2) Гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6] 3) Роданид-ион SCN− |
1) Выпадение осадка бурого цвета: Fe3+ + 3OH− = Fe(OH)3↓ 2) Выпадение синего осадка (берлинская лазурь): K+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6]↓ 3) Появление интенсивно-красного (кроваво-красного) окрашивания: Fe3+ + 3SCN− = Fe(SCN)3 |
| Al3+ | Щелочь (амфотерные свойства гидроксида) |
Выпадение белого осадка гидроксида алюминия при приливании небольшого количества щелочи: OH− + Al3+ = Al(OH)3 и его растворение при дальнейшем приливании: Al(OH)3 + NaOH = Na[Al(OH)4] |
| NH4+ | OH−, нагрев |
Выделение газа с резким запахом: NH4+ + OH− = NH3↑ + H2O Посинение влажной лакмусовой бумажки |
| H+ (кислая среда) |
Индикаторы: − лакмус − метиловый оранжевый |
Красное окрашивание |
Качественные реакции на анионы
| Анион | Воздействие или реактив | Признак реакции. Уравнение реакции |
| SO42- | Ba2+ |
Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
| NO3− |
1) Добавить H2SO4 (конц.) и Cu, нагреть 2) Смесь H2SO4 + FeSO4 |
1) Образование раствора синего цвета, содержащего ионы Cu2+, выделение газа бурого цвета (NO2) 2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца») |
| PO43- | Ag+ |
Выпадение светло-желтого осадка в нейтральной среде: 3Ag+ + PO43- = Ag3PO4↓ |
| CrO42- | Ba2+ |
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl: Ba2+ + CrO42- = BaCrO4↓ |
| S2- | Pb2+ |
Выпадение черного осадка: Pb2+ + S2- = PbS↓ |
| CO32- |
1) Ca2+ 2) H+ |
1) Выпадение белого осадка, растворимого в кислотах: Ca2+ + CO32- = CaCO3↓ 2) Выделение бесцветного газа («вскипание»), вызывающее помутнение известковой воды: CO32- + 2H+ = CO2↑ + H2O Ca(OH)2 + CO2 = CaCO3↓ + H2O |
| CO2 | Известковая вода Ca(OH)2 |
Выпадение белого осадка и его растворение при дальнейшем пропускании CO2: Ca(OH)2 + CO2 = CaCO3↓ + H2O CaCO3 + CO2 + H2O = Ca(HCO3)2 |
| SO32- | H+ |
Выделение газа SO2 с характерным резким запахом (SO2): 2H+ + SO32- = H2O + SO2↑ |
| F− | Ca2+ |
Выпадение белого осадка: Ca2+ + 2F− = CaF2↓ |
| Cl− | Ag+ |
Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц.): Ag+ + Cl− = AgCl↓ AgCl + 2(NH3·H2O) = [Ag(NH3)+ + Cl− + 2H2O |
| Br− | Ag+ | Выпадение светло-желтого осадка, не растворимого в HNO3:
Ag+ + Br− = AgBr↓ (осадок темнеет на свету) |
| I− | Ag+ | Выпадение желтого осадка, не растворимого в HNO3 и NH3·H2O(конц.):
Ag+ + I− = AgI↓ (осадок темнеет на свету) |
| OH− (щелочная среда) |
Индикаторы: — лакмус — фенолфталеин |
— синее окрашивание — малиновое окрашивание |