Карбонат кальция

Характеристика карбонат кальция

Плотность карбоната кальция
Плотность (кальцит) 2,74 г/см³, (арагонит) 2,83 г/см³.
Температура плавления карбонат кальция
Температура плавления (кальцит) 825° C, (арагонит) 1339° C,
Температура разложения карбоната кальция
Температура разложения 900-1000° C.
Формула карбоната кальция
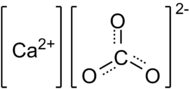
Химическая формула: CaCO3.
Получение карбоната кальция
Кальция карбонат получают взаимодействием известкового молока с углекислотой или хлоридом кальция (СаСl2) с карбонатом натрия (Na2CO3) в водном растворе.
Применение карбоната кальция
Кальция карбонат (углекислый кальций, мел, кальциевая соль угольной кислоты) применяется:
- в лакокрасочной промышленности, в производстве красок и отделочных материалов;
- в химической промышленности при производстве карбида кальция;
- в стекольной промышленности при изготовлении стекла;
- в строительстве при производстве шпатлевок, различных герметиков и др.;
- в сельском хозяйстве, как известковое удобрение и для комплексного агрохимического окультуривания полей;
- в качестве наполнителя для резиновых смесей, бумаги, линолеума;
- в медицине как антацидное, противоязвенное, восполняющее дефицит кальция средство;
- в косметической промышленности при производстве зубного порошка, как наполнитель косметических средств;
- в пишевой промышленности, как пищевая добавка краситель E170.
Таблица 1. Физико-химические показатели карбоната кальция
| Наименование показателя | Норма |
|---|---|
| Содержание хлоридов, %, не более | 0,033 |
| Содержание cульфатов, %, не более | 0,25 |
| Содержание мышьяка (As), %, не более | 0,0001 |
| Содержание бария (Ba), %, не более | 0,0001 |
| Содержание железа (Fe), %, не более | 0,01 |
| Содержание фтора (F), %, не более | 0,005 |
| Содержание ртути (Hg), %, не более | 0,00005 |
| Содержание свинца (Pb), %, не более | 0,0003 |
| Содержание тяжелых металлов, %, не более | 0,002 |
Электрические свойства наполнителей на основе карбоната кальция (2 таблицы):
Таблица 2.
| Диэлектрическая проницаемость (при 17-22°C) при 104 Гц: | |
|---|---|
| кальцит в направлении, перпендикулярном оптической оси | 8,5 |
| кальцит в направлении параллельном оптической оси | 8,0 |
| Диэлектрическая проницаемость (при 17-22°C) при 108 Гц: | |
| доломит, в направлении, перпендикулярном оптической оси | 8,0 |
| доломит, в направлении параллельном оптической оси | 6,8 |
Таблица 3.
| Удельное электрическое сопротивление мрамора при 20°C: | |
|---|---|
| объемное, Ом·см | 109-1011 |
| поверхностное при 50%-ной отн. влажности, Ом | (3-8)·109 |
| поверхностное при 90%-ной отн. влажности, Ом | (1-3)·107 |
| Удельное электрическое сопротивление дисперсии 5г CaCO3 в 100 мл воды при 23 °C, Ом: | |
| кальцит (CaCO3) | 17 000-25 000 |
| доломит (CaCO3·MgCO3) | 3 000-5 000 |
| pH кальцита | 9,0-9,5 |
| pH доломита | 9-10 |
| Удельное объемное электрическое сопротивление ПВХ композиции электроизоляционного назначения при 50°C, Ом·см | >4·1014 |
Таблица 4. Физические свойства различных типов карбонатов.
| Показатели | Кальцит CaCO3 (наиболее устойчивая модификация) | Арагонит CaCO3 (метастабильная модификация, переходит в кальцит) | Доломит CaCO3-MgCO3 (45% масс. MgCO3) | Магнезит MgCO3 |
|---|---|---|---|---|
| Плотность, кг/м3 | 2600 — 2750 | 2920 — 2940 | 2800 — 2900 | 3000 — 3100 |
| Твердость по Мосу | 3,0 | 3,5 — 4,0 | 3,5 — 4,0 | 3,5 — 4,5 |
| Содержание растворимых фракций | 0,99·10-8 (при 15°C)0,87·10-8 (при 25°C) | — | — | 2,6·10-5 (при 12°C) |
| Растворимость при 18°С | ||||
| г/100 г воды | 0,0013 | 0,0019 | 0,032 | 0,0106 |
| г/100 г водного раствора СО2 | 0,13 | 0,19 | 3,2 | 1,06 |
| Температура разложения, °C | 900 | 825, переходит в кальцит при Т>400°C | 730-760 | 350 |
| Природные источники | Известняк, мрамор, известковый шпат, яичная скорлупа, кости (с примесью фосфата кальция), горные породы (в сочетании с доломитом) | Панцири моллюсков, кораллы.Образуется при Т>30°C; переходит в кальцит при Т>400°C и Т<30°C | — | — |
Статьи по теме

Основные пигменты
Название элемента хрома происходит от греческого слова «хром», что означает «цвет», «краска». Оксид хрома — лишь одно из ярко окрашенных соединений элемента № 24.

Окрашивание пигментами
Пигменты полидисперсны; гранулометрии, (дисперсионный) состав их оказывает большое влияние на оптич. и технико-эко-номич. характеристики.

Красящие пигменты
Сегодня лакокрасочная продукция является достаточно распространенной. Она предназначена не только для нанесения декоративного слоя на различные виды поверхностей, но и для защиты отдельных видов материалов от появления ржавчины или коррозии.
Физические свойства
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Способ получения
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция, образуется карбонат кальция и хлорид натрия:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
CaO + CO2 = CaCO3
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Ca(OH)2 + СO2 = CaСO3 + H2O
Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
CaCO3 = CaO + CO2
2. Карбонат кальция вступает в реакцию со многими сложными веществами:
2.1. Карбонат кальция реагирует с оксидами:
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
CaCO3 + SiO2 = CaSiO3 + CO2
2.2. Карбонат кальция реагирует с кислотами:
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой. Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
CaCO3 + 2HF = CaF2↓ + CO2↑ + H2O
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
CaCO3 + H2S = CaS + H2O + CO2
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
| Карбонат кальция | |
 |
|
  |
|
| Общие | |
|---|---|
| Систематическое наименование | карбонат кальция |
| Традиционные названия | углекислый кальций |
| Химическая формула | CaCO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдые белые кристаллы |
| Молярная масса | 100.0869 г/моль |
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ |
| Термические свойства | |
| Температура плавления | (кальцит) 825 °C, (арагонит) 1339 °C |
| Температура разложения | 900−1000 °C |
| Химические свойства | |
| pKa | 9.0 |
| Растворимость в воде | (25 °C) 0.00015 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,60 |
| Структура | |
| Кристаллическая структура | тригональная, пространств. гр. 32/m |
| Безопасность | |
| Токсичность |
0 0 0 |
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — 
Зарегистрирован как белый пищевой краситель (E170).
Содержание
- 1 Применение
- 1.1 Массовое производство/использование
- 1.2 Строительство
- 2 Нахождение в природе
- 3 Геология
- 4 Изготовление
- 5 Химические свойства
- 6 Примечания
- 7 Ссылки
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Таблетки из карбоната кальция
Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Строительство — еще один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
- Арагонит
- Кальцит
- Фатерит (или μ-CaCO3)
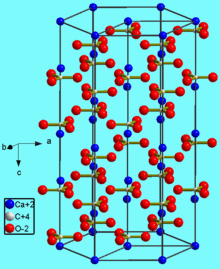
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
- Мел
- Известняк
- Мрамор
- Травертин
-
Кальцит
-
Арагонит
-
Мрамор
-
Травертин
Геология
Карбонат часто встречается в геологической среде. Он находится как полиморф. Полиморфами являются минералы с той же химической формулой, но разной химической структуры. Арагонит, кальцит, известняк, мел, мрамор, травертин, туф и др. — все они имеют формулу CaCO3, но каждый из них имеет несколько иной химический состав. Кальцит, как карбонат кальция, геологи обычно находят в морских условиях. Также кальцит, как правило, находится около теплых тропических условий. Это связано с его химией и свойствами. Кальцит может выпадать чаще как осадок в теплой среде, чем в холодной, поскольку теплая среда не дает улетучиваться в больших объемах CO2. Это аналогично тому как CO2 растворяется в воде. Когда вы открываете крышку пластиковой бутылки происходит выделение CO2. Из-за того что сода нагревается, выделяется углекислый газ. Этот же принцип может быть применен к кальциту и в океане. Карбонаты данного вещества в холодной воде существуют в более высоких широтах, но имеют очень медленный темп роста.
В тропических условиях вода теплая и чистая. Таким образом, вы можете увидеть много кораллов в данной среде по сравнению с холодной, где вода холодная. Производители карбоната кальция, такие как кораллы, водоросли и микроорганизмы, которые обычно встречаются в мелководных водоемах, как фильтраторы, требуют солнечный свет для производства карбоната кальция.
Изготовление
Подавляющее большинство карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из чистого источника (как правило, мрамор).
В качестве альтернативы карбонат кальция может быть приготовлен кальцинацией оксида кальция. Вода добавляется к этому оксиду, давая гидроксид кальция, и затем проводится углекислый газ, который проходит через этот раствор для осаждения желаемого карбоната кальция[1]:
Химические свойства
При нагревании до 900−1000 °C расщепляется на кислотный оксид — углекислый газ CO2 и оксид — негашёную известь CaO по уравнению:
.
В воде с углекислым газом растворяется, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
.
Существование именно этой реакции дает возможность образовываться сталактитам, сталагмитам и прочим красивейшим формам, да и вообще развиваться карсту.
При 1500 °C вместе с углеродом образует карбид кальция и оксид углерода (II)
.
Примечания
- ↑ Solvay Precipitated Calcium Carbonate: Production. Solvay S. A. (9 марта 2007). Архивировано из первоисточника 9 февраля 2012.
Ссылки
- Польза и возможный вред от карбоната кальция как пищевой добавки — е170
Шаблон:АТХ код A02
Карбонат кальция: способы получения и химические свойства
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Способ получения
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Источник
Карбонат кальция
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — 
Содержание
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Строительство — еще один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Источник
Карбонат кальция, характеристика, свойства и получение, химические реакции
Карбонат кальция, характеристика, свойства и получение, химические реакции.
Карбонат кальция – неорганическое вещество, имеет химическую формулу СаСО3.
Краткая характеристика карбоната кальция:
Карбонат кальция – неорганическое вещество белого цвета.
Химическая формула карбоната кальция СаСО3.
Карбонат кальция при прокаливании разлагается. Однако при избыточном давлении углекислого газа (СО2) плавится без разложения.
Встречается в виде трех кристаллических модификаций:
– кальцита (известняк, мел, мрамор);
– фатерита или ватерита.
Кальцит и арагонит являются устойчивыми кристаллическими модификациями. Фатерит является наименее стабильной разновидностью карбоната кальция, и очень быстро превращается в воде либо в кальцит, либо в арагонит. Фатерит в природе встречается относительно редко.
Зарегистрирован как белый пищевой краситель E170.
Физические свойства карбоната кальция:
| Карбонат кальция | |
 |
|
  |
|
| Общие | |
|---|---|
| Систематическое наименование | карбонат кальция |
| Традиционные названия | углекислый кальций |
| Химическая формула | CaCO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдые белые кристаллы |
| Молярная масса | 100.0869 г/моль |
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ |
| Термические свойства | |
| Температура плавления | (кальцит) 825 °C, (арагонит) 1339 °C |
| Температура разложения | 900−1000 °C |
| Химические свойства | |
| pKa | 9.0 |
| Растворимость в воде | (25 °C) 0.00015 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,60 |
| Структура | |
| Кристаллическая структура | тригональная, пространств. гр. 3 2/m |
| Безопасность | |
| Токсичность |
| Наименование параметра: | Значение: |
| Химическая формула | СаСО3 |
| Синонимы и названия иностранном языке | calcium carbonate (англ.) |
углекислый кальций (рус.)Тип веществанеорганическоеВнешний видбелые тригональные кристаллыЦветбелыйВкусбез вкусаЗапахбез запахаАгрегатное состояние (при 20 °C и атмосферном давлении 1 атм.)твердое веществоПлотность арагонита (состояние вещества – твердое вещество, при 20 °C), кг/м 32830Плотность арагонита (состояние вещества – твердое вещество, при 20 °C), г/см 32,83Плотность кальцита (состояние вещества – твердое вещество, при 20 °C), кг/м 32740Плотность кальцита (состояние вещества – твердое вещество, при 20 °C), г/см 32,74Температура разложения, °C900-1000Температура плавления арагонита, °C1339Температура плавления кальцита, °C825Молярная масса, г/моль100,0869Растворимость в воде (25 o С), г/л0,013
Получение карбоната кальция:
Промышленный способ получения карбоната кальция заключается в разработке его месторождений в природе.
В лаборатории карбонат кальция получают гашением негашеной извести и последующим продуванием углекислого газа.
Так как гидроксид кальция растворяется в воде в небольшом количестве, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода (углекислого газа). В результате образуется карбонат кальция, который выпадает в осадок.
Химические свойства карбоната кальция. Химические реакции карбоната кальция:
Карбонат кальция – это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная кислота H2CO3).
Водные растворы CaCO3 имеют слабую щелочную реакцию.
1. реакция термического разложения карбоната кальция – обжиг известняка:
В результате реакции образуются оксида кальция и оксид углерода (IV). Обжиг известняка – это промышленный способ получения углекислого газа. Технологически этот процесс в промышленности реализуют в специальных шахтных печах.
2. реакция карбоната кальция и углерода (графита, кокса):
CaCO3 + C → CaO + 2CO (t = 800-850 °C).
В результате реакции образуются оксид кальция и оксида углерода (II).
3. реакция карбоната кальция и фтороводорода:
4. реакция взаимодействия карбоната кальция и сероводорода:
В результате реакции образуются сульфид кальция, вода и оксид углерода (IV).
Аналогичные реакции протекают и с другими галогеноводородами.
5. реакция взаимодействия карбоната кальция и азотной кислоты:
6. реакция взаимодействия карбоната кальция и угольной кислоты:
В результате реакции образуется гидрокарбонат кальция.
7. реакция взаимодействия карбоната кальция и бромной кислоты:
В результате реакции образуются бромат кальция, вода и оксид углерода (IV).
Аналогично проходят реакции карбоната кальция и с другими кислотами.
8. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
В результате реакции образуется гидрокарбонат кальция. Реакция протекает при комнатной температуре.
9. реакция взаимодействия карбоната кальция и оксида кремния:
В результате реакции образуются метасиликат кальция и оксида углерода (IV).
10. реакция взаимодействия карбоната кальция и оксида титана:
В результате реакции образуются титанат кальция и оксида углерода (IV). Реакция протекает при сплавлении реакционной смеси.
11. реакция взаимодействия карбоната кальция, оксида серы и кислорода:
В результате реакции образуются сульфат кальция и оксида углерода (IV). Данная реакция представляет собой метод очистки смеси газов от SO2.
12. реакция взаимодействия карбоната кальция, оксида свинца и кислорода:
13. реакция взаимодействия карбоната кальция и гидроксида натрия:
В результате реакции образуются карбонат натрия и гидроксид кальция. При этом гидроксид натрия в качестве исходного вещества используется в виде водного раствора.
14. реакция взаимодействия карбоната кальция и хлорида аммония:
В результате реакции образуются хлорид кальция, аммиак, вода и оксид углерода (IV). Реакция протекает при кипении.
15. реакция взаимодействия карбоната кальция и сульфида калия:
В результате реакции образуются карбонат калия и сульфид кальция.
16. реакция взаимодействия карбоната кальция и сульфида натрия:
В результате реакции образуются карбонат натрия и сульфид кальция.
Применение и использование карбоната кальция:
Карбонат кальция используется во множестве отраслей промышленности и для бытовых нужд:
– для письма на досках;
– в быту для побелки потолков, покраски стволов деревьев;
– в целлюлозно-бумажной промышленности – в производстве бумаги в качестве отбеливателя, наполнителя, а также раскислителя;
– в качестве пищевой добавки в пищевой промышленности;
– при производстве предметов гигиены (например, зубной пасты) и лекарственных средств;
– при производстве силикатного стекла ;
– в качестве наполнителя при производстве шпаклёвок и герметиков,
Примечание: © Фото //www.pexels.com, //pixabay.com
карбонат кальция реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие карбоната кальция
реакции
Источник
Оксид кальция: способы получения и химические свойства
Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Источник
Оксид кальция

Всего получено оценок: 119.
Всего получено оценок: 119.
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.
Физические свойства
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
Общее описание вещества представлено в таблице.
Признак
Значение
Формула соединения оксид кальция
В глицерине. В этаноле не растворяется, с водой образует гидроксид
Химическая связь в кристалле
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.
Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Реакция получения оксида кальция из известняка выглядит следующим образом:
Кроме того, негашёную известь можно получить двумя способами:
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Реакции
Что образуется
Молекулярное уравнение
Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла
Растворяется, образуя соли
С оксидами неметаллов (кислотными остатками)
С углеродом при нагревании
Образуется карбид кальция
Восстанавливает кальций. Образуется оксид алюминия
Применение
Оксид используется в пищевой промышленности в качестве:
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
Что мы узнали?
Оксид кальция или негашёная известь – кристаллическое вещество, бурно реагирующее с водой и образующее гашёную известь. Широко используется в промышленности, в частности пищевой и строительной. Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Источник
Карбонат кальция — это неорганическое соединение, которое довольно широко используется в быту и промышленности. Это природное сырье также известно как кальцит или соль угольной кислоты и кальция. Каковы характеристики карбоната кальция? Вреден ли он? Какова роль карбоната кальция в почве и что из него можно получить? Ответы содержатся ниже.

Карбонат кальция: формула, свойства, паспорт безопасности
Что такое карбонат кальция? CaCO3 — это сводная формула, описывающая белый или прозрачный минерал в виде кристаллов. Карбонат кальция (обычное название — кальцит) состоит из солей угольной кислоты и кальция.
Каковы характеристики карбоната кальция? У этого неорганического соединения следующие физические свойства и химические свойства:
- карбонат кальция очень слабо растворим в воде (при растворении в воде с добавлением углекислого газа превращается в бикарбонат кальция, т. е. гидрокарбонат кальция),
- при нагревании происходит разложение карбоната кальция — тогда выделяется оксид кальция и углекислый газ (термическое разложение карбоната кальция и прокаливание карбоната кальция возможны при температуре выше 800 °С)
- вступает в реакцию с кислотами (например, сочетание карбоната кальция и соляной кислоты приводит к бурному выделению углекислого газа).
Соединение CaCO3 находит применение также в фармакологии. В каком виде? Медицинский карбонат кальция, известный как Calcium Carbonate, является лекарственным средством, используемым в качестве добавки кальция при заболеваниях нервной системы, почек, мышц, суставов и костей.
Карбонат кальция — применение в строительстве
В течение столетий люди ценили природное сырье, которым и является карбонат кальция. CaCO3 имеет низкую растворимость в воде, а сам порошок прекрасно подходит для производства цемента, одного из основных ингредиентов растворов для кладки и штукатурки. Кальцит образует качественные, прочные вяжущие вещества, которые имеют многолетний срок службы внутри и снаружи зданий.
Карбонат кальция для вина и пищевых продуктов
Можно ли снизить кислотность вина карбонатом кальция? Конечно! Производители и любители домашнего вина используют CaCO3 в критических ситуациях, когда сусло или конечный продукт слишком кислые и непригодны для употребления. После добавления небольшого количества карбоната кальция вино приобретает свой отчетливый естественный вкус.
В пищевой промышленности карбонат кальция известен как добавка Е170. Среди прочего, используется для приготовления кондитерских изделий, жевательных резинок, некоторых видов хлебобулочных изделий, чипсов и печенья.
Карбонат кальция в косметике
Реакция получения карбоната кальция относительно проста, быстра и экономична, поэтому CaCO3 также находит применение в косметической промышленности. Белый сухой порошок используют для изготовления пудр, присыпок, теней для век или косметических основ. Ввиду своего отбеливающего эффекта карбонат кальция также является очень распространенным ингредиентом зубных паст.
Карбонат кальция: применение — сельское хозяйство и животноводство
Карбонат кальция широко используют в сельском хозяйстве и животноводстве — известковое удобрение удобряет бесплодную почву, а смеси с добавлением Calcium Carbonate прекрасно дополняют рацион животных. Содержание карбоната кальция в почве — это показатель, который многое говорит о качестве почвы — чем меньше в ней содержится CaCO3, тем менее плодороден и стабилен грунт.
На фермах молочного скота используют бикарбонат кальция для коров, чтобы стимулировать лактацию и укреплять пищеварительную систему животных. Карбонат кальция для крупного рогатого скота, как и карбонат кальция для кур, положительно влияет на общее состояние поголовья, предотвращая закисление, слабость и заболевания.
Карбонат кальция: интересные факты
Количество различных возможных применений CaCO3 действительно впечатляет! В настоящее время карбонат кальция используют также как:
- средство от изжоги и повышенной кислотности желудка,
- полуфабрикат для производства школьного мела,
- ингредиент отбеливателей,
- пигмент.
Кроме того, стоит выделить роль карбоната кальция в промышленном умягчении воды. Этот процесс происходит по несколько иному механизму, чем при использовании хелатирующих продуктов, но он также является эффективным. При поиске качественных умягчителей воды стоит ознакомиться с предложением Группы РСС, в котором доступна серия EXOlat. Более подробную информацию об этом можно найти на Портале продукции!
Выше приведены, конечно же, не все возможные способы использования сырья, которым является карбонат кальция. Действие этого соединения многогранно, что открывает промышленности несчетное множество перспектив.










 .
. .
. .
.