Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
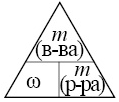
При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н. у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Источник: Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ—2020 по химии, Демонстрационная версия ЕГЭ−2019 по химии
2
Навеску гидрокарбоната натрия прокаливали в течение непродолжительного времени и получили твёрдый остаток массой 44,4 г. При растворении этого остатка в 400 г раствора азотной кислоты, взятой в избытке, выделилось 10,08 л (н. у.) газа. Найдите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления с указанием единиц измерения искомых физических величин.
3
Навеску основного карбоната меди прокаливали в течение непродолжительного времени и получили твёрдый остаток массой 98,6 г. При растворении этого остатка в 800 г раствора серной кислоты, взятой в избытке, выделилось 6,72 л (н. у.) газа. Найдите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления с указанием единиц измерения искомых физических величин. Относительную атомную массу меди примите равной 64.
4
Навеску технического карбоната кальция массой 8,00 г растворили в избытке соляной кислоты. К полученному раствору добавили избыток оксалата аммония, выпавший осадок отфильтровали и прокалили при температуре
до постоянной массы. Полученный порошок взвесили, его масса составила 4,03 г. Определите массовую долю карбоната кальция в техническом образце и объём газа (н. у.), выделившегося при его растворении в соляной кислоте. Примите, что технический образец содержит только некарбонатные примеси. Напишите уравнения всех проведённых реакций.
5
Железную проволоку массой 0,295 г растворили при нагревании в избытке разбавленной азотной кислоты. К полученному раствору добавили избыток раствора аммиака, выпавший осадок отфильтровали и прокалили до постоянной массы. Полученный порошок взвесили, его масса составила 0,400 г. Определите массовую долю железа в проволоке и объём оксида азота(II) (н. у.), выделившегося при растворении железа в азотной кислоте.
Напишите уравнения всех проведённых реакций.
Пройти тестирование по этим заданиям
Задачи на частичное разложение — это задачи, в которых исходное вещество распадается только частично, то есть часть исходного вещества остается. При разложении твердого вещества может образоваться новый твердый продукт, но также остается часть исходного реагента, который не разложился. Это необходимо учитывать при составлении химических реакций.
По сути, это одна из разновидностей задач на материальный баланс.
Рассмотрим несколько примеров решения задач на частичное разложение из реальных ЕГЭ по химии.
1. При нагревании образца нитрата алюминия часть вещества разложилась. При этом выделилось 10,08 л (в пересчёте на н.у.) смеси газов. Для полного растворения образовавшегося твёрдого остатка необходимо затратить 60 г 40%-ного раствора гидроксида натрия. При этом образовался тетрагидроксоалюминат натрия. Определите массу исходного образца нитрата алюминия.
Решение:
Реакция разложения нитрата алюминия:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
Из условия известно, что распалась только часть исходного вещества.
Количество вещества смеси газов:
nсм = V/Vm = 10,08 л/22,4 л/моль = 0,45 моль
Примем количество образовавшегося кислорода за х моль:
n(О2) = x моль
тогда количество вещества оксида азота (IV) равно 4х моль:
n(NО2) = 4x моль
Получаем уравнение:
х + 4х = 0,45
5х = 0,45
х = 0,09 моль
Количество образовавшегося оксида алюминия:
n(Al2О3) = 0,06 моль
Количество и масса разложившегося нитрата алюминия:
nразлож(Al(NО3)3) = 0,12 моль
mразлож(Al(NО3)3) = n·M = 0,12 моль · 213 г/моль = 25,56 г
С гидроксидом натрия реагирует и образовавшийся оксид алюминия, и остаток нитрата алюминия:
Al(NO3)3 + 4NaOH = Na[Al(OH)4] + 3NaNO3
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Определим массу и количество вещества гидроксида натрия:
m(NaOH) = ω(NaOH)·mр-ра(NaOH) = 0,40 ·60 г = 24 г
n(NaOH) = m(NaOH)/M(NaOH) = 24 г/40 г/моль = 0,6 моль
Определим количество гидроксида натрия, который потребуется для растворения оксида алюминия во второй реакции:
n2(NaOH) = 2n(Al2О3) = 2·0,06 моль = 0,12 моль
Тогда в первой реакции будет израсходовано:
n1(NaOH) = n(NaOH) – n2(NaOH) = 0,6 моль – 0,12 моль = 0,48 моль
Количество неразложившегося нитрата алюминия, который затем растворится в щелочи в первой реакции:
nнеразлож.(Al(NО3)3) = 1/4·n1(NaOH) = 1/4·0,48 моль = 0,12 моль
Масса этого неразложившегося нитрата алюминия:
mнеразлож.(Al(NО3)3) = nнеразлож.(Al(NО3)3)·M = 0,12 моль·213 г/моль = 25,56 г.
Масса исходного нитрата алюминия:
m(Al(NО3)3) = mразлож.(Al(NО3)3) + mнеразлож.(Al(NО3)3) = 25,56 г + 25,56 г = 51,12 г
Ответ: m(Al(NO3)3) = 51,12 г
2. При нагревании карбоната магния часть вещества разложилась. При этом выделилось 5,6 л газа и образовалось 18,4 г твёрдого остатка. Остаток растворили в 365 г соляной кислоты, при этом массовая доля кислоты в конечном растворе составила 2,9%. Вычислите массовую долю соляной кислоты в исходном растворе.
MgCO3 = MgO + CO2
MgCO3 + 2HCl = MgCl2 + CO2 + H2O
MgO + 2HCl = MgCl2 + H2O
Ответ: w(HCl) = 10%
3. При нагревании хлората калия (KClO3) в присутствии катализатора часть вещества разложилась. При этом выделилось 6,72 л (н.у.) газа и образовался твёрдый остаток массой 16 г. К остатку добавили 170 г 30%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в полученном растворе. (KClO3 и AgClO3 растворимы в воде.)
2KClO3 = 2KCl + 3O2
KCl + AgNO3 = AgCl + KNO3
Ответ: w(AgNO3) = 10,8%
4. При нагревании образца нитрата магния часть вещества разложилась. При этом выделилось 10,08 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 69,36 г. К этому остатку последовательно добавили 100 мл воды и 240 г 20%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Ответ: w(NaOH) = 3,8%
5. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом образовался твёрдый остаток массой 50,8 г. К остатку добавили 150 г 20%-ного раствора гидроксида натрия. При этом образовался раствор с массой 159 г и массовой долей гидроксида натрия 13,84%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата меди(II).
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: V(смеси газов) = 22,4 л
6. При нагревании образца нитрата серебра часть вещества разложилась. При этом образовался твёрдый остаток массой 88 г. К этому остатку добавили 200 г 20%-ного раствора соляной кислоты. При этом образовался раствор массой 205,3 г с массовой долей соляной кислоты 15,93%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата серебра.
2AgNO3 = 2Ag + 2NO2 + O2
AgNO3 + HCl = AgCl + HNO3
Ответ: V(смеси газов) = 16,8 л
7. При нагревании образца карбоната бария часть вещества разложилась. При этом выделилось 1,12 л (н.у.) газа. Масса твёрдого остатка составила 27,35 г. Этот остаток добавили к 73 г 30%-ного раствора соляной кислоты. Определите массовую долю кислоты в полученном растворе.
BaCO3 = BaO + CO2
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
BaO + 2HCl = BaCl2 + H2O
Ответ: w(HCl) = 11,4%
8. При нагревании образца нитрата цинка часть вещества разложилась. При этом выделилось 5,6 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 64,8 г. Остаток полностью растворили в минимальном объёме 28%-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в полученном растворе.
2Zn(NO3)2 = 2ZnO + 4NO2 + O2
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Ответ: w(NaNO3) = 19,26%
9. При нагревании образца нитрата серебра часть вещества разложилась. При этом выделилось 6,72 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 25 г. К этому остатку последовательно добавили 50 мл воды и 18,25 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
2AgNO3 = 2Ag + 2NO2 + O2
AgNO3 + HCl = AgCl + HNO3
Ответ: w(HCl) = 4,2%
10. При нагревании образца нитрата меди(II) массой 94 г часть вещества разложилась. При этом выделилось 11,2 л (в пересчёте на н.у.) смеси газов. К полученному твёрдому остатку добавили 292 г 10%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
2Cu(NO3)2 = 2CuO + 4NO2 + O2
CuO + 2HCl = CuCl2 + H2O
Ответ: w(HCl) = 4%
11. При нагревании образца нитрата магния часть вещества разложилась. При этом образовался твёрдый остаток массой 15,4 г. Этот остаток прореагировал с 20 г 20%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата магния и объём смеси газов (в пересчёте на н.у.), выделившихся при частичном разложении нитрата магния.
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Ответ: m(Mg(NO3)2) = 37 г, V(смеси газов) = 11,2 л
12. При нагревании образца карбоната бария часть вещества разложилась, при этом выделилось 4,48 л (н.у.) газа. К образовавшемуся твёрдому остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Вычислите массовую долю гидроксида натрия в полученном растворе.
BaCO3 = BaO + CO2
BaO + H2O = Ba(OH)2
Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH
Ответ: w(NaOH) = 5,6%
13. Оксид меди(II) массой 16 г нагрели в присутствии водорода объёмом 3,36 л (н.у.). При этом водород прореагировал полностью. Полученный твёрдый остаток растворили в 535,5 г 20%-ного раствора азотной кислоты, при этом наблюдали выделение бесцветного газа. Определите массовую долю азотной кислоты в образовавшемся растворе.
CuO + H2 = Cu + H2O
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
Ответ: w(HNO3) = 13,84%
14. При нагревании образца нитрата железа(III) часть вещества разложилась. При этом образовалось 88,6 г твёрдого остатка. Этот остаток может прореагировать с 225 г 16%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата железа(III) и объём выделившейся смеси газов (в пересчёте на н.у.).
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
Ответ: m(Fe(NO3)3) = 121 г, V(смеси газов) = 16,8 л
15. При нагревании образца гидрокарбоната натрия часть вещества разложилась. При этом выделилось 0,448 л (н.у.) углекислого газа и образовалось 4,64 г твёрдого безводного остатка. Остаток добавили к 0,15%-ному раствору гидроксида кальция. При этом в полученном растворе не осталось ионов кальция и карбонат-анионов. Определите массовую долю гидроксида натрия в конечном растворе.
2NaHCO3 = Na2CO3 + CO2 + H2O
NaHCO3 + Ca(OH)2 = CaCO3 + H2O + NaOH
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
Ответ: w(NaOH) = 0,11%
16. При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н.у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе.
CaCO3 = CaO + CO2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CaO + 2HCl = CaCl2 + H2O
Ответ: w(CaCl2) = 11,2%
17. При нагревании образца нитрата магния массой 44,4 г часть вещества разложилась. При этом выделилось 13,44 л (в пересчёте на н.у.) смеси газов. К полученному твёрдому остатку добавили 124,1 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
2Mg(NO3)2 = 2MgO + 4NO2 + O2
MgO + 2HCl = MgCl2 + H2O
Ответ: w(HCl) = 5,1%
18. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом выделилось 5,6 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 26,8 г. К этому остатку последовательно добавили 50 мл воды и 10%-ный раствор гидроксида натрия в количестве, необходимом для полного осаждения ионов меди. Определите массовую долю нитрата натрия в образовавшемся растворе.
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: w(NaNO3) = 12,2%
19. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом выделилось 2,8 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 32,2 г. К этому остатку последовательно добавили 50 мл воды и 160 г 10%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: w(NaOH) = 1,8%
20. При нагревании образца нитрата алюминия часть вещества разложилась. При этом выделилось 6,72 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 25,38 г. Остаток полностью растворили в необходимом для реакции минимальном объёме 24%-ного раствора гидроксида натрия. При этом образовался тетрагидроксоалюминат натрия. Определите массовую долю нитрата натрия в полученном растворе.
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
Al(NO3)3 + 4NaOH = Na[Al(OH)4] + 3NaNO3
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Ответ: w(NaNO3) = 24,2%
21. При нагревании образца гидрокарбоната натрия часть вещества разложилась. При этом выделилось 4,48 л (н.у.) газа и образовалось 63,2 г твёрдого безводного остатка. К полученному остатку добавили минимальный объём 20%-ного раствора соляной кислоты, необходимый для полного выделения углекислого газа. Определите массовую долю хлорида натрия в конечном растворе.
2NaHCO3 = Na2CO3 + CO2 + H2O
NaHCO3 + HCl = NaCl + CO2 + H2O
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Ответ: w(NaCl) = 26,8%
22. При нагревании образца нитрата магния часть вещества разложилась. При этом образовался твёрдый остаток массой 53,6 г. К остатку добавили 200 г 24%-ного раствора гидроксида натрия. При этом образовался раствор с массой 206,4 г и массовой долей гидроксида натрия 15,5%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата магния.
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Ответ: V(смеси газов) = 33,6 л
23. При нагревании образца карбоната бария часть вещества разложилась. При этом выделилось 4,48 л (н.у.) газа и образовалось 50 г твёрдого остатка. К остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Вычислите массовую долю гидроксида натрия в полученном растворе.
BaCO3 = BaO + CO2
BaO + H2O = Ba(OH)2
Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH
Ответ: w(NaOH) = 5,6%
25. При нагревании образца нитрата железа(III) часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 58 г обработали 267 г 20%-ного раствора гидроксида натрия. При этом массовая доля щёлочи в растворе уменьшилась вдвое. Вторую часть массой 29 г растворили в 126 г 10%-ного раствора азотной кислоты. Вычислите массовую долю соли в образовавшемся растворе.
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Ответ: w(Fe(NO3)3) = 25%
26. При нагревании образца нитрата меди(II) часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 59 г обработали 127,5 г 25,1%-ного раствора гидроксида натрия. При этом образовался раствор с массовой долей щёлочи 8%. Вторую часть массой 23,6 г растворили в 245 г 10%-ного раствора серной кислоты. Вычислите массовую долю кислоты в образовавшемся растворе
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
CuO + H2SO4 = CuSO4 + H2O
Ответ: w(H2SO4) = 6,9%
27. При нагревании образца нитрата цинка часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 27 г обработали 87,2 г 20%-ного раствора сульфида натрия. При этом массовая доля сульфида натрия в растворе уменьшилась вдвое. Вторую часть массой 81 г добавили к 202,5 г 40%-ного раствора бромоводородной кислоты. Вычислите массовую долю бромоводородной кислоты в образовавшемся растворе.
2Zn(NO3)2 = 2ZnO + 4NO2 + O2
Zn(NO3)2 + Na2S = ZnS + 2NaNO3
ZnO + 2HBr = ZnBr2 + H2O
Ответ: w(HBr) = 11,4%
28. При нагревании образца нитрата алюминия часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 73,2 г добавили к 663,6 г 15%-ного раствора карбоната натрия. При этом массовая доля соды в растворе уменьшилась в полтора раза. Вторую часть массой 24,4 г растворили при нагревании в 245 г 20%-ного раствора серной кислоты. Вычислите массовую долю кислоты в образовавшемся растворе.
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6NaNO3
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Ответ: w(H2SO4) = 7,3%
29. При нагревании образца карбоната кальция часть вещества разложилась. При этом масса карбоната кальция в образовавшемся твёрдом остатке оказалась в 1,4 раза больше массы оксида кальция. Остаток добавили к 640 г 25%-ной соляной кислоты. В результате массовая доля кислоты в растворе уменьшилась вдвое. Вычислите объём газа (в пересчёте на н.у.), выделившегося в результате частичного разложения карбоната кальция.
CaCO3 = CaO + CO2
CaO + 2HCl = CaCl2 + H2O
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Ответ: V(CO2) = 12,544 л
При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н.у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора хлороводородной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе. Ответ запишите с точностью до десятых.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Данную задачу проверяют не автоматически, а вручную.
Ознакомьтесь с критериями оценки, правильным решением и сами себе поставьте оценку от 0 до 4 баллов.
Даже если вы ошиблись в цифровом ответе, можно получить несколько баллов за правильный ход решения.
Форма для оценки находится внизу страницы.
Критерии оценки вопроса
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|---|---|
| Записаны уравнения реакций Рассчитано количество вещества соединений в твёрдом остатке Вычислена масса соли в полученном растворе Вычислена массовая доля хлорида кальция в растворе |
|
| Ответ правильный и полный, содержит следующие элементы • правильно записаны уравнения реакций, соответствующих условию задания; • правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания; • продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которых проводятся расчёты; • в соответствии с условием задания определена искомая физическая величина |
4 |
| Правильно записаны три элемента ответа | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| * Максимальный балл* | 0 |
Подробное решение
1. Запишем уравнения реакций
CaCO3 = CaO + CO2 (1)
Итак из условия задачи следует, что не весь карбонат кальция разложился при нагревании. С соляной (хлороводородной) кислотой будет реагировать как исходное вещество карбонат кальция, так и оксид кальция.
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O (2)
CaO + 2HCl = CaCl2 + H2O (3)
2. Масса твердого остатка 41,2 г- это масса смеси CaCO3 и CaO.. Рассчитаем массу каждого вещества в отдельности.
Приступим к расчетам по реакции 1.
1 моль любого газа = 22,4 литра в нормальных условиях.
n(CO2) = V/Vm = 4,48 (л) / 22,4 (л/моль) = 0,2 моль CO2 образовалось в реакции.
Значит и CaO образовалось 0,2 моль. n(CaO)=0,2 моль
M(CaO)=40+16=56 г/моль
m(CaO) = n*M = 0,2 моль *56 г/моль =11,2 г.
Масса твердого остатка 41,2 из них 11,2 CaO, значит остальное это CaCO3
m(CaCO3)=41,2 г – 11,2 г = 30 г
M(CaCO3)=40 г/моль +12 г/моль+3*16г/моль=52+48=100 г/моль
n(CaCO3 отаток)=30(г)/ 100(г/моль)= 0,3 моль.
3. Добавляем избыток HCl.
Массовая доля CaCl2 в конечном растворе — это масса соли CaCl2 делённая на общую массу раствора. Вообще можно посчитать массу всех конечных веществ в растворе, однако это крайне долго. Помним про закон сохранения масс. Общая масса раствора — это масса избытка раствора кислоты, плюс масса твердого остатка (CaCO3 и CaO), минус углекислый газ покидающий зону реакции.
В реакции номер 2 на 1 моль CaCO3 приходится 1 моль CO2, на 0,3 моль придется 0,3 моль CO2
M(CO2)=12 г/моль+16*2 г/моль = 44 г/моль
m(CO2) реакция 3 = 0,3 моль * 44 г/моль = 13,2 г.
Все общая масса раствора после реакции это m общ = 465,5 г +41,2 г -13,2 г = 493,5 г
4. Найдем массу образовавшийся соли. Соль образуемся в 2-х реакциях. Реакция номер 2.
на 1 моль CaCO3 1 моль CaCl2 у нас 0,3 моль CaCO3 , на 0,3 моль CaCO3 соответственно приходится 0,3 моль CaCl2
Реакция номер 3 на 1 моль CaO приходится CaCl2 1 моль CaCl2, на 0,2 моль CaO соответственно должно приходится 0,2 моль CaCl2
Общее количество образовавшейся соль n(CaCl2) = 0,3 моль + 0,2 моль = 0,5 моль
М(CaCl2) = 40 г/моль + 2*35,5 г/моль =40+71=111 г/моль
m(CaCl2) = 0,5 моль * 111 г/моль= 55,5 г
5. Рассчитаем массовую долю. w(CaCl2) = (55,5 г /493,5 г) * 100% = 11,2%
Оцените своё решение
0
1
2
3
4
1. Запишем уравнения реакций
CaCO3 = CaO + CO2 (1)
Итак из условия задачи следует, что не весь карбонат кальция разложился при нагревании. С соляной (хлороводородной) кислотой будет реагировать как исходное вещество карбонат кальция, так и оксид кальция.
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O (2)
CaO + 2HCl = CaCl2 + H2O (3)
2. Масса твердого остатка 41,2 г- это масса смеси CaCO3 и CaO.. Рассчитаем массу каждого вещества в отдельности.
Приступим к расчетам по реакции 1.
1 моль любого газа = 22,4 литра в нормальных условиях.
n(CO2) = V/Vm = 4,48 (л) / 22,4 (л/моль) = 0,2 моль CO2 образовалось в реакции.
Значит и CaO образовалось 0,2 моль. n(CaO)=0,2 моль
M(CaO)=40+16=56 г/моль
m(CaO) = n*M = 0,2 моль *56 г/моль =11,2 г.
Масса твердого остатка 41,2 из них 11,2 CaO, значит остальное это CaCO3
m(CaCO3)=41,2 г – 11,2 г = 30 г
M(CaCO3)=40 г/моль +12 г/моль+3*16г/моль=52+48=100 г/моль
n(CaCO3 отаток)=30(г)/ 100(г/моль)= 0,3 моль.
3. Добавляем избыток HCl.
Массовая доля CaCl2 в конечном растворе — это масса соли CaCl2 делённая на общую массу раствора. Вообще можно посчитать массу всех конечных веществ в растворе, однако это крайне долго. Помним про закон сохранения масс. Общая масса раствора — это масса избытка раствора кислоты, плюс масса твердого остатка (CaCO3 и CaO), минус углекислый газ покидающий зону реакции.
В реакции номер 2 на 1 моль CaCO3 приходится 1 моль CO2, на 0,3 моль придется 0,3 моль CO2
M(CO2)=12 г/моль+16*2 г/моль = 44 г/моль
m(CO2) реакция 3 = 0,3 моль * 44 г/моль = 13,2 г.
Все общая масса раствора после реакции это m общ = 465,5 г +41,2 г -13,2 г = 493,5 г
4. Найдем массу образовавшийся соли. Соль образуемся в 2-х реакциях. Реакция номер 2.
на 1 моль CaCO3 1 моль CaCl2 у нас 0,3 моль CaCO3 , на 0,3 моль CaCO3 соответственно приходится 0,3 моль CaCl2
Реакция номер 3 на 1 моль CaO приходится CaCl2 1 моль CaCl2, на 0,2 моль CaO соответственно должно приходится 0,2 моль CaCl2
Общее количество образовавшейся соль n(CaCl2) = 0,3 моль + 0,2 моль = 0,5 моль
М(CaCl2) = 40 г/моль + 2*35,5 г/моль =40+71=111 г/моль
m(CaCl2) = 0,5 моль * 111 г/моль= 55,5 г
5. Рассчитаем массовую долю. w(CaCl2) = (55,5 г /493,5 г) * 100% = 11,2%
Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии 2018. Задание 34
Представляем вашему вниманию задание 34 — Реальный ЕГЭ по химии 2018 с подробными текстовыми решениями, видеообъяснениями и ответами.
Задания 34 из реальных КИМов ЕГЭ по химии 2018
Вариант 1
При термической обработке нитрата меди (II) массой 94 г часть вещества разложилась и выделилось 11,2 л смеси газов. К полученному твердому остатку добавили 292 г 10 % раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
Решение.
- Запишем уравнение термического разложения нитрата меди (II):
2Cu(NO3)2→ 2CuО + 4NO2 + O2 + {Cu(NO3)2}ост. (1),
где {Cu(NO3)2}ост. – неразложившаяся часть нитрата меди (II).
- Таким образом, твердый остаток – это смесь образовавшегося оксида меди (II) и оставшегося нитрата меди (II).
- С соляной кислотой реагирует только один компонент твердого остатка – образовавшийся CuО:
CuO + 2HCl → CuCl2 + H2O (2)
- Рассчитаем количество вещества образовавшейся газовой смеси:
n(NO2 + O2) = 11,2 л / 22,4 л/моль = 0,5моль.
- Из уравнения(1): n(CuО) = n(NO2 + O2) ∙ 2/5= 0,5моль∙ 2/5 = 0,2моль.
- По уравнению(2) рассчитаем количество вещества соляной кислоты, вступившей в реакцию с CuО:
n(HCl(реакц.)) = 2∙n(CuО) = 2∙0,2моль = 0,4моль.
- Найдем общую массу и количество вещества соляной кислоты, взятой для реакции:
m(HCl (общ.))в-ва = m(HCl (общ.))р-ра∙ω(HCl) = 292 г∙ 0,1 = 29,2 г.
n(HCl (общ.)) = m(HCl (общ.))в-ва/M(HCl) = 29,2 г / 36,5 г/моль = 0,8 моль.
- Найдем количество вещества и массу оставшейся соляной кислоты в полученном растворе:
n(HCl(ост.)) = n(HCl (общ.)) – n(HCl(реакц.)) = 0,8 моль – 0,4 моль = 0,4моль.
m(HCl(ост.)) = n(HCl(ост.))∙M(HCl) = 0,4 моль∙ 36,5 г/моль = 14,6г.
- Найдем массу конечного раствора mкон.р-ра:
mкон.р-ра= m(CuО) + m(Cu(NO3)2(ост.)) + m(HCl (общ.))р-ра
- Рассчитаем массу образовавшегося СuO:
m(CuО) = n(CuО)∙M(CuО) = 0,2 моль ∙ 80 г/ моль = 16 г.
- Рассчитаем массу неразложившегося Cu(NO3)2:
n(Cu(NO3)2(реакц.)) = n(CuО) = 0,2 моль,
где Cu(NO3)2(реакц.) – разложившаяся часть нитрата меди (II).
m(Cu(NO3)2(реакц.)) = n(Cu(NO3)2(реакц.)) ∙ M(Cu(NO3)2) = 0,2 моль ∙ 188 г/моль = 37,6 г.
m(Cu(NO3)2(ост.)) = m(Cu(NO3)2(нач.)) – m(Cu(NO3)2(реакц.)) = 94 г – 37,6 г = 56,4 г.
- mкон.р-ра= m(CuО) + m(Cu(NO3)2(ост.)) + m(HCl (общ.))р-ра = 16г +56,4г + 292 г =364,4г
- Определиммассовую долю соляной кислоты в полученном растворе ω(HCl)кон.р-р:
ω(HCl)кон.р-р = m(HCl(ост.))/mкон.р-ра = 14,6г / 364, 4г = 0,0401 (4,01 %)
Ответ:ω(HCl) = 4,01 %
Вариант 2
При прокаливании смеси карбоната натрия и карбоната магния до постоянной массы выделилось 4,48 л газа. Твердый остаток полностью прореагировал с 73 г 25%-ого раствора соляной кислоты. Рассчитайте массовую долю карбоната натрия в исходной смеси.
Решение.
- Запишем уравнение термического разложения карбоната магния:
MgCO3→MgО + CO2 (1)
- Таким образом, твердый остаток – это смесь образовавшегося оксида магния и исходного карбоната натрия.С соляной кислотой реагируют оба компонента твердого остатка:
MgO+ 2HCl → MgCl2 + H2O(2)
Na2CO3 + 2HCl → MgCl2 + CO2↑ + H2O (3)
- Рассчитаем количество вещества выделившегосяCO2, выделившегося при разложении MgCO3:
n(CO2) = 4,48 л / 22,4 л/моль = 0,2 моль.
- Из уравнения(1): n(MgО) = n(CO2) = 0,2 моль,
m(MgО) = n(MgО)∙M(MgО) = 0,2 моль ∙ 40 г/ моль = 8 г.
- Найдём количество вещества соляной кислоты, потребовавшейся для реакции с MgO:
n(HCl)2 = 2∙n(MgО) = 2∙0,2 моль = 0,4 моль.
- Найдём общую массу и количество вещества соляной кислоты, взятой для реакции:
m(HCl(общ.))в-ва = m(HCl (общ.))р-ра ∙ ω(HCl) = 73 г ∙ 0,25 = 18,25 г,
n(HCl(общ.)) = m(HCl (общ.))в-ва/ M(HCl) = 18,25 г / 36,5 г/моль = 0,5 моль.
- Найдём количество вещества соляной кислоты, потребовавшейся для реакции с Na2CO3:
n(HCl)3 = n(HCl(общ.)) – n(HCl)2 = 0,5 моль – 0,4 моль = 0,1 моль.
- Найдем количество вещества и массу карбоната натрия в исходной смеси.
Из уравнения(3): n(Na2CO3) = 0,5∙n(HCl)3= 0,5∙0,1 моль = 0,05 моль.
m(Na2CO3) = n(Na2CO3) ∙M(Na2CO3) = 0,05моль,∙ 106 г/моль = 5,3 г.
- Найдем количество вещества и массу карбоната магния в исходной смеси.
Из уравнения (1): n(MgCO3) = n(CO2) = 0,2 моль,
m(MgCO3) = n(MgCO3) ∙M(MgCO3) = 0,2 моль∙ 84г/моль = 16,8г.
- Определим массу исходной смеси и массовую долю карбоната натрия в ней:
m(MgCO3 + Na2CO3) = m(MgCO3)+ m(Na2CO3) = 16,8 г + 5,3 г = 22,1г.
ω(Na2CO3) = m(Na2CO3) / m(MgCO3 + Na2CO3) = 5,3 г / 22,1г = 0,24 (24 %).
Ответ:ω(Na2CO3) = 24 %.
Вариант 3
При нагреванииобразца нитрата серебра(I) часть вещества разложилась, при этом образовался твердый остаток массой 88 г. К этому остатку добавили200 г 20%-ного раствора соляной кислоты, в результате чего образовался раствор массой 205,3 г с массовой долей соляной кислоты 15,93 %. Определите объем смеси газов, выделившейся при разложении нитрата серебра(I).
Решение.
- Запишем уравнение разложения нитрата серебра (I):
2AgNО3→ 2Ag + 2NО2 + O2+{AgNО3}ост. (1)
где {AgNO3}ост. – неразложившаяся часть нитрата серебра (I).
- Таким образом, твердый остаток – это смесь образовавшегося серебра и оставшегося нитрата серебра (I).
- С соляной кислотой реагирует только нитрат серебра (I):
AgNО3+ HCl → AgCl↓ + HNO3(2)
- Вычислим массу и количество вещества соляной кислоты в ее исходном растворе:
m(HCl)иcx. = 20г ∙ 0,2 = 40г
n(HCl)иcx.= 40г / 36,5 г/моль = 1,1моль
- Вычислим массу и количество вещества соляной кислоты в образовавшемся растворе:
m(HCl)кон. = 205,3 г ∙ 0,1593 = 32,7 г
n(HCl)кон.= 32,7 г / 36,5 г/моль = 0,896 моль(0,9 моль)
- Вычислим количество вещества соляной кислоты, пошедшей на реакцию с AgNО3:
n(HCl)реакц = 1,1 моль – 0,896 моль = 0,204 моль(0,2 моль)
- Найдем количество вещества и массу неразложившегося нитрата серебра:
По уравнению (2) n(AgNО3)ocт.= n(HCl)реакц.= 0,204 моль. (0,2 моль)
m(AgNО3)ocт.= (AgNО3)ocт.∙ M(AgNО3) = 0,204 моль∙ 170 г/моль = 34,68г.(34 г)
- Найдем массу образовавшегося серебра:
m(Ag) = mостатка – m((AgNО3)ocт) = 88 г – 34,68 г = 53,32 г.(54 г)
n(Ag) = m(Ag)/ M(Ag) = 53,32 г / 108 г/моль = 0,494 моль. (0,5 моль)
- Найдем количество вещества и объем смеси газов, образовавшихся при разложении нитрата серебра:
- По уравнению (1) n(NО2 + O2) =3/2∙n(Ag) = 3/2 ∙0,494моль= 0,741моль(0,75 моль)
V(NO2 + O2) = n(NO2 + O2) ∙Vm= 0,741моль∙ 22,4 л/моль = 16,6л.(16,8л).
Ответ: V(NO2 + O2) = 16,6л. (16,8л).
Вариант 4
При разложении образца карбоната бария выделился газ объемом 4,48 л (в пересчете на н. у.). Масса твердого остатка составила 50 г. После этого к остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
Решение.
- Запишем уравнение термического разложения карбоната бария:
ВаСО3→ ВаО + СО2(1)
- Таким образом, твердый остаток – это смесь образовавшегося оксида бария и неразложившегося карбоната бария.
- При добавлении воды, оксид бария растворяется:
ВаО + Н2О → Ва(ОН)2(2)
и образовавшийся гидроксид бария взаимодействует далее с сульфатом натрия:
Ва(ОН)2+ Na2SO4 → ВаSO4↓ + 2NaOH(3)
- Карбонат бария нерастворим в воде, поэтому в раствор не переходит.
- Вычислим количество углекислого газа, выделившегося при прокаливании карбоната бария:
n(СO2) = 4,48 л / 22,4 л/моль = 0,2 моль,
Из уравнения (1): n(BaО) = n(CO2) = 0,2 моль,
m(ВаО) = n(ВаО)∙M(ВаО) = 0,2 моль ∙ 153 г/моль = 30,6 г.
- Определим, какой из реагентов Ва(ОН)2 или Na2SO4 вступает в реакцию полностью.
- Вычислим массу и количество вещества сульфата натрия:
m(Na2SO4)в—ва = m(Na2SO4)р—ра∙ ω(Na2SO4) = 200 г ∙ 0,2 = 40 г
n(Na2SO4) = m(Na2SO4)в—ва/ M(Na2SO4) = 40г / 142г/моль= 0,282моль.
- Из уравнения(2): n(BaО) = n(Ва(ОН)2) = 0,2 моль.
- Значит, сульфат натрия взят в избытке, а гидроксид бария реагирует полностью.
- Вычислим количество вещества и массу образовавшегося гидроксида натрия:
Из уравнения (3): n(NaOH) = 2∙n(Ва(ОН)2) = 2∙0,2 моль = 0,4 моль
m(NaOH)в-ва = n(NaOH) ∙ M(NaOH) = 0,4 моль ∙ 40 г/моль = 16 г.
- Вычислим массу образовавшегося раствора:
mкон.р-ра = m(ВаО) + m(Н2O) +m(Na2SO4)р-ра – m(ВаSO4)
m(Н2O) = ρ(Н2O) ∙V(Н2O) = 1 г/мл∙ 100 мл = 100 г
Из уравнения (3): n(ВаSO4) = n(Ва(ОН)2) = 0,2 моль
m(ВаSO4) = n(ВаSO4) ∙ M(ВаSO4) = 0,2 г/моль ∙ 233 моль = 46,6 г.
mкон.р-ра = m(ВаО) + m(Н2O) +m(Na2SO4)р-ра – m(ВаSO4) = 30,6 г + 100 г + 200 г – 46,6 г = 284г.
- Массовая доля гидроксида натрия в растворе равна:
ω(NaOH) = m(NaOH) / mкон.р-ра = 16 г /284 г = 0,0563 (5,63 %).
Ответ: ω(NaOH) = 5,63 %.
Вариант 5
При нагревании образца нитрата магния часть вещества разложилась. Масса твердого остатка составила 15,4 г. Этот остаток может прореагировать с 20 г 20%-ного раствора гидроксида натрия. Определите массу исходного образца и объем выделившихся газов (в пересчете на н. у.).
Решение.
- Запишем уравнение термического разложения нитрата магния:
2Mg(NO3)2→t 2MgО + 4NO2 + O2 + {Mg(NO3)2}ост. (1),
где {Cu(NO3)2}ост. – неразложившаяся часть нитрата магния.
- Таким образом, твердый остаток – это смесь образовавшегося оксида магния и оставшегося нитрата магния. С гидроксидом натрия реагирует только один компонент твердого остатка – оставшийсяMg(NO3)2:
Mg(NO3)2 + 2NaOH → Mg(OH)2 + 2NaNO3 (2)
- Найдем количество вещества и массу гидроксида натрия:
m(NaOH) = m(NaOH)р-ра ∙ ω(NaOH) = 20 г ∙ 0,2 = 4 г
n(NaOH). = m(NaOH)/ М(NaOH) = 4 г / 40 г/моль = 0,1 моль.
Из уравнения(2): n(Mg(NO3)2)ост. = 0,5∙n(NaOH) = 0,5∙0,1 моль = 0,05 моль,
m(Mg(NO3)2)ост. = n(Mg(NO3)2)ост. ∙ M(Mg(NO3)2) = 0,05моль,∙ 148г/моль = 7,4г.
- Найдем массу и количество вещества оксида магния:
m(MgО) = mостатка – m(Mg(NO3)2)ост. = 15,4г – 7,4г = 8г.
n(MgО). = m(MgО)/ М(MgО) = 8г / 40 г/моль = 0,2моль.
- Найдем количество вещества и объем газовой смеси:
Из уравнения (1): n(NO2 + O2) = 5/2 ∙n(CuО)= 5/2 ∙ 0,2моль= 0,5 моль.
V(NO2 + O2) = n(NO2 + O2) ∙Vm= 0,5 моль∙ 22,4 л/моль = 11,2 л.
- Найдем количество вещества и массу исходного карбоната магния:
Изуравнения(1): n(Mg(NO3)2)реакц. = n(MgО) = 0,2 моль.
m(Mg(NO3)2)реакц. = n(Mg(NO3)2)реакц. ∙ M(Mg(NO3)2) = 0,2 моль,∙ 148 г/моль = 29,6г.
m(Mg(NO3)2)исх. = m(Mg(NO3)2)реакц. +m(Mg(NO3)2)ост = 29,6 г+7,4г = 37г.
Ответ:V(NO2 + O2) = 11,2 л; m(Mg(NO3)2) = 37 г.
Вариант 6
При разложении образца карбоната бария выделился газ объемом 1,12 л (в пересчете на н. у.). Масса твердого остатка составила 27,35 г. После этого к остатку добавили 73 г 30%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в образовавшемся растворе.
- При разложении карбоната бария образуется оксид бария и выделяется углекислый газ:
ВаСО3→t ВаО + СО2
- Вычислим количество углекислого газа, выделившегося при прокаливаниикарбоната бария:
n(СO2) = 1,12 л / 22,4 л/моль = 0,05 моль,
следовательно, в результате реакции разложения карбоната бария образовалось 0,05 моль оксида бария и прореагировало также 0,05 моль карбоната бария. Вычислим массу образовавшегося оксида бария:
m(ВаО) = 153 г/моль ∙ 0,05 моль = 7,65 г.
- Вычислим массу и количество вещества оставшегося карбоната бария:
m(ВаСО3)ост. = 27,35 г – 7,65 г = 19,7 г
n(ВаСО3)ост.= 19,7 г / 197 г/моль = 0,1 моль.
- С соляной кислотой взаимодействуют оба компонента твердого остатка – образовавшийся оксид бария и оставшийся карбонат бария:
ВаО + 2НСl → ВаСl2 + Н2O
ВаСО3 + 2НСl → ВаСl2 + CO2↑ + Н2O.
- Вычислим количество вещества и массу хлороводорода, взаимодействующего с оксидом и карбонатом бария:
n(НCl) = (0,05 моль + 0,1 моль) ∙ 2 = 0,3 моль;
m(НСl) = 36,5 г/моль ∙ 0,3 моль = 10,95 г.
- Вычислим массу оставшегося хлороводорода:
m(НСl)ост. = 73 г ∙ 0,3 – 10,95 г = 10,95 г.
- Вычислим массуконечного раствора:
mкон.р-ра= mостатка + m(НCl)р-ра –m(СО2) =27,35 г +73г– 4,4 г= 95,95 г.
- Массовая доля оставшейся соляной кислоты в растворе равна:
ω(HCl) = m(HCl)ост. / mкон.р-ра = 10,95 г / 95,95 г = 0,114 (11,4 %).
Ответ: ω(HCl) = 11,4 %.
Вариант 7
При нагреванииобразца нитрата серебра часть вещества разложилась и выделилась смесь газов объемом 6,72 л (в пересчете на н. у.). Масса остатка составила 25 г. После этого остаток поместили в 50 мл воды и добавили 18,25 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
Решение.
- Запишем уравнение термического разложения нитрата серебра (I):
2AgNО3→ 2Ag + 2NО2 + O2 (1)
- Твердый остаток – это смесь образовавшегося серебра и оставшегося нитрата серебра (I).
- С соляной кислотой реагирует только нитрат серебра (I):
AgNО3+ HCl → AgCl↓ + HNO3 (2)
- Вычислим количество газов, образующихся при разложении нитрата серебра:
n(NО2 + O2) = 6,72 л/22,4 л/моль = 0,3 моль.
- По уравнению (1) n(Ag) = 2/3∙n(NО2 + O2) = 2/3∙0,3 моль = 0,2 моль
m(AgNО3)ocт. = 25 г – 21,6 г = 3,4 г
n(AgNО3)ocт. = 3,4 г / 170 г/моль = 0,02 моль.
- Вычислим массу и количество вещества соляной кислоты в ее исходном растворе:
m(HCl)иcx.= 18,25 г∙ 0,2 = 3,65 г
n(HCl)иcx.= 3,65 г/36,5 г/моль = 0,1 моль
- По уравнению (2) n(AgNО3)ocт.= n(AgCl) = n(HCl)реакц., где n(HCl)реакц. – количество вещества соляной кислоты, пошедшей на реакцию с AgNО3. Следовательно, количество вещества и масса непрореагировавшей соляной кислоты:
n(НCl)ост.= 0,1 моль – 0,02 моль = 0,08 моль;
m(НСl)ост. = 0,08 моль∙ 36.5 г/моль = 2,92 г.
- Вычислим массу выпавшего осадка
m(AgCl) = n(AgCl) ∙M(AgCl) = 0,02 моль∙ 143,5 г/моль = 2,87 г.
- Масса получившегося раствора равна:
mкон.p-pa = mостатка + m(НCl)р-ра + m(Н2О) – m(AgCl) = 3,4 г + 18,25 г + 50 г – 2,87 г = 68,78 г.
- Массовая доля в получившемся растворе соляной кислоты равна:
ω(НСl) = m(НСl)ост./ mкон.p-pa = 2,92 г/68,78 г = 0,0425 (4,25 %).
Ответ: ω(НСl) = 4,25 %.
Вариант 8
При нагревании образца нитрата цинка часть вещества разложилась, при этом выделилось 5,6 л газов (в пересчете на н. у.). Остаток массой 64,8 г полностью растворили в минимальном объеме 28%-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в конечном растворе.
Решение.
- Запишем уравнение термического разложения нитрата цинка:
2Zn(NO3)2→ 2ZnО + 4NO2 + O2 + {Zn(NO3)2}ост. (1),
где {Zn(NO3)2}ост. – неразложившаяся часть нитрата цинка.
- Таким образом, твердый остаток – это смесь образовавшегося оксида цинка и оставшегося нитрата цинка.
- С раствором гидроксида натрия реагируют оба компонента твердого остатка – образовавшийся CuО и оставшийся Zn(NO3)2:
ZnО + 2NaOH+ H2O → Na2[Zn(OH)4] (2)
Zn(NO3)2+ 4NaOH→ Na2[Zn(OH)4] + 2NaNO3(3)
- Рассчитаем количество вещества образовавшейся газовой смеси:
n(NO2 + O2) = 5,6 л / 22,4 л/моль = 0,25 моль.
- Из уравнения (1): n(ZnО) = n(NO2 + O2) ∙ 2/5= 0,25 моль ∙ 2/5 = 0,1моль.
m(ZnО) = n(ZnО)∙M(ZnО) = 0,1 моль ∙ 81 г/ моль = 8,1 г.
- Найдем массу оставшегося нитрата цинка и его количество:
m(Zn(NO3)2(ост.)) = mостатка – m(ZnO) = 64,8 г – 8,1 г = 56,7 г.
n(Zn(NO3)2(ост.)) = m(Zn(NO3)2(ост.))/ M(Zn(NO3)2) = 56,7 г / 189 г/моль = 0,3 моль.
- По уравнению (2) рассчитаем количество вещества NaOH, потребовавшегося для реакции с ZnО:
n(NaOH(реакц.)2) = 2∙n(ZnО) = 2∙0,1моль = 0,2моль.
- По уравнению (3) рассчитаем количество вещества NaOH, потребовавшегося для реакции с неразложившимся Zn(NO3)2:
n(NaOH(реакц.)3) = 4∙n(Zn(NO3)2(ост.))= 4∙ 0,3 моль = 1,6 моль.
- Найдем общееколичество вещества и массу гидроксида натрия, потребовавшегося для растворения твердого остатка:
n(NaOH(реакц.)) = n(NaOH(реакц.)2) + n(NaOH(реакц.)3) = 0,2 моль +1,6 моль= 1,8моль
m(NaOH(реакц.))в-ва = n(NaOH(реакц.)) ∙ M(NaOH) = 1,4 моль ∙40 г/моль = 56 г
- Масса 28%-ного раствора гидроксида натрия:
m(NaOH)р-ра = m(NaOH(реакц.))в-ва / ω(NaOH) = 56 г / 0,28 = 200 г
- Найдем количество вещества и массу нитрата натрия в полученном растворе:
n(NaNO3) = 2n(Zn(NO3)2(ост.)) = 2∙0,3 моль = 0,6 моль.
m(NaNO3) = n(NaNO3)∙M(NaNO3) = 0,6 моль∙ 85 г/ моль = 51 г.
- Найдем массу конечного раствора mкон.р-ра:
mкон.р-ра = mостатка + m(NaOH)р-ра= 64,8г + 200г = 264,8г
- Определиммассовую долю нитрата натрия в полученном растворе:
ω(NaNO3) = m(NaNO3)/mкон.р-ра = 51г / 264,8г = 0,1926 (19,26 %)
Ответ:ω(NaNO3) = 19,26 %
Вариант 9
При проведении электролиза 360 г 15 % раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2→(электролиз)Сu + Cl2
- Найдем массу и количество вещества исходного хлорида меди (II):
m(CuCl2)исх. = m(CuCl2)р-ра∙ω(CuCl2) = 360 г∙ 0,15 = 54 г
n(CuCl2)исх. = m(CuCl2)исх./М(CuCl2) = 54 г / 135 г/моль = 0,4 моль.
- Найдем количество вещества выделившегося на аноде хлора:
n(Cl2)= V(Cl2)/Vm= 4,48 л / 22,4 л/моль = 0,2 моль.
- Найдем количество вещества и массу CuCl2, оставшегосяв растворе:
n(CuCl2)реакц. = n(Cl2) = 0,2 моль.
n(CuCl2)ост. = n(CuCl2)исх. – n(CuCl2)реакц. = 0,4 моль – 0,2 моль = 0,2 моль.
m(CuCl2)ост. =n(CuCl2)ост.∙М(CuCl2) = 0,2 моль∙135 г/моль = 27 г.
- Найдем массу конечного раствора:
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu)
m(Cl2) = n(Cl2)∙М(Cl2) = 0,2 моль∙71 г/моль = 14,2 г.
m(Cu) = n(Cu)∙М(Cu) = 0,2 моль∙64 г/моль = 12,8 г.
mкон.р-ра = m(CuCl2)р-ра– m(Cl2) – m(Cu) = 360 г – 14,2 г – 12,8 г = 333 г
ω(CuCl2)кон. = m(CuCl2)ост./mкон.р-ра = 27 г/ 333 г = 0,0811
- Найдем массу и количество вещества хлорида меди (II) в отобранной порции:
m(CuCl2)порц. = mпорц р-ра.∙ω(CuCl2)кон. = 66,6 г∙0,0811 = 5,4 г
n(CuCl2)порц. = m(CuCl2)порц. / М(CuCl2) = 5,4 г / 135 г/моль = 0,04 моль.
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
n(NaOH) = 2∙n(CuCl2)порц. = 2∙0,04 моль = 0,08 моль.
m(NaOH)в-ва = n(NaOH)∙М(NaOH) = 0,08 моль∙40 г/моль = 3,2 г.
m(NaOH)р-ра = m(NaOH)в-ва/ ω(NaOH) = 3,2 г / 0,1 = 32 г.
Ответ:m(NaOH)р-ра = 32 г.
Вариант 10
При проведении электролиза 500 г 16 % раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O→(электролиз)2Сu + O2 + 2H2SO4
- Найдем массу и количество вещества исходного сульфата меди (II):
m(CuSO4)исх. = m(CuSO4)р-ра∙ω(CuSO4) = 500 г ∙ 0,16 = 80 г
n(CuSO4)исх. = m(CuSO4)исх./М(CuSO4) = 80 г / 160 г/моль = 0,5 моль.
- Найдем количество вещества выделившегося на аноде кислорода:
n(О2)= V(О2)/Vm= 1,12 л / 22,4 л/моль = 0,05 моль.
- Найдем количество вещества и массу CuSO4, оставшегосяв растворе:
n(CuSO4)реакц. = 2∙n(О2) = 2∙0,05 моль = 0,1 моль.
n(CuSO4)ост. = n(CuSO4)исх. – n(CuSO4)реакц. = 0,5 моль – 0,1 моль = 0,4 моль.
m(CuSO4)ост. =n(CuSO4)ост.∙ М(CuSO4) = 0,4 моль ∙ 160 г/моль = 64 г.
- Найдем массу конечного раствора:
mкон.р-ра = m(CuSO4)р-ра – m(O2) – m(Cu)
m(О2) = n(О2)∙М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г.
n(Cu) = n(CuSO4)реакц.= 0,1 моль.
m(Cu) = n(Cu)∙М(Cu) = 0,1 моль ∙ 64 г/моль = 6,4 г.
mкон.р-ра = m(CuSO4)р-ра – m(O2) – m(Cu) = 500 г – 1,6 г – 6,4 г = 492 г
n(H2SO4) = n(CuSO4)реакц. = 0,1 моль.
m(H2SO4)=n(H2SO4)∙ М(H2SO4) = 0,1 моль∙ 98 г/моль = 9,8 г.
ω(CuSO4)кон.= m(CuSO4)ост./mкон.р—ра = 64 г / 492 г = 0,13
ω(H2SO4)кон. = m(H2SO4)/mкон.р-ра = 9,8г / 492 г = 0,02
- Найдем массу и количество вещества сульфата меди (II) в отобранной порции:
m(CuSO4)порц. = mпорц р-ра.∙ ω(CuSO4)кон. = 98,4 г ∙ 0,13 = 12,8 г
n(CuSO4)порц. = m(CuSO4)порц. / М(CuSO4) = 12,8 г / 160 г/моль = 0,08 моль.
- Найдем массу и количество вещества гидроксида бария в отобранной порции:
m(H2SO4)порц. = mпорц р-ра.∙ ω(H2SO4)кон. = 98,4 г ∙ 0,02 = 1,968 г
n(H2SO4)порц. = m(H2SO4)порц. / М(H2SO4) = 1,968г / 98г/моль = 0,02моль.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4(1)
H2SO4+ 2NaOH→Na2SO4 + 2H2O (2)
- Найдем массу гидроксида натрия, потребовавшегося для осаждения ионов Cu2+:
Из уравнения (1): n(NaOH)1 = 2∙n(CuSO4)порц.= 2∙0,08 моль = 0,16 моль.
Из уравнения (2):n(NaOH)2= 2∙n(H2SO4)порц. = 2∙ 0,02моль = 0,04моль.
n(NaOH(реакц.)) = n(NaOH(реакц.)1) + n(NaOH(реакц.)2) = 0,16моль +0,04моль= 0,2моль
m(NaOH)в-ва = n(NaOH)∙М(NaOH) = 0,2моль∙ 40 г/моль= 8г .
m(NaOH)р-ра = m(NaOH)в-ва / ω(NaOH) = 8г / 0,2 = 40г.
Ответ:m(NaOH)р-ра = 40г.
Вариант 11
Электролиз 282 г 40 % раствора нитрата меди (II) остановили после того, когда, масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ого раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
Решение.
- Запишем уравнение электролиза водного раствора нитрата меди (II):
2Cu(NO3)2 + 2H2O→(электролиз)2Сu + O2 + 4HNO3
- Уменьшение массы раствора произошло за счет выделения меди на катоде и кислорода на аноде.
Проверим, остался ли в растворе нитрат меди (II) после окончания электролиза (когда Cu(NO3)2полностьюпрореагирует, начнется электролиз воды).
- Найдем массу и количество вещества исходного сульфата меди (II):
m(Cu(NO3)2)исх. = m(Cu(NO3)2)р—ра∙ ω(Cu(NO3)2) = 282 г ∙ 0,4 = 112,8г
n(Cu(NO3)2)исх. = m(Cu(NO3)2)исх. / М(Cu(NO3)2) = 112,8г / 189г/моль = 0,6 моль.
Если весь Cu(NO3)2будет израсходован, то согласно уравнению электролиза масса образовавшейся меди составит 0,6 моль ∙ 64 г/моль = 38,4 г, что уже превосходит сумму масс меди и кислорода (32 г), выделившихся из раствора. Следовательно, после электролиза в растворе остался Cu(NO3)2.
- Добавленный гидроксид натрия реагирует с оставшимся Cu(NO3)2и образовавшейся азотной кислотой:
Cu(NO3)2+ 2NaOH → Cu(OH)2↓+ 2NaNO3(1)
HNO3+ NaOH → Na2SO4 + Н2О (2)
- Пусть количество вещества образовавшегося кислорода n(O2) = хмоль. Тогда количество вещества образовавшейся меди n(Сu) = 2xмоль. m(O2) = 32x(г), аm(O2) = 64∙2x = 128x(г). По условию задачи: m(O2) + m(O2) = 32.
32x + 128x = 32
х = 0,2(моль)
- Найдем количество вещества нитрата меди (II), подвергшегося электролизу:
n(Cu(NO3)2)реакц. = n(Cu) = 2xмоль = 2∙0,2 моль = 0,4 моль.
- Найдем количество вещества нитрата меди (II), оставшегося в растворе:
n(Cu(NO3)2)ост.= n(Cu(NO3)2)исх. – n(Cu(NO3)2)реакц.= 0,6 моль – 0,4 моль = 0,2 моль.
- Найдем количество вещества образовавшейся азотной кислоты:
n(HNO3) = 2∙n(CuSO4)реакц.= 2∙0,4 моль = 0,8 моль
- Определим массу и количество вещества исходного раствора гидроксида натрия:
m(NaOH(исх.))в-ва = m(NaOH(исх.))р-ра ∙ ω(NaOH) = 140г ∙ 0,4 = 56г
n(NaOH(исх.)) = m(NaOH(исх.))в-ва / M(NaOH) = 56г / 40 г/моль = 1,4моль.
- Определим количество вещества и массу гидроксида натрия, оставшегося в растворе:
n(NaOH)реакц.1 = 2∙n(CuSO4)ост. = 2∙0,2 моль = 0,4 моль.
n(NaOH)реакц.2 = n(HNO3) = 0,8 моль.
n(NaOH)ост. = n(NaOH)исх.–n(NaOH)реакц.1–n(NaOH)реакц.2 = 1,4моль–0,4 моль–0,8моль=0,2моль.
m(NaOH)ост. =n(NaOH)ост.∙ М(NaOH) = 0,2моль ∙ 40 г/моль = 8г.
- Найдем массу образовавшегося раствора и массовую долю гидроксида натрия в нем:
mкон.р-ра = m(Cu(NO3)2)р-ра + m(NaOH(исх.))р-ра – (m(Cu) + m(O2)) – m(Cu(OH)2)=
= 282г + 140 г – 32 г – (0,2 моль ∙ 98 г/моль) = 370,4г
ω(NaOH)кон.р-р = m(NaOH)ост./mкон.р-ра = 8г / 370,4 г = 0,216 (2,16 %).
Ответ: ω(NaOH) = 2,16 %.
Вариант 12
При проведении электролиза 340 г 20 %-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10 %-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора нитрата серебра (I):
4AgNO3 + 2H2O→(электролиз)4Ag + O2 + 4HNO3
- Найдем массу и количество вещества исходного нитрата серебра (I):
m(AgNO3)исх. = m(AgNO3)р-ра∙ ω(AgNO3) = 340 г ∙ 0,2 =68г
n(AgNO3)исх. = m(AgNO3)исх. / М(AgNO3) = 68г / 170 г/моль = 0,4моль.
- Найдем количество вещества выделившегося на аноде кислорода:
n(О2)= V(О2)/Vm= 1,12 л / 22,4 л/моль = 0,05 моль.
- Найдем количество вещества и массу AgNO3, оставшегося в растворе:
n(AgNO3)реакц. = 4∙n(О2) = 4∙0,05 моль = 0,2моль.
n(CuSO4)ост. = n(AgNO3)исх. – n(AgNO3)реакц. = 0,4моль – 0,2моль = 0,2моль.
m(AgNO3)ост. =n(AgNO3)ост.∙ М(AgNO3) = 0,2моль ∙ 170 г/моль = 34г.
- Найдем массу конечного раствора:
mкон.р-ра = m(AgNO3)р-ра – m(O2) – m(Ag)
m(О2) = n(О2)∙М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г.
n(Ag) = n(AgNO3)реакц.= 0,2моль.
m(Ag) = n(Ag)∙М(Ag) = 0,2моль ∙108г/моль = 21,6г.
mкон.р-ра = m(AgNO3)р-ра – m(O2) – m(Ag) = 340г – 1,6 г – 21,6г = 316,8г
ω(AgNO3)кон. = m(AgNO3)ост./mкон.р-ра = 34г / 316,8г = 0,107.
- Найдем массу и количество вещества нитрата серебра (I) в отобранной порции:
m(AgNO3)порц. = mпорц р-ра.∙ ω(AgNO3)кон. = 79,44 г ∙ 0,107 = 8,5г.
n(AgNO3)порц. = m(AgNO3)порц. / М(AgNO3) = 8,5г / 170 г/моль = 0,05моль.
AgNO3+ NaCl → AgCl +NaNO3
n(NaCl) = n(AgNO3)порц.= 0,05моль.
m(NaCl)в-ва = n(NaCl) ∙ М(NaCl) = 0,05моль∙ 58,5г/моль= 2,925г .
m(NaCl)р-ра = m(NaCl)в-ва / ω(NaCl) = 40,2г / 0,1 = 29,25г.
Ответ:m(NaCl)р-ра= 29,25г.
Вариант 13
При проведении электролиза 312 г 15 %-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20 %-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксил-ионов из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида натрия:
2NaCl + 2H2O→(электролиз)H2 + Cl2 + 2NaOH
- Найдем массу и количество вещества исходного хлорида натрия:
m(NaCl)исх. = m(NaCl)р-ра∙ ω(NaCl) = 312 г ∙ 0,15 = 46,8г
n(NaCl)исх. = m(NaCl)исх. / М(NaCl) = 46,8г / 58,5г/моль = 0,8моль.
- Найдем количествовещества выделившегося на катоде водорода:
n(H2)= V(H2)/Vm= 6,72л / 22,4 л/моль = 0,3моль.
- Найдем количество вещества и массу образовавшегося NaOH:
n(NaOH) = 2∙n(H2) = 2∙ 0,3моль = 0,6моль.
m(NaOH) = n(NaOH)∙М(NaOH) = 0,6моль ∙ 40г/моль = 24г.
- Найдем массу конечного раствора:
mкон.р-ра = m(NaCl)р-ра – m(H2)–m(Cl2)
m(H2) = n(H2)∙М(H2) = 0,3моль ∙ 2г/моль = 0,6г.
n(Cl2) = n(H2) = 0,3моль.
m(Cl2) = n(Cl2)∙М(Cl2) = 0,3моль ∙ 71г/моль = 21,3г.
mкон.р-ра = m(NaCl)р-ра – m(H2) – m(Cl2) = 312г – 0,6 г – 21,3г = 290,1г
ω(NaOH)кон. = m(NaOH)/mкон.р-ра = 24г / 290,1г = 0,0827
- Найдем массу и количество вещества гидроксида натрия в отобранной порции:
m(NaOH)порц. = mпорц р-ра.∙ ω(NaOH)кон. = 58,02 г ∙ 0,0827 = 4,8 г
n(NaOH)порц. = m(NaOH)порц. / М(NaOH) = 4,8г / 40= 0,12моль.
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
n(CuSO4) = 0,5∙n(NaOH)порц. = 0,5 ∙ 0,12 моль = 0,06моль
m(CuSO4)в—ва = n(CuSO4) ∙ М(CuSO4) = 0,06моль∙ 160 г/моль= 9,6 г .
m(CuSO4)р-ра = m(CuSO4)в-ва / ω(CuSO4) = 9,6г / 0,2 = 48 г.
Ответ:m(CuSO4)р-ра= 48 г.
Вариант 14
Электролиз 640 г 15 % раствора сульфата меди (II) остановили после того, когда, масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ого раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
Решение.
- Запишем уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O→(электролиз)2Сu + O2 + 2H2SO4
- Уменьшение массы раствора произошло за счет выделения меди на катоде и кислорода на аноде.
Проверим, остался ли в растворе сульфат меди (II) после окончания электролиза(когда CuSO4 полностьюпрореагирует, начнется электролиз воды).
- Найдем массу и количество вещества исходного сульфата меди (II):
m(CuSO4)исх. = m(CuSO4)р-ра∙ω(CuSO4) = 640 г ∙ 0,15 = 96г
n(CuSO4)исх. = m(CuSO4)исх./М(CuSO4) = 96г / 160 г/моль = 0,6моль.
Если весь CuSO4 будет израсходован, то согласно уравнению электролиза масса образовавшейся меди составит 0,6моль∙64 г/моль = 38,4 г, что уже превосходит сумму масс меди и кислорода (32 г), выделившихся из раствора. Следовательно, после электролиза в растворе остался CuSO4.
- Добавленный гидроксид натрия реагирует с оставшимся CuSO4 и образовавшейся серной кислотой:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4 (1)
Н2SO4 + 2NaOH → Na2SO4 + Н2О (2)
- Пусть количество вещества образовавшегося кислорода n(O2) = хмоль. Тогда количество вещества образовавшейся меди n(Сu) = 2xмоль. m(O2) = 32x(г), аm(O2) = 64∙2x = 128x(г). По условию задачи: m(O2) + m(O2) = 32.
32x + 128x = 32
х = 0,2(моль)
- Найдем количество вещества сульфата меди (II), подвергшегося электролизу:
n(CuSO4)реакц. = n(Cu) = 2xмоль= 2∙0,2 моль = 0,4моль.
- Найдем количество вещества сульфата меди (II), оставшегося в растворе:
n(CuSO4)ост. = n(CuSO4)исх. – n(CuSO4)реакц. = 0,6моль – 0,4моль = 0,2моль.
- Найдем количество вещества образовавшейся серной кислоты:
n(Н2SO4) = n(CuSO4)реакц.= 0,4 моль.
- Определим массу и количество вещества исходного раствора гидроксида натрия:
m(NaOH(исх.))в-ва = m(NaOH(исх.))р-ра ∙ ω(NaOH) = 400 г ∙ 0,2 = 80 г
n(NaOH(исх.)) = m(NaOH(исх.))в-ва / M(NaOH) = 80 г / 40 г/моль = 2 моль.
- Определим количество вещества и массу гидроксида натрия, оставшегося в растворе:
n(NaOH)реакц.1 = 2∙n(CuSO4)ост. = 2∙0,2моль = 0,4моль.
n(NaOH)реакц.2 = 2∙n(Н2SO4) = 2∙0,4 моль = 0,8 моль.
n(NaOH)ост. = n(NaOH)исх. – n(NaOH)реакц.1– n(NaOH)реакц.2= 2 моль – 0,4моль– 0,8 моль = 0,8моль.
m(NaOH)ост. =n(NaOH)ост.∙ М(NaOH) = 0,8моль ∙ 40 г/моль = 32г.
- Найдем массу образовавшегося раствора и массовую долю гидроксида натрия в нем:
mкон.р-ра = m(CuSO4)р-ра + m(NaOH(исх.))р-ра – (m(Cu) + m(O2)) – m(Cu(OH)2)=
= 640г + 400 г – 32 г– (0,2моль ∙ 98 г/моль) = 988,4г
ω(NaOH)кон.р-р = m(NaOH)ост./mкон.р-ра = 32г / 988,4 г = 0,324 (3,24 %).
Ответ: ω(NaOH) = 3,24%.
Вариант 15
При проведении электролиза 360 г 18,75 % раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2→(электролиз)Сu + Cl2
- Найдем массу и количество вещества исходного хлорида меди (II):
m(CuCl2)исх. = m(CuCl2)р-ра ∙ ω(CuCl2) = 360 г ∙ 0,1875 = 67,5г.
n(CuCl2)исх. = m(CuCl2)исх./М(CuCl2) = 67,5г / 135 г/моль = 0,5моль.
- Найдем количество вещества выделившегося на аноде хлора:
n(Cl2)= V(Cl2)/Vm= 4,48 л / 22,4 л/моль = 0,2 моль.
- Найдем количество вещества и массу CuCl2, оставшегося, в растворе:
n(CuCl2)реакц. = n(Cl2) = 0,2 моль.
n(CuCl2)ост. = n(CuCl2)исх. – n(CuCl2)реакц. = 0,5моль – 0,2 моль = 0,3моль.
m(CuCl2)ост. =n(CuCl2)ост. ∙ М(CuCl2) = 0,3моль∙135 г/моль = 40,5г.
- Найдем массу конечного раствора:
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu)
m(Cl2) = n(Cl2) ∙ М(Cl2) = 0,2 моль ∙ 71 г/моль = 14,2 г.
n(Cu) = n(Cl2) = 0,2 моль.
m(Cu) = n(Cu) ∙ М(Cu) = 0,2 моль ∙ 64 г/моль = 12,8 г.
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu) = 360 г – 14,2 г – 12,8 г = 333 г
ω(CuCl2)кон. = m(CuCl2)ост. / mкон.р-ра = 40,5г / 333 г = 0,122.
- Найдем массу и количество вещества хлорида меди (II) в отобранной порции:
m(CuCl2)порц. = mпорц р-ра.∙ ω(CuCl2)кон. = 22,2 г∙ 0,122 = 2,71г.
n(CuCl2)порц. = m(CuCl2)порц. / М(CuCl2) = 2,71г / 135 г/моль = 0,02моль.
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
- Найдем массу раствора гидроксида натрия, необходимого для осаждения Cu2+:
n(NaOH) = 2∙n(CuCl2)порц. = 2 ∙ 0,02моль = 0,04моль.
m(NaOH)в-ва = n(NaOH) ∙ М(NaOH) = 0,04моль ∙ 40 г/моль = 1,6г.
m(NaOH)р-ра = m(NaOH)в-ва / ω(NaOH) = 1,6г/ 0,2 = 8г.
Ответ:m(NaOH)р-ра = 8г.
Вариант 16
При проведении электролиза 624 г 10 %-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10 %-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида бария:
ВaCl2 + 2H2O →(электролиз)H2 + Cl2 + Вa(OH)2
- Найдем массу и количество вещества исходного хлорида бария:
m(ВaCl2)исх. = m(ВaCl2)р-ра∙ ω(ВaCl2) = 624 г ∙ 0,1 = 62,4г
n(ВaCl2)исх. = m(ВaCl2)исх. / М(ВaCl2) = 62,4г / 208г/моль = 0,3моль.
- Найдем количествовещества выделившегося на катоде водорода:
n(H2)= V(H2)/Vm= 4,48л / 22,4 л/моль = 0,2моль.
- Найдем количество вещества и массу образовавшегося Вa(OH)2:
n(Вa(OH)2) = n(H2) = 0,2моль.
m(Вa(OH)2) = n(Вa(OH)2)∙М(Вa(OH)2) = 0,2моль ∙ 171г/моль = 34,2г.
- Найдем количество вещества и массу ВaCl2, оставшегося в растворе:
n(ВaCl2)реакц. = n(H2) = 0,2моль.
n(ВaCl2)ост. = n(ВaCl2)исх. – n(ВaCl2)реакц. = 0,3моль – 0,2моль = 0,1моль.
m(ВaCl2)ост. =n(ВaCl2)ост.∙ М(ВaCl2) = 0,1моль ∙ 208г/моль = 20,8г.
- Найдем массу конечного раствора:
mкон.р-ра = m(ВaCl2)р-ра – m(H2)–m(Cl2)
m(H2) = n(H2)∙М(H2) = 0,2моль ∙ 2г/моль = 0,4г.
n(Cl2) = n(H2) = 0,2моль.
m(Cl2) = n(Cl2)∙М(Cl2) = 0,2моль ∙ 71г/моль = 14,2г.
mкон.р-ра = m(ВaCl2)р-ра – m(H2) – m(Cl2) = 624г – 0,4г – 14,2г = 609,4г
ω(ВaCl2)кон. = m(ВaCl2)/mкон.р-ра = 20,8г / 609,4г = 0,0341
ω(Вa(OH)2)кон. = m(Вa(OH)2)/mкон.р-ра = 34,2г / 609,4г = 0,0561
- Найдем массу и количество вещества гидроксида бария в отобранной порции:
m(Вa(OH)2)порц. = mпорц р-ра.∙ ω(Вa(OH)2)кон. = 91,41 г ∙ 0,0561 = 5,13 г
n(Вa(OH)2)порц. = m(Вa(OH)2)порц. / М(Вa(OH)2) = 5,13г / 171г/моль = 0,03моль.
- Найдем массу и количество вещества хлорида бария в отобранной порции:
m(ВaCl2)порц. = mпорц р-ра.∙ ω(ВaCl2)ост. = 91,41 г ∙ 0,0341 = 3,12г
n(ВaCl2)порц. = m(ВaCl2)порц. / М(ВaCl2) = 3,12г / 208 г/моль = 0,015моль.
Вa(OH)2 + Na2CO3 → ВaCO3 + 2NaOH (1)
ВaCl2 + Na2CO3 → ВaCO3 + 2NaCl (2)
- Найдем массу растворакарбоната натрия, необходимого для осаждения ионов Вa2+:
Изуравнения (1): n(Na2CO3)1 = n(Вa(OH)2)порц. = 0,03моль
Изуравнения (2): n(Na2CO3)2 = n(ВaCl2)порц.= 0,015моль
n(Na2CO3)= n(Na2CO3)1 + n(Na2CO3)2 = 0,03 моль + 0,015 моль = 0,045 моль
m(Na2CO3)в—ва = n(Na2CO3)∙ M(Na2CO3) = 0,045 моль∙ 106 г/моль = 4,77 г
m(Na2CO3)р—ра = m(Na2CO3)в—ва/ ω(Na2CO3) = 4,77 г / 0,1 = 47,7 г.
Ответ:m(Na2CO3)р-ра= 47,7 г.
Вариант 17
При проведении электролиза 500 г 16 %-ного раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10 %-ного раствора карбоната натрия. Определитемассовую долю сульфата меди (II) в полученном растворе.
Решение.
- Запишем уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O→(электролиз)2Сu + O2 + 2H2SO4
- Найдем массу и количество вещества исходного сульфата меди (II):
m(CuSO4)исх. = m(CuSO4)р-ра∙ ω(CuSO4) = 500 г ∙ 0,16 = 80 г
n(CuSO4)исх. = m(CuSO4)исх. / М(CuSO4) = 80 г / 160 г/моль = 0,5 моль.
- Найдем количество вещества выделившегося на аноде кислорода:
n(О2)= V(О2)/Vm= 1,12 л / 22,4 л/моль = 0,05 моль.
- Найдем количество вещества и массуCuSO4, оставшегосяв растворе после электролиза:
n(CuSO4)реакц. = 2∙n(О2) = 2∙0,05 моль = 0,1 моль.
n(CuSO4)ост. = n(CuSO4)исх. – n(CuSO4)реакц. = 0,5 моль – 0,1 моль = 0,4 моль.
m(CuSO4)ост. =n(CuSO4)ост.∙ М(CuSO4) = 0,4моль ∙ 160г/моль = 64г.
- Найдем количество вещества образовавшейся серной кислоты:
n(Н2SO4) = n(CuSO4)реакц.= 0,1моль.
- Найдем массу и количество вещества добавленного карбоната натрия:
m(Nа2СО3) = m(Nа2СО3)р-ра∙ ω(Nа2СО3) = 53 г ∙ 0,1 = 5,3г
n(Nа2СО3) = m(Nа2СО3)/ М(Nа2СО3) = 5,3г / 106г/моль = 0,05моль.
- При добавлении карбоната натрия возможно одновременное протекание реакций:
2CuSO4 + 2Nа2СО3 + Н2O → (СuОН)2СО3↓ + СО2↑ + 2Na2SO4(1)
Н2SO4 + Na2CO3 → СО2↑ + Н2О + Na2SO4 (2)
Т.к. серная кислота в избытке, то она сразу же растворяет образующийся по реакции (1) основный карбонат меди с образованием CuSO4 и выделением CO2:
(СuОН)2СО3+ 2Н2SO4→2CuSO4+ СО2↑ + 3Н2О (3)
Таким образом, количество CuSO4в растворе остается неизменным, а общее количество выделившегося CO2в реакциях (2) и (3) определяется количеством карбоната натрия:
n(Na2CO3) = n(СО2) = 0,05 моль
- Найдем массу конечного раствора:
mкон.р-ра = m(CuSO4)р-ра – m(Сu)–m(О2) + m(Nа2СО3) – m(СО2)
m(О2) = n(О2) ∙ М(О2) = 0,05моль ∙ 32г/моль = 1,6г.
n(Cu) = 2∙n(О2) = 2 ∙ 0,05моль = 0,1 моль.
m(Cu) = n(Cu) ∙ М(Cu) = 0,1моль ∙ 64 г/моль = 6,4г.
m(СО2) = n(СО2)∙М(СО2) = 0,05 моль ∙ 44 г/моль= 2,2 г.
mкон.р-ра = m(CuSO4)р-ра – m(Сu)–m(О2) + m(Nа2СО3) – m(СО2) =
= 500 г – 6,4г – 1,6г + 53 г – 2,2 г = 542,8 г.
- Найдем массовую долю сульфата меди (II) в полученном растворе:
ω(CuSO4)кон.р-р = m(CuSO4)ост./mкон.р-ра = 64г / 542,8 г = 0,118 (11,8 %).
Ответ: ω(CuSO4) = 11,8 %.
Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Задания 34 (C4) (2016). Расчет массовой доли химического соединения в смеси
Задание №1
Смесь карбоната магния и карбоната натрия нагрели, в результате чего выделилось 4,48 л газа (в расчете на н.у.). Остаток может прореагировать с 73 г 25%-ной соляной кислоты. Определите массовую долю карбоната натрия в смеси.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 23,98%
Пояснение:
Разложению подвергается только нерастворимый карбонат магния:
MgCO3 → MgO + CO2↑ (нагревание)
С соляной кислотой реагируют образовавшийся оксид магния и карбонат натрия:
MgO + 2HCl → MgCl2 + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Вычислим количество углекислого газа, выделяющегося при разложении карбоната магния, и соляной кислоты, реагирующей с оксидом магния и карбонатом натрия:
ν(CO2) = V(CO2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль, следовательно, ν(MgO) = 0,2 моль;
m(HCl) = m(р-ра HCl) · ω(HCl) = 73 г · 0,25 = 18,25 г;
ν(HCl) = m(HCl)/M(HCl) = 18,25 г/36,5 г/моль = 0,5 моль.
На реакцию с MgO расходуется 0,4 моль HCl, следовательно, на реакцию с Na2CO3 остается 0,1 моль.
ν(Na2CO3)=1/2ν(HCl), ν(Na2CO3) = 0,1 моль/2 = 0,05 моль;
m(MgCO3) = 84 г/моль · 0,2 моль = 16,8 г;
m(Na2CO3) = 106 г/моль · 0,05 моль = 5,3 г;
ω(Na2CO3) = m(Na2CO3)/m(смеси) = 5,3 г/22,1 г ≈ 0,2398 (23,98%).
Задание №2
При нагревании карбоната кальция часть вещества разложилась, при этом выделился газ объемом 4,48 л (в пересчете на н.у.). К твердому остатку массой 41,2 г добавили 465,5 г избытка раствора соляной кислоты. Определите массовую долю соли в образовавшемся растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 11,25%
Пояснение:
При прокаливании карбоната кальция образуется оксид кальция и выделяется углекислый газ:
CaCO3 → CaO + CO2↑ (нагревание)
Вычислим количество вещества углекислого газа:
ν(CO2) = V(CO2)/Vm = 4,48 л/22,4 л/моль = 0,2 моль, следовательно, ν(CaO) = 0,2 моль и m(CaO) = 56 г/моль · 0,2 моль = 11,2 г.
Масса и количество вещества непрокаленного карбоната кальция равна:
mост.(CaCO3) = 41,2 г – 11,2 = 30 г; νост.(CaCO3) = 30 г/100 г/моль = 0,3 моль.
С соляной кислотой реагируют и оксид кальция, и карбонат кальция:
CaO + 2HCl → CaCl2 + H2O
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Поскольку в реакции карбоната кальция с соляной кислотой выделяется углекислый газ, необходимо учитывать его массу:
νост.(CaCO3) = ν(CO2) = 0,3 моль, m(CO2) = 0,3 моль · 44 г/моль = 13,2 г.
Общие количество вещества и масса хлорида кальция равны:
ν(CaCl2) = νост.(CaCO3) + ν(CaO) = 0,3 моль + 0,2 моль = 0,5 моль;
m(CaCl2) = M(CaCl2) · ν(CaCl2) = 111 г/моль · 0,5 моль = 55,5 г.
Массовая доля соли рассчитывается по формуле:
ω(CaCl2) = m(CaCl2)/m(р-ра) = 55,5 г/(465,5 г + 41,2 г − 13,2 г) = 0,1125 (11,25%)
Задание №3
При нагревании образца нитрата магния часть вещества разложилась. Масса твердого остатка составила 15,4 г. Этот остаток может прореагировать с 20 г 20%-ного раствора гидроксида натрия. Определите массу исходного образца и объем выделившихся газов (в пересчете на н.у.).
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 37 г; 11,2 л
Пояснение:
При разложении нитрата магния образуются оксид магния, диоксид азота и кислород:
2Mg(NO3)2 → 2MgO + 4NO2↑ + O2↑ (нагревание)
Оксид магния реагирует с водой только при кипячении, поэтому с водным раствором щелочи взаимодействует оставшийся нитрат магния:
Mg(NO3)2 + 2NaOH → Mg(OH)2↓ + 2NaNO3
Вычислим массу и количество вещества щелочи, взаимодействующей с нитратом магния:
m(NaOH) = 20 г · 0,2 = 4 г; ν(NaOH) = 4 г/40 г/моль = 0,1 моль, следовательно, количество вещества нитрата магния, реагирующего с щелочью, равно:
νост.(Mg(NO3)2) = 1/2ν(NaOH) = 0,1 моль/2 = 0,05 моль, при этом
mост.(Mg(NO3)2 ) = 148 г/моль · 0,05 моль = 7,4 г.
Вычислим массу оксида магния:
m(MgO) = 15,4 г – 7,4 г = 8 г;
ν(MgO) = 8 г/40 г/моль = 0,2 моль; ν(MgO) = ν(Mg(NO3)2); m(Mg(NO3)2 ) = 148 г/моль · 0,2 моль = 29,6 г;
mобщ.(Mg(NO3)2 ) = 7,4 г + 29,6 г = 37 г.
По уравнению реакции разложения нитрата магния:
ν(MgO) = 2/5ν(NO2 + O2), отсюда ν(NO2 + O2) = 5 · 0,2 моль/2 = 0,5 моль, V(NO2 + O2) = 0,5 моль · 22,4 л/моль = 11,2 л.
Задание №4
При нагревании образца нитрата магния часть вещества разложилась. При этом образовалось 53,6 г твердого остатка. Этот остаток прореагировал с раствором гидроксида натрия массой 200 г с массовой долей щелочи 24%. В результате этой реакции образовался раствор массой 206,4 г с массовой долей щелочи 15,5%. Определите объем выделившихся при разложении нитрата магния газов (в пересчете на н.у.).
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 33,6 л
Пояснение:
При разложении нитрата магния образуются оксид магния, диоксид азота и кислород:
2Mg(NO3)2 → 2MgO + 4NO2↑ + O2↑ (нагревание)
Неразложившийся нитрат магния реагирует с водным раствором щелочи по реакции:
Mg(NO3)2 + 2NaOH → Mg(OH)2↓ + 2NaNO3
Вычислим исходные массу и количество вещества щелочи, взаимодействующей с нитратом магния:
mисх.(NaOH) = m(р-ра NaOH) · ω(NaOH) = 200 г · 0,24 = 48 г;
νисх.(NaOH) = 48 г/40 г/моль = 1,2 моль.
Вычислим массу и количество вещества гидроксида натрия в полученном растворе:
mконеч.(NaOH) = m(р-ра NaOH) · ω(NaOH) = 206,4 г · 0,155 = 32 г;
νконеч.(NaOH) = 32 г/40 г/моль = 0,8 моль, следовательно, прореагировало ν(NaOH) = 1,2 моль − 0,8 моль = 0,4 моль.
По уравнению реакции нитрата магния со щелочью νост.(Mg(NO3)2) = 1/2ν(NaOH) = 0,2 моль;
mост.(Mg(NO3)2) = 148 г/моль · 0,2 моль = 29,6 г
Масса MgO в твердом остатке равна: m(MgO) = 53,6 г – 29,6 г = 24 г;
ν(MgO) = 24 г/40 г/моль = 0,6 моль.
По уравнению реакции разложения ν(MgO) = 2/5ν(NO2 + O2), следовательно, ν(NO2 + O2) = 5/2 · 0,6 моль = 1,5 моль;
V(NO2 + O2) = 1,5 моль · 22,4 л/моль = 33,6 л.
Задание №5
При нагревании образца нитрата меди (II) часть вещества разложилась, при этом образовалось 26,8 г твердого остатка. Объем выделившихся газов составил 5,6 л (в пересчете на н.у.). Остаток растворили в 50 мл воды и добавили 10%-ный раствор гидроксида натрия, способный полностью осадить ионы меди. Определите массовую долю нитрата натрия в полученном растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 12,23%
Пояснение:
При разложении нитрата меди образуются оксид меди, диоксид азота и кислород:
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ (нагревание)
С водным раствором щелочи взаимодействует нитрат меди:
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
Вычислим количество газов, образующихся при разложении нитрата меди:
ν(NO2 + O2) = 5,6 л/22,4 л/моль = 0,25 моль.
По уравнению реакции ν(CuO) = ν(Cu(NO3)2) = 2/5 · 0,25 моль = 0,1 моль, следовательно, m(CuO) = 8 г.
Масса и количество вещества оставшегося нитрата меди (II):
mост.(Cu(NO3)2) = 26,8 г – 8 г = 18,8 г; νост.(Cu(NO3)2) = 18,8 г/188 г /моль = 0,1 моль;
νост.(Cu(NO3)2) = ν(Cu(OH)2) = 0,1 моль; νост.(Cu(NO3)2) = 1/2ν(NaOH);
ν(NaOH) = ν(NaNO3) = 0,2 моль; m(NaOH) = 8 г; m(р-ра NaOH) = 8 г/0,1 = 80 г;
m(Cu(OH)2) = 0,1 моль · 98 г/моль = 9,8 г; m(NaNO3) = 0,2 моль · 85 г/моль = 17 г.
Вычислим массу получившегося раствора с учетом того, что CuO не растворяется в воде:
m(р-ра) = 18,8 г + 50 г + 80 г – 9,8 г = 139 г;
ω(NaNO3) = 17 г/139 г = 0,1223 (12,23%).
[adsp-pro-3]
Задание №6
При разложении нитрата меди (II) выделилась смесь газов объемом 11,2 л (в пересчете на н.у.). Масса остатка составила 94 г. К остатку добавили 292 г 10%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 3,78%
Пояснение:
При разложении нитрата меди (II) образуется смесь газов – диоксида азота (IV) и кислорода:
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ (нагревание)
С водным раствором соляной кислоты реагирует оксид меди, образовавшийся при прокаливании нитрата меди (II):
CuO + 2HCl → CuCl2 + H2O
Вычислим количество газов, образующихся при разложении нитрата меди:
ν(NO2 + O2) = 11,2 л/22,4 л/моль = 0,5 моль.
По уравнению реакции ν(CuO) = 2/5 · ν(NO2 + O2) = 0,2 моль; m(CuO) = 0,2 моль · 80 г/моль = 16 г.
Вычисли массу и количество вещества хлороводорода в исходном растворе:
mисх.(HCl) = 292 г · 0,1 = 29,2 г; νисх.(HCl) = 29,2 г/36,5 г/моль = 0,8 моль.
По уравнению реакции взаимодействия оксида меди (II) с соляной кислотой νреаг.(HCl) = 2ν(CuO), следовательно, с CuO прореагировало νреаг.(HCl) = 2 · 0,2 моль = 0,4 моль.
В растворе осталось νост.(HCl) = 0,8 моль – 0,4 моль = 0,4 моль; mост.(HCl) = 36,5 г/моль · 0,4 моль = 14,6 г.
Вычислим массу образовавшегося раствора:
m(р-ра) = 94 г + 292 г = 386 г.
Массовая доля соляной кислоты в образовавшемся растворе равна:
ω = mост.(HCl)/m(р-ра) · 100% = 14,6/386 г · 100% = 3,78%.
Задание №7
При разложении нитрата серебра выделилась смесь газов объемом 6,72 л (в пересчете на н.у.). Масса остатка составила 25 г. После этого остаток поместили в 50 мл воды и добавили 18,25 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 4,25%
Пояснение:
При разложении нитрата серебра выделяется серебро и выделяются диоксид азота и кислород:
2AgNO3 → 2Ag + 2NO2↑ + O2↑ (нагревание)
С водным раствором щелочи взаимодействует нитрат меди:
AgNO3 + HCl → AgCl↓ + HNO3
Серебро не взаимодействует с соляной кислотой.
Вычислим количество газов, образующихся при разложении нитрата серебра:
ν(NO2 + O2) = 6,72 л/22,4 л/моль = 0,3 моль.
По уравнению реакции разложения нитрата серебра:
ν(Ag) = 3/2ν(NO2 + O2), следовательно, ν(Ag) = 0,2 моль, m(Ag) = 108 г/моль · 0,2 моль = 21,6 г.
Масса остатка складывается из образовавшегося при разложении нитрата серебра металлического серебра и не прореагировавшей полностью соли, следовательно,
mост.(AgNO3) = 25 г – 21,6 г = 3,4 г; νост.(AgNO3) = 3,4 г/170 г/моль = 0,02 моль.
Вычислим массу и количество вещества соляной кислоты в ее исходном растворе:
mисх.(HCl) = 18,25 г · 0,2 = 3,65 г; νост.(HCl) = 3,65 г/36,5 г/моль = 0,1 моль.
По уравнению взаимодействия нитрата серебра с соляной кислотой νост.(AgNO3) = ν(AgCl) = ν(HCl), следовательно, количество вещества и масса непрореагировавшей соляной кислоты:
νост.(HCl) = 0,1 моль – 0,02 моль = 0,08 моль; mост.(HCl) = 0,08 моль · 36,5 г/моль = 2,92 г.
Вычислим массу выпавшего осадка AgCl:
m(AgCl) = M(AgCl) · ν(AgCl) = 0,02 моль · 143,5 г/моль = 2,87 г.
Масса получившегося раствора равна:
m(р-ра) = 3,4 г + 18,25 г + 50 г – 2,87 г = 68,78 г.
Массовая доля в получившемся растворе соляной кислоты равна:
ω(HCl) = mост.(HCl)/m(р-ра) = 2,92 г/68,78 г = 0,0425 (4,25%).
Задание №8
При нагревании образца нитрата железа (III) часть вещества разложилась. При этом образовалось 88,6 г твердого остатка. Этот остаток может прореагировать с 225 г 16%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата железа (III) и объем выделившейся смеси газов (в пересчете на н.у.).
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 121 г; 16,8 л
Пояснение:
При разложении нитрата железа (III) образуется смесь газов – диоксида азота (IV) и кислорода:
4Fe(NO3)3 → 2Fe2O3 + 12NO2↑ + 3O2↑ (нагревание)
Оксид железа (III) со щелочами не взаимодействует. С гидроксидом натрия в реакцию вступает нитрат железа (III), при этом в осадок выпадает гидроксид железа (III):
Fe(NO3)3 + 3NaOH → Fe(OH)3↓ + 3NaNO3
Вычислим массу и количество вещества исходного гидроксида натрия:
mисх.(NaOH) = 225 г · 0,16 = 36 г; νисх.(NaOH) = 36 г/40 г/моль = 0,9 моль.
Та часть вещества нитрата железа, которая не разложилась, вступает в обменную реакцию с гидроксидом натрия с образованием осадка – гидроксида железа (III).
По уравнению реакции нитрата железа (III) со щелочью:
νост.(Fe(NO3)3) = 1/3ν(NaOH), следовательно, νост.(Fe(NO3)3) = 0,9 моль/3 = 0,3 моль, mост.(Fe(NO3)3) = 242 г/моль · 0,3 моль = 72,6 г.
Отсюда находим массу и количество вещества образовавшегося оксида железа (III):
m(Fe2O3) = 88,6 г – 72,6 г = 16 г; ν(Fe2O3) = 16 г/160 г/моль = 0,1 моль.
Вычислим количество вещества и массу разложившегося нитрата железа (III):
νразл.(Fe(NO3)3) = 0,1 моль · 2 = 0,2 моль, mразл.(Fe(NO3)3) = 242 г/моль · 0,2 моль = 48,4 г.
Вычислим общую массу нитрата железа (III):
mобщ.(Fe(NO3)3) = 48,4 г + 72,6 г = 121 г.
Вычислим количество и объем выделившихся газов – диоксида азота и кислорода из уравнения разложения нитрата железа:
ν(NO2 + O2) = 0,1 моль/2 · 15 = 0,75 моль; V(NO2 + O2) = 0,75 моль · 22,4 л/моль = 16,8 л.
Задание №9
При нагревании гидрокарбоната натрия часть вещества разложилась, при этом выделилось 0,448 л углекислого газа (в пересчете на н.у.). Масса безводного остатка составила 4,64 г. Остаток добавили к 0,15%-ному раствору гидроксида кальция. При этом в растворе не осталось ионов кальция и карбонат-анионов. Определите массовую долю гидроксида натрия в образовавшемся растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 0,11%
Пояснение:
При нагревании гидрокарбоната натрия образуется средняя соль – карбонат натрия и выделяется углекислый газ:
2NaHCO3 → Na2CO3 + CO2↑ + H2O (нагревание)
Поскольку в растворе не осталось ионов кальция и карбонат-анионов, следовательно, в осадок выпала средняя соль – карбонат кальция (гидрокарбонат кальция растворим в воде):
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
NaHCO3 + Ca(OH)2 = CaCO3↓ + NaOH + H2O
Вычислим количество углекислого газа, выделившегося при прокаливании гидрокарбоната:
ν(CO2) = 0,448 л/22,4 л/моль = 0,02 моль, следовательно, образовалось 0,02 моль карбоната натрия и прореагировало 0,04 моль гидрокарбоната натрия.
Вычислим массу образовавшегося карбоната и оставшегося гидрокарбоната натрия:
m(Na2CO3) = 106 г/моль · 0,02 моль = 2,12 г;
m(NaHCO3) = 4,64 г – 2,12 г = 2,52 г; ν(NaHCO3) = 2,52 г/84 г/моль = 0,03 моль.
С гидроксидом кальция взаимодействуют образовавшийся карбонат и неразложившийся гидрокарбонат натрия.
Поскольку с гидроксидом кальция вступают эквивалентные количества гидрокарбоната и карбоната натрия, то
ν(Ca(OH)2) = 0,02 моль + 0,03 моль = 0,05 моль; m(Ca(OH)2) = 74 г/моль · 0,05 моль = 3,7 г
Вычислим массу 0,15%-ного раствора гидроксида кальция:
m(р-ра Ca(OH)2) = 3,7 г/0,0015 = 2466,67 г.
Карбонат кальция выпадает в осадок, поэтому его массу необходимо вычесть из массы образовавшегося раствора. Вычислим массу карбоната кальция:
ν(CaCO3) = 0,05 моль · 100 г/моль = 5 г.
Вычислим количество вещества и массу гидроксида натрия:
ν(NaOH) = 0,02 моль · 2 + 0,03 моль = 0,07 моль; m(NaOH) = 0,07 моль · 40 г/моль = 2,8 г.
Определим массу раствора и массовую долю гидроксида натрия в образовавшемся растворе:
m(р-ра) = 2466,67 г + 4,64 г – 5 г = 2466,31 г;
ω(NaOH) = 2,8 г/2466,31 г · 100% = 0,11%.
Задание №10
При нагревании нитрата меди (II) часть вещества разложилась, при этом образовался твердый остаток массой 50,8 г. Остаток прореагировал с раствором гидроксида натрия массой 150 г с массовой долей щелочи 20%. В результате этой реакции образовался раствор массой 159 г с массовой долей щелочи 13,84%. Определите объем выделившихся при разложении нитрата меди (II) газов (в пересчете на н.у.).
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 22,4 л
Пояснение:
При разложении нитрата меди (II) образуется смесь газов – диоксида азота (IV) и кислорода:
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ (нагревание)
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
Вычислим исходные и конечные массы и количества вещества гидроксида натрия:
mисх.(NaOH) = 150 г · 0,2 = 30 г; νисх.(NaOH) = 30 г/40 г/моль = 0,75 моль;
mконеч.(NaOH) = 159 г · 0,1384 ≈ 22 г; νисх.(NaOH) = 22 г/40 г/моль ≈ 0,55 моль;
следовательно, с оставшимся нитратом меди (II) прореагировало:
νреаг.(NaOH) = 0,75 моль – 0,55 моль = 0,2 моль.
По уравнению обменной реакции нитрата меди (II) с гидроксидом натрия ν(Cu(NO3)2) = 1/2ν(NaOH),
поэтому ν(Cu(NO3)2) = 0,2 моль/2 = 0,1 моль и m(Cu(NO3)2) = 188 г/моль · 0,1 моль = 18,8 г.
Вычислим массу и количество вещества образовавшегося в результате разложения нитрата меди (II) оксида меди (II):
m(CuO) = 50,8 г – 18,8 г = 32 г; ν(CuO) = 32 г/80 г/моль = 0,4 моль.
По уравнению реакции разложения нитрата меди (II) ν(CuO) = 2/5ν(NO2 + O2), следовательно,
ν(NO2 + O2) = 0,4 моль · 5/2 = 1 моль; V(NO2 + O2) = 1 моль · 22,4 л/моль = 22,4 л.
[adsp-pro-3]
Задание №11
Фосфид кальция массой 36,4 г подвергли гидролизу. Образовавшийся газ сожгли в избытке кислорода. Полученную кислоту смешали с 50 мл 25%-ного раствора натриевой щелочи (плотность ρ = 1,28 г/см3). Определите состав образовавшейся соли и ее массовую долю в растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: NaH2PO4; 46,51%
Пояснение:
Фосфид кальция гидролизуется с образованием щелочи и выделением фосфина:
Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3↑
В присутствии кислорода фосфин самопроизвольно воспламеняется:
PH3 + 2O2 → H3PO4
С гидроксидом натрия ортофосфорная кислота реагирует с образованием средней либо кислых солей ортофосфорной кислоты в зависимости от соотношений реагентов.
Вычислим количество вещества фосфида кальция:
ν(Ca3P2) = 36,4 г/182 г/моль = 0,2 моль.
По уравнению гидролиза фосфида кальция ν(PH3) = 2ν(Ca3P2), следовательно, ν(PH3) = ν(H3PO4) = 2 · 0,2 моль = 0,4 моль.
Вычислим массу раствора натриевой щелочи, массу и количество вещества гидроксида натрия:
m(р-ра NaOH) = V(р-ра NaOH) · ρ(р-ра NaOH) = 50 мл · 1,28 г/см3 = 64 г;
m(NaOH) = 64 г · 0,25 = 16 г; ν(NaOH) = 16 г/40 г/моль = 0,4 моль.
По условию задачи ν(H3PO4) = ν(NaOH) = 0,4 моль, следовательно, продуктом реакции эквимолярных количеств щелочи и ортофосфорной кислоты является дигидроортофосфат натрия − NaH2PO4.
Уравнение реакции между эквимолярными количествами гидроксида натрия и ортофосфорной кислоты записывается в виде:
H3PO4 + NaOH → H2O + NaH2PO4 (дигидроортофосфат натрия)
Для нахождения массы раствора необходимо вычислить массы ортофосфорной кислоты и дигидроортофосфата натрия:
m(H3PO4) = 0,4 моль · 98 г/моль = 39,2 г; m(NaH2PO4) = 0,4 моль · 120 г/моль = 48 г.
Вычислим массу образовавшегося раствора:
m(р-ра) = 64 г + 39,2 г = 103,2 г.
Определим массовую долю дигидроортофосфата натрия в образовавшемся растворе:
ω(NaH2PO4) = 48 г/103,2 г · 100% = 46,51%.
Задание №12
При нагревании образца нитрата цинка часть вещества разложилась, при этом выделилось 5,6 л газов (в пересчете на н.у.). Остаток массой 64,8 г полностью растворили в минимальном объеме 28%-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в конечном растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 19,26%
Пояснение:
При разложении нитрата цинка (соли амфотерного металла) образуются оксид цинка, бурый газ – диоксид азота (IV) и кислород:
2Zn(NO3)2 → 2ZnO + 4NO2↑ + O2↑ (нагревание)
Поскольку в условии задачи речь идет о полном растворении остатка, состоящего из оксида и нитрата цинка, то в итоге образуется комплексная соль цинка – тетрагидроксоцинкат натрия:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
Zn(NO3)2 + 4NaOH → Na2[Zn(OH)4] + 2NaNO3
Вычислим количество смеси газов – NO2 и O2:
ν(NO2 + O2) = 5,6 л/22,4 л/моль = 0,25 моль
По уравнению реакции ν(ZnO) = 2/5ν(NO2 + O2) = 2/5 · 0,25 моль = 0,1 моль;
m(ZnO) = 81 г/моль · 0,1 моль = 8,1 г.
Вычисли массу и количество вещества оставшегося нитрата цинка:
mост.(Zn(NO3)2) = 64,8 г – 8,1 г = 56,7 г; νост.(Zn(NO3)2) = 56,7 г/189 г/моль = 0,3 моль.
По уравнениям реакции взаимодействия оксида цинка и нитрата цинка со щелочью, количество вещества и масса гидроксида натрия равно:
ν(NaOH) = 0,1 моль · 2 + 0,3 моль · 4 = 1,4 моль; m(NaOH) = 1,4 моль · 40 г/моль = 56 г.
Вычислим массу щелочного раствора:
m(р-ра NaOH) = 56 г/0,28 = 200 г.
Вычислим количество вещества и массу нитрата натрия:
ν(NaNO3) = 2νост.(Zn(NO3)2) = 2 · 0,3 моль = 0,6 моль; m(NaNO3) = 0,6 моль · 85 г/моль = 51 г.
Вычислим массу образовавшегося раствора и массовую долю нитрата натрия в нем:
m(р-ра) = 64,8 г + 200 г = 264,8 г;
ω(NaNO3) = 51 г/264,8 г · 100% = 19,26%.
Задание №13
При нагревании образца нитрата алюминия часть вещества разложилась, при этом выделилось 6,72 л газов (в пересчете на н.у.). Остаток массой 25,38 г полностью растворили в минимальном объеме 24%-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в конечном растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 24,20%
Пояснение:
При разложении нитрата алюминия (соли амфотерного металла) образуются оксид алюминия, бурый газ – диоксид азота (IV) и кислород:
4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑ (нагревание)
Поскольку в условии задачи речь идет о полном растворении остатка, состоящего из оксида и нитрата алюминия, то в итоге образуется комплексная соль цинка – тетрагидроксоалюминат натрия:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al(NO3)3 + 4NaOH → Na[Al(OH)4] + 3NaNO3
Вычислим количество вещества газа, выделившегося при разложении нитрата алюминия:
ν(NO2 + O2) = 6,72 л/22,4 л/моль = 0,3 моль.
По уравнению реакции разложения нитрата алюминия ν(Al2O3) = 2/15ν(NO2 + O2), следовательно, ν(Al2O3) = 2/15ν(NO2 + O2) = 2/15 · 0,3 моль = 0,04 моль, m(Al2O3) = 0,04 моль · 102 г/моль = 4,08 г.
Вычислим массу и количество вещества оставшегося нитрата алюминия:
mост.(Al(NO3)3) = 25,38 г – 4,08 г = 21,3 г; νост.(Al(NO3)3) = 21,3 г/213 г/моль = 0,1 моль.
Вычислим количество вещества и массу взаимодействующего с оксидом и нитратом алюминия гидроксида натрия:
ν(NaOH) = 0,04 моль · 2 + 0,1 моль · 4 = 0,48 моль; m(NaOH) = 0,48 моль · 40 г/моль = 19,2 г.
Масса 24%-ного раствора гидроксида натрия равна:
m(р-ра NaOH) = 19,2 г/0,24 = 80 г.
Вычислим количество вещества и масса образовавшегося в результате реакции нитрата алюминия со щелочью нитрата натрия:
ν(NaNO3) = 3νост.(Al(NO3)3) = 0,1 моль · 3 = 0,3 моль; m(NaNO3) = 0,3 моль · 85 г/моль = 25,5 г.
Вычислим массу образовавшегося раствора равна и массовую долю нитрата натрия:
m(р-ра) = 80 г + 25,38 г = 105,38 г;
ω(NaNO3) = 25,5 г/105,38 г · 100% = 24,20%.
Задание №14
При нагревании образца гидрокарбоната натрия часть вещества разложилась, в результате чего выделилось 4,48 л углекислого газа (в пересчете на н.у.). Масса безводного остатка составила 63,2 г. Остаток добавили к 20%-ному раствору соляной кислоты, при этом в растворе не осталось карбонат-анионов. Определите массовую долю хлорида натрия в образовавшемся растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 26,77%
Пояснение:
При разложении гидрокарбоната натрия образовалась средняя соль – карбонат натрия и выделился углекислый газ:
2NaHCO3 → Na2CO3 + CO2↑ + H2O (нагревание)
Поскольку в растворе не осталось карбонат-анионов, следовательно, реакция карбоната и гидрокарбоната натрия с соляной кислотой прошла полностью:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
NaHCO3 + HCl = NaCl + CO2↑ + H2O
Вычислим количество углекислого газа, выделившегося при прокаливании гидрокарбоната:
ν(CO2) = 4,48 л/22,4 л/моль = 0,2 моль, следовательно, образовалось 0,2 моль карбоната натрия и прореагировало 0,4 моль гидрокарбоната натрия.
Вычислим массы образовавшегося карбоната натрия и оставшегося после реакции разложения гидрокарбоната натрия:
m(Na2CO3) = 106 г/моль · 0,2 моль = 21,2 г; mост.(NaHCO3) = 63,2 г – 21,2 г = 42 г; отсюда
νост.(NaHCO3) = 42 г/84 г/моль = 0,5 моль.
Вычислим количество вещества соляной кислоты, взаимодействующей с солями.
Поскольку ν(HCl) = 2 · ν(Na2CO3) + νост.(NaHCO3), то ν(HCl) = 2 · 0,2 моль + 0,5 моль = 0,9 моль и m(HCl) = 36,5 г/моль · 0,9 моль = 32,85 г.
Масса исходного раствора соляной кислоты равна:
m(р-ра HCl) = 32,85 г/0,2 = 164,25 г.
Образующийся в результате реакции гидрокарбоната и карбоната натрия с соляной кислотой углекислый газ выделяется из раствора, вычислим его массу:
ν(CO2) = 0,2 моль + 0,5 моль = 0,7 моль; m(CO2) = 44 г/моль · 0,7 моль = 30,8 г.
Вычислим количество и массу хлорида натрия в образовавшемся растворе:
ν(NaCl) = 0,2 моль · 2 + 0,5 моль = 0,9 моль; m(NaCl) = 58,5 г/моль · 0,9 моль = 52,65 г.
Вычислим массу образовавшегося раствора и массовую долю хлорида натрия в нем:
m(р-ра) = 164,25 г + 63,2 – 30,8 = 196,65 г;
ω(NaCl) = 52,65 г/196,65 г · 100% = 26,77%.
Задание №15
При разложении образца карбоната бария выделился газ объемом 4,48 л (в пересчете на н.у.). Масса остатка составила 50 г. После этого остаток поместили в 100 мл воды и добавили 200 г 20%-ного раствора сульфата натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 5,63%
Пояснение:
При разложении карбоната бария – соли слабой угольной кислоты образуется оксид бария и выделяется углекислый газ:
BaCO3 → BaO + CO2↑ (нагревание)
Карбонат бария в воде не растворяется. При взаимодействии оксида щелочно-земельного металла с водой образуется щелочь:
BaO + H2O → Ba(OH)2
С сульфатом натрия взаимодействует только гидроксид бария:
Ba(OH)2 + Na2SO4 → BaSO4↓+ 2NaOH
Вычислим количество углекислого газа, выделившегося при прокаливании карбоната бария:
ν(CO2) = 4,48 л/22,4 л/моль = 0,2 моль, следовательно, в результате реакции разложения карбоната бария образовалось 0,2 моль оксида бария и прореагировало также 0,2 моль карбоната бария.
Вычислим массу образовавшегося оксида бария, взаимодействующего с водой:
m(BaO) = 153 г/моль · 0,2 моль = 30,6 г; тогда масса оставшегося карбоната бария равна:
mост.(BaCO3) = 50 г – 30,6 г = 19,4 г.
Плотность воды при н.у. ρ(H2O) = 1г/см3, следовательно, ее масса в 100 мл равна 100 г.
По уравнениям реакций ν(BaO) = ν(Ba(OH)2) = ν(BaSO4), следовательно, ν(Ba(OH)2) = ν(BaSO4) = 0,2 моль
Вычислим массу и количество сульфата натрия, взаимодействующего с щелочью:
m(Na2SO4) = 200 г · 0,2 = 40 г; ν(Na2SO4) = 40 г/142 г/моль ≈ 0,282 моль.
Поскольку по уравнению реакции щелочь и сульфат натрия реагируют в эквимолярных количествах, то в избытке количество вещества сульфата бария.
ν(NaOH) = 2ν(Ba(OH)2) = 0,2 моль · 2 = 0,4 моль, m(NaOH) = 40 г/моль · 0,4 моль = 16 г.
В результате обменной реакции между гидроксидом бария и сульфатом натрия в осадок выпадает сульфат бария, поэтому необходимо учесть его массу при расчетах массы раствора:
ν(BaSO4) = 0,2 моль; m(BaSO4) = 233 г/моль · 0,2 моль = 46,6 г.
Вычислим массу образовавшегося раствора с учетом того, что карбонат бария в воде не растворим, поэтому не вносит вклад в массу этого раствора:
m(р-ра) = 30,6 г + 100 г + 200 г – 46,6 г = 284 г.
Определим массовую долю гидроксида натрия в образовавшемся растворе:
ω(NaOH) = 16 г/284 г · 100% = 5,63%.
[adsp-pro-3]
Задание №16
При разложении образца карбоната бария выделился газ объемом 1,12 л (в пересчете на н.у.). Масса твердого остатка составила 27,35 г. После этого к остатку добавили 73 г 30%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в образовавшемся растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 11,41%
Пояснение:
При разложении карбоната бария – соли слабой угольной кислоты образуется оксид бария и выделяется углекислый газ:
BaCO3 → BaO + CO2↑ (нагревание)
Вычислим количество углекислого газа, выделившегося при прокаливании карбоната бария:
ν(CO2) = 1,12 л/22,4 л/моль = 0,05 моль, следовательно, в результате реакции разложения карбоната бария образовалось 0,05 моль оксида бария и прореагировало также 0,05 моль карбоната бария.
Вычислим массу образовавшегося оксида бария:
m(BaO) = 153 г/моль · 0,05 моль = 7,65 г.
Вычислим массу и количество вещества оставшегося карбоната бария:
mост.(BaCO3) = 27,35 г – 7,65 г = 19,7 г; νост.(BaCO3) = 19,7 г/197 г/моль = 0,1 моль.
С соляной кислотой взаимодействуют и оксид бария, и карбонат бария:
BaO + 2HCl → BaCl2 + H2O
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
Вычислим количество вещество и массу хлороводорода, взаимодействующего с оксидом и карбонатом бария:
ν(HCl) = (0,05 моль + 0,1 моль) · 2 = 0,3 моль; m(HCl) = 36,5 г/моль · 0,3 моль = 10,95 г.
Вычислим массу оставшегося хлороводорода:
mост.(HCl) = 73 г · 0,3 – 10,95 г = 10,95 г.
Поскольку углекислый газ не вносит вклад в массу раствора, его массу необходимо вычесть:
m(CO2) = 44 г/моль · 0,1 моль = 4,4 г.
Вычислим массу образовавшегося раствора:
m(р-ра) = 73 г + 27,35 г – 4,4 г = 95,95 г.
Массовая доля оставшейся соляной кислоты в растворе равна:
ω(HCl) = mост.(HCl)/m(р-ра) · 100% = 10,95 г/95,95 г · 100% = 11,41%.
Задание №17
При разложении образца нитрата магния выделилась смесь газов объемом 10,08 л (в пересчете на н.у.). Масса остатка составила 69,36 г. После этого остаток поместили в 100 мл воды и добавили к нему 240 г 20%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 3,81%
Пояснение:
При разложении нитрата магния образуются оксид магния, диоксид азота и кислород:
2Mg(NO3)2 → 2MgO + 4NO2↑ + O2↑(нагревание)
Вычислим количество смеси газов, выделившихся при прокаливании нитрата магния:
ν(газов) = 10,08 л/22,4 л/моль = 0,45 моль, следовательно, в результате реакции разложения нитрата магния образовалось 0,18 моль оксида магния и прореагировало также 0,18 моль нитрата магния.
Вычислим массу образовавшегося оксида магния:
m(MgO) = 40 г/моль · 0,18 моль = 7,2 г; тогда масса и количество вещества оставшегося нитрата магния равна:
mост.(Mg(NO3)2) = 69,36 г – 7,2 г = 62,16 г, νост.(Mg(NO3)2) = 62,16 г/148 г/моль = 0,42 моль;
Плотность воды при н.у. ρ(H2O) = 1г/см3, следовательно, ее масса в 100 мл равна 100 г.
После того как остаток поместили в 100 мл воды, оставшийся нитрат магния растворился, оксид магния реагирует с водой только при кипячении, поэтому в раствор не переходит.
С гидроксидом натрия реагирует нитрат магния с образованием осадка – не растворимого в воде гидроксида магния:
Mg(NO3)2 + 2NaOH → Mg(OH)2↓ + 2NaNO3
По уравнению реакции ν(NaOH) = 2ν(Mg(NO3)2) = 2ν(Mg(OH)2), следовательно, ν(NaOH) = 0,84 моль, ν(Mg(OH)2) = 0,42 моль.
Вычислим массу и количество вещества гидроксида натрия, оставшегося при взаимодействии с нитратом магния, и массу гидроксида магния:
mост.(NaOH) = 240 г · 0,2 – 0,84 моль · 40 г/моль = 14,4 г;
m(Mg(OH)2) =0,42 моль · 58 г/моль = 24,36 г.
Вычислим массу образовавшегося раствора с учетом нерастворимости оксида и гидроксида магния:
m(р-ра) = 62,16 г + 100 г + 240 г − 24,36 г = 377,8 г.
Определим массовую долю гидроксида натрия в образовавшемся растворе:
ω(NaOH) = 14,4 г/377,8 г · 100% = 3,81%.
Задание №18
При разложении образца нитрата меди (II) выделилась смесь газов объемом 2,8 л (в пересчете на н.у.). Масса остатка составила 32,2 г. После этого остаток поместили в 50 мл воды и добавили 160 г 10%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 1,79%
Пояснение:
При разложении нитрата меди (II) образуются оксид меди (II), бурый газ – диоксид азота (IV) и кислород:
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ (нагревание)
Вычислим количество смеси газов – NO2 и O2:
ν(NO2 + O2) = 2,8 л/22,4 л/моль = 0,125 моль.
По уравнению реакции ν(CuO) = 2/5ν(NO2 + O2) = 2/5 · 0,25 моль = 0,05 моль, следовательно,
m(CuO) = 80 г/моль · 0,05 моль = 4 г.
Вычисли массу и количество вещества оставшегося нитрата меди (II):
mост.(Cu(NO3)2) = 32,2 г – 4 г = 28,2 г; νост.(Cu(NO3)2) = 28,2 г/188 г/моль = 0,15 моль.
Оксид меди (II) в воде не растворяется и не взаимодействует с щелочами, поэтому вклад в массу раствора вносить не будет. С гидроксидом натрия реагирует оставшийся нитрат меди (II):
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
По уравнению реакции взаимодействия нитрата меди (II) с гидроксидом натрия ν(NaOH) = 2νост.(Cu(NO3)2) = 2ν(Cu(OH)2), следовательно, ν(Cu(OH)2) = 0,15 моль и ν(NaOH) = 0,3 моль.
Вычислим массу оставшегося после реакции гидроксида натрия:
mост.(NaOH) = 160 г · 0,1 − 0,3 моль · 40 г/моль = 4 г.
Для подсчета массы раствора необходимо учесть массу выпавшегося в осадок гидроксида меди (II):
m(Cu(OH)2) = 98 г/моль · 0,15 моль = 14,7 г.
Плотность воды при н.у. ρ(H2O) = 1 г/см3, следовательно, ее масса в 50 мл равна 50 г.
Вычислим массу образовавшегося раствора и массовую долю оставшегося гидроксида натрия в нем:
m(р-ра) = 28,2 г + 50 г + 160 г – 14,7 г = 223,5 г;
ω(NaOH) = mост.(NaOH)/m(р-ра) · 100% = 4 г/223,5 г · 100% = 1,79%.
Задание №19
Сульфид цинка массой 48,5 г подвергли обжигу в избытке кислорода. Образовавшийся твердый продукт прореагировал с 460 г 14%-ного раствора гидроксида калия. Определите массовую долю гидроксида калия в образовавшемся растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 1,67%
Пояснение:
Сульфид цинка вступает в окислительно-восстановительную реакцию с кислородом, в результате чего образуются оксиды – ZnO и SO2:
2ZnS + 3O2 → 2ZnO + 2SO2↑
Вычисли количество вещества сульфида и оксида цинка:
ν(ZnS) = 48,5 г/97 г/моль = 0,5 моль, ν(ZnS) = ν(ZnO) = 0,5 моль, отсюда
m(ZnO) = 0,5 моль · 81 г/моль = 40,5 г.
По условию задачи в щелочном растворе содержится 1,15 моль KOH, а ZnO образовалось 0,5 моль в результате горения сульфида цинка, следовательно, эти соединения взаимодействуют между собой с образованием тетрагидроксоцинката:
ZnO + 2KOH + H2O → K2[Zn(OH)4]
Количество вещества гидроксида калия, реагирующего с оксидом цинка, определяется как ν(KOH) = 2ν(ZnO) = 0,5 моль · 2 = 1 моль.
Вычислим массу непрореагировавшего гидроксида калия:
mост.(KOH) = 460 г · 0,14 – 1 моль · 56 г/моль = 8,4 г.
Вычислим массу образовавшегося раствора и массовую долю оставшегося гидроксида калия в нем:
m(р-ра) = 40,5 г + 460 г = 500,5 г;
ω(KOH) = mост.(KOH)/m(р-ра) · 100% = 8,4 г/500,5 г · 100% = 1,67%.
Задание №20
Хлорат калия разложили в присутствии катализатора – оксида марганца (IV), в результате чего выделился кислород объемом 6,72 л (в пересчете на н.у.). Масса сухого остатка составила 16 г. Этот остаток прореагировал с 170 г 30%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в образовавшемся растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 10,81%
Пояснение:
При разложении хлората калия в присутствии катализатора образуются хлорид калия и кислород:
2KClO3 → 2KCl + 3O2↑ (нагревание, кат. MnO2)
Вычислим количество вещества выделяющегося кислорода:
ν(O2) = 6,72 л/22,4 л/моль = 0,3 моль, следовательно,
по уравнению реакции образуется ν(KCl) = 0,3 моль · 2/3 = 0,2 моль и расходуется 0,2 моль KClO3.
Вычислим массы образующегося хлорида калия:
m(KCl) = 0,2 моль · 74,5 г/моль = 14,9 г, отсюда mост.(KClO3) = 16 г – 14,9 г = 1,1 г.
Таким образом, в результате прокаливания хлората калия образовалось 14,9 г хлорида калия и 1,1 г хлората калия не подверглась разложению.
В воде растворяются и хлорат, и хлорид, однако с раствором нитрата серебра взаимодействует только хлорид калия, в результате чего выпадает белый творожистый осадок – хлорид серебра:
KCl + AgNO3 → AgCl↓ + KNO3
По уравнению реакции ν(KCl) = ν(AgCl) = ν(KNO3) = 0,2 моль.
Поскольку нитрата серебра дан в избытке, по завершении реакции он остается в растворе. Вычислим его оставшуюся после реакции массу:
mост.(AgNO3) = 170 г · 0,3 моль – 170 г/моль · 0,2 моль = 17 г.
При расчете массы образующегося раствора необходимо учесть массу выпадающего в осадок хлорида серебра:
m(AgCl) = 143,5 г/моль · 0,2 моль = 28,7 г.
Вычислим массу образовавшегося раствора:
m(р-ра) = 16 г + 170 г – 28,7 г = 157,3 г.
Массовая доля оставшегося нитрата серебра в растворе равна:
ω(AgNO3) = 17 г/157,3 г · 100% = 10,81%.
[adsp-pro-3]
Задание №21
Цинк массой 78 г сожгли в присутствии серы массой 32 г. Образовавшийся твердый остаток добавили к 365 г 30%-ному раствору соляной кислоты. Определите массовую долю хлороводорода в образовавшемся растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
Ответ: 4,97%
Пояснение:
При взаимодействии цинка с серой образуется соль – сульфид цинка:
Zn + S → ZnS (нагревание)
Вычислим количества серы и цинка, вступающих между собой в реакцию:
ν(Zn) = 78 г/65 г/моль = 1,2 моль, ν(S) = 32 г/32 г/моль = 1 моль, следовательно, в результате реакции соединения образуется 1 моль сульфида цинка и остается непрореагировавшим 0,2 моль Zn.
С раствором соляной кислоты реагируют и сульфид цинка, и цинк (цинк расположен в ряду активностей металлов левее водорода). Признак реакции – растворение осадка:
ZnS + 2HCl → ZnCl2 + H2S↑
Zn + 2HCl → ZnCl2 + H2↑
Таким образом, на взаимодействии с сульфидом цинка и цинком расходуется ν(HCl) = 1 моль · 2 + 0,2 моль · 2 = 2,4 моль или m(HCl) = 2,4 моль · 36,5 г/моль = 87,6 г.
Для подсчета массы раствора необходимо учесть массы образующихся сероводорода и водорода:
m(H2S) = 1 моль · 34 г/моль = 34 г, m(H2) = 0,2 моль · 2 г/моль = 0,4 г.
Масса образовавшегося раствора равна:
m(р-ра) = 78 г + 32 г + 365 г – 34 г – 0,4 г = 440,6 г.
Вычислим массу оставшегося в растворе хлороводорода и его массовую долю:
mост.(HCl) = 365 г · 0,3 – 87,6 г = 21,9 г;
ω(HCl) = mост.(HCl)/m(р-ра) · 100% = 21,9 г/440,6 г · 100% = 4,97%.
[adsp-pro-10]
11 апреля 2022
В закладки
Обсудить
Жалоба
Разбор задачи на разложение соли
При нагревании образца нитрата железа 3 часть вещества разложилась и образовалось 88.6 г твердого остатка . Этот остаток может прореагировать с 225 г 16 %го раствора гидроксида натрия. Определите массу исходного образца нитрата железа 3 и объём выделившихся газов.
Задание 34
При
нагревании образца карбоната кальция часть вещества разложилась. При этом
выделилось 4,48 л (н.у.) углекислого газа. Масса твердого остатка
составила 41,2 г. Этот остаток добавили к 465,5 г раствора
хлороводородной кислоты, взятой в избытке. Определите массовую долю соли
в полученном растворе.
В
ответе запишите уравнения реакций, которые указаны в условии задачи,
и приведите все необходимые вычисления (указывайте единицы измерения
искомых величин).

ЕГЭ. Химия. Универсальный справочник
Справочник содержит подробный теоретический материал по всем темам, проверяемым ЕГЭ по химии. После каждого раздела приводятся разноуровневые задания в форме ЕГЭ. Для итогового контроля знаний в конце справочника даются тренировочные варианты, соответствующие ЕГЭ. Учащимся не придется искать дополнительную информацию в интернете и покупать другие пособия. В данном справочнике они найдут все необходимое для самостоятельной и эффективной подготовки к экзамену.
Справочник адресован учащимся старших классов для подготовки к ЕГЭ по химии.
Купить
Ответ: Запишем краткое
условие данной задачи.
|
Дано: V(CO2) = 4,48 л m() = 41,2 г. m(HCl) = 465,5 г |
Решение: Напишем
|
|||||||||||||||
После
того как все приготовления приведены, приступаем к решению.
1)
Определяем количество СО2, содержащееся в 4,48 л. его.
n(CO2) = V/Vm = 4,48 л / 22,4 л/моль = 0,2 моль
2)
Определяем количество образовавшегося оксида кальция.
По
уравнению реакции образуется 1 моль СО2 и 1 моль СаО
Следовательно:
n(CO2) = n(CaO) и равняется
0,2 моль
3)
Определяем массу 0,2 моль СаО
m(CaO) = n(CaO) · M(CaO) = 0,2 моль · 56 г/моль = 11,2 г
Таким образом,
твердый остаток массой 41,2 г состоит из 11,2 г СаО и (41,2
г. – 11,2 г.) 30 г СаСО3
4)
Определим количество СаСО3, содержащееся в 30 г
n(CaCO3) = m(CaCO3) / M(CaCO3) = 30 г / 100 г/моль = 0,3 моль

ЕГЭ. Химия. Большой сборник тематических заданий по химии для подготовки к ЕГЭ
Вниманию школьников и абитуриентов впервые предлагается учебное пособие для подготовки к ЕГЭ по химии, которое содержит тренировочные задания, собранные по темам. В книге представлены задания разных типов и уровней сложности по всем проверяемым темам курса химии. Каждый из разделов пособия включает не менее 50 заданий. Задания соответствуют современному образовательному стандарту и положению о проведении единого государственного экзамена по химии для выпускников средних общеобразовательных учебных учреждений. Выполнение предлагаемых тренировочных заданий по темам позволит качественно подготовиться к сдаче ЕГЭ по химии.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Купить
Далее пишем следующие два уравнения необходимые для решения данной задачи:
CaO + HCl = CaCl2 + H2O
CaCO3 + HCl = CaCl2 + H2O + CO2
5) Определим количество хлорида кальция, образующееся в результате данных реакций.
В реакцию
вступило 0,3 моль CaCO3 и 0,2 моль
СаО всего 0,5 моль.
Соответственно,
образуется 0,5 моль CaCl2
6)
Рассчитаем массу 0,5 моль хлорида кальция
M(CaCl2) = n(CaCl2) · M(CaCl2) = 0,5 моль ·
111 г/моль = 55,5 г.
7)
Определяем массу углекислого газа. В реакции разложения участвовало 0,3 моль
карбоната кальция, следовательно:
n(CaCO3) = n(CO2) = 0,3 моль,
отсюда:
m(CO2) = n(CO2) · M(CO2) = 0,3 моль · 44г/моль = 13,2 г.

Находим массу раствора. Она состоит из массы соляной кислоты + масс твердого
остатка (CaCO3 + CaO) минут масса выделившегося CO2. Запишем это
в виде формулы:
m(р-ра)
= m(CaCO3 + CaO) + m(HCl) – m(CO2) = 465,5 г + 41,2 г – 13,2 г = 493,5 г.

ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы.
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тренировочных заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к заданиям, которые помогут объективно оценить уровень своих знаний и степень подготовленности к аттестационному экзамену.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Купить
9)
И наконец, ответим на вопрос задачи. Найдем массовую долю в % соли в растворе,
воспользовавшись следующим волшебным треугольником:
ω%(CaCI2)
= m(CaCI2)
/ m(р-ра) = 55,5 г / 493,5 г = 0,112 или 11,2%
Ответ: ω % (СaCI2) = 11.2%