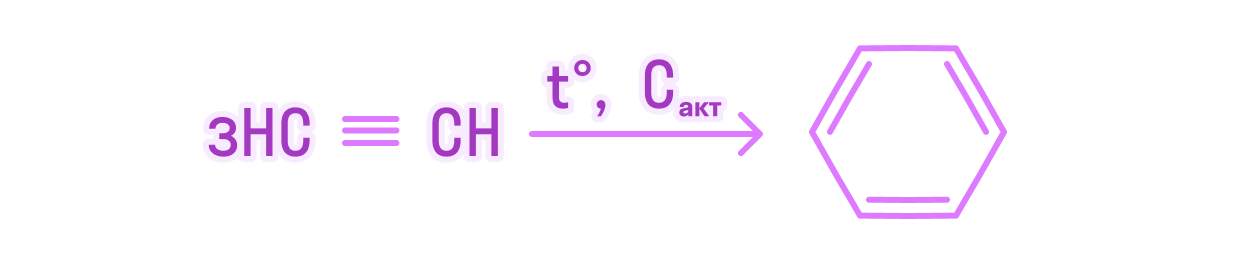Благодаря этому чек-листу вы сможете ознакомиться со всеми темами, которые могут встретиться вам в ЕГЭ по химии, а именно:
- Теоретические основы химии;
- Неорганическая химия;
- Органическая химия;
- Методы познания в химии. Химия и жизнь;
- Расчёты по химическим формулам и уравнениям реакций.
Теоретические основы химии
Неорганическая химия
Органическая химия
Методы познания в химии. Химия и жизнь
Расчёты по химическим формулам и уравнениям реакций
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
14 июля 2022
В закладки
Обсудить
Жалоба
Чек-лист по химии
Повторение основных разделов.
→ Теоретические основы химии.
→ Неорганическая химия.
→ Органическая химия.
→ Методы познания в химии. Химия и жизнь.
→ Расчёты по химическим формулам и уравнениям.
chek-h.pdf
Чек-лист для подготовки к ЕГЭ по химии
Материал по химии
Все темы ЕГЭ по химии

Новинки в 2023
На данный момент пока рано говорить о нововведениях в КИМы ФИПИ по химии. Следите за одновлениями здесь или в группе ВК.
Задание 1
Строение атомов и ионов:
- Строение электронных оболочек атомов первых четырех периодов.
- Правило Хунда и принцип Паули.
- Основное и возбужденное состояние атома.
- Конфигурация благородного газа. Строение электронной оболочки иона.
- Основное и возбужденное состояния атома.
- Особенности строения электронной конфигурации d-элементов.
- Квантовые числа.
- Понятие «валентные электроны».
Задание 2
Закономерности изменения свойств в периодах и группах ПС:
- Металлические и неметаллические свойства.
- Окислительные и восстановительные свойства.
- Электроотрицательность.
- Атомный радиус.
- Кислотные и основные свойства оксидов, гидроксидов, водородных соединений.
Задание 3
Валентность и степень окисления:
- Низшие и высшие степени окисления.
- Низшая и высшая валентность.
- Элементы-исключения (высшая валентность или высшая степень окисления не соответствует номеру группы).
- Элементы с постоянной валентностью.
- Элементы с постоянной степенью окисления в соединениях.
- Возможные промежуточные степени окисления.
Задание 4
Химические связи и кристаллические решетки
- Ковалентная неполярная связь.
- Ковалентная полярная связь.
- Донорно-акцепторный механизм образования ковалентных связей.
- Ионная связь.
- Металлическая связь.
- Водородная связь.
- Длина связи.
- Энергия связи.
- Аморфные вещества.
- Молекулярная решетка.
- Атомная решетка.
- Ионная решетка.
- Металлическая решетка.
- Вещества молекулярного и немолекулярного строения.
- Зависимость физических свойств от типа решетки.
Задание 5
Классификация веществ в неорганической химии:
- Оксиды (кислотные, основные, амфотерные, несолеобразующие).
- Гидроксиды (кислотные, основные, амфотерные)
- Кислоты (одноосновные, двухосновные, многоосновные, кислородсодержащие и бескислородные, сильные и слабые).
- Основания (растворимые и нерастворимые).
- Соли (нормальные, кислые, основные).
Подготовка к ЕГЭ по химии
Статьи
Тесты
Задания 6, 7, 8, 9, 31
Химические свойства неорганических веществ:
- Химические свойства простых веществ-металлов (реакции с неметаллами, кислотами, солями, оксидами). Особые свойства алюминия, цинка, бериллия.
- Химические свойства простых веществ-неметаллов (реакции с металлами и другими неметаллами, щелочами, концентрированными кислотами, водой, замещение одними неметаллами других).
- Характерные химические свойства основных оксидов (взаимодействие с водой, кислотами, кислотными оксидами, восстановителями). Получение основных оксидов.
- Характерные химические свойства кислотных оксидов (взаимодействие с основаниями и основными оксидами, водой). Получение кислотных оксидов.
- Химические свойства растворимых и нерастворимых оснований (реакции с кислотными оксидами и кислотами, амфотерными гидроксидами, солями средними и кислыми).
- Химические свойства кислот (взаимодействие с оксидами, основаниями и амфотерными гидроксидами, металлами, солями средними и кислыми).
- Химические свойства амфотерных оксидов и гидроксидов (взаимодействие со щелочами и кислотами, растворами некоторых солей и оксидами). Образование комплексных солей. Номенклатура и химические свойства комплексных солей (реакции с некоторыми кислотами и солями, разложение при нагревании).
- Химические свойства солей (взаимодействие со щелочами и раствором аммиака, с кислотами, друг с другом, с некоторыми оксидами и металлами).
- Соединения металлов IА-группы. Тривиальные названия (глауберова соль, едкий натр, поташ, селитра чилийская, кальцинированная сода, питьевая сода).
- Соединения металлов IА-группы. Образование оксидов и пероксидов, нитридов, гидридов, сульфидов, фосфидов, галогенидов, карбидов. Гидролиз нитридов, фосфидов, гидридов, карбидов.
- Соединения металлов IА-группы. Взаимодействие со сложными веществами: водой, аммиаком, спиртами и некоторыми алкинами.
- Окрашивание пламени солями щелочных металлов.
- Соединения металлов IIА-группы. Тривиальные названия (доломит, известняк, мрамор, мел, негашеная известь, гашеная известь, известковое молоко).
- Соединения металлов IIА-группы. Образование галогенидов, оксидов, пероксидов, гидридов, сульфидов, карбидов, нитридов и фосфидов.
- Соединения металлов IIА-группы. Реакции с водой.
- Окраска пламени солями щелочноземельных металлов.
- Жесткость воды и методы её устранения.
- Медь: тривиальные названия (малахит, медный купорос); получение из оксидов, из солей путем замещения и электролизом; Взаимодействие с галогенами, кислородом, азотной и серной кислотой.
- Оксид меди I: цвет, восстановительные свойства, образование комплексов с раствором аммиака.
- Оксид меди II: цвет, типичные химические свойства.
- Гидроксид меди II: цвет, типичные химические свойства оснований. Комплексообразование.
- Хром: методы получения; взаимодействие с азотной и серной кислотой, с кислородом, соляной кислотой и хлороводородом на воздухе.
- Оксид хрома III: получение путём разложения дихромата аммония и дихромата калия. Характерные амфотерные свойства.
- Оксид хрома VI: образование хромовой и дихромовой кислоты, хромата и дихромата калия/натрия.
- Окислительно-восстановительные свойства оксида хрома III, оксида хрома VI, хромата и дихромата калия/натрия.
- Оксид марганца IV: цвет, ОВ-свойства.
- Окислительно-восстановительные свойства манганатов и перманганатов. Цвета растворов.
- Железо. Особенности взаимодействия железа с кислородом, галогенами и соляной кислотой, с концентрированной серной и азотной кислотой.
- Оксид железа II: получение, ОВ-свойства, свойства типичного основного оксида, цвет. Гидроксид железа II: цвет, получение.
- Оксид железа III: получение, цвет, характерные амфотерные свойства, ОВ-свойства. Гидроксид железа III: цвет, получение, характерные амфотерные свойства.
- Железная окалина: получение, ОВ-свойства.
- Соли железа II: хлористое железо, железный купорос, желтая кровяная соль. Качественные реакции на соли железа II.
- Соли железа III: хлорное железо, красная кровяная соль. Качественные реакции на соли железа III.
- Водород: взаимодействие с металлами и неметаллами. Восстановительные свойства при реакциях со сложными веществами: оксидами и галогенидами.
- Лабораторные методы получения водорода (из кислот, щелочей, воды, гидридов). Промышленные методы получения водорода (электролизом, конверсией метана, крекингом углеводородов).
- Взаимодействие воды с металлами и неметаллами, амфотерные свойства воды. Получение и ОВ-свойства пероксида водорода.
- Агрегатное состояние и цвет элементов VIIА-группы (галогенов). Изменение окислительной активности в ряду галогенов на примере взаимодействия их с серой, фосфором, железом. Замещение одного галогена другим. Взаимодействие галогенов с водой и щелочами.
- Хлорсодержащие кислоты: хлорная, хлористая, хлорноватая, хлорноватистая, соответствующие им соли, их ОВ-свойства. Бертолетова соль, белильная известь, хлорка.
- Кислород: почему не проявляет степень окисления +6? Методы получения (из хлората калия, нитратов щелочных металлов, перманганата калия, оксида ртути II, пероксидов, электролизом, фракционной возгонкой).
- Кислород: образование оксидов, пероксидов, окалины. С какими элементами не реагирует? Реакции с серой и азотом. Реакции с сульфидами, метанов, сероводородом. Взаимодействие с оксидами металлов в промежуточной степени окисления.
- Сера: цвет, формулы: свинцового блеска, цинковой обманки, железного колчедана, серного колчедана, пирита. Получение серы из пирита, диоксида серы, сероводорода. Аллотропные модификации серы.
- Химические свойства серы: с какими элементами сера ведет себя как окислитель? Восстановительные свойства серы (реакции, в которых сера принимает значение степени окисления +4 и +6). Реакция серы со щелочами.
- Сероводород и сероводородная кислота: физические свойства, восстановительные свойства сульфид-иона. Качественные реакции на сульфид-ион. Получение сульфидов и гидросульфидов.
- Сравнение оксида серы IV и оксида серы VI: взаимодействие с водой, основными оксидами, основаниями, ОВ-свойства.
- Сравнение реакционной способности концентрированной и разбавленной серной кислоты.
- Разложение сульфатов. Качественные реакции на сульфат- и сульфит-ион.
- Азот и фосфор как простые вещества: сравнение свойств: агрегатное состояние, аллотропные модификации, взаимодействие с кислородом, водородом, металлами, серой, щелочами, кислотами.
- Сравнение свойств аммиака и фосфина: цвет, запах, токсичность, наличие водородных связей, растворимость, реакции с водой, кислотами, горение, восстановительные свойства.
- Нашатырь и нашатырный спирт. Качественные реакции на соли аммония. Разложение нитрита и нитрата аммония. Реакция раствора аммиака с растворимыми солями железа, меди, магния.
- Наиболее распространенные оксиды азота: NO и NO2, методы их получения, ОВ-свойства. Взаимодействие NO2 с водой и щелочами без доступа кислорода и в его присутствии.
- Сравнение концентрированной и разбавленной азотной кислоты.
- Фосфорный ангидрид: получение, взаимодействие с избытком и недостатком воды или щелочи, водоотнимающие свойства.
- Аллотропные модификации углерода. Взаимодействие с кислородом, водородом, серой, кремнием, восстановительная активность.Сравнение угарного и углекислого газа: строение, получение, ОВ-свойства, взаимодействие со щелочами. Химические свойства угольной кислоты.
- Кремний: методы получения, взаимодействие с водородом и галогенами, ОВ-свойства, реакция с щелочами, растворение в смеси азотной и плавиковой кислоты. Оксид кремния IV. Кремниевая кислота.
Задание 10
Классификация и номенклатура органических соединений
- Классификация углеводородов.
- Классификация кислород- и азотсодержащих органических соединений.
- Общие формулы и функциональные группы.
- Номенклатура органических соединений
Задание 11
Теория строения органических соединений.
- Гибридизация атомных орбиталей углерода.
- Гомология и изомерия. Основные типы изомерии.
- Типы связей в органических веществах.
Задания 12–16, 32
Органическая химия. Строение, получение, применение, химические и физические свойства:
- Алканов
- Алкенов
- Диенов
- Алкинов
- Циклоалканов
- Аренов
- Спиртов
- Карбонильных соединений
- Карбоновых кислот
- Аминов
- Анилина
- Аминокислот
- Белков
- Жиров
- Углеводов
Задание 17
Классификация химических реакций
- Классификация химических реакций в неорганической химии.
- Классификация химических реакций в органической химии.
Задание 18
Скорость химической реакции
- Зависимость скорости химической реакции от концентрации, температуры, давления, агрегатного состояния.
Задание 19, 29
Окислительно-восстановительные реакции
- Определение окислителей и восстановителей. Типичные окислители и восстановители, и продукты их окисления и восстановления.
- Молекулы и ионы как окислители и восстановители.
- Расстановка коэффициентов с помощью электронного баланса.
- Расстановка коэффициентов с помощью ионно-электронного баланса.
Задание 20
Электролиз
- Электролиз в расплавах.
- Электролиз в растворах. Катодные и анодные процессы.
- Получение веществ электролизом.
Задание 21
Гидролиз
- Классификация солей по способности гидролизоваться.
- Среда растворов, рН.
Задание 22
Химическое равновесие
- Смещение химического равновесия при различных воздействиях.
Задание 23
Решение задач по равновесным концентрациям
- Теория и разбор заданий.
Задание 24
Качественные реакции
- Качественные реакции в неорганической химии.
- Качественные реакции в органической химии.
Задание 25
Химическая промышленность
- Применение органических веществ в быту.
- Применение неорганических веществ в быту.
- Полимеры и их применение. Реакции полимеризации и конденсации.
- Классификация волокон и их получение.
- Производство серной и азотной кислоты, аммиака, метанола.
- Правила работы в лаборатории.
- Лабораторные приборы и посуда.
- Методы разделения смесей. Очистка веществ.
Задание 26
Задачи на растворы
- Решение простейших задач с применением понятия «массовая доля вещества в растворе».
- Решение простейших задач с применением понятия «кристаллогидраты».
- Решение простейших задач с применением понятия «растворимость».
Задание 27
Расчеты по термохимическим уравнениям
- Решение задач по термохимическим уравнениям.
Задание 28
Расчеты по химическим уравнениям
- Расчеты по известной массе, количеству вещества или объёму.
- Расчеты массовой или объёмной доли продуктов.
- Расчеты с применением понятия «массовая доля вещества в смеси».
Задание 30
Реакции ионного обмена
- Электролиты и неэлектролиты, сильные и слабые электролиты. Электролитическая диссоциация. Реакции ионного обмена.
Задание 33
Задачи повышенного уровня сложности (общая и неорганическая химия)
- Задачи на избыток и недостаток с применением понятий «массовая доля», «растворимость», «молярная концентрация».
- Задачи на избыток и недостаток с образованием кислых солей.
- Задачи на кристаллогидраты.
- Задачи на осаждение веществ двумя реакциями.
- Задачи на добавление оксида в раствор соответствующей кислоты.
- Задачи на систему двух уравнений (определение массовой доли веществ в первоначальной смеси).
- Задачи с использованием математической системы уравнений.
- Задачи на частичное разложение.
- Задачи на атомистику.
Задание 34
Установление молекулярной и структурной формулы вещества
- Расчеты по плотности газа, относительной молекулярной массе по известному газу, массе молекулы, плотности газа.
- Расчеты по массовой доли элементов в органическом веществе.
- Расчеты по массовой доле одного элемента известной группы веществ.
- Расчеты по продуктам сгорания.
- Расчеты по известному количеству кислорода при горении.
- Расчеты по реакционной способности.
Инфоурок
›
Химия
›Презентации›Чек-лист по подготовке к ГИА по химии 2022
Скачать материал

Скачать материал




- Сейчас обучается 431 человек из 67 регионов


- Сейчас обучается 111 человек из 49 регионов


Описание презентации по отдельным слайдам:
-
1 слайд
для выпускников 11 классов
Подготовка чек –листа к ГИА по химии
Методист районного методического кабинета отдела образования администрации Новоазовского района
Дьякова Елена Станиславовна -
2 слайд
Что такое чек-лист
Чек-лист — это список дел, в котором можно поставить отметку «сделано», когда задача решена.
Такие списки придумали в авиации. В 1934 году во время испытаний новая модель «Боинга» потерпела крушение. Стало понятно, что самолеты слишком сложны для управления, пилоты не могут запомнить и проконтролировать все процессы, которые происходят во время взлета, полета и посадки. Для них создали пошаговую инструкцию, включающую самые важные действия.
Так появился чек-лист или контрольный список. Сначала он помогал управлять технически сложными процессами, но постепенно перебрался во все сферы жизни. -
3 слайд
Чем отличается чек-лист от
списка делЧек-лист и список дел похожи: они помогают держать дела в памяти и содержат инструкцию, как достигнуть цели. На этом сходства заканчиваются.
Чек-лист создают для контроля постоянных процессов.
А список дел — для конкретной ситуации, его используют один раз.
Еще одно отличие — задачи в списках дел можно отменить или перенести.
В чек-листе нужно выполнять каждый пункт, причем часто важна
последовательность действий.
К примеру, для праздничного ужина нужно купить продукты, выбрать
подходящую посуду — это список дел.
А рецепт какого-либо блюда — это чек-лист. Дела меняются в зависимости от
условий, а чек-лист — нет. -
4 слайд
Зачем нужен чек-лист
Чек-листы используют, чтобы организовать процессы.
Часто чек-листы — это не подробный перечень задач, а список пунктов, обязательных к проверке.
Их используют для разных целей.
Например, для подготовки к экзаменам. -
5 слайд
Преимущества чек-листов
Чек-листы решают множество задач:
Систематизируют процесс. Чек-лист разбивает сложную работу на части и помогает не упустить из внимания важные детали.
Повышают производительность и исключают ошибки. План действий уже готов, можно сосредоточиться на главном.
Облегчают делегирование. С помощью готовой инструкции выпускнику
будет проще разобраться в новой задаче без потери качества.
Снижают необходимость в контроле. Учитель может отследить ход работ и корректировать процесс на любом этапе. Четкий алгоритм облегчает
проверку задач.
Чек-лист — это еще и инструмент личной эффективности: он
дисциплинирует и мотивирует.
Так ты понимаете, сколько сделано и сколько осталось. Это придает силы для новых достижений. -
6 слайд
Как правильно составить
чек-лист
Определить цель. Не нужно стараться решить все сразу. Лучше выбрать
более конкретную задачу и подробно расписать её пошаговое решение.
Учесть последовательность действий. В чек-листах, в отличие от
инструкций, это не так критично, но порядок и логика помогут ускорить процесс.
Структурировать информацию. Сто пунктов подряд запутают кого
угодно. Лучше разделить шаги на тематические блоки.
Писать просто и понятно. Одно действие — один пункт. Только важное, без лишней информации. Если текста много, лучше разбить на несколько подпунктов.
Стараться сделать чек-лист универсальным. То есть учесть, что им
могут пользоваться и другие люди. Тогда чек-лист поможет делегировать
работу и лучше понять, и оптимизировать процесс. -
7 слайд
Инструкция, как использовать
чек-лист на максимум:
— Распечатайте и повесьте его на видное место;— Отметьте темы, которые вы уже хорошо знаете, также постепенно отмечайте темы, которые проходите;
— Попробуйте устроить для себя челлендж, но сделайте так, чтобы он действительно мотивировал вас!
-
8 слайд
Чек-лист подготовки к
ГИА 2022
Неорганика
1.Классфикация неорганических веществ
2.Номенклатура неорганических веществ
(тривиальная и международная)
ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
1.щелочные металлы
2.щелочноземельные металлы
3.магний
4.алюминий
5.медь
6.цинк
7.хром
8.железо
9.водород
10.галогены
11.халькогены: кислород и сера
12.пниктогены: азот и фосфор
13.углерод и кремний -
9 слайд
Чек-лист подготовки к ГИА 2022
ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА
СЛОЖНЫХ ВЕЩЕСТВ
1.оксиды:
-оснóвные
-амфотерные
кислотные
2.гидроксиды:
основания
— амфотерных гидроксиды
кислоты
3.соли:
-средние
-кислые
-оснóвные
-комплексные (на примере соединений Al и Zn)
4.взаимосвязь неорганических веществ -
10 слайд
Чек-лист подготовки к ГИА 2022
Органика
1.Теория строения органических соединений:
гомология
-изомерия
2.Гибридизация атомных орбиталей углерода.ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕВОДОРОДОВ
1.алканы
2.циклоалканы
3.алкены
4.алкадииены
5.алкины
6.арены:
бензол
гомологи бензола
стирол -
11 слайд
Чек-лист подготовки к ГИА 2022
ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА
КИСЛОРОДСОДЕРЖАЩИХ СОЕДИНЕНИЙ
1.одноатомные спирты
2.многоатомные спирты
3.простые эфиры
4.фенолы
5.альдегиды и кетоны
6.карбоновые кислоты
7.производные карбоновых кислот
8.сложные эфиры
ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА
АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ
1.амины
2.аминокислоты
БИОЛОГИЧЕСКИ ВАЖНЫЕ ВЕЩЕСТВА
1.белки
2.жиры
3.углеводы -
12 слайд
Чек-лист подготовки к ГИА 2022
Общая химия
1.строение атома
2.периодический закон
3.степень окисления
4.валентность
5.типы химических связей
6.типы кристаллических решеток
7.классификация реакций
8.электролиз
9.гидролиз
10.химическое равновесие
11.скорость химической реакции -
13 слайд
Чек-лист подготовки к ГИА 2022
ХИМИЯ И ЖИЗНЬ
1.правила работы в лаборатории
2.лабораторная посуда и оборудование
3.методы разделения смесей и очистки веществ
4.общие научные принципы химического производства
промышленное получение аммиака
-промышленное получение серной кислоты
промышленное получение метанола
4.природные источники углеводородов, их переработка
5.полимеры
6.пластмассы
7.волокна
8.каучуки
9.способы применения веществ
10.способы получения веществ -
14 слайд
Чек-лист подготовки к ГИА 2022
РАСЧЕТНЫЕ ЗАДАЧИ1.расчёты с использованием понятия «растворимость»,
«массовая доля вещества в растворе»
2.расчёты по термохимическим уравнениям
3.расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке
4.расчеты массовой доли (массы) химического соединения в смеси
5.расчёты равновесных и исходных концентраций.
Химическое равновесие -
15 слайд
Удачи!
У ВАС ВСЕ ПОЛУЧИТСЯ!
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 157 019 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы


- 14.11.2021
- 194
- 4






Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Основы местного самоуправления и муниципальной службы»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Этика делового общения»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс повышения квалификации «Правовое регулирование рекламной и PR-деятельности»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Организация деятельности по водоотведению и очистке сточных вод»
-
Курс профессиональной переподготовки «Организация процесса страхования (перестрахования)»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
-
Курс профессиональной переподготовки «Гражданско-правовые дисциплины: теория и методика преподавания в образовательной организации»
-
Скачать материал
-
14.11.2021
2297
-
PPTX
532.1 кбайт -
46
скачиваний -
Оцените материал:
-
-
Настоящий материал опубликован пользователем Дьякова Елена Станиславовна. Инфоурок является
информационным посредником и предоставляет пользователям возможность размещать на сайте
методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них
сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайтЕсли Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с
сайта, Вы можете оставить жалобу на материал.Удалить материал
-
- На сайте: 2 года и 11 месяцев
- Подписчики: 0
- Всего просмотров: 3879
-
Всего материалов:
3
Сколько бы мы ни говорили о том, что ЕГЭ — это экзамен, с которым под силу справиться каждому выпускнику, никто не может отрицать тот факт, что ЕГЭ по химии (как и по любому другому предмету) — и правда очень сложная процедура, требующая тщательной подготовки и усилий. Процесс подготовки к экзамену важно структурировать, систематизировать, составить четкий план и сделать обучение частью своей рутины. Только так вы сможете добиться высокого результата без стресса и эмоционального истощения.
Именно поэтому мы решили составить специальный чек-лист для подготовки к ЕГЭ по химии: так каждый выпускник сможет грамотно выстроить процесс подготовки к экзамену и прийти к желаемому результату.
Чек-лист для подготовки к ЕГЭ по химии
- Определить, сколько времени осталось до экзамена.
- Понять, сколько времени в день/ в неделю вы можете уделять подготовке к экзамену по химии.
- Познакомиться с форматом экзамена, решить демоверсию.
- Изучить кодификатор и определить свой текущий уровень подготовки.
- Составить список тем, которые вы: а) хорошо знаете, б) нужно повторить, в) не знаете совсем.
- Определить важность и приоритетность тем: в первую очередь стоит разобраться с базовыми понятиями, а потом уже изучать сложные темы и задания.
- Составить план подготовки с учетом школы, времени для отдыха, времени для подготовки к другим экзаменам, а также форс-мажорных ситуаций.
- Не перегружать себя подготовкой с первого дня: график занятий должен быть адекватным, а изучение материала — постепенным.
- Помнить правило: «Тише едешь, дальше будешь» — лучше каждый день изучать по одной теме, чем изучить 10 тем за один вечер, а потом месяц ничего не делать из-за усталости.
- Еще одно правило: чем более разнообразной и интересной будет подготовка, тем легче будет «заставить себя» учиться. Находите необычные способы изучения информации, смотрите крутые видео на ютубе, обсуждайте подготовку с одноклассниками и друзьями.
- Помнить, что для эффективного обучения необходимо высыпаться, правильно питаться, заниматься спортом и качественно отдыхать. В период подготовки к ЕГЭ все эти вещи совмещать сложно, но жертвовать своим здоровьем и самочувствием ради этого точно не стоит.
- Больше практиковаться! ЕГЭ — все еще один из экзаменов, нацеленных на знание формата. Чем больше заданий вы решаете, тем легче вам их решать.
- Не забывать повторять информацию. Будет полезно узнать о таком понятии как кривая забывания и повторять изученный материал в течение всего периода подготовки.
- Использовать разные способы восприятия информации. Читать учебники, конечно, классно, но лучше разнообразить свои рутинные занятия также просмотром видео, прослушиванием аудиоматериала, составлением таблиц, графиков и рисунков.
- Убрать то, что отвлекает. Во время занятий старайтесь отключать уведомления на телефоне и убирать его подальше. Закройте все лишние вкладки в компьютере. Попросите близких не мешать вам заниматься.
- Расставить приоритеты. Если времени на подготовку осталось совсем мало, то, возможно, стоит поставить просмотр сериалов и встречи с друзьями на паузу. Да, это очень увлекательно, но вполне может подождать до лета.
- Сделать подготовку частью рутины. Скачайте квизлет и учите в нем формулы, носите с собой блокнот для решения уравнений, а вместо Тик-тока смотрите видео с объяснением сложных тем. Без фанатизма, конечно, но такие мелочи помогут ускорить процесс подготовки.
Помнить, что нет ничего невозможного! Если очень захотеть, можно в космос полететь. А значит, и у вас получится подготовиться к экзамену и поступить в вуз мечты.
Методические рекомендации предназначены для обучающихся 11 классов, планирующих сдавать ЕГЭ 2022 г. по химии.
Рассмотрены новые типы заданий, включённых в контрольные измерительные материалы ЕГЭ 2022 г., и даны рекомендации по их выполнению. Также приведены тренировочные задания новых типов, ответы на них и критерии оценивания.
→ скачать методические рекомендации
Содержание
Задания линии 5
Задания линии 21
Задания линии 23
Задания линии 28
Тренировочные задания
Задания линии 5
Задания линии 21
Задания линии 23
Задания 28
Ответы к тренировочным заданиям
Задания линии 5
В основе выполнения задания 5 лежит знание номенклатуры и классификации неорганических веществ.
При сохранении прежнего контролируемого элемента содержания претерпела изменения форма предъявления условия задания: в девяти пронумерованных ячейках таблицы размещены формулы и названия неорганических веществ. Важно заметить, что названия веществ могут быть как систематические, так и тривиальные. Вероятность встретить какое-либо тривиальное название вещества, которое не изучается в школьном курсе, отсутствует, а вот название, редко используемое в настоящее время, возможна. Могут встретиться названия: щелочей – едкое кали, едкий натр, гашеная известь; солей – малахит и пирит, железный купорос и питьевая сода, нашатырь и калийная селитра; оксидов – веселящий газ, угарный газ, негашёная известь и др.
Задания линии 21
В заданиях линии 21 контролируется усвоение темы (раздела) – гидролиз солей; среда водных растворов: кислая, нейтральная, щелочная.
При выполнении задания можно опираться на контекст, который раскрывает основные понятия, используемые в задании (рН и молярная концентрация), и иллюстрирует сведения о среде растворов.
Задания линии 23
В заданиях линии 23 контролируется усвоение темы – обратимые и необратимые химические реакции; химическое равновесие; расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ.
Задания линии 28
Задачи, расположенные в экзаменационном варианте на данной линии, предусматривают проверку умения выполнять: расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ; расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного; расчёты массовой доли (массы) химического соединения в смеси. Именно два последних вида расчёта являются основными в данных задачах.
Смотрите также:
Подготовка к ЕГЭ по химии
Как проходит ЕГЭ по химии в 2023 году
На ЕГЭ по химии, как и в случае с большинством других предметов, ученик 11 класса должен будет справиться с 2 частями экзамена:
-
1-я часть: 28 заданий с кратким ответом;
-
2-я часть: 6 заданий с развернутым ответом.
Чтобы решить все 34 задания единого государственного экзамена, у ученика будет 210 минут. За это время нужно будет успеть ответить на вопросы обеих частей, подготовить полное решение для задач 2-й части и перенести ответы в бланк.
Кстати, в отличие от ОГЭ, на ЕГЭ по химии не будет задания-эксперимента. Только обычные химические задания разной сложности. В таблице ниже можно посмотреть, сколько будет легких, средних и сложных вопросов.
| Уровень сложности заданий на ЕГЭ по химии | |
|---|---|
| Базовая | 17 |
| Повышенная | 11 |
| Высокая | 6 |
Если вы хотите больше узнать об особенностях экзамена и подготовки к нему, советуем заглянуть в раздел «Демоверсии, спецификации, кодификаторы» сайта ФИПИ. Там вы найдете всю актуальную информацию о ЕГЭ по химии и методические рекомендации. Все это поможет распланировать подготовку к экзамену так, чтобы сдать его на 100 баллов.
Изменения в ЕГЭ по химии
По сравнению с 2022 годом экзамен по химии немного изменится. Вот список нововведений:
-
Немного поменялось условие задания 23, в котором нужно рассчитать концентрацию веществ. Теперь данные в нем будут записаны текстом, а не в таблице.
-
Задания 33 и 34 поменялись местами.
-
Задания 9, 12 и 16 теперь станут повышенной сложности.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Как хорошо сдать ЕГЭ по химии: разбор сложных задач
Как мы узнали из таблицы в предыдущем разделе, экзамен по химии — один из самых сложных. На 34 задания в нем приходится целых 11 повышенной сложности и 6 — высокой. Но если вы хотите поступить в вуз мечты, советуем научиться их решать так, чтобы не упустить ни одного балла. А потому предлагаем начать подготовку прямо сейчас и вместе разобрать несколько таких задач.
Задание 7
Это задание проверяет буквально все ваши знания в области неорганической химии. Здесь нужно знать как химические свойства простых соединений, так и химические свойства сложных соединений. Давайте разберем одно из таких заданий, чтобы понять, как их решать, чтобы сдать ЕГЭ по химии.
Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Вещество | Реагенты |
|---|---|
| А) S | 1) AgNO3, K3PO4, Cl2 |
| Б) SO3 | 2) BaO, NaOH, H2O |
| В) Zn(OH)2 | 3) H2, Cl2, O2 |
| Г) ZnBr2 | 4) HBr, LiOH, CH3COOH (p-p) |
| 5) H3PO4 (p-p), BaCl2, CuO |
Решение:
-
Вариант под буквой А — простое вещество, сера. Как правило, простые вещества взаимодействуют с другими простыми веществами, значительно реже со сложными веществами. Под это описание подходит вариант № 3.
-
Вещество под буквой Б — кислотный оксид. Кислотные оксиды не реагируют с кислотами, поэтому смело вычеркиваем варианты, где присутствует хоть одна кислота. Остаются варианты № 1–3. Реагенты под цифрой 3 тоже можем вычеркнуть, так как кислотный оксид уже в своей максимальной степени окисления и дальше взаимодействовать с кислородом не может. Остаются варианты № 1 и № 2. Оксид серы (VI) может реагировать с основным оксидом с образованием соли, со щелочью с образованием соли и воды, и с водой, при этом образуя кислоту. Выбираем № 2.
-
Амфотерный нерастворимый в воде гидроксид цинка может взаимодействовать только с теми, что способны его растворить. Единственно верный вариант под № 4, где указаны кислоты и щелочь.
-
При взаимодействии соли с другими сложными веществами надо помнить про три признака протекания химической реакции: выпадения осадка, выделение газа и образование малодиссоциирующего вещества — воды. Под это описание подходит вариант под № 1. Но как же хлор? Дело в том, что вышестоящие в группе галогены способны вытеснить нижестоящие из их солей.
Ответ: 3241.
Задание 15
Это задание Единого государственного экзамена проверит ваши знания химических свойств органических соединений. Чтобы справиться с ним, нужно по записанным словами реагирующим веществам составить уравнение реакции и выбрать из перечня один из получившихся продуктов. Давайте рассмотрим на примере, как решать такую задачу.
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Реагирующие вещества | Продукт взаимодействия |
|---|---|
| А) уксусная кислота и сульфид калия | пропионат калия |
| Б) муравьиная кислота и гидроксид калия | этилат калия |
| В) муравьиный альдегид и гидроксид меди (II) при нагревании | формиат меди (II) |
| Г) этанол и калий | формиат калия |
| ацетат калия | |
| углекислый газ |
Решение:
-
Органические кислоты могут реагировать с солями, если те имеют летучий анион. В результате взаимодействия образуется соль уксусной кислоты и сероводород (летучее соединение). Соль, которая образована в таких условиях, — ацетат калия. Это вещество № 5.
-
Муравьиная кислота проявляет свойства неорганической кислоты и может взаимодействовать с щелочами с образованием соли и воды. Соль муравьиной кислоты — формиат. Правильный ответ № 4.
-
Под буквой В описана качественная реакция на альдегиды с образованием соответствующей кислоты, оксида меди (I) и воды. Исключение — муравьиный альдегид. Он окисляется до углекислого газа, а остальные продукты реакции те же. Соответственно, правильный ответ № 6.
-
Калий как активный металл может замещать протон водорода в гидроксогруппе у спиртов с образованием алкоголята. Правильный ответ: № 2.
Ответ: 5462.
Задание 16
Это задание всё так же проверяет ваши знания по химическим свойствам и, как следствие, умение записывать превращения в рамках органической химии. Однако оно усложняется тем, что теперь вам самим нужно подобрать такой реактив, чтобы произошло уже известное превращение. Давайте попробуем решить один из вариантов такой задачи вместе — это повысит ваши шансы сдать ЕГЭ на 100 баллов.
Задана схема превращений веществ:
Определите, какие из указанных веществ являются веществами х и у:
-
2-бромбутан;
-
этаналь;
-
этен;
-
метилпропан;
-
хлорэтан.
Решение:
Посмотрим, что случилось с известными нам веществами.
-
У спирта исчезла ОН-группа, затем что-то произошло, и углеродная цепочка увеличилась вдвое. Мы помним, что когда цепочка увеличивается вдвое, то, скорее всего, это реакция Вюрца. А в неё вступают только галогеналканы. Ищем нужный нам вариант. Он находится под номером 5. Первое вещество найдено.
-
Бутан подвергают нагреванию с использованием катализатора. Нужно помнить, что в таких условиях проводится изомеризация алканов. Из бутана получается метилпропан. Ответ: № 4.
Ответ: 54.
Задание 26
Теперь разберем задачи, которые заканчивают тестовую часть ЕГЭ по химии. Рассмотрим условие одной из них на нахождение массы соли, которую необходимо добавить для получения раствора с новой заданной массовой долей.
Вычислите массу нитрата калия (в граммах), которую следует растворить в 160 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ округлите до десятых.
Чтобы решить эту задачу, вспомним основную формулу нахождения массовой доли:
-
Найдем массу изначально растворенного нитрата калия в растворе, выразив из формулы выше:
подставим значения:
-
Чтобы увеличить массовую долю соли в растворе, необходимо ее добавить еще. Но мы не знаем сколько, поэтому примем массу добавляемой соли за Х и подставим в исходную формулу нахождения массовой доли с учетом новых значений:
-
Далее в дело вступает чистая математика. Разделим обе части уравнения на 100%:
-
По пропорции перемножим крест-накрест:
0,12 * (160 + X) = 16 + X.
-
Раскроем скобки:
19,2 + 0,12Х = 16 + Х.
-
Приведем подобные: с Х в одну сторону, без Х — в другую:
3,2 = 0,88Х.
-
Найдем Х:
Масса нитрата калия, которую необходимо добавить для увеличения массовой доли раствора до 12%, равна 3,6 граммам.
Ответ: 3,6.
Задание 28
Эта задача может встретиться на экзамене в нескольких вариантах. Давайте разберем один из них — задание на нахождение доли выхода продукта реакции.
В результате реакции тримеризации ацетилена объемом 26,88 л (н.у) получили 24,96 г бензола. Вычислите массовую долю выхода продукта реакции от теоретически возможного.
Решение:
-
Для начала напишем формулу, по которой считается доля выхода продукта:
Как определить, какая масса практическая, а какая — теоретическая? Значения, которые даются после слова «получили», — это практическая масса. Та, которая получилась в результате проведения химической реакции в реальных условиях. Масса теоретическая — та, которую рассчитывают из уравнения реакции, зная массу исходных реагентов.
-
Напишем уравнение химической реакции тримеризации ацетилена:
-
Найдем количество вещества ацетилена:
подставим значения:
-
Перейдем на количество вещества бензола, получаемого из ацетилена:
-
Зная количество вещества бензола, найдем его массу:
подставим значения:
m = 0,4 * 78 = 31,2 грамма.
-
Масса, рассчитываемая по уравнению реакции, является теоретической. Масса практическая дана нам по условию. Подставим полученные данные по массам в формулу для нахождения доли выхода продукта реакции:
Доля выхода бензола из данного объема ацетилена составляет 80%.
Ответ: 80.
Как оценивают готовые работы на ЕГЭ по химии
1-я часть
В 1-й части Единого государственного экзамена по химии задания 1–5, 9–13, 16–21, 25–28 оценивают 1 баллом, если вы запишете верный ответ по эталону. При этом в заданиях 1, 3, 4, 11, 12, 13, 17 и 18 ответ — это ряд цифр. То, в каком порядке вы их запишете, не влияет на оценку. Например, если в задании верны варианты под номерами 1 и 4, их можно записать как 14 или как 41. И в обоих случаях ответ засчитают как верный.
За правильные ответы в заданиях 6, 7, 8, 14, 15, 22, 23 и 24 можно получить по 2 балла. Если ваш ответ отличается от эталона на один символ, его оценят в 1 балл. Во всех остальных случаях задание считают выполненным неверно и ставят 0 баллов.
2-я часть
В этой части нужно записать не только ответ, но и решение. А значит, и оценивать такие задания будут сразу по нескольким критериям. Зато за верный ответ в некоторых вопросах можно получить больше баллов, чем за любое задание 1-й части. Максимум — 5 баллов. А теперь давайте разберемся, как именно их будут оценивать.
| Задание № 29 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества и записал уравнение химической реакции, составил электронный баланс, указал окислитель и восстановитель | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 30 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества, записал все нужные уравнения реакции | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 31 | Баллы |
|---|---|
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 4 |
| Задание № 32 | Баллы |
|---|---|
| Правильно записаны 5 уравнений реакции | 5 |
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 5 |
| Задание № 33 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 3 элемента | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 3 |
| Задание № 34 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 4 элемента | 4 |
| Правильно записаны только 3 элемента ответа | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 4 |
Как сдать ЕГЭ по химии на 3, 4 и 5
Мы уже познакомились с критериями, по которым будут оценивать работы на ЕГЭ. А теперь давайте разберемся, сколько баллов нужно получить для оценок 3, 4 или 5. Официально ЕГЭ не оценивают по пятибалльной системе с 2008 года. Если вам так проще оценить свои знания, их можно перевести. Но это будет лишь примерный перевод.
Будьте внимательны: баллы из таблиц выше — первичные, а требования к абитуриентам на поступление выражены в тестовых. Чтобы понять, сколько заданий точно нужно решить, чтобы поступить, надо перевести баллы из одной системы в другую. Это можно сделать по таблице ниже.
| Первичные баллы | Тестовые баллы | Оценка |
|---|---|---|
| <11 | <36 | 2 |
| 11–25 | 36–55 | 3 |
| 26–38 | 56–72 | 4 |
| 39–56 | 73–100 | 5 |
6 рекомендаций, как подготовиться к ЕГЭ по химии
Единый государственный экзамен — это ответственная задача, от результатов подготовки к которой иногда многое зависит. Чтобы немного облегчить для вас этот путь, мы собрали 6 простых, но рабочих советов от наших преподавателей. Следуйте им и тогда сможете подготовиться к экзамену по химии как можно лучше.
-
Узнайте все о структуре ЕГЭ и научитесь работать с КИМами.
-
Начинайте готовиться заранее. Но если получилось так, что осталось мало времени, составьте новый экспресс-план с помощью вашего преподавателя.
-
Ведите календарь подготовки к экзамену. Отмечайте на нем запланированные темы, разные методики, занятия у репетитора, пробные ЕГЭ и самоподготовку.
-
Распределяйте время на темы, исходя из ваших знаний. Больше учите то, что «западает», остальное — повторяйте.
-
Советуйтесь с учителем. Это может быть ваш преподаватель по химии или репетитор. Круто, если он сможет поделиться с вами опытом подготовки к ЕГЭ.
-
Заботьтесь о своем здоровье, не забывайте отдыхать, не лишайте себя живого общения. Все это может сказаться на вашем самочувствии, а значит, и баллах тоже.
Если вы хотите сдать ЕГЭ по химии на 100 баллов, советуем тщательно продумать, как вы будете готовиться к нему. Лучший из них — совмещать самостоятельную работу и дополнительные занятия.
На курсах подготовки к ЕГЭ по химии в Skysmart школьники отрабатывают все типы задач и разбирают критерии оценок. Для каждого из них мы составляем индивидуальный план, который приведет к нужным баллам. Он учитывает уровень знаний ученика и время до экзамена, что позволяет «выжать» максимум из подготовки. А еще мы рассказываем о ЕГЭ без «страшилок» и прикрас, чтобы школьник точно знал, что его ждет на экзамене. Ждем на первом бесплатном занятии!