15 мая 2021
В закладки
Обсудить
Жалоба
Повторение перед ЕГЭ по химии
Цикл лекций для выпускников.
Неорганическая химия для ЕГЭ (часть 1)
Неорганическая химия для ЕГЭ (часть 2)
Органическая химия для ЕГЭ (часть 1)
Органическая химия для ЕГЭ (часть 2)
Повторение для ЕГЭ (всё, кроме неорг. и орг. химии)
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии
Спецификация ЕГЭ по химии-2022
Химия
В помощь сдающим ОГЭ
методическое пособие по химии
для учащихся 9-х классов,
Тема №1: «Строение атомов первых 20 химических элементов
ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Строение атома: ядро (протоны и нейтроны) + электроны.
Число протонов (p+) – равно порядковому номеру химического элемента (Z).
Число нейтронов (n0) – равно A-Z, где А – массовое число.
Число электронов (е—) — равно порядковому номеру химического элемента (Z).
Заряд ядра = число протонов = число электронов (+Z = p+ = е—).
Номер периода показывает – число электронных слоев в электронной оболочке атома.
Номер группы показывает – число электронов на внешнем электронном слое атома + число валентных электронов.
Валентные электроны – электроны, участвующие в образовании химической связи.
Распределение электронов по энергетическим уровням: на 1-м максимум 2 электрона, на 2-м – 8 электронов, на 3-м – 18 электронов (если уровень последний – то число электронов на нём равно номеру группы или высчитывается как разница общего числа электронов и электронов на предыдущих уровнях). Если последний (внешний) уровень атома имеет максимальное число электронов, то такой электронный слой называется завершенным (его имеют атомы благородных газов – элементы 8 группы).
Тема №2: «Периодический закон и ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Закономерности изменения свойств элементов и их соединений.
В периоде слева направо:
-
Радиус атома уменьшается;
-
Металлические свойства ослабевают;
-
Неметаллические свойства возрастают;
-
Восстановительные свойства ослабевают;
-
Окислительные свойства возрастают;
-
Электроотрицательность возрастает;
-
Число валентных электронов возрастает;
-
Основные оксиды через амфотерные сменяются кислотными.
В группе сверху вниз:
-
Радиус атома возрастает;
-
Металлические свойства возрастают;
-
Неметаллические свойства ослабевают;
-
Восстановительные свойства возрастают;
-
Окислительные свойства ослабевают;
-
Электроотрицательность уменьшается;
-
Число валентных электронов постоянно и равно номеру группы.
Тема №3: «Химическая связь».
Обязательный минимум знаний.
Типы химических связей:
-
Ковалентная полярная химическая связь (образуется между атомами неметаллов с разным значением электроотрицательности или между атомами металла и неметалла с небольшой разностью в значении электроотрицательности). Например: H2S, NH3.
-
Ковалентная неполярная химическая связь (образуется между атомами неметаллов с одинаковым значением электроотрицательности). Например: H2, O2, P4, S8.
-
Ионная химическая связь (образуется между атомами неметалла и металла). Например: NaCl, CaO, K2S.
-
Металлическая химическая связь – характерна для металлов и сплавов. Например: Al, Cu, бронза, чугун, латунь.
Тема №4: «Степень окисления химических элементов».
Обязательный минимум знаний.
Правила расчета степени окисления:
-
С.о. водорода = +1 в соединениях с неметаллами и = -1 в соединениях с металлами (гидриды металлов);
-
С.о. кислорода = -2, кроме пероксидов (-1) и фторидов (+2);
-
С.о. металла = заряду его иона (в таблице растворимости);
-
С.о. простого вещества = 0;
-
Сумма с.о. всех элементов в сложном веществе = 0;
-
С.о. иона = заряду иона (в таблице растворимости).
Алгоритм определения степени окисления элементов в бинарных соединениях:
-
Выбрать более электроотрицательный элемент и найти его степень окисления, как № группы – 8. Написать над ним степень окисления.
-
Умножить степень окисления на индекс у этого элемента. Полученное число со знаком «минус» подписать под другим элементом.
-
Такое же число со знаком «плюс» подписать под другим элементом.
-
Разделить это число на индекс другого элемента. Полученную степень окисления написать над элементом.
Алгоритм определения степени окисления неметалла в кислотах и солях:
-
Отделить кислород вертикальной чертой, записать сверху его степень окисления – 2 и умножить на индекс. Полученное число написать под кислородом.
-
Такое же число с противоположным знаком записать под левой частью формулы.
-
Вычесть из него число атомов водорода (для кислот) или заряд металла*индекс металла (для солей). Полученное число написать над знаком центрального элемента.
Тема №5: «Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура органических соединений».
Обязательный минимум знаний.
Классификация веществ
Металлы Неметаллы Оксиды Основания Кислоты Соли
Оксиды – бинарные соединения кислорода, в котором он проявляет степень окисления –2 (CaO, Al2O3).
Классификация оксидов.
Оксиды
несолеобразующие солеобразующие
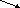
основные амфотерные кислотные
Несолеобразующие оксиды – не взаимодействуют с кислотами и щелочами и, как следствие, не образуют солей. Основные оксиды – образованы металлом в с.о.+1 и +2 (Na2O, MgO). Амфотерные оксиды – образованы металлами в с.о. +3 и +4 (Al2O3, PbO2). Исключения: ZnO, PbO, SnO, BeO (у них с.о. металла равна +2). Кислотные оксиды – образованы металлом в с.о.+5,+6,+7 или неметаллов, исключая несолеобразующие (SO3, CO2).
Основания – сложные соединения, в составе которых катион металла соединен с гидроксид-анионами: Me(OH)n. Например: NaOH, Ca(OH)2. Основания могут быть растворимыми и нерастворимыми. Растворимые в воде основания – щелочи (они окрашивают индикаторы).
Кислоты – сложные соединения, в составе которых атом водорода соединен с кислотным остатком (HCl, H2SO4). Кислотный остаток может состоять из одного элемента (Cl—) и быть сложным (SO4—).
Соли – сложные вещества, в составе которых катион металла соединен с кислотным остатком (NaCl, CaSO4).
Формулы и названия кислот и солей.
|
Формула кислоты |
Название кислоты |
Название соли |
Пример соли |
|
HF |
Фтороводородная (плавиковая) |
Фторид |
FeF3, фторид железа (III) |
|
HCl |
Хлороводородная (соляная) |
Хлорид |
CuCl2, хлорид меди (II) |
|
HBr |
Бромоводородная |
Бромид |
MgBr2, бромид магния |
|
HI |
Йодоводородная |
Йодид |
NaI, йодид натрия |
|
H2S |
Сероводородная |
Сульфид |
FeS, сульфид железа (II) |
|
H2SO3 |
Сернистая |
Сульфит |
Na2SO3, сульфит натрия |
|
H2SO4 |
Серная |
Сульфат |
BaSO4, сульфат бария |
|
HNO2 |
Азотистая |
Нитрит |
KNO2, нитрит калия |
|
HNO3 |
Азотная |
Нитрат |
Cu(NO3)2, нитрат меди (II) |
|
H2CO3 |
Угольная |
Карбонат |
CaCO3, карбонат кальция |
|
H2SiO3 |
Кремниевая |
Силикат |
Na2SiO3, силикат натрия |
|
H3PO4 |
Фосфорная |
Фосфат |
Ca3(PO4)2, фосфат кальция |
Тема №6: «Условия и признаки протекания химических реакций. Химические уравнения».
Обязательный минимум знаний.
Физические явления – явления, при которых состав вещества остается постоянным, а изменяется лишь его агрегатное состояние или форма и размеры тел. Примеры: плавление парафина, таяние льда, испарение воды.
Химические явления (химические реакции)– явления, при которых одни химические вещества превращаются в другие. Примеры: горение древесины, ржавление металлов, скисание молока.
Химическое уравнение – это условная запись химической реакции с помощью химических формул и коэффициентов.
Признаки химических реакций:
-
Изменение цвета;
-
Выделение тепла и света;
-
Выделение газа;
-
Растворение осадка;
-
Изменение запаха;
-
Выпадение осадка.
.
Тема №7: «Классификация химических реакций».
Обязательный минимум знаний.
Типы химических реакций по числу и составу исходных и полученных веществ:
-
Реакция разложения – это реакции, при которых из одного вещества образуется несколько других. Например: Cu(OH)2 → CuO + H2O
-
Реакция соединения – это реакции, при которых из нескольких веществ образуется одно. Например: S + O2 → SO2
-
Реакция обмена – это реакции, при которых два сложных вещества обмениваются своими составными частями. Например:
CuSO4 + BaCl2 → BaSO4 + CuCl2
-
Реакция замещения – это реакция между простым и сложным веществом, при которой атомы простого вещества, замещают атомы одного из элементов в сложном веществе. Например:
Zn + 2HCl → ZnCl2 + H2
Типы химических реакций по тепловому эффекту:
-
Экзотермические – протекают с выделением теплоты;
-
Эндотермические – протекают с поглощением теплоты.
По изменению степени окисления исходных веществ и продуктов реакции:
-
Окислительно-восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления;
-
Не окислительно-восстановительные реакции – реакции, протекающие без изменением степени окисления;
По участию катализатора:
-
Каталитические – протекают с участием катализатора;
-
Некаталитические – протекают без участия катализатора.
По обратимости:
-
Обратимые – протекают в двух противоположных направлениях;
NaCl + HNO3 ↔ HCl +NaNO3
-
Необратимые – протекают только в одном направлении.
NaCl + AgNO3 → AgCl↓ + NaNO3
Тема №8: «Электролиты и неэлектролиты. Катионы и анионы».
Обязательный минимум знаний.
Электролиты – вещества, растворы которых проводят электрический ток. К электролитам относятся – растворимые кислоты, щелочи, соли.
Неэлектролиты – вещества, растворы которых не проводят электрический ток. К неэлектролитам относятся – нерастворимые кислоты, основания, соли; оксиды; органические вещества: раствор сахарозы, метанол, этанол, глюкоза.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 35.
Тема №9: «Электролитическая диссоциация кислот, щелочей и солей».
Обязательный минимум знаний.
Положения ТЭД:
-
При растворении в воде электролиты диссоциируют на положительные ионы (катионы) и отрицательные ионы (анионы).
-
Под действие электрического тока катионы движутся к катоду (-), анионы – к аноду (+).
-
Диссоциация – обратимый процесс.
-
Не все электролиты диссоциируют в равной мере.
-
Химические свойства электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Кислоты – электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Например: HCl → H+ + Cl—
Основания – электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. Например: NaOH → Na+ + OH—
Соли — электролиты, которые при диссоциации образуют катионы металла и анионы кислотного остатка. Например: NaCl → Na+ + Cl—
Это важно! При диссоциации индексы выносятся вперед ионов. Например: Al2(SO4)3 → 2Al3+ + 3SO42-
Тема №10: «Реакции ионного обмена и условия их осуществления».
Обязательный минимум знаний.
Взаимодействие кислот, оснований и солей

1р р
р
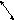
Алгоритм составления реакций ионного обмена:
-
Записать исходные вещества. Подписать классы веществ.
-
Проверить, являются ли они электролитами (по таблице растворимости). По схеме определить, возможна ли такая реакция.
-
Если возможно, над ионами в исходных веществах проставить заряды (по таблице растворимости).
-
Поменять правые части формул местами и записать, таким образом продукты реакции.
-
Правильно составить формулы продуктов. Для этого поставить заряды ионов, снести их крест-накрест и сократить, если нужно.
-
Расставить коэффициенты в уравнении
-
Под формулами продуктов реакции подписать, являются ли они электролитами или неэлектролитами.
-
Записать электролиты в виде ионов с учетом индексов и коэффициентов; неэлектролиты оставить в молекулярном виде.
-
В левой и правой части сократить одинаковые частицы.
-
Записать оставшиеся после сокращения ионы и молекулы.
Условия протекания реакций ионного обмена до конца (необратимо):
-
Образуется осадок.
-
Образуется газ.
-
Образуется малодиссоциируемое вещество, например вода.
Тема №11: «Химические свойства простых веществ: металлов и неметаллов».
Обязательный минимум знаний.
+ неметалл → соль или оксид (1)
+ Н2О → Ме(ОН)n+H2 (если Ме от Li-Al) (2)
+ Н2О → Ме2Оn+H2 (если Ме от Mn-Cd) (3)
Металл + кислота → соль (растворимая) + Н2 (Ме левее Н) (4)
+ соль → соль’ (растворимая)+ Ме (5)
+ Ме2Оn → Ме’ + Ме2Om (6)
-
. Образуется бинарное соединение. Металл пишется слева, неметалл справа. У металла с.о. равна +№ группы (есть исключения), у неметалла с.о. равна № группы — 8.Например: 2Са + О2 → 2Са+2О-2.
-
. Металлы от лития до натрия реагируют с водой при комнатной температуре, остальные – при нагревании. 2Na + 2H2O → 2NaOH + H2.
-
. Данная реакция протекает при нагревании. Zn + H2O → ZnO + H2.
-
.Данная реакция характерна только для разбавленных кислот. Металлы, стоящие в ряду напряжений после водорода, с разбавленными кислотами не взаимодействуют. Ещё одно условие данной реакции: в результате неё должна быть образована растворимая соль. Mg + 2HCl → MgCl2 + H2. Это важно!: азотная кислота по особому взаимодейстует с металлами (см. А.14).
-
. Zn + CuCl2 → ZnCl2 +Cu.
-
. 2Al + Cr2O3 → Al2O3 + 2Cr
Это важно! Особенности химических свойств некоторых металлов:
1. Особенности щелочных металлов (Li, Na, K):
-
При взаимодействии с кислородом литий образует оксид Li2O, натрий образует пероксид Na2O2: 2Na + O2 → Na2O2.
-
С растворами кислот и солей не взаимодействуют, т.к. в первую очередь будут вступать в реакцию с водой.
2. Особенности алюминия:
-
При обычных условиях малоактивен, т.к. покрыт прочной оксидной пленкой Al2O3 (большинство реакций идут при нагревании);
-
Является амфотерным металлом, поэтому взаимодействует не только с растворами кислот, но и с щелочами, образуя соль — алюминат:
2Al+2NaOH+2H2O→2NaAlO2+3H2↑
-
На холоду не взаимодействует с концентрированными серной и азотной кислотами (пассивируется).
3. Особенности железа:
-
Для железа характерно образование двух соединений: Fe2+ и Fe3+;
-
Образование соединений железа:
|
+2 |
+3 |
|
1). С неметаллами |
|
|
Fe + S → FeS |
2Fe + 3Cl2 → 2FeCl3 |
|
3Fe + 2O2 → Fe3O4 |
|
|
2). C водой: |
|
|
3Fe + 4H2O → Fe3O4 + 4H2↑ |
|
|
3). С кислотами |
|
|
Fe + 2HCl → FeCl2 + H2↑ |
|
|
4). С солями: |
|
|
Fe + СuSO4 → FeSO4 + Cu |
Тема №12: «Химические свойства оксидов: основных, амфотерных, кислотных».
Обязательный минимум знаний.





Это важно! Амфотерные оксиды будут сочетать свойства основных и кислотных оксидов, т.е. будут вступать в реакции с щелочами и кислотами.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 40.
Тема №13: «Химические свойства оснований».
Обязательный минимум знаний.
+ кислотный оксид → соль + H2O
Щелочи + кислота → соль + H2O
Основания + соль → соль + основание (↑,↓)
Нерастворимые + кислота → соль + H2O
нагревание → МеО + H2O
Тема №14: «Химические свойства кислот».
Обязательный минимум знаний.
+ Ме (до Н) → соль + Н2
+ основный/амфотерный оксид → соль + Н2О
Кислота + основание/амфотерный гидроксид → соль + Н2О
+ соль → соль + кислота (↓,↑)
!Особенности взаимодействия азотной кислоты с металлами:
-
Водород никогда не выделяется;
-
Металл в полученном нитрате имеет максимальную степень окисления;
-
На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni.
-
Продукты реакции зависят от двух факторов:
-
Активность металла;
-
Концентрация кислоты.
HNO3 (к) + Ме (I, II группа, гл.подгр.) → нитрат + N2O + H2O
HNO3 (к) + Ме (остальные) → нитрат + NO2 +H2O
HNO3 (р) + Ме (I, II группа, гл.подгр.) → нитрат + NH3 (или NH4NO3) + H2O
HNO3 (р) + Ме (остальные) → нитрат + NO + H2O
Например:
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 38.
Ag + 2HNO3 (к) → AgNO3 + NO2 + H2O.
!Особенности химических свойств концентрированной серной кислоты:
-
С металлами:
-
Может взаимодействовать с металлами, стоящими в ряду напряжений после водорода;
-
Металл в полученном сульфате имеет максимальную с.о.
-
Водород никогда не выделяется;
-
На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni.
H2SO4 (к) + Me (I, II группа, гл.подгр, Zn) → сульфат + H2S/S/SO2 +H2O
H2SO4 (к) + Me (остальные) → сульфат + SO2 + H2O.
-
С неметаллами:
2H2SO4 (к) + C → CO2 + 2SO2 + 2H2O
2H2SO4 (к) + S → 3SO2 + 2H2O
-
С органическими веществами: обугливает бумагу, ткань, древесину, сахарозу.
Тема №15: «Химические свойства солей».
Обязательный минимум знаний.
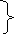
+ кислота → соль + кислота’
Соли + щелочь → соль + основание’ (↑,↓).
+ соль → соль + соль’
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 41.
Тема №16: «Первоначальные представления об органических веществах».
Обязательный минимум знаний.
Общие признаки органических веществ:
-
Наличие углерода;
-
Наличие в молекулах только ковалентных связей;
-
Валентность углерода всегда равна четырем.
Основные классы органических веществ.
-
Предельные углеводороды (алканы). Общая формула CnH2n+2. Важнейшие представители алканов:
|
Формула |
Название |
|
CH4 |
Метан |
|
C2H6 |
Этан |
|
C3H8 |
Пропан |
|
C4H10 |
Бутан |
|
C5H12 |
Пентан |
Характерные реакции: замещение и окисление.
-
Непредельные углеводороды (алкены). Общая формула CnH2n. Важнейшие представители:
|
Формула |
Название |
|
C2H4 |
Этен (этилен) |
|
C3H6 |
Пропен (пропилен) |
|
C4H8 |
Бутен |
|
C5H10 |
Пентен |
Особенность строения: наличие двойной С-С связи. Характерные реакции: присоединения и окисления.
-
Непредельные углеводороды (алкины). Общая формула CnH2n-2. Важнейшие представители:
|
Формула |
Название |
|
C2H2 |
Этин (ацетилен) |
|
C3H4 |
Пропин |
|
C4H6 |
Бутин |
|
C5H8 |
Пентин |
Особенность строения: наличие тройной С-С связи. Характерные реакции: присоединения и окисления.
-
Спирты. Общая формула CnH2n+1ОН. Важнейшие представители:
|
Формула |
Название |
|
CH3ОН |
Метанол (метиловый спирт) |
|
C2H5ОН |
Этанол (этиловый спирт) |
|
C3H5(ОН)3 |
Глицерин |
-
Карбоновые кислоты. Общая формула CnH2n+1СООН. Важнейшие представители:
|
Формула |
Название |
|
НСООН |
Муравьиная кислота |
|
CH3СООН |
Уксусная кислота |
|
C17H35СООН |
Стеариновая кислота |
Характерны все свойства кислот (взаимодействие с металлами, оксидами металлов, основаниями, солями).
Тема №17: «Чистые вещества и смеси. Правила безопасной работы в школьной лаборатории. Разделение смесей и очистка веществ».
Обязательный минимум знаний.
Химические формулы соответствуют чистым веществам. Все изучаемы в школьном курсе способы разделения смесей относятся к физическим.
Смесь – многокомпонентная система (воздух, нефть, морская вода, стекло, бронза, молоко, лимонад).
Смеси бывают однородными (нельзя увидеть границу раздела между веществами): раствор сахара в воде и неоднородными (видна граница раздела между веществами): взвесь мела в воде.
Способы разделения неоднородных смесей:
-
Отстаивание (этим же методом можно разделить две несмешивающиеся жидкости с помощью делительной воронки). Ускоряют отстаивание центрифугированием;
-
Фильтрование;
-
Некоторые твердые смеси можно разделить при помощи магнита (смесь железных и медных опилок, смесь железных опилок и серы).
Способы разделения однородных смесей:
-
Выпаривание;
-
Перегонка (дистилляция).
Некоторые правила безопасной работы в химической лаборатории:
-
При растворении серной кислоты нужно вливать её тонкой струей в воду и перемешивать;
-
При работе с растворами едких веществ необходимо надевать защитные перчатки и очки;
-
Воспламенившиеся ЛВЖ (нефть, спирт, ацетон) необходимо тушить песком;
-
Опыты с получением токсичных газообразных веществ (SO2, H2S, NO2) необходимо проводить в вытяжном шкафу.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008 г., § 23.
Тема №18: «Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе и на газообразные вещества».
Обязательный минимум знаний.
Индикаторы
|
Кислая |
Нейтральная |
Щелочная |
|
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Лакмус |
красный |
фиолетовый |
синий |
|
Метилоранж |
розовый |
оранжевый |
желтый |
Качественные реакции
|
Хлорид-ион Cl— |
+ Ag+ → AgCl↓ белый творожистый осадок |
|
Сульфат-ион SO42- |
+ Ba2+ → BaSO4↓ белый осадок |
|
Карбонат-ион CO32- |
+ H+ → CO2↑+H2O выделение газа + Ca2+ → CaCO3↓ белый осадок |
|
Ион аммония NH4+ |
+ OH— → NH4OH при нагревании запах аммиака |
|
Кислород O2 |
Загорание тлеющей лучины |
|
Водород H2 |
Хлопок при поднесении горящей лучины |
|
Углекислый газ CO2 |
Горящая лучина гаснет |
|
Аммиак NH3 |
По запаху; посинение влажной лакмусовой бумаги; появление белого дыма при внесении палочки, смоченной соляной кислотой («дым без огня»). |
Тема №19: «Вычисление массовой доли химического элемента в веществе».
Обязательный минимум знаний.
Вычисления производятся по следующей формуле:
ω = Ar∙n/Mr ∙ 100%, где Ar – атомная масса химического элемента; n – число атомов того элемента, массовая доля которого находится; Mr – молярная масса молекулы. Например: вычислите массовую долю кислорода в карбиде натрия. Решение:
1. Составляем формулу карбида натрия: Na4C.
2. Ar(Na)=23 г/моль; n(Na)=4; Mr(Na4C)=104г/моль.
3. Подставляем в формулу и вычисляем: ω(Na)=23∙4/104 ∙100% = 88,5%
4. Ответ: 88,5%.
Задания части В.
Тема №1: «Периодический закон Д. И. Менделеева».
Обязательный минимум знаний.
См. тема №2 части А.
Тема №2: «Химические свойства простых веществ и оксидов».
Обязательный минимум знаний.
Химические свойства неметаллов.
|
Как окислитель |
Как восстановитель |
|
|
H2 |
Щелочные металлы |
НеМе и МеО |
|
O2 |
Ме, неМе (большинство), неМеО (в которых степень окисления неМе не max) |
F2 |
|
Галогены (F2, Cl2, Br2) |
Ме, H2 |
— |
|
S |
Ме, H2 |
O2, галогены, H2SO4 (к), HNO3(к) |
|
N2 |
Ме (в обычных условиях только с литией, с остальными – при нагревании), H2(при нагревании и давлении) |
O2 (при температуре электрической дуги), галогены. |
|
P |
Ме, H2 |
O2, галогены, HNO3(к) |
|
C |
Ме, H2 |
O2, галогены, МеО, H2SO4(к), HNO3(к) |
|
Si |
Ме, H2 |
O2, галогены, щелочи |
+ см. тема № 12 части А.
Тема №3: «Окислительно-восстановительные реакции».
Обязательный минимум знаний.
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых атомы меняют степени окисления.
Восстановитель – элемент, отдающий электроны (в ОВР его степень окисления повышается). Им может быть атом, ион, имеющий минимальную или промежуточную степень окисления. Например: Zn0 – 2e— = Zn+2.
Окислитель – элемент, принимающий электроны (в ОВР его степень окисления понижается). Им может быть атом, ион, максимальную или промежуточную степень окисления. Например: S0 + 4e— = S+4.
Атом или ион, имеющий промежуточную степень окисления, может проявлять как восстановительные, так и окислительные свойства, т.е. проявлять окислительно-восстановительную двойственность. Для элементов главных подгрупп максимальная степень окисления = +№ группы; минимальная № группы – 8.
Восстановление – процесс принятия электронов.
Окисление – процесс отдачи электронов.
+ см. тема №4 части А.
Тема №4: «Химические свойства кислот, оснований и солей».
Обязательный минимум знаний.
см. тема №13, 14, 15 части А.
Задания части С.
Тема №1: «Взаимосвязь различных классов неорганических веществ».
Обязательный минимум знаний.
Схема генетической связи веществ.
+O2 +H2O
металл основной оксид основание соль
неметалл кислотный оксид кислота соль
+O2 +H2O
Дополнительная информация: Габриэлян О. С., Химия 8 кл., 2008г., § 42.
Тема №2: «Вычисление массовой доли растворенного вещества в растворе».
Обязательный минимум знаний.
Алгоритм решения расчетных задач на нахождение массы выпавшего осадка по уравнению реакции:
-
Составить уравнение реакции, уравнять его.
-
По таблице растворимости определить в правой части реакции осадок, обозначить его ↓.
-
Рассчитать массу вещества в растворе по формуле:
m(вещества) = m(раствора)∙ω.
-
Рассчитать количество вещества по формуле: n = m/M.
-
По уравнению реакции определить количество вещества того вещества, которое выпало в осадок.
-
Рассчитать массу осадка по формуле: m = M·n.
Пример. К 80 г раствора с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди (II). Определите массу выпавшего осадка.
Решение.
-
Составляем уравнение реакции: NaOH + CuSO4 → Na2SO4 + Cu(OH)2.
-
По таблице растворимости определяем, что в осадок выпадает гидроксид меди(II), тогда уравнение реакции принимает вид: NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓.
-
Рассчитаем массу NaOH по формуле m(вещества) = m(раствора)∙ω:
m(NaOH)=80г · 0,05= 4г.
-
Рассчитаем количество вещества NaOH по формуле m = M·n:
n(NaOH)= 4г/40г/моль=0,1моль.
-
По уравнению реакции определяем (по коэффициентам перед веществами), что n(Cu(OH)2)=1/2n(NaOH)→n(Cu(OH)2)=0,05моль.
-
Рассчитаем массу Cu(OH)2 (осадок) по формуле m = M·n:
m(Cu(OH)2)= 98г/моль∙0,05моль = 4,9г.
Ответ: 4,9 г.
Необходимые формулы:
-
m = M·n; n = m/M.
-
m(в-ва)=m(р-ра)·ω; m(р-ра)=m(в-ва)/ω.
-
V=Vm·n; n=V/Vm.
Если выпускник хочет получить профессию, которая связана с такими сферами как наука, медицина, ветеринария, промышленность, фармакология, агрономия и селекция, он выбирает ЕГЭ по химии. Успешная сдача зависит от того, насколько внимательны и усидчивы были ученики в период посещения школы.
Как готовиться
Чтобы получить отличную оценку по единому экзамену по химии, важны следующие
моменты:
- Хорошая подготовленность в теории;
-
достижения в области чтения и составления формул;
-
«натренированность» в решении задач и уравнений;
-
способность разбираться в таких способах структурирования данных как таблицы и
схемы.
Работа должна быть основательной и комплексной. Предпочтительны
различные методы тренировки:
- Использование учебных материалов за все годы с
акцентом на объемные и сложные темы; -
изучение дополнительной специализированной литературы: это обязательно пригодится во время тестирования;
-
прохождение онлайн-тестов для закрепления полученной информации и выработки навыков правильного и качественного заполнения бланков теста.
Упражнения с тестами помогают выявлять «уязвимые места» и направлять силы в нужное русло.
Нюансы
На ЕГЭ придется блеснуть познаниями по всем ячейкам школьного курса. В
процессе подготовки рекомендуется обратить внимание на теоретические разделы по следующим вопросам:
- Химические элементы — характеристика;
- атом — строение;
- органические соединения — особенности;
- массовые доли, масса в растворах и соединениях — расчеты;
- оксиды;
- простые вещества, основания, кислоты, соли,
углеводороды, спирты, альдегиды и другие; - реакции и связи;
- неорганика — классификация, свойства, взаимосвязи классов.
Советы
Лучше всего придерживаться стратегии, включающей как повторение легких,
так и доскональная проработка тех тем, которые вызывают сложности. При переключении деятельности качество занятий повышается;
Не пытайтесь перегружать мозг потоком информации одного типа – очень
полезно дополнять тексты цифровыми выражениями и условными записями;
Чтобы уложить в голове непростые вопросы, не ленитесь делать заметки и
составлять схематические изображения.
Нас с детства интересуют различные опыты. Задумываемся ли мы над тем, что, заваривая себе чай, мы проводим один из них?
Химия – это увлекательный и интересный предмет, именно поэтому его выбирают девятиклассники. К тому же, он начинается в восьмом классе. Но предмет достаточно сложный. В этой статье мы расскажем, как сдать химию на «пятерку».
Содержание
- Структура экзамена
- Оценивание заданий ОГЭ по химии
- План подготовки к ОГЭ по химии в 2021
- Система подготовки к экзамену
- Темы для подготовки к ОГЭ по химии
- Материалы для подготовки

Структура экзамена
В новом учебном году появилась практическая часть по химии, которая является обязательной для всех учеников, сдающих экзамен по химии.
По данным ФИПИ в КИМе этого года предусмотрено увеличение числа заданий на сопоставление и уменьшение тестов с выбором ответа. Всего имеется 24 задания, 14 из них относятся к базовому, пять к повышенному, оставшиеся – к высокому уровню сложности.
Каждый ученик хочет получить максимальный результат. Как подготовиться к химии, чтобы его достичь? Этот вопрос интересует многих. В 2021 году максимум равняется 40 баллам. Для выпуска из школы необходимо набрать не менее 10. Всё очень просто!
Оценивание заданий ОГЭ по химии
Подготовиться к ОГЭ по химии, не зная критерии проверки невозможно! Но они достаточно просты и понятны.
За каждый верный ответ ученики получают «первичные баллы». Вы получаете два первичных балла за 4, 9-10, 12, 17. 3 балла начисляются за 20, 22. За задание с практической частью — 4 основных балла. Остальные оцениваются в один.
Для того, чтобы набрать желаемое количество, нужно составить план, как подготовиться к ОГЭ по химии.
План подготовки к ОГЭ по химии в 2021
Сдать «на отлично» можно! Нужно как можно скорее начинать учить. Логичнее всего разбирать каждую тему постепенно.
- Прежде всего рекомендуем изучить и разобрать актуальную демоверсию, а также кодификатор;
- Соберите все необходимые материалы;
- Составьте примерный график подготовки к экзамену с учетом прописанных в кодификаторе тем;
- Далее – изучение тем и закрепление информации на практике.
Мы советуем вам вести учет вашего прогресса, а также систематически решать пробные варианты.
Система подготовки к экзамену
Как подготовиться к ОГЭ по химии, если не учили ничего до этого? Начните с основных понятий. Изучите степени окисления веществ и связи между ними. А также другие вопросы. Освоив это, трудные темы станут намного легче.
Не стоит упускать из виду учебник 8 класса, например, под редакцией Н. Е. Кузнецовой или В. В. Ерёмина, ведь именно в этот учебный год изучаются все основные темы, знания по которым могут пригодиться. Тем, кто планирует продолжить обучение в школе и собирается сдавать ЕГЭ, рекомендуем сборник К. А. Егорова «Репетитор по химии», с подробными темами всего курса.
После изучения теории, знания нужно закрепить на практике.
Сейчас мы расскажем вам, как последовательно подготовиться к ОГЭ по химии.
Этапы подготовки:
- пройдитесь по теории на каждую тему;
- просмотрите видеоуроки по ней;
- решайте всевозможные упражнения по выбранному разделу.
Если при выполнении заданий вы все еще допускаете неточности, вернитесь к изучению теоретического материала и разберите с учителем вопросы, которые вызывают у вас трудности. Поняв структуру химических процессов, представленных в задачах, вы заметите, что ваш балл заметно возрастет.

Темы для подготовки к ОГЭ по химии
Сама тематика не изменялась уже очень давно, так как основана на проверке теоретических знаний и умений, которые были получены в последние годы обучения.
Как эффективнее подготовиться к ОГЭ по химии?
Вам следует повторить названия всех элементов, их положение в таблице Менделеева. Знать условия изменения свойств атомов элементов, формулы веществ, а также виды связей в различных соединениях. Повторить органические и неорганические вещества и всё, что связано с ними. Полностью пройтись по разделу, связанному с химическими реакциями. Для успешного выполнения 8 и 22 заданий следует уделить внимание реакциям ионного обмена.
Особую сложность может возникнуть при решении задания под номером 13. В его состав множество тем: правила безопасности в лаборатории, обращение с различными веществами, приготовление растворов, а также загрязнение окружающей среды.
Это основные темы, которые нужно рассмотреть перед экзаменом, следует повторить каждый раздел, любой вопрос может встретиться в КИМе. Поэтому следует как можно тщательнее подготовиться к ОГЭ по химии.
Материалы для подготовки
Книги и справочники очень важны в процессе изучения. Что следует знать и учить, чтобы как можно лучше подготовиться к ОГЭ по химии? Нужно повторить весь школьный курс, поэтому советуем начать подготовку как можно раньше:
- Соберите проверенные теоретические материалы. Специалисты-разработчики рекомендуют для приобретения расширенную версию ФИПИ. В них анализируются наиболее сложные задания, представлены пояснения и ответы на часто задаваемые вопросы. Хорошим дополнением станут издательства Н. Е. Кузнецова или В. В. Еремина. Кроме того, материал хорошо представлен в учебнике А. Егорова.
- Выделяйте наиболее сложные темы.
- Материал лучше всего моментально закреплять на практике.
- При возникновении сложных ситуаций с конкретными темами, найдите репетитора.
Обращаем внимание на сборник «Типовые варианты экзаменационных заданий», разработанный Ю. Н. Медведевым, А.С. Корощенко, Г. Н. Молчановой, а также Елены Савинковой. С помощью вышеупомянутых пособий вы узнаете, как правильно подготовиться к ОГЭ по химии.
Больше читайте и практикуйте полученные знания. Изучайте каждый день что-то новое и повторяйте пройденное. Это поможет вам как можно лучше подготовиться к ОГЭ по химии. Кроме того, хорошие знания обеспечат вам уверенность и вы легче справитесь с волнением.
Общая и неорганическая химия
По итогам прошлого года можно выделить задания, в которых большинство выпускников допустили ошибки. Из блока «Общая и неорганическая химия» это задания 19, 20, 24, 30, 31, 32 (соответственно, № 17, 18, 22, 29, 30, 31 в нумерации 2022 года).
Задание «Классификация химических реакций в неорганической и органической химии»
Большие трудности вызвало выполнение задания «Классификация химических реакций в неорганической и органической химии». Вероятная причина снижения результативности — изменение формы ответа: вместо фиксированных двух ответов необходимо выбрать все правильные (а их число может быть от двух до четырех).
При выполнении этого задания нужно внимательно анализировать каждое предложенное утверждение, а иногда подбираться к ответу от обратного: «это утверждение точно неверно».
Обратите внимание, что в ЕГЭ 2022 года таких заданий с открытым ответом стало три: №12, №17, №18.
Задание «Скорость химической реакции, ее зависимость от различных факторов»
По-видимому, та же причина привела и к низкой результативности выполнения задания «Скорость химической реакции, ее зависимость от различных факторов» (№18 в новом формате ЕГЭ). При выполнении нужно помнить, что все факторы, влияющие на скорость реакции, условно можно отнести к левой части уравнения. То есть продукты реакции на скорость не влияют никак. Важно не путать скорость реакции и смещение равновесия, помнить, что слово «катализатор» относится к скорости, но никак не к равновесию. А при повышении температуры реакция всегда идет с большей скоростью.
Павел Лисицын/РИА Новости
Задание «Обратимые и необратимые химические реакции. Химическое равновесие и его смещение под действием различных факторов»
Задание №22 — это задание на соответствие, то есть к каждому фактору нужно подобрать направление смещения равновесия.
Особые сложности вызывает анализ ответной реакции равновесной системы на внешнее воздействие, если это воздействие вызвано добавлением твердых веществ в растворы. В этом случае в растворе появляются дополнительные ионы, способные влиять на состояние химического равновесия. Здесь речь идет о факторе «концентрация». Но важно понять, будет ли менять концентрацию добавленное вещество.
Если в систему вносят нерастворимое вещество, то оно никак не смещает равновесие. Точно так же не смещает равновесие и растворимое вещество, если оно не принимает участия в реакции.
Но если растворимое вещество в своем составе содержит те же ионы, какие есть в уравнении, то нужно смотреть, с какой стороны увеличивается их концентрация, а равновесие, соответственно, смещается в другую сторону.
И еще один случай, когда добавленное растворимое вещество смещает равновесие — если оно реагирует с ионами, которые находятся в обратимой реакции, и уменьшает их концентрацию.
Задание «Реакции окислительно-восстановительные»
В задании №29 нужно продемонстрировать умение составлять уравнение окислительно-восстановительной реакции с учетом коэффициентов и электронный баланс к этой реакции. Но часто участники экзамена баланс не засчитывают, так как он составлен к уравнению, не отвечающему условиям задания.
Также выпускники допускают традиционные ошибки:
• неверно выбирают окислитель и восстановитель для реакции;
• записывают уравнения несуществующих химических реакций, которые теоретически не противоречат окислительно-восстановительным превращениям, но практически не осуществимы;
• записывают уравнения реакций, которые не отвечают условиям задания;
• не учитывают характер среды и возможные взаимодействия между продуктами (например, кислота+щелочь) или продуктов с исходными веществами.
При выполнении этого задания нужно учитывать, что не допускается использовать воду в качестве реагента, так как это оговорено в условии задания.
Баллы снимаются, если в балансе неверно определены или записаны степени окисления (сначала пишется знак, а потом цифра).
Также частая ошибка — это неверно записанные процессы окисления и восстановления и, соответственно, неверно определенные окислитель и восстановитель.
Помните: окислитель-грабитель окисляет, забирает электроны, понижает свою степень окисления. Досадной ошибкой, лишающей балла, становится отсутствие множителей в балансе, без которых не будет и самого баланса. Ведь баланс — это равенство, которое должно заключаться в том, что число отданных электронов равно числу принятых. Без множителей запись будет неверной.
Aleksander Polyakov/Global Look Press
Задание «Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена»
В задании №30 сразу снижает результативность, если в списке веществ для проведения реакции ионного обмена появляются кислые соли.
Следует придерживаться такого принципа: если для реакции взяли кислую соль, в продуктах никогда не получится основание, так как любая кислая соль будет сразу реагировать с основанием.
Если вы будете контролировать себя таким образом, это поможет вам избежать ошибок.
Выпускники часто допускают следующие типичные ошибки:
• неверно выбирают реагенты, например, выбирают вещества, взаимодействие которых не удовлетворяет условиям протекания реакций ионного обмена до конца;
• не сокращают коэффициенты в сокращенном ионном уравнении;
• неверно записывают формулы ионов;
• неправильно определяют и записывают заряды ионов (записывать нужно так, как в таблице растворимости: сначала цифру, потом знак).
Задание «Реакции, подтверждающие взаимосвязь классов неорганических веществ»
При выполнении задания №31 школьники часто невнимательно читают описание конкретного химического эксперимента. Следовательно, неверно записывают продукты реакции, что приводит к нарушению отражения генетической связи, идея которой заложена в задании.
Например, при смешивании твердых гидроксида натрия и иодида аммония и дальнейшем нагревании образуется только газообразный аммиак (гидрат не образуется!)
Часто не учитываются специфические свойства представителей различных классов неорганических веществ, например, соединений хрома, алюминия. Уравнение считается записанным неверно, если в нем пропущен даже один коэффициент, или ошибочно записан хотя бы один индекс в формуле. К сожалению, типичной является ошибка, когда вместо формулы сульфита пишут сульфид. Учите номенклатуру!
Комбинированная расчетная задача
Традиционно самым сложным заданием с самым низким процентом выполнения является комбинированная расчетная задача (№33).
Она сложная, ее выполнение требует целого комплекса знаний и умений, в том числе:
• умения анализировать условия;
• понимать суть химических процессов, отраженных в условии;
• составлять уравнения химических реакций (согласно данным условия задачи), необходимых для выполнения стехиометрических расчетов;
• выстраивать алгоритм решения веществ, выполнять расчеты, необходимые для нахождения ответа;
• логически обосновывать все этапы решения.
Кроме того, участники экзамена часто допускают арифметические ошибки, не указывают размерности физических величин, путаются в обозначениях.
Немаловажное значение имеет грамотная запись данных, извлеченных из условия задания, которая отражает обоснованный логический подход к решению задачи. Но многие выпускники этого не делают.
Если во время подготовки к экзамену вы чувствуете, что не можете решить ни одну из задач подобного типа, может быть, лучше уделить больше внимания другим заданиям?
Органическая химия
В блоке «Органическая химия» наибольшее число ошибок было допущено в заданиях №11 (Гомология и изомерия. Гибридизация), №13 (Свойства азотсодержащих органических веществ), №32 (Взаимосвязь органических веществ), №34 (Установление молекулярной и структурной формулы вещества).
Aleksander Polyakov/Global Look Press
Гомология и изомерия. Гибридизация
При выполнении задания №11 помните: гомологи — это всегда представители одного класса с разным числом атомов, а изомеры могут принадлежать и к одному классу, и к разным, но общая формула, то есть число атомов, у них всегда одинаковое.
Задание, проверяющее знание свойств азотсодержащих органических веществ, часто вызывает проблемы при выполнении. Возможно, это связано с тем, что, изучая свойства кислородсодержащих веществ, школьники обращают внимание на их кислотные свойства. А с азотом все наоборот: аминогруппа проявляет основные свойства за счет не поделенной электронной пары на атоме азота. И чем больше смещена электронная плотность к азоту, тем сильнее основные свойства.
Выполняя задания, относящиеся к органической химии, следует иметь в виду, что химические свойства веществ одного класса являются способами получения веществ другого класса.
И если вы вдруг забыли, с чем реагируют спирты, то, возможно, вспомните, из чего могут быть получены альдегиды.
Внимательно читайте текст задания! Не исключено, что вы найдете в нем подсказки для себя.
Цепочка превращений органических веществ
Задание №32 из года в год вызывает типичные ошибки. Выпускники неверно записывают формулы органических веществ:
• вместо структурной появляется молекулярная формула,
• добавление лишней черточки к азоту образует несуществующий пятивалентный азот,
• бензольное кольцо отображают с указанными сверху атомами углерода.
Помимо ошибочно написанных продуктов реакции, пропускаются коэффициенты, теряются побочные продукты. А еще иногда вместо уравнения реакции бывает записана схема, а это неправильно, потому что в схеме реагенты, а иногда и побочные продукты, записаны не в строке, а над стрелочкой.
Установление молекулярной и структурной формулы вещества
При выполнении задания №34 нужно:
• установить молекулярную формулу органического вещества на основании вычислений с использованием физических величин;
• установить структурную формулу по указанным свойствам или способам получения;
• составить уравнение реакции.
Типичные ошибки здесь такие:
1. вместо молекулярной формулы выводится простейшее соотношение, не позволяющее составить правильную структурную формулу органического вещества;
2. неполный анализ условия задачи приводит к составлению не существующей, придуманной формулы без ориентации на указанные в задании свойства или способы получения вещества.
Для выполнения этой задачи необходимо знать свойства органических веществ.
При повторении органики начните с углеводородов, усвойте для себя, как особенности строения влияют на свойства веществ. Далее — кислородсодержащие. Как их можно получить из углеводородов? В чем проявляется окисление кислородсодержащих веществ по ряду спирт-альдегид-кислота?
Окисление в органике — это появление в молекуле атомов кислорода и двойной связи перед ним.
Свойства азотсодержащих органических веществ
Повторяя свойства азотсодержащих, помните, что аминогруппа — основание. А если в аминокислотах присутствует и аминогруппа, и карбоксильная группа, значит, они являются амфотерными соединениями и реагируют как с кислотами, так и с основаниями.
Поскольку самое главное, что определяет свойства органических веществ, — это их строение, запомните, что реакции идут по функциональным группам или по особенностям связи (одинарные связи алканов позволяют протекать только реакциям замещения, а кратными связями обусловлены реакции присоединения).
Таким образом, при подготовке к экзамену по химии важно уметь выделять нужную информацию, анализировать ее и фиксировать этапы решения задачи.
Полезные ссылки для подготовки к ЕГЭ по химии
• Чтобы хорошо сдать экзамен по химии нужно готовиться, повторять теорию и выполнять практические задания. Найти их можно в открытом банке заданий на сайте Федерального института педагогических измерений.
• Полезными будут и записи вебинаров по разбору заданий ЕГЭ на сайте РЦОИ города Москвы.
• Другой вид подготовки — диагностика в формате ЕГЭ. Проверить свои знания и потренироваться в заполнении экзаменационных бланков школьники могут в Центре независимой диагностики Московского центра качества образования. Записаться на них можно в разделе Центра на сайте МЦКО.
• Кроме того, в Библиотеке «Московской электронной школы» есть виртуальная лаборатория по химии, в которой учащиеся могут проводить безопасные научные опыты с помощью компьютера или планшета, а затем использовать полученные знания на практике. Также выпускники могут проходить неограниченное количество раз самодиагностику.





