Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат ровно один неспаренный электрон.
Объяснение понятно.
изменить
Друзья! Я, конечно, уверен, что вы сможете вычислить относительную молекулярную массу любого соединения и без помощи данного калькулятора. Для этого нужно лишь иметь под рукой таблицу Менделеева.
Напомню, что в данной таблице рядом с символом элемента и его порядковым номером всегда указывается относительная атомная масса (Ar). Например, атомная масса углерода приближенно равна 12, Ar(O) = 16, Ar(Pb) = 207. Внимание: атомная масса хлора округляется до 35,5!
Из атомов складываются молекулы, а из относительных атомных масс — относительные молекулярные массы (Mr).
Пример 1. Молекула H2S состоит из 3 атомов: двух атомов водорода и одного атома серы. Отн. молек. масса сероводорода = 2Ar(H) + Ar(S) = 2 + 32 = 34.
Пример 2. Молекула H3PO4 состоит из 8 атомов: трех атомов водорода, одного атома фосфора и четырех атомов кислорода. Mr(H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 + 31 + 64 = 98.
Вот, собственно, и вся «наука»! Осталось лишь напомнить, что молярная масса вещества (в г/моль) ЧИСЛЕННО равна его относительной молекулярной массе. Например, в задаче 2 мы вычислили Mr фосфорной кислоты (98). Молярная масса этого вещества = 98 г/моль. M(Cl2) = 71 г/моль, M(NO2) = 46 г/моль и т. д.
Если вы решаете задачу, в которой необходимо вычислять молярные массы многих соединений, да еще каждое из них состоит из большого числа атомов, «ручной» расчет Мr становится утомительным. Вот здесь и можно воспользоваться данным калькулятором. Все элементарно: в левой колонке выбираем символ соответствующего элемента, в правой — количество атомов данного элемента в молекуле.
Например, если вам нужно вычислить Mr(HClO4), в первой строке выберите Н и 1, во второй — Cl и 1, в третьей — O и 4. Остальные строки оставьте без изменений. Нажимаем кнопку «Вычислить» и получаем результат — 100,5. Это и есть относительная молекулярная масса хлорной кислоты.
Закономерности изменения химических свойств элементов и их соединений по периодам и группам.
1. В ряду Na –>Mg –>Al –>Si
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
2. У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) атомный радиус
2) заряд ядра атома
3) число валентных электронов в атомах
4) электроотрицательность
3. В ряду элементов азот – кислород – фтор возрастает
1) валентность по водороду
2) число энергетических уровней
3) число внешних электронов
4) число неспаренных электронов
4. В ряду химических элементов бор – углерод – азот возрастает
1) способность атома отдавать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
5. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
6. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N 2 O 5 –> P 2 O 5 –> As 2 O 5 –> Sb 2 O 5
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
7. В порядке возрастания неметаллических свойств элементы расположены в ряду:
8. В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
9. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
10. Какой элемент образует газообразное водородное соединен соответствующее общей формуле RH 2 ?
1) бор 2) калий 3) сера 4) хром
11. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
12. В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО 4 ?
1) IV 2) V 3) VI 4) VII
13. В ряду оксидов SiO 2 — Р 2 О 5 — SO 2 – Cl 2 O 7 кислотные свойства
1) возрастают
2) убывают
3) не изменяются
4) сначала уменьшаются, потом увеличиваются
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
15. По периоду слева направо уменьшается(-ются)
1) атомный радиус элементов
2) число валентных электронов в атомах
4) кислотные свойства гидроксидов
16. В порядке увеличения электроотрицательности химические элементы расположены в раду:
1) С, N, О 2) Si.Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
17. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
18. Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
19. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
3) О, S, Se, Те
20. Среди элементов третьего периода наименьший атомный радиус имеет
2) алюминий
21. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
22. По периоду слева направо уменьшается
1) число валентных электронов в атомах
2) атомный радиус элементов
3) электроотрицательность элементов
4) кислотность гидроксидов элементов
23. Наиболее сильное основание образует
1) цезий 2) натрий 3} литий 4) цинк
24. Оксид с наиболее выраженными кислотными свойствами образует
1) кремний 2) фосфор 3) сера 4) хлор
25. Наиболее сильное основание образует
1) магний 2) стронций 3) барий 4) кадмий
26. Кислотный характер наиболее выражен у высшего оксида, образованного элементом:
1) Sn 2) А1 3) С 4} S
27. Кислотный характер наиболее выражен у высшего оксида, образованного
1) бериллием 2) бором 3) фосфором 4) кремнием
28. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
29. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
30. Кислотные свойства оксидов в ряду SiO 2 –> P 2 O 5 –>SО 3
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
31. Газообразные водородные соединения состава ЭН 3 образуют
1) Be, Ca, Sr 2) P, As, Sb 3) Ga, Al, B 4) Te, S, Sc
32. В ряду элементов
Cl ® S ® P ® Si
1) уменьшается число электронных слоев в атомах
2) увеличивается число внешних электронов в а томах
3) возрастают радиус атомов
4) усиливаются неметаллические свойства
33. Неметаллические свойства наиболее выражены у
1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом
1) олова 2} кремния 3) свинца 4} углерода
35. В ряду химических элементов
Na –>Mg –> Al –> Si
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев а атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
36.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
37.Электронную конфигурацию 1s 2 2s 2 2р 6 3.s 2 Зр 6 3d 1 имеет ион
1) Са 2+ 2) А1 3+ 3) K + 4) Sc 2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
| 1) | 1s 2 2s 2 2p 1 |
| 2) | 1s 2 2s 2 2p 6 3s 1 |
| 3) | 1s 2 2s 2 |
| 4) | 1s 2 2s 2 2p 6 3s 2 3p 1 |
Ответы 1-4, 2-4, 3-3, 4-2, 5-1, 6-1, 7-4, 8-1, 9-2, 10-3, 11-2, 12-4, 13-1, 14-1, 15-1, 16-1, 17-3, 18-3, 19-3, 20-4, 21-2, 22-2, 23-1, 24-4, 25-3, 26-4, 27-3, 28-1, 29-2, 30-2, 31-2, 32-3, 33-2, 34-3, 35-1, 36-3, 37-4, 38-2.
А2. Периодический закон.
1. В ряду Na
Mg
Al
Si
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
2. У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) атомный радиус 2) заряд ядра атома 3) число валентных электронов в атомах
4) электроотрицательность
3. В ряду элементов азот — кислород — фтор возрастает
1) валентность по водороду 2) число энергетических уровней
3) число внешних электронов 4) число неспаренных электронов
4. В ряду химических элементов бор — углерод — азот возрастает
1) способность атома отдавать электроны 2) высшая степень окисления
3) низшая степень окисления 4) радиус атома
5. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
6. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N
2
O
5
P
2
O
5
As
2
O
5
Sb
2
O
5
7. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) O,N,C,B
2) Cl,S,P,Si
3) C,Si,Ge,Sn
4) B,C,O,F
8. В порядке усиления металлических свойств элементы расположены в ряду:
1)
А1,
Са,
К2) Ca.Ga.Fe
3) K,Al,Mg
4) Li,Be,Mg
9. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1
2) O,S,Se,Te
3) At,I,Br,Cl
4) Mg,Al,Si, P
10. Какой элемент образует газообразное водородное соединен соответствующее общей формуле RH
2
?
1) бор 2) калий 3) сера 4) хром
11. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
12. В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО 4
?
1) IV
2) V
3) VI
4) VII
13. В ряду оксидов SiO
2
— Р 2
О 5
— SO
2
— Cl
2
O
7
кислотные свойства
1) возрастают 2) убывают 3) не изменяются 4) сначала уменьшаются, потом увеличиваются
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) Mg, Ca,
Ва 2) Na, Mg, A1 3) K,Ca,Fe 4) Sc, Ca, Mg
15. По периоду слева направо уменьшается(-ются)
1) атомный радиус элементов 2) число валентных электронов в атомах
3) электроотрицательность элементов 4) кислотные свойства гидроксидов
16. В порядке увеличения электроотрицательности химические элементы расположены в раду:
1) С, N
, О 2) Si
.Al
.Mg
3) Mg
,Ca
, Ва 4) Р, S
, Si
17. Химический элемент расположен в IV
периоде, IA
группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2,8, 18,2
18. Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
19. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Rb,K,Na,Li 2) Na,Mg,Al, S 3)
О, S, Se,
Те 4) C,N,
О, F
20. Среди элементов третьего периода наименьший атомный радиус имеет
1) натрий 2) алюминий 3) фосфор 4) сера
21. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов 2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов 4) увеличением числа валентных электронов
22. По периоду слева направо уменьшается
1) число валентных электронов в атомах 2) атомный радиус элементов
3) электроотрицательность элементов 4) кислотность гидроксидов элементов
23. Наиболее сильное основание образует
1) цезий 2) натрий 3} литий 4) цинк
24. Оксид с наиболее выраженными кислотными свойствами образует
1) кремний 2) фосфор 3) сера 4) хлор
25. Наиболее сильное основание образует
1) магний 2) стронций 3) барий 4) кадмий
26. Кислотный характер наиболее выражен у высшего оксида, образованного элементом:
1) Sn
2) А1 3) С 4} S
27. Кислотный характер наиболее выражен у высшего оксида, образованного
1) бериллием 2) бором 3) фосфором 4) кремнием
28. Сила бескислородных кислот неметаллов VII
А группы соответственно возрастанию заряда ядра атомов элементов
1) увеличивается 2) уменьшается 3) не изменяется 4) изменяется периодически
29. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1) хлор 2) германий 3) мышьяк 4) селен
30. Кислотные свойства оксидов в ряду SiO
2
P
2
O
5
S
О 3
1) ослабевают 2) усиливаются 3) не изменяются 4) изменяются периодически
31. Газообразные водородные соединения состава ЭН 3
образуют
1) Be, Ca, Sr 2) P, As, Sb 3) Ga, Al, B 4) Te, S, Sc
32. В ряду элементов Cl
S
P
Si
1) уменьшается число электронных слоев в атомах 2) увеличивается число внешних электронов в а томах
3) возрастают радиус атомов 4) усиливаются неметаллические свойства
33. Неметаллические свойства наиболее выражены у
1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом
1) олова2} кремния3) свинца4} углерода
35. В ряду химических элементов Na
Mg
Al
Si
1) увеличивается число валентных электронов в атомах 2) уменьшается число электронных слоев а атомах 3) уменьшается число протонов в ядрах атомов 4)
увеличиваются радиусы атомов
36.Наибольший радиус имеет атом
1) брома2) мышьяка3) бария4) олова
37.Электронную конфигурацию 1s
2
2s
2
2р 6
3.s
2
Зр 6
3d
1
имеет ион
1) Са 2+
2) А1 3+
3) K
+
4) Sc
2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1
s
2
2
s
2
2
p
1
2) 1
s
2
2
s
2
2
p
6
3
s
1
3) 1
s
2
2
s
2
4) 1
s
2
2
s
2
2
p
6
3
s
2
3
p
1
А2. Периодический закон.
Закономерности изменения химических свойств элементов и их соединений по периодам и группам.
Ответы 1-4, 2-4, 3-3, 4-2, 5-1, 6-1, 7-4, 8-1, 9-2, 10-3, 11-2, 12-4, 13-1, 14-1, 15-1, 16-1, 17-3, 18-3, 19-3, 20-4, 21-2, 22-2, 23-1, 24-4, 25-3, 26-4, 27-3, 28-1, 29-2, 30-2, 31-2, 32-3, 33-2, 34-3, 35-1, 36-3, 37-4, 38-2.
ГОТОВИМСЯ К ЕГЭ по ХИМИИ http://maratakm.
АХМЕТОВ М. А. УРОК 3. ОТВЕТЫ НА ЗАДАНИЯ.
Выбрать другой урок
Периодический закон и периодическая система химических элементов. Радиусы атомов, их периодические изменения в системе химических элементов. Закономерности изменения химических свойств элементов и их соединений по периодам и группам.
1. Расставьте следующие химические элементы N, Al, Si, C в порядке увеличения их атомных радиусов.
ОТВЕТ:
N
и
C
расположены в одном периоде. Правее расположен
N
. Значит азот меньше, чем углерод.
С и
Si
расположены в одной группе. Но выше С. Значит С меньше чем
Si
.
Si
и
Al
расположены в одном третьем периоде, но правее находится
Si
, значит
Si
меньше чем
Al
Порядок увеличения размеров атомов будет таким:
N
,
C
,
Si
,
Al
2. Какой из химических элементов фосфор или кислород проявляет более выраженные неметаллические свойства? Почему?
ОТВЕТ:
Более выраженные неметаллические свойства проявляет кислород, так как он расположен в периодической системе элементов выше и правее.
3. Как изменяются свойства гидроксидов IV группы главной подгруппы при движении сверху вниз?
ОТВЕТ:
Свойства гидроксидов изменяются от кислотных к основным. Так
H
2
CO
3
– угольная кислота, как следует из ее названия, проявляет кислотные свойства, а
Pb
(OH
)2 – основание.
ОТВЕТЫ НА ТЕСТЫ
А1. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
|
увеличивается |
|
|
уменьшается |
|
|
не изменяется |
|
|
изменяется периодически |
ОТВЕТ: 1
Речь идет о кислотах
HF
,
HCl
,
HBr
,
HI
. В ряду
F
,
Cl
,
Br
,
I
происходит увеличение размеров атомов. Следовательно, увеличивается межъядерное расстояние
H
–
F
,
H
–
Cl
,
H
–
Br
,
H
–
I
. А раз так, значит, энергия связи ослабевает. И протон легче отщепляется в водных растворах
А2. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
ОТВЕТ: 2
Конечно, речь идет об элементе 4 группы (см. период. с-му элементов)
А3. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
ОТВЕТ: 1
Металлические свойства в группе элементов, как известно, увеличиваются сверху вниз.
А4. B ряду Na ® Mg ® Al ®Si
|
увеличивается число энергетических уровней в атомах |
|
|
усиливаются металлические свойства элементов |
|
|
уменьшается высшая степень окисления элементов |
|
|
ослабевают металлические свойства элементов |
ОТВЕТ: 4
В периоде слева-направо неметаллические свойства усиливаются, а металлические ослабевают.
А5. У элементов подгруппы углерода с увеличением атомного номера уменьшается
ОТВЕТ: 4.
Электроотрицательность – это способность смещать к себе электроны при образовании химической связи. Электроотрицательность практически напрямую связана с неметаллическими свойствами. Уменьшаются неметаллические свойства, уменьшается и электроотрицательность
А6. В ряду элементов: азот – кислород – фтор
возрастает
ОТВЕТ: 3
Число внешних электронов равно номеру группы
А7. В ряду химических элементов:
бор – углерод – азот
возрастает
ОТВЕТ:
2
Число электронов во внешнем слое равно высшей степени окисления за исключением (F
,
O
)
А8. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
ОТВЕТ: 1
Углерод расположен в той же группе, что и кремний, только выше.
А9. Химические элементы расположены в порядке возрастания их атомного радиуса в ряду:
ОТВЕТ: 2
В группах химических элементов атомный радиус увеличивается сверху вниз
А10. Наиболее выражены металлические свойства у атома:
1) лития 2) натрия
3) калия 4) кальция
ОТВЕТ: 3
Среди указанных элементов ниже и левее расположен калий
А11. Наиболее выражены кислотные свойства:
Ответ: 4 (см. ответ на А1)
А12. Кислотные свойства оксидов в ряду SiO2 ® P2O5 ®SО3
1) ослабевают
2) усиливаются
Получить полный текст
3) не изменяются
4) изменяются периодически
ОТВЕТ: 2
Кислотные свойства оксидов, как и неметаллические свойства, в периодах усиливаются слева-направо
А13. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 ® P2O5 ®As2O5 ® Sb2O5
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
ОТВЕТ: 1
В группах сверху вниз кислотные свойства, как и неметаллические, ослабевают
А14. Кислотные свойства водородных соединений элементов VIA группы с увеличением порядкового номера
1) усиливаются
2) ослабевают
3) остаются неизменными
4) изменяются периодически
ОТВЕТ: 3
Кислотные свойства водородных соединений связаны с энергией связи
H
—
El
. Эта энергия сверху-вниз ослабевает, значит, кислотные свойства усиливаются.
А15. Способность отдавать электроны в ряду Na ® К ® Rb ®Cs
1) ослабевает
2) усиливается
3) не изменяется
4) изменяется периодически
ОТВЕТ: 2
В этом ряду увеличивается число электронных слоев и отдаленность электронов от ядра, следовательно, повышается способность отдавать внешний электрон
А16. В ряду Al ®Si ®P ®S
1) увеличивается число электронных слоев в атомах
2) усиливаются неметаллические свойства
3) уменьшается число протонов в ядрах атомов
4) возрастают радиусы атомов
ОТВЕТ: 2
В периоде с возрастанием заряда ядра неметаллические свойства усиливаются
А17. B главных подгруппах периодической системы восстановительная способность атомов химических элементов растет c
ОТВЕТ: 1
С возрастанием числа электронных уровней усиливается отдаленность и экранированность внешних электронов от ядра. Следовательно, возрастает способность к их отдача (восстановительные свойства)
А18. Согласно современным представлениям свойства химических элементов находятся в периодической зависимости от
ОТВЕТ: 3
А19. Атомы химических элементов, имеющие одинаковое число валентных электронов расположены
|
по диагонали |
|
|
в одной группе |
|
|
в одной подгруппе |
|
|
в одном периоде |
ОТВЕТ: 2
А20. Элемент с порядковым номером 114 должен обладать свойствами, сходными с
ОТВЕТ: 3. Этот элемент будет находиться
в клетке, соответствующей той, что занимает свинец в
VI
группе
А21. B периодах восстановительные свойства химических элементов справа-налево
|
увеличиваются |
|
|
уменьшаются |
|
|
не изменяются |
|
|
изменяются периодически |
ОТВЕТ: 1
Уменьшается заряд ядра.
А22. Электроотрицательность и энергия ионизации в ряду О–S–Se–Te, соответственно
|
возрастает, возрастает |
|
|
возрастает, уменьшается |
|
|
уменьшается, уменьшается |
|
|
уменьшается, возрастает |
ОТВЕТ: 3
Электроотрицательность уменьшается с увеличением числа заполненных электронных слоев. Энергия ионизации – это энергия, которая требуется для удаления электрона из атома. Она тоже уменьшается
А23. В каком ряду знаки химических элементов расположены в порядке увеличения атомных радиусов?
1) Установим состав исходного раствора:
(m{left(р-раright)}_{исх};=;493;cdot;1{,}15;=;567;г)
(m{left(HNO_3right)}_{исх;}=;567;cdot;0{,}25;=;141{,}75;г)
(nu{left(HNO_3right)}_{исх};=;frac{141,75}{63}=2{,}25;моль)
В раствор перенесли
(nu{(Al)}_{общ};=;frac{21{,}6}{27}=0{,}8;моль)
2) При внесении алюминия в раствор очень разбавленной (массовая доля меньше 30%) азотной кислоты, протекает реакция:
(overset{0,6}{underset8{8Al}};+;overset{2,25}{underset{30}{30HNO_3;}}rightarrow;overset{0,6}{underset8{8Al{left(NO_3right)}_3}};+;overset{0,225}{underset3{3NH_4NO_3}};+;9H_2O) (I)
В соответствии со стехиометрическими коэффициентами
(nu{left(HNO_3right)}_{коэфф};:;nu{left(Alright)}_{коэфф};=;30;:;8;=;3{,}75;:;1)
В условиях данной задачи
(nu{left(HNO_3right)}_{усл};:;nu{left(Alright)}_{усл}=;2{,}25;:;0{,}8;=;2{,}8;:;1)
Азотной кислоты недостаточно для растворения всего алюминия, следовательно, HNO3 в недостатке и расчет следует проводить по количеству азотной кислоты.
Из стехиометрических коэффициентов следует, что
(nu_I{left(Alright)}_{прореаг};=;nu_I{left(Al{left(NO_3right)}_3right)}_{обр};=;frac8{30};nu_I(HNO_3);=;0{,}6;моль)
(nu_I{left(NH4NO_3right)}_{обр};=;frac3{30}nu Ileft(HNO_3right);=;0{,}225;моль)
В сосуде после реакции содержится:
(nu_I{(Al)}_{ост};=;0{,}2;моль)
(nu_I{left(Al{left(NO_3right)}_3right)}_{обр};=;0{,}6;моль)
(nu_I{left(NH_4NO_3right)}_{обр};=;0{,}225;моль)
2) В этот же реакционный сосуд добавили
(nu{left(NaOHright)}_{общ};=;с;cdot;V;=;0{,}2;cdot;15;=;3;моль)
Масса добавленного раствора
(m(р-ра;NaOH);=;200;cdot;1{,}44;=;288;г)
При этом протекают реакции:
(overset{0,6}{underset I{Al{left(NO_3right)}_3}};+:overset{2,4}{underset4{4NaOH}};rightarrow;3NaNO_3;+;Nalbrack Al{left(OHright)}_4rbrack) (II)
(nu_{II}(NaOH);=;4nu(Al{left(NO_3right)}_3);=;2{,}4;моль)
(overset{0,225}{underset I{NH_4NO_3}};:+;overset{0,225}{underset I{NaOH}};rightarrow;NaNO_3;+;overset{0,225}{underset I{NH_3}}uparrow+;H_2O) (III)
(nu_{III}(NaOH);=;nu(NH_3);=;nu(NH_4NO_3);=;0{,}225;моль)
(m(NH_3);=;3{,}825;г)
(overset{0,2}{underset2{2Al}};+overset{0,2}{underset2{;2NaOH}};+;6H_2O;rightarrow;2Naleft[Al{left(OHright)}_4right];+;overset{0,3}{underset3{3H_2}}uparrow) (IV)
(nu_{IV}(NaOH);=;nu(Al);=;0{,}2;моль)
(nu_{IV}(H_2);=;1,5nu(Al);=;0{,}3;моль)
(m(H_2);=;0{,}6;г)
Общее количество израсходованного гидроксида натрия равно
(nu_{II(}NaOH);+;nu_{III}(NaOH);+;nu_{IV}(NaOH);=;2{,}4;+;0{,}225;+;0{,}2;=;2{,}825;моль)
В растворе осталось
(nu{(NaOH)}_{ост};=;3;–;2{,}825;=;0{,}175;моль)
(m{(NaOH)}_{ост};=;40;cdot;0{,}175;=;7;г)
3) Тогда масса полученного раствора
(m_{р-ра;получ.};=;m_{р-ра;исх};+;m_{Al;}+;m_{р-ра;NaOH};–;;m(NH_3);–;m(H_2))
(m_{р-ра;получ.;}=;141{,}75;+;21{,}6;+;288;–;0{,}6;–;3{,}825;=;446{,}925;approx;446{,}9;г)
4) Массовая доля щелочи в полученном растворе
(omegaleft(NaOHright)=frac{{mleft(NaOHright)}_{ост}}{mleft(р-ра;получ.right)};cdot;100%)
(omegaleft(NaOHright);=;frac7{446{,}9};cdot;100%;approx;1{,}6%)
Ответ: (omegaleft(NaОНright);=;1{,}6%.)
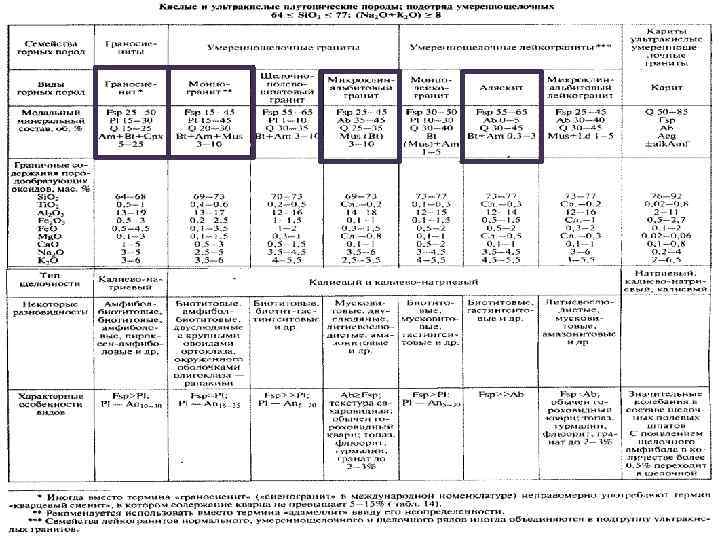
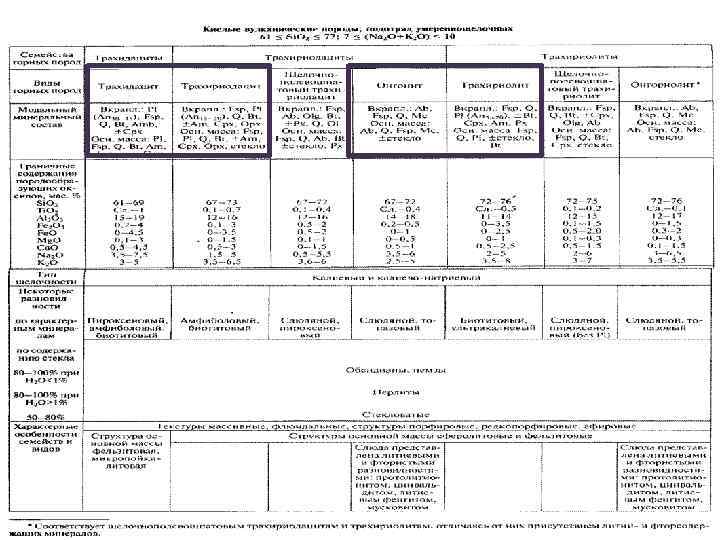
Кислые породы повышенной щелочности и щелочные
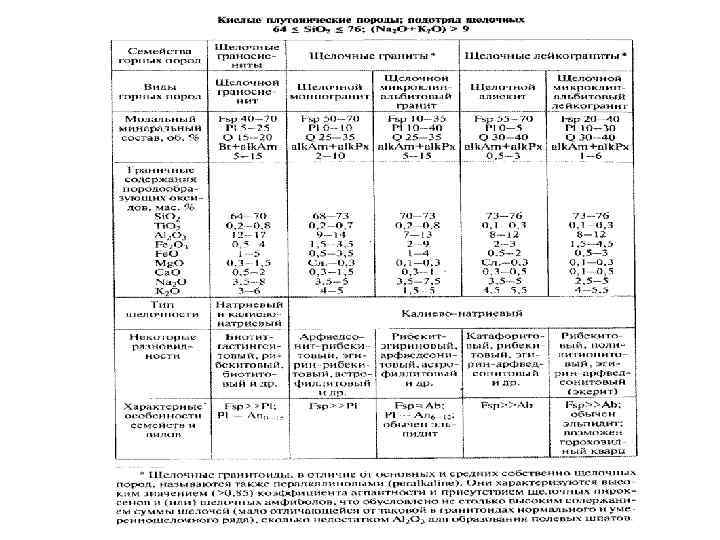
Кислые породы умеренно-щелочного ряда Петрохимическая характеристика более высокие содержание щелочей, по отношению к породам нормального ряда. Во многих случаях это единственное отличие от пород нормального ряда. Плутонические породы: 3 семейства: граносиенитов, умеренно-щелочных гранитов, умеренно-щелочных лейкогранитов Вулканические породы: 3 семейства: трахидацитов, трахириолитов,
Субщелочной двуполевошпатовый гранит Структура, текстура – серые, розовые, красные, желтые, граниты от мелко до крупнозернистой структуры. Текстуры разнообразны: массивная, овоидная, трахитоидная, гнейсовидная. Минеральный состав: Главные: К-Na. Fsp (микроклин, реже ортоклаз), Pl зональный от андезина в центре до олигоклаза на периферии, Qtz, Bt >Mus, Hbl (обыкновенная), Второстепенные: Fa. Акцессорные: Ap, Zrn. Вторичные: Clt, Mgt, Cal. Разновидности: принято выделят три группы: 1) с близкими содержаниями Pl и Kfsp 2) существенно калиево натриевополевошпатовые, в т. ч. рапакиви 3) существенно плагиоклазовые Между ними не наблюдаются постепенных переходов, относятся к различным формациям, сопровождаются своим типом рудопроявлений и кристаллизуются при различных физико химических условиях. Структура: гипидиоморфнозернистая (в существенно плагиоклазовых разновидностях начинается с Pl, заканчивается Qtz и Kfsp; в рапакиви начинается с Kfsp и заканчивается Pl и Qtz), порфировидная, пойкилитовая, маргинационная =рапакиви.
Семейство трахидацитов Трахидацит — порода промежуточная между трахитом и дацитом. Текстура – массивная, флюидальная. Шероховатый излом из за тончайших пор. Структура – порфировая. Вкрапленники: Kfsp, Pl (ядра An 28 30, периферия An 18 20), Bt (аннит), Hbl, Cpx (Aug), Opx (Hyp), Ol (Fa), акцессории: Mag, Ap, Zrn, Ttn, ортит. Qtz во вкрапленниках не характерен. Одно из отличий от дацита – преобладанием вкрапленников Kfsp (анортоклаз, санидин). Основная масса пилотакситовая, трахитовая, реже микролитовая, ортофировая (напоминает фельзитовую, но мало Qtz). Форма залегания – экструзивные купола. С субвулканическими порфировыми разностями этих пород связаны Cu Mo месторождения (Клаймакс, Сора, Эрденет)
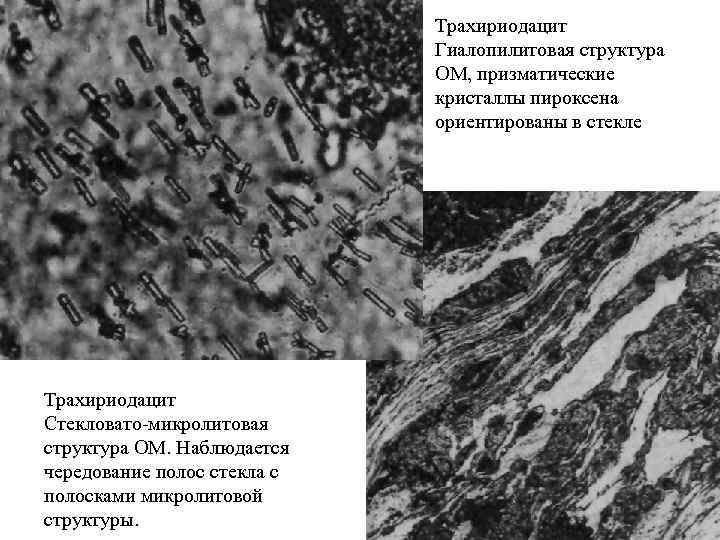
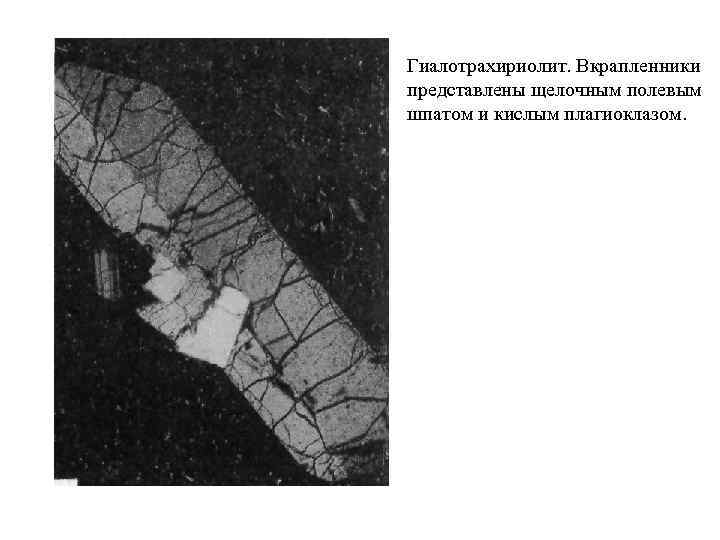
Семейство трахириодацитов Типоморфные минералы симейства: Qtz, K-Na. Fsp, Pl (An 0 -40), : Bt или Li слюды, Hbl. 3 вида: Трахириодацит, щелочнополевошпатовый трахириодацит, онгонит Трахириодацит — порфировая порода с голубоватым оттенком и флюидальностью. Вкрапленники: Kfsp, Pl, Qtz, Bt, Hbl (обыкновенная, базальтическая редко) , Opx (Hyp, реже до эвлита), Cpx (Aug) – распространен реже Opx, Ol (Fa). Отличается от трахидацита присутствием кварца во вкрапленниках, а от риодацита 1) преобладанием вкрапленников Kfsp (анортоклаз, санидин), 2) Pl более кислый An 18 25. Основная масса фельзитовая, сферолитовая, микролитовая и трахитоидная.
Трахириодацит Гиалопилитовая структура ОМ, призматические кристаллы пироксена ориентированы в стекле Трахириодацит Стекловато микролитовая структура ОМ. Наблюдается чередование полос стекла с полосками микролитовой структуры.
Гиалотрахириолит. Вкрапленники представлены щелочным полевым шпатом и кислым плагиоклазом.
Щелочнополевошпатовый трахириодацит Структура, текстура – зеленовато серые массивные или полосчатые порфировые породы. Полосчатость обусловлена чередованием участков различной зернистости или с разным содержанием стекла. Вкрапленники: KFsp, в меньшей степени Opx, Fa – встречается чаще чем в др. умеренно щелочных породах, Qtz редок. Pl не характерен. ОМ – микрозернистая, микросферолитовая, фельзитовая, стекловатая. Состоит из щелочного полевого шпата и одной или нескольких модификаций Si. O 2: кварца, тридимита и кристобалита. Порода встречается редко.
Онгонит Типоморфные минералы онгонитов и онгориолитов: K Na. Fsp, Ab, Qtz. Является вуканическим аналогом литий фтористых гранитов, но имеет свои особенности, обусловленные вулканическим происхождением. Синонимы: богатые фтором риолиты, топазовые риолиты, эльваны. Название дано по W месторождению Онгон Хайерхан, Монголия, где была впервые обнаружена. Структура, текстура – белые, светло серые, светло голубые или светло кремовые массивные породы. Чаще порфировые, реже афировые. Флюидальность распространена участками. Вкрапленники – Ab, К Na. Fsp (часто пертитовый микроклин – амазонит, редко – санидин), каймы нарастания на Ab, Qtz, часто гломеры, слюды – литиевые и фтористые ряда фенгит мусковит цинвальдит протолитионит, топаз. Основная масса – афанитовая, стекловатая, микрокристаллическая состоит из Ab, К Na. Fsp, Qtz, слюд, топаза. Акцессории: Fl, Grt, Zrn, Mnz, Ilm, колумбит танталит, касситерит, пирит. Онгониты принципиальны для доказательства существования в природе гранитоидных магм богатых фтором.
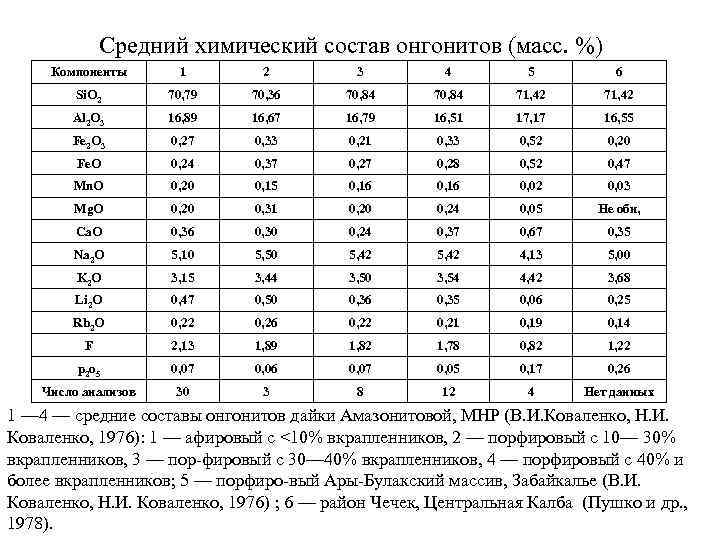
Средний химический состав онгонитов (масс. %) Компоненты 1 2 3 4 5 6 Si. O 2 70, 79 70, 36 70, 84 71, 42 Аl 2 О 3 16, 89 16, 67 16, 79 16, 51 17, 17 16, 55 Fe 2 O 3 0, 27 0, 33 0, 21 0, 33 0, 52 0, 20 Fe. O 0, 24 0, 37 0, 28 0, 52 0, 47 Mn. O 0, 20 0, 15 0, 16 0, 02 0, 03 Mg. O 0, 20 0, 31 0, 20 0, 24 0, 05 He обн, Ca. O 0, 36 0, 30 0, 24 0, 37 0, 67 0, 35 Na 2 O 5, 10 5, 50 5, 42 4, 13 5, 00 K 2 O 3, 15 3, 44 3, 50 3, 54 4, 42 3, 68 Li 2 O 0, 47 0, 50 0, 36 0, 35 0, 06 0, 25 Rb 2 O 0, 22 0, 26 0, 22 0, 21 0, 19 0, 14 F 2, 13 1, 89 1, 82 1, 78 0, 82 1, 22 p 2 o 5 0, 07 0, 06 0, 07 0, 05 0, 17 0, 26 Число анализов 30 3 8 12 4 Нет данных 1 — 4 — средние составы онгонитов дайки Амазонитовой, МНР (В. И. Коваленко, Н. И. Коваленко, 1976): 1 — афировый с
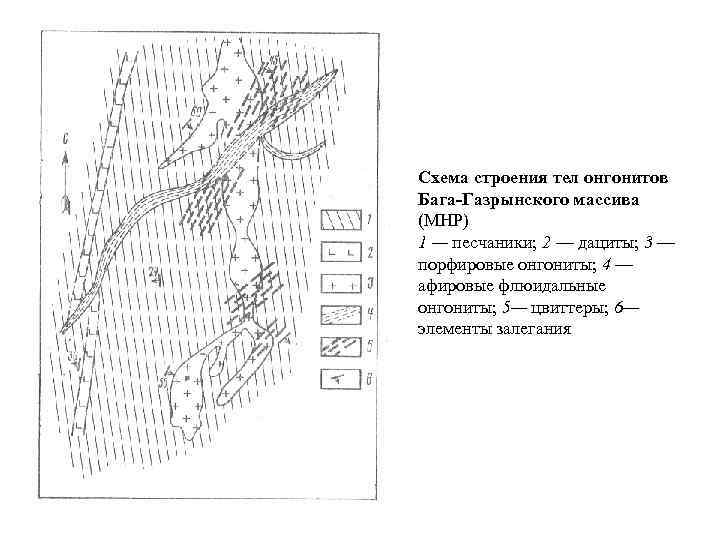
Схема строения тел онгонитов Бага-Газрынского массива (МНР) 1 — песчаники; 2 — дациты; 3 — порфировые онгониты; 4 — афировые флюидальные онгониты; 5— цвиттеры; 6— элементы залегания
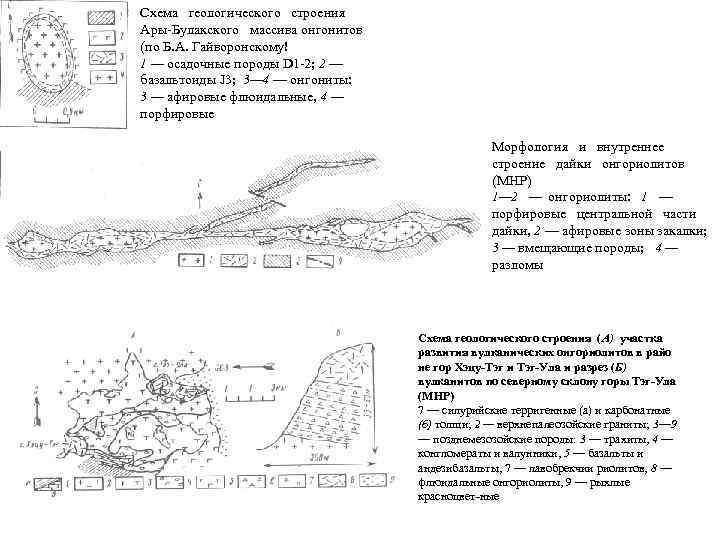
Схема геологического строения Ары Булакского массива онгонитов (по Б. А. Гайворонскому! 1 — осадочные породы D 1 2; 2 — базальтоиды J 3; 3— 4 — онгониты: 3 — афировые флюидальные, 4 — порфировые Морфология и внутреннее строение дайки онгориолитов (МНР) 1— 2 — онгориолиты: 1 — порфировые центральной части дайки, 2 — афировые зоны закалки; 3 — вмещающие породы; 4 — разломы Схема геологического строения (А) участка развития вулканических онгориолитов в райо не гор Хэцу-Тэг и Тэг-Ула и разрез (Б) вулканитов по северному склону горы Тэг-Ула (МНР) 7 — силурийские терригенные (а) и карбонатные (б) толщи; 2 — верхнепалеозойские граниты; 3— 9 — позднемезозойские породы: 3 — трахиты, 4 — конгломераты и валунники, 5 — базальты и андезибазальты, 7 — лавобрекчии риолитов, 8 — флюидальные онгориолиты, 9 — рыхлые красноцвет ные
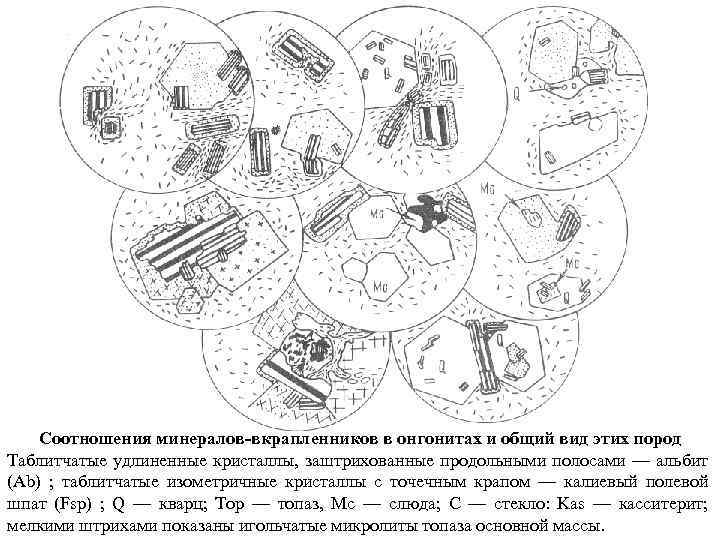
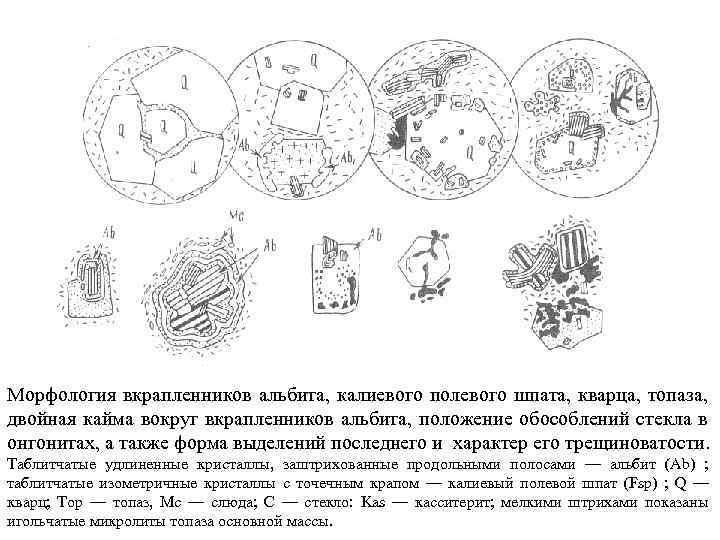
Соотношения минералов-вкрапленников в онгонитах и общий вид этих пород Таблитчатые удлиненные кристаллы, заштрихованные продольными полосами — альбит (Аb) ; таблитчатые изометричные кристаллы с точечным крапом — калиевый полевой шпат (Fsp) ; Q — кварц; Тор — топаз, Мс — слюда; С — стекло: Kas — касситерит; мелкими штрихами показаны игольчатые микролиты топаза основной массы.
Морфология вкрапленников альбита, калиевого полевого шпата, кварца, топаза, двойная кайма вокруг вкрапленников альбита, положение обособлений стекла в онгонитах, а также форма выделений последнего и характер его трещиноватости. Таблитчатые удлиненные кристаллы, заштрихованные продольными полосами — альбит (Аb) ; таблитчатые изометричные кристаллы с точечным крапом — калиевый полевой шпат (Fsp) ; Q — кварц; Тор — топаз, Мс — слюда; С — стекло: Kas — касситерит; мелкими штрихами показаны игольчатые микролиты топаза основной массы.
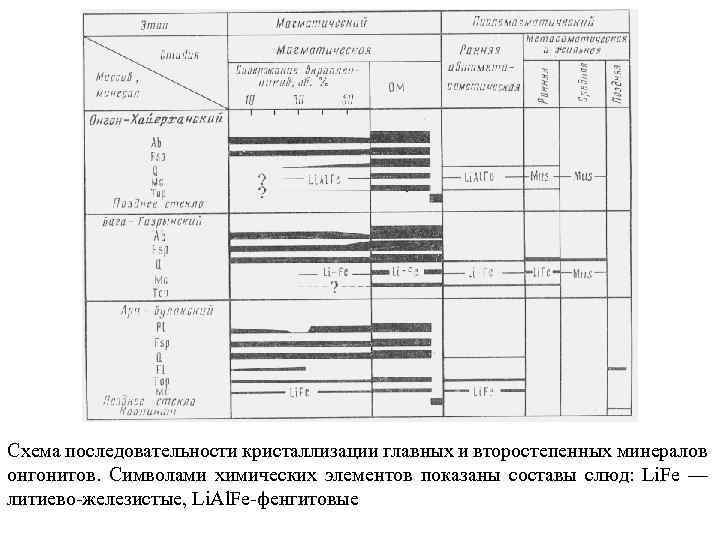
Схема последовательности кристаллизации главных и второстепенных минералов онгонитов. Символами химических элементов показаны составы слюд: Li. Fe — литиево железистые, Li. Al. Fe фенгитовые
Трахириолит Структура, текстура – серые с голубоватым оттенком или зеленовато серые афировые, порфировые или полосчатые породы. Полосчатость обусловлена чередованием участков различной зернистости или участков с разным содержанием стекла. Бывают пузыристыми. Вкрапленники – Qtz, К Na. Fsp (санидин, анортоклаз), Pl (An 0 30), Px (Hd), Ol (Fa), Mgt, Hbl, Bt. Qtz – наиболее типичный минерал. Основная масса – микрозернистая (ксеноморфный Fsp, Crs, Trd редко Qtz + лейсты Bt, Hbl), микросферолитовая (в центре сферолита кристаллик Ilm или Px, сферолиты состоят из волокон Fsp с включениями зерен Crs и Trd), гранофировая (встречается чаще чем в риолите, характерны ихтеоглипты Qtz, погруженные в Fsp) или стекловатая. Акцессории: ортит, Zrn, Ttn, Ap и др. Содержание их выше чем в риолите.
Щелочнополевошпатовый трахириолит Структура, текстура – серые с розоватым оттенком полосчатые или массивные породы. Порфировая структура. Вкрапленники – К-Na. Fsp (санидин, анортоклаз), Ol (Fa), Px (Hyp, Aug), Bt, Qtz, . Основная масса – микрозернистая (ксеноморфный Fsp, Crs, Trd редко Qtz + лейсты Bt, Hbl), микросферолитовая (в центре сферолита кристаллик Ilm или Px, сферолиты состоят из волокон Fsp с включениями зерен Crs и Trd), гранофировая (встречается чаще чем в риолите, характерны ихтеоглипты Qtz, погруженные в Fsp) или стекловатая (с содержанием стекла 100% редки).
Кислые породы щелочного ряда Зернистые породы содержат щелочные темноцветные минералы (щелочные пироксены, щелочные амфиболы, энигматит, тухуалит Na 2 Mg 2 Si 6 O 15, и щелочные полевые шпаты (KFsp и Ab), Pl редок. В стекловатых породах – коэффициент агпаитности больше 1.
Щелочной щелочнополевошпатовый гранит и щелочной аляскит Структура, текстура – серые, розовые граниты различной зернистости. Текстура массивная, реже пятнистая. Минеральный состав: Главные: К-Na. Fsp пертитовый до «шахматного» альбита, Qtz, Am (Rbk, Arf), Px (Aeg). Второстепенные: энигматит, Fa, астрофиллит, слюды. Разновидности: по темноцветному минералу. Структура: панидиоморфнозернистая, гипидиоморфнозернистая с участками пойкилитовой и пегматоидной. Часто идиоморфизм Fsp>Qtz>ТЦ. Слагают интрузивные тела различных размеров, морфологии и возраста. Известны громадные (до 10000 км 2) батолитообразные тела на Кольском п ове (кейвские граниты). Также весьма обычны мелкие дайкообразные тела мощностью в несколько см.
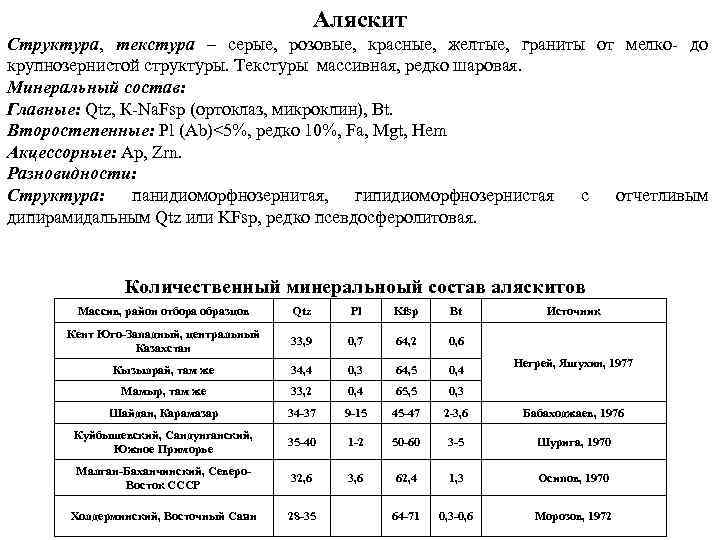
Аляскит Структура, текстура – серые, розовые, красные, желтые, граниты от мелко до крупнозернистой структуры. Текстуры массивная, редко шаровая. Минеральный состав: Главные: Qtz, К Na. Fsp (ортоклаз, микроклин), Bt. Второстепенные: Pl (Ab)
Шаровые текстуры в аляскитах. Затравкой шаров служат ксенолиты крупнозернистых гранитов главной интрузивной фазы (а) и ксенолиты ороговикоизнных песчаников (6). Центральный Казахстан, массив Кент Юго Западный
Структура аляскитов: э — Панидиоморфнозернистая. Центральный Казахстан, массив Кент Юго Западный, с анализатором, Гипидиоморфнозернистая. Центральный Казах стан, массив Кент Юго Западный, с анализатором,
а — гипидиоморфнозернистая структура субщелочных двуполевошпатовых лейкогранитов. Казахстан, массив Восточный Сарытау. б — порфировидные двуполевошпатовые лейкограниты. Восточный Казахстан, массив Акжай ляу. в — включения зональных плагиоклазов в краевой части вкрапленников калиево натриевого полевого шпата. Центральный Казахстан, массив Кызылтау. г — общий вид структуры субщелочных двуполевошпатовых лейкогранитов второй фазы. Центральный Казахстан, массив Акчатау.
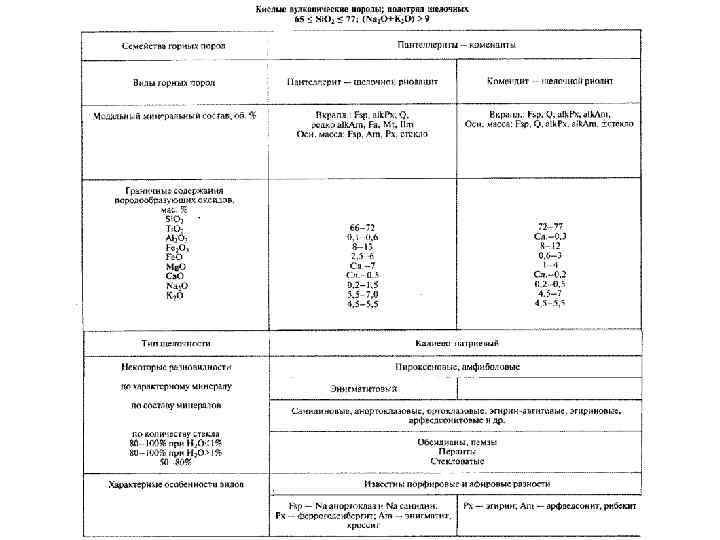
Пантеллерит и комендит Структура, текстура – зеленоватые, серые, черные, нередко с голубоватым оттенком породы, шлаковидные, иногда плотные, трахитоидные, игнимбритовые. Известны туфы и агломераты. Вкрапленники: К Na. Fsp (анортоклаз, санидин), Px (зеленый Na Hd, Aeg Aug), энигматит, Qtz, редко Fa, Am, Mgt, Ilm. Основная масса: стекловатая или раскристаллизована в различной степени, стекло светло желтое или серое с полосами флюидальности. 1. 2. 3. 4. Образование пантеллеритов и комендитов. Остаточные расплавы при фракционировании трахибазальтов. Остаточные расплавы при фракционировании кислых магм. Частичное плавление малых степеней плавления эгеринсодержащей мантии. Частичное плавление метасоматизированной мантии.
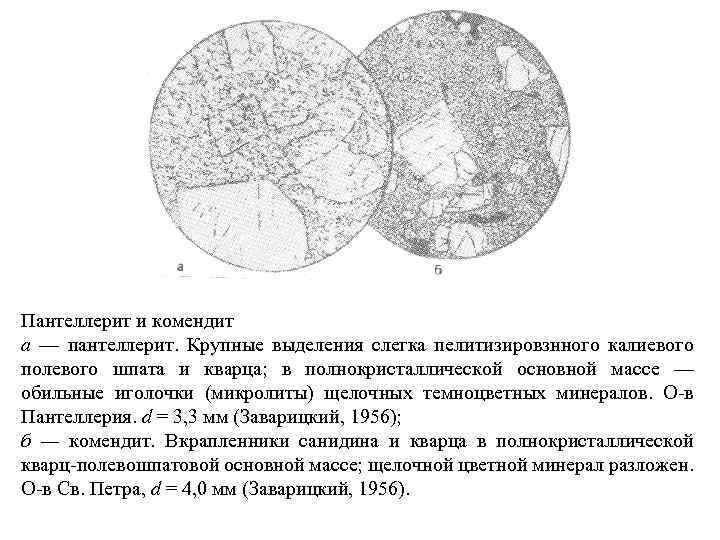
Пантеллерит и комендит а — пантеллерит. Крупные выделения слегка пелитизировзнного калиевого полевого шпата и кварца; в полнокристаллической основной массе — обильные иголочки (микролиты) щелочных темноцветных минералов. О в Пантеллерия. d = 3, 3 мм (Заварицкий, 1956); б — комендит. Вкрапленники санидина и кварца в полнокристаллической кварц полевошпатовой основной массе; щелочной цветной минерал разложен. О в Св. Петра, d = 4, 0 мм (Заварицкий, 1956).
Система подготовки к ЕГЭ по химии
(часть А)
Пояснительная записка
В связи с введением единого государственного экзамена по химии возникла необходимость формирования у учащихся прочных теоретических знаний, а так же умений и навыков, необходимых для достижения высоких результатов.
Для успешной работы по подготовке учащихся к ЕГЭ необходимо определить основные этапы и направления данной деятельности, то есть разработать специальную педагогическую систему, которая вписывается в общий учебный процесс.
Одним из этапов разработки является создание банка дидактических материалов, в частности тестовых заданий по темам плана экзаменационной работы ЕГЭ 2009 по химии. В данной работе содержатся по 4 варианта составленных мной тестов к темам заданий ЕГЭ группы А (с А1. по А30.), которые можно использовать для группового и индивидуального контроля знаний, а также для внеурочной подготовки к единому государственному экзамену.
А1. СТРОЕНИЕ АТОМА
Современные представления о строении атомов. Изотопы. Строение электронных оболочек атомов элементов первых четырех периодов. Атомные орбитали, s— и p— d— элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
Вариант 1
1. Число электронов в ионе железа Fe2+ равно
1) 54 2) 28 3) 58 4) 24
2. В основном состоянии три неспаренных электрона имеет атом
1) кремния 2) фосфора 3) серы 4) хлора
3. Элемент с электронной конфигурацией внешнего уровня … 3s23p3 образует водородное соединение состава
1) ЭН4 2) ЭН 3) ЭН3 4) ЭН2
4. Атом металла, высший оксид которого Ме2О3, имеет электронную формулу внешнего энергетического уровня
1) ns2пр1 2) ns2пр2 3) ns2np3 4) ns2nps
5. В ряду химических элементов
Na – Mg – Al – Si
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев а атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
6. Число энергетических слоев и число электронов во внешнем энергетическом слое атомов мышьяка равны соответственно
1) 4, 6 2) 2, 5 3) 3, 7 4) 4, 5
7. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1s22s22p1 2) 1s22s22p63s1 3)1s22s2 4) 1s22s22p63s23p1
Вариант 2
1. Восьмиэлектронную внешнюю оболочку имеет ион
1) Р3+ 2) S2- 3) С15+ 4) Fe2+
2. Одинаковую электронную конфигурацию внешнего уровня имеют Са2+ и
1) К+ 2) Аr 3) Ва 4) F—
3. Высший оксид состава R2O7 образует химический элемент, в атоме которого заполнение электронами энергетических уровней соответствует ряду чисел:
1) 2, 8, 1 2) 2, 8, 7 3) 2, 8, 8, 1 4) 2, 5
4. Наибольший радиус имеет атом
1) олова 2} кремния 3) свинца 4} углерода
5. Число валентных электронов у марганца равно
1) 1 2) 3 3) 5 4) 7
6. Количество электронов в атоме определяется
1) числом протонов 2) числом нейтронов
3) числом энергетических уровней 4) величиной относительной атомной массы
7. Ядро атома 81Br содержит
1)81p и 35n 2) 35p и 46n 3)46p и 81n 4) 46p и 35n
Вариант 3
1. Двухэлектронную внешнюю оболочку имеет ион
1) S6+ 2) S2- 3) Вг5+ 4) Sn4+
2. Электронная конфигурация Is22s22p6 соответствует иону
1) А13+ 2) Fe3+ 3) Zn2+ 4) Cr3+
3. Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:
1) ns2np3 2)ns2np5 3) ns2np1 4) ns2np2
4. Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
1) +4 2) -2 3) +2 4) -4
5. Химический элемент, один из изотопов которого имеет массовое число 44 и содержит в ядре 24 нейтрона, — это
1) хром 2) кальций 3) рутений 4) скандий
6.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
7. Число протонов и нейтронов, содержащихся в ядре атома изотопа 40K, равно соответственно
1) 19 и 40 2) 21 и 19 3) 20 и 40 4) 19 и 21
Вариант 4
1. Электронная конфигурация Is22s22p63s23p6 соответствует иону
1) Sn2+ 2) S2- 3) Cr3+ 4) Fe2
2. Электронная конфигурация Is22s22p63s23p6 соответствует иону
1) Сl— 2) N3- 3) Br— 4) О2-
3. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
1)4 и + 16 2)6 и + 32 3)6 и + 16 4)4 и + 32
4. Одинаковое электронное строение имеют частицы
1) Na0 и Na+ 2) Na0 и K0 3) Na+ и F— 4) Cr2+ и Сr3+
5. Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя
1) ns2np1 2) ns2np3 3) ns2np4 4) ns2np6
6. Конфигурация внешнего электронного слоя атома серы в невозбужденном состоянии
1) 4s2 2) 3s23р6 3) 4s24р4 4) 3s23р4
7. Электронную конфигурацию Is22s22p63s23p64s1 в основном состоянии имеет атом 1) лития 2) калия 3) натрия 4) кальция
Ответы
| Вариант | Задания | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| 1 | 4 | 2 | 3 | 1 | 1 | 4 | 2 |
| 2 | 2 | 1 | 2 | 3 | 4 | 1 | 2 |
| 3 | 3 | 1 | 2 | 2 | 2 | 3 | 4 |
| 4 | 2 | 1 | 3 | 3 | 3 | 4 | 2 |
А2. ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И.МЕНДЕЛЕЕВА
Периодический закон и периодическая система химических элементов Д.И. Менделеева. Радиусы атомов, их периодические изменения в системе химических элементов. Закономерности изменения химических свойств элементов и их соединений по периодам и группам.
Вариант 1
1. У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) атомный радиус 2) заряд ядра атома
3) число валентных электронов в атомах 4) электроотрицательность
2. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) B,C,O,F 2) Cl,S,P,Si 3) C,Si,Ge,Sn 4) O,N,C,B
3. В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО4?
1) IV 2) V 3) VI 4) VII
4. Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
5. Среди элементов третьего периода наименьший атомный радиус имеет
1) натрий 2) сера 3) фосфор 4) алюминий
6. Оксид с наиболее выраженными кислотными свойствами образует
1) кремний 2) фосфор 3) сера 4) хлор
7. Кислотный характер наиболее выражен у высшего оксида, образованного
1) бериллием 2) бором 3) фосфором 4) кремнием
Вариант 2
1. В ряду элементов азот — кислород — фтор возрастает
1) валентность по водороду 2) число энергетических уровней
3) число внешних электронов 4) число неспаренных электронов
2. В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
3. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
4. В ряду оксидов SiO2 — Р205 — SO2 — Cl2O7 кислотные свойства
1) возрастают 2) убывают
3) не изменяются 4) сначала уменьшаются, потом увеличиваются
5. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2,8, 18,2
6. Наиболее сильное основание образует
1) цезий 2) натрий 3} литий 4) цинк
7. Кислотный характер наиболее выражен у высшего оксида, образованного элементом:
1) Sn 2) А1 3) С 4} S
Вариант 3
1. В ряду химических элементов бор — углерод — азот возрастает
1) способность атома отдавать электроны 2) высшая степень окисления
3) низшая степень окисления 4) радиус атома
2. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1 2) O,S,Se,Te 3) At,I,Br,Cl 4) Mg,Al,Si, P
3. Какой элемент образует газообразное водородное соединен соответствующее общей формуле RH2?
1) бор 2) калий 3) сера 4) хром
4. В порядке увеличения электроотрицательности химические элементы расположены в раду:
1) С, N, О 2) Si.Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
5. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
6. Наиболее сильное основание образует
1) магний 2) стронций 3) барий 4) кадмий
7. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
1) увеличивается 2) уменьшается
3) не изменяется 4) изменяется периодически
Вариант 4
1. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
2. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 – P2O5 – As2O5 – Sb2O5
1) ослабевают 2) усиливаются
3) не изменяются 4) изменяются периодически
3. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) Sc, Ca, Mg 2) Na, Mg, A1 3) K,Ca,Fe 4) Mg, Ca, Ва
4. В периоде слева направо уменьшается
1) атомный радиус элементов
2) число валентных электронов в атомах
3) электроотрицательность элементов
4) кислотные свойства гидроксидов
5. В порядке возрастания атомного радиуса расположены элементы в ряду
1) Rb,K,Na,Li 2) Na,Mg,Al, S
3) О, S, Se, Те 4) C,N, О, F
6. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1) хлор 2) германий 3) мышьяк 4) селен
7. Кислотные свойства оксидов в ряду SiO2 – P2O5 – SO3
1) ослабевают 2) усиливаются
3) не изменяются 4) изменяются периодически
Ответы
| Вариант | Задания | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| 1 | 4 | 1 | 4 | 3 | 2 | 4 | 3 |
| 2 | 3 | 1 | 2 | 1 | 3 | 1 | 4 |
| 3 | 2 | 2 | 3 | 1 | 2 | 3 | 1 |
| 4 | 1 | 1 | 4 | 1 | 3 | 2 | 2 |
Поделитесь с Вашими друзьями:
1 2 3 4 5 6 7 8 9 … 13
Тест на строение атома и электронные конфигурации.
Задание №1
Четыре электрона на внешнем энергетическом уровне имеют атомы химических элементов:
- 1. Na
- 2. K
- 3. Si
- 4. Mg
- 5. C
Решение
Ответ: 35
Задание №2
Одинаковое число валентных электронов имеют атомы:
- 1. Cr
- 2. V
- 3. As
- 4. Al
- 5. Li
Решение
Ответ: 23
Задание №3
Одинаковое число валентных электронов имеют атомы:
- 1. Ca
- 2. Se
- 3. Fe
- 4. S
- 5. Al
Решение
Ответ: 24
Задание №4
Одинаковое число валентных электронов имеют атомы:
- 1. Ca
- 2. Al
- 3. Cl
- 4. Fe
- 5. Mn
Решение
Ответ: 35
Задание №5
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1. Cr
- 2. Al
- 3. K
- 4. N
- 5. Cl
Решение
Ответ: 13
Задание №6
Одинаковое число неспаренных электронов в основном состоянии имеют атомы:
- 1. Al
- 2. N
- 3. Ca
- 4. P
- 5. O
Решение
Ответ: 24
Задание №7
Одинаковое число неспаренных электронов в основном состоянии имеют атомы:
- 1. Na
- 2. Ca
- 3. As
- 4. Cr
- 5. Al
Решение
Ответ: 15
Задание №8
Три неспаренных электрона в основном состоянии имеют атомы:
- 1. B
- 2. V
- 3. O
- 4. As
- 5. Ne
Решение
Ответ: 24
Задание №9
Одинаковое число неспаренных электронов в основном состоянии содержат атомы:
- 1. Ti
- 2. Al
- 3. C
- 4. Ba
- 5. N
Решение
Ответ: 13
Задание №10
Один неспаренный электрон в основном состоянии имеют атомы:
- 1. Ba
- 2. Al
- 3. N
- 4. Cl
- 5. Ca
Решение
Ответ: 24
[adsp-pro-3]
Задание №11
В основном состоянии все валентные электроны расположены только на s-подуровне у атомов:
- 1. Sb
- 2. Ra
- 3. Fe
- 4. B
- 5. Na
Решение
Ответ: 25
Задание №12
Валентные электроны, расположенные на s- и d-подуровнях, содержат атомы:
- 1. Rb
- 2. Cr
- 3. Sr
- 4. V
- 5. P
Решение
Ответ: 24
Задание №13
Все валентные электроны расположены на третьем энергетическом уровне у атомов:
- 1. Cl
- 2. N
- 3. C
- 4. Be
- 5. P
Решение
Ответ: 15
Задание №14
К s-элементам относятся:
- 1. Cu
- 2. Rb
- 3. Sc
- 4. Al
- 5. Ra
Решение
Ответ: 25
Задание №15
К s-элементам относятся:
- 1. He
- 2. P
- 3. Al
- 4. Cl
- 5. Li
Решение
Ответ: 15
Задание №16
К p-элементам относятся:
- 1. Cu
- 2. B
- 3. Cr
- 4. Ba
- 5. Sb
Решение
Ответ: 25
Задание №17
К d-элементам относятся:
- 1. Cs
- 2. Zn
- 3. Cl
- 4. Te
- 5. Mn
Решение
Ответ: 25
Задание №18
Химические элементы, атомы которых не содержат электронов на d-подуровне:
- 1. K
- 2. Sr
- 3. Mn
- 4. Ca
- 5. Br
Решение
Ответ: 14
Задание №19
Химические элементы, атомы которых не содержат электронов на d-подуровне:
- 1. Cl
- 2. F
- 3. Br
- 4. Cu
- 5. Fe
Решение
Ответ: 12
Задание №20
Валентных электронов на d-подуровне не содержат атомы химических элементов:
- 1. Ti
- 2. Br
- 3. Se
- 4. Sc
- 5. Ni
Решение
Ответ: 23
[adsp-pro-3]
Задание №21
Одинаковое число нейтронов и протонов содержат атомы наиболее распространенных изотопов:
- 1. S
- 2. Al
- 3. K
- 4. Ca
- 5. Na
Решение
Ответ: 14
Задание №22
Число нейтронов большее, чем число протонов содержат ядра наиболее распространенных изотопов:
- 1. Ar
- 2. Si
- 3. K
- 4. Mg
- 5. O
Решение
Ответ: 13
Задание №23
Не могут переходить в возбужденное состояние атомы:
- 1. N
- 2. Ca
- 3. F
- 4. Sr
- 5. Se
Решение
Ответ: 13
Задание №24
Не могут переходить в возбужденное состояние атомы:
- 1. O
- 2. S
- 3. He
- 4. As
- 5. P
Решение
Ответ: 13
Задание №25
Не могут переходить в возбужденное состояние атомы:
- 1. Cl
- 2. F
- 3. B
- 4. Ne
- 5. C
Решение
Ответ: 24
Задание №26
Не могут переходить в возбужденное состояние атомы:
- 1. P
- 2. Br
- 3. Be
- 4. O
- 5. N
Решение
Ответ: 45
Задание №27
Не могут переходить в возбужденное состояние атомы:
- 1. Ca
- 2. P
- 3. O
- 4. F
- 5. S
Решение
Ответ: 34
Задание №28
Возможен переход в возбужденное состояние для атомов:
- 1. Cs
- 2. C
- 3. Al
- 4. Rb
- 5. N
Решение
Ответ: 23
Задание №29
Один неспаренный электрон в основном состоянии содержат атомы:
- 1. Ba
- 2. Al
- 3. N
- 4. Cl
- 5. Ca
Решение
Ответ: 24
Задание №30
Из предложенного перечня химических элементов выберите два таких, наиболее устойчивые катионы которых имеют одинаковые электронные конфигурации:
- 1. Al
- 2. Ca
- 3. Ba
- 4. Na
- 5. I
Решение
Ответ: 14
[adsp-pro-3]
Задание №31
Три неспаренных электрона в основном состоянии содержат атомы:
- 1. B
- 2. N
- 3. Al
- 4. Se
- 5. P
Решение
Ответ: 25
Задание №32
В возбужденном состоянии электронную форму внешнего электронного уровня ns1np2 имеют атомы:
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Решение
Ответ: 12
Задание №33
Электронную формулу внешнего энергетического уровня ns1 в основном состоянии имеют атомы:
- 1. Cr
- 2. Ca
- 3. Cs
- 4. Cl
- 5. Br
Решение
Ответ: 13
Задание №34
Три неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. As
- 2. B
- 3. P
- 4. F
- 5. Al
Решение
Ответ: 25
Задание №35
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 4s24p6
- 1. Sr
- 2. Br
- 3. Rb
- 4. As
- 5. Se
Решение
Ответ: 13
Задание №36
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 2s22p6
- 1. Na
- 2. Al
- 3. Br
- 4. Cu
- 5. Se
Решение
Ответ: 12
Задание №37
Электронную конфигурацию внешнего энергетического уровня в основном состоянии ns2np3 имеют атомы:
- 1. Cu
- 2. N
- 3. P
- 4. Cr
- 5. Fe
Решение
Ответ: 23
Задание №38
Схожую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1. Al
- 2. Mg
- 3. Br
- 4. F
- 5. Na
Решение
Ответ: 34
Задание №39
Полностью завершенный второй энергетический уровень имеют атомы:
- 1. Ne
- 2. He
- 3. Na
- 4. F
- 5. O
Решение
Ответ: 13
Задание №40
Двух электронов до завершения внешнего энергетического уровня не хватает атомам:
- 1. Cr
- 2. Zn
- 3. O
- 4. S
- 5. Fe
Решение
Ответ: 34
[adsp-pro-3]
Задание №41
Одного электрона до завершения внешнего энергетического уровня не хватает атому:
- 1. Na
- 2. Br
- 3. K
- 4. Ca
- 5. Cl
Решение
Ответ: 25
Задание №42
В основном состоянии электронную формулу внешнего энергетического уровня ns2np4 имеют атомы:
- 1. P
- 2. Se
- 3. Si
- 4. Cr
- 5. S
Решение
Ответ: 25
Задание №43
Атомы каких из указанных в ряду элементов в основном состоянии имеют только один неспаренный электрон:
- 1. P
- 2. Cu
- 3. Zn
- 4. Si
- 5. Cl
Решение
Ответ: 25
Задание №44
Не содержат неспаренных электронов в основном состоянии атомы:
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Решение
Ответ: 45
Задание №45
Электронную конфигурацию ns1 имеют атомы:
- 1. Na
- 2. S
- 3. Se
- 4. K
- 5. O
Решение
Ответ: 14
Задание №46
Валентные электроны и на s- и на d-подуровнях содержат атомы:
- 1. Cr
- 2. C
- 3. Ge
- 4. Fe
- 5. Pb
Решение
Ответ: 14
Задание №47
До полного заполнения внешнего энергетического уровня не хватает одного электрона атомам:
- 1. N
- 2. Li
- 3. H
- 4. F
- 5. O
Решение
Ответ: 34
Задание №48
В основном состоянии во внешнем слое содержат один неспаренный электрон атомы:
- 1. Al
- 2. S
- 3. Cr
- 4. P
- 5. Si
Решение
Ответ: 13
Задание №49
Одинаковое число валентных электронов содержат атомы:
- 1. Na
- 2. Cl
- 3. Si
- 4. Mn
- 5. Cr
Решение
Ответ: 24
Задание №50
Электронную конфигурацию ns1np3 в возбужденном состоянии имеют атомы:
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Решение
Ответ: 24
[adsp-pro-3]
Задание №51
Электронную конфигурацию ns1np2 в возбужденном состоянии имеют атомы:
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Решение
Ответ: 12
Задание №52
Электронную конфигурацию внешнего энергетического уровня ns2 в основном состоянии имеют атомы:
- 1. Na
- 2. Al
- 3. Fe
- 4. Ba
- 5. P
Решение
Ответ: 34
Задание №53
Из предложенного перечня химических элементов, выберите такие, устойчивые катионы которых имеют электронную конфигурацию, как у атома неона:
- 1. Mg
- 2. Ca
- 3. Al
- 4. Li
- 5. Be
Решение
Ответ: 13
Задание №54
Из предложенного перечня химических элементов, выберите такие, устойчивые анионы которых имеют электронную конфигурацию, как у атома неона:
- 1. Cl
- 2. О
- 3. Br
- 4. F
- 5. S
Решение
Ответ: 24
Задание №55
Из предложенного перечня химических элементов, выберите такие, устойчивые анионы которых имеют электронную конфигурацию, как у атома аргона:
- 1. Cl
- 2. S
- 3. F
- 4. Br
- 5. O
Решение
Ответ: 12
Задание №56
Из предложенного перечня химических элементов, выберите такие, устойчивые катионы которых имеют электронную конфигурацию, как у атома аргона:
- 1. S
- 2. Ca
- 3. Cl
- 4. K
- 5. Br
Решение
Ответ: 24
Задание №57
Содержат один неспаренный электрон в основном состоянии атомы:
- 1. S
- 2. Na
- 3. Al
- 4. Si
- 5. Mg
Решение
Ответ: 23
Задание №58
Шесть валентных электронов имеют атомы:
- 1. P
- 2. C
- 3. Si
- 4. Cr
- 5. S
Решение
Ответ: 45
Задание №59
Неспаренных электронов не содержат атомы:
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Решение
Ответ: 45
Задание №60
Как на s-, так и на d-подуровне расположены валентные электроны атомов:
- 1. Si
- 2. Cr
- 3. Mn
- 4. Br
- 5. C
Решение
Ответ: 23
[adsp-pro-3]
Задание №61
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Cr
- 2. P
- 3. Mg
- 4. O
- 5. H
Решение
Ответ: 15
Задание №62
До завершения внешнего электронного слоя одного электрона не хватает атомам:
- 1. Ba
- 2. O
- 3. K
- 4. Cl
- 5. H
Решение
Ответ: 45
Задание №63
В основном состоянии один неспаренный электрон имеют атомы:
- 1. B
- 2. Mg
- 3. C
- 4. S
- 5. Rb
Решение
Ответ: 15
Задание №64
Электронную формулу внешнего энергетического уровня ns1np2 в возбужденном состоянии имеют атомы:
- 1. Al
- 2. P
- 3. Cl
- 4. Cr
- 5. B
Решение
Ответ: 15
Задание №65
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. C
- 2. As
- 3. B
- 4. H
- 5. Ne
Решение
Ответ: 34
Задание №66
Одинаковое число d-электронов в основном состоянии содержат атомы:
- 1. Cr
- 2. V
- 3. Cu
- 4. Mn
- 5. Na
Решение
Ответ: 14
Задание №67
Одинаковое число валентных электронов имеют атомы:
- 1. O
- 2. Ba
- 3. P
- 4. Sr
- 5. C
Решение
Ответ: 24
Задание №68
Одинаковое число энергетических уровней, содержащих электроны, имеют атомы:
- 1. Ag
- 2. Rb
- 3. Li
- 4. Na
- 5. Cu
Решение
Ответ: 12
Задание №69
Определите химические элементы, анионы которых имеют конфигурацию внешнего электронного слоя 2s22p6:
- 1. Na
- 2. Cl
- 3. Mg
- 4. F
- 5. O
Решение
Ответ: 45
Задание №70
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1. Cr
- 2. Sb
- 3. Ne
- 4. Cu
- 5. Fe
Решение
Ответ: 14
[adsp-pro-3]
Задание №71
Из предложенного перечня выберите p-элементы:
- 1. Sc
- 2. Fe
- 3. Li
- 4. Sb
- 5. Sn
Решение
Ответ: 45
Задание №72
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Si
- 2. Be
- 3. N
- 4. Rb
- 5. K
Решение
Ответ: 45
Задание №73
Из предложенного перечня выберите d-элементы:
- 1. Cs
- 2. As
- 3. Mn
- 4. Te
- 5. Zn
Решение
Ответ: 35
Задание №74
Одинаковое количество неспаренных электронов в основном состоянии содержат атомы:
- 1. S
- 2. Br
- 3. P
- 4. B
- 5. Zn
Решение
Ответ: 24
Задание №75
В наиболее распространенных изотопах атомов каких элементов число нейтронов больше, чем число электронов:
- 1. O
- 2. Se
- 3. S
- 4. Ar
- 5. Ca
Решение
Ответ: 24
Задание №76
На внешнем энергетическом уровне только два электрона содержат атомы:
- 1. Ca
- 2. Br
- 3. N
- 4. Cr
- 5. He
Решение
Ответ: 15
Задание №77
Атомам каких элементов для приобретения электронной конфигурации как у благородного газа не хватает двух электронов:
- 1. Cl
- 2. P
- 3. N
- 4. Se
- 5. S
Решение
Ответ: 45
Задание №78
Одного электрона до завершения внешнего электронного слоя не хватает атомам:
- 1. Al
- 2. Na
- 3. Cl
- 4. H
- 5. O
Решение
Ответ: 34
Задание №79
В возбужденном состоянии электронную конфигурацию внешнего энергетического уровня ns1np3 имеют атомы:
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Решение
Ответ: 24
Задание №80
Одинаковое число валентных электронов имеют атомы:
- 1. Cr
- 2. Si
- 3. Li
- 4. Ti
- 5. B
Решение
Ответ: 24
[adsp-pro-3]
Задание №81
Одинаковое число спаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Ca
- 2. F
- 3. Al
- 4. S
- 5. Na
Решение
Ответ: 13
Задание №82
К d-элементам относятся:
- 1. Ge
- 2. Te
- 3. S
- 4. Ni
- 5. Zn
Решение
Ответ: 45
Задание №83
К p-элементам относятся:
- 1. Ge
- 2. Sr
- 3. Se
- 4. Ni
- 5. Cu
Решение
Ответ: 13
Задание №84
d-Электроны содержат атомы:
- 1. Ca
- 2. P
- 3. Cu
- 4. Cl
- 5. Rb
Решение
Ответ: 35
Задание №85
Аналогичную электронную конфигурацию внешнего энергетического уровня в основном состоянии имеют наиболее распространенные изотопы элементов:
- 1. Li
- 2. Na
- 3. Al
- 4. N
- 5. С
Решение
Ответ: 12
Задание №86
Один электрон на s-подуровне внешнего энергетического уровня имеют в основном состоянии атомы:
- 1. V
- 2. Cr
- 3. Fe
- 4. Mn
- 5. Cu
Решение
Ответ: 25
Задание №87
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. O
- 2. S
- 3. Na
- 4. Mg
- 5. F
Решение
Ответ: 34
Задание №88
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Ti
- 2. Mg
- 3. Si
- 4. Al
- 5. V
Решение
Ответ: 34
Задание №89
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Ti
- 2. Mg
- 3. F
- 4. Ne
- 5. V
Решение
Ответ: 34
Задание №90
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Cu
- 2. V
- 3. Mg
- 4. Li
- 5. Cr
Решение
Ответ: 25
[adsp-pro-3]
Задание №91
Электронную конфигурацию внешнего энергетического уровня в основном состоянии ns2np2 имеют атомы:
- 1. Se
- 2. Sn
- 3. S
- 4. Sb
- 5. Si
Решение
Ответ: 25
Задание №92
Не содержат неспаренных электронов в основном состоянии атомы:
- 1. Zn
- 2. Ti
- 3. Sr
- 4. Cs
- 5. V
Решение
Ответ: 13
Задание №93
Три неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. P
- 2. Ti
- 3. As
- 4. Al
- 5. B
Решение
Ответ: 45
Задание №94
Четыре неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. С
- 2. P
- 3. Al
- 4. V
- 5. Si
Решение
Ответ: 15
Задание №95
Одинаковое число валентных электронов содержат атомы:
- 1. As
- 2. V
- 3. Cl
- 4. Se
- 5. Na
Решение
Ответ: 12
Задание №96
Десять электронов на 3d-подуровне содержат атомы:
- 1. Cu
- 2. Mn
- 3. Ni
- 4. Co
- 5. Se
Решение
Ответ: 15
Задание №97
Пять электронов на 3d-подуровне содержат атомы:
- 1. Ga
- 2. Cr
- 3. As
- 4. Mn
- 5. V
Решение
Ответ: 24
Задание №98
Атомы каких химических элементов при потере двух электронов приобретают электронную конфигурацию как у благородного газа:
- 1. Ba
- 2. Al
- 3. Fe
- 4. Co
- 5. Be
Решение
Ответ: 15
Задание №99
Атомы каких химических элементов при потере одного электрона приобретают электронную конфигурацию как у благородного газа:
- 1. H
- 2. Rb
- 3. Cr
- 4. Mn
- 5. Cs
Решение
Ответ: 25
Задание №100
Наиболее стабильные анионы вида Э2- образуют химические элементы:
- 1. Ca
- 2. Zn
- 3. Se
- 4. Br
- 5. S
Решение
Ответ: 35
[adsp-pro-3]
Задание №101
Наиболее стабильные катионы вида Э2+ образуют химические элементы:
- 1. Cl
- 2. S
- 3. Ca
- 4. Br
- 5. Zn
Решение
Ответ: 35
[adsp-pro-10]
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности
в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.

Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством
компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем
вы думаете: внутри гаджета, которым вы пользуетесь 

Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
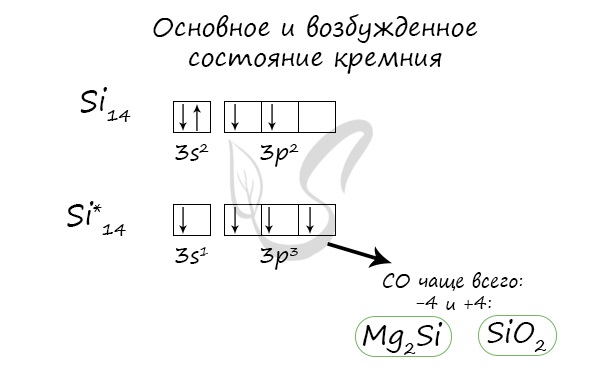
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe3+ — цитрин
- SiO2 с примесью Fe2+ и Fe3+ — аметист

Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
SiO2 + C → (t) Si + CO2↑
SiO2 + Al → (t) Si+ Al2O3
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакция с щелочами
При обычных условиях без нагревания кремний реагирует только со фтором.
Si + F2 → SiF4
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний
с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + Cl2 → (t) SiCl4
Si + C → (t) SiC
Si + O2 → (t) SiO2
Si + O2 → (t = 1200 °C) SiO

В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
KOH + Si → K2SiO3 + H2↑
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре
+1730 °C градусов.
Получение
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
Si + O2 → SiO2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2,
который выпадает в осадок, и воду.
Na2SiO3 + CH3COOH → CH3COONa + H2SiO3↓
H2SiO3 → SiO2 + H2O

Химические свойства
- Реакции с кислотами
- Реакции с основными оксидами и щелочами
- С карбонатами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
SiO2 + HF → SiF4 + H2O
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли
данной кислоты — силикаты.
MgO + SiO2 → MgSiO3
NaOH + SiO2 → Na2SiO3 + H2O

Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
K2CO3 + SiO2 → K2SiO3 + CO2↑
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии
через ее соли — силикаты.
LiOH + SiO2 → Li2SiO3 + H2O
Li2SiO3 + HCl → LiCl + H2SiO3↓
Химические свойства
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
H2SiO3 → H2O + SiO2

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.