Тренажер задания 31 из ЕГЭ по химии азота, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии азота с текстовыми решениями и ответами.
- Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании её с раствором щелочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой. Напишите уравнения описанных реакций.
(NH4)2Cr2O7 N2↑ + Cr2O3 + 4H2O
NH4Cl + AgNO3 = AgCl↓ + NH4NO3
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Mg3N2 + 6H2O = 3Mg(OH)2 ↓ + 2NH3↑
- Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрасился в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твёрдый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3 → 2NaNO2 + O2
- В результате термического разложения дихромата аммония получили газ, который пропустили над нагретым магнием. Образовавшееся вещество поместили в воду. образовавшийся при этом газ пропустили через свежеосажденный гидроксид меди (II). Напишите уравнения описанных реакций.
(NH4)2Cr2O7 → N2↑ + Cr2O3 + 4H2O
3Mg + N2 = Mg3N2
Mg3N2 + 6H2O = 3Mg(OH)2 ↓ + 2NH3↑
4NH3 + Cu(OH)2 = [Cu(NH3)4](OH)2
- Газ, выделившийся на аноде при электролизе нитрата ртути (II), был использован для каталитического окисления аммиака. Получившийся в результате реакции бесцветный газ мгновенно вступил в реакцию с кислородом воздуха. Образовавшийся бурый газ пропустили через баритовую воду. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
- Йод поместили в пробирку с концентрированной горячей азотной кислотой. выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + O2 + 2H2O = 4HNO3
2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 → 2CuO + O2 + 4NO2
- Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели. Напишите уравнения описанных реакций.
6Li + N2 = 2Li3N
Li3N + 3H2O = 3LiOH + NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
NH4Cl + NaNO2 → N2 + NaCl + 2H2O
- Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделилось простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твердый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Напишите уравнения описанных реакций.
10Al + 36HNO3 = 10Al(NO3)3 + 3N2↑ + 18H2O
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaNO3
2Al(OH)3 → Al2O3 + 3H2O
NaNO3 + NH4Cl → N2O + NaCl + 2H2O
3N2O + 2NH3 = 4N2 + 3H2O
- Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании ее с раствором щелочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой. Напишите уравнения описанных реакций.
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
NH4Cl + AgNO3 = AgCl↓ + NH4NO3
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Mg3N2 + 6H2O = 2NH3↑ + 3Mg(OH)2↓
- Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твердый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3 → 2NaNO2 + O2↑
- Смесь двух бесцветных, не имеющих цвета и запаха, газов А и Б пропустили при нагревании над катализатором, содержащим железо, и образующимся при этом газом В нейтрализовали раствором бромоводородной кислоты. Раствор выпарили и остаток нагрели с едким кали, в результате выделился бесцветный газ В с резким запахом. При сжигании газа В на воздухе образуется вода и газ А. Напишите уравнения описанных реакций.
газы – N2, H2, NH3
N2 + 3H2 = 2NH3
NH3 + HBr = NH4Br
NH4Br + KOH = KBr + H2O + NH3↑
4NH3 + 3O2 = 2N2 + 6H2O
- Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганатом калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким характерным запахом. Напишите уравнения описанных реакций.
HNO3 + NaHCO3 = NaNO3 + H2O + CO2↑
2NaNO3 → 2NaNO2 + O2↑
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H2O = NH3↑ + 4Na2[Zn(OH)4]
- Азотоводородную смесь нагрели до температуры 500º С и под высоким давлением пропустили над железным катализатором. Продукты реакции пропустили через раствор азотной кислоты до его нейтрализации. Образовавшийся раствор осторожно выпарили, твердый остаток прокалили и выделившийся при этом газ пропустили над медью при нагревании, в результате образовалось вещество черного цвета. Напишите уравнения описанных реакций.
N2 + 3H2 ↔ 2NH3
NH3 + HNO3 = NH4NO3
NH4NO3 → N2O↑ + 2H2O
N2O + Cu = CuO + N2↑
- Продукт взаимодействия азота и лития обработали водой. Выделившийся в результате реакции газ смешали с избытком кислорода и при нагревании пропустили над платиновым катализатором; образовавшееся газовая смесь имела бурый цвет. Напишите уравнения описанных реакций.
N2 + 6Li = 2Li3N
Li3N + 3H2O = 3LiOH + NH3↑
2NO + O2 = 2NO2
- Газовую смесь аммиака и большого избытка воздуха пропустили при нагревании над платиной и продукты реакции через некоторое время поглотили раствором едкого натра. После выпаривания раствора был получен единственный продукт. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO2 + O2 = 2NaNO3
- Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели; выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
2NO2 + O2 + 2KOH = 2KNO3 + H2O
KNO3 + 4Mg + 6H2O = NH3↑ + 4Mg(OH)2↓ + KOH
NH3 + HNO3 = NH4NO3
NH4NO3 → N2O + 2H2O
- Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2↑ + 3H2O
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + N2O↑ + 5H2O или
4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
- Нитрид магния обработали избытком воды. При пропускании выделившегося газа через бромную воду или через нейтральный раствор перманганата калия, так и при его сжигании образуется один и тот же газообразный продукт. Напишите уравнения описанных реакций.
Mg3N2 + 6H2O = 3Mg(OH)2↓ + 2NH3↑
2NH3 + 3Br2 = N2↑ + 6HBr или
8NH3 + 3Br2 = N2↑ + 6NH4Br
2KMnO4 + 2NH3 = 2MnO2 + N2↑ + 3KOH + 3H2O
4NH3 + 3O2 = 2N2↑ + 6H2O
- Один из продуктов взаимодействия аммиака с бромом – газ, входящий в состав атмосферы, смешали с водородом и нагрели в присутствии платины. Образовавшуюся смесь газов пропустили через раствор соляной кислоты и к полученному раствору добавили при небольшом нагревании нитрит калия. Напишите уравнения описанных реакций.
2NH3 + 3Br2 = N2↑ + 6HBr или
8NH3 + 3Br2 = N2↑ + 6NH4Br
N2 + 3H2 ↔ 2NH3
NH3 + HCl = NH4Cl
NH4Cl + KNO2 = KCl + N2 + 2H2O
- Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагревали до появления запаха, после чего добавили раствор щелочи. Напишите уравнения описанных реакций.
2NH3 + 3Mg = Mg3N2 + 3H2
Mg3N2 + 8HBr = 3MgBr2 + 2NH4Br
NH4Br → NH3 + HBr
MgBr2 + 2NaOH = Mg(OH)2↓ + 2NaBr
- Смесь азота и водорода последовательно пропустили над нагретой платиной и через раствор серной кислоты. В раствор добавили хлорид бария и после отделения выпавшего осадка – известковое молоко и нагрели. Напишите уравнения описанных реакций.
N2 + 3H2 = 2NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = 2NH4Cl + BaSO4↓
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
- Аммиак смешали с большим избытком воздуха, нагрели в присутствии платины и через некоторое время поглотили водой. Медная стружка, добавленная в полученный раствор растворяется с выделением бурого газа. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
4NO2 + O2 + 2H2O = 4HNO3
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
- При нагревании вещества оранжевого цвета оно разлагается; среди продуктов разложения – бесцветный газ и твердое вещество зеленого цвета. Выделившийся газ реагирует с литием даже при небольшом нагревании. Продукт последней реакции взаимодействует с водой, при этом выделился газ с резким запахом, который может восстанавливать металлы, например медь из их оксидов. Напишите уравнения описанных реакций.
(NH4)2Cr2O7 → N2↑ + Cr2O3 + 4H2O
N2 + 6Li = 2Li3N
Li3N + 3H2O = 3LiOH + NH3↑
2NH3 + 3CuO = N2↑ + 3Cu + 3H2O
- Металлический кальций прокалили в атмосфере азота. Продукт реакции обработали водой, выделившийся при этом газ пропустили в раствор нитрата хрома (III). Выпавший в ходе процесса серо-зеленый осадок обработали щелочным раствором пероксида водорода. Напишите уравнения описанных реакций.
N2 + 3Ca → Ca3N2
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
3NH3 + 3H2O + Cr(NO3)3 = Cr(OH)3↓ + 3NH4NO3
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
- Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. полученную магниевую соль в растворе обработали карбонатом натрия. Напишите уравнения описанных реакций.
KNO2 + NH4Cl → KCl + N2↑ + 2H2O
N2 + 3Mg → Mg3N2
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
2MgCl2 + 2Na2CO3 + H2O = (MgOH)2CO3↓ + CO2 + 4NaCl
- Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдали сначала образование осадка, а затем – его полное растворение. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu(NO3)2 + 2NH3 · H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 2NH3 · H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
- Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. Получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Напишите уравнения описанных реакций.
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3↑ + 3H2O
Mg(NO3)2 + 2KOH = Mg(OH)2↓ + 2KNO3
NH4NO3 + KOH = KNO3 + NH3↑ + H2O
4NH3 + 3O2 = 2N2↑ + 6H2O
- Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор. Напишите уравнения описанных реакций.
KNO3 + Pb = KNO2 + PbO
2KNO2 + 2H2SO4 + 2KI = 2K2SO4 + 2NO + I2 + 2H2O
I2 + 10HNO3 → 2HIO3 + 10NO2 + 4H2O
10NO2 + 4P = 2P2O5 + 10NO
- Газ, образовавшийся при взаимодействии азота и водорода, разделили на две части. Первую пропустили над раскаленным оксидом меди (II), вторую сожгли в кислороде в присутствии катализатора. Образовавшийся газ в избытке кислорода превратили в газ бурого цвета. Напишите уравнения описанных реакций.
N2 + 3H2 = 2NH3
3CuO + 2NH3 = 3Cu + N2 + 3H2O
2NO + O2 = 2NO2
- Разбавленная азотная кислота прореагировала с магнием с выделением бесцветного газа. В его атмосфере сожгли графит с образованием простого и сложного вещества. простое вещество при нагревании вступило в реакцию с кальцием, а сложное прореагировало с избытком раствора гидроксида натрия. Напишите уравнения описанных реакций.
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O↑ + 5H2O
2N2O + C = 2N2↑ + CO2↑
3Ca + N2 = Ca3N2
CO2 + 2NaOH = Na2CO3 + H2O
- Аммиак поглотили азотной кислотой, полученную соль нагрели до образования только двух оксидов. Один из них прореагировал с натрием, а второй при высокой температуре прореагировал с медью. Напишите уравнения описанных реакций.
NH3 + HNO3 = NH4NO3
NH4NO3 → N2O + H2O
2H2O + 2Na = 2NaOH + H2
N2O + 2CuO = N2 + Cu2O
- Оксид азота (II) доокислили кислородом. Продукт реакции поглотили раствором гидроксида калия, через полученный раствор пропускали кислород до тех пор, пока в нем не образовалась только одна соль. Образовавшуюся соль отделили и прокалили. Напишите уравнения описанных реакций.
2NO + O2 = 2NO2
2NO2 + 2KOH = KNO2 + KNO3 + H2O
2KNO2 + O2 = 2KNO3
2KNO3 → 2KNO2 + O2
- Кальций сожгли в атмосфере азота. Полученное вещество разложили кипящей водой. Выделившийся газ сожгли в кислороде в присутствии катализатора, а к суспензии прибавили раствор соляной кислоты. Напишите уравнения описанных реакций.
3Ca + N2 = Ca3N2
Ca3N2 + 6H2O = Ca(OH)2 + 2NH3
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
- Азот при нагревании на катализаторе прореагировал с водородом. Полученный газ поглотили раствором азотной кислоты, выпарили досуха и полученное кристаллическое вещество разделили на две части. Первую разложили при температуре 190 – 240°С, при этом образовался только один газ и водяные пары. Вторую часть нагрели с концентрированным раствором едкого натра. Напишите уравнения описанных реакций.
N2 + 3H2 = 2NH3
NH3 + HNO3 = NH4NO3
NH4NO3 → N2O + 2H2O
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
Азот. Соединения азота.
I.Азот. В лаборатории получают разложением нитрита аммония:
NH4NO2N2 + 2H2O
NaNO2 + NH4Cl N2+ NaCl + 2H2O
В обычных условиях азот не реагирует ни с металлами (за исключением лития – с ним N2взаимодействует при комнатной температуре), ни с неметаллами. При нагревании химическая активность азота повышается.
При взаимодействии с металлами образуются нитриды металлов:
N2+ 6 Li = 2Li3NN2 + 6 Na 2Na3N
N2+ 3Mg Mg3N2N2 + 2Al(порошок)
2AlN
Нитриды щелочных и щелочноземельных металлов легко разлагаются водой и растворами кислот:
Li3N + 3H2O = 3LiOH + NH3Ca3N2 + 6HCl = 3CaCl2 + 2NH3
Cнеметаллами азот взаимодействует только в специальных условиях – при высокой температуре, давлении, в присутствии катализатора или при пропускании сильного электрического разряда:
N2 + 3H2 2NH3
N2 + O2 2NO
N2+ 3LiH Li3N + NH3
II. Соединения азота.
- Аммиак.
Наиболее энергично аммиак реагирует с хлором и бромом, оксидами некоторых металлов, а также (при поджигании смеси или в присутствии катализатора) с кислородом:
2NH3 + 3Cl2 = N2 + 6HCl
2NH3 + 3CuO = 3Cu + N2 + 3H2O
4NH3 + 3O2 = 2N2 + 6H2O
4NH3 + 5O2 4NO+ 6H2O
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 = N2 + 6H2O
За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием:
2NH3 + 2Na = 2NaNH2+ H2 (Na2NH, Na3N)
2NH3 + 2Al = 2AlN + 3H2
Растворение аммиака в воде сопровождается химическим взаимодействием с ней:
NH3 + H2O ↔ NH3 ∙ H2O ↔NH4+ + OH−
При взаимодействии с кислотами образуются соли аммония:
NH3 + HCl = NH4Cl
NH3 + H2SO4 = NH4HSO4
2NH3 + H2SO4 = (NH4)2SO4
При взаимодействии аммиака с углекислым газом образуется карбамид (мочевина):
2NH3 + CO2= (NH2)2CO + H2O
Аммиак вступает в реакции комплексообразования:
6NH3+ CuCl2 = [Cu(NH3)6]Cl2
4NH3 + Cu(OH)2 = [Cu(NH3)4](OH)2
- Соли аммония.
Все соли аммония проявляют общие свойства солей (взаимодействуют с растворами кислот, щелочей и других солей), а такжеподвергаются гидролизу и разлагаются при нагревании:
NH4Cl + KOH = KCl + NH3 + H2O (качественная реакция на NH4+)
(NH4)2SO4 + Ba(NO3)2 = 2NH4NO3 + BaSO4↓
NH4+ + HOH ↔ NH3 ∙ H2O + H+
NH4HS + 3HNO3 = S + 2NO2 + NH4NO3 + 2H2O
Если соль не содержит аниона-окислителя, то разложение проходит без изменения степени окисления атома азота:
NH4Cl NH3 + HCl
NH4HCO3 NH3 + CO2 + H2O
(NH4)2SO4 NH4HSO4+ NH3
NH4HSNH3 + H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония:
NH4NO2 N2 + 2H2O
NH4NO3 = N2O + 2H2O (190 – 245° C)
2NH4NO3= 2NO + 4H2O (250 – 300° C)
2NH4NO3 = 2N2 + O2 + 4H2O (выше 300° С)
(NH4)2Cr2O7 Cr2O3 + N2 + 4H2O
- Оксиды азота.
|
оксид |
степень окисления |
цвет (н.у.) |
характер оксида |
|
N2O |
+1 |
бесцветный |
несолеобразующий |
|
NO |
+2 |
бесцветный |
несолеобразующий |
|
N2O3 |
+3 |
синий |
кислотный |
|
NO2 |
+4 |
бурый |
кислотный |
|
N2O5 |
+5 |
бесцветный |
кислотный |
N2O
В нормальных условиях N2Oхимически инертен, при нагревании проявляет свойства окислителя:
N2O + H2 = N2 + H2O
N2O + Mg = N2 + MgO
N2O + 2Cu = N2 + Cu2O
3N2O + 2NH3 = 4N2+ 3H2O
N2O + H2O+ SO2 = N2 + H2SO4
При взаимодействии с сильными окислителями N2Oможет проявлять свойства восстановителя
5N2O + 3H2SO4 + 2KMnO4 = 10NO + 2MnSO4 + K2SO4+ 3H2O
NO ядовит!
В лаборатории получают взаимодействием 30%-ной азотной кислоты с некоторыми металлами:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить по реакциям:
FeCl2 + NaNO3 + 2HCl = FeCl3 + NaCl+ NO + H2O
2HNO3+ 2HI = 2NO + I2 + 2H2O
На воздухе NO практически мгновенно окисляется до NO2
2NO+ O2 = 2NO2
По отношению к галогенам, озону также проявляет свойства восстановителя:
2NO + Cl2= 2NOCl NO + O3 = NO2 + O2
В присутствии более сильных восстановителей проявляет свойства окислителя:
2NO + 2H2 = N2 + 2H2O 2NO + 2SO2 = 2SO3 + N2
N2O3 Кислотный оксид. Ангидрид азотистой кислоты. При взаимодействии с водой дает азотистую кислоту:
N2O3 + H2O↔ 2HNO2
При взаимодействии с растворами щелочей образуются нитриты:
N2O3 + 2NaOH = 2NaNO2 + H2O
NO2 Очень ядовит! Для NO2 характерна высокая химическая активность: он взаимодействует с неметаллами (фосфор, уголь, сера горят в оксиде азота (IV), оксид серы (IV) окисляется до оксида серы VI)). В этих реакциях NO2 – окислитель:
2NO2 + 2S = N2 + 2SO2
2NO2 + 2C = N2 + 2CO2
10NO2 + 8P = 5N2 + 4P2O5
NO2 + SO2 = SO3 + NO
Растворение NO2 в воде приводит к образованию азотной и азотистой кислот:
2NO2 + H2O = HNO3 + HNO2
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 + H2O = 2HNO3 + NO
При нагревании: 4NO2 + 2H2O = 4HNO3+ O2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 + 2H2O+ O2 = 4HNO3
При растворении в щелочах – нитраты и нитриты:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 = Ca(NO2)2 + Ca(NO3)2 + 2H2O
В присутствии кислорода – нитраты:
4NO2 + 4NaOH +O2 = 4NaNO3 + 2H2O
N2O5 Кислотный оксид. Ангидрид азотной кислоты.
Растворяется в воде с образованием азотной кислоты:
N2O5 + H2O = 2HNO3
в щелочах – с образованием нитратов:
N2O5 + 2NaOH = 2NaNO3 +H2O
4) Кислоты.
HNO2 Азотистая кислота.HNO2 существует только в разбавленных растворах, при нагревании которых она разлагается:
3HNO2 ↔ HNO3 + 2NO + H2O
Поскольку степень окисления азота в HNO2 равна +3, то азотистая кислота проявляет как окислительные свойства, так и восстановительные:
2HNO2 + 2HI = 2NO + I2 + 2H2O
5HNO3 + 2HMnO4 = 2Mn(NO3)2 + HNO3 + 3H2O
HNO2+ Cl2 + H2O = HNO3 + 2HCl
2HNO2 + O2= 2HNO3
HNO2 + H2O2= HNO3 + H2O
2HNO2 + 3H2SO4 + 6FeSO4 = 3Fe2(SO4)3 + N2 + 4H2O
HNO3 Азотная кислота.При кипении (tкип.= 85°C) и при длительном стоянии она частично разлагается:
4HNO3 4NO2 + O2 + 2H2O
Азотная кислота проявляет очень высокую химическую активность. Степень окисления азота в HNO3равна +5, поэтому азотная кислота является окислителем, причем очень сильным. В зависимости от условий (природы восстановителя, концентрации HNO3 и температуры) степень окисления атома азота в продуктах реакции может меняться от +4 до −3: NO2, NO,N2O,N2, NН4+
NO3− + 2H+ + 1e → NO2 + H2O
NO3− + 4H+ + 3e → NO + 2H2O
2NO3− + 10H+ + 8e → N2O + 5H2O
2NO3− + 12H+ + 10e → N2 + 6H2O
NO3− + 10H+ + 8e → NH4+ + 3H2O
Чем выше концентрация азотной кислоты, тем меньше электронов склонен принять анион NO3−.
Взаимодействие с металлами.
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет:
Fe + 6HNO3(конц.)Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.)Al(NO3)3 + 3NO2 + 3H2O
Золото и платина растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему)
HNO3 + 3HCl + Au = AuCl3 + NO + 2H2O
4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2 + 2H2O
8HNO3 (разб.)+ 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
4HNO3 (60%)+ Zn = Zn(NO3)2 + 2NO2 + 2H2O
8HNO3 (30%)+ 3Zn = 3Zn(NO3)2 + 2NO + 4H2O
10HNO3 (20%)+ 4Zn = 4Zn(NO3)2 + 2N2O + 5H2O
10HNO3 (3%)+ 4Zn = 4Zn(NO3)2 + NH4NO3 + 3H2O
Взаимодействие с неметаллами.
При взаимодействии с неметаллами HNO3 обычно восстанавливается до NOилиNO2, неметаллы окисляются до соответствующих кислот:
6HNO3 + S = H2SO4 + 6NO2 + 2H2O
5HNO3 + P = H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO
4HNO3 + C = CO2 + 4NO2 + 2H2O
10HNO3 + I2 = 2HIO3 + 10NO2 + 4H2O
Свойства окислителя НNO3 может проявлять и в реакциях со сложными веществами:
6HNO3 + HI = HIO3 + 6NO2 + 3H2O
2HNO3 + SO2 = H2SO4 + 2NO2
2HNO3 + H2S = S + 2NO2 + 2H2O
8HNO3 + CuS = CuSO4 + 8NO2 + 4H2O
4HNO3 + FeS = Fe(NO3)3 + NO + S + 2H2O
5) Соли
Соли азотистой кислоты – нитриты. Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты.Поскольку степень окисления азота в нитритахравна +3, то они проявляют как окислительные свойства, так и восстановительные:
2KNO2 + O2 = 2KNO3
KNO2 + H2O2= KNO3 + H2O
KNO2 + H2O + Br2 = KNO3 + 2HBr
5KNO2 + 3H2SO4 + 2KMnO4 = 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
3KNO2 + 4H2SO4 + K2Cr2O7 = 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
2KNO2 + 2H2SO4 + 2KI = 2NO + I2 + 2K2SO4 + 2H2O
3KNO2 + Cr2O3+ KNO3 = 2K2CrO4 + 4NO
Соли азотной кислоты – нитраты.
Нитратытермически неустойчивы, причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Соли щелочных и щелочноземельных металлов (до Mg) разлагаются до нитрита и кислорода:
2NaNO3 2NaNO2 + O2
- Соли тяжелых металлов (от Mg до Cu) – до оксида металла, оксида азота (IV) и кислорода:
2Cu(NO3)2 2CuO + 4NO2 + O
- Соли малоактивных металлов (правее Cu) – до металла, оксида азота (IV) и кислорода
2AgNO3 2Ag + 2NO2 + O2
Смесь 75% KNO3, 15% C и 10% S называют «черным порохом»
2KNO3 + 3C + S = N2 + 3CO2 + K2S +Q
Азот. Соединения азота.
1. Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании её с раствором щелочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой.Напишите уравнения описанных реакций.
2. Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрасился в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твёрдый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
3. В результате термического разложения дихромата аммония получили газ, который пропустили над нагретым магнием. Образовавшееся вещество поместили в воду. образовавшийся при этом газ пропустили через свежеосажденный гидроксид меди (II). Напишите уравнения описанных реакций.
4. Газ, выделившийся на аноде при электролизе нитрата ртути (II), был использован для каталитического окисления аммиака. Получившийся в результате реакции бесцветный газ мгновенно вступил в реакцию с кислородом воздуха. Образовавшийся бурый газ пропустили через баритовую воду. Напишите уравнения описанных реакций.
5. Йод поместили в пробирку с концентрированной горячей азотной кислотой. выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
6. Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.Напишите уравнения описанных реакций.
7. Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделилось простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твердый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Напишите уравнения описанных реакций.
8. Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании ее с раствором щелочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой. Напишите уравнения описанных реакций.
9. Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твердый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
10. Смесь двух бесцветных, не имеющих цвета и запаха, газов А и Б пропустили при нагревании над катализатором, содержащим железо, и образующимся при этом газом В нейтрализовали раствором бромоводородной кислоты. Раствор выпарили и остаток нагрели с едким кали, в результате выделился бесцветный газ В с резким запахом. При сжигании газа В на воздухе образуется вода и газ А. Напишите уравнения описанных реакций.
11. Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганатом калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким характерным запахом. Напишите уравнения описанных реакций.
12. Азотоводородную смесь нагрели до температуры 500º С и под высоким давлением пропустили над железным катализатором. Продукты реакции пропустили через раствор азотной кислоты до его нейтрализации. Образовавшийся раствор осторожно выпарили, твердый остаток прокалили и выделившийся при этом газ пропустили над медью при нагревании, в результате образовалось вещество черного цвета. Напишите уравнения описанных реакций.
13. Продукт взаимодействия азота и лития обработали водой. Выделившийся в результате реакции газ смешали с избытком кислорода и при нагревании пропустили над платиновым катализатором; образовавшееся газовая смесь имела бурый цвет. Напишите уравнения описанных реакций.
14. Газовую смесь аммиака и большого избытка воздуха пропустили при нагревании над платиной и продукты реакции через некоторое время поглотили раствором едкого натра. После выпаривания раствора был получен единственный продукт. Напишите уравнения описанных реакций.
15. Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели; выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
16. Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине.Напишите уравнения описанных реакций.
17. Нитрид магния обработали избытком воды. При пропускании выделившегося газа через бромную воду или через нейтральный раствор перманганата калия, так и при его сжигании образуется один и тот же газообразный продукт. Напишите уравнения описанных реакций.
18. Один из продуктов взаимодействия аммиака с бромом – газ, входящий в состав атмосферы, смешали с водородом и нагрели в присутствии платины. Образовавшуюся смесь газов пропустили через раствор соляной кислоты и к полученному раствору добавили при небольшом нагревании нитрит калия. Напишите уравнения описанных реакций.
19. Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагревали до появления запаха, после чего добавили раствор щелочи. Напишите уравнения описанных реакций.
20. Смесь азота и водорода последовательно пропустили над нагретой платиной и через раствор серной кислоты. В раствор добавили хлорид бария и после отделения выпавшего осадка – известковое молоко и нагрели. Напишите уравнения описанных реакций.
21. Аммиак смешали с большим избытком воздуха, нагрели в присутствии платины и через некоторое время поглотили водой. Медная стружка, добавленная в полученный раствор растворяется с выделением бурого газа. Напишите уравнения описанных реакций.
22. При нагревании вещества оранжевого цвета оно разлагается; среди продуктов разложения – бесцветный газ и твердое вещество зеленого цвета. Выделившийся газ реагирует с литием даже при небольшом нагревании. Продукт последней реакции взаимодействует с водой, при этом выделился газ с резким запахом, который может восстанавливать металлы, например медь из их оксидов. Напишите уравнения описанных реакций.
23. Металлический кальций прокалили в атмосфере азота. Продукт реакции обработали водой, выделившийся при этом газ пропустили в раствор нитрата хрома (III). Выпавший в ходе процесса серо-зеленый осадок обработали щелочным раствором пероксида водорода.
Напишите уравнения описанных реакций.
24. Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. полученную магниевую соль в растворе обработали карбонатом натрия.Напишите уравнения описанных реакций.
25. Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдали сначала образование осадка, а затем – его полное растворение. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
26. Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. Получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Напишите уравнения описанных реакций.
27. Нитрит калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор.Напишите уравнения описанных реакций.
28. Газ, образовавшийся при взаимодействии азота и водорода, разделили на две части. Первую пропустили над раскаленным оксидом меди (II), вторую сожгли в кислороде в присутствии катализатора. Образовавшийся газ в избытке кислорода превратили в газ бурого цвета. Напишите уравнения описанных реакций.
29. Разбавленная азотная кислота прореагировала с магнием с выделением бесцветного газа. В его атмосфере сожгли графит с образованием простого и сложного вещества. простое вещество при нагревании вступило в реакцию с кальцием, а сложное прореагировало с избытком раствора гидроксида натрия.Напишите уравнения описанных реакций.
30. Аммиак поглотили азотной кислотой, полученную соль нагрели до образования только двух оксидов. Один из них прореагировал с натрием, а второй при высокой температуре прореагировал с медью.Напишите уравнения описанных реакций.
31. Оксид азота (II)доокислили кислородом. Продукт реакции поглотили раствором гидроксида калия, через полученный раствор пропускали кислород до тех пор, пока в нем не образовалась только одна соль. Напишите уравнения описанных реакций.
32. Кальций сожгли в атмосфере азота. Полученное вещество разложили кипящей водой. Выделившийся газ сожгли в кислороде в присутствии катализатора, а к суспензии прибавили раствор соляной кислоты. Напишите уравнения описанных реакций.
33. Азот при нагревании на катализаторе прореагировал с водородом. Полученный газ поглотили раствором азотной кислоты, выпарили досуха и полученное кристаллическое вещество разделили на две части. Первую разложили при температуре 190 – 240°С, при этом образовался только один газ и водяные пары. Вторую часть нагрели с концентрированным раствором едкого натра. Напишите уравнения описанных реакций.
Азот. Соединения азота.
1) (NH4)2Cr2O7N2↑ + Cr2O3 + 4H2O
NH4Cl + AgNO3 = AgCl↓ + NH4NO3
NH4Cl + NaOH = NaCl + NH3↑ +H2O
Mg3N2 + 6H2O = 3Mg(OH)2 ↓ + 2NH3↑
2) N2 + O2 2NO
2NO + O2 = 2NO2
NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3 2NaNO2 + O2
3) (NH4)2Cr2O7N2↑ + Cr2O3 + 4H2O
3Mg + N2 = Mg3N2
Mg3N2 + 6H2O = 3Mg(OH)2 ↓ + 2NH3↑
4NH3 + Cu(OH)2 = [Cu(NH3)4](OH)2
4) 2Hg(NO3)2 + 2H2O 2Hg + O2 + 4HNO3
4NH3 + 5O24NO + 6H2O
2NO + O2 = 2NO2
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
5) I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + O2 + 2H2O = 4HNO3
2HNO3+ Cu(OH)2 = Cu(NO3)2 + 2H2O
2Cu(NO3)22CuO + O2 + 4NO2
6) 6Li + N2 = 2Li3N
Li3N + 3H2O = 3LiOH + NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
NH4Cl + NaNO2 N2 + NaCl + 2H2O
7) 10Al + 36HNO3 = 10Al(NO3)3 + 3N2↑ + 18H2O
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaNO3
2Al(OH)3 Al2O3 + 3H2O
NaNO3+ NH4Cl N2O + NaCl + 2H2O
3N2O + 2NH3 = 4N2 + 3H2O

N2 + Cr2O3 + 4H2O
NH4Cl + AgNO3 = AgCl↓ + NH4NO3
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Mg3N2 + 6H2O = 2NH3↑ + 3Mg(OH)2↓
9) N2 + O2 2NO
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
2NaNO3 2NaNO2 + O2↑
10) газы – N2, H2, NH3
N2 + 3H2 = 2NH3
NH3 + HBr = NH4Br
NH4Br + KOH = KBr + H2O + NH3↑
4NH3 + 3O2 = 2N2 + 6H2O
11) HNO3 + NaHCO3 = NaNO3 + H2O + CO2↑
2NaNO3 2NaNO2 + O2↑
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H2O = NH3↑ + 4Na2[Zn(OH)4]
12) N2 + 3H2 ↔ 2NH3
NH3 + HNO3 = NH4NO3
NH4NO3 N2O↑ + 2H2O
N2O + Cu = CuO + N2↑
13) N2 + 6Li = 2Li3N
Li3N + 3H2O = 3LiOH + NH3↑
4NH3 + 5O2 4NO + 6H2O
2NO + O2 = 2NO2
14) 4NH3 + 5O2 4NO + 6H2O
2NO + O2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2+ H2O
2NaNO2 + O2 = 2NaNO3
15) 2NO2 + O2 + 2KOH = 2KNO3 + H2O
KNO3 + 4Mg + 6H2O = NH3↑ + 4Mg(OH)2↓ + KOH
NH3 + HNO3= NH4NO3
NH4NO3N2O + 2H2O
16) Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2↑ + 3H2O
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + N2O↑ + 5H2O или
4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
17) Mg3N2 + 6H2O = 3Mg(OH)2↓ + 2NH3↑
2NH3+ 3Br2 = N2↑ + 6HBr или
8NH3+ 3Br2 = N2↑ + 6NH4Br
2KMnO4 + 2NH3 = 2MnO2 + N2↑ + 3KOH + 3H2O
4NH3 + 3O2 = 2N2↑ + 6H2O
18) 2NH3 + 3Br2 = N2↑ + 6HBr или
8NH3+ 3Br2 = N2↑ + 6NH4Br
N2 + 3H2 ↔ 2NH3
NH3 + HCl = NH4Cl
19) 2NH3 + 3Mg = Mg3N2 + 3H2
Mg3N2 + 8HBr = 3MgBr2 + 2NH4Br
NH4Br NH3 + HBr
MgBr2 + 2NaOH = Mg(OH)2↓ + 2NaBr
20) N2 + 3H2 = 2NH3
2NH3 + H2SO4 = (NH4)2SO4
(NH4)2SO4 + BaCl2 = 2NH4Cl + BaSO4↓
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 3H2O
21) 4NH3 + 5O2 4NO + 6H2O
2NO + O2 = 2NO2
4NO2 + O2 + 2H2O = 4HNO3
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
22) (NH4)2Cr2O7 N2↑ + Cr2O3 + 4H2O
N2 + 6Li = 2Li3N
Li3N + 3H2O = 3LiOH + NH3↑
2NH3 + 3CuO = N2↑ + 3Cu + 3H2O
23) N2 + 3Ca Ca3N2
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
3NH3 + 3H2O + Cr(NO3)3 = Cr(OH)3↓ + 3NH4NO3
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
24) KNO2+ NH4Cl KCl + N2↑ + 2H2O
N2 + 3Mg Mg3N2
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
2MgCl2 + 2Na2CO3 + H2O = (MgOH)2CO3↓ + CO2 + 4NaCl
25) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu(NO3)2 + 2NH3 · H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 2NH3 · H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
26) 4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3↑ + 3H2O
Mg(NO3)2 + 2KOH = Mg(OH)2↓ + 2KNO3
NH4NO3 + KOH = KNO3 + NH3↑ + H2O
4NH3 + 3O2 = 2N2↑ + 6H2O
27) KNO3 + Pb = KNO2 + PbO
2KNO2 + 2H2SO4 + 2KI = 2K2SO4 + 2NO + I2 + 2H2O
I2 + 10HNO3 2HIO3 + 10NO2 + 4H2O
10NO2 + 4P = 2P2O5 + 10NO
28) N2 + 3H2 = 2NH3
3CuO + 2NH3 = 3Cu + N2 + 3H2O
4NH3 + 5O2 4NO + 6H2O
2NO + O2 = 2NO2
29) 4Mg + 10HNO3 = 4Mg(NO3)2 + N2O↑ + 5H2O
2N2O + C = 2N2↑ + CO2↑
3Ca + N2 = Ca3N2
CO2 + 2NaOH = Na2CO3 + H2O
30) NH3 + HNO3 = NH4NO3
NH4NO3 N2O + H2O
2H2O + 2Na = 2NaOH + H2
N2O + 2CuO = N2 + Cu2O
31) 2NO + O2 = 2NO2
2NO2 + 2KOH = KNO2 + KNO3 + H2O
2KNO2 + O2 = 2KNO3
2KNO3 2KNO2 + O2
32) 3Ca + N2 = Ca3N2
Ca3N2 + 6H2O = Ca(OH)2 + 2NH3
4NH3 + 5O2 4NO + 6H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
33) N2 + 3H2 = 2NH3
NH3 + HNO3 = NH4NO3
NH4NO3 N2O + 2H2O
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.
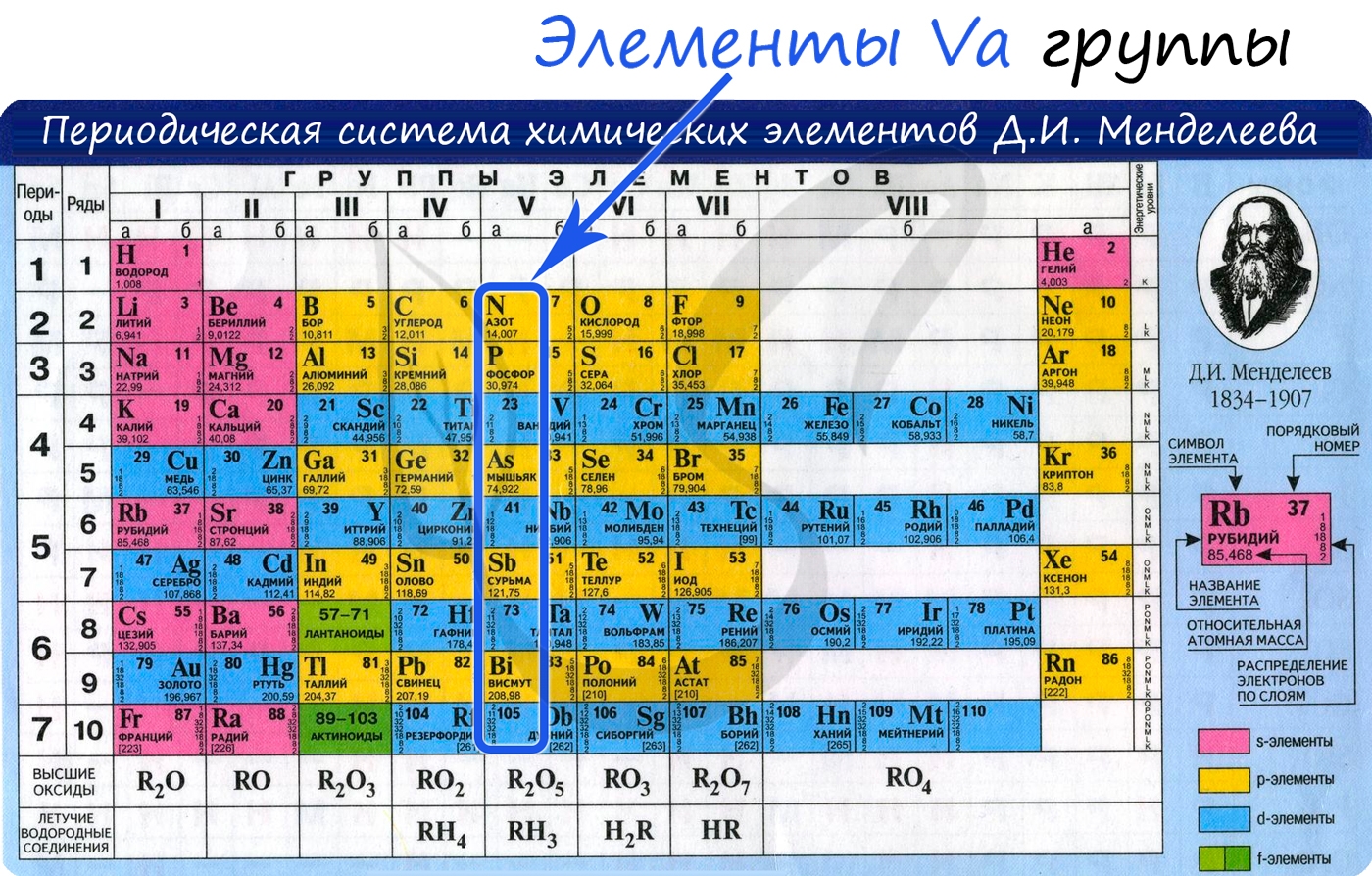
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
Основное и возбужденное состояние азота
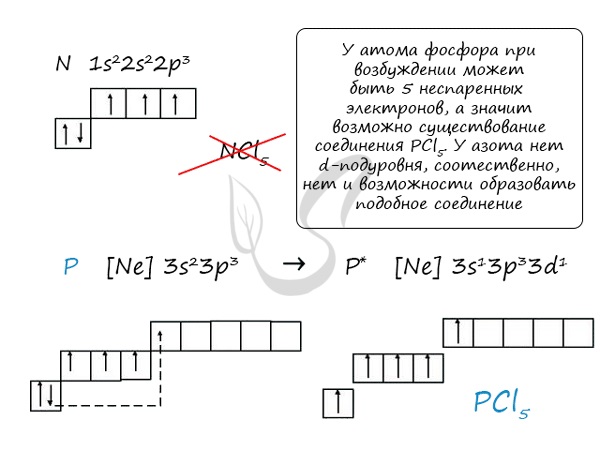
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
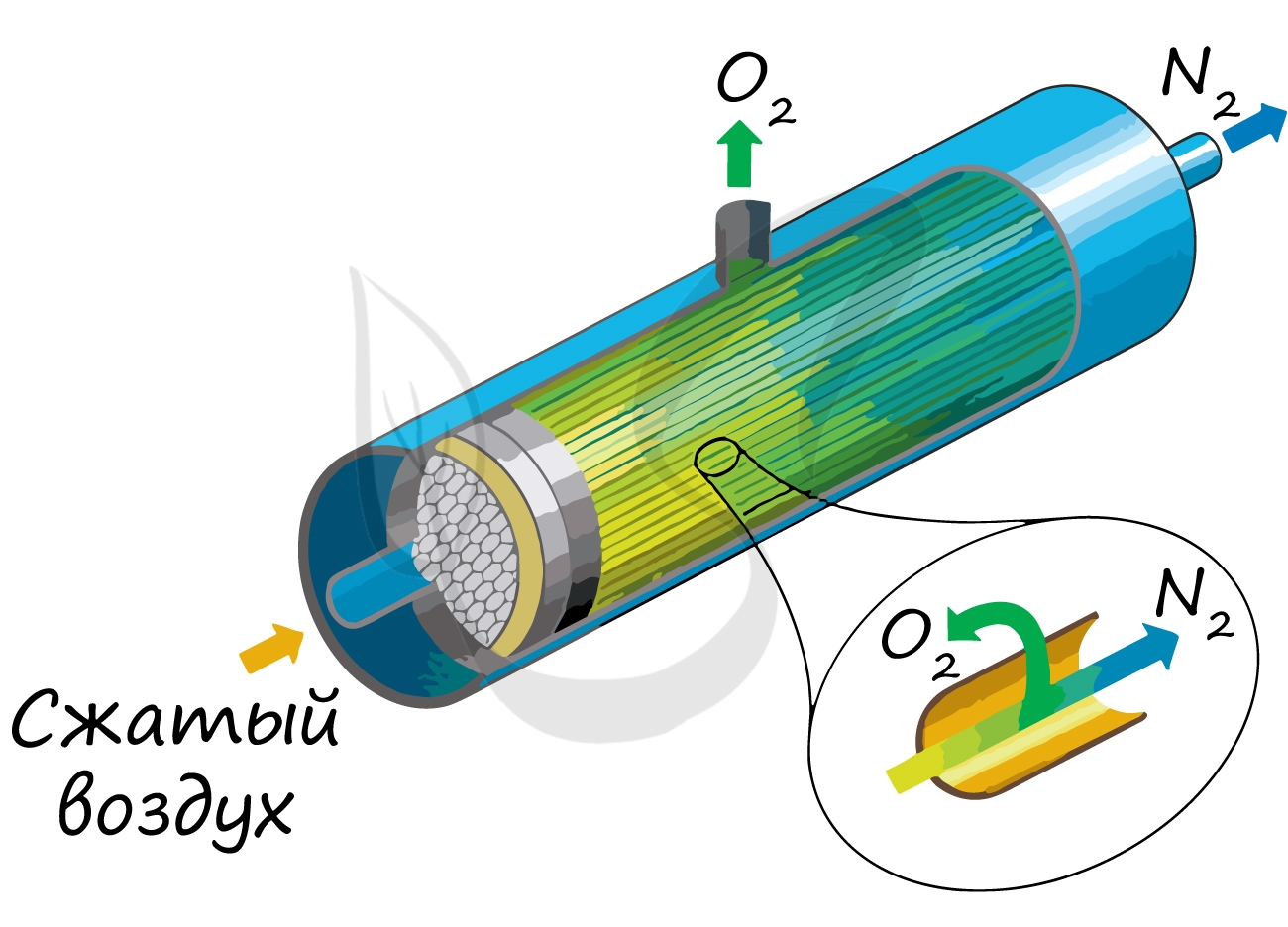
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.
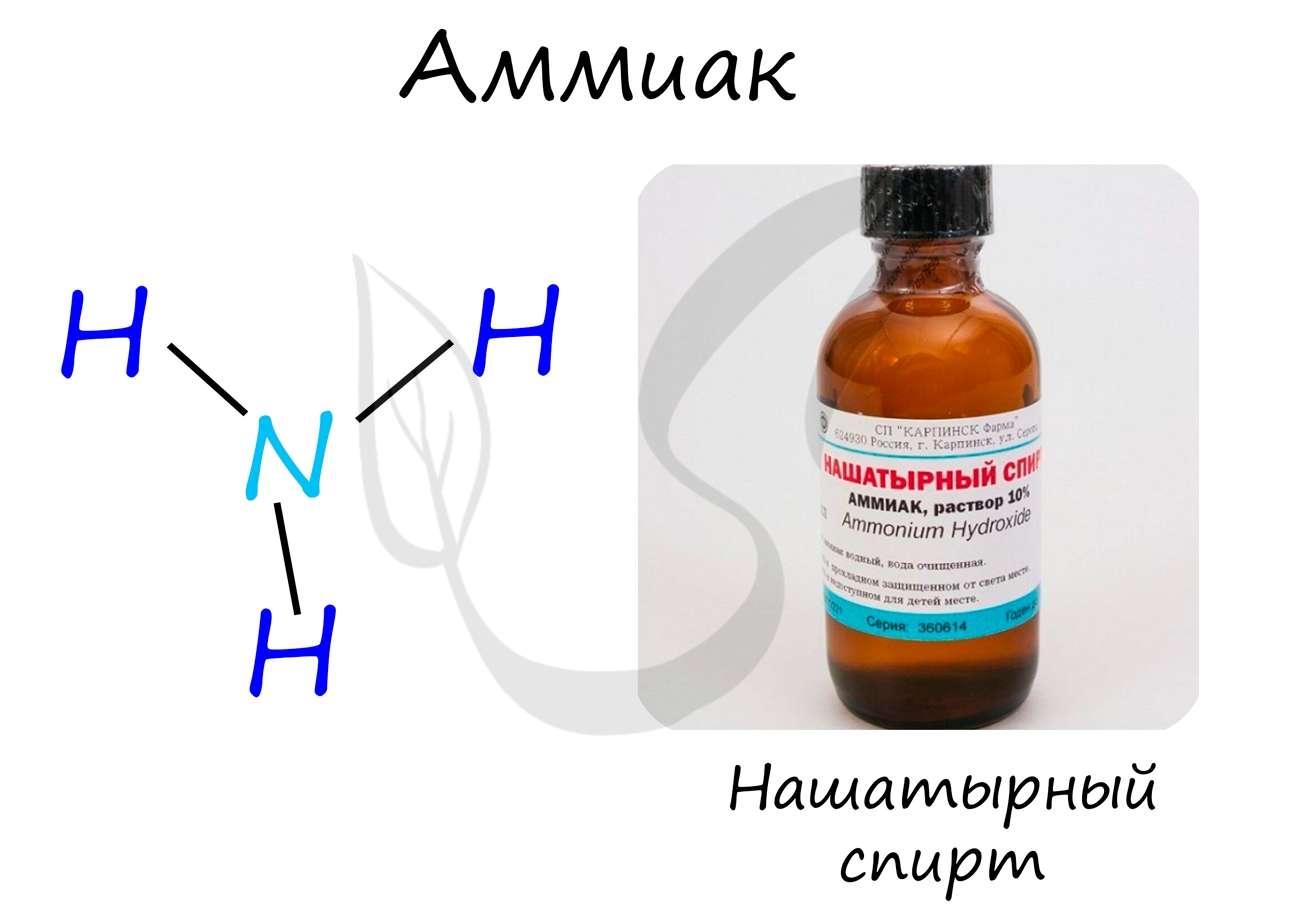
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем
охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 + H2O → H3AsO4 + NO↑
As2O3 + HNO3 + H2O → H3AsO4 + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2—).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Задание №1
Из предложенного списка соединений выберите те, в которых атом азота проявляет степень окисления -3. Число верных ответов может быть любым.
- 1. NH3
- 2. NF3
- 3. NH4Cl
- 4. N2O3
- 5. HCN
Решение
Ответ: 135
Задание №2
Из предложенного списка соединений выберите те, в которых атом азота проявляет степень окисления +1. Число верных ответов может быть любым.
- 1. NO
- 2. NH4HCO3
- 3. N2O
- 4. NO2
- 5. NH4I
Решение
Ответ: 3
Задание №3
Из предложенного списка соединений выберите те, в которых атом азота проявляет степень окисления +2. Число верных ответов может быть любым.
- 1. N2
- 2. NO
- 3. NH3
- 4. Cl3N
- 5. K3N
Решение
Ответ: 2
Задание №4
Из предложенного списка соединений выберите те, в которых атом азота проявляет степень окисления +3. Число верных ответов может быть любым.
- 1. KNO3
- 2. NaNO2
- 3. NH3
- 4. NH4NO2
- 5. N2O3
Решение
Ответ: 245
Задание №5
Из предложенного списка соединений выберите те, в которых атом азота проявляет степень окисления +4. Число верных ответов может быть любым.
- 1. CsNO2
- 2. N2O3
- 3. N2O
- 4. NO2
- 5. KNO3
Решение
Ответ: 4
Задание №6
Из предложенного списка соединений выберите те, в которых атом азота проявляет степень окисления +5. Число верных ответов может быть любым.
- 1. NO2
- 2. N2O5
- 3. HNO2
- 4. HNO3
- 5. Ca(NO3)2
Решение
Ответ: 245
Задание №7
Из предложенного списка соединений выберите те, в которых атом азота проявляет валентность, равную III. Число верных ответов может быть любым.
1) аммиак
2) оксид азота(V)
3) фторид азота(III)
4) хлорид аммония
5) гидрокарбонат аммония
Решение
Ответ: 13
Задание №8
Из предложенного списка соединений выберите те, в которых атом азота проявляет валентность, равную IV. Число верных ответов может быть любым.
1) азотная кислота
2) нитрат аммония
3) аммиак
4) нитрид кальция
5) оксид азота(II)
Решение
Ответ: 12
Задание №9
Из предложенного списка соединений выберите те, в которых атом азота проявляет валентность, не равную степени окисления. Число верных ответов может быть любым.
1) нитрат калия
2) азотистая кислота
3) азотная кислота
4) аммиак
5) хлорид аммония
Решение
Ответ: 135
Задание №10
Из предложенного списка соединений выберите те, в которых атом азота проявляет низшую степень окисления. Число верных ответов может быть любым.
1) нитрид натрия
2) нитрат натрия
3) нитрит калия
4) нитрат аммония
5) сульфид аммония
Решение
Ответ: 145
[adsp-pro-3]
Задание №11
Из предложенного списка соединений выберите те, в которых атом азота образует связь по донорно-акцепторному механизму. Число верных ответов может быть любым.
1) азотная кислота
2) карбонат аммония
3) аммиак
4) сульфат аммония
5) нитрид магния
Решение
Ответ: 124
Задание №12
Из предложенного списка частиц выберите те, которые могут проявлять только окислительные свойства. Число верных ответов может быть любым.
- 1. NO2—
- 2. NO3—
- 3. N3-
- 4. S2-
- 5. SO32-
Решение
Ответ: 2
Задание №13
Из предложенного списка частиц выберите те, которые могут проявлять только восстановительные свойства. Число верных ответов может быть любым.
- 1. Cl—
- 2. NO2—
- 3. N3-
- 4. S2-
- 5. SO42-
Решение
Ответ: 134
Задание №14
Из предложенного списка частиц выберите те, которые могут проявлять как окислительные, так и восстановительные свойства. Число верных ответов может быть любым.
- 1. SO32-
- 2. NO2—
- 3. NO3—
- 4. PO43-
- 5. N3-
Решение
Ответ: 12
Задание №15
Из предложенного списка частиц выберите те, которые не проявляют окислительных свойств. Число верных ответов может быть любым.
- 1. Br—
- 2. NO2—
- 3. NO3—
- 4. N3-
- 5. S2-
Решение
Ответ: 145
Задание №16
Из предложенного списка соединений выберите те, которые имеют заметную окраску. Число верных ответов может быть любым.
- 1. NH3
- 2. NO
- 3. N2O
- 4. NO2
- 5. Cl2
Решение
Ответ: 45
Задание №17
Из предложенного списка соединений выберите те, которые не имеют заметной окраски. Число верных ответов может быть любым.
- 1. Br2
- 2. I2
- 3. N2
- 4. NO2
- 5. NO
Решение
Ответ: 35
Задание №18
Из предложенного списка соединений выберите те, которые взаимодействуют с кислородом. Число верных ответов может быть любым.
- 1. N2O5
- 2. NO
- 3. NH3
- 4. KNO3
- 5. N2
Решение
Ответ: 235
Задание №19
Из предложенного списка соединений выберите те, которые не взаимодействуют с кислородом. Число верных ответов может быть любым.
- 1. HNO3
- 2. NO
- 3. СO2
- 4. SO2
- 5. SO3
Решение
Ответ: 135
Задание №20
Из предложенного списка соединений выберите те, которые взаимодействуют со щелочами. Число верных ответов может быть любым.
1) аммиак
2) оксид азота (I)
3) оксид азота (II)
4) оксид азота (III)
5) оксид азота (IV)
Решение
Ответ: 45
[adsp-pro-3]
Задание №21
Из предложенного списка соединений выберите те, которые не взаимодействуют со щелочами. Число верных ответов может быть любым.
1) азот
2) оксид азота (I)
3) оксид азота (II)
4) оксид азота (III)
5) оксид азота (V)
Решение
Ответ: 123
Задание №22
Из предложенного списка соединений выберите те, которые не проявляют кислотно-основных свойств. Число верных ответов может быть любым.
1) аммиак
2) оксид азота (I)
3) оксид азота (II)
4) оксид азота (III)
5) оксид азота (IV)
Решение
Ответ: 23
Задание №23
Из предложенного списка соединений выберите те, которые проявляют выраженные основные свойства. Число верных ответов может быть любым.
1) аммиак
2) азот
3) оксид азота (II)
4) оксид азота (III)
5) оксид азота (V)
Решение
Ответ: 1
Задание №24
Из предложенного списка соединений выберите те, которые взаимодействуют с аммиаком. Число верных ответов может быть любым.
1) кислород
2) гидроксид натрия
3) хлороводород
4) водород
5) оксид меди (II)
Решение
Ответ: 135
Задание №25
Из предложенного списка соединений выберите те, которые взаимодействуют с азотом. Число верных ответов может быть любым.
1) медь
2) цезий
3) литий
4) свинец
5) кальций
Решение
Ответ: 235
Задание №26
Из предложенного списка соединений выберите те, которые взаимодействуют с веселящим газом. Число верных ответов может быть любым.
1) графит
2) кислород
3) медь
4) азот
5) гидроксид калия
Решение
Ответ: 13
Задание №27
Из предложенного списка соединений выберите те, которые не взаимодействуют с аммиаком. Число верных ответов может быть любым.
1) водород
2) кислород
3) оксид серебра
4) азотная кислота
5) плавиковая кислота
Решение
Ответ: 1
Задание №28
Из предложенного списка соединений выберите те, которые не взаимодействуют с азотом. Число верных ответов может быть любым.
1) кислород
2) водород
3) хлор
4) сера
5) магний
Решение
Ответ: 34
Задание №29
Из предложенного списка соединений выберите те, которые взаимодействуют с оксидом азота(II). Число верных ответов может быть любым.
1) гашеная известь
2) мел
3) цинк
4) кислород
5) хлор
Решение
Ответ: 345
Задание №30
Из предложенного списка соединений выберите те, которые взаимодействуют с оксидом азота(IV). Число верных ответов может быть любым.
1) едкий натр
2) вода
3) азотная кислота
4) графит
5) медь
Решение
Ответ: 1245
[adsp-pro-3]
Задание №31
Из предложенного списка соединений выберите те, которые не взаимодействуют с бурым газом. Число верных ответов может быть любым.
1) нитрат калия
2) сульфит калия
3) вода
4) азот
5) веселящий газ
Решение
Ответ: 145
Задание №32
Из предложенного списка соединений выберите те, которые взаимодействуют с нитритом калия. Число верных ответов может быть любым.
1) иодоводородная кислота
2) перекись водорода
3) соляная кислота
4) гидроксид калия
5) негашеная известь
Решение
Ответ: 123
Задание №33
Из предложенного списка соединений выберите те, которые взаимодействуют с оксидом азота(V). Число верных ответов может быть любым.
1) вода
2) азотная кислота
3) гашеная известь
4) нитрат натрия
5) кислород
Решение
Ответ: 13
Задание №34
Из предложенного списка соединений выберите те, которые не взаимодействуют с нитритом натрия. Число верных ответов может быть любым.
1) хлорид калия
2) хлорид бария
3) хлорид аммония
4) соляная кислота
5) серная кислота
Решение
Ответ: 12
Задание №35
Из предложенного списка соединений выберите те, которые взаимодействуют с хлоридом аммония. Число верных ответов может быть любым.
1) едкий натр
2) гашеная известь
3) азот
4) серная кислота (конц.)
5) водород
Решение
Ответ: 124
Задание №36
Из приведенных пар соединений выберите те, между которыми возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
1) азот + медь
2) азот + магний
3) азот + серебро
4) азот + оксид алюминия
5) азот + оксид магния
Решение
Ответ: N2 + 3Mg = Mg3N2
Задание №37
Из приведенных пар соединений выберите те, между которыми возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
1) аммиак + водород
2) аммиак + сера
3) аммиак + гидроксид калия
4) аммиак + сероводород
5) аммиак + медь
Решение
Ответ:
2NH3 + H2S = (NH4)2S
или
NH3 + H2S = NH4HS
Задание №38
Из приведенных пар соединений выберите те, между которыми возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
1) оксид азота (III) + песок
2) оксид азота (III) + поваренная соль
3) оксид азота (III) + едкий натр
4) оксид азота (III) + нитрат свинца
5) оксид азота (III) + азот
Решение
Ответ: N2O3 + 2NaOH = 2NaNO2 + H2O
Задание №39
Из приведенных пар соединений выберите те, между которыми возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
1) оксид азота (IV) + азот
2) оксид азота (IV) + медь
3) оксид азота (IV) + золото
4) оксид азота (IV) + алмаз
5) оксид азота (IV) + веселящий газ
Решение
Ответ: 2NO2 + 4Cu = 4CuO + N2
Задание №40
Из приведенных пар соединений выберите те, между которыми возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
1) нитрит калия + азот
2) нитрит калия + водород
3) нитрит калия + хлорид натрия
4) нитрит калия + перекись водорода
5) нитрит калия + сульфат бария
Решение
Ответ: KNO2 + H2O2 = KNO3 + H2O
[adsp-pro-3]
Задание №41
Из приведенных пар соединений выберите те, между которыми возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
1) оксид азота (V) + кислород
2) оксид азота (V) + вода
3) оксид азота (V) + азот
4) оксид азота (V) + серный ангидрид
5) оксид азота (V) + углекислый газ
Решение
Ответ: N2O5 + H2O = 2HNO3
Задание №42
В заданной схеме превращений
NH3 X
Y
Веществами X и Y являются соответственно
1) азот
2) бурый газ
3) оксид азота (II)
4) оксид азота (III)
5) азотная кислота
Первым укажите X, вторым — Y
Решение
Ответ: 32
Задание №43
В заданной схеме превращений
X Y
N2
Веществами X и Y являются соответственно
1) аммиак
2) азот
3) сульфат аммония
4) оксид азота (II)
5) нитрит калия
Первым укажите X, вторым — Y
Решение
Ответ: 31
Задание №44
В заданной схеме превращений
NO2 X
NH3
Веществами X и Y являются соответственно
1) оксид азота (II)
2) оксид азота (I)
3) азот
4) водород
5) оксид азота (III)
Первым укажите X, вторым — Y
Решение
Ответ: 34
Задание №45
В заданной схеме превращений
KNO2 X
Y
Веществами X и Y являются соответственно
1) азот
2) оксид азота (II)
3) оксид азота (IV)
4) оксид азота (I)
5) аммиак
Первым укажите X, вторым — Y
Решение
Ответ: 23
Задание №46
В заданной схеме превращений
NO2 X
Y
Веществами X и Y являются соответственно
1) бурый газ
2) аммиак
3) азотистая кислота
4) нитрат аммония
5) азотная кислота
Первым укажите X, вторым — Y
Решение
Ответ: 54
Задание №47
В заданной схеме превращений
Mg X
Y
Веществами X и Y являются соответственно
1) нитрит магния
2) аммиак
3) нитрат магния
4) хлорид аммония
5) нитрид магния
Первым укажите X, вторым — Y
Решение
Ответ: 54
Задание №48
Запишите уравнение реакции хлорида аммония с гашеной известью. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
Задание №49
Запишите уравнение реакции карбоната аммония с соляной кислотой. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: (NH4)2СO3 + 2HCl = 2NH4Cl + CO2 + H2O
Задание №50
Запишите уравнение реакции аммиака с соляной кислотой. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: NH3 + HCl = NH4Cl
[adsp-pro-3]
Задание №51
Запишите уравнение реакции избытка аммиака с серной кислотой. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 2NH3 + H2SO4 = (NH4)2SO4
Задание №52
Запишите уравнение реакции углекислого газа с избытком раствора аммиака. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 2NH3 + CO2 + H2O = (NH4)2CO3
Задание №53
Смешали водные растворы аммиака и хлорида железа (III). Запишите уравнение проведенной реакции. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 3NH3 + FeCl3 + 3H2O = Fe(OH)3 + 3NH4Cl
Задание №54
Смешали водные растворы аммиака и сульфата хрома (III). Запишите уравнение проведенной реакции. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 6NH3 + Cr2(SO4)3 + 6H2O = 2Cr(OH)3 + 3(NH4)2SO4
Задание №55
Запишите уравнение реакции нитрида калия с водой. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: K3N + 3H2O = 3KOH + NH3
Задание №56
Запишите уравнение реакции нитрида кальция с избытком водного раствора соляной кислоты. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: Ca3N2 + 8HCl = 3CaCl2 + 2NH4Cl
Задание №57
Запишите уравнение реакции горения аммиака. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 4NH3 + 3O2 = 2N2 + 6H2O
Задание №58
Запишите уравнение взаимодействия аммиака с кислородом в присутствии катализатора. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 4NH3 + 5O2 = 4NO + 6H2O
Задание №59
Запишите уравнение реакции термического разложения нитрита аммония. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: NH4NO2 = N2 + 2H2O
Задание №60
Запишите уравнение реакции термического разложения нитрата аммония. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: NH4NO3 = N2O + 2H2O
[adsp-pro-3]
Задание №61
Смешали горячие водные растворы хлорида аммония и нитрита калия. Запишите уравнение проведенной реакции. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: NH4Cl + KNO2 = KCl + N2 + 2H2O
Задание №62
Запишите уравнение реакции термического разложения гидрокарбоната аммония. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: NH4HCO3 = NH3 + CO2 + H2O
Задание №63
Запишите уравнение реакции термического разложения дихромата аммония. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Задание №64
Запишите уравнение реакции, протекающей между азотом и литием. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 6Li + N2 = 2Li3N
Задание №65
Запишите уравнение реакции азота и водорода в присутствии катализатора. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: N2 + 3H2 = 2NH3
Задание №66
Запишите уравнение реакции, происходящей при сильном нагревании смеси азота и кислорода. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: N2 + O2 = 2NO
Задание №67
Запишите уравнение реакции, протекающей при взаимодействии веселящего газа с раскаленными медными опилками. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: N2O + Cu = CuO + N2
Задание №68
Запишите уравнение реакции окисления оксида азота (II) на воздухе. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 2NO + O2 = 2NO2
Задание №69
Запишите уравнение реакции оксида азота (III) и едкого кали. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: N2O3 + 2KOH = 2KNO2 + H2O
Задание №70
К водному раствору, содержащему перманганат калия и серную кислоту, добавили водный раствор нитрита калия. Запишите уравнение проведенной реакции.
В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + K2SO4 + 2MnSO4 + 3H2O
[adsp-pro-3]
Задание №71
К водному раствору, содержащему йодид калия и серную кислоту, добавили нитрит калия.
Запишите уравнение проведенной реакции. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 2KNO2 + 2KI + 2H2SO4 = 2K2SO4 + 2NO + I2 + 2H2O
Задание №72
К водному раствору, содержащему дихромат калия и серную кислоту, прибавили водный раствор нитрита натрия. Запишите уравнение проведенной реакции.
В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 3NaNO2 + K2Cr2O7 + 4H2SO4 = 3NaNO3 + K2SO4 + Cr2(SO4)3 + 4H2O
Задание №73
Запишите уравнение реакции, протекающей между сульфатом железа (II) и нитритом калия в присутствии серной кислоты. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 2KNO2 + 2FeSO4 + 2H2SO4 = K2SO4 + Fe2(SO4)3 + 2NO + 2H2O
Задание №74
Над раскаленной медной стружкой пропустили бурый газ. Запишите уравнение проведенной реакции.
В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 2NO2 + 4Cu = 4CuO + N2
Задание №75
Через водный раствор гидроксида калия пропустили бурый газ. Запишите уравнение проведенной реакции.
В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 2NO2 + 2KOH = KNO2 + KNO3 + H2O
Задание №76
Смесь бурого газа с избытком кислорода пропустили через воду. Запишите уравнение проведенной реакции.
В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 4NO2 + O2 + 2H2O = 4HNO3
Задание №77
Запишите уравнение реакции газообразного аммиака с оксидом меди (II) при нагревании. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: 2NH3 + 3CuO = 3Cu + N2 + 3H2O
Задание №78
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) азот Б) цинк В) бурый газ |
1) едкий натр, медь, гашеная известь 2) серная кислота, сера, кислород 3) плавиковая кислота, вода, аммиак 4) водород, литий, кальций |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 421
Задание №79
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) бромид аммония Б) гидрокарбонат аммония В) оксид азота (V) |
1) аммиак, едкий натр, соляная кислота 2) едкое кали, хлор, едкий натр 3) вода, оксид цинка, негашеная известь 4) вода, азот, водород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 213
Задание №80
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) хлор Б) азот В) аммиак |
1) вода, соляная кислота, серная кислота 2) вода, медь, гидроксид рубидия 3) водород, цезий, кислород 4) вода, водород, азот |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 231
[adsp-pro-3]
Задание №81
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) серная кислота Б) нитрит натрия В) нитрид лития |
1) сера, цинк, хлорид бария 2) азотная кислота, перекись водорода, иодид калия 3) плавиковая кислота, водород, азот 4) бромоводородная кислота, вода, серная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 124
Задание №82
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) оксид азота (II) Б) сернистый газ В) азот |
1) водород, кислород, литий 2) кислород, медь, цинк 3) едкий натр, сульфит натрия, кислород 4) вода, цинк, серебро |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 231
Задание №83
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) гидрокарбонат аммония Б) фторид аммония В) аммиак |
1) нитрат лития, хлорид бария, едкое кали 2) едкий натр, вода, аргон 3) серная кислота, едкий натр, аммиак 4) соляная кислота, плавиковая кислота, кислород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 314
Задание №84
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) нитрат серебра Б) карбонат аммония В) бурый газ |
1) гашеная известь, соляная кислота, нитрат бария 2) едкий натр, магний, вода 3) соляная кислота, угарный газ, углекислый газ 4) хлорид калия, фосфат натрия, бромоводород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 412
Задание №85
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) хлорид бария Б) бромид аммония В) азот |
1) водород, рубидий, барий 2) едкий натр, хлор, нитрат серебра 3) нитрат серебра, нитрат свинца, сульфат натрия 4) аммиак, хлор, йод |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 321
Задание №86
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) карбонат калия Б) бурый газ В) аммиак |
1) вода, соляная кислота, серная кислота 2) едкий натр, мел, азот 3) соляная кислота, серная кислота, гидроксид бария 4) цинк, вода, медь |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 341
Задание №87
Вычислите объем газа, образующийся при взаимодействии 100 г едкого натра с 53,5 г хлорида аммония. Ответ приведите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 22,4
Задание №88
Определите массовую долю соли в растворе, полученном при пропускании 6,72 л аммиака через 162,5 г 10%-ного раствора хлорного железа. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 10,23
Задание №89
Рассчитайте массу твердого остатка, полученного при пропускании 1,12 л аммиака над раскаленным оксидом меди (II) массой 20 г. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения). Решение
Ответ: 18,8
Задание №90
Вычислите массовую долю щелочи в растворе, полученном при пропускании 2,24 л бурого газа в 100 г 10%-ного раствора гидроксида натрия. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 5,74
[adsp-pro-3]
Задание №91
Определите массу йода, которую можно получить, исходя из 8,5 г нитрита калия и избытка сернокислого раствора йодида калия. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 12,7
Задание №92
Навеску смеси гидрокарбонатов натрия и аммония массой 10 г прокалили до постоянной массы. Остаток обработали соляной кислотой и получили 1,12 л газа. Определите массовую долю гидрокарбоната аммония в исходной смеси. Ответ приведите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 16
Задание №93
Определите объем кислорода, необходимый для каталитического горения 11,2 л аммиака. Ответ приведите в литрах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 14
Задание №94
Навеску нитрида магния массой 10 г растворили в 169,5 мл 18,25%-ного раствора соляной кислоты (плотность 1,18 г/см3). Определите массовую долю кислоты в полученном растворе. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 3,48
Задание №95
Навеску смеси сульфата и карбоната аммония растворили в воде и добавили избыток хлорида бария. Масса выпавшего осадка составила 21,5 г. Если такую же навеску обработать избытком соляной кислоты, то выделяется 1,12 л газа. Определите массовую долю сульфата аммония в исходной смеси. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 57,9
Задание №96
Твердое вещество, полученное при пропускании 11,2 л бурого газа через избыток раскаленных магниевых опилок, обработали водой. Полученный газ поглотили 100 г 20%-ного водного раствора соляной кислоты. Рассчитайте массовую долю кислоты в полученном растворе. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 1,6
[adsp-pro-10]
Предложите, как улучшить StudyLib
(Для жалоб на нарушения авторских прав, используйте
другую форму
)
Ваш е-мэйл
Заполните, если хотите получить ответ
Оцените наш проект
1
2
3
4
5
Пробники ЕГЭ ↓
Математика,
Физика,
Информатика,
Химия,
Русский,
Обществознание,
Литература,
История,
Иностранные языки,
География,
Биология
19 апреля 2013
В закладки
Обсудить
Жалоба
Азот и его соединения в формате ЕГЭ
Вариант КИМ ЕГЭ 2013 года, содержание которого связано со свойствами азота и его соединений.
Все предложенные задания полностью соответствуют спецификации контрольных измерительных материалов для проведения ЕГЭ в 2013 году.
Тема «Азот и его соединения» традиционно вызывает затруднения у учащихся, но знание особенностей строения и свойств азота и его соединений востребовано в заданиях по общей, неорганической и органической химии, как базового, так и повышенного и высокого уровня.
Данная разработка демонстрирует возможности использования материала одной темы в каждом задании всех блоков содержания ЕГЭ по химии и может быть использована как при подготовке к ЕГЭ, так и для традиционного контроля знаний учащихся.
azot-himiya-ege.docx
Людмила Николаевна Хитрова.

