Взаимосвязь различных классов неорганических веществ
Рассмотрим её на нескольких примерах.
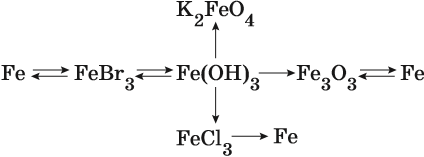
Пример 1. Взаимосвязь соединений железа.
Переход из железа в бромид железа (II) возможен при реакции железа с бромоводородной кислотой:
Получить из бромида железа (II) чистое железо можно при электролизе расплава:
При добавлении к бромиду железа (II) щёлочи образуется гидроксид железа (II):
Обратный переход возможен при взаимодействии гидроксида железа (II) с бромоводородной кислотой:
Окисление гидроксида железа (II) приводит к гидроксиду железа (III):
При нагревании гидроксид железа (II) теряет воду, превращаясь в оксид железа (II):
Восстановление оксида железа (II) приводит к железу:
Пример 2. Взаимосвязь соединений железа.
Реакция железа с бромом приводит к бромиду железа (III):
Получить из этого соединения железо можно электролизом расплава:
Переход из бромида железа (III) в гидроксид железа (III) возможен под действием щёлочи:
При нагревании гидроксид железа (III) теряет воду, превращаясь в оксид железа (III):
Восстановлением оксида железа (III) можно получить железо:
Железо в степени окисления +6 можно получить из гидроксида железа (III) по реакции:
Гидроксид железа (III) под действием соляной кислоты переходит в хлорид железа (III):
Из хлорида железа (III) электролизом можно получить железо:
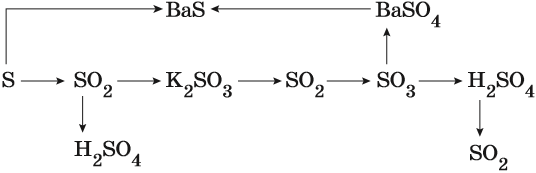
Пример 3. Взаимосвязь соединений серы.
Сера окисляется кислородом воздуха до оксида серы (IV):
Взаимодействие серы с водородом приводит к сероводороду:
Оксид серы (IV) может вступить в окислительно-восстановительную реакцию с образованием серной кислоты или в обменную реакцию с образованием сульфита калия:
Под действием сильных кислот сульфит калия разлагается до SO2:
Каталитическое окисление SO2 приводит к оксиду серы (VI):
Из оксида серы (VI) можно получить как серную кислоту, так и сульфат бария:
Из сульфата бария восстановлением углём можно получить сульфид бария:
Восстановление SO2 приводит к сере:
Пример 4. Осуществить следующую цепочку превращений: N2 → NH3 → (NH4)2SO4 → NH4Cl.
Азот взаимодействует с водородом при повышенной температуре в присутствии катализатора с образованием аммиака:
Реакция газообразного аммиака с серной кислотой приводит к сульфату аммония:
При взаимодействии водных растворов сульфата аммония и хлорида бария образуется нерастворимый сульфат бария, эта реакция идёт до конца. После отделения осадка и упаривания водного раствора можно выделить чистый хлорид аммония:
Пример 5. Осуществить следующую цепочку превращений: NO2 → HNO3 → NH4NO3 → N2O.
Оксид азота (IV) при взаимодействии с кислородом и водой даёт азотную кислоту:
При реакции азотной кислоты с аммиаком образуется нитрат аммония:
Контролируемое разложение нитрата аммония приводит к образованию оксида азота (I) и воды:
Пример 6. Осуществить следующую цепочку превращений: NaBr → NaCl → Cl2 → KClO.
Хлор способен вытеснять бром из бромидов:
Электролиз расплава хлорида натрия приводит к образованию молекулярного хлора:
Гипохлорид калия образуется при взаимодействии газообразного хлора с водным раствором гидроксида калия при охлаждении:
Особенностью заданий, в которых требуется определить неизвестное вещество Х как промежуточный продукт в цепочке химических превращений, является принципиальная возможность наличия нескольких правильных ответов. Вам нужно обосновать свой выбор.
Пример 7. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
Каким же может быть вещество X1? Возможны несколько вариантов. Предположим, что марганец в этом соединении имеет степень окисления +2, тогда этим веществом будет, например, сульфат марганца (II). Почему? Из него удобно получит хлорид марганца (II) с помощью обменной реакции:
Данная реакция пойдёт до конца, потому что сульфат бария выпадет в осадок.
Перманганат калия — сильный окислитель, который при реакции с восстановителем в кислой среде может понизить свою степень окисления до +2. Чтобы получить сульфат марганца (II) из перманганата калия, можно использовать окислительно-восстановительную реакцию:
Другой вариант ответа:
Из хлорида марганца (II) можно получить нитрат марганца (II) с помощью обменной реакции с нитратом серебра. Эта реакция идёт до конца благодаря образованию нерастворимого хлорида серебра:
Термическое разложение нитрата марганца (II) — обычный способ получения оксида марганца (IV):
Пример 8. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
Наиболее рациональным вариантом будет следующий. Вначале железо под действием хлора окисляется до хлорида железа (III) (вещество X1), из которого по обменной реакции получают гидроксид железа (III):
Веществом (X2) может быть любая растворимая соль железа (III), например сульфат, нитрат и т. д.:
Под действием расчётного количества щёлочи в осадок выпадает гидроксид железа (III):
Тренировочные задания
Общее задание 1. Составьте уравнения реакций, с помощью которых можно осуществить следующие цепочки превращений:
1. Al → AlCl3 → Al(OH)3 → KAlO2 → K[Al(OH)4] → Al(OH)3.
2. Ca3(PO4)2 → P → P2O5 → → Ca(H2PO4)2 → CaHPO4 → Ca3(PO4)2.
3. FeS → H2S → S → SO2 → NaHSO3 → BaSO3 → BaSO4.
4. Cl2 → CaOCl2 → CaCO3 → CaO → → CaC2 → Ca(OH)2 → Ca(HSO3)2.
5. Ca3(PO4)2 → P → P2O5 → H3PO4.
6. NH4NO2 → N2 → NH3 → NH4NO3.
7. P → Ca3P2 → PH3 → H3PO4.
8. NH3 → N2 → Mg3N2 → NH3.
9. KNO2 → NO → NO2 → HNO3.
10. H2SO4 → SO2 → SO3 → H2SO4.
11. HCl → Cl2 → KClO3 → Cl2.
12. Cl2 → NaCl → HCl → AlCl3.
13. KCl → Cl2 → NaClO → NaClO3.
14. HBr → NaBr → Br2 → HBr.
15. KBr → Br2 → HBr → NaBr.
16. NaCl → HCl → Cl2 → KClO3.
17. Mg → Mg3N2 → NH3 → Al(OH)3.
18. Ba(NO3)2 → Fe(NO3)2 → Fe2O3 → Fe.
Общее задание 2. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте ваш выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
1. Cu(NO3)2 → X1 → CuCl2 → X2 → Cu(OH)2.
2. FeS → X1 → Fe2O3 → X2 → FeS.
3. H3PO4 → X1 → P → X2 → H3PO4.
4. SiO2 → Si → X → BaSiO3.
5. MgSO4 → X1 → MgI2 → X2 → Mg(OH)2.
6. KNO2 → X1 → NO2 → X2 → Ba(NO3)2.
Ответы
Чтобы поделиться, нажимайте
Схемы (цепочки) превращений неорганических веществ. Часть 1
Предлагаем вашему вниманию задания по химии по теме Схемы (цепочки) превращений неорганических веществ, с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
1. Для осуществления превращения по схеме
BaHPO4→H3PO4→NH4H2PO4→Na3PO4→Na2SO4, выберите реагенты из предложенных: 1 – хлорид натрия 2 – гидроксид натрия 3 – карбонат аммония 4 – сульфат аммония 5 – концентрированная серная кислота. Ответ запишите цифрами в порядке следования превращений, например 2123. Помните, что один и тот же реагент может использоваться несколько раз, а другой не использоваться вообще.
2. Укажите вещества, которые необходимо использовать для превращений:
P→ P2O3 → P2O5 →Ba3(PO4)2 →BaHPO4 → Ba(H2PO4)2 → H3PO4.
1) вода;2) кислород;3) оксид бария;4) хлорид бария;5) серная кислота.
Ответ запишите цифрами в порядке следования превращений. К примеру: 233415.
3. 
4.
5.
6. Имеется схема превращений:
1) S8 → SO2;
2) SO2→ NaHSO3;
3) NaHSO3→ Na2SO3;
4) Na2SO3→ NaNO3.
И имеются реактивы для этих превращений:
1 – KNO3;
2 – NaOH;
3 – O2;
4 – Ba(NO3)2;
5 – NaCl.
Ответ запишите цифрами реактивов в порядке следования превращений без запятых (реактивы могут использоваться несколько раз или не использоваться вообще).
7. Найдите сумму молярных масс (г/моль) медьсодержащего вещества В и азотсодержащего вещества E, образующихся по схеме превращений:
8. Найдите сумму молярных масс (г/моль) простого вещества Б и натрийсодержащего вещества Д, образовавшихся в результате превращений (вещество В имеет молекулярное строение):
9. Для получения веществ по схеме превращений: CuI2→ CuCl2 →Cu(NO3)2 → Zn(NO3)2 →Zn(OH)2 выберите реагенты из предложенных:
1 – ZnCl2; 2 – HNO3; 3 – Zn; 4 – NH3 (p-p); 5 – AgNO3; 6 – Cl2; 7 – H2O.
Ответ запишите цифрами в порядке следования превращений, например 1235.
10.
11. Запишите цифрами реактивы (по порядку), которые следует использовать для превращений:
Be→BeO→Na2[Be(OH)4]→BeCl2→Be(OH)2→Na2BeO2;
-
KCl(р-р);
-
O2;
-
NaOH (тв.);
-
H2O;
-
NaOH (р-р);
-
HСl (р-р).
12. Имеется схема превращений: NaBr → NaF → NaCl → HCl → FeCl2. Выберите реагенты для этих превращений соответственно: 1) H2SO4конц., t; 2) HF (p-p); 3) FeCl2; 4) AgF; 5) Fe.
Ответ запишите цифрами в порядке следования превращений, например, 1342.
13. Для получения веществ по указанной схеме превращений Na2CO3 → NaOH → NaHS → H2S → H2→ выберите реагенты из предложенных: 1 – раствор сероводорода; 2 –натрий; 3 –сульфид кальция; 4 –хлорид натрия; 5 –разбавленная серная кислота; 6 – гидроксид бария. Ответ запишите цифрами в порядке следования превращений, например: 1244.
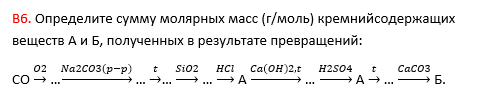
14. Определите сумму молярных масс (г/моль) натрийсодержащих веществ А и Б, полученных в результате превращений:
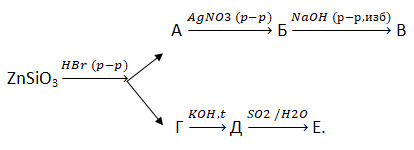
15. Для осуществления превращений по схеме  выберите вещества А – Д из предложенных:
выберите вещества А – Д из предложенных:
1 – карбонат натрия;
2 – натрий;
3 – гидроксид натрия;
4 – серная кислота;
5 – гидрокарбонат натрия;
6 – оксид углерода (IV).
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв, например: А1Б2В4Г3Д6.
16. 
17. 
18. Дана схема превращений, в которой каждая химическая реакция обозначена буквой:
Для осуществления этих превращений выберите по одному реагенту на каждую реакцию из предложенных:
-
KNO3; 6. FeSO4;
-
Ba(OH)2; 7. PbSO4;
-
HNO3; 8. CuO;
-
CuCl2; 9. C2H5CHO;
-
Cu; 10. SO2 (водн).
Ответ запишите в виде сочетания букв и цифр, например А4Б4В2Г3Д5Е6. Помните, что некоторые реактивы могут использоваться несколько раз, а некоторые не использоваться вообще.
19. В схеме превращений каждая реакция обозначена буквой:
 Для каждой реакции, зашифрованной буквой, подберите один реактив, обозначенный цифрой из предложенных ниже. Ответ запишите в виде А1Б7В4Г5.
Для каждой реакции, зашифрованной буквой, подберите один реактив, обозначенный цифрой из предложенных ниже. Ответ запишите в виде А1Б7В4Г5.
1) ZnCl2; 2) H2O; 3) NaOH; 4) NH3;
5) Al(OH)3; 6) C2H5CHO; 7) C2H6;  HgCl2.
HgCl2.
Ответ:
20. Определите сумму молярных масс (г/моль) натрийсодержащего вещества В и серодсодержащего вещества Е, в котором массовая доля серы равна 26,7%:
Ответы:
Развернуть/свернуть
1. 5325
2. 223555
3. 127
4. 354
5. 184
6. 3224
7. 165
8. 168
9. 6534
10. 287
11. 25653
12. 4315
13. 6152
14. 144
15. А6Б3В5Г1Д4
16. А2Б3В5Г4Д6
17. 194
18. А2Б6В2Г4Д9Е3
19. А6Б4В8Г3
20. 299
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть пробные и реальные варианты ЕГЭ вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Больше заданий РТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЦТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЕГЭ вы можете найти здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.
В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:
Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.
Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.
Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
Все реакции из заданий 32, которые могут вызвать затруднения при составлении. На ЕГЭ 99% реакций в заданиях 32 будут либо они, либо аналогичные.
1) Si + 2Cl2 SiCl4
2) SiCl4 + 3H2O H2SiO3 + 4HCl
3) Ca3(PO4)2 + 5C + 3SiO2 2P + 5CO + 3CaSiO3
4) Ca3N2 + 6H2O 3Ca(OH)2 + 2NH3↑
5) 2NH3 + 3CuO 3Cu + 3H2O + N2↑
6) Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2H2O
7) 2Cu(NO3)2 2CuO + 4NO2 + O2↑

2Fe2O3 + 4SO2↑
9) 2H2S + SO2 3S↓ + 2H2O
10) S + 6HNO3 H2SO4 + 6NO2↑ + 2H2O
11) 4Al(NO3)3 2Al2O3 + 12NO2↑ + 3O2↑
12) 2Al2O3 4Al + 3O2↑ (электролиз раствора Al2O3 в расплаве криолита)
13) 3KNO3 + 8Al + 5KOH + 18H2O 3NH3↑ + 8K[Al(OH)4]
14) CrO3 + 2KOH K2CrO4 + H2O
15) 2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O
16) 14HBr + K2Cr2O7 2CrBr3 + 3Br2 + 7H2O + 2KBr
17) H2S + Br2 S↓ + 2HBr
18) 3Mg + N2 Mg3N2
19) Mg3N2 + 6H2O 3Mg(OH)2↓ + 2NH3↑
20) Cr2(SO4)3 + 6NH3 + 6H2O 2Cr(OH)3↓ + 3(NH4)2SO4
21) 2Cr(OH)3 + 4KOH + 3H2O2 2K2CrO4 + 8H2O
22) 2Ag + 2H2SO4(конц.) Ag2SO4 + SO2↑ + 2H2O
23) 2KClO3 2KCl + 3O2↑ (в присутствии кат-ра)
24) 3Fe + 2O2 Fe3O4
25) Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O
26) 6FeCl2 + 14HCl + K2Cr2O7 6FeCl3 + 2CrCl3 + 2KCl + 7H2O
27) 2Na + H2 2NaH
28) NaH + H2O NaOH + H2↑
29) 2NO2 + 2NaOH NaNO2 + NaNO3 + H2O
30) 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2↑
31) Cu + 2H2SO4 CuSO4 + SO2↑ + 2H2O
32) 2CuSO4 + 4KI 2CuI↓ + I2↓ + 2K2SO4
33) 2NaCl + 2H2O H2↑ + Cl2↑ + 2NaOH (электролиз раствора)
34) Fe2O3 + 6HI 2FeI2 + I2↓ + 3H2O
35) Na[Al(OH)4] + CO2 NaHCO3 + Al(OH)3↓
36) Al2O3 + Na2CO3 (тв.) 2NaAlO2 + CO2↑ (сплавление)
37) Al4C3 + 12HBr 4AlBr3 + 3CH4↑
38) 2AlBr3 + 3K2SO3 + 3H2O 2Al(OH)3↓ + 3SO2↑ + 6KBr
39) 3SO2 + K2Cr2O7 + H2SO4 K2SO4 + Cr2(SO4)3 + H2O
40) Zn + 2KOH + 2H2O K2[Zn(OH)4] + H2↑
41) K2[Zn(OH)4] K2ZnO2 + 2H2O
42) K2ZnO2 + 4HCl 2KCl + ZnCl2 + 2H2O
43) HI + KHCO3 KI + H2O + CO2↑
44) 6KI + K2Cr2O7 + 7H2SO4 4K2SO4 + 3I2↓ + Cr2(SO4)3 + 7H2O
45) 2AlI3 + 3Na2S + 6H2O 2Al(OH)3↓ + 3H2S↑ + 6NaI
46) Fe3O4 + 10HNO3 3Fe(NO3)3 + NO2↑ + 5H2O
47) Fe2O3 + Fe 3FeO
48) 2Na + O2 Na2O2 (горение)
49) Na2O2 + 4HCl 2NaCl + 2H2O + Cl2↑
50) 3Cl2 + 10KOH + Cr2O3 2K2CrO4 + 6KCl + 5H2O
51) K2CrO4 + BaCl2 BaCrO4↓ + 2KCl
52) 2Cu(NO3)2 + 2H2O 2Cu + O2↑ + 4HNO3 (электролиз раствора)
53) 6KOH + 3S K2SO3 + 2K2S + 3H2O
54) 6KHCO3 + Fe2(SO4)3 2Fe(OH)3↓ + 3K2SO4 + 6CO2↑
55) KH + H2O KOH + H2↑
56) K2ZnO2 + 2H2SO4 K2SO4 + ZnSO4 + 2H2O
57) FeSO4 + 2NH3 + 2H2O Fe(OH)2↓ + (NH4)2SO4
58) Fe(OH)2 + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 3H2O
59) 2Fe(NO3)3 + 3K2CO3 + 3H2O 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
60) 4NO2 + 2Ca(OH)2 Ca(NO3)2 + Ca(NO2)2 + 2H2O
61) 3Ca + 2P Ca3P2
62) Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3↑
63) PH3 + 8NaMnO4 + 11NaOH 8Na2MnO4 + Na3PO4 + 7H2O
64) Na2MnO4 + Na2SO3 + H2O MnO2↓ + Na2SO4 + 2NaOH
65) P + 5HNO3 H3PO4 + 5NO2↑ + H2O
66) 4Zn + 2NO2 4ZnO + N2↑
67) 2NaNO3 2NaNO2 + O2↑
68) NaNO2 + NH4I NaI + N2↑ + 2H2O
69) 2NaI + H2O2 + H2SO4 Na2SO4 + I2↓ + 2H2O
70) 3I2 + 6NaOH(р−р) NaIO3 + 5NaI + 3H2O
71) H2O2 + Ag2O 2Ag↓ + O2↑ + H2O
72) 2ZnS + 3O2 2ZnO + 2SO2↑
73) Na2[Zn(OH)4] Na2ZnO2 + 2H2O
74) 3Cu2O + Na2Cr2O7 + 10H2SO4 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
75) NaHCO3 + NaOH Na2CO3 + H2O
76) K2Cr2O7(тв.) + 14HCl(конц.) 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
77) 3NaNO2 + 2KMnO4 + H2O 2MnO2↓ + 2KOH + 3NaNO3
78) MnO2 + 4HCl(конц.) MnCl2 + Cl2↑ + 2H2O
79) 2Fe(OH)3 + 6HI 2FeI2 + I2↓ + 6H2O
80) 3Na2CO3 + 2CrBr3 + 3H2O 2Cr(OH)3↓ + 6NaBr + 3CO2↑
81) 5FeCl2 + KMnO4 + 8HCl 5FeCl3 + MnCl2 + KCl + 4H2O
82) K2SiO3(р—р) + 2H2O + 2CO2 H2SiO3↓ + 2KHCO3
83) Ba(OH)2 + 2NaHCO3 = Na2CO3 + BaCO3↓ + 2H2O (при избытке NaHCO3)
либо
Ba(OH)2 + NaHCO3 = BaCO3 + NaOH + H2O (при избытке Ba(OH)2)
84) 6KOH + 3Cl2 KClO3 + 5KCl + 3H2O
85) Cr2O3 + KClO3 + 4KOH 2K2CrO4 + KCl + 2H2O
86) 4NH3 + 5O2 4NO + 6H2O (кат. Pt, Cr2O3, t, p)
87) 2NO + O2 2NO2
88) NaNO2 + 2KMnO4 + 2KOH 2K2MnO4 + NaNO3 + H2O
89) 8KI(тв.) + 9H2SO4(конц.) 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
90) Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
91) Na[Al(OH)4] + 4HNO3 NaNO3 + Al(NO3)3 + 4H2O
92) 2Ca(OH)2 + 4NO2 + O2 2Ca(NO3)2 + 2H2O
93) K[Al(OH)4] + SO2 KHSO3 + Al(OH)3↓
94) 8KOH + PCl5 K3PO4 + 5KCl + 4H2O
95) 2KBr(тв) + 2H2SO4(конц., гор.) K2SO4 + Br2 + SO2↑ + 2H2O
96) 3Br2 + 6KOH 5KBr + KBrO3 + 3H2O
97) Br2 + K2SO3 + 2NaOH 2NaBr + K2SO4 + H2O
98) Fe2O3 + 6HI 2FeI2 + I2 + 3H2O
99) Fe2O3 + 2NaOH(тв.) 2NaFeO2 + H2O (сплавление)
100) 4NO2 + O2 + 2H2O 4HNO3
101) NaFeO2 + 4HNO3(изб.) NaNO3 + Fe(NO3)3 + 2H2O
102) FeO + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 2H2O
103) Ca2Si + 4H2O 2Ca(OH)2 + SiH4↑
104) 3Na2SO3 + Na2Cr2O7 + 4H2SO4 Cr2(SO4)3 + 4Na2SO4 + 4H2O
105) 4Mg + 5H2SO4(конц.) 4MgSO4 + H2S↑ + 4H2O
106) CuS + 10HNO3 Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
CuS + 8HNO3(конц.) CuSO4 + 8NO2↑ + 4H2O
107) 3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO↑ + 4H2O
108) 2Cu(NO3)2 + 2H2O 2Cu↓ + O2↑ + 4HNO3 (электролиз раствора)
109) Cu2O + 3H2SO4(конц.) 2CuSO4 + SO2↑ + 3H2O
110) 2NaI + 2NaMnO4 I2↓ + 2Na2MnO4 (в щелочном растворе)
111) 2Na2O2 + 2CO2 2Na2CO3 + O2
112) 8NaOH(р-р, изб.) + Al2S3 2Na[Al(OH)4] + 3Na2S
113) 4Ca + 5H2SO4(конц.) H2S↑ + 4CaSO4↓ + 4H2O
114) 2Fe(OH)2 + H2O2 2Fe(OH)3
115) Na2O2 + 2H2O(хол.) H2O2 + 2NaOH
116) Ag2S + 10HNO3(конц.) = 2AgNO3 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
Ag2S + 8HNO3 → Ag2SO4 + 8NO2 + 4H2O


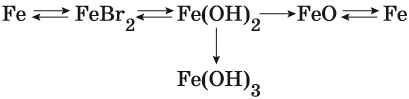
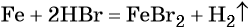
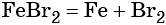
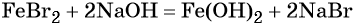
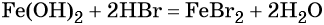
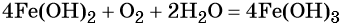
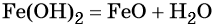
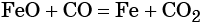
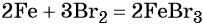
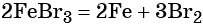
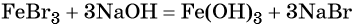
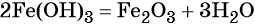
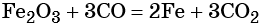
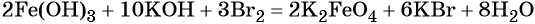
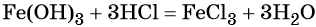
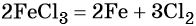
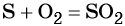
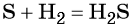
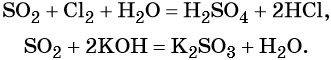
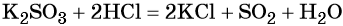
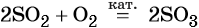
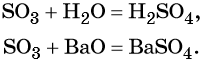
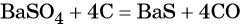
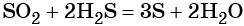
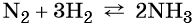
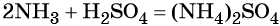
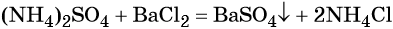
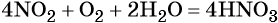
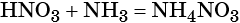
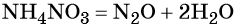
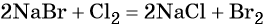
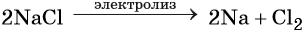
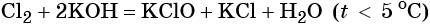
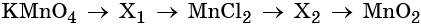
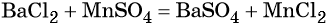
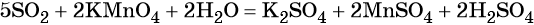
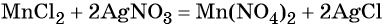
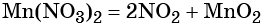
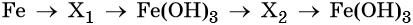
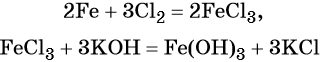
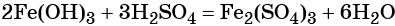
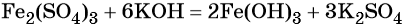

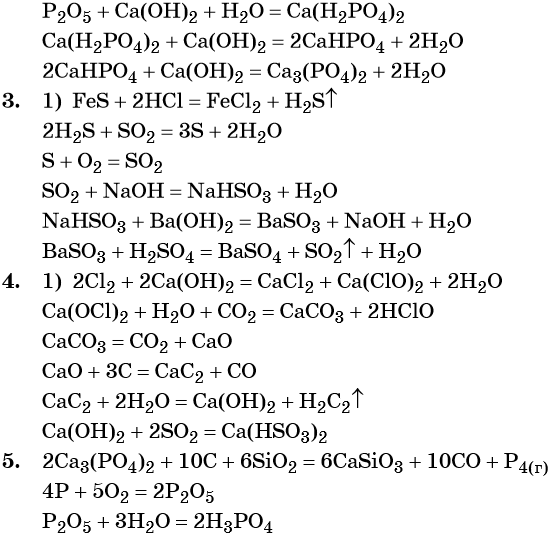
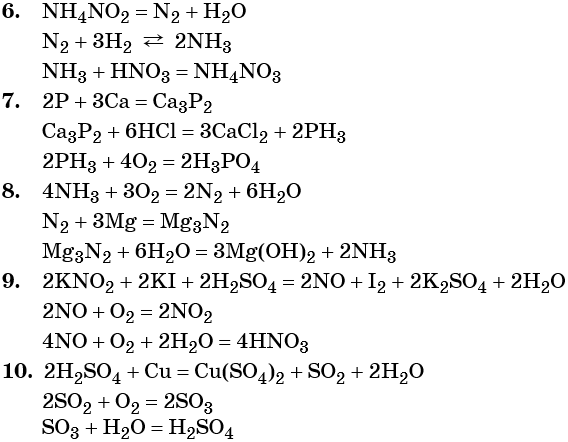

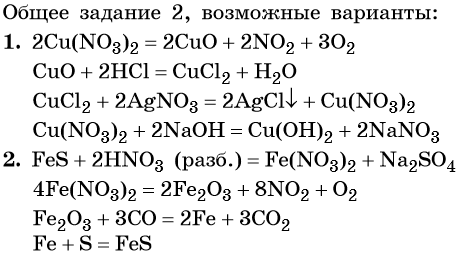
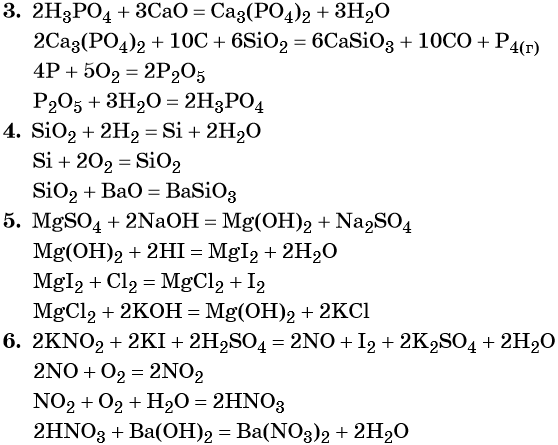
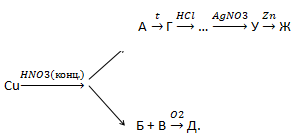
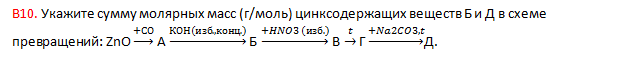
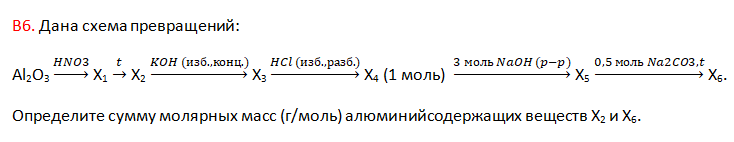

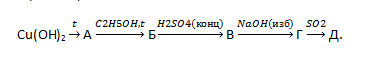

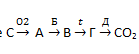 выберите вещества А – Д из предложенных:
выберите вещества А – Д из предложенных:
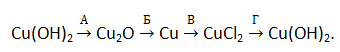 Для каждой реакции, зашифрованной буквой, подберите один реактив, обозначенный цифрой из предложенных ниже. Ответ запишите в виде А1Б7В4Г5.
Для каждой реакции, зашифрованной буквой, подберите один реактив, обозначенный цифрой из предложенных ниже. Ответ запишите в виде А1Б7В4Г5.