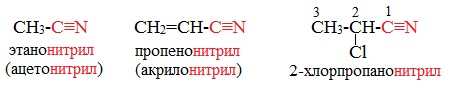
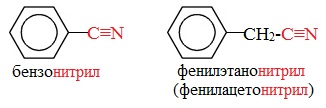
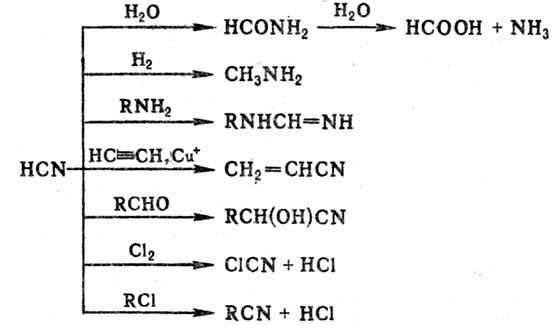
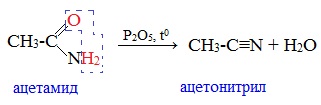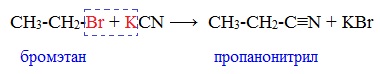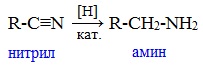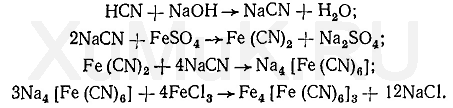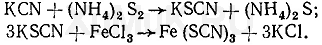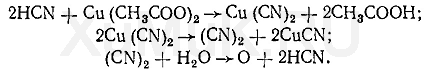Нитрилами называют органические соединения, содержащие одну или несколько цианогрупп -С≡N, связанных с углеводородным радикалом.
От других функциональных производных карбоновых кислот нитрилы отличаются отсутствием карбонильной группы.
Общая формула нитрилов — R-С≡N
Номенклатура
Ациклические соединения R-CN называют по названию углеводорода с соответствующим количеством углеродных атомов, включая углеродный атом группы -С≡N, к которому добавляют суффикс – нитрил. А также от названий ацильных остатков карбоновых кислот, к которым добавляется суффикс —нитрил:
Названия нитрилов также можно образовывать из названий карбоновых кислот заменой окончания –карбоновая кислота на –карбонитрил:
Способы получения
1. Дегидратация амидов
Нитрилы получают дегидратацией амидов при нагревании с сильными водоотнимающими средствами — оксидом фосфора (V) P2O5 или трихлороксидом фосфора POCl3:
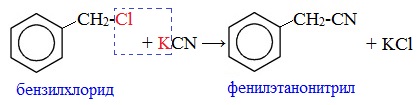
2. Взаимодействие галогеналканов с цианидами щелочных металлов
Нитрилы можно получить при взаимодействии галогеналканов с солями циановодородной кислоты:
Характеристика реакционной способности
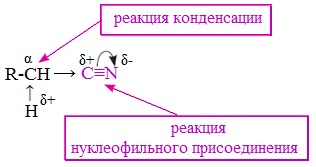
Реакционная способность нитрилов обусловлена наличием в их структуре цианогруппы -С≡N. Цианогруппа имеет линейное строение, атомы углерода и азота находятся в sp-гибридизации и образуют между собой полярную тройную связь, электронная плотность которой смещена к атому азота.
Проявляя отрицательный индуктивный эффект (-I-эффект), цианогруппа смещает на себя электронную плотность с углеводородного радикала и тем самым увеличивает подвижность атомов водорода при α— углеродном атоме (СН-кислотность).
По месту разрыва тройной связи нитрилы вступают в реакции нуклеофильного присоединения, за счет α-углеродных атомов для них характерны реакции конденсации.
Химические свойства
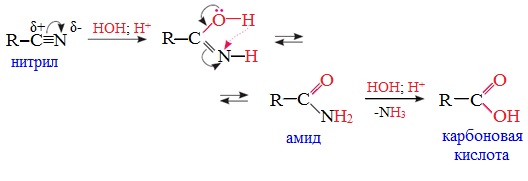
1. Гидролиз нитрилов
При нагревании с водными растворами щелочей или кислот нитрилы гид-ролизуются с образованием карбоновых кислот.
Гидролиз идет в две стадии. Вначале по месту разрыва кратной связи присоединяется одна молекула воды, в результате чего образуются амиды, которые могут быть выделены в индивидуальном состоянии. Дальнейший гидролиз амидов приводит к карбоновым кислотам:
2. Восстановление нитрилов
При восстановлении нитрилов алюмогидридом лития (LiAlH4) или водородом в присутствии катализатора образуются первичные амины:
Отдельные представители
Ацетонитрил используется для растворения масел, жиров, лаков, эфиров целлюлозы, различных синтетических полимеров и неорганических солей, используется в производстве витамина B1.
Токсичен, всасывается через неповрежденную кожу, опасен при попадании в глаза.
Используют в производстве синтетического волокна (нитрон), бутадиен-нитрильного каучука, широко применяется в органическом синтезе.

Акрилонитрил необратимо связывается с белками, РНК и ДНК различных тканей. Опасен при вдыхании, ядовит при приёме внутрь — вплоть до летального исхода. Пары вызывают раздражение слизистых оболочек и кожи. Действует через неповреждённую кожу. При горении образуются ядовитые газы.
Малононитрил обладает высокой реакционной способностью, широко применяется в органическом синтезе для получения гетероциклических соединений. Используют в производстве витаминов B1 и B6, пестицидов, красителей. Его используют также как сшивающий агент для полимеров, добавку к смазочным маслам, стабилизирующую их вязкость, и комплексообразователь при извлечении золота.

Причиняет вред головному мозгу и сердцу, связанный с недостатком клеточного кислорода.
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| 1.1 | Современные представления о строении атома | |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. | |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. | |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И.Менделеева и особенностям строения их атомов. | |
| 1.3 | Химическая связь и строение вещества | |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. | |
| 1.4 | Химическая реакция | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии. | |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. | |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов. | |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | |
| 1.4.6 | Реакции ионного обмена. | |
| Особенности взаимодействия кислых солей со щелочами. | ||
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | |
| Необратимый гидролиз бинарных соединений. | ||
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. | |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей,кислот). | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | |
| 2.2 | Химические свойства простых веществ — металлов | |
| 2.2.1 | Характерные химические свойства щелочных металлов. | |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. | |
| 2.2.3 | Характерные химические свойства алюминия. | |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). | |
| 2.3 | Химические свойства простых веществ — неметаллов | |
| 2.3.1 | Химические свойства водорода и галогенов. | |
| 2.3.2 | Химические свойства кислорода и серы. | |
| 2.3.3 | Химические свойства азота и фосфора. | |
| 2.3.4 | Химические свойства углерода и кремния. | |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. | |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. | |
| 2.6 | Характерные химические свойства кислот. | |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). | |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). | |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. | |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. | |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) | |
| 3.8.1 | Жиры. | |
| 3.8.2 | Белки. | |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). | |
| 3.9 | Взаимосвязь органических соединений. | |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1 | Экспериментальные основы химии | |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. | |
| 4.1.2 | Методы разделения смесей и очистки веществ. | |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы. | |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. | |
| 4.1.5 | Качественные реакции органических соединений. | |
| 4.1.7 | Основные способы получения углеводородов. | |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. | |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ | |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. | |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). | |
| 4.2.3 | Природные источники углеводородов, их переработка. | |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. | |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций | |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе». | |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях. | |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. | |
| 4.3.4 | Расчеты теплового эффекта реакции. | |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). | |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |
Содержание
- Получение
- Свойства
- Применение
- Токсикология
- Обезвреживание цианидов в сточных водах предприятий
- Меры при отравлении цианидами
Цианиды — соли цианистоводородной кислоты. В номенклатуре IUPAC к цианидам относят также C-производные синильной кислоты — нитрилы.
Получение
Основой способ получения цианидов щелочных металлов — взаимодействие соответствующего гидроксида с синильной кислотой, в частности, это основной метод получения наиболее крупнотоннажного цианида — цианида натрия. Другой промышленный метод получения цианида натрия — сплавление цианамида кальция с углем и хлоридом натрия либо содой с образованием цианплава:
Прочие цианиды получают в основном реакциями обмена цианидов щелочных металлов с соответствующими солями.
Цианиды щелочных металлов также могут быть получены взаимодействием металла с дицианом:
или из роданидов путём нагрева их в присутствии железного порошка:
Свойства
Цианиды щелочных и щелочноземельных металлов — ионные соединения, хорошо растворимые в воде. Их водные растворы вследствие гидролиза имеют щелочную реакцию, и при использовании в промышленности в растворы цианидов щелочных металлов в качестве стабилизатора добавляют соответствующие гидроксиды. Цианиды щелочных металлов во влажном воздухе разлагаются с выделением синильной кислоты и образованием соответствующего карбоната.
При нагревании водные растворы ионных цианидов разлагаются с образованием формиата и аммиака:
Под действием мягких окислителей (в том числе и при действии кислорода воздуха) цианиды щелочных металлов легко окисляются до цианатов:
Применение
- Цианиды применяют для извлечения золота и серебра из руд методом цианирования (один из процессов гидрометаллургии, основанный на растворении металла в цианистых растворах вследствие образования комплексных солей).
- В электрохимии — как комплексообразователь с высокой константой устойчивости для составления электролитов для гальванического покрытия благородными металлами изделий (золочение, серебрение, платинирование),
- В органическом синтезе.
- Цианиды применяют в аналитической химии для разделения металлов (как комплексообразователь).
- Как и ферроцианиды, цианиды когда-то использовались для азотирования стали.
- Использовались в качестве ядов, в том числе, как яд от мышей и крыс, синильная кислота и некоторые её производные (хлорциан) также применялись в качестве боевых отравляющих веществ.
- В качестве фиксажа в мокром фотопроцессе.
Токсикология
Все (неорганические) цианиды очень ядовиты. Цианиды в XX веке применялись как отравляющее вещество против грызунов в сельском хозяйстве. В начале XX века синильная кислота использовалась французами как боевое отравляющее вещество (ОВ) как например хлорциан.
Цианид-анион является ингибитором фермента цитохром с-оксидаза в IV комплексе дыхательной цепи переноса электронов (у эукариот локализована на внутренней мембране митохондрий). Связывается с железом, входящим в состав фермента, чем препятствует переносу электронов между цитохром с-оксидазой и кислородом. В результате нарушается транспорт электронов, и, следовательно, прекращается аэробный синтез АТФ.
Наиболее токсичным цианидом является синильная кислота.
Обезвреживание цианидов в сточных водах предприятий
Промывные воды гальванических участков, в которых используются цианиды, относительно легко обезвреживаются с помощью окислителей. В связи с этим в 80-х — 90-х гг. XX века был приостановлен массовый переход на «нецианистые электролиты» — оказалось, что несмотря на меньшую токсичность, они сложнее в обезвреживании и часто менее технологичны.
Наиболее часто применяются гипохлориты (хлорная известь, гипохлорит натрия).
Меры при отравлении цианидами
Противоцианидные антидоты вводят внутривенно или перорально. Их можно разделить на три основных класса. Первый — сахара (прежде всего глюкоза), необратимо связывающие цианиды в нетоксичные циангидрины. Постоянно присутствуют в крови, собственно, и обеспечивая максимальную несмертельную дозу в десятки миллиграммов.
Из второй группы можно назвать тиосульфат натрия, который реагирует с цианидами, превращая их в роданиды, которые также безвредны. Третья группа антидотов — вещества, превращающие гемоглобин крови в метгемоглобин. Он не способен переносить кислород, но быстро связывает цианиды с образованием цианметгемоглобина, который впоследствии выводится из организма. К этой группе относятся некоторые красители (например, метиленовый синий), органические и неорганические нитриты.
Метгемоглобинобразователи наиболее эффективны из всех антидотов, так как действуют быстрее других, но в то же время они и опасны сами по себе: при их передозировке кровь теряет способность переносить кислород. Кроме того, реакция образования цианметгемоглобина обратима, и со временем часть цианида будет высвобождаться обратно. Поэтому антидоты этой группы применяют обычно в сочетании с антидотами других групп.
К третьей группе относятся амилнитрит и нитроглицерин.
Задание
№8
Опишите
способы получения веществ , указанных
в пунктах (А), строение их молекул
,физические и химические свойства ,
применение . Ответ иллюстрируйте
уравнениями реакций .
№219
А)
Дициан , синильная кислота , цианиды ,
роданиды.
Б)
Как можно осуществить следущее превращение
[Fe(CN)4]4-
[Fe(CN)6]3-
Дициан
Получение:Получают
дициан в крупных масштабах
методами,основанными на каталитич.
окислении
HCN при 200-400 °С О2
воздухаили
NO2.
В небольших кол-вах дициан получают
термич. разложениемцианидов
Ag и Hg либо при действии на цианиды
солей
Сu:
2KCN
+ CuSO42CuCN
+ 2K2SO4
+ (CN)2
Другие
способы получения дициана:
2AgCN(350°С)=2Ag+(CN)2
Hg(CN)2+HgCl2=Hg2Cl2+(CN)2
Физические
свойства:
Молекула
дициана линейна; длина связи С — С 0,1368
нм,
0,1157 нм; C2N2
— бесцветный газ с резким запахом,
tпл
−27,8 °C; tкип −21,15 °C; Горюч. На воздухе
иногда самовоспламеняется.
Химические
свойства:
По химическим свойствам дициан частично
напоминает галогены,(поэтому получил
название «псевдогалоген») например,
C2N2
взаимодействует с водными растворами
щелочей аналогично хлору:
(CN)2
+ 2KOH = KCN + KCNO + H2O.
Ограниченно
растворим в воде, лучше — в спирте,
эфире,
уксусной
кислоте.С
металлами
образует комплексные соед., напр. (CN)2
x
2CuCl,
с реактивом Гриньяра — нитрилы:
(CN)2
+ RMgHalRCN
+ Mg(CN)Hal
(CN)2+Cl2=2CNCl(хлор
циан)
Применение:В
1824 году немецкий химик Фридрих
Вёлер
получил из диацина и воды щавелевую
кислоту.:
(CN)2
H2O
> (COOH)2
(щавелевая кислота)
Дициан,
бромистый
дициан и
хлористый
дициан
используются в органическом синтезе.
дииан также применяется в качестве
фумиганта и горючего газа для сварки и
резки тугоплавких металлов. Он является
основным компонентом ракетного топлива
в смеси с озоном или фтором, а также
может присутствовать в выделяемых
доменной печью газах. Бромистый дициан
используется для обработки тканей, как
фумигант и пестицид, в процессе добычи
золота. Хлористый дициан служит в
качестве добавки к фумигантам.
Сини́льная (циа́нистоводородная) кислота́
Получение—В
настоящий момент есть три наиболее
распространенных метода получения
синильной кислоты в промышленных
масштабах:
-
Метод
Андрусова: прямой синтез из аммиака
и метана
в присутствии воздуха и платинового
катализатора
при высокой температуре:
-
Метод
BMA
(Blausäure aus Methan und Ammoniak),
запатентованный фирмой Degussa:
прямой синтез из аммиака
и метана
в присутствии платинового катализатора
при высокой температуре:
-
Побочный
продукт при производстве акрилонитрила
путем окислительного аммонолиза
пропилена.
Физические
свойства—
(цианистый
водород, нитрил
муравьиной к-ты) HCN, бесцв. подвижная
жидкость
с запахом горького миндаля. Молекула
линейна, длина связи С—H 0,1064 нм, C=N 0,1156
нм,
9,92·10-30
Кл·м (газ);
т.
пл. -13,29°С, т. кип. 25,65°С;
Существует
в двух кристаллич. модификациях: ниже
— 102,78 °С- в ромбической (а = 0,413 нм, b =
0,485 нм, с = 0,434 нм, z = 2, пространств. группа
I2mm), выше этой т-ры-в тетрагональной (а
= 0,463 нм, с = 0,434 нм, z = 2, пространств. группа
I4mm). В жидком виде и в р-ре образует
линейные ассоциаты благодаря водородным
связям N… Н.
Синильная
кислота горюча
и взрывоопасна.
Сильно
токсична.
Химические
свойства-
Молекула HCN сильно полярна (μ = 0,96·10−29
Кл·м).
Безводный
цианистый водород является сильно
ионизирующим
растворителем, растворенные в нем
электролиты
хорошо диссоциируют
на ионы. Его относительная диэлектрическая
проницаемость
при 25 °C равна 107 (выше, чем у воды).
Это обусловлено линейной ассоциацией
полярных молекул HCN за счет образования
водородных
связей.
Очень
слабая
одноосновная кислота
К = 1,32·10−9
(18 °C). Образует с металлами
соли — цианиды.
Взаимодействует с оксидами
и гидроксидами
щелочных
и щёлочноземельных
металлов.
Пары
синильной кислоты горят на воздухе
фиолетовым пламенем с образованием
Н2О,
СО2
и N2.
В смеси кислорода
со фтором
горит с выделением большого количества
тепла:
кДж.
Легко
полимеризуется в присутствии основания
(часто со взрывом). Образует аддукты,
например HCN-CuCl
Применение:
Применяют
синильную кислоту
в произ-ве цианидов,
хлорциана,
акрило-нитрила, адиподинитрила,
акрилатов,
аминокислот,
гид-роксинитрилов, как фумигант.
Синильная
кислота являлась основной составной
частью препарата «Циклон
Б», который применялся нацистами во
время Второй мировой войны для убийства
людей в концентрационных лагерях. В
некоторых штатах США синильная кислота
использовалась в газовых камерах в
качестве отравляющего вещества при
исполнении приговоров смертной
казни, в последний раз это было сделано
в Аризоне в 1999 году.[4]
Смерть, как правило, наступает в течение
5-15 минут.
Цианиды
Получение:
Основой способ получения цианидов
щелочных металлов — взаимодействие
соответствующего гидроксида с синильной
кислотой, в частности, это основной
промышленный метод получения наиболее
крупнотоннажного цианида — цианида
натрия.
Другой промышленный метод получения
цианида натрия — сплавление цианамида
кальция
с углем и хлоридом
натрия
либо содой:
CaCN2
+ C + 2 NaCl
2
NaCN + CaCl2
Образующийся
в процессе плав («цианплав», «чёрный
цианид») содержит 40 — 47 % цианидов в
пересчете на NaCN и используется для
цианирования
стали,
а также использовался в качестве сырья
для получения цианидов натрия, калия,
а также желтой
кровяной соли.
Прочие
цианиды получают в основном реакциями
обмена
цианидов щелочных металлов с
соответствующими солями.
Цианиды
щелочных
металлов
также могут быть получены взаимодействием
металла с дицианом:
N≡C-C≡N
+ 2Na
2NaCN
или
из роданидов,
нагревая их в присутствии железного
порошка:
KSCN
+ Fe
KCN
+ FeS
Физические
и химические свойства-
ЦИАНИДЫ,
неорг.
соединения, содержащие группу CN. Различают
простые цианиды- соли
синильной
кислоты HCN и нек-рые др. и комплексные.
По характеру хим. связи между элементом
и ионом
CN—
делятся на ионные, ковалентные и
координационные. Цианидами наз. также
псевдогалогенидами.
Орг.
соед., содержащие группу CN, образуют два
ряда производных — нитрилы
и изонитрилы.
Цианиды
аммония,
щелочных и щел.-зем. металлов
— ионные соед., хорошо раств. в воде,
a NaCN и NH4CN
раств. в этаноле.
При повышенной т-ре цианиды щелочных и
щел.-зем. металлов
полностью гидролизуются. Водные р-ры
цианидов вследствие гидролиза
обладают сильноосновной р-цией.
Цианиды
щелочных
металлов MeCN и щёлочноземельных металлов
Me (CN)2
(где Me — металл) термически устойчивы,
в водных растворах гидролизуются. Цианды
тяжёлых металлов термически неустойчивы,
в воде, кроме Hg (CN)2,
нерастворимы. При окислении Цианидов
образуют цианаты
(например, 2KCN + O2
=2KOCN). Многие металлы при действии избытка
цианида
калия или цианида
натрия дают комплексные
соединения, что используется, например,
для извлечения золота и серебра из руд
(см. Цианирование):
4NaCN
+ 2Au+1/2O2
+ H2O
=2Na [Au (CN)2]
+ 2NaOH.
Золото
и серебро из раствора выделяют
электролитическим осаждением либо при
действии металлического цинка.
При
нагревании в водные растворы ионных
цианидов гидролизуется до формиата и
аммиака:
NaCN
+ 2 H2O
HCOONa
+ NH3
Под
действием мягких окислителей (в том
числе и на воздухе) цианиды щелочных
металлов легко окисляются до цианатов:
NaCN
+ [O]
NaNCO
-
Применение:
Цианиды применяют для извлечения золота
и серебра
из руд
методом цианирования
(один из процессов гидрометаллургии,
основанный на растворении металла в
цианистых растворах вследствие
образования комплексных
солей). -
В
электрохимии
— как комплексообразователь
с высокой константой
устойчивости
для составления электролитов для
гальванического
покрытия благородными
металлами
изделий (золочение,
серебрение), -
В
органическом
синтезе. -
Цианиды
применяют в аналитической
химии
для разделения металлов (как
комплексообразователь). -
Как
и ферроцианиды,
цианиды когда-то использовались для
азотирования
стали. -
Использовались
в качестве ядов,
в том числе, как яд от мышей и крыс,
синильная кислота и некоторые ее
производные (хлорциан)
также применялись в качестве боевых
отравляющих
веществ.
-В
качестве фиксажа в мокром фотопроцессе.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Синильная кислота (цианистоводородная кислота) — газ или бесцветная жидкость (г. кип. 25,6 °С, т. пл.— 13,3 °С, плотность 0,699), имеет запах горького миндаля, легко смешивается с водой и с рядом органических растворителей. При — 13,3 °С синильная кислота затвердевает, образуя волокнистую кристаллическую массу. Синильная кислота является слабой кислотой. Ее вытесняют из солей даже углекислота и слабые органические кислоты.
В свободном состоянии в природе синильная кислота не встречается. Она встречается в виде химических соединений, к числу которых относятся гликозиды (амигдалин, пруназин, дур-рин и др.). Амигдалин содержится в семенах горького миндаля, косточках персиков, абрикосов, слив, вишен, в листьях лавровишни и др. Этот гликозид под влиянием фермента эмульсина, а также под влиянием кислот разлагается на глюкозу, бензальдегид и синильную кислоту. Пруназин содержится в пенсильванской вишне, а дуррин — в просе. Синильная кислота может образовываться при горении целлулоида. Следы этой кислоты содержатся в табачном дыме.
Соли синильной кислоты (цианиды) легко гидролизуются d воде. При хранении водных растворов цианидов при доступе диоксида углерода они разлагаются:
KCN + H
2
O
+ СО
2
—> HCN + КНСО
3
KCN + 2H
2
O —> NH
3
+ НСООК
В водных растворах разлагаются не только цианиды, но и сама синильная кислота:
HCN + 2Н
2
О —> HCOONH
4.
Применение. Действие на организм.
Синильная кислота и ее соли применяются для синтеза ряда органических соединений, при добыче золота, для дезинфекции и дезинсекции, для борьбы с вредителями растений и т. д. Из соединений синильной кислоты, применяемых в народном хозяйстве, большое значение имеют цианиды натрия и калия.
Синильная кислота и ее соли очень ядовиты. По токсичности синильная кислота превосходит многие известные яды. Поэтому с синильной кислотой и ее солями следует обращаться очень осторожно. Следует помнить, что от прибавления сильных кислот к цианидам сразу же выделяется синильная кислота, которая может быть причиной тяжелых, а иногда и смертельных отравлений. Отравления могут давать и различные соединения синильной кислоты (хлорциан, бромциан и др.). Отмечены случаи отравления людей семенами миндаля. По данным М. Д. Швайковой (1975), смерть у взрослых может наступить при поедании 40—60 штук, а у детей— 10—12 штук семян миндаля. При вдыхании больших концентраций синильной кислоты смерть может наступить мгновенно от остановки дыхания и сердца. Учитывая высокую токсичность синильной кислоты и ее солей, работать с ними в лаборатории можно только в вытяжном шкафу с хорошей вентиляцией.
Синильная кислота угнетает внутриклеточные железосодержащие дыхательные ферменты. При угнетении цитохромоксидазы синильной кислотой клетки организма не усваивают кислород, поступающий с кровью. В результате этого наступает клеточное кислородное голодание, несмотря на то, что кровь насыщенна кислородом. Цианиды также могут блокировать гемоглобин крови, нарушая его функции.
Синильная кислота может поступать в организм с вдыхаемым воздухом и частично через неповрежденную кожу, а цианиды — через пищевой канал.
Метаболизм. Метаболитом синильной кислоты является тиоцианат (роданид), который образуется в организме при конъюгации цианидов с серой под влиянием фермента роданазы.
Обнаружение синильной кислоты и цианидов
Изолирование синильной кислоты и цианидов из биологического материала производят перегонкой с водяным паром. Для этой цели собирают 3—5 мл первого дистиллята в пробирку,
содержащую 2 мл 2 %-го раствора гидроксида натрия. Поскольку синильная кислота быстро разлагается в организме, исследование биологического материала на наличие этой кислоты и ее солей желательно проводить сразу же после вскрытия трупов.
При отравлении синильной кислотой и цианидами на химико-токсикологическое исследование берут желудок с содержимым, печень и почки. Ввиду быстрого разложения синильной кислоты и цианидов в тканях организма эти яды можно обнаружить в содержимом желудка и не обнаружить в паренхиматозных органах.
При заключении об отравлении синильной кислотой и цианидами (на основании результатов химико-токсикологического анализа биологического материала) следует учитывать то, что цианиды в небольших количествах (около 6 мкг %) могут быть в моче лиц, неподвергавшихся воздействию этих соединений. В моче курящих количество цианидов может быть почти в 3 раза больше, чем в крови некурящих. В крови цианиды могут образовываться и посмертно.
Для обнаружения синильной кислоты в дистиллятах применяют несколько реакций, из которых наиболее доказательной является реакция образования берлинской лазури. Другие описанные ниже реакции используют как вспомогательные, а также для обнаружения цианидов в порошках, жидкостях и в других объектах.
Реакции на синильную кислоту и ее соли выполняют под тягой.
Реакция образования берлинской лазури.
От прибавления сульфата железа (II) к щелочному раствору цианидов, образуется цианид железа (II), который при взаимодействии с избытком цианидов, а затем с сульфатом или хлоридом железа (III) образует берлинскую лазурь:
При образовании берлинской лазури происходят и побочные реакции между солями железа и щелочью (образуются гидро-ксиды железа).
Для растворения гидроксидов железа и нейтрализации избытка щелочи прибавляют кислоту до кислой реакции. Большой избыток прибавленной кислоты может замедлить процесс образования берлинской лазури.
Выполнение реакции.
К нескольким миллилитрам дистиллята, собранного в раствор щелочи, прибавляют 1—4 капли разбавленного раствора сульфата железа (II) и такой же объем разбавленного раствора хлорида железа (III). Смесь хорошо взбалтывают и нагревают на пламени газовой горелки почти до кипе-
ния, а затем охлаждают до комнатной температуры и прибавляют 10 %-й раствор соляной кислоты до слабокислой реакции на лакмус. Появление синего осадка или синей окраски указывает на наличие синильной кислоты (цианидов) в дистилляте.
Предел обнаружения: 20 мкг синильной кислоты в 1 мл раствора. Предельная концентрация 1 : 100000. При количествах синильной кислоты, превышающих 30 мкг в 1 мл, образуется синий осадок. При наличии 20—30 мкг синильной кислоты в 1 мл появляется зеленая или голубоватая окраска. При малых количествах синильной кислоты в растворах синяя окраска появляется только через 24—48 ч. При длительном отсутствии синего осадка или синей окраски к смеси прибавляют 5 %-ый раствор хлорида бария. При этом выпадает осадок сульфата бария и происходит соосаждение берлинской лазури.
Осадок берлинской лазури может быть представлен судебно-следственным органам как доказательство наличия синильной кислоты или цианидов в исследуемых объектах.
Реакция образования роданида железа.
Эта реакция основана на том, что при нагревании цианидов с раствором полисульфида аммония образуется роданид, от прибавления к которому раствора хлорида железа (Ш) появляется кроваво-красная окраска:
Выполнение реакции.
К 2—3 мл исследуемого раствора прибавляют 3—5 капель 10—20 %-го раствора полисульфида аммония и смесь упаривают на водяной бане до небольшого объема. К упаренной жидкости по каплям прибавляют 8 %-й раствор соляной кислоты до кислой реакции (по лакмусу), а затем прибавляют 1 каплю 10 %-го раствора хлорида железа (III). Появление кроваво-красной окраски указывает на наличие цианидов в растворе. При взбалтывании окрашенного раствора с диэтило-вым эфиром окраска переходит в эфирный слой.
Предел обнаружения: 10 мкг синильной кислоты в 1 мл.
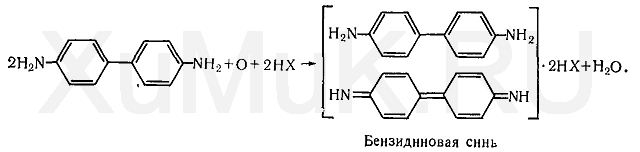
Реакция образования бензидиновой сини.
Соли меди (II) с цианидами образуют дициан (CN)
2, при взаимодействии которого с водой выделяется кислород, окисляющий бензидин. Продуктом окисления бензидина является бензидиновая синь:
Выполнение реакции.
Для выполнения этой реакции пользуются индикаторной бумагой, смоченной смесью растворов ацетата меди и бензидина.
В колбу вносят 2—3 мл исследуемого раствора, к которому прибавляют 1 мл 10 %-го раствора винной кислоты. Колбу сразу же закрывают пробкой, к которой прикреплена влажная индикаторная бумага. Затем колбу нагревают несколько минут на водяной бане. При наличии синильной кислоты или ее солей в пробе бумага синеет.
Приготовление индикаторной бумаги
(см. Приложение 1,
реактив 6).
Реакция с пикриновой кислотой.
От прибавления пикриновой кислоты и щелочи к цианидам образуется соль изопурпуровой кислоты, имеющая красную окраску:
Выполнение реакции.
К 1 мл щелочного дистиллята прибавляют 1 мл 0,5 %-го раствора пикриновой кислоты и слегка нагревают на водяной бане. При наличии цианидов раствор приобретает красную окраску. Подобную окраску с пикриновой кислотой дают и некоторые другие вещества (альдегиды, ацетон, сульфиты и др.). Поэтому реакция с пикриновой кислотой на цианиды имеет значение только при отсутствии цианидов в дистилляте.
Обнаружение цианидов методом микродиффузии.
Синильную кислоту и ее соли можно обнаружить методом микродиффузии, который основан на реакции с пиридином и барбитуровой кислотой. Способ обнаружения цианидов методом микродиффузии описан выше (см. гл. III, § 3).
СОДЕРЖАНИЕ
ПРЕДЫДУЩАЯ | СЛЕДУЮЩАЯ
Еще по теме:
- СИНИЛЬНАЯ КИСЛОТА — химическая энциклопедия
Содержание
- Отравление цианистым калием и другими цианидами — симптомы, причины, последствия
- Как действуют цианиды
- Свойства и применение соединений синильной кислоты
- Цианистый натрий
- Цианид аммония
- Цианид серебра
- Цианид кальция
- Цианид ртути
- Цианид цинка
- Основные характеристики цианистого калия
- Распространение в окружающей среде
- Где еще содержится вещество
- Как действует цианид калия на человека
- Клиническая картина и стадии отравления цианистым калием
- Симптомы хронического отравления
- Оказание первой помощи при отравлении
- Медикаментозное лечение антидотами
- Что происходит с человеком, который выпил цианистый калий?
- Что такое цианистый калий?
- Виды и характерные особенности
- Где содержатся цианиды?
- Воздействие на человека и риск отравления
- Симптомы
- Оказание первой помощи и лечение
- Профилактика
- Что такое цианид? Цианиды и их влияние на организм человека
- Что такое цианид?
- Цианид в растениях
- Применение цианида
- Влияние на организм
- Когда проявляются признаки отравления
- Основные симптомы отравления
- В завершение
- Цианистый калий
- Что такое цианистый калий
- Где содержатся цианиды
- Симптомы отравления цианистым калием
- Первая помощь при отравлении
- Лечение
Отравление цианистым калием и другими цианидами — симптомы, причины, последствия
Цианиды представляют собой класс быстродействующих химических соединений, смертельно опасных для человека и животных. К цианидам относится синильная (цианистоводородная) кислота и ее производные – соли. Все эти вещества объединяет наличие в их химической формуле цианогруппы CN, они могут иметь как органическое, так и неорганическое происхождение.
Как действуют цианиды
О механизме токсического действия всех отравляющих цианидов известно, что вмешиваясь в процесс внутриклеточного окисления, цианид-ионы взаимодействуют с окисленными молекулами и препятствуют усвоению кислорода тканями.
Они блокируют важнейший железосодержащий дыхательный фермент, в результате чего происходит парадоксальное состояние – ткани и клетки переполняются кислородом, но оказываются неспособными его усвоить, так как он потерял химическую активность.
[attention type=yellow]
В результате количество кислорода в венозной крови (отводящей в легкие углекислый газ) становится практически равным его количеству в крови артериальной (несущей кислород от легких к тканям).
[/attention]
Из-за этого при отравлении цианидами у людей может наблюдаться гиперемия (сильное покраснение всего тела).
Свойства и применение соединений синильной кислоты
Химические свойства, которыми обладают цианистые соединения, широко применяются в различных сферах человеческой деятельности. При этом цианиды неорганического происхождения используются, в основном, в промышленных целях, а органические – в фармакологии и сельском хозяйстве.
| Представители неорганических цианидов | Представители органических цианидов |
| Синильная кислота, цианид натрия, цианид кальция, цианид железа, цианид цинка, цианид ртути и другие | Гликозид-амигдалин, тиоционаты, нитрилы, эфир цианоуксусной кислоты, эфир цианомуравьиной кислоты |
К сфере применения неорганических цианидов относятся:
- химическая промышленность – в качестве комплексообразователя в составе электролитов для гальванического покрытия металлических деталей напылением из золота, серебра, платины в электрохимии;
- текстильное и кожевенное производство – для выделки сырой кожи, производства текстиля и других процессов;
- фотография – в составе фиксирующего вещества (фиксажа) при фотопечати мокрым способом;
- золотодобывающая промышленность – для цианирования с целью извлечения драгоценных металлов из руды;
- гальванопластика.
Органические цианиды применяются:
- в сельском хозяйстве (борьба с вредителями);
- в органическом синтезе;
- в фармацевтической промышленности.
Большинство цианидов является крайне ядовитыми веществами, отравление которыми чаще всего приводит к смерти. Характерной особенностью большинства CN-содержащих соединений можно назвать острый запах горького миндаля.
Цианистый натрий
Соединение цианид натрия имеет различные формы:
- гигроскопичных кристаллов;
- пасты;
- пластинок;
- белого порошка.
Цианистый натрий обладает высоким уровнем токсической опасности, способен вызвать паралич тканевого газообмена и, как результат, быстрое удушье. Смертельная доза цианистого натрия составляет 0,1 грамма.
Причиной отравления может быть случайное попадание вещества в пищеварительный тракт, контакт вещества с кожей, особенно, пораненной, а также вдыхание пыли, содержащей ядовитые соединения.
Людям, работающим с NaCN необходимо соблюдать строжайшие меры безопасности – надевать спецодежду, состоящую из комбинезона, резиновых перчаток, головного убора и сапог, и противогазы.
Помещение, где ведутся работы с этим веществом, должны оснащаться мощными вентиляционными системами.
Цианид аммония
Цианид аммония относится к неорганическим соединениям и представляет собой бесцветные кристаллы соли, полученной от взаимодействия аммония с синильной кислотой. Соединение хорошо растворяется в воде, действует в качестве реагента в процессах органического синтеза. Требует обычных мер предосторожности, тех же, что и другие цианистые соединения.
Цианид серебра
Еще один представитель неорганического соединения, цианид серебра образуется из реакции синильной кислоты с одновалентным серебром, выпадая в виде осадка белого цвета.
Используется как составляющая электролита в процессе серебрения и для других целей.
Отличается высокой токсичностью, обусловленной действием цианид-ионов на процесс газообмена путем блокирования фермента цитохромоксидазы.
Цианид кальция
Соединение, получаемое при взаимодействии синильной кислоты с карбидом кальция, носит название цианид кальция и имеет вид светло-коричневого легко распыляемого вещества. Наиболее популярное применение – борьба с грызунами и другими вредителями в сельском хозяйстве.
Цианид ртути
Растворимое в воде неорганическое вещество цианид ртути является ртутной солью синильной кислоты в виде бесцветного или белого кристаллического соединения, не обладающего запахом. Это соединение растворяется в воде и проявляет сильное отравляющее действие.
В малых дозах применяется в медицине как дезинфицирующе и терапевтическое средство для лечения сифилиса. Допустимые дозы внутримышечного введения – 1 мл 2%-ного раствора раз в 2 дня, внутривенного – от 0,5 мл 1%-ного раствора до 1 мл.
Симптоматика при отравлении схожа с клинической картиной отравления металлической ртутью.
Цианид цинка
Бесцветная, не растворяемая в воде соль цинка, цианид цинка представляет собой бесцветный кристаллический порошок, применяемый в гальванопластике и в качестве катализатора в процессе органического синтеза. Требует осторожности и надежных мер защиты при использовании.
Основные характеристики цианистого калия
Одним из ядовитых производных синильной кислоты является цианисто-калиевая соль, или цианистый калий.
То ли ввиду похожести этого соединения по виду на сахарный песок, то ли из-за его всеобщей доступности в конце XIX-начале XX века (продавался просто в аптеке), этот яд, который практически ничем не пахнет, приобрел широкую известность.
Именно этим белоснежным ядом пользовались книжные злодеи знаменитых детективных романов, именно им отравилась целая семья военного преступника Геббельса, не пожелавшего предстать перед правосудием. Но на деле отравление цианистым калием не более, а то и менее опасно, чем такими «бытовыми» ядами, как ботулотоксин и никотин.
Распространение в окружающей среде
Цианистый калий является не слишком устойчивым цианидом. Ввиду слабости синильной кислоты соли более сильных кислот без труда вытесняют цианогруппу из соединения, в результате чего та улетучивается, лишая соединение ядовитых свойств. Тем не менее, опасность отравления цианистым калием существует даже при таких условиях, о которых многие, скорее всего, и не подозревают.
https://www.youtube.com/watch?v=u1wPQsOq9E0
Пользуясь реактивами для фотолабораторий, средствами для чистки ювелирных украшений, морилками для насекомых в энтомологии и даже такими акварельными и гуашевыми красками как «милори», «берлинская лазурь», «прусская синяя», в которых содержится некоторое количество цианистого калия, можно надышаться парами синильной кислоты, улетучивающейся в процессе работы.
Где еще содержится вещество
В персиках сливах и абрикосах присутсвует цианистый калий. Правда в микроскопических дозах
Отравление цианистым калием теоретически возможно и в природных условиях. Соединение амигдалин, содержащее калийную цианогруппу, обнаружили в мякоти косточек таких садовых растений как:
- персики;
- вишни;
- сливы;
- абрикосы;
- миндаль.
Присутствие группы CN цианистого калия превращает в яд молодые черешки и листву бузины.
Чтобы получить смертельную дозу цианистого калия (1 г и более), достаточно съесть около 100 г абрикосовых ядрышек.
Как действует цианид калия на человека
Как и большинство цианидов, цианистый калий может проникнуть в организм через ротовую полость, кожные покровы и дыхательные пути и блокировать клеточный фермент, отвечающий за усвоение клетками кислорода.
В результате кислород не усваивается, а продолжает циркулировать в соединении с гемоглобином. Внутриклеточный метаболизм прекращается, и наступает смерть организма. Эффект сравним с удушением.
Смертельной для человека является доза 1,7 мг/кг массы тела.
Наибольшей опасности отравления цианистым калием подвержены работники гальванических производств, горно-обогатительных комплексов, химических лабораторий, чья деятельность связана с использованием этого яда. В числе пострадавших могут оказаться и люди, проживающие вблизи вредных производств, в результате выбросов токсических соединений в атмосферу, в почву или водоемы.
Клиническая картина и стадии отравления цианистым калием
Симптомы отравления цианистым калием находятся в прямой зависимости от индивидуальной чувствительности к яду и полученной дозы.
При значительном количестве яда отмечается острое отравление, как правило, убивающего человека за считанные минуты. При отравлении малыми дозами, но в продолжительное время, речь идет о хроническом отравлении.
Признаки сильного, острого отравления:
- резкий привкус и запах горького миндаля во рту;
- потеря сознания пострадавшим;
- развитие мгновенного паралича дыхательной системы и работы сердечной мышцы (миокарда);
- смерть.
Как правило, при высоких концентрациях токсического вещества (более 1,7 мл/кг веса), проникнувшего в организм, врачи оказать медицинскую помощь пострадавшему не успевают.
Невысокие дозы цианистого калия приводят к замедленному отравлению, которому свойственно поэтапное развитие.
Симптомы начальной стадии:
- головокружение;
- спонтанная сильная головная боль;
- сильная тяжесть в лобных долях;
- прилив крови к голове;
- учащенное сердцебиение и дыхание.
Симптомы стадии одышки:
- снижение частоты дыхания, появление шума при глубоком вдохе;
- замедление пульса;
- расширение зрачков;
- появление тошноты и рвоты.
Признаки стадии судорог:
- прикусывание языка вследствие челюстных судорог;
- потеря сознания.
Симптомы стадии паралича:
- потеря чувствительности и рефлекторности;
- крайне слабое дыхание;
- как правило – непроизвольные дефекация и мочеиспускание.
Если до наступления этой стадии больному не была оказана помощь антидотом, наступает остановка сердца и смерть. Яркими показателями смерти от токсинов цианистого калия является гиперемия кожи и алая окраска слизистых и венозных прожилков.
Симптомы хронического отравления
Работники вредных производств или лабораторий, получавшие невысокие дозы в течение продолжительного времени, могут почувствовать симптомы хронического отравления цианистым калием:
- диспепсические признаки;
- частые головные и сердечные боли;
- снижение памяти;
- бессонницу;
- головокружения.
Довольно часто действие цианистых соединений сказывается на работе печени, центральной нервной системы и щитовидной железы.
Оказание первой помощи при отравлении
Поскольку отравление любыми видами цианидов грозит смертельной опасностью пострадавшему, первая помощь должна быть оказана быстро и грамотно.
- Если отравление произошло ингаляционно (то есть при вдыхании паров), отравившегося нужно немедленно вынести на свежий воздух. Если произошли выбросы в атмосферу, следует расположиться ближе к земле – цианиды будут улетучиваться вверх, так как они легче воздуха.
- Если цианиды осели на одежду пострадавшего, ее нужно срезать и уничтожить, чтобы не усугублять отравление находящимися на ткани токсинами.
- Контактные линзы (если их носил пострадавший) должны быть извлечены, а глаза – тщательно промыты.
- При пероральном отравлении цианидами необходимо промыть желудок 0,1%-ным раствором марганцовки или 2%-ным раствором пищевой соды. Если больной не потерял сознания, нужно дать ему слабительное на основе солевого раствора или вызвать рвоту специальным средством.
- Умеренным противоядием считается и сладкая теплая вода. (Известна история попытки отравления Г.Распутина цианистым калием, которая провалилась только потому, что яд был внесен в сладкие пирожные и вино, где под воздействием глюкозы синильная кислота нейтрализовалась).
Медикаментозное лечение антидотами
Квалифицированная помощь медиков при отравлении цианидами предполагает немедленное пероральное или внутривенное введение антидота. Сегодня известны 3 группы эффективных противоядий:
- Сахара – введение 5%-ной глюкозы способствует быстрому связыванию цианидов в безвредные соединения, которые выведутся организмом естественным образом.Сахар – самый простой и эффективный метод нейтрализовать цианистый калий
- Тиосульфат натрия – превращает цианистые в нетоксичные вещества – роданиды.
- Препараты метиленового синего, амилнитрита и нитроглицерина, образующие при взаимодействии с токсином цианметгемоглобин, легко выводящийся из организма.
- Обеспечение пострадавшего дополнительным кислородом в стационарных условиях.
Скорая медицинская помощь при наличии необходимых препаратов-антидотов может быть оказана по следующей схеме:
- давать пострадавшему каждые 2 минуты вдыхать пары Амилнитрита, пропитав этим веществом ватку;
- ввести 10 мл 2%-ного раствора Нитрита натрия внутривенно;
- далее – 50 мл 1%-ного раствора метиленового синего на основе 25%-ного раствора глюкозы;
- еще – 30-50 мл 30%-ного Тиосульфата натрия.
Если необходимые препараты ввести в первые же минуты после отравления, можно будет не допустить летального исхода. Все выше описанные процедуры, сделанные повторно с той же последовательностью спустя 1 час, усилят действие антидотов и улучшат прогнозы выживаемости.
Необходимо и самим соблюдать меры предосторожности. При потере сознания первое, чем многие пытаются помочь больному, – ничто другое, как сделать ему искусственное дыхание «рот в рот». При отравлении цианидами этого делать нельзя, так как можно отравиться выдыхаемыми пострадавшим парами, которые пахнут смертельной опасностью – горьким миндалем.
Что происходит с человеком, который выпил цианистый калий?
Калия цианид — яд, который пришел на смену мышьяку и не раз использовался в убийствах политических деятелей. После открытия особенностей белых кристаллов цианистый калий запретили в свободной продаже.
По мнению токсикологов, неорганическое вещество занимает пятое место в рейтинге быстродействующих ядов.
При работе с этим химическим компонентом соблюдать меры безопасности недостаточно — необходимо знать механизм действия яда и суметь вовремя помочь пострадавшему.
Что такое цианистый калий?
Цианид калия — производное синильной кислоты, обозначается химической формулой KCN. В твердом агрегатном состоянии выглядит как кристаллический порошок без цвета. Это неустойчивое соединение, так как синильная кислота представляет слабый комплекс ионных элементов.
Цианогруппу вытесняют любые соли более сильных кислот, которая улетучивается в виде паров. Газообразное состояние становится ядовитым, тогда как остаток обезвреживается.
Связи легко разрываются концентрированным раствором глюкозы, при термической обработке и в условиях повышенной влажности.
Виды и характерные особенности
Токсичное вещество встречается в персиках и 250 сортах сливовой культуры. При употреблении фруктов отравление не происходит, так как яд содержится в косточках.
В результате обмена веществ амигдалин из группы природных гликозидов расщепляется под действием соляной кислоты в желудке, образуя токсин. Остатки вещества распадаются на глюкозу, бензальдегид и синильную кислоту.
Сахар мгновенно нейтрализует образовавшееся количество цианида, в результате чего здоровью человека ничего не угрожает.
Характеристики:
- По внешнему виду напоминает кристаллы рафинированного сахара.
- Цианид свободно растворяется в воде, не влияя на цвет и плотность жидкости.
- В присутствии ядовитых паров или кристаллов человек ощущает легкий запах миндаля.
Обонятельные рецепторы 50 % людей распознают аромат. Особенность зависит от индивидуальных особенностей и генетического фактора. Из-за риска отравления сильно вдыхать воздух с ядовитыми парами не рекомендуется.
Где содержатся цианиды?
В природе кристаллы цианистого калия обнаружить нельзя. Опасное вещество вырабатывается клетками ядовитых растений. Присутствует в малых количествах в косточках:
- абрикосов;
- сливы;
- персиков;
- вишни.
Миндаль рекомендуется выбирать с осторожностью, только в сертифицированных торговых точках. Некачественный продукт способен отравить синильной кислотой.
Цианид применяется в производстве горнодобывающей отрасли, ювелирном деле, при изготовлении красок. Химическое отравление грозит сотрудникам промышленных предприятий, лаборантам и химикам. В бытовой сфере ядовитое соединение встречается в фотореактивах и средствах борьбы с насекомыми-вредителями.
Воздействие на человека и риск отравления
Существует гипотеза, что при попадании кристаллов в желудок мгновенно наступает летальный исход. Теория подтверждается только в 50 % клинических экспериментов над животными.
Цианистый калий опасен для человеческого организма, но вероятность моментальной смерти при пероральном употреблении минимальна. Принцип действия химического вещества сложен в понимании и разделяется в научной сфере на 4 стадии отравления:
- Молекулы кислорода проникают в клетки, вызывая окислительные процессы благодаря дыхательному ферменту — цитохромоксидазе. В ходе научно-исследовательской деятельности ставили эксперимент на животных. При употреблении ядовитого компонента с пищей венозная кровь крыс окрашивалась в ярко-алый оттенок, аналогичный цвету артериального русла. В заключении отмечено, что цианид калия блокирует действие цитохромоксидазы.
- Кислород перестает поступать в клеточные структуры, продолжая циркулировать в организме в комплексе с гемоглобином. Отравление цианидом развивает кислородное голодание.
-
Из-за нарушения дыхательного процесса клетки перестают получать энергию и погибают. При омертвении клеточных структур сбивается функционирование внутренних органов. Прекращает работу даже натрий-калиевый насос на фоне истощения энергетических запасов, в результате чего прекращается передача нервных импульсов.
- Отказ дыхательной и нервной систем вызывает летальный исход. Симптоматика схожа с удушьем.
По результатам исследований выявлено, что смерть наступает не мгновенно. Из-за недостатка кислорода человек способен потерять сознание, что окружающие воспринимают как летальный исход.
В течение минуты из-за прекращения работы диафрагмы дыхание не ощущается, сердце отказывается генерировать нервные импульсы. Пульс нитевидный.
Через 5 минут после остановки дыхания и сердцебиения организм умирает полностью.
https://www.youtube.com/watch?v=bIneZTKyb28
Ядовитое соединение способно проникать в тело не только при пероральном применении, но и путем вдыхания газообразного состояния, при попадании яда в организм через кожный покров диффузионным путем или при проникновении в кровеносное русло через раны.
Симптомы
В 85 % случаев поражение ядом принимает хроническую или острую форму. В последнем случае признаки отравления проявляются через 2–3 минуты после применения цианистого калия в пищу или при вдыхании в виде пара, порошка.
Быстрое действие обусловлено проникновением химического соединения в кровеносные сосуды через слизистые оболочки ротовой полости, пищевода, сквозь стенки желудка при пищеварительном акте.
В 4 фазах отравления наблюдаются разные симптомы:
| Наименование стадии | Признаки отравления |
| Продромальная (начало проявления признаков отравления) |
|
| Активный процесс кислородного голодания |
|
| Омертвение клеток |
|
| Летальный исход | После остановки клеточного дыхания смерть наступает в течение 5–20 минут в зависимости от принятой дозы |
Человек начинает чувствовать симптомы через 40 минут, если дозировка небольшая. Концентрация в крови не достигает смертельного уровня, и клетки печени справляются с обезвреживанием яда.
Отравление цианидами в хронической форме проходит мягче. Интоксикация длится несколько суток: ядовитые вещества накапливаются, постепенно ослабляя организм. С каждым днем повышается вероятность летального исхода. Симптомы начинают проявляться медленно.
Смерть нейронов головного мозга
Цианид калия циркулирует в крови до 4 часов. Если в течение этого срока не наступает летальный исход, организм начинает выводить яд, а человек выживает. Отравление накладывает отпечаток: происходит нарушение деятельности головного мозга из-за смерти нейронов в результате кислородного голодания. Восстановить потерянные связи невозможно.
Оказание первой помощи и лечение
При первых симптомах интоксикации необходимо вызвать бригаду «Скорой», после чего оказать оперативную первую помощь:
- Обеспечить доступ свежему воздуху. Если человек отравился парами — освободить от сдавливающей одежды.
- При попадании ядовитого соединения через ротовую полость нужно промыть желудок большим количеством воды, соды, слабым раствором марганцовки.
- Если отсутствует сознание, пульс не прощупывается, а дыхание остановилось, принимаются реанимационные меры. Два вдоха рот в рот искусственной вентиляции легких чередуются с 30 быстрыми нажатиями в области сердца.
- Токсин способен проникнуть через кожу, если пропитывает одежду. Ядовитую ткань необходимо снять, чтобы предотвратить дальнейшую интоксикацию.
В медицинском учреждении специалисты определяют степень отравления и вводят противоядие для нейтрализации цианистого калия. Назначаются анализ и терапия медикаментами, включая антидот. В тяжелой ситуации пациента госпитализируют и выводят цианид постепенно в условиях стационарного лечения.
Лекарственную помощь оказывают с помощью азотсодержащих препаратов и веществ, отдающих серные радикалы из метгемоглобинообразователей. Группы медикаментов сходятся в механизме действия — способствуют отделению молекул кислорода от гемоглобина, восстанавливая дыхательный процесс в клетках. На практике используют:
- пары Амилнитрита;
- внутривенный раствор Нитрита натрия;
- раствор Метиленового Синего.
Неожиданное открытие в начале XXI в. — противоядие против цианистого калия (глюкоза). Сахар стал причиной провалов ряда покушений на Распутина и слона Ямбо, так как убийцы клали яд в кондитерские изделия.
Если цианид уже попал в организм, принимать в пищу глюкозу бесполезно. Моносахарид способен ослабить действие токсина только при прямом контакте в результате реакции синтеза.
Аналогичным свойством обладает сера, молекулы которой нейтрализуют яд в желудке.
Токсикологи рекомендуют сотрудникам химических предприятий при взаимодействии с цианидом соблюдать не только меры безопасности, но и употреблять несколько кусочков сахара в качестве дополнительной защиты.
Повышение концентрации глюкозы в плазме крови после приема пищи способствует обезвреживанию токсина в сосудах.
При признаках хронической интоксикации необходимо прекратить контакт с ядовитым веществом и пройти медицинское обследование.
Профилактика
Острое отравление одним из смертельных ядов нарушает деятельность головного мозга и способно привести к летальному исходу. 85 % случаев отравления цианистым калием приходятся на долю рабочих лабораторий и горнодобывающей промышленности. Работники соответствующих профессий должны соблюдать технику безопасности:
- При утечке паров и нарушении герметичности оборудования требуется немедленно покинуть помещение.
- Работать необходимо только в специальных защитных костюмах.
- Перед взаимодействием с токсином нужно надеть очки, потому что ядовитое соединение способно оседать на контактных линзах.
- В аптечке рабочего помещения требуется хранить противоядие.
- Необходимо уметь оказывать первую помощь и знать реанимационные действия.
При медленном воздействии яда на организм обостряются хронические заболевания, сбивается работа органов и систем. Не рекомендуется работать с цианидом или пытаться получить вещество в домашних условиях. Неизвестно, какую дозировку яда способен получить человек при вдохе или прямом контакте. Высока вероятность летального исхода, поэтому необходимо соблюдать крайнюю осторожность.
Что такое цианид? Цианиды и их влияние на организм человека
В 1945 году был издан роман «Сверкающий цианид» Агаты Кристи. Детектив получился увлекательным и интересным. Однако далеко не все знают, что подобного цианида не существует. Так что же собой представляет это вещество и как оно влияет на организм человека?
Что такое цианид?
Цианиды – это класс быстродействующих веществ, которые оказывают пагубное воздействие на организм человека. Иными словами, это яды. Их токсичность легко объяснить негативным воздействием некоторых их составляющих на клеточное дыхание.
В свою очередь, нарушается работа всего организма. Клетки просто перестают функционировать.
После этого важные системы организма перестают выполнять свои функции, и возникает патологическое тяжелое состояние, которое чаще всего заканчивается летальным исходом.
[attention type=red]
Так что такое цианид? Прежде всего, это производные синильной кислоты. Формула цианистого калия достаточно проста: KCN. Впервые это вещество было получено немецким химиком Робертом Вильгельмом Бунзеном. Помимо этого, ученый разработал еще и промышленные способы его синтеза. Произошло это в 1845 году.
[/attention]
Цианид калия представляет собой порошок белого цвета с кристаллической структурой. Вещество прекрасно растворяется в воде. Яд обладает своеобразным запахом, однако почувствовать его могут около 50 % населения нашей планеты. Стоит отметить, что цианид калия является неустойчивым веществом. Оно окисляется в растворах, содержащих глюкозу, и при достаточном уровне влажности.
Также нередко встречается и цианид натрия. Формула этого вещества: NaCN. Цианид натрия представляет собой белый пластилин, порошок, пасту или гигроскопические кристаллы. Вещество также неустойчивое. Оно быстро растворяется в ментоле и в воде.
Сам по себе цианид натрия не горюч. Однако при контакте с влажным воздухом вещество выделяет газ, который легко воспламеняется. При горении цианид натрия выделяет токсические и раздражающие пары. Они способны вызвать серьезное отравление.
Также летучие вещества образует и гидролиз цианидов.
Цианид в растениях
Что такое цианид, разобрались. Но как его получают и для чего? Цианиды производятся не только синтетическим путем. Эти вещества встречаются и в природе. Это повышает риск намеренного или же случайного отравления. Яд можно получить из определенных продуктов питания и растений. Именно по этой причине следует знать все источники цианида.
В список опасных продуктов входит бобы Лимы, миндаль и маниока. Помимо этого, цианид содержится в косточках груши, сливы, абрикоса, вишни, персика и даже яблок. Отравление же наступает только в тех случаях, когда в организм поступает чрезмерное количество опасных продуктов. В группе риска находятся те люди, у которых имеется индивидуальная непереносимость.
Применение цианида
Растворы цианидов применяются во многих отраслях промышленности. Эти вещества обычно используют для изготовления бумаги, пластмассы и некоторых разновидностей текстиля.
Как правило, яд присутствует во многих реактивах, которые используются для проявления фотографий.
В металлургии рассматриваемое нами вещество задействуют для очистки гальваники и металлов, а также для выделения из руд золота.
Помимо этого, цианид используется в виде газа в сочетании с другими веществами с целью обеззараживания хранилищ с зерном. Подобные составы позволяют уничтожить грызунов.
Влияние на организм
При попадании цианида в живой организм происходит блокировка особого фермента – цитохромоксидаза. В результате ткани недополучают необходимое количество кислорода. Это приводит к развитию асфиксии.
Прежде всего, гипоксия тканей затрагивает головной мозг. В результате развивается паралич ЦНС. Все это приводит к быстрому летальному исходу. Что касается симптомов отравления, то они возникают практически моментально.
Тяжесть состояния больного зависит в первую очередь от того, каким путем яд попал в организм. При вдыхании паров и газов отравление наступает мгновенно. Крайне редко цианид проникает через кожные покровы и желудочно-кишечный тракт. В таких случаях симптомы отравления могут проявляться постепенно.
Когда проявляются признаки отравления
Как уже было сказано, признаки отравления и степень их проявления зависят от того, каким путем яд попал в организм и в каком количестве. Для человека смертельная доза цианида составляет всего лишь 0,1 мг/л. Смерть наступает в течение часа. Если же в организм попало 0,12-0,15 мг/л, то человек умирает за полчаса.
Если же концентрация ядовитого вещества увеличена до 0,2 мг, то летальный исход наступает уже через 10 минут. Стоит учесть, что человек способен выдержать отравление цианидом при определенных условиях. Это возможно, если концентрация отравляющего вещества не превышает 0,55 мг/л и воздействует яд не более одной минуты.
Если цианид проник в организм вместе с газом, то симптомы наблюдаются спустя пару секунд. Если же отравляющее вещество попало через желудок, клиническая картина развивается спустя несколько минут.
Основные симптомы отравления
Цианид – яд, который начинает действовать сразу, как только попал в организм человека. При высоких дозировках отравляющего вещества симптомы отравления проявляются моментально. Вот основные признаки:
- Прежде всего пострадавший теряет сознание.
- Мгновенно наступает паралич системы органов дыхания. Помимо этого, блокируется работа сердечных мышц.
- Летальный исход.
При незначительных дозировках симптомы возникают постепенно:
- Для начальной стадии отравления цианидами характерно головокружение, острая и быстро нарастающая головная боль, учащенное сердцебиение и дыхание, ощущение тяжести в лобных долях, прилив к голове крови.
- Вторая стадия – одышка. При этом дыхание становится шумным, глубоким и редким. Пульс у пострадавшего замедляется, возникает тошнота, рвота, расширяются зрачки.
- На следующей стадии человек теряет сознание. Нередко тетанические судороги вызывают спазмы жевательной мускулатуры, что может закончиться прикусыванием языка.
- Следующая стадия – паралич. Пострадавший утрачивает не только рефлексы, но и чувствительность. Дыхание очень редкое. Помимо этого, возможно непроизвольное опорожнение кишечника и мочеиспускание. Если не оказать пострадавшему первую помощь, то сердечная деятельность прекратится и наступит смерть.
В завершение
Теперь вы знаете, что такое цианид и как он воздействует на организм человека. Увы, не всегда это вещество применялось в мирных целях.
Цианистый водород во время Второй мировой войны входил в состав такого отравляющего газа, как «Циклон-Б». Это оружие широко применялось немецкими войсками.
Также существует мнение, что этот отравляющий газ использовался и в 1980 году в период войны между Ираном и Ираком.
Цианистый калий
цианистый калий
Из всех ядов цианистый калий имеет наиболее дурную славу. В детективных романах использование этого цианида злоумышленниками — очень популярный способ избавиться от нежелательных лиц. Очевидно, широкая известность яда связана ещё и с доступностью его на рубеже XIX–XX веков, когда порошок можно было запросто купить в аптеке.
А между тем цианистый калий не самое опасное и ядовитое вещество — по летальной дозе он уступает таким прозаическим ядам, как никотин или ботулотоксин. Так что такое цианистый калий, где он применяется и как воздействует на организм человека? Соответствует ли его слава реальному положению вещей?
Что такое цианистый калий
Яд относится к группе цианидов — производных синильной кислоты. Формула цианистого калия — KCN. Вещество впервые получил немецкий химик Роберт Вильгельм Бунзен в 1845 году, он же разработал промышленный способ его синтеза.
По внешнему виду цианистый калий — это бесцветный кристаллический порошок, хорошо растворимый в воде. В справочниках описано, что цианистый калий имеет специфический запах горького миндаля.
Но эта его характеристика не всегда верна — ощутить такой запах способны примерно 50% человек. Полагают, что это связано с индивидуальными различиями обонятельного аппарата. Цианистый калий — не очень устойчивое соединение.
[attention type=green]
Поскольку синильная кислота является слабой, то цианогруппа легко вытесняется из соединения солями более сильных кислот. В результате цианогруппа улетучивается, а вещество теряет свои ядовитые свойства.
[/attention]
Также цианиды окисляются при доступе влажного воздуха или в растворах с глюкозой. Последнее свойство позволяет использовать глюкозу как один из антидотов при отравлении синильной кислой и её производными.
Где содержатся цианиды
горно-обогатительная промышленность
Для чего же нужен цианистый калий человеку? Его применяют в горно-обогатительной промышленности и на гальванических производствах. Поскольку благородные металлы не способны окисляться кислородом напрямую, то для катализации процесса используют растворы цианида калия или натрия.
Хроническое отравление цианистым калием могут получить люди и не связанные с производством. Так, в начале 2000 годов были случаи токсических выбросов с горно-обогатительных предприятий на территории Румынии и Венгрии в реку Дунай, в результате чего пострадали люди, живущие в окрестностях поймы.
Рискуют получить хроническое заболевание работники специальных лабораторий, соприкасающиеся с ядом в качестве реактива.
В бытовых условиях цианиды можно найти в реактивах для фотолабораторий, в средствах для чистки ювелирных изделий. Небольшие количества цианистого калия используются энтомологами в морилках для насекомых.
Также есть художественные краски (гуашь, акварель), в состав которых входят цианиды — «прусская синяя», «берлинская лазурь», «милори».
Там они находятся в соединении с железом и придают красителю насыщенный лазурный цвет.
В чём содержится цианистый калий в природе? В чистом виде вы его не встретите, но соединение с цианогруппой — амигдалин, содержится в косточках абрикосов, слив, вишен, миндаля, персиков; листьях и побегах бузины.
[attention type=yellow]
При расщеплении амигдалина образуется синильная кислота, которая действует аналогично цианистому калию.
[/attention]
Смертельное отравление можно получить от 1 гр амигдалина, что соответствует примерно 100 гр ядер абрикосовых косточек.
Как действует цианистый калий на организм человека? Яд блокирует клеточный фермент — цитохромоксидазу, которая отвечает за усвоение кислорода клеткой. В результате кислород остаётся в крови и циркулирует там в связанном с гемоглобином виде.
Поэтому при отравлении цианидами даже венозная кровь имеет ярко-алое окрашивание. Без доступа кислорода обменные процессы внутри клетки останавливаются и организм быстро погибает.
Эффект равносилен тому, как если бы отравленный просто задохнулся из-за недостатка воздуха.
Цианистый калий ядовит при попадании внутрь, при вдыхании порошка и паров раствора; также может проникать через кожу, особенно если на ней есть повреждения. Смертельная доза цианистого калия для человека составляет 1,7 мг/кг веса. Препарат относится к группе сильнодействующих ядовитых веществ, использование его контролируется со всей возможной строгостью.
Действие цианидов ослабевает в сочетании с глюкозой. Работники лабораторий, вынужденные соприкасаться с этим ядом во время работы держат за щекой кусочек сахара. Это позволяет обезвредить случайно попавшие в кровь микроскопические дозы токсина.
[attention type=red]
Также яд медленнее всасывается на полный желудок, что позволяет организму уменьшить его вредное воздействие путём окисления глюкозой и некоторыми другими соединениями крови. Небольшое количество цианид-ионов, порядка 140 мкг в одном литре плазмы, циркулируют в крови как естественный метаболит обмена веществ.
[/attention]
Например, они входят в состав витамина B12 — цианокобаламина. А в крови курильщиков их содержится в два раза больше.
Симптомы отравления цианистым калием
Каковы симптомы отравления цианистым калием? Действие яда проявляется очень быстро — при вдыхании практически моментально, при попадании в желудок — через несколько минут. Через кожу и слизистые цианиды всасываются медленно. Признаки отравления цианистым калием зависят от полученной дозы и индивидуальной чувствительности к яду.
https://www.youtube.com/watch?v=a5Hmlp6MX_E
При остром отравлении нарушения развиваются в четыре стадии.
Продромальная стадия:
-
першение в горле
першение в горле, ощущение царапанья;
- горечь во рту, возможен пресловутый привкус «горького миндаля»;
- онемение слизистой ротовой полости, глотки;
- слюнотечение;
- тошнота и рвота;
- головокружение;
- ощущение сдавливания в груди.
Вторая стадия — диспноэтическая, при ней признаки кислородного голодания нарастают:
- давление в груди усиливается;
- пульс замедляется, ослабевает;
- нарастает общая слабость;
- одышка;
- зрачки расширены, конъюнктива глаз краснеет, глазные яблоки выпячиваются;
- возникает чувство страха, переходящее в оглушённое состояние.
При получении смертельной дозы начинается третья стадия — судорожная:
-
обморок
судороги;
- прикус языка;
- непроизвольное мочеиспускание и дефекация;
- обморок.
Четвёртая стадия — паралитическая, приводит к смерти от цианистого калия:
- пострадавший без сознания;
- дыхание сильно замедляется;
- слизистые оболочки краснеют, проступает румянец;
- теряется чувствительность и рефлексы.
Смерть наступает через 20–40 минут (при попадании яда внутрь) от остановки дыхания и сердца. Если пострадавшие не погибают в течение четырёх часов, то, как правило, они выживают. Возможны последствия — остаточные нарушение мозговой деятельности из-за кислородного голодания.
При хроническом отравлении цианидами симптомы во многом обусловлены интоксикацией тиоцианатами (роданидами) — веществами второго класса опасности, в которые цианиды переходят в организме под воздействием сульфидных групп. Тиоцианаты вызывают патологию щитовидной железы, вредно действуют на печень, почки и провоцируют развитие гастрита.
Первая помощь при отравлении
Пострадавший нуждается в скорейшем введении антидотов цианистого калия, которых существует несколько. До введения специфического противоядия необходимо облегчить состояние больного — удалить яд из желудка путём промывания:
- 0,1% раствором марганцовки;
- 2% раствором питьевой соды;
- 2% раствором перекиси водорода;
- 5% раствором тиосульфата натрия.
Затем дать сладкое тёплое питье.
Если пострадавший без сознания, то помочь ему может, только медицинский работник. В случае остановки дыхания проводят искусственную вентиляцию лёгких.
В случае если есть вероятность попадания цианистого калия на одежду, необходимо снять её и обмыть кожу больного водой.
Лечение
Принимают меры для поддержания жизнедеятельности — вводят дыхательную трубку и внутривенный катетер. Цианистый калий — яд, к которому имеется несколько антидотов. Применяют их все, поскольку они имеют разный механизм действия. Противоядие эффективно действует даже на последних стадиях отравления.
- Метгемоглобинобразователи отщепляют кислород от гемоглобина и позволяют ему забирать молекулы цианида из клеток. К этой группе относятся оксиды азота, нитраты и нитриты, нитроглицерин, амилнитрит, метиленовый синий.
- Амилнитрит капают на ватку и дают нюхать каждые две минуты.
- Нитрит натрия вводят внутривенно в форме 2% раствора.
- Метиленовый синий 1% раствор на 25% растворе глюкозы внутривенно.
При этом ориентируются на то, чтобы уровень метгемоглобина в крови не превышал 25–30%.
- Растворы веществ, легко отдающих серу, нейтрализуют цианиды в крови. Применяют 25% раствор тиосульфата натрия.
- Раствор глюкозы 5 или 40%.
Для возбуждения дыхательного центра вводят препараты «Лобелин» или «Цититон».
Подводя итоги, можно сказать, следующее. Токсическое действие цианистого калия на человека заключается в блокировке механизма клеточного дыхания, в результате чего очень быстро наступает смерть от удушья и паралича. Помочь могут лекарственные препараты-противоядия — амилнитрит, тиосульфат натрия, глюкоза. Их вводят внутривенно или делают ингаляции.
Для профилактики хронических отравлений на производствах необходимо соблюдать общие меры по технике безопасности: избегать прямого контакта с ядом, пользоваться защитными средствами, регулярно проводить медицинские профосмотры.