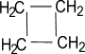
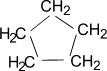
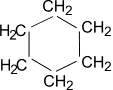
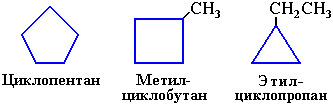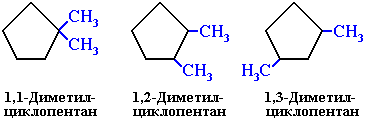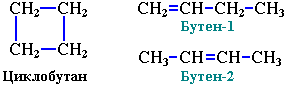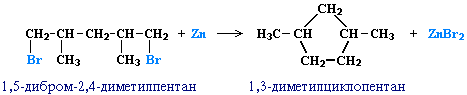Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл.
Общая формула циклоалканов CnH2n, где n≥3.
Строение, номенклатура и изомерия циклоалканов
Химические свойства циклоалканов
Получение циклоалканов
Строение циклоалканов
Атомы углерода в молекулах циклоалканов находятся в состоянии sp3-гибридизации и образует четыре σ-связи С–С и С–Н. В зависимости от размеров цикла меняются валентные углы.
В малых циклах (циклопропан и циклобутан) валентные углы между связями С–С сильно отличаются от валентных углов между связями С–С в алканах (109о35′). Поэтому в малых циклах возникает напряжение, которое приводит к высокой реакционной способности таких циклоалканов.
Самый простой циклоалкан — циклопропан, представляет, по сути, плоский треугольник.
σ-Связи в циклопропане называют «банановыми». Они не лежат вдоль оси, соединяющей ядра атомов, а отклоняются от неё, уменьшая напряжение в молекуле циклопропана.
По свойствам «банановые» связи напоминают π-связи. Они легко разрываются.
Поэтому циклопропан очень легко вступает в реакции присоединения с разрывом углеродного цикла.
Остальные циклоалканы имеют неплоское строение. Молекула циклобутана имеет перегиб по линии, соединяющей первый и третий атомы углерода в кольце:
Циклобутан также вступает в реакции присоединения, но угловое напряжение в циклобутане меньше, чем в циклопропане, поэтому реакции присоединения к циклобутану протекают сложнее.
Большие циклы имеют более сложное, неплоское строение, вследствие чего угловое напряжение в молекулах больших циклоалканов почти отсутствует.
Циклоалканы с большим циклом не вступают в реакции присоединения. Для них характерны реакции замещения.
Строение циклопентана также неплоское, молекула представляет собой так называемый «конверт».
Молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
«кресло» «ванна»
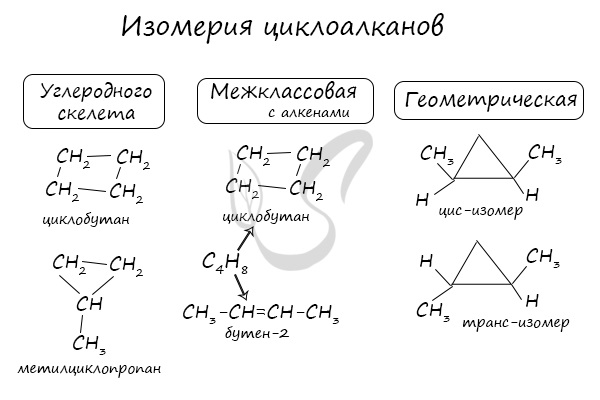
Изомерия циклоалканов
Структурная изомерия
Для циклоалканов характерна структурная изомерия, связанная с разным числом углеродных атомов в кольце, разным числом углеродных атомов в заместителях и с положением заместителей в цикле.
- Изомеры с разным числом атомов углерода в цикле отличаются размерами углеродного цикла.
Изомеры с разным числом углеродных атомов в цикле – это этилциклопропан и метилциклобутан с общей формулой С5Н10
- Изомеры с разным числом атомов углерода в заместителях отличаются строением заместителей у одинакового углеродного цикла.
Структурные изомеры с различным числом углеродных атомов в заместителях – 1-метил-2-пропилциклопентан и 1,2-диэтилциклопентан
- Изомеры с разным положением одинаковых заместителей в углеродном цикле.
- Межклассовая изомерия: циклоалканы изомерны алкенам.
Формуле С3Н6 соответствуют циклопропан и пропен.
Геометрическая (цис-транс-) изомерия
У циклоалканов с двумя заместителями, расположенными у соседних атомов углерода в цикле цис-транс-изомерия обусловлена различным взаимным расположением в пространстве заместителей относительно плоскости цикла.
В цис-изомерах заместители находятся по одну сторону от плоскости цикла, в транс-изомерах – заместители расположены по разные стороны.
В молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
Для 1,1-диметилциклопропана цис-транс-изомерия не характерна.
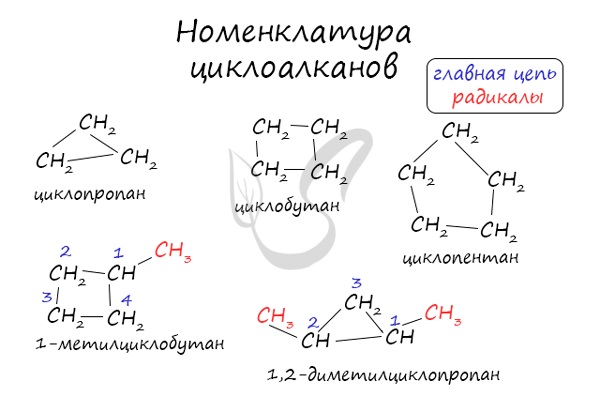
Номенклатура циклоалканов
В названиях циклоалканов используется префикс -ЦИКЛО.
Название циклоалканов строится по следующим правилам:
1. Цикл принимают за главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями.
2. Нумеруют атомы углерода в цикле так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 1,1-диметилциклопропан или 1,1,3-триметилциклопентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 1,1-диметил-3-этилциклопентан.
5. Называют углеродный цикл.
Химические свойства циклоалканов
Циклоалканы с малым циклом (циклопропан, циклобутан и их замещенные гомологи) из-за большой напряженности в кольце могут вступать в реакции присоединения.
1. Реакции присоединения к циклоалканам
Чем меньше цикл и чем больше угловое напряжение в цикле, тем легче протекают реакции присоединения. Способность вступать в реакции присоединения уменьшается в ряду: циклопропан > циклобутан > циклопентан.
1.1. Гидрирование циклоалканов
С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана.
Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:
Циклопентан присоединяет водород в жестких условиях:
Бромирование протекает более медленно и избирательно.
Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют.
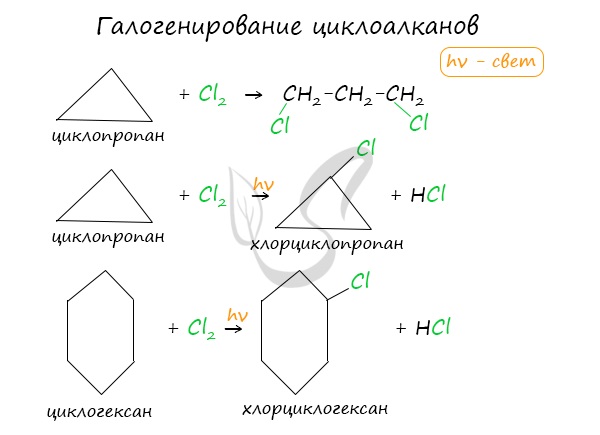
1.2. Галогенирование циклоалканов
Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит присоединение галогенов к молекуле, сопровождающееся разрывом кольца.
Например. Циклопропан присоединяет бром с образованием 1,3-дибромпропана:
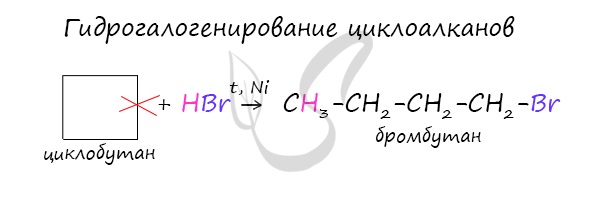
1.3. Гидрогалогенирование
Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
Например, циклопропан присоединяет йодоводород.
Присоединение галогеноводородов к гомологам циклопропана с заместителями у трехатомного цикла (метилциклопропан и др.) происходит по правилу Марковникова.
Например, при присоединении бромоводорода к метилциклопропану преимущественно образуется 2-бромбутан
2. Реакции замещения
Поэтому большие циклы гораздо более устойчивы, чем малые, и реакции присоединения с разрывом связей С-С для них не характерны. В химических реакциях они ведут себя подобно алканам, вступая в реакции замещения без разрыва кольца.
2.1. Галогенирование
Галогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
Например, при хлорировании циклопентана на свету или при нагревании образуется хлорциклопентан
При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:
2.2. Нитрование циклоалканов
При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
Например, нитрование циклопентана.
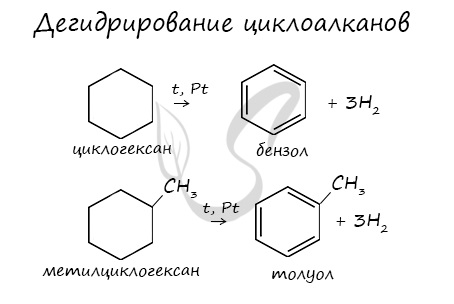
2.3. Дегидрирование
При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода.
Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
Например, бензол образуется при дегидрировании циклогексана.
Например, при отщеплении водорода от метилциклогексана образуется толуол.
3. Окисление циклоалканов
3.1. Горение
Как и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, горение циклопентана.
2C5H10 + 15O2 → 10CO2 + 10H2O + Q
3.2. Окисление
При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:
Получение циклоалканов
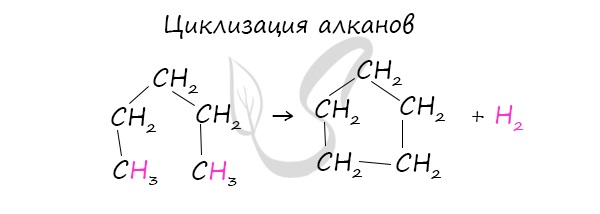
1. Дегидрирование алканов
Алканы с длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при нагревании в присутствии металлических катализаторов образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
Дегидроциклизация алканов — важный промышленный способ получения циклоалканов.
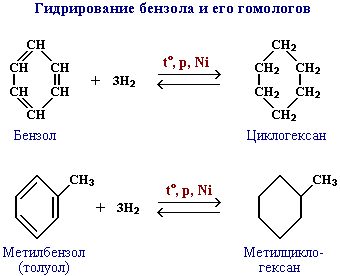
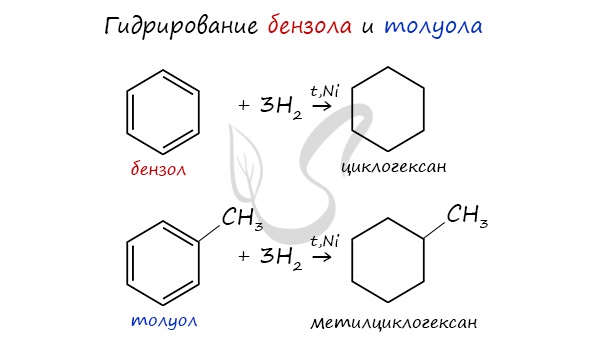
2. Гидрирование бензола и его гомологов
При гидрировании бензола при нагревании и в присутствии катализатора образуется циклогексан:
При гидрировании толуола образуется метилциклогексан:
Этим способом можно получить только циклогексан и его гомологи с шестичленным кольцом.
3. Дегалогенирование дигалогеналканов
При действии активных металлов на дигалогеналканы, в которых между атомами галогенов находится три и более атомов углерода.
Например, 1,4-дибромбутан реагирует с цинком с образованием циклобутана
Таким образом можно синтезировать циклоалканы заданного строения, в том числе циклоалканы с малыми циклами (С3 и С4).
Циклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только
простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их
гомологического ряда — CnH2n.
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом:
циклопропан, циклобутан и т.д.
Как и у алканов, атомы углерода циклоалканов находятся в sp3 гибридизации.
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде
существования цис- и транс-изомеров.
Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
- Из ароматических углеводородов
- Циклизация алканов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)

Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана
реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Дегидрирование
- Изомеризация
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ — не вступают, но на самом деле эти реакции идут, просто крайне затруднены).

Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция
идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола.
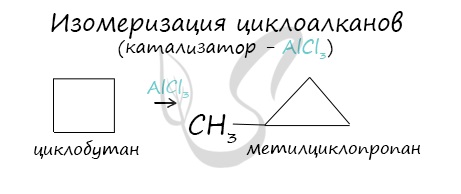
В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Циклоалканы — предельные циклические углеводороды.
Общая формула гомологического ряда CnH2n.
|
|
|
|
|
|
Циклопропан |
Циклобутан |
Циклопентан |
Циклогексан |
|
Малые циклы |
Большие циклы |
Строение циклоалканов.
Каждый атом углерода в циклоалканах находится в состоянии sp3-гибридизации и образует четыре σ-связи С-С и С-Н.
Углы между связями зависят от размера цикла. В малых циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность.
σ-связи в циклопропане называют «банановыми». По свойствам они напоминают ПИ-связи. Поэтому молекулу циклопропана очень легко разорвать и поэтому он способен вступать в реакции присоединения (с разрывом цикла).
Циклобутан в пространстве имеет перегиб по линии, соединяющей 1 и 3 атом С в кольце:
Циклопентан имеет форму, которую называют «конверт»:
Большие циклы очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
а — кресло б — ванна.
И в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.
Изомерия:
1. Структурная изомерия, связанная:
a) с числом углеродных атомов в кольце:
 (этилциклопропан),
(этилциклопропан),  (метилциклобутан);
(метилциклобутан);
b) с числом углеродных атомов в заместителях:
 (1-метил-2-пропилциклопентан),
(1-метил-2-пропилциклопентан),  (1,2-диэтилциклопентан)
(1,2-диэтилциклопентан)
c) с положением заместителя в кольце:
 (1,1-диметилциклогексан),
(1,1-диметилциклогексан),  (1,2-диметилциклогексан)
(1,2-диметилциклогексан)
2. Межклассовая изомерия: циклоалканы изомерны алкенам.
3. Геометрическая цис-транс-изомерия:
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
цис-изомер транс-изомер
Получение.
1. Отщепление двух атомов галогена от дигалогеналканов:
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные: C6H6 + 3H2 -t°,р,Ni→ C6H12.
Химические свойства.
1. Малые циклы (циклопропан и циклобутан) из-за большой напряженности кольца (малые углы) легко разрываются, вступая в реакции присоединения.
1) Гидрирование. При каталитическом гидрировании трех-, четырех- и даже пятичленные циклы разрываются с образованием алканов.
(циклопропан) + H2 —120ºC,Ni🡪 CH3–CH2–CH3
(циклопентан)+ H2—300ºC,Pd🡪CH3–CH2–CH2–CH2–CH3
Пятичленный цикл разрывается только при высоких температурах.
2) Галогенирование. Циклопропан и циклобутан разрываются, присоединяя атомы галогена.
+ Br2 🡪 BrCH2–CH2–CH2Br (1,3- дибромпропан)
3)Гидрогалогенирование. Циклопропан и замещенные циклопропаны взаимодействуют с галогеноводородами с разрывом цикла.
В случае замещенных циклопропанов реакция идёт в соответствии с правилом Марковникова.
Другие циклоалканы с галогеноводородами не реагируют.
2. Большие циклы – циклопентан и циклогексан – гораздо более устойчивы, цикл в них не разрывается. Они ведут себя подобно алканам, вступая в реакции замещения: галогенирование на свету, нитрование.
1) Галогенирование: циклопентан и циклопентан реагируют с галогенами на свету, вступая в реакцию замещения.
+ Cl2-(свет)🡪
(хлорциклопентан) + HCl
2) Нитрование.
Циклопентан + HNO3 –(t,p)🡪 нитроциклопентан + вода.
3. Дегидрирование. Производные циклогексана дегидрируются в производные бензола:
|
|
––300°C,Pd🡪 |
|
+ 3H2 |
4. Горение. Как и любые органические вещества, циклоалканы горят с образованием углекислого газа и воды.
Циклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только
простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их
гомологического ряда — CnH2n.
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом:
циклопропан, циклобутан и т.д.

Как и у алканов, атомы углерода циклоалканов находятся в sp3 гибридизации.
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде
существования цис- и транс-изомеров.

Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
- Из ароматических углеводородов
- Циклизация алканов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.

При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.

В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)

Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана
реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Дегидрирование
- Изомеризация
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ — не вступают, но на самом деле эти реакции идут, просто крайне затруднены).

Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция
идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.

В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.

При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола.

В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Чтобы поделиться, нажимайте
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины, нафтены). Общая формула гомологического ряда циклоалканов CnH2n. Представителями этого ряда соединений являются циклопропан, циклобутан, циклопентан, циклогексан.
 |
|
|
|
|
Циклопропан |
Циклобутан |
Циклопентан |
Циклогексан |
Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми геометрическими фигурами
Физические свойства
Циклоалканы имеют более высокие температуры плавления, кипения и большую плотность, чем соответствующие алканы. При одинаковом составе температура кипения циклопарафина тем выше, чем больше размер цикла. Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях. Физические свойства некоторых циклоалканов представлены в таблице.
Таблица. Физические свойства некоторых циклоалканов
| Соединение | t°пл., °С |
t°кип., °С |
| Циклопропан | -126,9 | -33 |
| Метилциклопропан | -177,2 | 0,7 |
| Циклобутан | — 80 | 13 |
| Метилциклобутан | -149,3 | 36,8 |
| Циклопентан | — 94,4 | 49,3 |
| Метилциклопентан | -142,2 | 71,9 |
| Циклогексан | 6,5 | 80,7 |
Изомерия циклоалканов
Для циклоалканов характерны как структурная, так и пространственная изомерия.
Структурная изомеpия
1. Изомерия углеродного скелета:
а) кольца
б) боковых цепей
2. Изомерия положения заместителей в кольце:
3. Межклассовая изомерия с алкенами:
Пространственная изомерия
1. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные:
2. Оптическая изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение:
3. Конформационная изомерия циклоалканов. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями. Это достигается поворотами по σ-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, т.е. более устойчивые. Например, в циклогексане наиболее устойчивой является конформация «кресла».
Химические свойства
Химические свойства циклопарафинов зависят от числа атомов углерода, составляющих цикл. Низшие циклоалканы (циклопропан и циклобутан) ведут себя как ненасыщенные углеводороды, они способны вступать в реакции присоединения. Циклоалканы с большим количеством углеродных атомов в цикле ведут себя как алканы, для них характерны реакции замещения.
Реакции горения:
CnH2n + 3n/2O2 — t → nCO2 + nH2O +Q
|
Малые циклы (n=3,4) |
| Реакции присоединения – сходство с алкенами.
1) Галогенирование: C3H6 + Br2 → C3H6Br2 (1,3-дибромпропан ) циклопропан 2) Гидрирование: C4H8 + H2 — t,Ni или Pt → C4H10 ( бутан ) циклобутан 3) Гидрогалогенирование (по правилу Марковникова): C3H6 + HI → CH3-CH2-CH2I ( 1- йодпропан ) |
|
Обычные циклы (n=5-7) |
| Реакции замещения – сходство с алканами.
1) Галогенирование: C6H12 + Br2 — t → C6H11Br + HBr бромциклогексан Реакции отщепления – дегидрирования циклогексана (р. Зелинского-Казанского): C6H12 — t=300˚С ,Pt,Pd→ C6H6 + 3H2 бензол |
Получение циклоалканов
|
В промышленности |
| 1) Из нефти (пяти- и шестичленных)
Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий — нафтены). При переработке нефти выделяют главным образом циклоалканы С5 — С7. 2) Из ароматических углеводородов – каталитическое гидрирование: C6H6 + H2 —t,p,Ni→ C6H12 |
|
В лаборатории |
| Из дигалогенпроизводных алканов (внутримолекулярная реакция Вюрца):
Br-CH2-CH2-CH2-Br + Mg — t → MgBr2 + C3H6 или Cl-CH2-CH2-CH2-CH2-Cl + 2Na → 2NaCl + C4H8 |
Применение
Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
Мы подготовили полезные таблички с теорией по циклоалканам. Наибольшие трудности у ребят вызывают химические свойства — забирай к себе и обязательно повтори перед ЕГЭ по химии!
🔹 ОБЩИЕ СВЕДЕНИЯ
Циклоалканы — предельные углеводороды с общей формулой CnH2n.
Простейший циклоалкан — циклопpопан С₃Н₆ — представляет собой плоский трехчленный цикл. Остальные циклоалканы имеют неплоское строение!
Атомы углерода находятся в состоянии sp³-гибридизации и образуют по 4 σ-связи.
Для циклоалканов характерна структурная изомерия и пространственная изомерия (при условии наличия двух разных заместителей у двух атомов углерода).
🔹 НОМЕНКЛАТУРА
Главной считается цепь углеродных атомов, образующих цикл.
Нумерацию проводят так, чтобы заместители имели как можно меньший номер.
🔹 ФИЗИЧЕСКИЕ СВОЙСТВА
С₃Н₆ и C₄H₈ — газы
C₅H₁₀ и C₆H₁₂ — жидкости
🔹 СПОСОБЫ ПОЛУЧЕНИЯ
1️⃣ Добыча из нефти
2️⃣ Дегалогенирование дигалогеналканов
Условие: t°C
Сl-CH₂-CH₂-CH₂-Cl + Zn → циклопропан + ZnCl₂ (t°C)
СH₃-CH(Cl)-CH₂-CH₂-Cl + Mg → метилциклопропан + MgCl₂ (t°C)
3️⃣ Гидрирование бензола и его гомологов
Условие: t°C, p, Ni
C₆H₆ + 3H₂ → C₆H₁₂ (t°C, p, Ni)
🔹 ПРИМЕНЕНИЕ
Циклогексан является для получения капролактама, нейлона (через адипиновую кислоту).
Циклопропан оказывает сильное общеобезболивающее действие, используется в медицинских целях.


Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Чтобы поделиться, нажимайте
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины, нафтены). Общая формула гомологического ряда циклоалканов CnH2n. Представителями этого ряда соединений являются циклопропан, циклобутан, циклопентан, циклогексан.
 |
|
|
|
|
Циклопропан |
Циклобутан |
Циклопентан |
Циклогексан |
Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми геометрическими фигурами
Физические свойства
Циклоалканы имеют более высокие температуры плавления, кипения и большую плотность, чем соответствующие алканы. При одинаковом составе температура кипения циклопарафина тем выше, чем больше размер цикла. Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях. Физические свойства некоторых циклоалканов представлены в таблице.
Таблица. Физические свойства некоторых циклоалканов
| Соединение | t°пл., °С |
t°кип., °С |
| Циклопропан | -126,9 | -33 |
| Метилциклопропан | -177,2 | 0,7 |
| Циклобутан | — 80 | 13 |
| Метилциклобутан | -149,3 | 36,8 |
| Циклопентан | — 94,4 | 49,3 |
| Метилциклопентан | -142,2 | 71,9 |
| Циклогексан | 6,5 | 80,7 |
Изомерия циклоалканов
Для циклоалканов характерны как структурная, так и пространственная изомерия.
Структурная изомеpия
1. Изомерия углеродного скелета:
а) кольца
б) боковых цепей
2. Изомерия положения заместителей в кольце:
3. Межклассовая изомерия с алкенами:
Пространственная изомерия
1. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные:
2. Оптическая изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение:
3. Конформационная изомерия циклоалканов. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями. Это достигается поворотами по σ-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, т.е. более устойчивые. Например, в циклогексане наиболее устойчивой является конформация «кресла».
Химические свойства
Химические свойства циклопарафинов зависят от числа атомов углерода, составляющих цикл. Низшие циклоалканы (циклопропан и циклобутан) ведут себя как ненасыщенные углеводороды, они способны вступать в реакции присоединения. Циклоалканы с большим количеством углеродных атомов в цикле ведут себя как алканы, для них характерны реакции замещения.
Реакции горения:
CnH2n + 3n/2O2 — t → nCO2 + nH2O +Q
|
Малые циклы (n=3,4) |
| Реакции присоединения – сходство с алкенами.
1) Галогенирование: C3H6 + Br2 → C3H6Br2 (1,3-дибромпропан ) циклопропан 2) Гидрирование: C4H8 + H2 — t,Ni или Pt → C4H10 ( бутан ) циклобутан 3) Гидрогалогенирование (по правилу Марковникова): C3H6 + HI → CH3-CH2-CH2I ( 1- йодпропан ) |
|
Обычные циклы (n=5-7) |
| Реакции замещения – сходство с алканами.
1) Галогенирование: C6H12 + Br2 — t → C6H11Br + HBr бромциклогексан Реакции отщепления – дегидрирования циклогексана (р. Зелинского-Казанского): C6H12 — t=300˚С ,Pt,Pd→ C6H6 + 3H2 бензол |
Получение циклоалканов
|
В промышленности |
| 1) Из нефти (пяти- и шестичленных)
Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий — нафтены). При переработке нефти выделяют главным образом циклоалканы С5 — С7. 2) Из ароматических углеводородов – каталитическое гидрирование: C6H6 + H2 —t,p,Ni→ C6H12 |
|
В лаборатории |
| Из дигалогенпроизводных алканов (внутримолекулярная реакция Вюрца):
Br-CH2-CH2-CH2-Br + Mg — t → MgBr2 + C3H6 или Cl-CH2-CH2-CH2-CH2-Cl + 2Na → 2NaCl + C4H8 |
Применение
Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.