Всего: 25 1–20 | 21–25
Добавить в вариант
Из предложенного перечня выберите два вещества, которые имеют цис-транс-изомеры.
1) гексен-3
2) 2-метилпропен
3) 1,2-диметилциклогексан
4) 1,2-диметилбензол
5) бутин-2
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите два вещества, для которых возможна цис-транс-изомерия.
1) гексен-2
2) бутин-1
3) 2,3-диметилпентан
4) 2,3-диметилбутен-2
5) 1,3-диметилциклобутан
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, у которых возможна геометрическая (цис-транс-)изомерия.
1) бутен-2
2) 2-метилбутен-2
3) метилпропен
4) 1,1-диметилциклопропан
5) 1,2-диметилциклопропан
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, которые имеют пространственные цис-транс-изомеры.
1) З-метилгексен-2
2) 2,2-диметилпентан
3) циклогексан
4) пентен-2
5) бутин-2
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, которые могут существовать в виде цис-транс-изомеров.
1) этилен
2) бутен-1
3) бутен-2
4) 2-метилпентен-2
5) 3-метилгептен-3
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, у которых существуют цис-транс-изомеры.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, для которых возможна цис-транс-изомерия.
1) гексена-2
2) бутина-1
3) 1-хлоргептена-2
4) 2,3-диметилпентана
5) 2,3-диметилбутена-2
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1
Из предложенного перечня выберите два вещества, для которых возможна цис-транс-изомерия.
1) 2,3-диметилбутен-2
2) пентен-2
3) 2,3-диметилпентан
4) бутен-2
5) гексен-1
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 1
Из предложенного перечня выберите два вещества, для которых возможна цис-транс-изомерия.
1) гептен-3
2) бутин-2
3) 2,3-диметилпентан
4) бутен-2
5) метан
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, для которых возможна цис-транс-изомерия.
1) 2,3-дихлорбутен-2
2) пентан
3) 2,3-диметилгексан
4) 3-метилпентен-2
5) гептен-1
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, которые существуют в виде цис-транс-изомеров.
1) 1,1-дибромэтен
2) бутен-1
3) 2,3-дибромпропен
4) 1,2-дибромэтен
5) бутен-2
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
Для ацетальдегида характерна(-о)
1) sp-гибридизация атомов углерода
2) существование цис-, транс-изомеров
3) взаимодействие со спиртами
4) взаимодействие с гидроксидом меди(II)
5) реакция этерификации
6) реакция с водородом
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 3
Из предложенного перечня выберите два утверждения, характерные для вещества состава .
1) существование цис-транс-изомеров
2) наличие одинарной связи между атомами углерода
3) sр3-гибридизация орбиталей атомов углерода
4) наличие двойной связи между атомами углерода
5) наличие тройной связи между атомами углерода
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ
При сжигании дихлорциклоалкана и охлаждении продуктов сгорания до нормальных условий получена смесь газов массой 5,86 г и объёмом 3,136 л. Установите формулу и структуру органического вещества, если известно, что оно имеет неразветвлённый углеродный скелет и не имеет цис-транс-изомеров. Напишите уравнение реакции искомого вещества с разбавленным водным раствором щёлочи.
Из предложенного перечня выберите две пары веществ, в каждой из которых вещества являются пространственными изомерами.
1) цис-пентен-2 и транс-пентен-2
2) цис-1,2-дихлорэтилен и транс-1,2-дихлорэтилен
3) уксусная кислота и метилформиат
4) цис-пентен-2 и цис-1,2-диметилциклопропан
5) фенол и бензол
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых вещества являются геометрическими изомерами.
1) 2-метилбутан и 2,2-диметилпропан
2) цис-пентен-2 и транс-пентен-2
3) пентадиен-1,2 и пентадиен-1,3
4) цис-1,2-дихлорэтилен и транс-1,2-дихлорэтилен
5) бутанол-1 и бутанол-2
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ, Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
Смесь цис- и транс-изомеров этиленового углеводорода общим объёмом 1,568 л (н. у.) пропустили через избыток водного раствора перманганата калия, в результате образовался двухатомный спирт массой 6,30 г. Установите молекулярную формулу углеводорода, изобразите структурную формулу транс-изомера и напишите уравнение его реакции с подкисленным раствором перманганата калия.
Из предложенного перечня выберите две пары веществ, в каждой из которых вещества являются структурными изомерами.
1) цис-пентен-2 и транс-пентен-2
2) цис-бутен-2 и циклобутан
3) фенол и бензиловый спирт
4) этилциклопропан и пентен-1
5) ацетилен и этилен
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых вещества являются пространственными изомерами.
1) бутан и 2-метилпропан
2) пентен-1 и пентен-2
3) цис-пентен-2 и транс-пентен-2
4) бензол и толуол
5) цис-гексен-3 и транс-гексен-3
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых вещества являются структурными изомерами.
1) ацетилен и бензол
2) гептан и 2,2-диметилпентан
3) циклогексан и метилциклопентан
4) цис-пентен-2 и транс-пентен-2
5) пентан и циклопентан
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Всего: 25 1–20 | 21–25
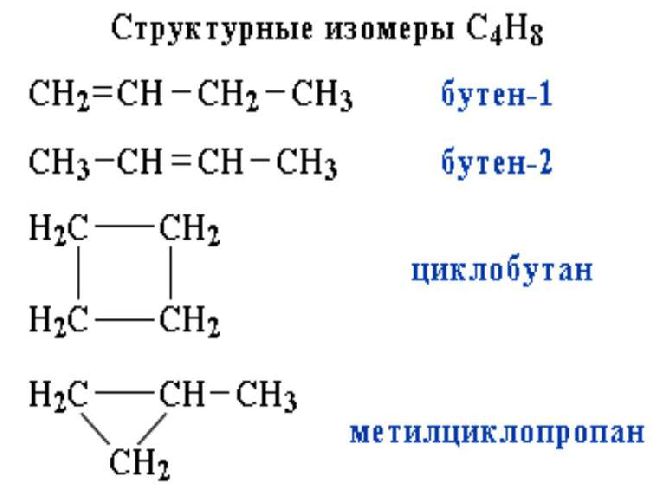
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
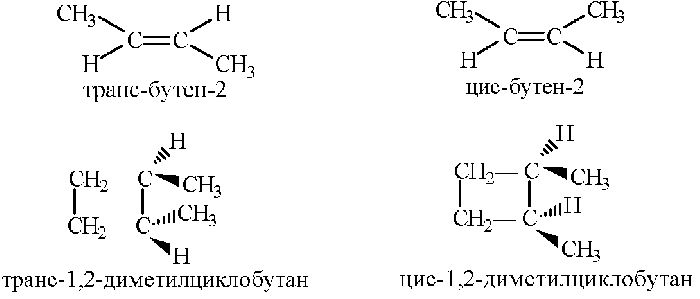
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах.
Органическая химия — раздел химии, в котором изучают соединения углерода, их строение, свойства, взаимопревращения.
Само название дисциплины — «органическая химия» — возникло достаточно давно. Причина его кроется в том, что большинство соединений углерода, с которыми сталкивались исследователи на начальном этапе становления химической науки, имели растительное или животное происхождение. Тем не менее, в порядке исключения, отдельные соединения углерода относят к неорганическим. Так, например, неорганическими веществами принято считать оксиды углерода, угольную кислоту, карбонаты, гидрокарбонаты, циановодород и некоторые другие.
В настоящее время известно чуть менее 30-ти миллионов разнообразных органических веществ и этот список непрерывно пополняется. Такое огромное число органических соединений связано, прежде всего, со следующими специфическими свойствами углерода:
1) атомы углерода могут соединяться друг с другом в цепи произвольной длины;
2) возможно не только последовательное (линейное) соединение атомов углерода между собой, но также разветвленное и даже циклическое;
3) возможны разные виды связей между атомами углерода, а именно одинарные, двойные и тройные. При этом валентность углерода в органических соединениях всегда равна четырем.
Помимо этого, большому разнообразию органических соединений способствует также и то, что атомы углерода способны образовывать связи и с атомами многих других химических элементов, например, водородом, кислородом, азотом, фосфором, серой, галогенами. При этом водород, кислород и азот встречаются наиболее часто.
Следует отметить, что довольно долго органическая химия представляла для ученых «темный лес». Какое-то время в науке даже была популярна теория витализма, согласно которой органические вещества не могут быть получены «искусственным» способом, т.е. вне живой материи. Однако теория витализма просуществовала не очень долго, ввиду того что одно за одним обнаруживались вещества, синтез которых возможен вне живых организмов.
У исследователей вызывало недоумение то, что многие органические вещества имеют одинаковый качественный и количественный состав, однако часто обладают совершенно непохожими друг на друга физическими и химическими свойствами. Так, например, диметиловый эфир и этиловый спирт имеют абсолютно одинаковый элементный состав, однако диметиловый эфир в обычных условиях представляет собой газ, а этиловый спирт – жидкость. Кроме того, диметиловый эфир с натрием не реагирует, а этиловый спирт взаимодействует с ним, выделяя газообразный водород.
Исследователями XIX века было выдвинуто множество предположений касательно того, как все-таки устроены органические вещества. Существенно важные предположения были выдвинуты немецким ученым Ф.А.Кекуле, который первый высказал идею о том, что атомы разных химических элементов имеют конкретные значения валентностей, а атомы углерода в органических соединениях четырехвалентны и способны объединяться друг с другом, образуя цепи. Позднее, отталкиваясь от предположений Кекуле, российский ученый Александр Михайлович Бутлеров разработал теорию строения органических соединений, которая не потеряла свою актуальность и в наше время. Рассмотрим основные положения этой теории:
1) все атомы в молекулах органических веществ соединены друг с другом в определенной последовательности в соответствии с их валентностью. Атомы углерода имеют постоянную валентность, равную четырем, и могут образовывать друг с другом цепи различного строения;
2) физические и химические свойства любого органического вещества зависят не только от состава его молекул, но также и от порядка соединения атомов в этой молекуле между собой;
3) отдельные атомы, а также группы атомов в молекуле оказывают влияние друг на друга. Такое взаимное влияние отражается в физических и химических свойствах соединений;
4) исследуя физические и химические свойства органического соединения можно установить его строение. Верно также обратное – зная строение молекулы того или иного вещества, можно спрогнозировать его свойства.
Аналогично тому, как периодический закон Д.И.Менделева стал научным фундаментом неорганической химии, теория строения органических веществ А.М. Бутлерова фактически стала отправной точкой в становлении органической химии как науки. Следует отметить, что после создания теории строения Бутлерова органическая химия начала свое развитие очень быстрыми темпами.
Изомерия и гомология
Согласно второму положению теории Бутлерова, свойства органических веществ зависят не только от качественного и количественного состава молекул, но и от порядка соединения атомов в этих молекулах между собой.
В связи с этим, среди органических веществ широко распространено такое явление как изомерия.
Изомерия – явление, когда разные вещества имеют абсолютно одинаковый состав молекул, т.е. одинаковую молекулярную формулу.
Очень часто изомеры сильно отличаются по физическим и химическим свойствам. Например:
Типы изомерии
Структурная изомерия
а) Изомерия углеродного скелета
б) Изомерия положения:
кратной связи
заместителей:
функциональных групп:
в) Межклассовая изомерия:
Межклассовая изомерия имеет место, когда соединения, являющиеся изомерами, относятся к разным классам органических соединений.
Пространственная изомерия
Пространственная изомерия — явление, когда разные вещества при одинаковом порядке присоединения атомов друг к другу отличаются друг от друга фиксировано-различным положением атомов или групп атомов в пространстве.
Существует два типа пространственной изомерии – геометрическая и оптическая. Задания на оптическую изомерию на ЕГЭ не встречаются, поэтому рассмотрим только геометрическую.
Если в молекуле какого-либо соединения есть двойная C=C связь или цикл, иногда в таких случаях возможно явление геометрической или цис-транс-изомерии.
Например, такой вид изомерии возможен для бутена-2. Смысл ее заключается в том, что двойная связь между атомами углерода фактически имеет плоское строение, а заместители при этих атомах углерода могут фиксированно располагаться либо над, либо под этой плоскостью:
Когда одинаковые заместители находятся по одну сторону плоскости говорят, что это цис-изомер, а когда по разные — транс-изомер.
На в виде структурных формул цис- и транс-изомеры (на примере бутена-2) изображают следующим образом:
Отметим, что геометрическая изомерия невозможна в случае, если хотя бы у одного атома углерода при двойной связи будет два одинаковых заместителя. Так, например, цис-транс-изомерия невозможна для пропена:
Как можно видеть из иллюстрации выше, если поменять местами метильный радикал и атом водорода, находящиеся при втором углеродном атоме, по разные стороны плоскости, мы получим ту же самую молекулу, на которую просто посмотрели с другой стороны.
Влияние атомов и групп атомов друг на друга в молекулах органических соединений
Понятие о химической структуре как о последовательности связанных друг с другом атомов было существенно расширено с появлением электронной теории. С позиций данной теории можно объяснить, каким образом атомы и группы атомов в молекуле оказывают влияние друг на друга.
Различают два возможных способа влияния одних участков молекулы на другие:
1) Индуктивный эффект
2) Мезомерный эффект
Индуктивный эффект
Для демонстрации данного явления возьмем для примера молекулу 1-хлорпропана (CH3CH2CH2Cl). Связь между атомами углерода и хлора является полярной, поскольку хлор имеет намного более высокую электроотрицательность по сравнению с углеродом. В результате смещения электронной плотности от атома углерода к атому хлора на атоме углерода формируется частичный положительный заряд (δ+), а на атоме хлора — частичный отрицательный (δ-):
Смещение электронной плотности от одного атома к другому часто обозначают стрелкой, направленной к более электроотрицательному атому:
Однако, интересным является такой момент, что, кроме смещения электронной плотности от первого атома углерода к атому хлора, также имеет место смещение, но в несколько меньшей степени от второго атома углерода к первому, а также от третьего ко второму:
Такое смещение электронной плотности по цепи σ-связей называют индуктивным эффектом (I). Данный эффект затухает по мере удаления от влияющей группы и уже практически не проявляется после 3 σ-связей.
В случае, когда атом или группа атомов обладают большей электроотрицательностью по сравнению с атомами углерода, говорят, что такие заместители обладают отрицательным индуктивным эффектом (-I). Таким образом, в рассмотренном выше примере отрицательным индуктивным эффектом обладает атом хлора. Кроме хлора, отрицательным индуктивным эффектом обладают следующие заместители:
–F, –Cl, –Br, –I, –OH, –NH2, –CN, –NO2, –COH, –COOH
Если электроотрицательность атома или группы атомов меньше электроотрицательности атома углерода, фактически происходит передача электронной плотности от таких заместителей к углеродным атомам. В таком случае говорят, что заместитель обладает положительным индуктивным эффектом (+I) (является электронодонорным).
Так, заместителями с +I-эффектом являются предельные углеводородные радикалы. При этом выраженность +I-эффекта возрастает с удлинением углеводородного радикала:
–CH3, –C2H5, –C3H7, –C4H9
Следует отметить, что атомы углерода, находящиеся в разных валентных состояниях, обладают также и разной электроотрицательностью. Атомы углерода в состоянии sp-гибридизации имеют большую электроотрицательность по сравнению с атомами углерода в состоянии sp2-гибридизации, которые, в свою очередь, более электроотрицательны, чем атомы углерода в состоянии sp3-гибридизации.
Мезомерный эффект (М), или эффект сопряжения, — влияние заместителя, передаваемое по системе сопряженных π-связей.
Знак мезомерного эффекта определяется по тому же принципу, что и знак индуктивного эффекта. Если заместитель увеличивает электронную плотность в сопряженной системе, он обладает положительным мезомерным эффектом (+М) и является электронодонорным. Положительным мезомерным эффектом обладают двойные углерод-углеродные связи, заместители, содержащие неподеленную электронную пару: -NH2, -OН, галогены.
Отрицательным мезомерным эффектом (–М) обладают заместители, оттягивающие электронную плотность от сопряженной системы, при этом электронная плотность в системе уменьшается.
Отрицательным мезомерным эффектом обладают группы:
–NO2, –COOH, –SO3H, -COH, >C=O
За счет перераспределения электронной плотности за счет мезомерного и индуктивного эффектов в молекуле на некоторых атомах появляются частичные положительные или отрицательные заряды, что имеет отражение в химических свойствах вещества.
Графически мезомерный эффект показывают изогнутой стрелкой, которая начинается в центре электронной плотности и завершается там, куда смещается электронная плотность. Так, например, в молекуле хлористого винила мезомерный эффект возникает при сопряжении неподеленной электронной пары атома хлора, с электронами π-связи между углеродными атомами. Таким образом, в результате этого на атоме хлора появляется частичный положительный заряд, а обладающее подвижностью π-электронное облако под воздействием электронной пары смещается в сторону крайнего атома углерода, на котором возникает вследствие этого частичный отрицательный заряд:
Если в молекуле имеются чередующиеся одинарные и двойные связи, то говорят, что молекула содержит сопряженную π-электронную систему. Интересным свойством такой системы является то, что мезомерный эффект в ней не затухает.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ОСНОВНЫЕ ПОЛОЖЕНИЯ
ТЕОРИИ ХИМИЧЕСКОГО СТРОЕНИЯ А.М. БУТЛЕРОВА
1 ПОЛОЖЕНИЕ:
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям.
Органические вещества образуют углеродные цепи, в которых углерод всегда имеет валентность IV.
2 ПОЛОЖЕНИЕ
Свойства веществ определяются не только их качественным и количественным составом, но и химическим строением молекулы (порядком связи атомов друг с другом).
СТРУКТУРНАЯ ФОРМУЛА, ИЛИ ФОРМУЛА СТРОЕНИЯ — схематическое изображение строения молекулы, показывающее последовательность соединения атомов и функциональных групп
3 ПОЛОЖЕНИЕ
По свойствам можно описать строение его молекулы, а по строению молекулы — предсказать свойства вещества.
4 ПОЛОЖЕНИЕ
Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга, причем влияние ослабевает при увеличении расстояния между ними. Это отражается на химических и физических свойствах вещества.
ГОМОЛОГИ
Вещества, имеющие сходное химическое строение (тип углеродного скелета, вид, количество и расположение заместителей, вид, количество и расположение кратных связей и т.д.), но отличающиеся лишь длиной углеродной цепи (на одну или несколько –СН2- групп)
ИЗОМЕРЫ
вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение, а, следовательно, и свойства. Возможность образовывать изомеры называется изомерией.
1. структурная
2. пространственная (стереоизомерия).
СТРУКТУРНАЯ ИЗОМЕРИЯ И ЕЕ ВИДЫ
Структурные изомеры отличаются друг от друга порядком связей между атомами в молекуле;
1. ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА:
вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Веществ с молекулярной формулой С4Н10 существует два:
2. ИЗОМЕРИЯ ПОЛОЖЕНИЯ
обусловлена различным положением кратной связи или функциональной группы при одинаковом углеродном скелете молекул.
Например:
С3Н8О:
3. МЕЖКЛАССОВАЯ ИЗОМЕРИЯ
вещества из разных классов веществ имеют одинаковую общую формулу.
ПАРЫ МЕЖКЛАССОВЫХ ИЗОМЕРОВ:
CnH2n — алкены и циклоалканы
CnH2n-2 — алкины и алкадиены (и циклоалкены)
СnH2n+2O — спирты и простые эфиры
CnH2nO — альдегиды и кетоны, а также: циклические спирты, циклические эфиры, непредельные спирты и эфиры
CnH2nO2 — карбоновые кислоты и сложные эфиры
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ И ЕЕ ВИДЫ
стереоизомеры отличаются расположением атомов в пространстве при одинаковом порядке связей между ними.
1. ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ (ИЛИ ЦИС-ТРАНС-ИЗОМЕРИЯ)
Геометрическая изомерия свойственна соединениям, содержащим двойные связи С = С и циклопарафинам.
Заместители могут быть расположены либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение).
Геометрические изомеры различаются по физическим свойствам (температурам кипения и плавления, растворимости и др
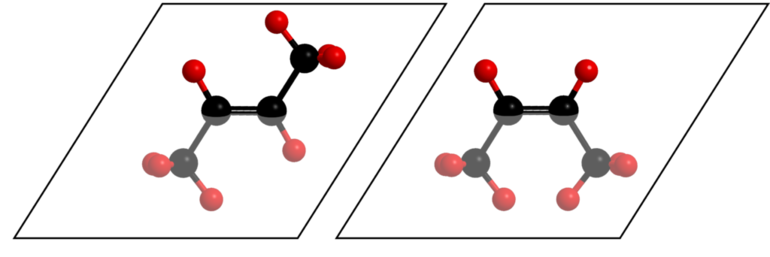
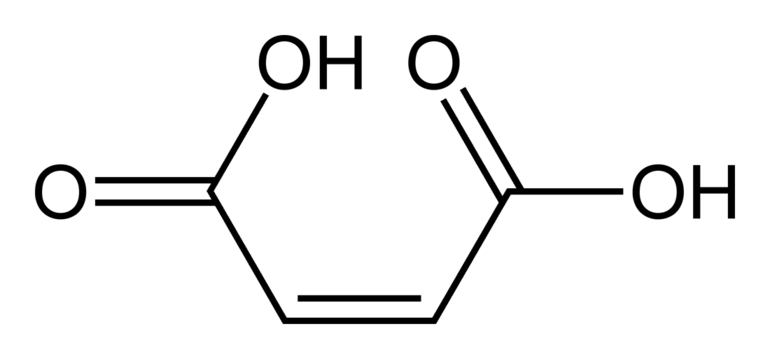
Некоторые физические свойства малеиновой и фумаровой кислот
2. ОПТИЧЕСКАЯ ИЗОМЕРИЯ
свойственна молекулам органических веществ, не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению). Это кислоты, спирты, углеводы и др.
ИЗОМЕРИЯ АЛКАНОВ
СТРУКТУРНАЯ ИЗОМЕРИЯ
1.изомерия углеродного скелета.
ИЗОМЕРИЯ ЦИКЛОАЛКАНОВ
1. Изомерия углеродного скелета
a) число углеродных атомов в кольце:
б) число углеродных атомов в заместителях:
в) положение заместителя в кольце:
2. Межклассовая изомерия: циклоалканы изомерны алкенам.
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
ИЗОМЕРИЯ АЛКЕНОВ:
1. Изомерия углеродного скелета:
(начиная с С4Н8 – бутен и 2-метилпропен)
2. Изомерия положения кратной связи:
3. Межклассовая изомерия:
с циклоалканами (начиная с пропена): C4H8 — бутен и циклобутан.
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ:
Из-за того, что вокруг двойной связи невозможно свободное вращение, становится возможной цис-транс-изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи:
ИЗОМЕРИЯ ДИЕНОВ
1. Изомерия положения двойных связей:
2. Изомерия углеродного скелета:
3. Межклассовая изомерия с алкинами и циклоалкенами.
Например, формуле С4Н6 соответствуют следующие соединения:
4. Пространственная изомерия: цис-транс-изомерия.
12(Б) Тесты ЕГЭ ФИПИ 2015 Гомология и изомерия. Радикал. Функциональная группа.
Условия для пространственной изомерии
Не все химические соединения обладают способностью образовывать геометрические изомеры. Пространственная цис-транс-изомерия возможна для следующих веществ:
- алкенов;
- циклоалканов;
- алкадиенов;
- ненасыщенных жирных кислот.
Чтобы молекула могла принимать различные формы в пространстве, должно выполняться 2 условия.
Ненасыщенная или циклическая молекула
Важным условием для получения структурной изомерии молекул является наличие двойной связи или неароматического кольца. У гексана, как представителя алканов, не будет существовать пространственных изомеров. Так же они не встречаются у алкинов. Например, у атомов углерода в веществе бутин-2 будет только одна метильная группа радикалов, поэтому пространственная изомерия не наблюдается.
При пространственном изображении молекул такого типа плоскость проводят через 2 атома углерода, соединенных двойной связью, или через ароматическое кольцо. Остальные радикалы располагаются в пространстве относительно этой плоскости. Цис-изомер — молекула, у которой одинаковые радикалы лежат на одной стороне от плоскости симметрии. У трансизомера радикалы расположены крест накрест относительно двойной связи.
Например, вещество бутен-2. Это алкен с длиной цепочки в 4 атома углерода. Формула записывается СН3 — СН = СН — СН3. При условном изображении цис-формы, атомы водорода будут расположены вверху от кратной связи, а метильные группы внизу. У транс-бутена расположение заместителей будет симметричным.
Алкадиены — ненасыщенные углеводороды, имеющие 2 двойные связи и не цикличные по своей структуре. Цис- транс-изомеры имеются у веществ из гомологического ряда бутадиена R-CH=CH-CH=CH2. Плоскость симметрии у алкадиенов проходит через одну двойную связь, а заместителями являются группы R- и -CH=CH2. Для ненасыщенных жирных кислот определение цис-транс-изомеров будет аналогичным.
Для циклических соединений пространственная изомерия зависит от расположения заместителей относительно ароматического кольца. В молекуле диметилциклобутана атомы водорода замещают 2 метильных радикала.
У цис — диметилциклобутана замещающие группы расположены по одну сторону от кольца, а атомы водорода по другую. В транс-изомере расположение радикалов будет перекрестным.
Разные заместители
Второе важное условие для существования геометрических форм — наличие разных заместителей при атоме углерода. Например, для бутадиена пространственные формы невозможны, так как при одном из атомов находятся только 2 водорода. Так же 2 — метилбутен — 2 не образует пространственных изомеров, из-за двух радикалов метила при одном атоме углерода. Чтобы существование их стало возможно, необходимо увеличить длину цепочки. Например, октен — 2 образует структурные изомеры, так как при каждом атоме углерода находится водород и алкильный радикал.
Отличие в свойствах
Разная пространственная форма молекул влияет на физические свойства веществ. У различных геометрических форм будут отличаться:
- точка кипения;
- точка плавления;
- растворимость .
Влияние на различие свойств пространственных изомеров оказывает природа функциональных групп и то, какое расстояние между ними. Если заместители представлены слабыми донорами, их влияние на свойства вещества будет несильным. Например, цис — и транс пентен — 2 почти не отличаются по физическим свойствам, потому что водород замещают метильная и этильная группы.
Но если есть полярная группа, влияющая на двойную связь, свойства пространственных форм существенно отличаются. Например, малеиновая кислота по физическим свойствам и химической активности сильно отличается от фумаровой. Но обе они являются изомерными формами бутендиовой кислоты. Это связано с тем, что у цис — изомера расстояние между функциональной группой и радикалом меньше, чем у транс — изомера.
На свойства молекул влияние так же оказывает симметричность. Трансизомеры симметричны, поэтому молекулы расположены очень плотно. Температура плавления из-за этого существенно выше, чем у не симметричных цис — изомеров.
Соотношение изомеров
У молекул простых алкенов высокая энергия вращения относительно кратной связи. Это позволяет отдельно существовать цис— транс— изомерам. Примером алкена служит гексен — 3 СН3 — СН2 — СН= СН — СН2 — СН3.
Однако энергию вращения можно понизить. Для этого в молекулу нужно внести сильный донор по одну сторону от кратной связи, и сильный акцептор — по другую. К таким соединениям относятся амидные производные эфиров и кетонов. Соотношение пространственных изомеров для таких веществ зависит от природы растворителя.
Теория А.М. Бутлерова
1. Атомы в молекулах соединены между собой в определенной последовательности химическими связями в соответствии с их валентностью. Порядок связи атомов называется их химическим строением. Углерод во всех органических соединениях четырехвалентен.
2. Свойства веществ определяются не только качественным и количественным составом молекул, но и их строением.
3. Атомы или группы атомов взаимно влияют друг на друга, от чего зависит реакционная способность молекулы.
4. Строение молекул может быть установлено на основании изучения их химических свойств.
Органические соединения обладают рядом характерных особенностей, которые отличают их от неорганических. Почти все они (за редким исключением) горючи; большинство органических соединений не диссоциирует на ионы, что обусловлено природой ковалентной связи в органических веществах. Ионный тип связи реализуется только в солях органических кислот, например, CH3COONa.
Гомологический ряд
– это бесконечный ряд органических соединений, имеющих сходное строение и, следовательно, сходные химические свойства и отличающихся друг от друга на любое число СН2– групп (гомологическая разность).
Еще до создания теории строения были известны вещества одинакового элементного состава, но c разными свойствами. Такие вещества были названы изомерами, а само это явление – изомерией.
В основе изомерии, как показал А.М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов.
Изомерия
– это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства.
Различают 2 вида изомерии:
структурную
изомерию и
пространственную
изомерию.
Структурная изомерия
Структурные изомеры
– соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением.
Пространственная изомерия
Пространственные изомеры
(стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле.
Пространственными изомерами являются оптические и цис-транс изомеры (геометрические).
Цис-транс-изомерия
заключается в возможности расположения заместителей по одну или по разные стороны плоскости двойной связи или неароматического цикла.В
цис-изомерах
заместители находятся по одну сторону от плоскости кольца или двойной связи, в
транс-изомерах
– по разные.
В молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи — в цис-изомере, либо по разные стороны — в транс-изомере.
Оптическая изомерия
Появляется тогда, когда углерод имеет четыре разных заместителя.
Если поменять местами любые два из них, получается другой пространственный изомер того же состава. Физико-химические свойства таких изомеров существенно различаются. Соединения такого типа отличаются способностью вращать плоскость пропускаемого через раствор таких соединений поляризованного света на определенную величину. При этом один изомер вращает плоскость поляризованного света в одном направлении, а его изомер – в противоположном. Вследствие таких оптических эффектов этот вид изомерии называют оптической изомерией.
Читать далее
Хиральность и оптическая активность
Взаимное влияние атомов в молекулах.
Типы связей в молекулах органических веществ.
Гибридизация атомных орбиталей углерода.
Радикал. Функциональная группа
Цис-транс-изомерия

4.6
Средняя оценка: 4.6
Всего получено оценок: 651.
4.6
Средняя оценка: 4.6
Всего получено оценок: 651.
Геометрическая или цис-транс-изомерия – один из видов пространственной или стереоизомерии. Изомеры отличаются положением радикалов относительно плоскости, условно делящей молекулу пополам. Характерна для веществ, содержащих двойные связи или циклические молекулы.
Изомерия веществ
Изомерия – явление, характеризующее изомеры. Это одинаковые по составу (количеству атомов), но разные по структурному строению или пространственному расположению атомов в молекуле. В связи с этим выделяют структурную и пространственную изомерию.
Структурная изомерия затрагивает строение молекулы. В длинных углеродных цепях структурные единицы «перецепляются» к другим атомам углерода в молекуле. В результате образуются новые вещества, отличающиеся свойствами.
Также изомеры могут образовываться изменением положения в основной молекуле:
- функциональной группы;
- двойной связи;
- заместителя.
При пространственной изомерии образуются изомеры (стереоизомеры) двух типов:
- энантиомеры – молекулы, имеющие зеркальное строение;
- диастереомеры – молекулы, не имеющие зеркального строения.
Энантиомеры являются результатом оптической или зеркальной изомерии. Диастереомеры возникают при геометрической изомерии и характерны для веществ с двойной связью. При этом важным условием является нахождение одинаковых радикалов у атомов углерода, объединённых двойной связью или сцепленных в кольцо. Другими словами, геометрическая изомерия возможна в соединении типа RCH=CHR, но не возможна в CH2=CHR, CR2=CHR’.
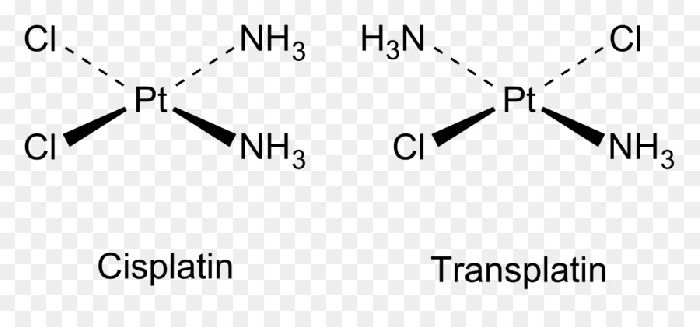
Изомерия – явление, свойственное в первую очередь органическим соединениям, в частности углеводородам. Однако примеры цис-транс-изомерии встречаются и в неорганической химии. Например, цис-[Pt(NH3)2Cl2] (цисплатин) и транс-[Pt(NH3)2]Cl2 (трансплатин), цис-[Co(NH3)4Cl2]+ и транс-[Co(NH3)4Cl2]+.
Цис-транс-изомерия
Условная плоскость, разделяющая молекулу пополам, проходит либо в месте двойной связи, либо по кольцу. Атомы углерода, образующие связь С=С или цикл, лежат в одной плоскости. При этом другие атомы могут прикрепляться условно сверху и снизу.
Если одинаковые радикалы прикрепляются по одну сторону плоскости (только сверху или только снизу), значит, этот изомер является представителем цис-изомерии. Приставка «цис-» значит «одинаковый», «по одну сторону». Радикалы, лежащие по разным сторонам условной плоскости, указывают на принадлежность вещества к транс-изомерии. «Транс» значит «через».
В соответствии с принадлежностью к цис- или транс-изомерии к названиям веществ прибавляют приставки. Например, цис-бутен-2, транс-бутен-2.
Что мы узнали?
Для веществ, содержащих в молекуле двойные связи или циклические молекулы, характерна геометрическая изомерия, которая также называется цис-транс-изомерией. Изомеры отличаются расположением радикалов относительно плоскости молекулы. При цис-изомерии радикалы лежат по одну сторону плоскости. В транс-изомерах радикалы расположены противоположно друг другу по разные стороны плоскости.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Юрий Кувшинов
5/5
-
Иван Мастин
4/5
-
Кристина Микляева
4/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 651.
А какая ваша оценка?














![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)