Цвета соединений, знание которых необходимо для сдачи ЕГЭ
1. Медь – мягкий пластичный металл розового цвета. Степени окисления: +1, +2.
Cu2O – кристаллическое, нерастворимое в воде вещество кирпично-красного цвета.
CuO – кристаллы чёрного цвета, практически нерастворимые в воде.
CuS — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
Cu2S — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
CuOH — желтое вещество; не растворимо в воде; является неустойчивым и разлагается при нагревании на Cu2O и H2O.
Cu(OH)2 – голубое аморфное или кристаллическое вещество; практически не растворимо в воде.
CuSO4 – кристаллическое вещество белого цвета, хорошо растворяется в воде. Из водных растворов кристаллизуется пентагидрат CuSO4·5H2O – медный купоро́с, кристаллы голубого цвета (при нагревании снова теряет воду и становится белым). Водный раствор CuSO4 также голубого цвета.
2. Цинк – металл голубовато-белого цвета, мягкий, хрупкий. Степень окисления: +2.
ZnO, Zn(OH)2, ZnS – белые твердые вещества, нерастворимые в воде.
3. Алюминий – легкий металл серебристо-белого цвета. Степень окисления: +3.
Al2O3, Al(OH)3 – белые твердые вещества, нерастворимые в воде.
AlPO4 — твёрдое, белое кристаллическое вещество, нерастворимое в воде.
4. Серебро – блестящий белый мягкий пластичный металл. Степень окисления: +1.
AgCl – белое твердое нерастворимое в воде вещество.
AgBr – светло-желтое твердое нерастворимое в воде вещество.
AgI – твердое нерастворимое в воде вещество желтого цвета.
Ag2S — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
Ag2O — твердое нерастворимое в воде вещество черного цвета.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
5. Железо – серебристо-серый мягкий ковкий металл. Степени окисления: +2, +3, +6.
FeO – твердое нерастворимое в воде вещество черного цвета.
Fe(OH)2 – серо-зеленый осадок, студенистый осадок зеленого цвета. Не растворяется в воде.
Fe2O3, Fe(OH)3 – твердые красно-коричневые (бурые), нерастворимые в воде соединения.
Fe3O4 – твердое черное вещество. Не растворяется в воде.
FeCl3 – раствор желтого цвета.
6. Сера – желтое нерастворимое в воде вещество. Степени окисления: -2, +4, +6.
SO2 – бесцветный газ с неприятным запахом; газ, образующийся в момент зажигания спички
H2SO4 – тяжелая бесцветная жидкость, растворяется в воде с сильным разогреванием раствора.
7. Хром — твёрдый металл голубовато-белого цвета.
CrO — твердое вещество ченого цвета.
Cr2O3 — твердое вещество темно-зеленого цвета.
CrO3 — твердое вещество красного цвета.
Na2Cr2O7 и другие дихроматы — соединения оранжевого цвета.
Na2CrO4 и другие хроматы — соединения желтого цвета.
Cr2(SO4)3 — в растворе сине-фиолетового цвета (кислотная среда).
K3[Cr(OH)6] — в растворе зеленого цвета (щелочная среда).
8. Марганец — металл серебристо-белого цвета.
MnO2 — твердое нерастворимое в воде вещество бурого цвета.
Mn(OH)2 — белый осадок.
KMnO4 — пурпурные кристаллы, растворяется в воде с образованием фиолетового раствора.
K2MnO4 — растворимая соль темно-зеленого цвета.
Mn(NO3)2, MnCl2, MnBr2 и некоторые другие соли Mn+2 — как правило, розовые растворимые в воде соединения.
9. Фосфор — неметалл. Основные модификации: белый, красный и черный фосфор.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
AlPO4 — твердое нерастворимое в воде вещество белого цвета.
Li3PO4 — твердое нерастворимое в воде вещество белого цвета.
Ba3(PO4)2 — осадок белого цвета
10. Свинец — ковкий, тяжёлый металл серебристо-белого цвета.
PbS — осадок черного цвета.
PbSO4 — осадок белого цвета.
PbI2 – осадок ярко-желтого цвета.
11. Соединения бария:
BaSO4 – белый осадок нерастворимый в кислотах
BaSO3 – белый осадок растворимый в кислотах
Ba3(PO4)2 — осадок белого цвета
BaCrO4 — осадок желтого цвета
12. Другие соединения:
CaCO3 – осадок белого цвета
NH3 – аммиак, бесцветный газ с резким запахом
CO2 – газ тяжелее воздуха, без цвета и запаха, играющий важную роль в процессе фотосинтеза.
NO2 – газ бурого цвета (лисий хвост)
H2SiO3 – бесцветный студенистый осадок
30 октября 2022
В закладки
Обсудить
Жалоба
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.
priznaki-him-r.pdf
Автор: Фрундина Дарья Андреевна, учитель химии.
Медь — мягкий пластичный металл розового цвета. Степени окисления: +1, +2.
Cu2O — кристаллическое, нерастворимое в воде вещество кирпично-красного цвета.
CuO — кристаллы чёрного цвета, практически нерастворимые в воде.
Cu(OH)2 — голубое аморфное или кристаллическое вещество; практически не растворимо в воде.
CuSO4 — кристаллическое вещество белого цвета, хорошо растворяется в воде. Из водных растворов кристаллизуется пентагидрат CuSO4·5H2O — медный купоро́с, кристаллы голубого цвета (при нагревании снова теряет воду и становится белым). Водный раствор CuSO4 также голубого цвета.
Серебро — блестящий белый мягкий пластичный металл. Степень окисления: +1.
AgCl — белое твердое нерастворимое в воде вещество.
AgBr — светло-желтое твердое нерастворимое в воде вещество.
AgI — твердое нерастворимое в воде вещество желтого цвета.
Ag2O — твердое нерастворимое в воде вещество черного цвета.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
Железо — серебристо-серый мягкий ковкий металл. Степени окисления: +2, +3, +6.
FeO — твердое нерастворимое в воде вещество черного цвета.
Fe(OH)2 — серо-зеленый осадок, студенистый осадок зеленого цвета. Не растворяется в воде.
Fe2O3, Fe(OH)3 — твердые красно-коричневые (бурые), нерастворимые в воде соединения.
Fe3O4 — твердое черное вещество. Не растворяется в воде.
FeCl3 — раствор желтого цвета.
Хром — твёрдый металл голубовато-белого цвета.
CrO — твердое вещество ченого цвета.
Cr2O3 — твердое вещество темно-зеленого цвета.
CrO3 — твердое вещество красного цвета.
Na2Cr2O7 и другие дихроматы — соединения оранжевого цвета.
Na2CrO4 и другие хроматы — соединения желтого цвета.
Cr2(SO4)3 — в растворе сине-фиолетового цвета (кислотная среда).
K3[Cr(OH)6] — в растворе зеленого цвета (щелочная среда).
Марганец — металл серебристо-белого цвета.
MnO2 — твердое нерастворимое в воде вещество бурого цвета.
Mn(OH)2 — белый осадок.
KMnO4 — пурпурные кристаллы, растворяется в воде с образованием фиолетового раствора.
K2MnO4 — растворимая соль темно-зеленого цвета.
Mn(NO3)2, MnCl2, MnBr2 и некоторые другие соли Mn+2 — как правило, розовые растворимые в воде соединения.
Качественные реакции на неорганические вещества и ионы
Теория к заданию 24 из ЕГЭ по химии
Разбор сложных заданий в тг-канале:
Качественные реакции на катионы и анионы некоторых неорганических веществ
Качественные реакции на анионы.
| Анион | Условие, реактив, катион | Признаки и сокращенное ионное уравнение реакции |
| $Cl^{-}$ | Нитрат серебра $Ag^{+}$ | Белый творожистый осадок:$Ag^{+}+Cl^{-}→AgCl↓$ |
| $Br^{-}$ | Нитрат серебра $Ag^{+}$ | Желтоватый творожистый осадок: $Ag^{+}+Br^{-}→AgBr↓$ |
| $I^{-}$ | Нитрат серебра $Ag^{+}$ | Желтый творожистый осадок: $Ag^{+}+I^{–}→AgI↓$ |
| $SO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Белый осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ |
| $NO_3^{-}$ | $H_2SO_4(конц)$ и $Cu$ | Выделение бурого газа: $Cu+NO_3^{-}+2H^{+}=Cu^{2+}+NO_2↑+H_2O$ |
| $PO_4^{3-}$ | Нитрат серебра $Ag^{+} | Ярко-желтый осадок:$3Ag^{+}+PO_4^{3-}→Ag_3PO_4↓$ |
| $CrO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Желтый осадок: $Ba^{2+}+CrO_4^{2-}=BaCrO_4↓$ |
| $S^{2-}$ | Растворимые соли меди $Cu^{2+}$ | Черный осадок: $Cu^{2+}+S^{2–}=CuS↓$ |
| $CO_3^{2-}$ | Кислоты $H^{+}$ | Выделение газа без запаха: $2H^{+}+CO_3^{2-}=H_2O+CO_2↑$ |
| $OH^{-}$ | Лакмус | Синий цвет раствора |
| Фенолфталеин | Малиновый цвет раствора | |
| Метиловый оранжевый | Желтый цвет раствора |
Качественные реакции на катионы.
| Катион | Условие, реактив, анион | Признаки, сокращенное ионное уравнение реакции |
| $H^{+}$ | Лакмус | Красный цвет раствора |
| Метиловый оранжевый | Розовый цвет раствора | |
| $NH_4^{+}$ | Щелочь, $OH^{–}$, $t°$ | Выделение газа с резким запахом: $NH_4^{+}+OH^{-}=NH_3↑+H_2O$ |
| $Ag^{+}$ | Соляная кислота, растворы хлоридов, $Cl^{–} | Белый творожистый осадок: $Ag^{+}+Cl^{–}→AgCl↓$ |
| $Li^{+}$ | Пламя | Красное окрашивание |
| $Na^{+}$ | Пламя | Желтое окрашивание |
| $K^{+}$ | Пламя | Фиолетовое окрашивание |
| $Ca^{2+}$ | Пламя | Кирпично-красное окрашивание |
| Растворы карбонатов, $CO_3^{2−}$ | Белый осадок: $Ca^{2+}+CO_3^{2-}→CaCO_3↓$ | |
| $Ba^{2+}$ | Пламя | Желто-зеленое окрашивание |
| Серная кислота, растворы сульфатов, $SO_4^{2−}$ | Белый (мелкокристаллический) осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ | |
| $Cu^{2+}$ | Пламя | Зеленое окрашивание |
| Вода | Гидратированные ионы $Cu^{2+}$ имеют голубую окраску | |
| Щелочь, $OH^{–}$ | Синий осадок: $Cu^{2+}+2OH^{-}=Cu(OH)_2↓$ | |
| $Fe^{2+}$ | Щелочь, $OH^{–}$ | Зеленоватый осадок: $Fe^{2+}+2OH^{–}=Fe(OH)_2↓$ |
| Красная кровяная соль $K_3[Fe(CN)_6], Fe(CN)_6^{3−}$ | Синий осадок (турнбулева синь): $3Fe^{2+}+2[Fe(CN)_6]^{3-}=Fe_3[Fe(CN)_6]_2↓$ | |
| $Fe^{3+}$ | Щелочь, $OH^{–}$ | Бурый осадок: $Fe^{3+}+3OH^{–}=Fe(OH)_3↓$ |
| Роданид аммония $NH_4SCN, SCN^{–}$ | Кроваво-красный осадок: $3Fe^{3+}+3CNS^{-}⇄Fe(SCN)_3↓$ | |
| $Fe^{3+}$ | Желтая кровяная соль $K_4[Fe(CN)_6]$ | Темно-синий осадок (берлинская лазурь): $4Fe^{3+}+3[Fe(CN)_6]^{4–}=Fe_4[(CN)_6]_3↓$ |
| $Al^{3+}$ | Щелочь, $OH^{–}$ | Желеобразный осадок белого цвета, растворяется в избытке раствора щелочи: $Al^{3+}+3OH^{–}=Al(OH)_3↓$ |
Качественные реакции на неорганические вещества и ионы
Таблица. Качественные реакции на анионы
| Анион | Реактив | Наблюдаемая реакция |
| SO42- | соли Ва2+ | Выпадение белого осадка BaSO4 |
| NO3— | добавить конц. H2SO4 и Сu, нагреть | Образование голубого раствора (ионы Сu2+), выделение газа бурого (NO2) |
| РО43- | ионы Ag+ | Выпадение светло-желтого осадка в нейтральной среде:
ЗАg+ + РO43- = Аg3РO4 |
| СrO42- | ионы Ва2+ | Выпадение желтого осадка:
Ва2+ + СrO42- = BaCrO4 |
| S2- | ионы Рb2+ | Выпадение черного осадка:
Pb2+ + S2- = PbS |
| СО32- | ионы Са2+ | выпадение белого осадка СаСО3 |
| CO2 | известковая вода Са(ОН)2 | Выпадение белого осадка и его растворение при пропускании СO2:
Са(ОН)2 + СO2 = СаСО3+Н2O СаСО3 + СO2 + Н2O = Са(НСO3)2 |
| SO32- | ионы Н+ | Появление запаха SO2:
2Н+ + SO32- = Н2O + SO2 Сернистый газ обесцвечивает бромную воду. |
| F— | ионы Са2+ | Выпадение белого осадка:
Са2+ + 2F— = CaF2 |
| Cl— | ионы Аg+ | Выпадение белого творожистого осадка:
Аg+ + Cl— = AgCl |
| Br— | ионы Аg+ | Выпадение светло-желтого осадка:
Ag+ + Br— = AgBr осадок темнеет на свету |
| I— | ионы Аg+ | Выпадение желтого осадка:
Аg+ + I— = АgI осадок темнеет на свету |
| ОН— | индикаторы: лакмус
фенолфталеин |
синее окрашивание
малиновое окрашивание |
Таблица. Качественные реакции на катионы
| Катион | Реактив | Наблюдаемая реакция |
| Li+ | Пламя | Карминово-красное окрашивание |
| Na+ | Пламя | Желтое окрашивание |
| K+ | Пламя | Фиолетовое окрашивание |
| Ca2+ | Пламя | Кирпично-красное окрашивание |
| Sr2+ | Пламя | Карминово-красное окрашивание |
| Ba2+ | 1) Пламя
2) Ион SO42- |
1) Желто-зеленое окрашивание
2) Выпадение белого осадка BaSO4 |
| Cu2+ | 1) Вода
2) Ионы ОН— |
1) Растворы солей Сu2+ имеют голубую окраску
2) Голубой осадок Cu(OH)2 |
| Pb2+ | Ион S2- | Выпадение черного осадка: PbS |
| Ag+ | Ион Cl— | Выпадение белого осадка:
Аg+ + Cl— = AgCl |
| Fe2+ | Красная кровяная соль, K3[Fe(CN)6] | Выпадение синего осадка KFe[Fe(CN)6] |
| Fe3+ | 1) Желтая кровяная соль, K4[Fe(CN)6] 2) Роданид-ион SCN— |
1) Выпадение синего осадка: KFe[Fe(CN)6]
2) Появление ярко-красного окрашивания |
| Al3+ | Щелочь (амфотерные свойства гидроксида) | Выпадение белого осадка гидроксида алюминия при добавлении первых порций щелочи и его растворение при дальнейшем добавлении. |
| NH4+ | Щелочь при нагревании | Запах аммиака NH3 и окрашивание влажного лакмуса в синий цвет |
| H+ | Индикаторы: лакмус, метилоранж | Красное окрашивание (кислая среда) |
Таблица. Качественные реакции на газы
| Газ | Качественная реакция |
| Водород, H2 | Хлопок при поднесении горящей лучинки к источнику водорода |
| Азот, N2 | Горящая лучинка тухнет в атмосфере азота. При пропускании через раствор Ca(OH)2 осадок не выпадает |
| Кислород, O2 | Тлеющая лучинка ярко загорается в атмосфере кислорода |
| Озон, O3 | Взаимодействие озона с раствором иодидов с выпадением кристаллического иода I2 в осадок:
2KI + O3 + H2O = 2KOH + I2↓ + O2↑ |
| Хлор, Сl2 | При взаимодействии хлора с растворами иодидов в осадок выпадает желтый осадок йода I2:
2KI + Cl2 = 2KCl + I2↓ |
| Аммиак, NH3 | Резкий запах; влажный лакмус синеет. Реакция аммиака с хлороводородом («дым» без огня):
NH3 + HCl = NH4Cl |
| Углекислый газ, CO2 | Тлеющая лучинка гаснет в атмосфере углекислого газа. Пропускание углекислого газа через известковую воду Ca(OH)2: Ca(OH)2 + CO2 = CaCO3↓ + H2O Дальнейшее пропускание приведет к растворению осадка: CaCO3 + CO2 + H2O = Ca(HCO3)2 |
| Оксид азота (II), NO | Оксид азота (II) очень чувствителен к кислороду воздуха, потому на воздухе буреет, окисляясь до оксида азота (IV) NO2:
2NO+ O2 = 2NO2 |
| Сернистый газ, SO2 | Обесцвечивание бромной воды и раствора перманганата калия |
| Сероводород, H2S | Чёрный осадок сульфида при пропускании через раствор соли меди или свинца |
Что такое качественная реакция
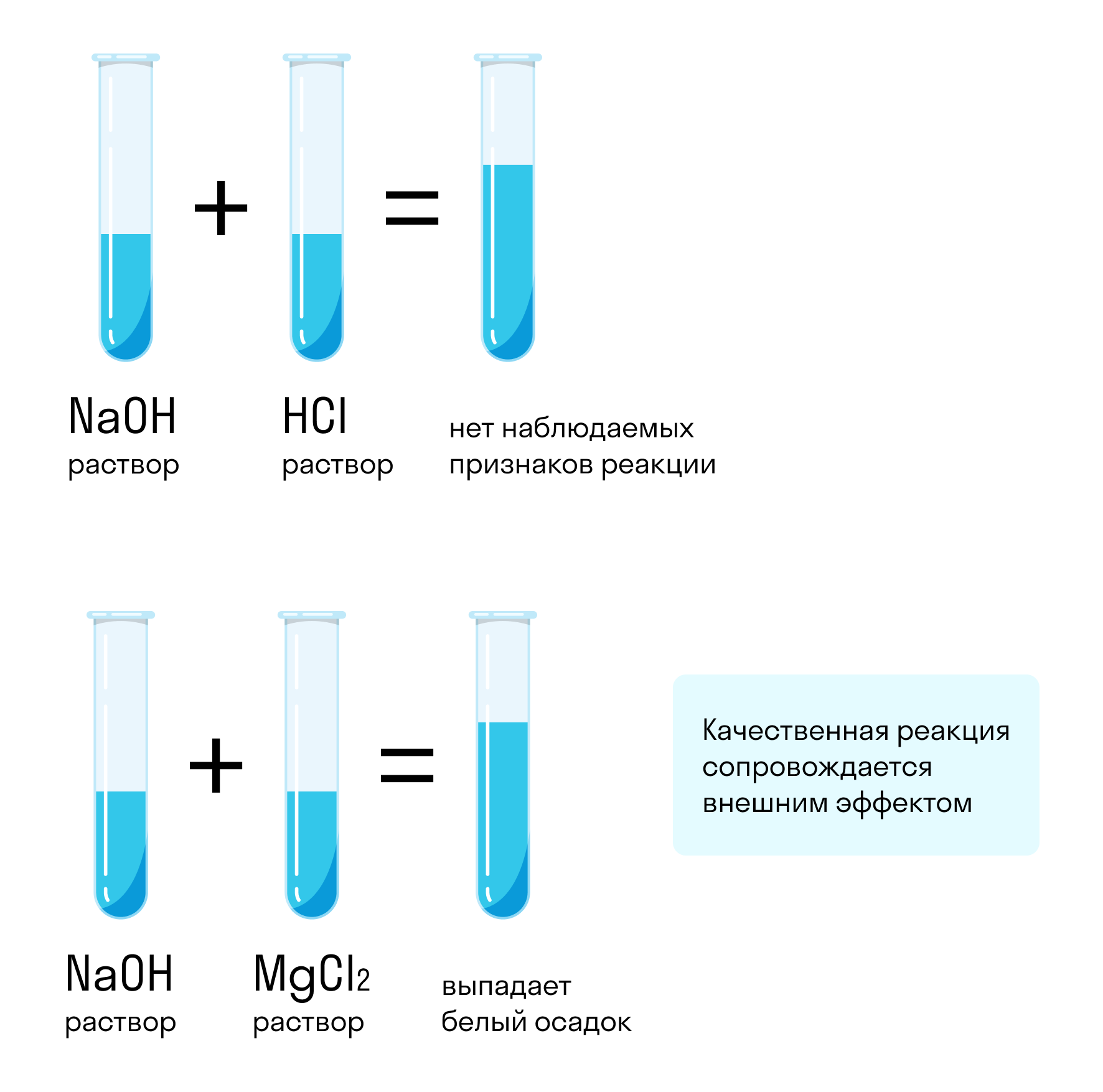
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
-
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
-
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Правила растворимости химических соединений
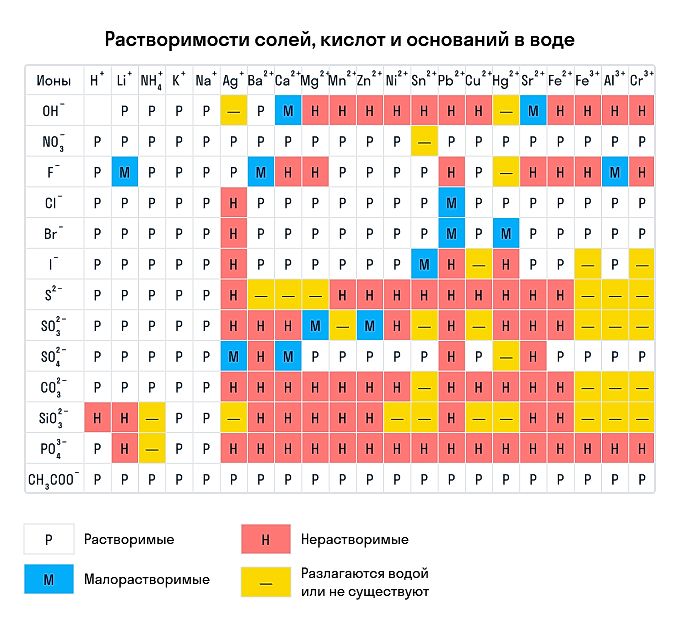
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
-
абсолютно все нитраты;
-
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
-
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
-
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
-
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
-
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
-
любые карбонаты, фосфаты и сульфиты, кроме K2CO3, K2SO3, K3PO4, Na2CO3, Na2SO3, Na3PO4, (NH4)2CO3, (NH4)2SO3, (NH4)3PO4.
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
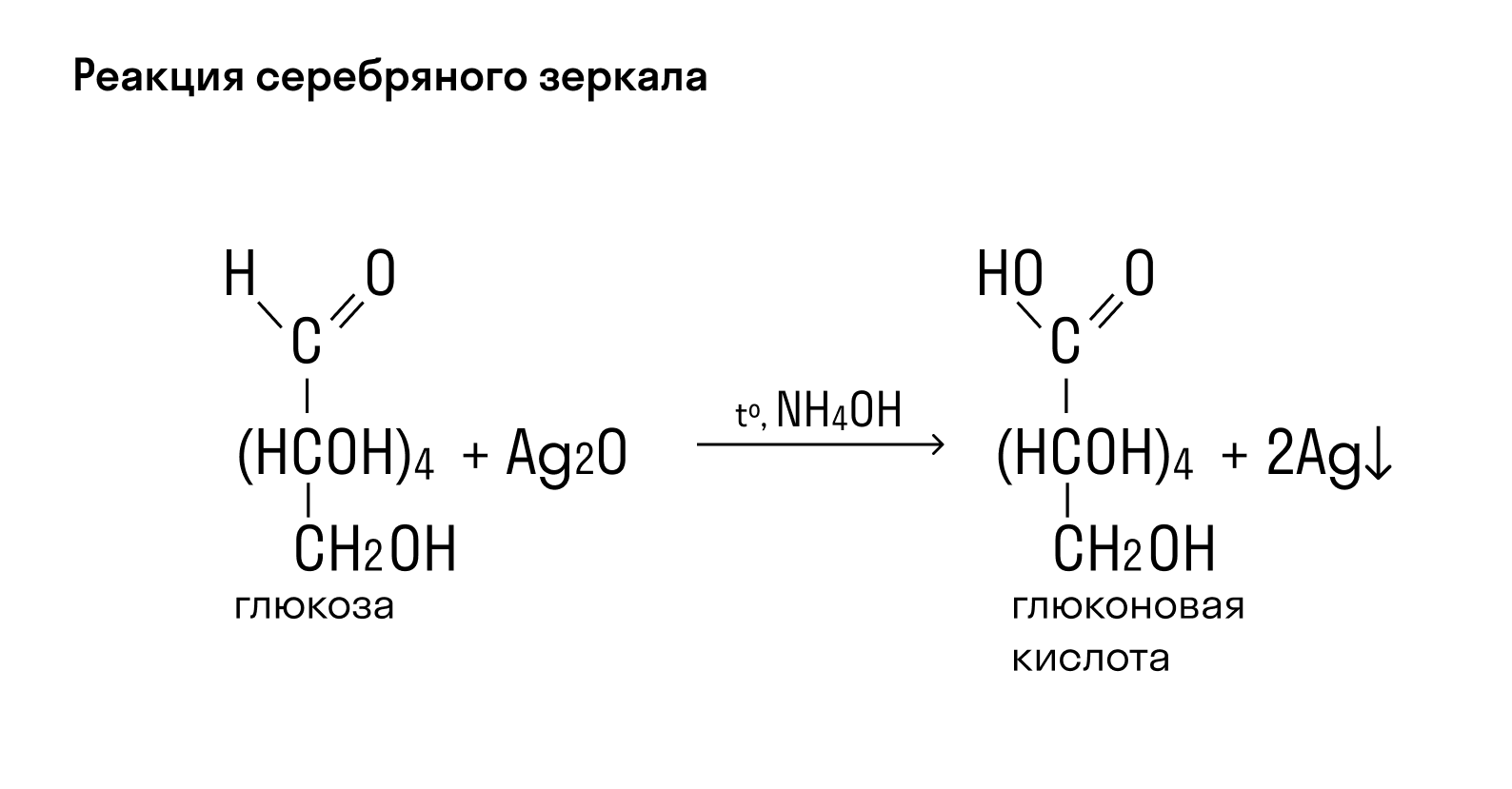
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
C6H5OH + 2Br2 ⇒ C6H2Br3OH + 3HBr — реакция с бромной водой.
3C6H5OH + FeCl3 ⇒ (C6H5O)3Fe + 3HCl — реакция с хлоридом железа (III).
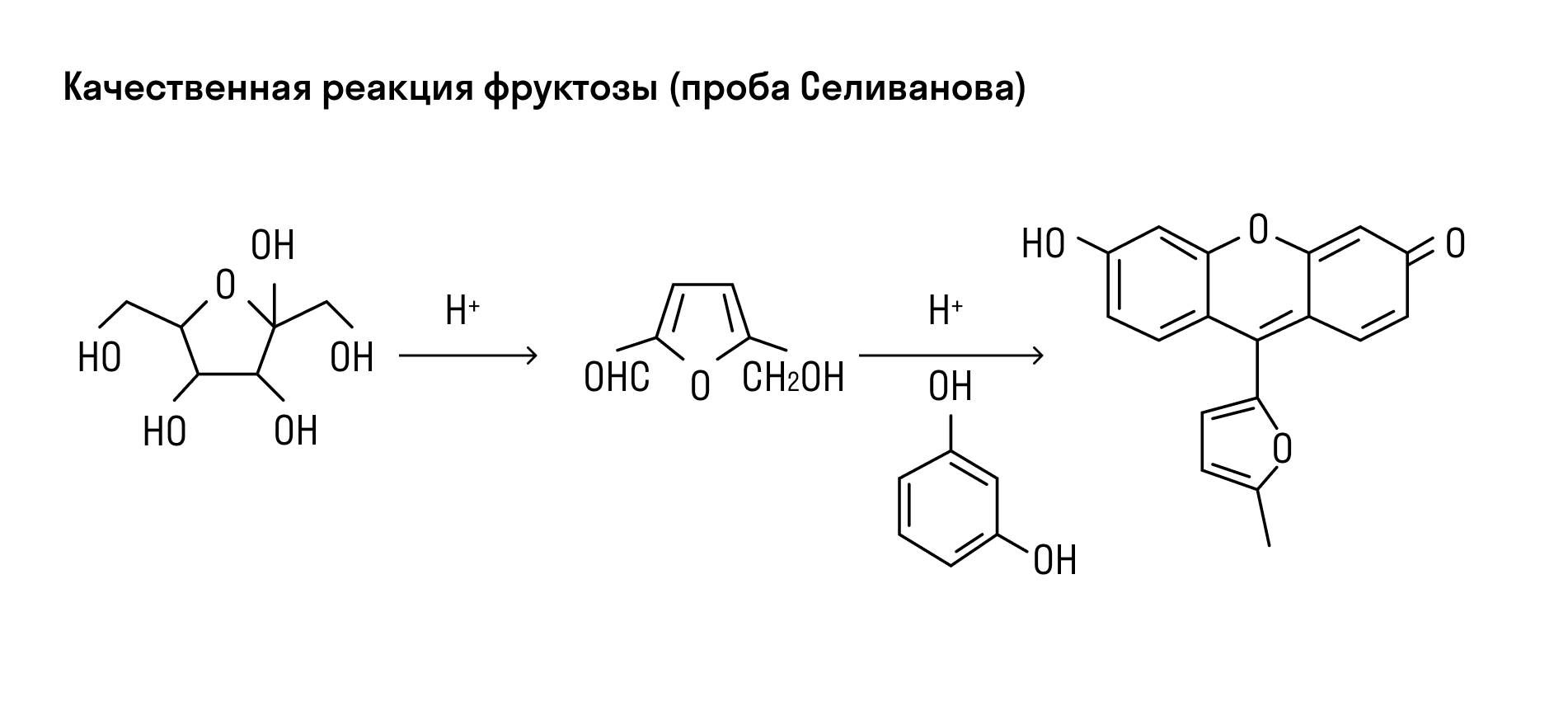
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
I2 + (C6H10O5)n ⇒ I2(C6H10O5)n— качественная реакция крахмала с йодом.
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Таблицы качественных реакций
21-Дек-2013 | комментариев 9 | Лолита Окольнова
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
| Описание | Формула |
Реакции |
| Бурый газ |
NO2 |
1) N2 + 2O2 = 2NO2 2) взаимодействие металлов с азотной кислотой (концентрированной) 3) разложение нитратов |
| Запах тухлых яиц |
H2S |
Взаимодействие активных металлов с концентрированной серной кислотой: |
|
Газ с резким запахом. Растворимый в воде |
SO2 |
1) взаимодействие серасодежащих веществ с кислородом
2) взаимодействие некоторых металлов с концентрированной серной кислотой |
| Газ с резким характерным запахом, растворимый в воде |
NH3 |
1) N2 + 3H2 = 2NH3 2) обменные реакции солей аммония |
| Газ, не поддерживающий горение, малорастворимый в воде, не ядовитый |
N2 |
1) горение азотсодержащих веществ; NH4NO2 = N2 + 2H2O |
|
Газы, поддерживающие горение: (для NO2 – бурый цвет) |
O2 O3 NO2 |
3C + 2O3 = 3CO2 С + 2NO2 = CO2 + 2NO |
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
|
желто-зеленое |
фиолетовое |
кирпично-красное |
ярко-красное |
желтое |
карминово-красное |
|
Ba2+ |
K+ |
Са2+ |
Li+ |
Na+ |
Sr2+ |
Таблица качественных реакций
— цвета осадков
|
Осадки белого цвета |
Качественная реакция |
|
Белый творожистый нерастворимый в воде; нерастворимый в HNO3 |
Ag+ + Cl— → AgCl↓ качественная реакция на соли серебра; качественная реакция на хлорид-ионы; |
|
Белый осадок нерастворимый в кислотах |
Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария; качественная реакция на сульфат-ионы; |
|
Белый осадок образуется при пропускании газа без цвета с резким запахом через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + SO2 = CaSO3↓ + H2O
|
|
Белый осадок образуется при добавлении щелочи; растворяется в избытке щелочи |
Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓
|
|
Белый осадок образуется при пропускании газа без цвета и запаха через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2H+ → CO2↑ + H2O + Ca2+ |
|
Осадок светло-желтого цвета (осадок кремового цвета) образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + Br— → AgBr↓ качественная реакция на бромид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + I— → AgJ↓ качественная реакция на иодид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; растворим в кислотах; |
3Ag+ + PO43- → Ag3PO4↓ |
|
Осадки коричневых цветов |
Качественная реакция |
|
Осадок бурого цвета образуется при взаимодействии с растворами щелочей; |
Fe3+ +3OH— → Fe(OH)3↓ качественная реакция на соли железа |
|
Осадки синих и зеленых цветов |
Качественная реакция |
|
Осадки зеленого цвета |
Fe2+ +2OH— → Fe(OH)2↓ |
|
Осадок голубого цвета (осадок синего цвета) образуется при взаимодействии с растворами щелочей |
Cu2+ +2OH— → Cu(OH)2↓ качественная реакция на соли меди (II) |
|
Осадок синего цвета образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли |
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ качественная реакция на соли железа (II) — с красной кровяной солью; 4Fe3+ + 3[Fe(CN)6]-4 → Fe4[Fe(CN)6]3↓ качественная реакция на соли железа (III) — с желтой кровяной солью; |
|
Осадки черного цвета |
Качественная реакция |
|
Осадок черного цвета Образуется при взаимодействии с сульфидами или с H2S |
Fe2+ + S2- → FeS↓ Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ качественная реакция на сульфид-ионы |
Обсуждение: «Таблицы качественных реакций»
(Правила комментирования)