30 октября 2022
В закладки
Обсудить
Жалоба
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.
priznaki-him-r.pdf
Автор: Фрундина Дарья Андреевна, учитель химии.
Качественные реакции на неорганические вещества и ионы
Теория к заданию 24 из ЕГЭ по химии
Разбор сложных заданий в тг-канале:
Качественные реакции на катионы и анионы некоторых неорганических веществ
Качественные реакции на анионы.
| Анион | Условие, реактив, катион | Признаки и сокращенное ионное уравнение реакции |
| $Cl^{-}$ | Нитрат серебра $Ag^{+}$ | Белый творожистый осадок:$Ag^{+}+Cl^{-}→AgCl↓$ |
| $Br^{-}$ | Нитрат серебра $Ag^{+}$ | Желтоватый творожистый осадок: $Ag^{+}+Br^{-}→AgBr↓$ |
| $I^{-}$ | Нитрат серебра $Ag^{+}$ | Желтый творожистый осадок: $Ag^{+}+I^{–}→AgI↓$ |
| $SO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Белый осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ |
| $NO_3^{-}$ | $H_2SO_4(конц)$ и $Cu$ | Выделение бурого газа: $Cu+NO_3^{-}+2H^{+}=Cu^{2+}+NO_2↑+H_2O$ |
| $PO_4^{3-}$ | Нитрат серебра $Ag^{+} | Ярко-желтый осадок:$3Ag^{+}+PO_4^{3-}→Ag_3PO_4↓$ |
| $CrO_4^{2-}$ | Растворимые соли бария $Ba^{2+}$ | Желтый осадок: $Ba^{2+}+CrO_4^{2-}=BaCrO_4↓$ |
| $S^{2-}$ | Растворимые соли меди $Cu^{2+}$ | Черный осадок: $Cu^{2+}+S^{2–}=CuS↓$ |
| $CO_3^{2-}$ | Кислоты $H^{+}$ | Выделение газа без запаха: $2H^{+}+CO_3^{2-}=H_2O+CO_2↑$ |
| $OH^{-}$ | Лакмус | Синий цвет раствора |
| Фенолфталеин | Малиновый цвет раствора | |
| Метиловый оранжевый | Желтый цвет раствора |
Качественные реакции на катионы.
| Катион | Условие, реактив, анион | Признаки, сокращенное ионное уравнение реакции |
| $H^{+}$ | Лакмус | Красный цвет раствора |
| Метиловый оранжевый | Розовый цвет раствора | |
| $NH_4^{+}$ | Щелочь, $OH^{–}$, $t°$ | Выделение газа с резким запахом: $NH_4^{+}+OH^{-}=NH_3↑+H_2O$ |
| $Ag^{+}$ | Соляная кислота, растворы хлоридов, $Cl^{–} | Белый творожистый осадок: $Ag^{+}+Cl^{–}→AgCl↓$ |
| $Li^{+}$ | Пламя | Красное окрашивание |
| $Na^{+}$ | Пламя | Желтое окрашивание |
| $K^{+}$ | Пламя | Фиолетовое окрашивание |
| $Ca^{2+}$ | Пламя | Кирпично-красное окрашивание |
| Растворы карбонатов, $CO_3^{2−}$ | Белый осадок: $Ca^{2+}+CO_3^{2-}→CaCO_3↓$ | |
| $Ba^{2+}$ | Пламя | Желто-зеленое окрашивание |
| Серная кислота, растворы сульфатов, $SO_4^{2−}$ | Белый (мелкокристаллический) осадок: $Ba^{2+}+SO_4^{2-}→BaSO_4↓$ | |
| $Cu^{2+}$ | Пламя | Зеленое окрашивание |
| Вода | Гидратированные ионы $Cu^{2+}$ имеют голубую окраску | |
| Щелочь, $OH^{–}$ | Синий осадок: $Cu^{2+}+2OH^{-}=Cu(OH)_2↓$ | |
| $Fe^{2+}$ | Щелочь, $OH^{–}$ | Зеленоватый осадок: $Fe^{2+}+2OH^{–}=Fe(OH)_2↓$ |
| Красная кровяная соль $K_3[Fe(CN)_6], Fe(CN)_6^{3−}$ | Синий осадок (турнбулева синь): $3Fe^{2+}+2[Fe(CN)_6]^{3-}=Fe_3[Fe(CN)_6]_2↓$ | |
| $Fe^{3+}$ | Щелочь, $OH^{–}$ | Бурый осадок: $Fe^{3+}+3OH^{–}=Fe(OH)_3↓$ |
| Роданид аммония $NH_4SCN, SCN^{–}$ | Кроваво-красный осадок: $3Fe^{3+}+3CNS^{-}⇄Fe(SCN)_3↓$ | |
| $Fe^{3+}$ | Желтая кровяная соль $K_4[Fe(CN)_6]$ | Темно-синий осадок (берлинская лазурь): $4Fe^{3+}+3[Fe(CN)_6]^{4–}=Fe_4[(CN)_6]_3↓$ |
| $Al^{3+}$ | Щелочь, $OH^{–}$ | Желеобразный осадок белого цвета, растворяется в избытке раствора щелочи: $Al^{3+}+3OH^{–}=Al(OH)_3↓$ |
Цвета соединений, знание которых необходимо для сдачи ЕГЭ
1. Медь – мягкий пластичный металл розового цвета. Степени окисления: +1, +2.
Cu2O – кристаллическое, нерастворимое в воде вещество кирпично-красного цвета.
CuO – кристаллы чёрного цвета, практически нерастворимые в воде.
CuS — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
Cu2S — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
CuOH — желтое вещество; не растворимо в воде; является неустойчивым и разлагается при нагревании на Cu2O и H2O.
Cu(OH)2 – голубое аморфное или кристаллическое вещество; практически не растворимо в воде.
CuSO4 – кристаллическое вещество белого цвета, хорошо растворяется в воде. Из водных растворов кристаллизуется пентагидрат CuSO4·5H2O – медный купоро́с, кристаллы голубого цвета (при нагревании снова теряет воду и становится белым). Водный раствор CuSO4 также голубого цвета.
2. Цинк – металл голубовато-белого цвета, мягкий, хрупкий. Степень окисления: +2.
ZnO, Zn(OH)2, ZnS – белые твердые вещества, нерастворимые в воде.
3. Алюминий – легкий металл серебристо-белого цвета. Степень окисления: +3.
Al2O3, Al(OH)3 – белые твердые вещества, нерастворимые в воде.
AlPO4 — твёрдое, белое кристаллическое вещество, нерастворимое в воде.
4. Серебро – блестящий белый мягкий пластичный металл. Степень окисления: +1.
AgCl – белое твердое нерастворимое в воде вещество.
AgBr – светло-желтое твердое нерастворимое в воде вещество.
AgI – твердое нерастворимое в воде вещество желтого цвета.
Ag2S — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
Ag2O — твердое нерастворимое в воде вещество черного цвета.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
5. Железо – серебристо-серый мягкий ковкий металл. Степени окисления: +2, +3, +6.
FeO – твердое нерастворимое в воде вещество черного цвета.
Fe(OH)2 – серо-зеленый осадок, студенистый осадок зеленого цвета. Не растворяется в воде.
Fe2O3, Fe(OH)3 – твердые красно-коричневые (бурые), нерастворимые в воде соединения.
Fe3O4 – твердое черное вещество. Не растворяется в воде.
FeCl3 – раствор желтого цвета.
6. Сера – желтое нерастворимое в воде вещество. Степени окисления: -2, +4, +6.
SO2 – бесцветный газ с неприятным запахом; газ, образующийся в момент зажигания спички
H2SO4 – тяжелая бесцветная жидкость, растворяется в воде с сильным разогреванием раствора.
7. Хром — твёрдый металл голубовато-белого цвета.
CrO — твердое вещество ченого цвета.
Cr2O3 — твердое вещество темно-зеленого цвета.
CrO3 — твердое вещество красного цвета.
Na2Cr2O7 и другие дихроматы — соединения оранжевого цвета.
Na2CrO4 и другие хроматы — соединения желтого цвета.
Cr2(SO4)3 — в растворе сине-фиолетового цвета (кислотная среда).
K3[Cr(OH)6] — в растворе зеленого цвета (щелочная среда).
8. Марганец — металл серебристо-белого цвета.
MnO2 — твердое нерастворимое в воде вещество бурого цвета.
Mn(OH)2 — белый осадок.
KMnO4 — пурпурные кристаллы, растворяется в воде с образованием фиолетового раствора.
K2MnO4 — растворимая соль темно-зеленого цвета.
Mn(NO3)2, MnCl2, MnBr2 и некоторые другие соли Mn+2 — как правило, розовые растворимые в воде соединения.
9. Фосфор — неметалл. Основные модификации: белый, красный и черный фосфор.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
AlPO4 — твердое нерастворимое в воде вещество белого цвета.
Li3PO4 — твердое нерастворимое в воде вещество белого цвета.
Ba3(PO4)2 — осадок белого цвета
10. Свинец — ковкий, тяжёлый металл серебристо-белого цвета.
PbS — осадок черного цвета.
PbSO4 — осадок белого цвета.
PbI2 – осадок ярко-желтого цвета.
11. Соединения бария:
BaSO4 – белый осадок нерастворимый в кислотах
BaSO3 – белый осадок растворимый в кислотах
Ba3(PO4)2 — осадок белого цвета
BaCrO4 — осадок желтого цвета
12. Другие соединения:
CaCO3 – осадок белого цвета
NH3 – аммиак, бесцветный газ с резким запахом
CO2 – газ тяжелее воздуха, без цвета и запаха, играющий важную роль в процессе фотосинтеза.
NO2 – газ бурого цвета (лисий хвост)
H2SiO3 – бесцветный студенистый осадок
Таблицы качественных реакций
21-Дек-2013 | комментариев 9 | Лолита Окольнова
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
| Описание | Формула |
Реакции |
| Бурый газ |
NO2 |
1) N2 + 2O2 = 2NO2 2) взаимодействие металлов с азотной кислотой (концентрированной) 3) разложение нитратов |
| Запах тухлых яиц |
H2S |
Взаимодействие активных металлов с концентрированной серной кислотой: |
|
Газ с резким запахом. Растворимый в воде |
SO2 |
1) взаимодействие серасодежащих веществ с кислородом
2) взаимодействие некоторых металлов с концентрированной серной кислотой |
| Газ с резким характерным запахом, растворимый в воде |
NH3 |
1) N2 + 3H2 = 2NH3 2) обменные реакции солей аммония |
| Газ, не поддерживающий горение, малорастворимый в воде, не ядовитый |
N2 |
1) горение азотсодержащих веществ; NH4NO2 = N2 + 2H2O |
|
Газы, поддерживающие горение: (для NO2 – бурый цвет) |
O2 O3 NO2 |
3C + 2O3 = 3CO2 С + 2NO2 = CO2 + 2NO |
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
|
желто-зеленое |
фиолетовое |
кирпично-красное |
ярко-красное |
желтое |
карминово-красное |
|
Ba2+ |
K+ |
Са2+ |
Li+ |
Na+ |
Sr2+ |
Таблица качественных реакций
— цвета осадков
|
Осадки белого цвета |
Качественная реакция |
|
Белый творожистый нерастворимый в воде; нерастворимый в HNO3 |
Ag+ + Cl— → AgCl↓ качественная реакция на соли серебра; качественная реакция на хлорид-ионы; |
|
Белый осадок нерастворимый в кислотах |
Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария; качественная реакция на сульфат-ионы; |
|
Белый осадок образуется при пропускании газа без цвета с резким запахом через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + SO2 = CaSO3↓ + H2O
|
|
Белый осадок образуется при добавлении щелочи; растворяется в избытке щелочи |
Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓
|
|
Белый осадок образуется при пропускании газа без цвета и запаха через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2H+ → CO2↑ + H2O + Ca2+ |
|
Осадок светло-желтого цвета (осадок кремового цвета) образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + Br— → AgBr↓ качественная реакция на бромид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + I— → AgJ↓ качественная реакция на иодид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; растворим в кислотах; |
3Ag+ + PO43- → Ag3PO4↓ |
|
Осадки коричневых цветов |
Качественная реакция |
|
Осадок бурого цвета образуется при взаимодействии с растворами щелочей; |
Fe3+ +3OH— → Fe(OH)3↓ качественная реакция на соли железа |
|
Осадки синих и зеленых цветов |
Качественная реакция |
|
Осадки зеленого цвета |
Fe2+ +2OH— → Fe(OH)2↓ |
|
Осадок голубого цвета (осадок синего цвета) образуется при взаимодействии с растворами щелочей |
Cu2+ +2OH— → Cu(OH)2↓ качественная реакция на соли меди (II) |
|
Осадок синего цвета образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли |
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ качественная реакция на соли железа (II) — с красной кровяной солью; 4Fe3+ + 3[Fe(CN)6]-4 → Fe4[Fe(CN)6]3↓ качественная реакция на соли железа (III) — с желтой кровяной солью; |
|
Осадки черного цвета |
Качественная реакция |
|
Осадок черного цвета Образуется при взаимодействии с сульфидами или с H2S |
Fe2+ + S2- → FeS↓ Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ качественная реакция на сульфид-ионы |
Обсуждение: «Таблицы качественных реакций»
(Правила комментирования)
Что такое качественная реакция
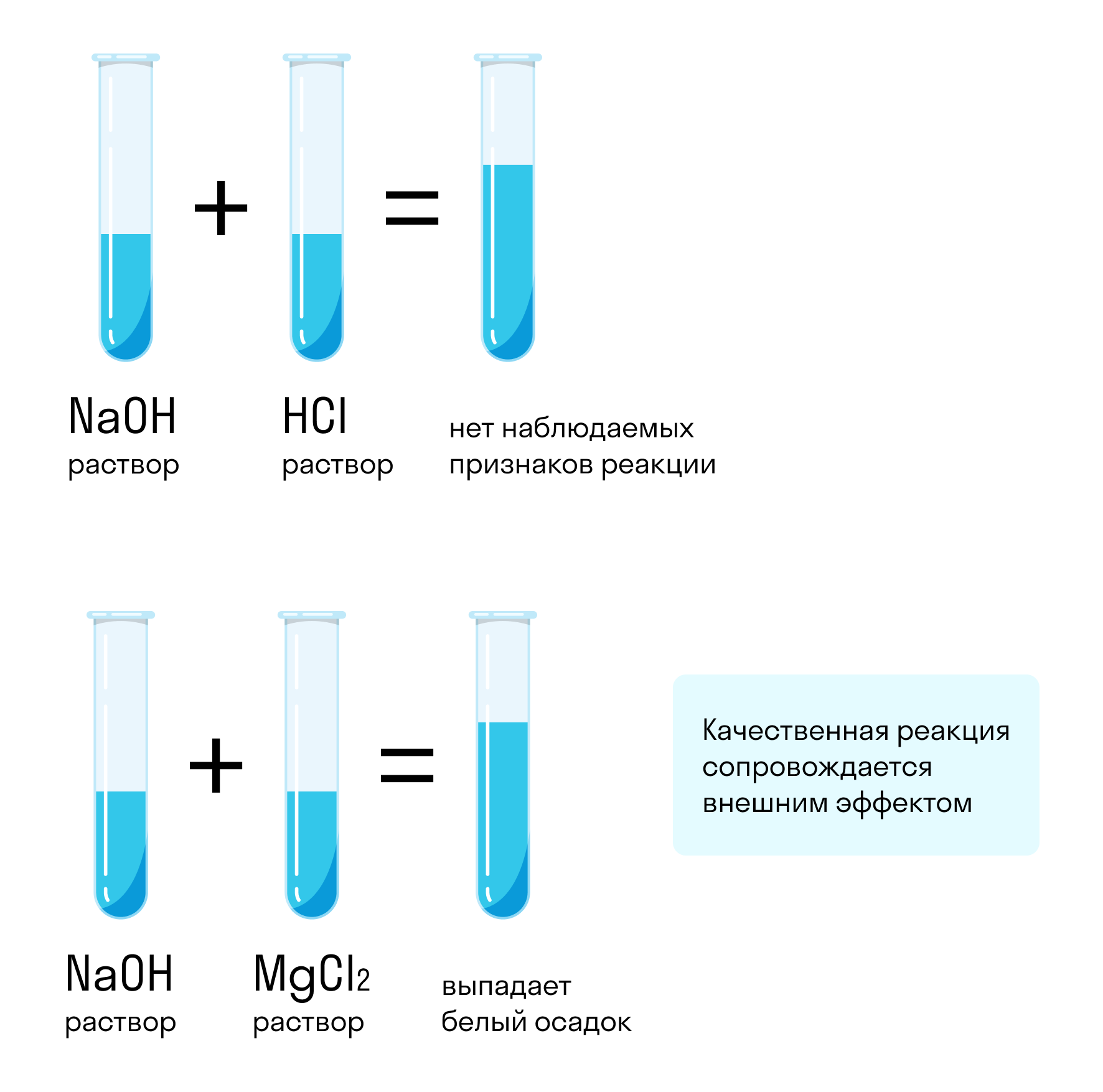
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
-
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
-
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Правила растворимости химических соединений
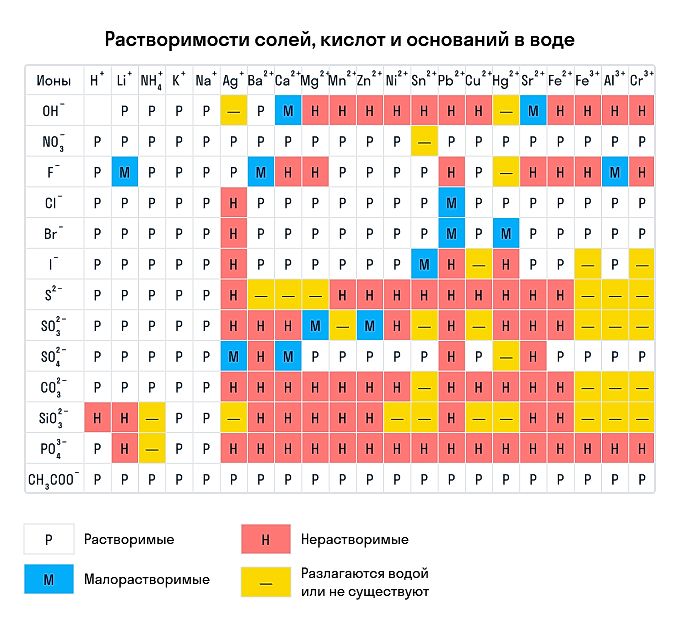
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
-
абсолютно все нитраты;
-
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
-
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
-
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
-
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
-
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
-
любые карбонаты, фосфаты и сульфиты, кроме K2CO3, K2SO3, K3PO4, Na2CO3, Na2SO3, Na3PO4, (NH4)2CO3, (NH4)2SO3, (NH4)3PO4.
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
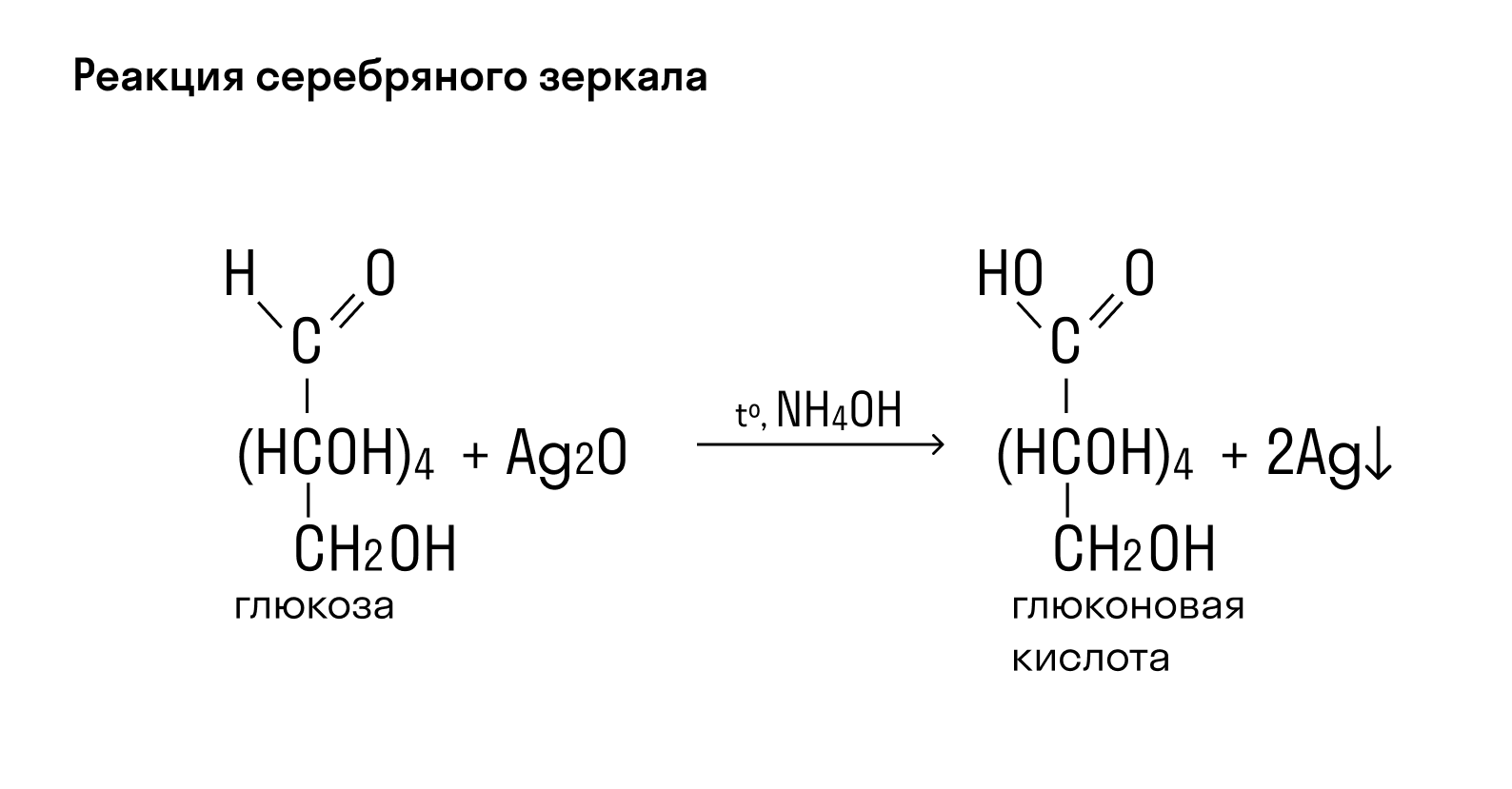
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
C6H5OH + 2Br2 ⇒ C6H2Br3OH + 3HBr — реакция с бромной водой.
3C6H5OH + FeCl3 ⇒ (C6H5O)3Fe + 3HCl — реакция с хлоридом железа (III).
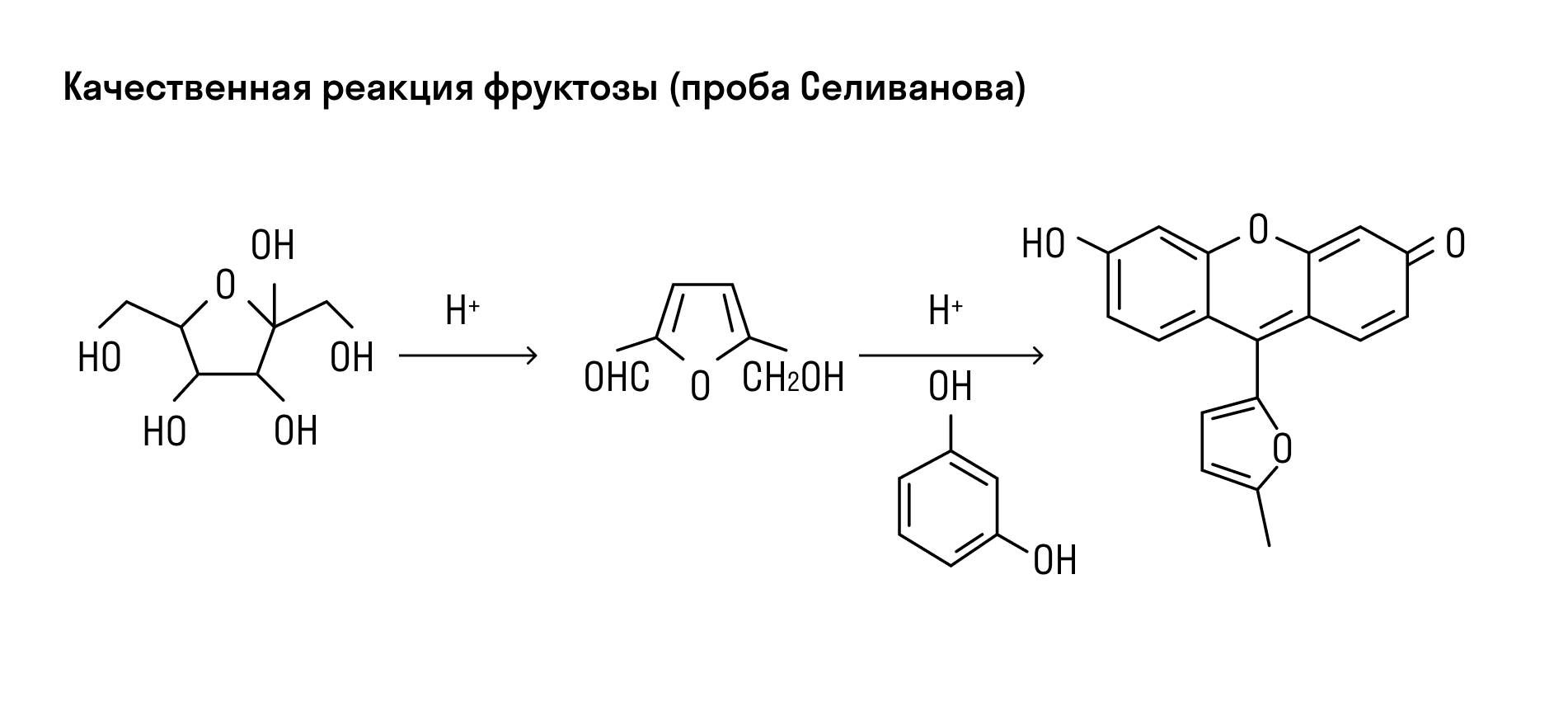
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
I2 + (C6H10O5)n ⇒ I2(C6H10O5)n— качественная реакция крахмала с йодом.
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Качественные реакции на неорганические вещества и ионы
Таблица. Качественные реакции на анионы
| Анион | Реактив | Наблюдаемая реакция |
| SO42- | соли Ва2+ | Выпадение белого осадка BaSO4 |
| NO3— | добавить конц. H2SO4 и Сu, нагреть | Образование голубого раствора (ионы Сu2+), выделение газа бурого (NO2) |
| РО43- | ионы Ag+ | Выпадение светло-желтого осадка в нейтральной среде:
ЗАg+ + РO43- = Аg3РO4 |
| СrO42- | ионы Ва2+ | Выпадение желтого осадка:
Ва2+ + СrO42- = BaCrO4 |
| S2- | ионы Рb2+ | Выпадение черного осадка:
Pb2+ + S2- = PbS |
| СО32- | ионы Са2+ | выпадение белого осадка СаСО3 |
| CO2 | известковая вода Са(ОН)2 | Выпадение белого осадка и его растворение при пропускании СO2:
Са(ОН)2 + СO2 = СаСО3+Н2O СаСО3 + СO2 + Н2O = Са(НСO3)2 |
| SO32- | ионы Н+ | Появление запаха SO2:
2Н+ + SO32- = Н2O + SO2 Сернистый газ обесцвечивает бромную воду. |
| F— | ионы Са2+ | Выпадение белого осадка:
Са2+ + 2F— = CaF2 |
| Cl— | ионы Аg+ | Выпадение белого творожистого осадка:
Аg+ + Cl— = AgCl |
| Br— | ионы Аg+ | Выпадение светло-желтого осадка:
Ag+ + Br— = AgBr осадок темнеет на свету |
| I— | ионы Аg+ | Выпадение желтого осадка:
Аg+ + I— = АgI осадок темнеет на свету |
| ОН— | индикаторы: лакмус
фенолфталеин |
синее окрашивание
малиновое окрашивание |
Таблица. Качественные реакции на катионы
| Катион | Реактив | Наблюдаемая реакция |
| Li+ | Пламя | Карминово-красное окрашивание |
| Na+ | Пламя | Желтое окрашивание |
| K+ | Пламя | Фиолетовое окрашивание |
| Ca2+ | Пламя | Кирпично-красное окрашивание |
| Sr2+ | Пламя | Карминово-красное окрашивание |
| Ba2+ | 1) Пламя
2) Ион SO42- |
1) Желто-зеленое окрашивание
2) Выпадение белого осадка BaSO4 |
| Cu2+ | 1) Вода
2) Ионы ОН— |
1) Растворы солей Сu2+ имеют голубую окраску
2) Голубой осадок Cu(OH)2 |
| Pb2+ | Ион S2- | Выпадение черного осадка: PbS |
| Ag+ | Ион Cl— | Выпадение белого осадка:
Аg+ + Cl— = AgCl |
| Fe2+ | Красная кровяная соль, K3[Fe(CN)6] | Выпадение синего осадка KFe[Fe(CN)6] |
| Fe3+ | 1) Желтая кровяная соль, K4[Fe(CN)6] 2) Роданид-ион SCN— |
1) Выпадение синего осадка: KFe[Fe(CN)6]
2) Появление ярко-красного окрашивания |
| Al3+ | Щелочь (амфотерные свойства гидроксида) | Выпадение белого осадка гидроксида алюминия при добавлении первых порций щелочи и его растворение при дальнейшем добавлении. |
| NH4+ | Щелочь при нагревании | Запах аммиака NH3 и окрашивание влажного лакмуса в синий цвет |
| H+ | Индикаторы: лакмус, метилоранж | Красное окрашивание (кислая среда) |
Таблица. Качественные реакции на газы
| Газ | Качественная реакция |
| Водород, H2 | Хлопок при поднесении горящей лучинки к источнику водорода |
| Азот, N2 | Горящая лучинка тухнет в атмосфере азота. При пропускании через раствор Ca(OH)2 осадок не выпадает |
| Кислород, O2 | Тлеющая лучинка ярко загорается в атмосфере кислорода |
| Озон, O3 | Взаимодействие озона с раствором иодидов с выпадением кристаллического иода I2 в осадок:
2KI + O3 + H2O = 2KOH + I2↓ + O2↑ |
| Хлор, Сl2 | При взаимодействии хлора с растворами иодидов в осадок выпадает желтый осадок йода I2:
2KI + Cl2 = 2KCl + I2↓ |
| Аммиак, NH3 | Резкий запах; влажный лакмус синеет. Реакция аммиака с хлороводородом («дым» без огня):
NH3 + HCl = NH4Cl |
| Углекислый газ, CO2 | Тлеющая лучинка гаснет в атмосфере углекислого газа. Пропускание углекислого газа через известковую воду Ca(OH)2: Ca(OH)2 + CO2 = CaCO3↓ + H2O Дальнейшее пропускание приведет к растворению осадка: CaCO3 + CO2 + H2O = Ca(HCO3)2 |
| Оксид азота (II), NO | Оксид азота (II) очень чувствителен к кислороду воздуха, потому на воздухе буреет, окисляясь до оксида азота (IV) NO2:
2NO+ O2 = 2NO2 |
| Сернистый газ, SO2 | Обесцвечивание бромной воды и раствора перманганата калия |
| Сероводород, H2S | Чёрный осадок сульфида при пропускании через раствор соли меди или свинца |
Эксперимент на ОГЭ по химии у многих вызывает вопросы, ведь далеко не во всех школах на уроках проводят опыты. Как подготовиться к экспериментальной части? Что на ней нужно делать? Как заработать максимум баллов и за что их можно лишиться? Рассказываем в этой статье.
Приходите на курсы подготовки к ОГЭ по химии в MAXIMUM Education: я и другие наши преподаватели отлично знаем структуру экзамена и умеем подавать сложные темы просто и доступно. Благодаря занятиям ваши знания по химии выстроятся в систему, а на экзамене вы не запутаетесь в хитрых вопросах составителей. Готовьтесь к ОГЭ осознанно — тогда высокий балл вам гарантирован!
Эксперимент на ОГЭ по химии
Экспериментальная часть экзамена по химии представлена двумя заданиями: 23 и 24. В 23-м задании нужно записать два уравнения качественных реакций, подтверждающие свойства заданного вещества.
Пример 1. Дан раствор сульфата железа (II), а также набор следующих реактивов: оксид меди (II), соляная кислота, растворы хлорида бария, гидроксида калия, серной кислоты.
Запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства сульфата железа (II), и укажите признаки их протекания. Используйте только вещества из приведенного выше перечня.
Запишите уравнения реакции
Чтобы записать два уравнения реакции, вы можете использовать такой лайфхак. Заданное вещество — сульфат железа (II) — состоит из катиона Fe2+ и аниона SO42–. Запишем их и все формулы реактивов в виде таблицы:
| CuO | HCl | BaCl2 | KOH | H2SO4 | |
| Fe2+ | |||||
| SO42– |
Затем, пользуясь таблицей растворимости солей, кислот и оснований, находим нерастворимые вещества. Отмечаем это в таблице.
| CuO | HCl | BaCl2 | KOH | H2SO4 | |
| Fe2+ | — | — | — | Fe(OH)2 | — |
| SO42– | — | — | BaSO4 | — | — |
Теперь записываем уравнения реакций:
- FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4
- FeSO4 + BaCl2 = FeCl2 + BaSO4↓
За эту запись вы получите 2 балла.
Укажите цвет осадка
Чтобы получить еще 2 балла, нужно описать качественные признаки. Если качественный признак — осадок, нужно указать его цвет. Помните, что осадки металлов, находящихся в ряду активности до хрома, имеют белый цвет, как и AgCl. А вот осадки металлов после хрома включительно — цветные.
Можно выучить цвета часто используемых осадков:
| Белые осадки | Желтые осадки | Голубой осадок | Черные осадки | Бурый осадок | Зеленый осадок |
|---|---|---|---|---|---|
| BaSO4, CaCO3, AgCl, ZnS, Mg(OH)2, Al(OH)3 и т. д. | AgBr, AgI, PbI2, Ag3PO4 | Cu(OH)2 | CuS, PbS, Ag2S | Fe(OH)3 | Fe(OH)2, FeCO3 |
Но, если эта задача кажется, невыполнимой, вы можете оставить место после уравнений, выполнить эксперимент, а затем вернуться к работе и записать признак, какой увидели в пробирке.
Охарактеризуйте газы
Кроме осадков, мы часто наблюдаем другой качественный признак — выделение газа.
Пример 2. Дан раствор серной кислоты, а также набор следующих реактивов: цинк, соляная кислота, растворы хлорида бария, карбоната натрия, хлорида магния.
Используя только вещества из приведенного перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства серной кислоты, и укажите признаки их протекания.
Запишем уравнения реакций для серной кислоты:
- H2SO4 + Zn = ZnSO4 + H2↑
- H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑
Для характеристики газов следует указывать цвет и запах. В данном случае Н2 и СО2 — это бесцветные газы без запаха. Также в задании 23 вы можете встретить газы H2S и SO2 (бесцветные газы с неприятным запахом) и NH3 (бесцветный газ с резким запахом).
Опишите окраску индикатора
Но самое сложное задание 23 для учеников — это эксперимент с использованием индикаторов.
Пример 3. Дан раствор гидроксида натрия, а также набор следующих реактивов: медь, оксид меди (II), соляная кислота, растворы карбоната калия, сульфата меди (II), фенолфталеина. Возможно использование индикаторной бумаги.
Используя только вещества из приведенного перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства гидроксида натрия, и укажите признаки их протекания.
Известно, что индикатор меняет свою окраску при изменении типа среды раствора. Поэтому описать его окраску необходимо до и после протекания реакции. Записать это следует так:
Добавим 1–2 капли фенолфталеина в пробирку с NaOH. Наблюдается появление малиновой окраски раствора:
NaOH + HCl = NaCl + H2O
После протекания реакции наблюдается исчезновение окраски раствора:
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 — выпадение голубого осадка.
Итого: за 2 уравнения реакций и 2 описания качественных признаков вы получаете уже 4 балла. Но это еще не все: вас ждет задание 24 — сам эксперимент.
Задание 24
В каждом КИМ вы увидите инструкцию по выполнению практического задания. Мы выбрали для вас пункты, на которые стоит обратить пристальное внимание.
1. В склянке находится пипетка. Это означает, что отбор жидкости и переливание ее в пробирку для проведения реакции необходимо проводить только с помощью пипетки. Для проведения опытов отбирают 7–10 капель реактива.
2. Пипетка в склянке с жидкостью отсутствует. В этом случае переливание раствора осуществляют через край склянки, которую располагают так, чтобы при ее наклоне этикетка оказалась сверху («этикетку — в ладонь!»).
3. Отбор порошкообразного вещества из емкости осуществляют только с помощью ложечки или шпателя.
4. Возврат излишка реактива в исходную емкость категорически запрещен.
За правильно выполненный эксперимент вы получаете еще 2 балла, и ваш результат увеличивается уже на 6 баллов!
Теперь вы знаете, как выполнить эксперимент на ОГЭ по химии и правильно оформить задания 23 и 24 в бланке. Используйте наши советы и лайфхаки для получения максимальных результатов на экзамене. Успехов!