Алкадиены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С.
Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда — пропадиен — CH2=C=CH2.
Общая формула их гомологического ряда — CnH2n-2.
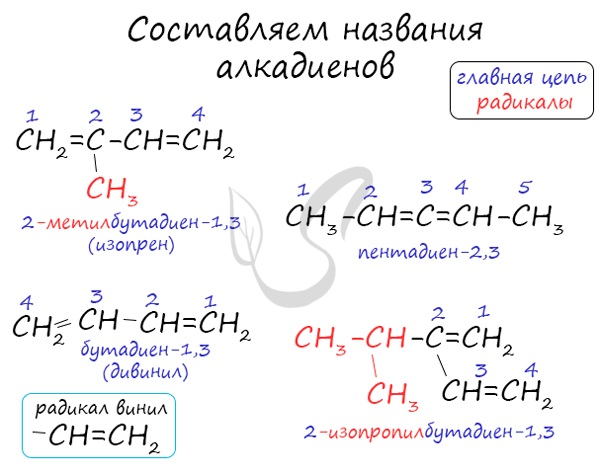
Номенклатура и изомерия алкадиенов
Названия алкадиенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом:
пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация
атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых
начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
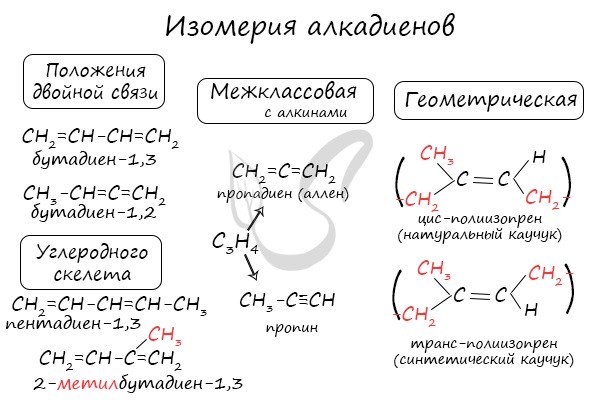
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая
изомерия в виде существования цис- и транс-изомеров.
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
- Кумулированные двойные связи
- Сопряженные двойные связи
- Изолированные двойные связи
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
Пример — пропадиен-1,2 (аллен) — CH2=C=CH2
В молекуле аллена крайние атомы углерода находятся в состоянии sp2-гибридизации, а центральный атом — sp-гибридизации.
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в
молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией
плоскости (линией, соединяющей центры атомов).
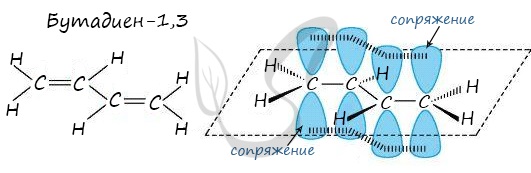
Пример — бутадиен-1,3 — CH2=CH-CH=CH2
В случае, если две двойные связи разделены двумя и более одинарными связями.
Пример — пентадиен-1,4 — CH2=CH-CH2-CH=CH2
Получение алкадиенов
Алкадиены получают несколькими способами:
- Дегидрогалогенирование дигалогеналканов
- Синтез С.В. Лебедева
- Дегидрирование алканов
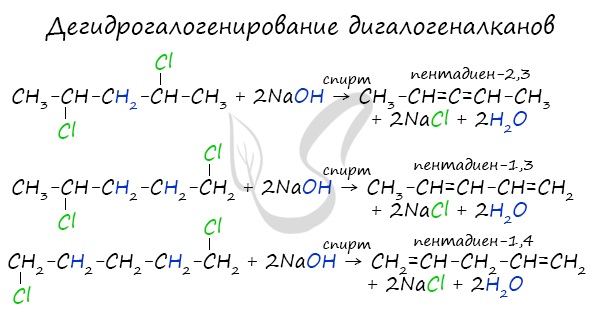
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи
получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из
этилового спирта.
2CH3-CH2-OH → (450 °C, кат. ZnO) CH2=CH-CH=CH2 + 2H2O
+ H2
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и
способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.

В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит
при повышенной температуре и в присутствии катализатора.

Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3
при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C — продукт 1,4-присоединения.

Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.
При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление.
2CH2=CH-CH=CH2 + 11O2 → 8CO2 + 6H2O
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения
молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Тематический тест на диены.
Задание №1
Из предложенного списка формул выберите те, которые могут относиться к алкадиенам. Число верных ответов может быть любым.
- 1. C4H8
- 2. C6H10
- 3. C8H16
- 4. C7H12
- 5. C4H6
Решение
Ответ: 245
Задание №2
Из предложенного списка формул выберите те, которые не могут относиться к алкадиенам. Число верных ответов может быть любым.
- 1. C3H4
- 2. C4H10
- 3. C6H8
- 4. C5H8
- 5. C9H18
Решение
Ответ: 235
Задание №3
Из предложенного списка формул выберите те, которые могут относиться к алкадиенам с сопряженными двойными связями. Число верных ответов может быть любым.
- 1. C4H8
- 2. C3H4
- 3. C5H8
- 4. C6H12
- 5. C2H6
Решение
Ответ: 3
Задание №4
Из предложенного списка формул выберите те, которые не могут относиться к сопряженным алкадиенам. Число верных ответов может быть любым.
- 1. C5H12
- 2. CH4
- 3. C3H4
- 4. C6H10
- 5. C7H16
Решение
Ответ: 1235
Задание №5
Из предложенного списка формул выберите те, которые могут содержать атомы углерода в состоянии sp3-гибридизации орбиталей. Число верных ответов может быть любым.
- 1. C2H4
- 2. C3H4
- 3. C2H2
- 4. C4H6
- 5. C5H8
Решение
Ответ: 245
Задание №6
Из предложенного списка формул выберите те, которые не могут содержать sp3-гибридные атомы углерода. Число верных ответов может быть любым.
- 1. C2H2
- 2. C4H8
- 3. C5H6
- 4. C4H10
- 5. CH4
Решение
Ответ: 1
Задание №7
Из предложенного формул выберите те, которые можно использовать для производства каучука. Число верных ответов может оказаться любым.
- 1. C5H8
- 2. C4H10
- 3. C3H8
- 4. C4H6
- 5. C2H6
Решение
Ответ: 14
Задание №8
Из предложенного формул выберите те, которые могут полимеризоваться. Число верных ответов может быть любым.
- 1. C5H12
- 2. C10H22
- 3. C2H4
- 4. C5H8
- 5. C4H6
Решение
Ответ: 345
Задание №9
Какие из приведенных веществ не являются углеводородами? Число верных ответов может быть любым.
1) изопрен
2) этилен
3) дивинил
4) хлоропрен
5) винилхлорид
Решение
Ответ: 45
Задание №10
Какие из приведенных веществ не являются диенами? Число верных ответов может быть любым.
1) бутадиен
2) дивинил
3) изопрен
4) хлоропрен
5) полиэтилен
Решение
Ответ: 5
[adsp-pro-3]
Задание №11
Какие из приведенных веществ являются газами при комнатной температуре? Число верных ответов может быть любым.
1) изопрен
2) дивинил
3) метан
4) пропилен
5) хлоропрен
Решение
Ответ: 234
Задание №12
Из приведенного перечня веществ выберите два таких, которые не являются газами при комнатной температуре?
1) полибутадиен
2) дивинил
3) бром
4) пропан
5) этилен
Решение
Ответ: 13
Задание №13
Для каких из приведенных веществ возможно как 1,2-, так и 1,4-присоединение? Число верных ответов может быть любым.
1) изопрен
2) пентадиен-1,4
3) бутадиен-1,3
4) хлоропрен
5) гексадиен-2,4
Решение
Ответ: 1345
Задание №14
Для каких из приведенных веществ невозможно 1,4-присоединение? Число верных ответов может быть любым.
1) изопрен
2) пентадиен-1,4
3) бутадиен-1,3
4) хлоропрен
5) гексадиен-1,5
Решение
Ответ: 25
Задание №15
Из приведенного списка соединений выберите те, которые могут образоваться при гидрировании дивинила в условиях различного соотношения водород : диен. Число верных ответов может быть любым.
1) бутен-1
2) изопрен
3) бутан
4) бутадиен
5) бутен-2
Решение
Ответ: 135
Задание №16
Из приведенного списка соединений выберите те, которые могут образоваться при гидрировании изопрена в условиях различного соотношения водород : диен. Число верных ответов может быть любым.
1) пентен-1
2) 2-метилбутен-2
3) изопентан
4) пентен-2
5) бутен-2
Решение
Ответ: 23
Задание №17
Из приведенного списка соединений выберите те, которые можно в одну стадию превратить в дивинил. Число верных ответов может быть любым.
1) н-бутан
2) изобутан
3) н бутанол
4) этанол
5) 1,4-дибромбутан
Решение
Ответ: 145
Задание №18
Из приведенного списка соединений выберите те, которые можно в одну стадию превратить в хлоропрен. Число верных ответов может быть любым.
1) бутен-1
2) винилацетилен
3) бутан
4) пентен-1
5) пропан
Решение
Ответ: 2
Задание №19
Из приведенного списка соединений выберите те, которые можно в одну стадию получить из бутадиена-1,3. Число верных ответов может быть любым.
1) бутен-2
2) 2,3-дибромбутан
3) 1,3-дибромбутен-2
4) 3,4-дибромбутен-1
5) 1,4-дихлорбутен-2
Решение
Ответ: 145
Задание №20
Из приведенного списка соединений выберите те, которые можно в одну стадию получить из изопрена. Число верных ответов может быть любым.
1) н-пентан
2) изопентан
3) 2-метилбутен-2
4) бутадиен
5) 1,4-дибром-2-метилбутен-2
Решение
Ответ: 235
[adsp-pro-3]
Задание №21
Из приведенного списка соединений выберите те, которые участвуют в получении дивинила по методу Лебедева. Число верных ответов может быть любым.
1) оксид цинка
2) этанол
3) бутиловый спирт
4) оксид алюминия
5) изобутан
Решение
Ответ: 124
Задание №22
Из приведенного списка соединений выберите те, которые можно использовать для получения изопрена в качестве катализаторов и реагентов. Число верных ответов может быть любым.
1) серная кислота
2) никель
3) бутан
4) 2-метилбутан
5) дивинил
Решение
Ответ: 24
Задание №23
Из приведенных соединений выберите те, которые реагируют с дивинилом. Число верных ответов может быть любым.
1) кислород
2) азот
3) водород
4) алюминий
5) бром
Решение
Ответ: 135
Задание №24
Какие из приведенных соединений выберите те, которые реагируют с изопреном? Число верных ответов может быть любым.
1) бромоводород
2) хлор
3) водород
4) едкий натр
5) оксид натрия
Решение
Ответ: 123
Задание №25
Какие из приведенных соединений выберите те, которые реагируют как с бутадиеном-1,3, так и с н-бутаном? Число верных ответов может быть любым.
1) водород
2) хлороводород
3) цинк
4) бром
5) кислород
Решение
Ответ: 45
Задание №26
Какие из приведенных соединений выберите те, которые реагируют с дивинилом, но не реагируют с пропаном? Число верных ответов может быть любым.
1) хлор
2) азот
3) бромоводород
4) натрий
5) водород
Решение
Ответ: 35
Задание №27
Какие из приведенных соединений выберите те, которые реагируют с изопреном? Число верных ответов может быть любым.
1) иод
2) калий
3) азот
4) бром
5) никель
Решение
Ответ: 14
Задание №28
Какие из приведенных соединений выберите те, которые реагируют с изопреном, но не реагируют с гексаном? Число верных ответов может быть любым.
1) азот
2) водород
3) едкое кали
4) пирит
5) хлор
Решение
Ответ: 2
Задание №29
Установите соответствие между веществом и продуктом его неполного гидрирования.
| ВЕЩЕСТВО | ПРОДУКТ |
|
А) изопрен Б) дивинил В) хлоропрен |
1) 2-хлорбутен-2 2) 1-хлорбутен-2 3) бутен-2 4) 2-метилбутан 5) 2-метилбутен-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 531
Задание №30
Установите соответствие между веществом и продуктом его полного гидрирования.
| ВЕЩЕСТВО | ПРОДУКТ |
|
А) бутадиен-1,3 Б) изопрен В) пентадиен-1,4 |
1) изопентан 2) н-пентан 3) н-бутан 4) пропан 5) изобутан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 312
[adsp-pro-3]
Задание №31
Установите соответствие между веществом и продуктом его взаимодействия с 1 эквивалентом брома.
| ВЕЩЕСТВО | ПРОДУКТ |
|
А) бутан Б) дивинил В) пентадиен-1,3 |
1) н-бутилбромид 2) втор-бутилбромид 3) изобутилбромид 4) 1,4-дибромбутен-2 5) 1,4-дибромпентен-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 245
Задание №32
Установите соответствие между веществом и продуктом его взаимодействия с 2 эквивалентами брома.
| ВЕЩЕСТВО | ПРОДУКТ |
|
А) 2-метилбутан Б) 2-метилбутадиен-1,3 В) бутадиен-1,3 |
1) 2,3-дибром-2-метилбутан 2) 1,2,3,4-тетрабром-2-метилбутан 3) 1,1,2,2-тетрабромбутан 4) 1,2,3,3-тетрабромбутан 5) 1,2,3,4-тетрабромбутан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 125
Задание №33
В заданной схеме превращений
C2H4 X
Y
Веществами X и Y являются соответственно
1) н-бутан
2) дивинил
3) бутен-2
4) этанол
5) этиленгликоль
Первым укажите вещество X, вторым — Y
Решение
Ответ: 42
Задание №34
В заданной схеме превращений
C2H5Cl C4H10
Y
Веществами X и Y являются соответственно
1) гидроксид калия
2) нитрид лития
3) натрий
4) изобутан
5) бутадиен-1,3
Первым укажите вещество X, вторым — Y
Решение
Ответ: 35
Задание №35
В заданной схеме превращений
X Y
дивинил
Веществами X и Y являются соответственно
1) н-бутан
2) изобутан
3) циклобутан
4) 1,3-дибромбутан
5) 1,4-дибромбутан
Первым укажите вещество X, вторым — Y
Решение
Ответ: 35
Задание №36
В заданной схеме превращений
CH3-CH2-OH X
Y
Веществами X и Y являются соответственно
1) изопрен
2) хлоропрен
3) дивинил
4) изобутан
5) н-бутан
Первым укажите вещество X, вторым — Y
Решение
Ответ: 35
[adsp-pro-3]
Цепочки на алкадиены.
Задание №1
Напишите уравнения реакций, в соответствии с которыми можно осуществить следующие превращения:
C2H6 X1
X2
X3
X4
X5
X6
Решение
Задание №2
Напишите уравнения реакций, в соответствии с которыми можно осуществить следующие превращения:
циклобутан X1
X2
X3
X4
X5
X6
Решение
Задание №3
Напишите уравнения реакций, в соответствии с которыми можно осуществить следующие превращения:
изопрен X1
X2
X3
Решение
Задание №4
Напишите уравнения реакций, в соответствии с которыми можно осуществить следующие превращения:
метан бромметан
этан
хлорэтан
этилен
этанол
дивинил
Решение
Задание №5
Напишите уравнения реакций, в соответствии с которыми можно осуществить следующие превращения:
C4H8 C4H9Br
бутен-1
X1
X2
X3
X4
Решение
[adsp-pro-10]
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение, изомерия и гомологический ряд алкадиенов
Химические свойства алкадиенов
Получение алкадиенов
Строение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
CH2=CH–CH2–CH=CH2
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода.
Например, пропадиен:
CH2=C=CH2
Кумулированные алкадиены неустойчивы.
Сопряженные двойные связи разделены одной σ-связью С-С.
Например, бутадиен-1,3:
CH2=CH–CH=CH2
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
Строение сопряженных алкадиенов
Молекула бутадиена-1,3 содержит четыре атома углерода в sp2—гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
Это соответствует плоскому строению молекулы бутадиена-1,3.
Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей.
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
Например, 2-метилбутадиен-1,3:
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Изображение с сайта orgchem.ru
Изомерия алкадиенов
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
Изомеры положения двойных связей с формулой С6Н10 — гексадиен-1,3 и гексадиен-2,4
| Гексадиен-1,3 |
Гексадиен-2,4 |
 |
 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкадиены являются межклассовыми изомерами с алкинами и циклоалкенами с общей формулой — CnH2n-2.
Межклассовые изомеры с общей формулой С4Н6 — бутадиен-1,3, бутин-1, циклобутен
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры углеродного скелета, которые соответствуют формуле С5Н8 — пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен)
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| цис-Алкадиен |
транс-Алкадиен |
 |
 |
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
CH2=CH–CH=CH2
Номенклатура алкадиенов
В названиях алкадиенов для обозначения двух двойных связей используется суффикс -ДИЕН.
Например, алкадиен имеет название бутадиен-1,3.
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей.
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода.
1.1. Гидрирование алкадиенов
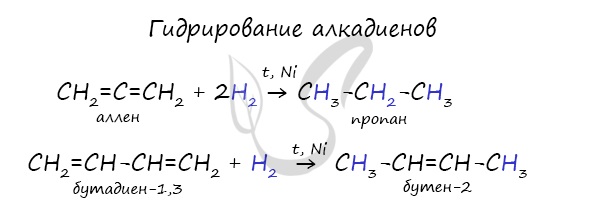
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2).
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2:
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
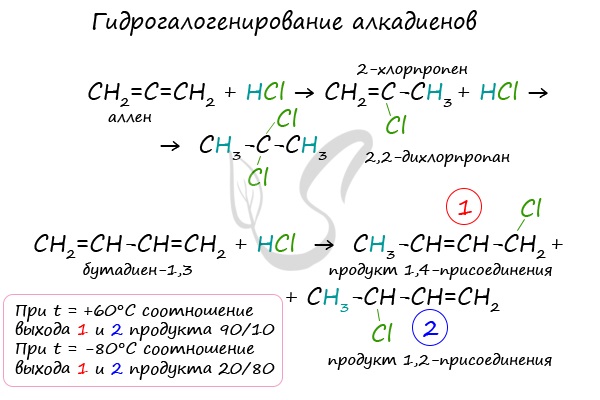
1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
.
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
1.4. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком.
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
При полимеризации изопрена образуется природный (натуральный) каучук:
2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь.
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
Например, уравнение сгорания бутадиена:
2C4H6 + 11O2 → 8CO2 + 6H2O
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):
Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Нагревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
Алкадиены— СnH2n-2, две двойные связи, n ≥ 3,диен.
1.От расположения двойных связей выделяют 3 вида
диенов:
Алкадиены с кумулированным расположением СН2 = С=СН2,
у С – sp2 –
гибридизация;
Алкадиены с сопряжёнными двойными связями CH2=CH—CH=CH2
Алкадиены с изолированными двойными связями СН2=СН-СН2-СН=СН2
пентадиен-1,4
Свойства алкадиенов.: алкадиены вступают в реакции в 2 ступени. Атомы
углерода при двойной связи находятся в sp2— гибридизации, р- орбитали, образующие п- связи (сопряжённые),
образуют единую систему- П—систему.
Длины двойных связей 1 и 3- 0, 137 нм (двойная- в
алкенах- 0-132 нм), а одинарная(2) — 0,146 нм ( у алканов- 0,154 нм), иногда
изображают: СН2 – СН – СН – СН2
2. Изомерия
1)Структурная а) у/в цепи
б)положения кратных свойств в)межклассовая- алкины
2) Пространственная цис- и транс- СН2=СН
СН3 СН2=СН
Н
С=С С=С
Н
СН3 Н СН3
цис-пентадиен-1,3 транс-
3.
Получение:
4250
1. Метод Лебедева. 2СН3-СН2ОН
СН2=СН-СН=СН2+2Н2О+Н2
этанол Al2O3,ZnO
бутадиен- 1,3
2. Дегидрирование 550-600
СН3-СН2-СН2-СН3 СH2=СH-СH=СH2+2Н2
Al2 O3, Cr2 O3
бутан
на 1 стадии образуется СН2=СН-СН2
-СH3 и СН3-СН=СH-СH3
бутен —
1 бутен — 2
3. Дегидрогалогенирование
t
СН2 — СН2 — СН2 — СН2+ 2
КОН СН2=СН-СН=СН2+2KBr + 2H2O
| | спиртовой
Br 1,4–дибром — Br р-р
бутан
из Н2С СН СН СН3
+ 2КОН СН3—CH2—C-=СН+2КBr+ 2H2O
I I
cпиртовой бутин-1
Br Br р—р
2,3 –дибромбутан
Физические
свойства: пропандиен-1,2 2- метилбутандиен-1,3
Г;
Ж;
бутадиен- 1,3
пентадиен-1,4
5. Химические свойства для веществ с сопряжёнными связями ( электрофильное
присоединение)
реакции присоединения (Н2, НАl2, HHAl)
Н2С-СН-СН=СН2 1,2- присоединение
I I
Вr Br
СН2=СН-СН=СН2 +Br 2
СН2-СН=СН-СН2
1,4- присоединение
I
I
Br
Br
+Br2 CH2 CH
CH CH2
I I I
I
Br Br Br Br
2) реакции полимеризации (радикальный механизм)
Na
n Н2С=СН-СН=СН2 (-CH2-СН=СН-СН2=) n синтетический
бутадиеновый каучук
для получения синтетических каучуков
Н Н Н
CН2—
стереорегулярный
С=С
С=С
—
H2C H
-Н2С
цис—
СН2 — транс—
АЛКАДИЕНЫ.
Это углеводороды, содержащие две двойные связи. Первый член ряда – С3Н4 (пропадиен или аллен). В названии появляется суффикс – ДИЕН.
|
СН2=СН –СН=СН2 бутадиен-1,3 (дивинил) |
СН2=С –СН=СН2 │ 2-метилбутадиен-1,3 СН3 (изопрен) |
Типы двойных связей в диенах:
|
1.Изолированные двойные связи разделены в цепи двумя или более σ-связями: СН2=СН–СН2–СН=СН2. Диены этого типа проявляют свойства, характерные для алкенов. |
|
2. Кумулированные двойные связи расположены у одного атома углерода: СН2=С=СН2 (аллен) Подобные диены (аллены) относятся к довольно редкому и неустойчивому типу соединений. |
|
3.Сопряженные двойные связи разделены одной σ-связью: СН2=СН–СН=СН2 Сопряженные диены отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp2-атомов углерода. |
Изомерия диенов
|
1. Изомерия положения двойных связей: |
|
2. Изомерия углеродного скелета: |
|
3. Межклассовая изомерия с алкинами и циклоалкенами. Например, формуле С4Н6 соответствуют следующие соединения: |
|
4. Пространственная изомерия Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию. (1)Цис-изомер (2) Транс-изомер |
Электронное строение сопряженных диенов.
Молекула бутадиена-1,3 СН2=СН-СН=СН2 содержит четыре атома углерода в sp2—гибридизованном состоянии и имеет плоское строение.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы между всеми атомами углерода.
Кратность связей (число общих электронных пар) между атомами углерода имеет промежуточное значение: нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
ХИМИЧЕСКИЕ СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.
|
РЕАКЦИИ ПРИСОЕДИНЕНИЯ К СОПРЯЖЕННЫМ ДИЕНАМ. Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах). Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная системы из двух двойных связей: Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения). |
|
1. Гидрирование. CН3-СН2-СН=СН2 (1,2-продукт) СН2=СН-СН=СН2 + Н2 СН3-СН=СН-СН3 (1,4-продукт) В присутствии катализатора Ni получается продукт полного гидрирования: CH2=CH-CH=CH2 + 2 H2 –(Ni,t)🡪 CH3-CH2-CH2-CH3 |
|
2. Галогенирование, гидрогалогенирование и гидратация 1,4-присоединение. 1,2-присоединение. При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана. |
|
3. Реакция полимеризации. Реакция протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком: nСН2=СН-СН=СН2 🡪 (-СН2-СН=СН-СН2-)nполимеризация изопрена: nCH2=C–CH=CH2 🡪( –CH2 –C =CH –CH2 –)n │ │ CH3 CH3 (полиизопрен) |
|
РЕАКЦИИ ОКИСЛЕНИЯ – мягкое, жесткое, а также горение. Протекают так же, как и в случае алкенов – мягкое окисление приводит к многоатомному спирту, а жесткое окисление – к смеси различных продуктов, зависящих от строения диена: СН2=СН –СН=СН2 + KMnO4 + H2O 🡪 СН2 – СН – СН – СН2 +MnO2 + KOH │ │ │ │ OH OH OH OH |
|
Алкадиены горят – до углекислого газа и воды. С4Н6 + 5,5О2 🡪 4СО2 + 3Н2О |
ПОЛУЧЕНИЕ АЛКАДИЕНОВ.
|
1. Каталитическое дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах: Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен: |
|
2. Синтез Лебедева: (катализатор – смесь оксидов Al2O3,MgO,ZnO 2 C2H5OH –( Al2O3,MgO,ZnO, 450˚C)🡪 CH2=CH-CH=CH2 + 2H2O + H2 |
|
3. Дегидратация двухатомных спиртов: |
|
4. Действие спиртового раствора щелочи на дигалогеналканы (дегидрогалогенирование): |
Вы попросили — мы сделали! Скорее изучай новые шпаргалки по диенам, здесь мы собрали самую важную информацию для подготовки к ЕГЭ по химии, а именно:
- Строение и классификация диенов;
- Способы получения диенов;
- Типа изомерии;
- Химические свойства диенов.
Не забудь просмотреть реакцию Лебедева — по статистике её постоянно забывают при решении 33-его задания
🔹 ОБЩИЕ СВЕДЕНИЯ
АлкаДИены — непредельные углеводороды с общей формулой CnH2n-2 (являются межклассовыми изомерами алкинов).
В молекуле алкадиена есть 2 двойные связи (отсюда и название).
Атом углерода при двойной связи находится в состоянии sp²-гибридизации, образует 3 σ-связи и 1 𝜋-связь (кроме кумулированных).
⠀
Для алкадиенов характерна структурная и пространственная изомерия, правила игры такие же, как в алкенах! 🤪
⠀
Алкадиены бывают разные:
🔸 Кумулированные (двойные связи примыкают друг к другу)
СH₂=C=СH₂ («центральный» углерод находится в состоянии sp-гибридизации).
Соединения такого типа неустойчивы и в ЕГЭ не встречаются;
⠀
🔸 Сопряжённые (двойные связи разделены одной одинарной)
СH₂=СH-СH=СH₂
⠀
🔸 Изолированные (двойные связи разделены более чем одной одинарной связью)
СH₂=СH-СH₂-СH=СH₂
Эти соединения обладают теми же свойствами, что и алкены.
⠀
🔹 НОМЕНКЛАТУРА
Для обозначения наличия двойных связей к суффиксу добавляется частица «ди»:
бутадиен-1,3 или пентадиен-1,4.
⠀
Стоит запомнить тривиальные названия некоторых диенов:
пропадиен — аллен
бутадиен-1,3 — дивинил
2-метилбутадиен-1,3 — изопрен
⠀
🔹 ФИЗИЧЕСКИЕ СВОЙСТВА
дивинил — газ
изопрен — жидкость
Большего знать не требуется!
⠀
🔹 СПОСОБЫ ПОЛУЧЕНИЯ
1️⃣ Дегидрирование алканов
Условие: t°C, Cr₂O₃
СH₃-СH₂-СH₂-СH₃ → СH₂=СH-СH=СH₂ + 2H₂ ( t°C, Cr₂O₃)
⠀
2️⃣ Реакция Лебедева (дегидрирование и дегидратация этанола )
Условие: t°C, ZnO и Al₂O₃
2СH₃-СH₂-OH → СH₂=СH-СH=СH₂ + H₂ + 2H₂O (t°C, ZnO, Al₂O₃)
⠀
3️⃣ Дегидрогалогенирование дигалогеналканов спиртовым раствором щёлочи
Условие: t°C
Сl-CH₂-CH₂-CH₂-CH₂-Cl + 2KOH (спирт. р-р) → СH₂=СH-СH=СH₂ + 2KCl + 2H₂O (t°C)
⠀
🔹 ПРИМЕНЕНИЕ
Бутадиен и изопрен — источники для получения каучуков (синтетического и натурального).
Каучуки служат для изготовления резиновых изделий (например, автомобильных шин) 🚗






Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Алкадиены
(диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов С
n
H
2n
-2
.
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах:
1)
изолированные
двойные связи разделены в цепи двумя или более s-связями:
СН
2
=СН–СН
2
–СН=СН
2
(разделенные
sp
3
-атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах);
2)
кумулированные
двойные связи расположены у одного атома углерода:
СН
2
=С=СН
2
(подобные диены (аллены) менее стабильны, чем другие диены и при нагревании в щелочной среде перегруппировываются в алкины);
3)
сопряженные
двойные связи разделены одной s-связью:
СН
2
=СН–СН=СН
2
.
Сопряженные диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех
sp
2
-атомов углерода. Все атомы углерода лежат в одной плоскости, образуя s-скелет. Негибридизованные р-орбитали каждого атома углерода перпендикулярны плоскости s-скелета и параллельны друг другу, взаимно перекрываются, образуя единое p-электронное облако. Такой особый вид взаимного влияния атомов называется сопряжением.
Перекрывание р-орбиталей
молекулы бутадиена
имеет место не только между С
1
– С
2
, С
3
– С
4
, но и между С
2
– С
3
. В связи с этим применяют термин: «сопряженная система». Следствием делокализации электронной плотности является то, что длины связей С
1
– С
2
(С
3
– С
4
) увеличены, по сравнению с длиной двойной связи в этилене (0,132 нм) и составляют 0,137 нм; в свою очередь, длина связи С
3
– С
4
меньше, чем в этане С – С (0,154 нм) и составляет 0,146 нм. Диены с сопряженной системой двойных связей более энергетически выгодны.
Номенклатура алкадиенов
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода) с добавлением окончания –
диен
.
Виды изомерии алкадиенов:
Структурная изомерия:
1) изомерия положения сопряженных двойных связей;
2) изомерия углеродного скелета;
3) межклассовая (изомерны алкинам)
Пространственная изомерия
— диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию.
Способы получения алкадиенов


Химические свойства алкадиенов


Для сопряженных диенов характерны реакции присоединения (реакции 1, 2). Наличие сопряженной системы p-электронов приводит к особенностям реакций присоединения. Сопряженные диены способны присоединять не только по двойным связям (С
1
и С
2
, С
3
и С
4
), но и к концевым (С
1
и С
4
) атомам углерода сообразованием двойной связи между С
2
и С
3
. Соотношение продуктов 1,2- и 1,4-присоединения зависит от температуры, при которой проводился эксперимент и от полярности применяемого растворителя.
Восстановление (реакция 3) с помощью [Na + C
2
H
5
OH] называется восстановлением водородом в момент выделения (при взаимодействии натрия и спирта выделяется водород). Алкены в таких условиях не восстанавливаются, это отличительное свойство сопряженных диенов.
Полимеризация (реакция 4) важнейшее свойство сопряженных диенов, которая происходит под действием различных катализаторов (AlCl
3
, TiCl
4
+(C
2
H
5
)
3
Al) или света. В случае применения определенных катализаторов можно получить продукт полимеризации с определенной конфигурацией цепей.
Цис-конфигурацию имеет натуральный каучук. Макромолекулы натурального каучука имеют спиралевидную структуру цепи из-за того, что изопреновые звенья изогнуты, что создает пространственные препятствия упорядоченному расположению цепей. В каучуке длинные молекулы скручены в спутаны друг с другом в спирали. При растяжении каучука спирали растягиваются, а при снятии напряжения они снова скручиваются. В природе существует еще другой полимер изопрена гуттаперча (транс-конфигурация). Гуттаперча обладает стержнеобразной структурой цепи из-за выпрямленности изопреновых звеньев (цепи с транс-конфигурацией двойных связей могут располагаться одна вдоль другой), поэтому гуттаперча твердый, но хрупкий полимер. Натуральный каучук имеют немногие страны и поэтому его заменяют синтетическими каучуками из дивинила, а также из изопрена.
Для практического использования каучуки превращают в резину.
Резина – это вулканизованный каучук с наполнителем (сажа). Суть процесса вулканизации заключается в том, что нагревание смеси каучука и серы приводит к образованию трехмерной сетчатой структуры из линейных макромолекул каучука, придавая ему повышенную прочность. Атомы серы присоединяются по двойным связям макромолекул и образуют между ними сшивающие дисульфидные мостики.
Сетчатый полимер более прочен и проявляет повышенную упругость – высокоэластичность (способность к высоким обратимым деформациям).
В зависимости от количества сшивающего агента (серы) можно получать сетки с различной частотой сшивки. Предельно сшитый натуральный каучук – эбонит – не обладает эластичностью и представляет собой твердый материал.

























