Дисперсные системы
Материал по химии
Оглавление
- Дисперсные системы на ЕГЭ
- Что такое дисперсная система?
- Классификация дисперсных систем по дисперсности
- Классификация дисперсных систем по агрегатному состоянию
- Коллоиды и кристаллоиды. Истинные и коллоидные растворы
- Классификация коллоидных систем
Дисперсные системы на ЕГЭ
В кодификаторе, предложенном ФИПИ для 2022 года по химии, в разделе «Химия и жизнь» (пункт 4.1.2) появились следующие темы:
- Дисперсные системы
- Понятие о коллоидах (золи и гели)
- Истинные растворы
В каких заданиях появятся данные понятия пока неизвестно, возможно, это будут задания линии 25.
Что такое дисперсная система?
Дисперсные системы – это измельченные тела одного вещества, равномерно распределенные в сплошной массе другого вещества. Другими словами – это смеси мельчайших частиц, не взаимодействующих друг с другом химически, но имеющие отличные от отдельно взятых чистых веществ, из которых состоит данная система, физические свойства.
Дисперсные системы состоят из двух основных структур:
Дисперсная фаза – частицы, равномерно распределенные в какой-либо среде.
Дисперсионная среда – вещество, в котором растворяют (размешивают) дисперсную фазу.
К дисперсным системам относят большое количество биологических объектов: почву, кровь, цитоплазму, яичный белок и т. д.
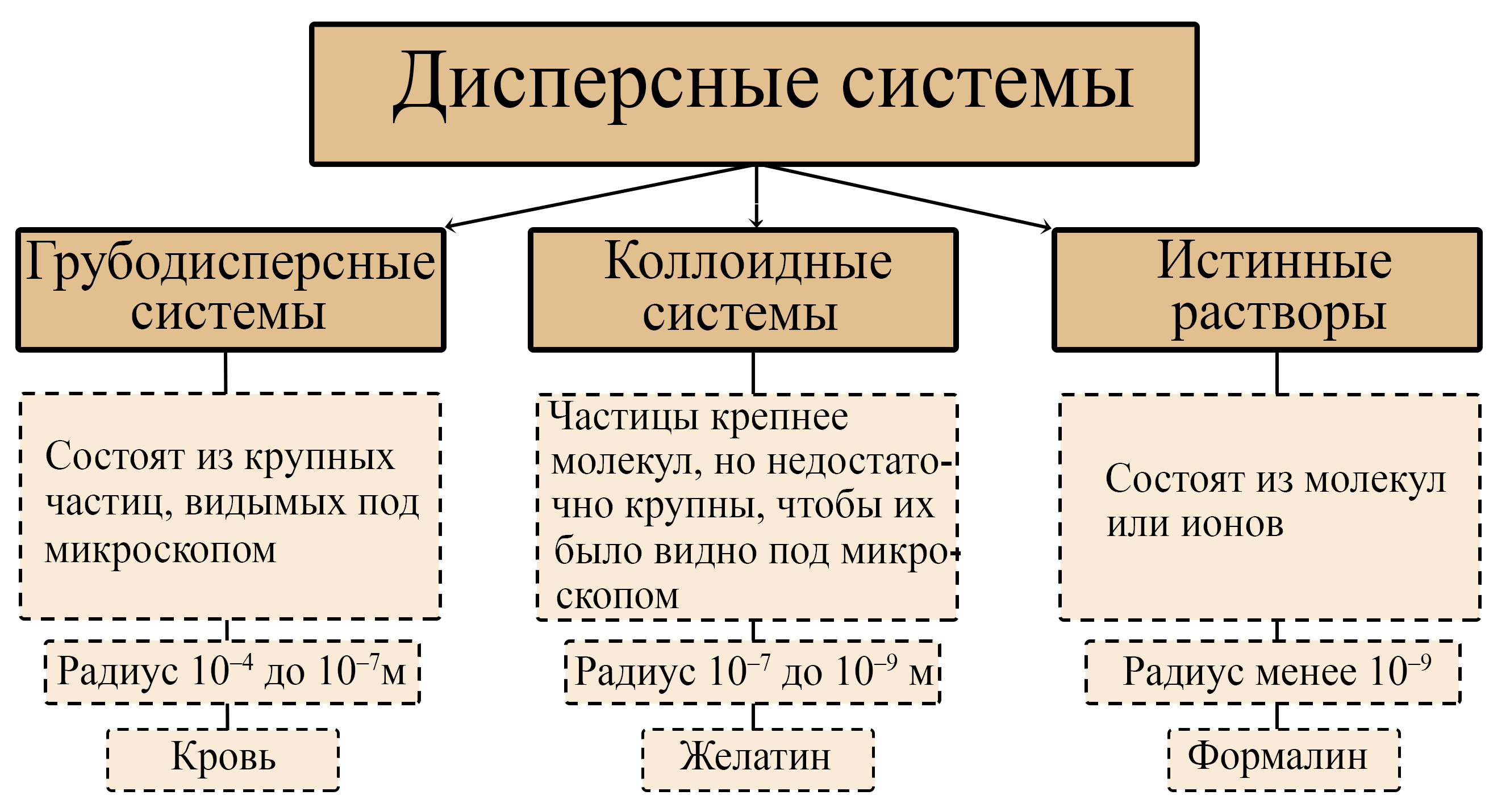
Классификация дисперсных систем по дисперсности (размеру частиц)
- Грубодисперсные системы содержат относительно крупные частицы радиусом от 10‒4 до 10‒7м, то есть самые крупные частицы этой системы достигают радиуса 0,1мм.
- Коллоидно-дисперсные системы (золи) содержат частицы с радиусами от 10‒7 до 10‒9 м, то есть самые крупные частицы этих систем достигают радиуса 0,0001мм.
- Молекулярные и ионные растворы (истинные растворы) содержат частицы с радиусом менее 10‒9 м или 0,000001 мм.
Классификация дисперсных систем по размеру частиц
Отличия грубодисперсных и коллоидных систем от истинных растворов
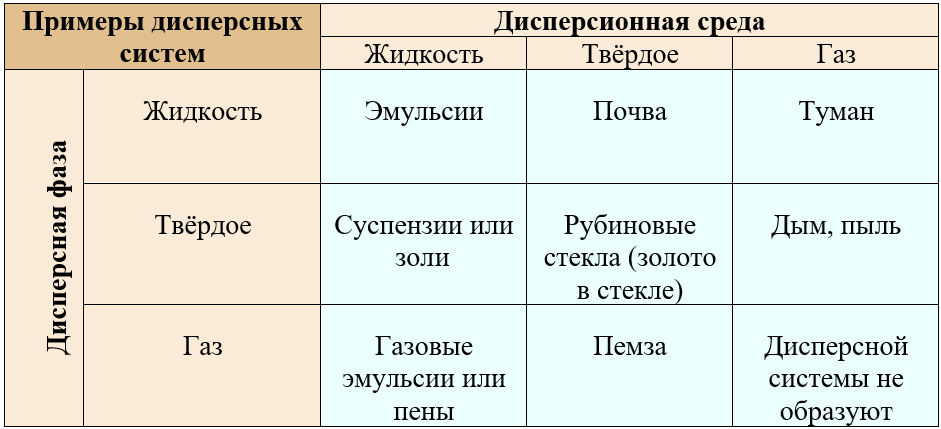
Классификация дисперсных систем по агрегатному состоянию
Классификация дисперсных систем по агрегатному состоянию
Таблица с примерами дисперсных систем в разных агрегатных состояниях
- Две или более жидкости, не смешивающиеся между собой, образуют эмульсии. При их отстаивании жидкости отслаиваются и распределяются в сосуде по плотности: более плотная жидкость опускается вниз, менее плотная жидкость поднимается наверх. В этом случае дисперсную систему восстанавливают повторным размешиванием. К эмульсиям относят масла, диспергированные в воде, например, молочные жиры в молоке, основу которого составляет вода; яичный белок, сырую нефть. Жировые эмульсии используются в медицине для инфузий (капельниц). Эмульсии широко распространены в косметологии, к ним относятся кремы. Для того чтобы компоненты эмульсии не расслаивались, используют эмульгаторы.
- Жидкость, диспергированная в газовой среде, образует туман. Примером может служит туман как погодное явление и туман, образующийся при растворении серного ангидрида или серной кислоты в воде. Этот туман обладает высокой окислительной способностью, вызывает коррозию, сжигает слизистые, поэтому данный метод получения раствора серной кислоты неприемлем. Вместо серного ангидрида используют олеум – раствор ангидрида в концентрированной серной кислоте, который растворяют не в воде, а в растворах серной кислоты, получая более концентрированные растворы. Из них, в свою очередь, можно получить раствор заданной концентрации, добавив серную кислоту в воду небольшими порциями. К системе жидкость/газ также можно отнести облака.
- Жидкость, диспергированная в твёрдом пористом веществе, образует множество природных дисперсных систем, таких как почва.
- Если мельчайшие частицы твердого вещества распределены в газовой среде, то образуется аэрозоль. Их широко применяют в быту: в форме аэрозолей выпускают дезодоранты, освежители воздуха, лекарственные средства для ингаляций.
- Если частицы твердого вещества диспергированы в жидкости, то образованная система называется суспензией, если частицы крупные или коллоидным раствором (золем), если радиус твёрды частиц не превышает 10‒7 м.
- Существуют дисперсные системы, состоящие из нескольких твёрдых веществ, например, в сырые пластмассы добавляют порошкообразные красители, пластмасса застывает и тоже становится твёрдой.
- При пропускании газа через раствор или при встряхивании раствора в резервуаре, содержащем газ (например, воздух), молекулы раствора обволакивают пузырьки газа тонким слоем, образуя пены. К таким системам относят пены моющих (поверхностно-активных) средств.
Газовая эмульсия отличается от пены тем, что в ней количество газовых частиц (дисперсной фазы) значительно меньше, чем частиц жидкости, образующих дисперсионную среду. В пене количество газовых частиц достигает 90% из-за чего пены имеют ячеистую очень рыхлую структуру.
- Газы имеют способность растворяться в твёрдых веществах. Например, водород проникает между узлами металлической решетки металлов, например, свинца. Также газы хорошо проникают между частицами силикагеля и активированного угля.
- Два газа не образуют дисперсной системы, так как при их смешивании они самопроизвольно распределяются между молекулами друг друга, и главного условия существования дисперсной системы — границы раздела фаз не наблюдается.
Коллоиды и кристаллоиды. Истинные и коллоидные растворы
Особое место в природе занимают коллоидные системы. Еще в середине XIX века шотландский ученый Томас Грэм обнаружил, что некоторые вещества, обычно не растворимые в воде, при определенных условиях могут образовывать с ней однородные смеси, отличающиеся от обычных растворов. Так, обычные растворы проходят через фильтр из растительного пергамента полностью и в дальнейшем способны кристаллизоваться, а смеси из нерастворимых веществ и воды не проходят через поры такого фильтра и не способны кристаллизоваться.
Растворы, проходящие через фильтр и способные кристаллизоваться, он назвал кристаллоидами, их принято называть истинными растворами. Смеси, не проходящие через фильтр – коллоидами, по названию клея (по греч. – «колла») или коллоидными растворами (золями). Данная классификация является простой, но устаревшей.
В истинных растворах присутствуют отдельные ионы и молекулы, тогда как в коллоидных растворах присутствуют более крупные частицы.
Классификация растворов на коллоиды и кристаллоиды
Таблица с примерами дисперсных систем в разных агрегатных состояниях
Классификация коллоидных систем
Коллоидные системы могут быть не только жидкими (молоко, горячий раствор желатина), но и твёрдыми (яшма и многие другие окрашенные минералы), и газообразными (дым, туман).
Если дисперсионной средой выступает вода, то коллоид называется гидрозолем, если спирт – алкозоли, если бензол – бензозоли и т. д.
Если дисперсионной средой выступает газ, то коллоид называется аэрозолем.
Кроме того, существуют особые коллоиды, занимающие промежуточное состояние между жидкими и твердыми, их называют гелями. Гель образуется, например, при застывании раствора желатина при охлаждении. К гелям относят осадок кремниевой кислоты, желе, кисель.
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) нитрит натрия
2) гидроксид рубидия
3) дихромат калия
4) нитрат хрома(III)
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
2
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) нитрит натрия
2) гидроксид рубидия
3) дихромат калия
4) нитрат хрома(III)
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
3
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) нитрат бария
2) карбонат натрия
3) серная кислота
4) сульфат железа(III)
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
4
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) сульфат калия
2) сульфат алюминия
3) гидроксид лития
4) гидроксид аммония
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
5
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) иодид бария
2) нитрат железа(III)
3) карбонат калия
4) уксусная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Пройти тестирование по этим заданиям
…
Здесь Вы найдете задач по теме Дисперсные системы и Коллоидные растворы. Это задачи на строение коллоидных частиц (составление формулы мицеллы золя) и коагуляция золей.
Задача 1. Какой объем 0,001 н. раствора BaCl2 надо добавить к 0,03 л 0,001 н. раствора K2CrO4, чтобы получить положительно заряженные частицы золя BaCrO4? Составьте формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат калия или фосфат калия. Поясните выбор.
Показать решение »
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
BaCl2 + K2CrO4 = BaCrO4↓ + 2KCl
Найдем необходимый объем BaCl2 при условии, что вещества участвуют в реакции в стехиометрическом соотношении, используя «золотое правило аналитики»:
CK2CrO4·VK2CrO4 = CBaCl2·VBaCl2
Подставим в выражение известные значения:
0,001·0,03 = 0,001·VBaCl2, откуда
VBaCl2 = 0,03 л.
На поверхности образовавшегося золя адсорбируются ионы, входящие в его состав и находящиеся в растворе в избытке.
Чтобы получить «+» заряженные частицы золя BaCrO4, на его поверхности должны адсорбироваться ионы Ba2+. Таким образом, в растворе должен быть избыток BaCl2 по сравнению с K2CrO4, т.е. к 0,03 л 0,001 н. раствора K2CrO4 необходимо добавить более 0,03 л. 0,001 н. раствора BaCl2.
Т.к. частицы золя заряжены положительно, то к ним будут притягиваться отрицательно заряженные ионы Cl—.
Формула мицеллы золя будет выглядеть следующим образом:
[(BaCrO4)m·nBa2+, 2(n-x)Cl—]2x+·2xCl—
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат калия или фосфат калия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
K+Cl—, K2+SO42-, K3+PO43-
Допустим, что коагуляцию золя вызывают катионы, тогда все приведенные соединения обладают одинаковым коагулирующим действием.
Если же коагуляция золя вызвана анионами, то более сильным коагулирующим действием будет обладать фосфат калия K3PO4, т.к. фосфат-ион имеет наибольший заряд.
Задача 2. Золь Al(OH)3 получен при добавлении к 0,005 л 0,001 н. раствора AlCl3 0,002 л 0,0015 н. раствора NaOH. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрат калия, сульфат магния или фосфат калия. Поясните выбор.
Показать решение »
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
AlCl3+ NaOH = Al(OH)3↓ + 3NaCl
Определим количества участвующих в реакции веществ:
Сн=n/V
n(AlCl3)= Сн·V = 0,001·0,005 = 5·10-6 моль
n(NaOH)= Сн·V = 0,0015·0,002 = 3·10-6 моль
Следовательно, в избытке AlCl3, значит, ядром коллоидных частиц будут адсорбироваться Al3+ и частицы золя приобретут положительный заряд. Противоионами будут служить ионы Cl—.
Формула мицеллы золя будет выглядеть следующим образом:
[(Al(OH)3)m·nAl3+, 3(n-x)Cl—]3x+·3xCl—
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрат калия, сульфат магния или фосфат калия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
K+NO3—, Mg2+SO42-, K3+PO43-
Допустим, что коагуляцию золя вызывают катионы, тогда наиболее сильным коагулирующим действием будет обладать сульфат магия MgSO4, т.к заряд иона магния имеет наибольшее значение.
Если же коагуляция золя вызвана анионами, то более сильным коагулирующим действием будет обладать фосфат калия K3PO4, т.к. фосфат-ион имеет наибольший заряд.
Задача 3. Какой объем 0,0025 н. раствора KI надо добавить к 0,035 л 0,003 н. раствора Pb(NO3)2, чтобы получить золь PbI2, противоионы которого двигались бы в электрическом поле к аноду? Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид натрия, сульфат натрия или фосфат калия. Поясните выбор.
Показать решение »
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
2KI + Pb(NO3)2 = PbI2↓+ 2KNO3
При образовании золя PbI2, на его поверхности адсорбируются потенциалопределяющие ионы, входящие в его состав и находящиеся в растворе в избытке.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата.
По условию задачи, противоионы движутся к аноду, значит, они заряжены отрицательно, а потенциалопределяющие ионы будут заряжены положительно. В нашем примере, в качестве потенциалопределяющих ионов будут выступать ионы свинца. В результате, (PbI2)m с адсорбированным слоем Pb2+ приобретает положительный заряд. Противоионами служат нитрат-ионы NO3–.
Таким образом, в растворе должен быть избыток Pb(NO3)2.
Применяя «золотое правило аналитики», найдем объем KI:
CKI ·VKI = CPb(NO3)2·VPb(NO3)2
Подставим в выражение известные значения:
0,0025·VKI = 0,003·0,035, откуда
VKI = 0,042 л.
Следовательно, чтобы достичь избытка Pb(NO3)2, объем VKI должен быть менее 0,042 л.
Формула мицеллы золя будет выглядеть следующим образом:
[(PbI2)m·nPb2+, 2(n-x)NO3—]2x+·2xNO3—
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид натрия, сульфат натрия или фосфат калия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
Na+Cl—, Na2+SO42-, K3+PO43-
Допустим, что коагуляцию золя вызывают катионы, тогда все приведенные соединения обладают одинаковым коагулирующим действием, т.к. все катионы имеют положительный заряд.
Если же коагуляция золя вызвана анионами, то более сильным коагулирующим действием будет обладать фосфат калия K3PO4, т.к. фосфат-ион имеет наибольший заряд.
Задача 4. Золь Mg3(РО4)2 получен при добавлении к 0,015 л 0,002 н. раствора Na3PO4 0,005 л 0,004 н. раствора MgCl2. Укажите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат меди или нитрат алюминия. Поясните выбор.
Показать решение »
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
3MgCl2+ 2Na3PO4 = Mg3(PO4)2↓ + 6NaCl
Определим количества участвующих в реакции веществ:
Сн=n/V
n(Na3PO4)= Сн·V = 0,002·0,015 = 0,00003 моль
n(MgCl2)= Сн·V = 0,004·0,005 = 0,00002 моль
Как видно из расчетов, в избытке Na3PO4, значит, в качестве потенциалопределяющих ионы, т.е. ионов, входящие в его состав и находящиеся в растворе в избытке, выступают PO43-.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата – Na+
Формула мицеллы золя будет выглядеть следующим образом:
[(Mg3(PO4)2)m·nPO43-, 3(n-x)Na+]3x-·3xNa+
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат меди или нитрат алюминия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
K+Cl—, Cu2+SO42-, Al3+(NO3)3—
Допустим, что коагуляцию золя вызывают катионы, тогда наибольшим коагулирующим действием обладает нитрат алюминия Al(NO3)3, т.к. ион Al3+ имеет наибольший заряд.
Если же коагуляция золя вызвана анионами, то более сильным коагулирующим действием будет обладать сульфат меди CuSO4, т.к. сульфат-ион имеет наибольший заряд.
Задача 5. Золь Zn(OH)2 получен при взаимодействии растворов КОН и ZnCl2. Составьте формулу мицеллы золя, если противоионы движутся в электрическом поле к катоду. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: ацетат калия, сульфат никеля или сульфат хрома. Поясните выбор.
Показать решение »
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
2KOH + ZnCl2 = Zn(OH)2↓+ 2KCl
При образовании золя Zn(OH)2, на его поверхности адсорбируются потенциалопределяющие ионы, входящие в его состав и находящиеся в растворе в избытке.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата.
По условию задачи, противоионы движутся к катоду, значит, они заряжены положительно, а потенциалопределяющие ионы будут заряжены отрицательно.
В нашем примере, в качестве потенциалопределяющих ионов будут выступать гидроксид-ионы. В результате, (Zn(OH)2)m с адсорбированным слоем OH— приобретает отрицательный заряд.
Противоионами служат ионы K+.
Формула мицеллы золя будет выглядеть следующим образом:
[(Zn(OH)2)m·nOH—, (n-x)K+]x-·xK+
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: ацетат калия, сульфат никеля или сульфат хрома. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
CH3COO—K+, Ni2+SO42-, Cr23+(SO4)3—
Допустим, что коагуляцию золя вызывают анионы, тогда наибольшим коагулирующим действием обладают сульфат никеля NiSO4 и сульфат хрома Cr2(SO4)3.
Если же коагуляция золя вызвана катионами, то более сильным коагулирующим действием будет обладать сульфат хрома Cr2(SO4)3, т.к. ион хрома имеет наибольший заряд.
Задача 6. Золь Ag2S получен при добавлении к 0,015 л 0,003 н. раствора Na2S 0,035л 0,0005 н. раствора AgNO3. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат цинка или фосфат калия. Поясните выбор.
Показать решение »
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
Na2S + 2AgNO3 = Ag2S↓ + 2NaNO3
Определим количества участвующих в реакции веществ:
Сн=n/V
n(Na2S)= Сн·V = 0,003·0,015 = 0,000045 моль
n(AgNO3)= Сн·V = 0,0005·0,035 = 0,0000175 моль
Как видно из расчетов, в избытке находится Na2S, значит, в качестве потенциалопределяющих ионы, т.е. ионов, входящие в его состав и находящиеся в растворе в избытке, выступают S2-.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой.
Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата – Na+
Формула мицеллы золя будет выглядеть следующим образом:
[(Ag2S)m·nS2-, 2(n-x)Na+]2x-·2xNa+
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат цинка или фосфат калия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. Коагулирующая способность иона тем больше, чем больше его заряд.
K+Cl—, Zn2+SO42-, K3+(PO4)3-
Допустим, что коагуляцию золя вызывают анионы, тогда наибольшим коагулирующим действием обладают фосфат калия K3PO4, т.к. фосфат-ион PO43- имеет наибольший заряд.
Если же коагуляция золя вызвана катионами, то более сильным коагулирующим действием будет обладать сульфат цинка ZnSO4, т.к. ион цинка Zn2+ имеет наибольший заряд.
Задача 7. Золь Fe(OH)3 получен смешиванием равных объемов 0,0001 н. раствора KOH и 0,00015 н. раствора FeCl3. Укажите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрат свинца, сульфат марганца или фосфат калия. Поясните выбор.
Показать решение »
Решение.
Запишем уравнение реакции, протекающей при сливании двух растворов:
3KOH + FeCl3 = Fe(OH)3↓+ 3KCl
По условию задачи объемы смешиваемых растворов равны, поэтому в избытке будет находиться вещество с наибольшей концентрацией, т.е. хлорид железа FeCl3.
Таким образом, в качестве потенциалопределяющих ионы, т.е. ионов, входящих в состав ядра и находящиеся в растворе в избытке, выступают Fe3+.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой.
Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата – Cl—.
Формула мицеллы золя будет выглядеть следующим образом:
[(Fe(OH)3)m·nFe3+, 3(n-x)Cl—]3x+·3xCl—
Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрат свинца, сульфат марганца или фосфат калия. Поясните выбор.
Коагуляцию золя вызывает тот из ионов добавляемого электролита, чей заряд противоположен заряду коллоидной частицы. По правилу Шульца-Гарди коагулирующая способность иона тем больше, чем больше его заряд.
Pb2+(NO3)2—, Мn2+SO42-, K3+(PO4)3-
Допустим, что коагуляцию золя вызывают анионы, тогда наибольшим коагулирующим действием обладают фосфат калия K3PO4, т.к. фосфат-ион PO43- имеет наибольший заряд.
Если же коагуляция золя вызвана катионами, то более сильным коагулирующим действием будут обладать нитрат свинца Pb(NO3)2и сульфат марганца МnSO4, т.к. ионы свинца Pb2+ и марганца Мn2+ имеют наибольший заряд, по сравнению с ионом K+
2 ноября 2021
В закладки
Обсудить
Жалоба
Дисперсные системы
Презентация по химии.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объёме другого.
Дисперсные системы состоят как минимум из двух компонентов
→ дисперсионной среды, которая играет роль растворителя и, следовательно, является непрерывной фазой;
→ дисперсной фазы, играющей роль растворённого вещества.
disp-s.ppt
disp-s.pdf
Автор: Зубкова Маргарита Михайловна.
Теория
| 1. | Чистые вещества и смеси | |
| 2. | Дисперсное состояние вещества | |
| 3. | Грубодисперсные системы | |
| 4. | Коллоидные системы |
Задания
| 1. |
Основные понятия
Сложность: |
1 |
| 2. |
Классификация дисперсных систем
Сложность: |
2 |
| 3. |
Вычисли массовую долю компонента смеси
Сложность: |
1 |
| 4. |
Гомогенные и гетерогенные смеси
Сложность: |
2 |
| 5. |
Вычисли массу компонентов смеси
Сложность: |
1 |
| 6. |
Смеси и способы их разделения
Сложность: |
2 |
| 7. |
Вычисли массу осадка
Сложность: |
2 |
| 8. |
Задача на смесь углеводородов
Сложность: |
2 |
| 9. |
Вычисли объём углекислого газа
Сложность: |
3 |
Тесты
| 1. |
Тренировка по теме Дисперсные системы (смеси)
Сложность: среднее |
12 |
Материалы для учителей
| 1. | Методическое описание |
- ЕГЭ по химии
Вопрос №21 ЕГЭ. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Подборка заданий на pH и гидролиз в новом формате ЕГЭ 2022 по химии.
→ скачать задания
→ Проверить ответы
Источник: vk.com/chem4you
Примеры заданий:
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) Гидросульфат натрия
2) Гидросульфид калия
3) Нитрат бария
4) Гидроксид лития
Запишите номера веществ в порядке убывания значения pH их водных растворов.
Вещества, приведенные в перечне, растворили в воде и получили растворы с одинаковой молярной (моль/л) концентрацией веществ. Определите характер среды полученных растворов.
1) SiCl4
2) Na3PO4 · 12H2O
3) KClO3
4) Ba3P2
Запишите номера веществ в порядке возрастания значения pH растворов, полученных при внесении данных веществ в воду.
Смотрите также:
Пример
5.1. Найдите
массу AlCl3,
необходимую для приготов-ления 2 л
(2·10-3
м3)
раствора с массовой долей хлорида
алюминия равной 12 %. Плотность раствора
1090 кг/м3.
Вычислите молярную концентрацию
эквивалента, молярную концентрацию,
моляльность и титр этого раствора.
Р е ш е н и е
1.
Определяем молярную массу и молярную
массу эквивалента AlCl3
М
(AlCl3)
= 133,34 г/моль, Э (AlCl3)
=
≈ 44,45 г/моль.
2.
Находим массу AlCl3,
необходимую для приготовления 2 л его
раствора с массовой долей 12 %. Массовая
доля ω показывает, сколько единиц массы
растворенного вещества содержится
в 100 единицах массы раствора.
Масса
раствора равна произведению объема
раствора (V)
на его плотность (ρ)
m
= 2·10-3
м3
· 1090 кг/м3
= 2,18 кг.
В
100 кг раствора содержится 12 кг AlCl3.
В
2,18 кг раствора
содержится х
кг AlCl3,
.
3.
Находим молярную концентрацию раствора.
Молярная концентрация раствора сМ
показывает количество растворенного
вещества, содержащегося в 1 л раствора.
В
2 л раствора содержится 261,6 г AlCl3.
В
1 л раствора содержится х
г AlCl3,
х
=
г.
Молярная концентрация
равна
с
(AlCl3)
= моль/л.
4. Находим молярную
концентрацию эквивалента. Молярная
концентрация эквивалента (нормальная
концентрация) раствора показывает число
молярных масс эквивалентов растворенного
вещества, содержащихся в 1 л раствора.
cэкв.(AlCl3)
=
.
5.
Находим моляльность раствора. Моляльность
раствора cm
(моль/кг) показывает количество
растворенного вещества, находя-щееся
в 1 кг растворителя.
Масса воды равна
2180 г – 261,6 г = 1918,4 г.
Количество
AlCl3
равно
.
В
1918,4 г Н2О
растворено 1,96 моль AlCl3.
В
1000 г Н2О
растворено х
моль AlCl3,
x
= cm
=
= 1,02 моль/кг.
6.
Находим титр раствора. Титр раствора
Т
показывает массу (г) растворенного
вещества, содержащегося в 1 мл раствора.
В 1 л раствора содержится 130,8 г AlCl3.
Т
=
= 0,1308 г/мл.
Пример
5.2. Напишите
уравнение электролитической диссо-циации
муравьиной кислоты и найдите концентрации
ионов Н+
и НСОО
в моль/л в растворе, молярность
которого равна 0,01, если константа
диссоциации Кдисс
= 1,8·10-4.
Р е ш е н и е
НСООН
Н+
+ НСОО.
Сион
= С
· α · n,
где С
– молярная концентрация электролита;
α – степень диссоциации; n
– число ионов данного вида.
Степень диссоциации
приближенно находим из выражения
упрощенного закона Оствальда
α
=
0,01·1,34·
10-1·1
= 1,34·10-3
моль/л.
Пример
5.3. Вычислите
водородный показатель (рН) раствора
соляной кислоты HCl,
содержащей 0,0365 г HCl
в 100 мл раствора (1) и раствора гидроксида
калия КОН, содержащего 0,056 г КОН в 100 мл
раствора (2), α = 1 для обоих растворов.
Р
е ш е н и е
1.
Находим концентрацию раствора НСl
в молях. Молярная масса НСl
равна 36,5 г/моль.
Находим
молярную концентрацию раствора НСl.
В
100 мл раствора содержится 0,001 моль НСl,
в
1000 мл раствора содержится х
моль НСl,
х
= 0,01 моль
Концентрация
HCl
(сHCl)
равна 0,01 моль/л.
Концентрация
Н+
– ионов равна 0,01 моль/л.
рН раствора
рассчитываем по формуле
рН
= –lg
c=
–lg
0,01 = –lg
10-2
= 2.
2.
Находим число молей КОН в 100 мл данного
раствора. Молярная масса КОН равна 56
г/моль.
Находим, сколько
молей КОН содержится в 1 л раствора.
В 100 мл
раствора содержится 0,001 моль КОН.
В
1000 мл раствора содержится х
моль КОН,
х
= 0,01 моль.
Концентрация
КОН (сКОН)
равна 0,01 моль/л.
Концентрация
ОН—
ионов равнасКОН
= 0,01 моль/л.
Концентрация
Н+
— ионов равна 10-14/сОН—
= 10-14/10-2
= 10-12
моль/л.
рН раствора
рассчитываем по формуле
рН
= –lg
c=
–lg
10-12
= 12.
Пример
5.4. Составьте
молекулярные и ионные уравнения гидролиза
солей: а) нитрата аммония NH4NO3;
б) сульфита лития Li2SO3;
в) ацетата алюминия Al(CH3COO)3;
напишите выражение для константы
гидролиза и оцените рН среды.
Р
е ш е н и е
а)
При растворении в воде соль NH4NO3
диссоциирует
NH4NO3
NH
+ NO.
Ионы
воды (Н+
и ОН)
в малодиссоциирующее соединение
связывает ионNH,
образуя молекулы слабого основания
NH4OH.
Ионное
уравнение гидролиза NH4NO3
NH
+ Н2O
NH4OH
+ H+.
где
– константа
диссоциации NH4OH.
Уравнение гидролиза
в молекулярной форме
NH4NO3
+ Н2О
NH4OH
+ HNO3.
Реакция
среды кислая, рН < 7.
б) Сульфит лития
при растворении в воде диссоциирует
Li2SO3
2Li+
+ SO.
Ионы
SO
связывают Н+
— ионы воды ступенчато, образуя кислые
ионы HSO
и молекулы слабой кислоты H2SO3.
Практически гидролиз соли ограничивается
первой ступенью
SO+ H2O
HSO+ OH
,
Li2SO3
+ H2O
LiHSO3
+ LiOH.
.
Реакция
раствора щелочная, рН > 7.
в) Соль ацетата
алюминия диссоциирует, образуя ионы
Al(CH3COO)3
Al3+
+ 3CH3COO.
Ионы
Al3+
и ион
СН3СООвзаимодействуют с ионами воды, образуя
малорастворимое соединениеAl(OH)3
и малодис-социирующее соединение
СН3СООН.
Соли, образованные при взаи-модействии
слабой кислоты и слабого основания,
гидролизуются необратимо
и полностью.
Al(CH3COO)3
+ 3H2O
= Al(OH)3+ 3CH3COOH.
.
рН
раствора Al(CH3COO)3
зависит от соотношения
и
.
Из табл.П. 6 следует, что<
,
следовательно, реакция среды кислая.
Пример
5.5. Образуется
ли осадок труднорастворимого соединения
CaSO4,
если смешать равные объемы растворов
Ca(NO3)2
и K2SO4
с молярной концентрацией 0,003 моль/л?