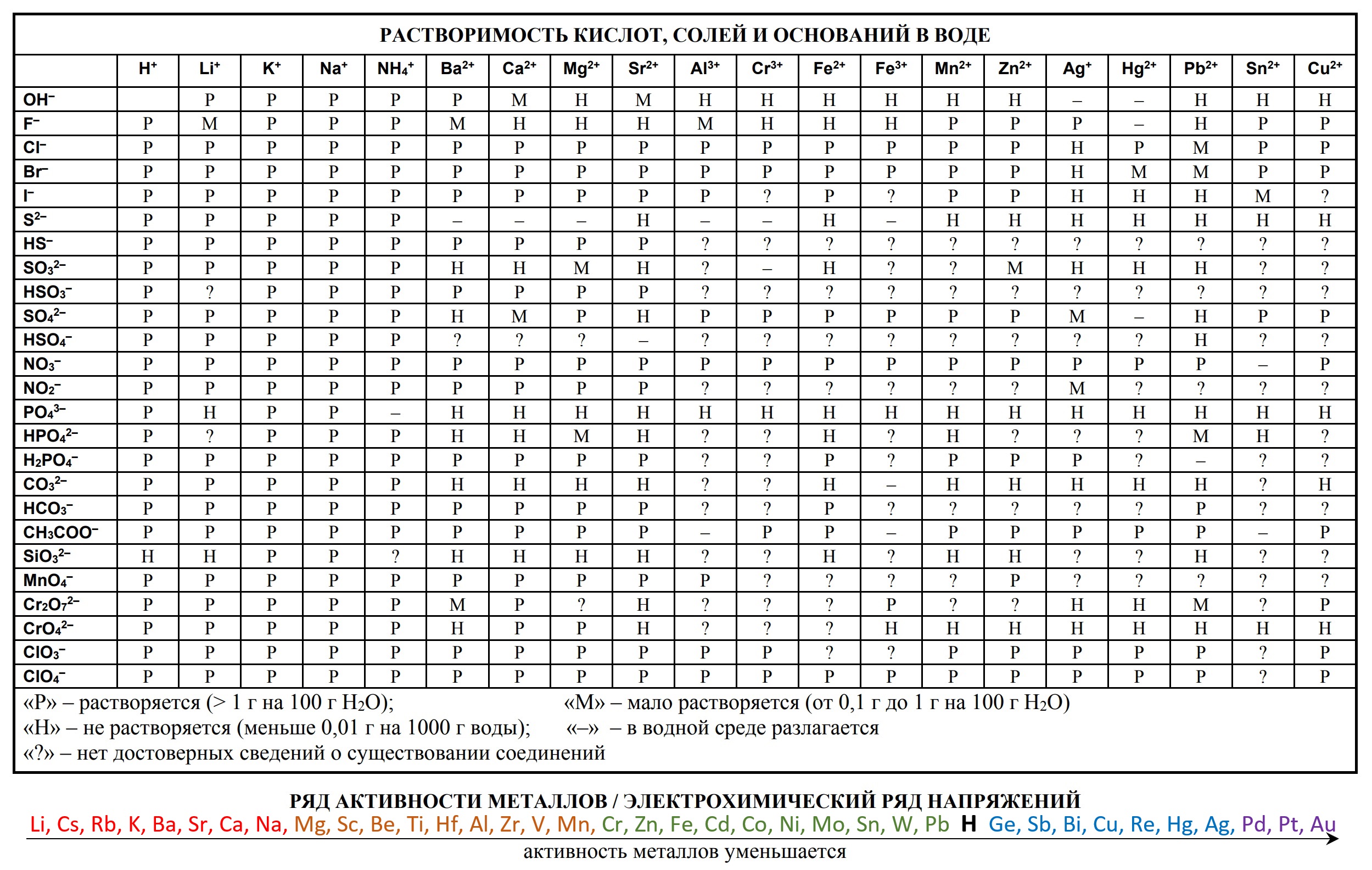
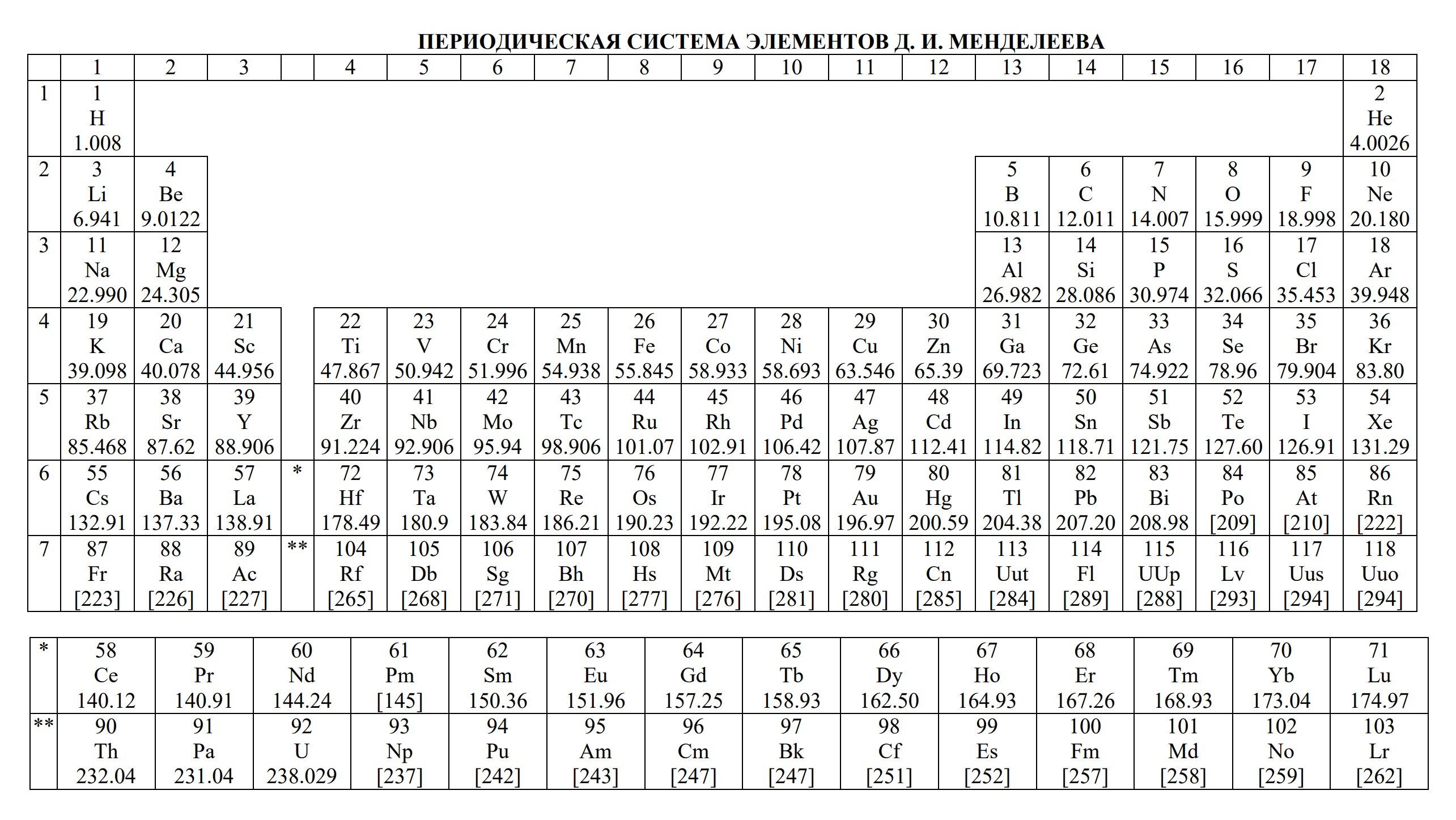
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Длиннопериодная периодическая таблица (система) химических элементов Д.И. Менделеева (ПСХЭ) — табличное отображение химических элементов, которые упорядочены по атомному номеру, электронной конфигурации и повторяющимся (периодическим) химическим свойствам. Данная таблица содержит 18 групп химических элементов.
Период ↓
2
He
Гелий
4,003
1s2
6
C
Углерод
12,011
[He]2s22p2
8
O
Кислород
15,999
[He]2s22p4
13
Al
Алюминий
26,982
[Ne]3s23p1
14
Si
Кремний
28,086
[Ne]3s23p2
15
P
Фосфор
30,974
[Ne]3s23p3
18
Ar
Аргон
39,948
[Ne]3s23p6
21
Sc
Скандий
44,956
[Ar]3d14s2
23
V
Ванадий
50,942
[Ar]3d34s2
25
Mn
Марганец
54,938
[Ar]3d54s2
26
Fe
Железо
55,847
[Ar]3d64s2
27
Co
Кобальт
58,933
[Ar]3d74s2
28
Ni
Никель
58,69
[Ar]3d84s2
29
Cu
Медь
63,546
[Ar]3d104s1
31
Ga
Галлий
69,72
[Ar]3d104s24p1
32
Ge
Германий
72,59
[Ar]3d104s24p2
33
As
Мышьяк
74,92
[Ar]3d104s24p3
34
Se
Селен
78,96
[Ar]3d104s24p4
35
Br
Бром
79,904
[Ar]3d104s24p5
36
Kr
Криптон
83,80
[Ar]3d104s24p6
39
Y
Иттрий
88,905
[Kr]4d15s2
40
Zr
Цирконий
91,22
[Kr]4d25s2
41
Nb
Ниобий
92,906
[Kr]4d45s1
42
Mo
Молибден
95,94
[Kr]4d55s1
43
Tc
Технеций
97,91
[Kr]4d55s2
44
Ru
Рутений
101,07
[Kr]4d75s1
45
Rh
Родий
102,905
[Kr]4d85s1
46
Pd
Палладий
106,4
[Kr]4d105s0
47
Ag
Серебро
107,868
[Kr]4d105s1
48
Cd
Кадмий
112,40
[Kr]4d105s2
49
In
Индий
114,82
[Kr]4d105s25p1
50
Sn
Олово
118,69
[Kr]4d105s25p2
51
Sb
Сурьма
121,75
[Kr]4d105s25p3
52
Te
Теллур
127,60
[Kr]4d105s25p4
53
I
Йод
126,904
[Kr]4d105s25p5
54
Xe
Ксенон
131,30
[Kr]4d105s25p6
57
La*
Лантан
138,906
[Xe]5d16s2
72
Hf
Гафний
178,49
[Xe]4f145d26s2
73
Ta
Тантал
180,948
[Xe]4f145d36s2
74
W
Вольфрам
183,85
[Xe]4f145d46s2
75
Re
Рений
186,207
[Xe]4f145d56s2
76
Os
Осмий
190,2
[Xe]4f145d66s2
77
Ir
Иридий
192,22
[Xe]4f145d76s2
78
Pt
Платина
195,08
[Xe]4f145d96s1
79
Au
Золото
196,967
[Xe]4f145d106s1
80
Hg
Ртуть
200,59
[Xe]4f145d106s2
81
Tl
Таллий
204,383
[Xe]4f145d106s26p1
82
Pb
Свинец
307,2
[Xe]4f145d106s26p2
83
Bi
Висмут
280,980
[Xe]4f145d106s26p3
84
Po
Полоний
208,982
[Xe]4f145d106s26p4
85
At
Астат
209,987
[Xe]4f145d106s26p5
86
Rn
Радон
222,018
[Xe]4f145d106s26p6
87
Fr
Франций
222,019
[Rn]7s1
89
Ac**
Актиний
227,028
[Rn]6d17s2
104
Rf
Резерфордий
[267]
[Rn]5f146d27s2
105
Db
Дубний
[268]
[Rn]5f146d37s2
106
Sg
Сиборгий
[269]
[Rn]5f146d47s2
107
Bh
Борий
[270]
[Rn]5f146d57s2
108
Hs
Хасий
[269]
[Rn]5f146d67s2
109
Mt
Мейтнерий
[278]
[Rn]5f146d77s2
110
Ds
Дармштадтий
[281]
[Rn]5f146d87s2
111
Rg
Рентгений
[282]
[Rn]5f146d97s2
112
Cn
Коперниций
[285]
[Rn]5f146d107s2
113
Nh
Нихоний
[286]
[Rn]5f146d107s27p1
114
Fl
Флеровий
[289]
[Rn]5f146d107s27p2
115
Mc
Московий
[290]
[Rn]5f146d107s27p3
116
Lv
Ливерморий
[293]
[Rn]5f146d107s27p4
117
Ts
Теннессин
[294]
[Rn]5f146d107s27p5
118
Og
Оганесон
[294]
[Rn]5f146d107s27p6
58
Ce
Церий
140,12
[Xe]4f25d06s2
59
Pr
Празеодим
140,908
[Xe]4f35d06s2
60
Nd
Неодим
144,24
[Xe]4f45d06s2
61
Pm
Прометий
144,913
[Xe]4f55d06s2
62
Sm
Самарий
150,36
[Xe]4f65d06s2
63
Eu
Европий
151,96
[Xe]4f75d06s2
64
Gd
Гадолиний
157,25
[Xe]4f75d16s2
65
Tb
Тербий
158,925
[Xe]4f95d06s2
66
Dy
Диспрозий
162,50
[Xe]4f105d06s2
67
Ho
Гольмий
164,930
[Xe]4f115d06s2
68
Er
Эрбий
167,26
[Xe]4f125d06s2
69
Tm
Тулий
168,934
[Xe]4f135d06s2
70
Yb
Иттербий
173,04
[Xe]4f145d06s2
71
Lu
Лютеций
174,967
[Xe]4f145d16s2
90
Th
Торий
232,038
[Rn]5f06d27s2
91
Pa
Протактиний
231,036
[Rn]5f26d17s2
92
U
Уран
238,030
[Rn]5f36d17s2
93
Np
Нептуний
237,049
[Rn]5f46d17s2
94
Pu
Плутоний
244,064
[Rn]5f56d17s2
95
Am
Америций
243,061
[Rn]5f76d07s2
96
Cm
Кюрий
247,070
[Rn]5f76d17s2
97
Bk
Берклий
247,070
[Rn]5f86d17s2
98
Cf
Калифорний
251,080
[Rn]5f106d07s2
99
Es
Эйнштейний
252,083
[Rn]5f116d07s2
100
Fm
Фермий
257,095
[Rn]5f126d07s2
101
Md
Менделевий
258,099
[Rn]5f136d07s2
102
No
Нобелий
[259]
[Rn]5f146d07s2
103
Lr
Лоуренсий
[266]
[Rn]5f146d17s2
Уважаемый посетитель!
Если у вас есть вопрос, предложение или жалоба, пожалуйста, заполните короткую форму и изложите суть обращения в текстовом поле ниже. Мы обязательно с ним ознакомимся и в 30-дневный срок ответим на указанный вами адрес электронной почты
Статус Абитуриент Студент Родитель Соискатель Сотрудник Другое
Филиал Абакан Актобе Алагир Алматы Алушта Анапа Ангарск Архангельск Армавир Асбест Астана Астрахань Атырау Баку Балхаш Барановичи Барнаул Белая Калитва Белгород Бельцы Берлин Бишкек Благовещенск Бобров Бобруйск Борисов Боровичи Бронницы Брянск Бузулук Чехов Челябинск Череповец Черкесск Дамаск Дербент Димитровград Дмитров Долгопрудный Домодедово Дубай Дубна Душанбе Екатеринбург Электросталь Елец Элиста Ереван Евпатория Гана Гомель Гродно Грозный Хабаровск Ханты-Мансийск Хива Худжанд Иркутск Истра Иваново Ижевск Калининград Карабулак Караганда Каракол Кашира Казань Кемерово Киев Кинешма Киров Кизляр Королев Кострома Красноармейск Краснодар Красногорск Красноярск Краснознаменск Курган Курск Кызыл Липецк Лобня Магадан Махачкала Майкоп Минеральные Воды Минск Могилев Москва Моздок Мозырь Мурманск Набережные Челны Нальчик Наро-Фоминск Нижневартовск Нижний Новгород Нижний Тагил Ногинск Норильск Новокузнецк Новосибирск Новоуральск Ноябрьск Обнинск Одинцово Омск Орехово-Зуево Орел Оренбург Ош Озёры Павлодар Пенза Пермь Петропавловск Подольск Полоцк Псков Пушкино Пятигорск Радужный Ростов-на-Дону Рязань Рыбинск Ржев Сальск Самара Самарканд Санкт-Петербург Саратов Сергиев Посад Серпухов Севастополь Северодвинск Щербинка Шымкент Слоним Смоленск Солигорск Солнечногорск Ставрополь Сургут Светлогорск Сыктывкар Сызрань Тамбов Ташкент Тбилиси Терек Тихорецк Тобольск Тольятти Томск Троицк Тула Тверь Тюмень Уфа Ухта Улан-Удэ Ульяновск Ургенч Усть-Каменогорск Вёшенская Видное Владимир Владивосток Волгодонск Волгоград Волжск Воркута Воронеж Якутск Ярославль Юдино Жлобин Жуковский Златоуст Зубова Поляна Звенигород
Тип обращения Вопрос Предложение Благодарность Жалоба
Тема обращения Поступление Трудоустройство Обучение Оплата Кадровый резерв Внеучебная деятельность Работа автоматических сервисов университета Другое
* Все поля обязательны для заполнения
Я даю согласие на обработку персональных данных, согласен на получение информационных рассылок от Университета «Синергия» и соглашаюсь c политикой конфиденциальности
Периодическая система химических элементов Д. И. Менделеева
| Период | Ряд | Группа | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||
| 1 | 1 | 1HВодород1,0079 | (H) | 2HeГелий4,0026 | |||||||
| 2 | 2 | 3LiЛитий6,941 | 4BeБериллий9,012 | 5BБор10,811 | 6CУглерод12,011 | 7NАзот14,007 | 8OКислород15,999 | 9FФтор18,998 | 10NeНеон20,18 | ||
| 3 | 3 | 11NaНатрий22,99 | 12MgМагний24,305 | 13AlАлюминий26,982 | 14SiКремний28,086 | 15PФосфор30,974 | 16SСера32,065 | 17ClХлор35,453 | 18ArАргон39,948 | ||
| 4 | 4 | 19KКалий39,098 | 20CaКальций40,078 | 21ScСкандий44,956 | 22TiТитан47,867 | 23VВанадий50,942 | 24CrХром51,996 | 25MnМарганец54,938 | 26FeЖелезо55,845 | 27CoКобальт58,933 | 28NiНикель58,693 |
| 5 | 29CuМедь63,546 | 30ZnЦинк65,409 | 31GaГаллий69,723 | 32GeГерманий72,64 | 33AsМышьяк74,992 | 34SeСелен78,96 | 35BrБром79,904 | 36KrКриптон83,798 | |||
| 5 | 6 | 37RbРубидий85,468 | 38SrСтронций87,62 | 39YИттрий88,906 | 40ZrЦирконий91,224 | 41NbНиобий92,906 | 42MoМолибден95,94 | 43TcТехнеций[98,906] | 44RuРутений101,07 | 45RhРодий102,906 | 46PdПалладий106,42 |
| 7 | 47AgСеребро107,868 | 48CdКадмий112,411 | 49InИндий114,818 | 50SnОлово118,71 | 51SbСурьма121,76 | 52TeТеллур127,60 | 53IИод126,904 | 54XeКсенон131,293 | |||
| 6 | 8 | 55CsЦезий132,905 | 56BaБарий137,327 | 57La*Лантан138,905 | 72HfГафний178,49 | 73TaТантал180,948 | 74WВольфрам183,84 | 75ReРений186,207 | 76OsОсмий190,23 | 77IrИридий192,217 | 78PtПлатина195,084 |
| 9 | 79AuЗолото196,967 | 80HgРтуть200,59 | 81TlТаллий204,383 | 82PbСвинец207,2 | 83BiВисмут208,98 | 84PoПолоний[208,98] | 85AtАстат[209,98] | 86RnРадон[222,02] | |||
| 7 | 10 | 87FrФранций[223,02] | 88RaРадий[226,03] | 89Ac**Актиний[227,03] | 104RfРезерфордий[261,1087] | 105DbДубний[262,1138] | 106SgСиборгий[263,1182] | 107BhБорий[262,1229] | 108HsХассий[265] | 109MtМейтнерий[266] | 110DsДармштадтий[269] |
| 11 | 111RgРентгений[272] | 112CnКоперниций[285] | 113UutУнунтрий[284] | 114FlФлеровий[289] | 115UupУнунпентий[288] | 116LvЛиверморий[293] | 117UusУнунсептий[295] | 118UuoУнуноктий[294] | |||
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие соединения с водородом | RH4 | RH3 | H2R | HR |
*Лантаноиды
| 58CeЦерий140,12 | 59PrПразеодим140,91 | 60NdНеодим144,24 | 61PmПрометий[146,9] | 62SmСамарий[150,36] | 63EuЕвропий151,96 | 64GdГадолиний157,25 | 65TbТербий158,93 | 66DyДиспрозий162,50 | 67HoГольмий164,93 | 68ErЭрбий167,26 | 69TmТулий168,93 | 70YbИттербий173,04 | 71LuЛютеций174,97 |
**Актиноиды
| 90ThТорий232,04 | 91PaПротактиний231,04 | 92UУран238,03 | 93NpНептуний[237,05] | 94PuПлутоний[244,06] | 95AmАмериций[243,06] | 96CmКюрий[247,07] | 97BkБерклий[247,07] | 98CfКалифорний[251,08] | 99EsЭйнштейний[252,08] | 100FmФермий[257,1] | 101MdМенделевий[258,1] | 102NoНобелий[259,1] | 103LrЛоуренсий[260,11] |
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году.
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Выше приведена «короткая» форма таблицы.
I. Повторение
Повторите следующие темы 8 класса:
- Классификация химических элементов
- ПСХЭ. Группы и периоды
- Строение атома. Состав атомных ядер. Изотопы. Химический элемент
- Строение электронных оболоческ атомов
- Распределение электронов по энергетическим уровням элементов третьего и четвертого периодов ПСХЭ
II.Состояние электрона в атоме
1. Основные положения
1. Электронное облако– это модель квантовой механики, описывающая движение электрона в атоме.
2. Орбиталь (s, p, d, f) – часть атомного пространства, в котором вероятность нахождения данного электрона наибольшая (~ 90%).
3.Энергетический уровень – это энергетический слой с определённым уровнем энергии находящихся на нём электронов.
Число энергетических уровне в атоме химического элемента равно номеру периода, в котором этот элемент расположен.
4.Максимально возможное число электронов на данном энергетическом уровне определяется по формуле:
N = 2n2 , где n – номер периода.
5. Состояние электрона в атоме описывается 5 квантовыми числами (n, l, ml, ms, s).
6. Движение электрона в атоме описывается 4 квантовыми числами:
a) n – главное квантовое число, определяет энергию электрона и размеры электронного облака (n = 1,..7)
б) l — орбитальное квантовое число, определяет форму орбитали (s, p, d, f) и принимает значения l = 0,..n-1.
Подуровень, характеризующийся значением
l=0 называется s- подуровнем,
l=1 называется p-подуровнем,
l=2 называется d-подуровнем,
l=3 называется f-подуровнем.
в) ml – магнитное квантовое число, определяет ориентацию орбиталей в пространстве и принимает значения ml = -l…0…+1.
г) ms – спиновое квантовое число, определяет направление вращения электрона вокруг своей оси и принимает только два значения +1/2 или-1/2.
7. Спин S – собственный момент импульса движения электрона. Это – внутреннее свойство электрона, которое не связано с движением в пространстве. Спин всех электронов равен 1/2.
|
Главное квантовое число (n) |
Орбитальное квантовое число (l) |
Название подуровня (орбитали) |
Значение магнитного квантового числа |
Число орбиталей, составляющих подуровень |
|
1 |
0 |
s |
0 |
1 |
|
2 |
0 1 |
s p |
0 -1,0,+1 |
1 3 |
|
3 |
0 1 2 |
s p d |
0 -1,0,+1 -2,-1,0,+1,+2 |
1 3 5 |
|
4 |
0 1 2 3 |
s p d f |
0 -1,0,+1 -2,-1,0,+1,+2 -3,-2,-1,0,+1,+2,+3 |
1 3 5 7 |
8. Согласно принципу Паули: в атоме не может быть двух электронов с одинаковым набором всех четырёх квантовых чисел.
III. Структура периодической системы
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной.
Короткая форма периодической системы элементов — один из способов изображения периодической системы химических элементов, восходящий к первоначальной версии таблицы Д. И. Менделеева. Короткая форма таблицы Менделеева основана на параллелизме степеней окисления элементов главных и побочных подгрупп: например, максимальная степень окисления ванадия равна +5, как у фосфора и мышьяка, максимальная степень окисления хрома равна +6, как у серы и селена, и т. д. В таком виде таблица была опубликована Менделеевым в 1871 году. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Водород иногда помещают в 7-ю («короткая» форма) или 17-ю («длинная» форма) группу таблицы.
Ниже приведён длинный вариант (длиннопериодная форма), утверждённый Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного.
Короткая форма таблицы, содержащая восемь групп элементов, была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткая форма продолжает приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают в том числе с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной (международной) информации.
В 1970 году Теодор Сиборг предложил расширенную периодическую таблицу элементов. Нильсом Бором разрабатывалась лестничная (пирамидальная) форма периодической системы. Существует и множество других, редко или вовсе не используемых, но весьма оригинальных, способов графического отображения Периодического закона. Сегодня существуют несколько сотен вариантов таблицы, при этом учёные предлагают всё новые варианты.
Таблица Менделеева
IV. Задания для закрепления
Каким набором квантовых чисел описывается движение 4 электрона в атоме бора; последнего электрона в атоме хлора; 25 электрона в атоме меди.
V. Тест
1. Чему равен заряд ядра атома натрия?
1) 0; 2) +11; 3) +1; 4) +23.
2. Сколько электронов в атоме азота?
1) 0; 2) 1; 3) 7; 4) 14.
3. Сколько нейтронов в атоме углерода 12 6C?
1) 0; 2) 12; 3) 6; 4) 7.
4. Что общего в атомах 14 7N и 14 6C?
1) массовое число; 2) число протонов; 3) число нейтронов; 4) заряд ядра.
5. Укажите атом, в котором больше всего электронов:
1) 1H; 2) 40Ar; 3) 41Ar; 4) 39K.
6. Сколько электронов содержится в молекуле CO2?
1) 6; 2) 12; 3) 8; 4) 22.
7. Сколько протонов и электронов содержит ион CO32-?
1) 30p,30e; 2)30p,28e; 3)28p,30e; 4)30p,32e.
8. Природный кремний состоит из трёх изотопов: 28Si (молярная доля 92,3%), 29Si (4,7%), какой ещё изотоп входит в состав кремния, если атомная масса кремния 28,1.
1) 27; 2) 31; 3) 32; 4) 30.
9. Набор квантовых чисел (n, l, ml, ms) последнего электрона в атоме кислорода:
1) 2, 0, -1, -1/2; 2) 2, 1, +1, -1/2; 3) 2, 1, -1, -1/2; 4) 2, 1, 0, -1/2.
10. Сумма значений n+l максимальна для орбиталей:
1) 5s; 2) 4p; 3) 3d; 4) 6s.
11. На внешнем энергоуровне элементов главных подгрупп число
электронов :
1) равно 2; 2) равно номеру периода; 3) равно номеру группы; 4) равно 1.
12. Элементу 2-го периода до завершения внешнего уровня не хватает 3 электронов. Это элемент-…
1) бор; 2) углерод; 3) азот; 4) фосфор.
13. Элемент проявляет в соединениях максимальную степень окисления +7. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 3d7; 2) 2s22p5; 3) 3s23p5; 4) 3s24d5.
14. Формула высшего оксида некоторого элемента – ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 4d6; 2) 2s22p4; 3) 3s23p4; 4) 3s13d5.
15. Атому элемента марганец соответствует сокращённая электронная формула
1) [18Ar]4s23d5; 2) [18Ar,3d10]4s22p5; 3) [10Ne]3s23p5; 4) [36Kr]4d55s2.
16. Строение внешнего и предвнешнего электронных слоёв атома меди
1) 3s23p63d94s2; 2) 3s23p63d104s0; 3) 3s23p64s13d10; 4) 3s23p63d11.
17. Движение электрона в атоме описывается … квантовыми числами.
1) 1; 2) 5; 3) 4; 4) 3.
18. Изотопы одного элемента различаются
1) числом протонов 2) числом нейтронов 3) числом электронов 4) зарядом ядра
19. Относительная атомная масса элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
20. В периоде слева направо уменьшается
1) число уровней 2) число валентных электронов
3) радиус атома 4) активность неметаллов
21. Металлические свойства простых веществ
1) уменьшаются в периодах и увеличиваются в группах
2) уменьшаются в периодах и уменьшаются в группах
3) увеличиваются в периодах и увеличиваются в группах
4) увеличиваются в периодах и уменьшаются в группах
22. Формула оксида, соответствующая элементу седьмой группы в его высшей степени окисления
1) ЭО3 2) Э2О7 3) Э2О5 4) ЭО2
23. Все атомы одного элемента имеют
1)одинаковое число электронов 2) одинаковое массовое число
3) разный заряд ядра 4) одинаковое число нейтронов
24. Номер периода элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
25. В группе сверху вниз уменьшается
1) высшая степень окисления 2) число валентных электронов
3) радиус атома 4) активность неметаллов
26. Основные свойства высших гидроксидов
1) уменьшаются в периодах и уменьшаются в группах
2) уменьшаются в периодах и увеличиваются в группах
3) увеличиваются в периодах и уменьшаются в группах
4) увеличиваются в периодах и увеличиваются в группах
27. Формула основания, соответствующая элементу четвертой группы в его высшей степени окисления
1) ЭОН 2) Э (ОН)2 3) Э (ОН)3 4) Э (ОН)4
28. Электронная формула валентного уровня 3d84s2 имеется у атомов
1) скандия 2) никеля 3) марганца 4) титана
29. Электронная формула атома натрия
1) ls22s22p63s23p1 2) 1s22s22p63s23p3
3) 1s22s22p63s1 4) ls22s1
30. Число неспаренных электронов в основном состоянии атома бериллия равно
1) 0 2) 1 3) 2 4) 4
31. Элемент, атомы которого имеют в основном состоянии 4 неспаренных электронов
1) марганец 2) железо 3) ванадий 4) хром
32. Является f-элементом
1) Sr 2) Se 3) Sc 4) Sm
33. Никель является
1) s-элементом 2) р-элементом
3) d-элементом 4) f-элементом
34. Какой подуровень из перечисленных заполняется электронами первым?
1) 3d 2) 4d 3) 4p 4) 4s
ЦОРы
Фильм: “Электронные оболочки. Квантовые числа”
Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе, что значительно облегчит решение задач. Более того, периодическую систему можно использовать на ЕГЭ, и это может стать серьезным подспорьем. Главное — уметь грамотно ей пользоваться. Как это делать — читайте в нашей статье.
Таблица Менделеева — краткое описание
Таблица Менделеева — это графическое выражение периодического закона, который открыл русский ученый Д.И. Менделеев в 1869 году. Периодическая система представляет собой классификацию химических элементов, которая основана на зависимости свойств химических элементов от заряда их атомного числа. Первоначальный вариант предполагал зависимость свойств веществ от их атомной массы.
Существуют три формата таблицы Менделеева:
- короткий (короткопериодный);
- длинный (длиннопериодный);
- сверхдлинный.
Международным союзом теоретической и прикладной химии (ИЮПАК) в качестве основного утвержден длинный вариант таблицы Менделеева, а короткий вариант официально отменен в 1989 году.
Пустые ячейки в таблице
Создав периодическую таблицу в 1869 году на базе уже известных миру 63-х химических элементов, Менделеев предсказал открытие новых и оставил для них пустые ячейки в таблице. Русский ученый оказался прав. Гипотеза Менделеева в скором времени была подтверждена открытиями других ученых: в 1875 году был открыт галлий, в 1879 — скандий, в 1886 — германий. На 2023 год в таблицу собраны 118 известных элементов. Последние из них открыты в 2016 году: ученые обнаружили нихоний, московий, теннессин и оганесон.
Структура таблицы
В таблице Менделеева химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы. Таблица состоит из семи периодов и восьми групп.
Периоды — это горизонтальные ряды в таблице.
Элементы, которые относятся к одному периоду, показывают следующие закономерности с увеличением их порядкового номера:
- Возрастает электроотрицательность.
- Металлические свойства убывают, неметаллические возрастают.
- Атомный радиус падает.
Периоды в таблице делятся на:
- малые;
- большие.
Малыми называются периоды, которые содержат небольшое количество элементов. Это первый, второй и третий периоды, первый состоит из 2-х, второй и третий из 8 элементов.
Все остальные периоды — это большие периоды. Четвертый и пятый состоят из 18 элементов, шестой — из 32-х, седьмой — из 24-х.
В нижней части таблицы Менделеева расположены химические вещества, которые называются лантаноидами и актиноидами.
Таблица периодической системы содержит десять рядов. Малые периоды состоят из одного ряда, большие периоды содержат по два ряда. В седьмом периоде находится один ряд.
Каждый большой период состоит из четного и нечетного рядов. В четных рядах содержатся металлы, в нечетных рядах — неметаллы.
Периодическая система начинается водородом — первым химическим элементом, а заканчивается на сегодняшний день 118-м — оганесоном. Ученые утверждают, что таблица не закончена, идет активный поиск 119-го элемента.
Группы элементов с похожими свойствами
Группа — это вертикальная колонка в периодической таблице, определяющая основные физико-химические свойства элементов. Вещества, принадлежащие к одной и той же группе, обладают похожими химическими особенностями и демонстрируют одинаковую закономерность в изменении своих свойств по мере увеличения атомного числа.
Всем группам (колонкам таблицы) присваиваются номера от 1 до 18 — слева направо (от щелочных металлов к благородным газам). Такая система вступила в силу в 1988 году по инициативе ИЮПАК. Все прежние названия групп, которые использовали в разных странах, больше не употребляются.
Элементы, которые относятся к одной группе, показывают следующие закономерности по направлению сверху вниз:
- Возрастает радиус атома элементов в рамках одной группы.
- Усиливаются металлические свойства элементов и ослабевают неметаллические.
- Падает электроотрицательность.
Цветовое определение групп
Вещества в каждой группе делятся на те, которые находятся в главной подгруппе и те, которые входят в побочную подгруппу. В таблице составляющие побочной группы выделяются синим цветом, к ней относятся элементы только больших периодов (начинаются с четвертого периода). В главную подгруппу могут входить элементы и малых, и больших периодов (начинаются с первого или второго периодов).
Различение металлов, металлоидов и неметаллов
Все химические элементы в зависимости от их химических и физических свойств можно разделить на 3 типа:
- металлы;
- металлоиды;
- неметаллы.
Характеристика металлов (например, медь, алюминий, золото):
- Хорошая электро- и теплопроводность.
- Способность отражать свет (яркий внешний вид).
- Высокая температура плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Пластичность и податливость.
Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Их характеризуют:
- Неспособность проводить тепло и электричество.
- Разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Значительно более низкая температура плавления в сравнении с металлами.
- Хрупкость и ломкость.
Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Их основные черты:
- Средняя тепло- и электропроводность.
- Внешний вид может быть схож с металлами или неметаллами.
- Различаются между собой по температуре плавления, плотности, цвету и форме.
Обозначение элементов
Каждый элемент в периодической системе Менделеева имеет несколько обозначений:
- название;
- буквенное выражение;
- атомный номер;
- массовое число.
Буквенное, название
В таблице может быть указано полное название вещества (например, Carbon), в таких случаях его располагают под химическим символом.
Символ — это сокращенное название элемента (например, гелий — He).
Иногда в таблице не указываются названия вещества и приводится лишь его химический символ. Обозначения, как правило, состоят из одной или двух латинских букв. Символ элемента расположен в центре соответствующей ячейки в таблице.
Атомный номер
Атомный номер элемента обычно располагается вверху соответствующей ячейки, посередине или в углу. Все элементы имеют атомные номера от 1 до 118. Атомный номер — это всегда целое число.
Массовое число
Массовое число — это общее количество протонов и нейтронов в ядре. Его легко определить по атомной массе элемента, округляя ее до ближайшего целого числа.
Атомная масса указывается внизу ячейки, под символом элемента. Атомная масса — это сумма масс частиц, которые составляют ядро атома (протоны и нейтроны), представляет собой среднюю величину, для большинства элементов записывается в виде десятичной дроби.
Например, фосфор (P) имеет атомную массу равную 30,97376, следовательно, массовое число (количество протонов и нейтронов в ядре) составит 31.
Валентность
Валентность — это свойство элементов образовывать химические связи.
Валентность бывает:
- постоянная;
- переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность по таблице Менделеева несложно:
- Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
- Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 (всего 8 групп в таблице) вычесть № группы, в которой находится вещество.
Например, вещества, находящиеся в первой группе главной подгруппы (Li, К) имеют валентность, равную I; элементы, которые располагаются во второй группе главной подгруппы (Mg, Ca) обладают II валентностью. Мышьяк (As) находится в V группе главной подгруппы, следовательно, значение его валентности также будет равняться V. Помимо этого, у вещества есть еще одно значение валентности. Определяется оно по приведенной выше формуле и равняется III.
Если у вас возникнут сложности в усвоении знаний не только по химии, но и по любому другому предмету, обращайтесь за помощью к образовательному ресурсу Феникс.Хелп. Для нас не существует нелюбимых дисциплин и сложных тем!