Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- + OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 + OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 + NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О = (МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз.
Тренировочные тесты по теме «Гидролиз»( с ответами)
179
Создан на
16 января, 2022 От Admin
Тренажер задания 21
Тренажер задания 21 ЕГЭ по химии
1 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) H2SO4
2) Na2S
3) AICl3
4) CaCl2
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
2 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) KHCO3
2) Ba(NO3)2
3) ZnSO4
4) HCIO3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
3 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) NaHSO4
2) KClO4
3) CH3COOH
4) KHCO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
4 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) KOH
2) NaHCO3
3) H3PO4
4) НCl
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
5 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Аl(NO3)3
2) NH3
3) CH3COONH4
4) HClO3
Запишите номера веществ в порядке возрастания значения pН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
6 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) сульфат железа
2) нитрат бария
3) сульфид натрия
4) азотная кислота
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
7 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2CO3
2) Н3РО4
3) Ва(NO3)2
4) Са(ОН)2
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
8 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HF
2) HI
3) CaCrO4
4) Cs3PO4
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
9 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HNO2
2) C2H5COOK
3) H2CrO4
4) Ca(OH)2
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
10 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) FeBr3
2) НСООNa
3) НВr
4) LiOH
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Ваша оценка
The average score is 26%
Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой , гидролизуются ПО АНИОНУ .
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH — . Водородный показатель такого раствора рН>7 .
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой , гидролизуются ПО КАТИОНУ . Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
или в молекулярной форме:
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н + . Водородный показатель такого раствора рН .
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой , гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ .
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7 . Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой , в водных растворах НЕ ИДЕТ .
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
- Некоторые соли необратимо гидролизуются с образованием оксосолей :
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза .
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Совместный гидролиз двух солей примеры уравнений
В ходе урока мы изучим тему «Гидролиз. Среда водных растворов. Водородный показатель». Вы узнаете о гидролизе – обменной реакции вещества с водой, приводящей к разложению химического вещества. Кроме того, будет введено определение водородному показателю – так называемому РН.
I. Механизм гидролиза
Гидролиз – это обменная реакция вещества с водой, приводящая к его разложению.
Попробуем разобраться в причине данного явления.
Электролиты делятся на сильные электролиты и слабые. См. Табл. 1.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Степень диссоциации при 180С в растворах с концентрацией электролита 0,1 моль/л близка к 100%. Диссоциируют практически необратимо.
Степень диссоциации при 180С в растворах с концентрацией электролита 0,1 моль/л значительно меньше 100%. Диссоцииация необратима.
- Щелочи
- Соли
- Некоторые неорганические кислоты (НNO3, HClO4,HI, HCl, HBr, H2SO4)
- Гидроксиды металлов, кроме IA и IIA групп, раствор аммиака
- Многие неорганические кислоты (H2S, HCN, HClO, HNO2)
- Органические кислоты (HCOOH, CH3COOH)
- Вода
Вода относится к слабым электролитам и поэтому диссоциирует на ионы лишь в незначительной степени
Н2О ↔ Н + + ОН —
Ионы веществ, попадающие в раствор, гидратируются молекулами воды. Но при этом может происходить и другой процесс. Например, анионы соли, которые образуются при её диссоциации, могут взаимодействовать с катионами водорода, которые, пусть и в незначительной степени, но все-таки образуются при диссоциации воды. При этом может происходить смещение равновесия диссоциации воды. Обозначим анион кислоты Х-.
Предположим, что кислота сильная. Тогда она по определению практически полностью распадается на ионы. Если кислота слабая, то она диссоциирует неполностью. Она будет образовываться при прибавлении в воду из анионов соли и ионов водорода, получающихся при диссоциации воды. За счет её образования, в растворе будут связываться ионы водорода, и их концентрация будет уменьшаться. Н + + Х — ↔ НХ
Но, по правилу Ле Шателье, при уменьшении концентрации ионов водорода равновесие смещается в первой реакции в сторону их образования, т. е. вправо. Ионы водорода будут связываться с ионами водорода воды, а гидроксид ионы – нет, и их станет больше, чем было в воде до прибавления соли. Значит, среда раствора будет щелочная. Индикатор фенолфталеин станет малиновым.
Аналогично можно рассмотреть взаимодействие катионов с водой. Не повторяя всю цепочку рассуждений, подытоживаем, что если основание слабое, то в растворе будут накапливаться ионы водорода, и среда будет кислая.
II. Классификация катионов и анионов
К сильным кислотам относятся:
- H2SO4 (серная кислота),
- HClO4 (хлорная кислота),
- HClO3 (хлорноватая кислота),
- HNO3 (азотная кислота),
- HCl (соляная кислота),
- HBr (бромоводородная кислота),
- HI (иодоводородная кислота).
Ниже приведен список слабых кислот:
- H2SO3 (сернистая кислота),
- H2CO3 (угольная кислота),
- H2SiO3 (кремниевая кислота),
- H3PO3 (фосфористая кислота),
- H3PO4 (ортофосфорная кислота),
- HClO2 (хлористая кислота),
- HClO (хлорноватистая кислота),
- HNO2 (азотистая кислота),
- HF (фтороводородная кислота),
- H2S (сероводородная кислота),
- большинство органических кислот, напр., уксусная (CH3COOH).
Слабые основания — это:
- все нерастворимые в воде гидроксиды (напр., Fe(OH)3, Cu(OH)2 и т. д.),
- NH4OH (гидроксид аммония).
III. Отношение к гидролизу солей разных типов
Поскольку и катионы и анионы, согласно данной классификации, бывают двух типов, то всего существует 4 разнообразных комбинации при образовании их солей. Рассмотрим, как относится к гидролизу каждый из классов этих солей.
1. Гидролиз не возможен (гидролиз соли, образованной сильным основанием и сильной кислотой)
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается нейтральной.
2. Гидролиз по катиону (в реакцию с водой вступает только катион, т.е. это гидролиз соли, образованной слабым основанием и сильной кислотой)
В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3,MgSO4) гидролизу подвергается катион:
FeCl2 + HOH Fe(OH)Cl + HCl
Fe 2+ + 2Cl — + H + + OH — FeOH + + 2Cl — + Н +
В результате гидролиза образуется слабый электролит, ион H + и другие ионы.
рН раствора Подведем итог тому, что вы узнали о гидролизе по катиону:
1) по катиону соли, как правило, гидролизуются обратимо;
2) химическое равновесие реакций сильно смещено влево;
3) реакция среды в растворах таких солей кислотная (рН Гидролиз по аниону (в реакцию с водой вступает только анион, т.е. это гидролиз соли, образованной сильным основанием и слабой кислотой)
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3,CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН — и другие ионы.
K2SiO3 + НОH KHSiO3 + KОН
2K + +SiO3 2- + Н + + ОH — НSiO3 — + 2K + + ОН —
рН таких растворов > 7 (раствор приобретает щелочную реакцию).
Подведем итог тому, что вы узнали о гидролизе по аниону:
1) по аниону соли, как правило, гидролизуются обратимо;
2) химическое равновесие в таких реакциях сильно смещено влево;
3) реакция среды в растворах подобных солей щелочная (рН > 7);
4) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
4. Совместный гидролиз: и по катиону, и по аниону (в реакцию с водой вступает и катион и анион, т.е. это гидролиз соли, образованной слабым основанием и слабой кислотой)
Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3,Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:

Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота
Видео — Эксперимент: «Гидролиз солей»
IV. Алгоритм составления уравнений гидролиза солей
Ход рассуждений
Пример
1. Определяем силу электролита – основания и кислоты, которыми образована рассматриваемая соль.
Помните!
Гидролиз всегда протекает по слабому электролиту, сильный электролит находится в растворе в виде ионов, которые не связываются водой.
Кислота
Основания
Слабые – все нерастворимые в воде основания и NH4OH
Na2CO3 – карбонат натрия, соль образованная сильным основанием (NaOH) и слабой кислотой (H2CO3)
2. Записываем диссоциацию соли в водном растворе, определяем ион слабого электролита, входящий в состав соли
2Na + + CO3 2- + H + OH — ↔
Это гидролиз по аниону
От слабого электролита в соли присутствует анион CO3 2- , он будет связываться молекулами воды в слабый электролит – происходит гидролиз по аниону.
3. Записываем полное ионное уравнение гидролиза – ион слабого электролита связывается молекулами воды
2Na + + CO3 2- + H + OH — ↔ (HCO3) — + 2Na + + OH —
В продуктах реакции присутствуют ионы ОН — , следовательно, среда щелочная pH>7
4. Записываем молекулярное гидролиза
V. Практическое применение гидролиза
На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной.
В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
VI. Задания для закрепления
Задание №1. Запишите уравнения гидролиза солей и определите среду водных растворов (рН) и тип гидролиза:
Na2SiO3 , AlCl3, K2S.
Задание №2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора:
Сульфита калия, хлорида натрия, бромида железа (III)
Задание №3. Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора соли для следующих веществ:
сульфид калия — K2S, бромид алюминия — AlBr3, хлорид лития – LiCl, фосфат натрия — Na3PO4, сульфат калия — K2SO4, хлорид цинка — ZnCl2, сульфит натрия — Na2SO3, сульфат аммония — (NH4)2SO4, бромид бария — BaBr2
Совместный гидролиз двух солей
Рассмотрим реакцию, происходящую в водном растворе двух солей:
В ионно-молекулярном виде:
Процесс совместного гидролиза двух солей FeCl3 и Na2CO3 можно представить следующим образом. Сначала записывают уравнение реакции вза-имодействия этих солей
а затем уравнение реакции гидролиза Fe2(CO3)3:


Соль NaCl гидролизу не подвергается. Для получения общего уравнения гидролиза FeCl3 и Na2CO3 следует просуммировать уравнения (1) и (2).
Гидролиз принадлежит к числу обратимых процессов, поэтому положение его равновесия может быть смещено в ту или иную сторону изменением концентрации исходных веществ, а также температуры раствора. Разбавление раствора, повышение температуры увеличивает степень гидролиза. Наоборот, добавляя кислоту в растворы, имеющие кислую реакцию, или щелочь в растворы со щелочной реакцией, можно понизить степень гидролиза.
Если кислота и основание, образующие соль, не только слабые электроли-ты, но и малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то гидролиз соли часто протекает необратимо, в результате чего про-исходит полное разложение соли водой, т.е. такие соли разлагаются водой:
202. Вычислить рН растворов, в которых концентрация ионов Н + (в моль/л) равна: а) 4,6×10 -4 ; б) 9,3×10 -9 .
203. Вычислить рН растворов, в которых концентрация ионов ОН — (в моль/л) равна: а) 2×10 -7 ; б) 8,1×10 -3 .
204. Определите [H + ] и [OH — ] в растворе, рН которого равен 7,5.
205. Составьте ионное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов K2S и CrCl3. Каждая из взятых солей гидролизуется необратимо до конца.
206. При смешивании растворов CuSO4 и K2CO3 выпадает осадок основной соли – гидроксокарбонат меди(II) и выделяется диоксид углерода. Составьте ион-ное и молекулярное уравнения происходящего гидролиза.
207. Какое значение рН (больше или меньше 7) имеют растворы солей Li2S, AlCl3, NiSO4? Составьте ионные и молекулярные уравнения гидролиза этих солей.
208. Какое значение рН (больше или меньше 7) имеют растворы следующих солей K3PO4, Pb(NO3)2, Na2S? Составьте ионные и молекулярные уравнения гидролиза солей.
209. Какая из солей K2SO4, CH3COOK, (NH4)2SO4 при растворении в воде имеет рН > 7? Составьте уравнение гидролиза для этой соли в ионном и молекулярном виде.
210. Составьте ионные и молекулярные уравнения гидролиза солей Na2CO3, ZnCl2. Какое значение рН (больше или меньше 7) имеют растворы этих солей?
211. Составьте ионные и молекулярные уравнения гидролиза солей : ацетата калия, сульфата цинка и нитрата алюминия. Какое значение рН (больше или меньше 7) имеют растворы этих солей?
212. Какие из солей – RbCl, Cr2(SO4)3, Ni(NO3)2 – подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза соответствующих солей.
213. Составьте ионные и молекулярные уравнения гидролиза солей K2S, NiCl2, Pb(CH3COO)2. Какое значение рН (больше или меньше 7) имеют растворы этих солей?
214. Какое значение рН (больше или меньше 7) имеют растворы солей MnCl2, Na2CO3, Ni(NO3)2? Составьте ионные и молекулярные уравнения гидролиза этих солей.
215. Какие из солей — Al2(SO4)3, K2S, Pb(NO3)2, KCl подвергаются гидроли-зу? Составьте ионные и молекулярные уравнения гидролиза соответствующих солей.
216. Какие из солей — KNO3, CrCl3, Cu(NO3)2, NaCN – подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза соответ-ствующих солей.
217. Какие из солей — K2CO3, FeCl3, K2SO4, ZnCl2 — подвергаются гидролизу? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей.
218. При смешивании растворов Al2(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца. Составьте ионное и молекулярное уравнения происходящего совместного гидролиза.
219. При смешивании растворов Al2(SO4)3, и Na2S образуются Al(ОН)3 и Н2S. Выразите этот гидролиз ионным и молекулярным уравнениями.
220. Какое значение рН (больше или меньше 7) имеют растворы следующих солей: Na3РO4, K2S, CuSO4? Составьте ионные и молекулярные уравнения гидро-лиза этих солей.
источники:
http://kardaeva.ru/89-dlya-uchenika/9-klass/142-gidroliz-solej
http://megaobuchalka.ru/4/38452.html
Необратимый гидролиз бинарных соединений.
Бинарные соединения – соединения, образованные двумя химическими элементами.
Например, PCl5, H2O, Mg3N2, Ca2Si и т.д.
Бинарные соединения делят на ионные и ковалентные.
Ионными называют такие бинарные соединения, которые образованы атомами металла и неметалла.
Ковалентными называют бинарные соединения, образованные двумя неметаллами.
Общая информация по гидролизу бинарных соединений
Многие бинарные соединения способны разлагаться под действием воды. Такая реакция бинарных соединений с водой называется необратимым гидролизом.
Необратимый гидролиз практически всегда протекает с сохранением степеней окисления всех элементов. В результате взаимодействия бинарных соединения с водой всегда:
✓ элемент в отрицательной степени окисления переходит в состав водородного соединения;
✓ элемент в положительной степени окисления переходит в состав соответствующего гидроксида.
Напомним, что гидроксид неметалла – это ни что иное, как соответствующая кислородсодержащая кислота. Так, например, гидроксид серы (VI) — это серная кислота H2SO4.
Так, например, попробуем записать уравнение необратимого гидролиза фосфида кальция Ca3P2, опираясь на информацию, представленную выше.
В фосфиде кальция мы имеем кальций в степени окисления «+2» и фосфор в степени окисления «-3». Как уже было сказано, в результате взаимодействия с водой должно образоваться водородное соединение элемента в отрицательной степени окисления (т.е. фосфора) и соответствующий гидроксид элемента в положительной степени окисления.
Также сказано, что в результате реакции гидролиза практически всегда сохраняются степени окисления элементов.
Это значит, что в образующемся водородном соединении фосфор будет иметь ту же степень окисления, что и в исходном фосфиде, т.е. «-3», исходя из чего легко записать формулу самого водородного соединения – PH3 (газ фосфин).
В то же время, кальций, как элемент в положительной степени окисления, должен перейти в состав соответствующего гидроксида с сохранением степени окисления «+2», т.е. в Ca(OH)2.
Таким образом, без расстановки коэффициентов реакция будет описываться следующей схемой:
Ca3P2 + H2O = PH3 + Ca(OH)2
Расставив коэффициенты получаем уравнение:
Ca3P2 + 6H2O = 2PH3 + 3Ca(OH)2
Используя аналогичный алгоритм, запишем уравнение гидролиза пентахлорида фосфора PCl5.
В данном соединении мы имеем фосфор в степени окисления «+5» и хлор в степени окисления «-1».
Очевидно, что водородным соединением хлора с хлором в степени окисления «-1» будет HCl.
В свою очередь, поскольку элемент в положительной степени окисления относится к неметаллам, его гидроксидом будет кислородсодержащая кислота с фосфором в той же степени окисления «+5».
При условии, что вы знаете формулы всех неорганических кислот, несложно догадаться, что данным гидроксидом является фосфорная кислота H3PO4.
Само уравнение при этом после расстановки коэффициентов будет иметь вид:
PCl5 + 4H2O = H3PO4 + 5HCl
Как видите, если вам дали формулу бинарного соединения и попросили записать уравнения его гидролиза, то ничего сложного в этом нет.
Какие ионные бинарные соединения способны вступать в реакцию необратимого гидролиза?
Для успешной сдачи ЕГЭ нужно запомнить, что из ионных бинарных соединений в реакцию необратимого гидролиза водой вступают:
1) нитриды щелочных металов (ЩМ), щелочноземельных металлов (ЩЗМ) и магния:
Na3N + 3H2O = NH3 + 3NaOH
Ca3N2 + 6H2O = 2NH3 + 3Ca(OH)2
2) фосфиды ЩМ, ЩЗМ и магния:
Na3P + 3H2O = PH3 + 3NaOH
Ca3P2 + 6H2O = 2PH3 + 3Ca(OH)2
3) силициды ЩМ, ЩЗМ и магния:
Na4Si + 4H2O = SiH4 + 4NaOH
Ca2Si + 4H2O = SiH4 + 2Ca(OH)2
4) карбиды ЩМ, ЩЗМ и магния. Знать нужно формулы только двух карбидов — Al4C3 и CaC2 и, соответственно, уметь записывать уравнения их гидролиза:
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3
CaC2 + 2H2O = C2H2 + Ca(OH)2
5) сульфиды алюминия и хрома:
Al2S3 + 6H2O = 3H2S + 2Al(OH)3
Cr2S3 + 6H2O = 3H2S + 2Cr(OH)3
6) гидриды ЩМ, ЩЗМ, Mg, Al:
NaH + H2O = H2 + NaOH
CaH2 + 2H2O = 2H2 + Ca(OH)2
AlH3 + 3H2O = 3H2 + Al(OH)3
Гидролиз гидридов металлов – редкий пример окислительно-восстановительного гидролиза. Фактически, в данной реакции объединяются ионы водорода H+ и анионы водорода H—, в следствие чего образуются нейтральные молекулы H2 с водородом в степени окисления, равной 0.
Какие ковалентные бинарные соединения вступают в реакцию гидролиза?
Из ковалентных бинарных соединений, способных вступать в реакцию необратимого гидролиза, нужно знать про:
1) галогениды фосфора III и V.
Например, PCl3, PCl5:
PCl5 + 4H2O = 5HCl + H3PO4
PCl3 + 3H2O = 3HCl + H3PO3
2) галогениды кремния:
SiCl4 + 3H2O = 4HCl + H2SiO3
Гидролиз бинарных соединений действием растворов кислот и щелочей
Помимо обычного гидролиза водой существует также вариант гидролиза, при котором бинарное соединение обрабатывают водным раствором щелочи или кислоты.
Как в таком случае записать уравнение гидролиза?
Для того, чтобы записать уравнение гидролиза бинарного соединения водным раствором щелочи или кислоты, нужно:
1) в первую очередь, представить, какие продукты образовались бы при обычном гидролизе водой.
Например, мы хотим записать уравнение щелочного гидролиза соединения PCl5 действием водного раствора KOH.
Тогда, согласно этому пункту, мы должны вспомнить какие продукты образуются при обычном гидролизе. В нашем случае это HCl и H3PO4
2) посмотреть на отношение этих продуктов к средообразователю (кислоте или щелочи) – реагируют они или нет. Если продукты обычного гидролиза реагируют со средообразователем, то запомнить продукты этого взаимодействия.
Возвращаясь к нашему случаю с PCl5, мы должны посмотреть на то, как относятся к щелочи продукты обычного гидролиза, т.е. HCl и H3PO4. Оба данных соединения в водном растворе являются кислотами, в связи с чем существовать в щелочной среде не могут. В частности, с гидроксидом калия они прореагируют, образуя соответственно соли KCl и K3PO4
3) в конечном уравнении в качестве продуктов записать то, что получается при взаимодействии со средообразователем. Воду при этом мы пока не пишем, вывод о том, писать ее или нет, делаем после попытки уравнивания реакции без нее.
Таким образом, следуя этому принципу, запишем:
PCl5 + KOH = KCl + K3PO4
Уже до начала расстановки коэффициентов очевидно, что есть необходимость в записи в качестве одного из продуктов реакции воды, поскольку в левой части присутствует водород, а в правой его нет.
Таким образом, суммарная схема реакции будет иметь вид:
PCl5 + KOH = KCl + K3PO4 + H2O
А само уравнение после расстановки коэффициентов будет выглядеть так:
PCl5 + 8KOH = 5KCl + K3PO4 + 4H2O
Следует отметить, что щелочной гидролиз ионных соединений чаще всего не отличается от обычного гидролиза действием воды, поскольку чаще всего ни один продукт обычного гидролиза с щелочью не взаимодействует.
Аналогично, можно сказать, что кислотный гидролиз ковалентных бинарных соединений не будет отличаться от водного.
В связи с этим имеет смысл более детально рассмотреть кислотный гидролиз ионных бинарных соединений и щелочной гидролиз ковалентных бинарных соединений.
Кислотный гидролиз ионных бинарных соединений
Со всеми перечисленными ионными бинарными соединениями, участвовавшими в реакциях обычного гидролиза водой, можно записать соответствующие уравнения их кислотного гидролиза. Возьмем в качестве примера водный раствор соляной кислоты:
1) Ca3P2 + 6HCl = 3CaCl2 + 2PH3
2) Mg2Si + 4HCl(р-р) = 2MgCl2 + SiH4
3) Al4C3 + 12HCl(р-р) = 4AlCl3 + 3CH4
4) Al2S3 + 6HCl = 2AlCl3 + 3H2S
5) Ca3N2 + 8HCl(р-р) = 3CaCl2 + 2NH4Cl
Обратите внимание, что вместо водородного соединения в случае нитридов металлов образуется продукт его взаимодействия с соляной кислотой (NH3 + HCl = NH4Cl). Следует отметить, что нитриды металлов – единственный случай, когда при кислотном гидролизе ионного бинарного соединения не выделяется газообразное водородное соединение. Связано это с тем, что по сравнению с другими водородными соединениями неметаллов, только у аммиака основные свойства выражены в значительной степени.
6) CaH2 + 2HCl(р-р) = CaCl2 + 2H2
Как можно заметить, кислотный гидролиз гидридов металлов также относится к окислительно-восстановительным реакциям. В результате этой реакции образуется простое вещество водород. Связано это с тем, что водород с кислотами не реагирует.
Щелочной гидролиз ковалентных бинарных соединений
Щелочному гидролизу среди ковалентных соединений подвержены все те же бинарные соединения, что и обычному гидролизу водой, то есть галогениды фосфора и кремния:
PBr5 + 8NaOH = Na3PO4 + 5NaBr + 4H2O
SiCl4 + 6KOH = K2SiO3 + 4KCl + 3H2O
Щелочной гидролиз галогенидов фосфора III в ЕГЭ не встретится из-за специфических свойства фосфористой кислоты.
Тем не менее, для тех, кто хочет, ниже предоставляю пример такого рода уравнений с пояснением:
Посмотреть
PCl3 + 5KOH = K2HPO3 + 3KCl + 2H2O
Поскольку фосфористая кислота является двухосновной, то несмотря на наличие трех атомов водорода, при ее реакции с щелочью на атомы металла способны заместиться только два атома водорода.
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет
реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз
(вода) разрушает «слабое» — это правило вам очень пригодится.

Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются
слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести
нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем
интеллектуальном составляющем 

По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr,
CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4,
FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз
разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4+ и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти
по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2
не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4,
NaNO2, Ca(OCl)2, Ba(CH3COO)2, K2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2,
Al2S3, Cr2(SO3)3, CH3COONH4.
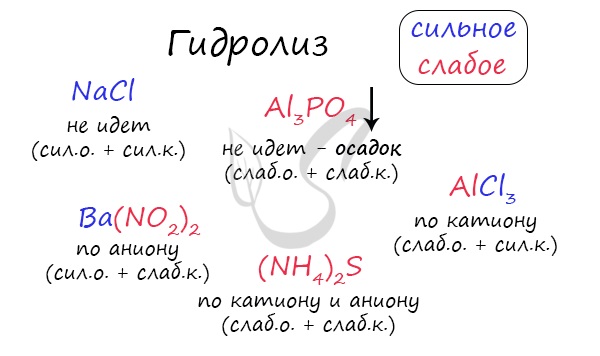
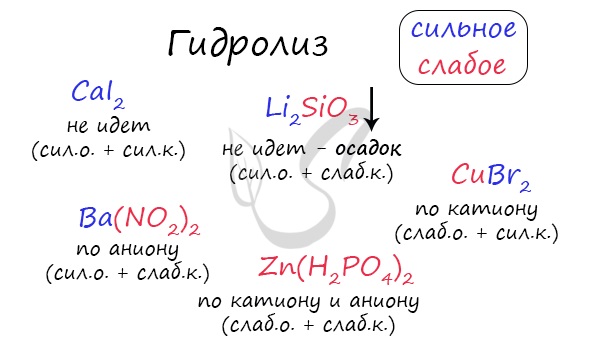
Самостоятельно определите тип гидролиза для CaI2, Li2SiO3, Ba(NO2)2, CuBr2, Zn(H2PO4)2.
Ниже вы найдете решение.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль,
вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда
раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда
раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры:
NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.

Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили.
Ниже будет располагаться решение.

С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH < 7. В нейтральной pH = 7. В щелочной pH > 7.
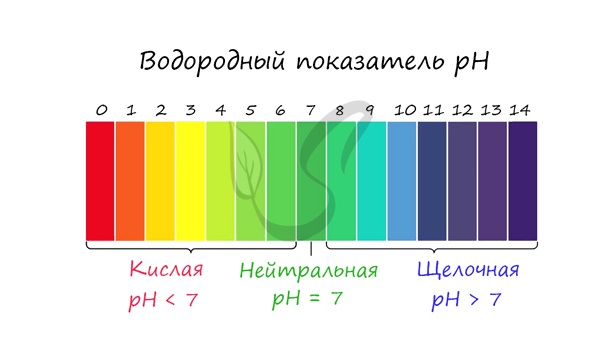
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH < 7).
Индикаторы (лат. indicator — указатель)
Индикатор — вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен
менять его цвет, что наглядно отражает характер среды в определенный момент времени.
Наиболее известные и широко применяемые индикаторы: лакмус, фенолфталеиновый и метиловый оранжевый. В зависимости от среды
раствора их окраска меняется, что отражает приведенная ниже таблица.

Для тех, кто обладает хорошей зрительной памятью, будет несложно запомнить эту схему. Но что делать аудиалам и кинестетикам? 
От волнения на экзамене такая таблица легко может раствориться и перепутаться в океане мыслей, поэтому своим ученикам я рекомендую
запомнить индикаторы по стихам.
Только представьте, как приятно будет прочитать стих на экзамене, и убедиться в его безошибочности. Это придаст уверенности и поднимет
настроение 
Лакмус
Индикатор лакмус красный
Кислоту укажет ясно.
Индикатор лакмус синий —
Щелочь здесь, не будь разиней!
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеин
Фенолфталеиновый
В щелочах малиновый
Несмотря на это —
В кислотах он без цвета.
Метиловый оранжевый
От щелочи я желт как в лихорадке
Я розовею от кислот, как от стыда
И я бросаюсь в воду без оглядки —
Здесь я оранжевый практически всегда!

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Совместный гидролиз двух солей
Рассмотрим
реакцию, происходящую в водном растворе
двух солей:
2FeCl3
+ 3Na2CO3
+3Н2О
= 2Fe(ОН)3
+ 3CO2
+ 6NaCl.
В
ионно-молекулярном виде:
2Fe3+
+ 3CO32-
+ 3Н2О
= 2Fe(ОН)3
+ 3CO2.
Процесс
совместного гидролиза двух солей FeCl3
и Na2CO3
можно представить следующим образом.
Сначала записывают уравнение реакции
взаимодействия этих солей
2FeCl3
+ 3Na2CO3
= Fe2(CO3)3
+ 6NaCl,
(1)
а
затем уравнение реакции гидролиза
Fe2(CO3)3:
F
e2(CO3)3
+ 6НОН = 2Fe(ОН)3
+ 3Н2CO3.
(2)
3CO2
3Н2О
Соль
NaCl
гидролизу не подвергается. Для получения
общего уравнения гидролиза FeCl3
и Na2CO3
следует просуммировать уравнения (1) и
(2).
Гидролиз
принадлежит к числу обратимых процессов,
поэтому положение его равновесия может
быть смещено в ту или иную сторону
изменением концентрации исходных
веществ, а также температуры раствора.
Разбавление раствора, повышение
температуры увеличивает степень
гидролиза. Наоборот, добавляя кислоту
в растворы, имеющие кислую реакцию, или
щелочь в растворы со щелочной реакцией,
можно понизить степень гидролиза.
Если
кислота и основание, образующие соль,
не только слабые электролиты, но и
малорастворимы или неустойчивы и
разлагаются с образованием летучих
продуктов, то гидролиз соли часто
протекает необратимо, в результате чего
происходит полное разложение соли
водой, т.е. такие соли разлагаются водой:
Cr2S3
+ 6H2O
= 2Cr(OH)3↓
+ 3H2S↓.
Задания
-
Составьте
молекулярные и ионные уравнения
гидролиза солей: СН3СООК,
Сr2(SO4)3,
А1(NО3)3.
Какое значение рН (больше или меньше
7) имеют растворы этих солей?
-
Какое
значение рН (больше или меньше 7) имеют
растворы солей: К2S,
А12(SO4)3,
FеС13?
Составьте
молекулярные и ионные уравнения
гидролиза солей. -
Составьте
молекулярные и ионные уравнения
гидролиза солей: Рb(NО3)2,
Nа2SO3
, ZnSO4.
Какое значение рН (больше или меньше
7) имеют растворы этих солей?
-
Вычислить
рН растворов, в которых концентрация
ионов Н+
(в моль/л) равна: а) 4,610-4;
б) 9,310-9. -
Определите
[H+]
и [OH—]
в растворе, рН которого равен 7,5. -
При
смешивании растворов сульфата алюминия
и карбоната натрия образуются А1(ОН)3
и СО2.
Составьте молекулярное и ионное
уравнения происходящей реакции. -
Какие
из солей NаВr, Nа2S,
К2СО3,
СоС12,
К2SO4
подвергаются гидролизу? Составьте
молекулярные и ионные уравнения
гидролиза соответствующих солей.
-
Какие
из солей NаNО3,
СrС13,
Сu(NО3)2,
КС1, КI подвергаются гидролизу? Составьте
молекулярные и ионные уравнения
гидролиза соответствующих солей.
-
Составьте
молекулярные и ионные уравнения реакций,
происходящих при смешивании растворов
СrС13
и Nа2S.
(образуются Сr(ОН)3
и
H2S). -
Какое
значение рН (больше или меньше 7) имеют
растворы солей: МnС12,
К2СО3,
Ni(NО3)2?
Составьте
молекулярные и ионные уравнения
гидролиза солей. -
Какие
из солей Nа2SО4,
А1С13,
МnSO4
КNО2,
КС1 подвергаются гидролизу? Составьте
молекулярные и ионные уравнения
гидролиза соответствующих солей. -
При
смешивании концентрированных растворов
FеС13
и Nа2СО3
образуются Fе(ОН)3
и СО2.
Составьте молекулярное и ионное
уравнения происходящей реакции. -
Какие
из солей NаI, FеС12,
К2SO4
КNО3,
Со(NО3)2
подвергаются гидролизу? Составьте
молекулярные и ионные уравнения
гидролиза соответствующих солей. -
При
смешивании растворов сульфата алюминия
и сульфида натрия образуются А1(ОН)3
и Н2S.
Составьте молекулярное и ионное
уравнения происходящей реакции. -
Составьте
молекулярные и ионные уравнения
гидролиза соли, в результате которого
образуется: кислая соль; основная соль. -
Вычислить
рН растворов, в которых концентрация
ионов ОН—
(в моль/л) равна: а) 210-7;
б) 8,110-3. -
Какое
значение рН (больше или меньше 7) имеют
растворы солей: NiSО4,
К3РO4,
NаОС1?
Составьте
молекулярные и ионные уравнения
гидролиза солей. -
Составьте
молекулярные и ионные уравнения
гидролиза солей: СН3СООК,
СuSO4,
Nа3РО4,
Li2S.
Какое значение рН (больше или меньше
7) имеют растворы этих солей?
-
Какие
из солей NаС1, Сr2(SO4)3,
CuС12,
КВr, Zn(NО3)2,
подвергаются гидролизу? Составьте
молекулярные и ионные уравнения
гидролиза соответствующих солей. -
При
смешивании растворов сульфата меди и
карбоната натрия образуются (СuОН)2СО3
и выделяется СО2.
Составьте молекулярное и ионное
уравнения происходящей реакции.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #







