|
ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕН 2003 |
ХИМИЯ, 11 КЛ. |
(1201 — 1 ) |
Единый государственный экзамен по ХИМИИ Вариант №1201
Инструкция по выполнению работы
На выполнение экзаменационной работы по химии дается 3 часа (180 минут). Работа состоит из 3 частей и включает 50 заданий.
Часть 1 включает 35 заданий (А1 – А35). К каждому заданию дается 4 варианта ответа, из которых только один правильный.
Часть 2 состоит из 10 заданий (В1 – В10), для которых необходимо сформулировать краткий ответ (назвать вещество, тип реакции, окислитель или восстановитель, указать направление реакции и т.д.).
Часть 3 содержит 5 самых сложных заданий по общей, неорганической и органической химии. Задания C1 – C5 требуют полного (развернутого) ответа.
Внимательно прочитайте каждое задание и предлагаемые варианты ответа, если они имеются. Отвечайте только после того, как вы поняли вопрос и проанализировали все варианты ответа.
Выполняйте задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. К пропущенному заданию вы сможете вернуться после выполнения всей работы, если останется время.
За выполнение различных по сложности заданий дается один или более баллов. Баллы, полученные вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕН 2003 |
ХИМИЯ, 11 КЛ. |
(1201 — 2 ) |
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером выполняемого вами задания (А1 – А35) поставьте знак « × » в
клеточку, номер которой соответствует номеру выбранного вами ответа.
Химическому элементу соответствует высший оксид состава RO3. Электронная конфигурация внешнего энергетического уровня атома этого элемента
|
1) |
ns2np4 |
2) |
ns2np3 |
3) |
ns2np2 |
4) |
ns2np6 |
|
В атоме хрома число свободных 3d орбиталей равно |
|||||||
|
1) |
1 |
2) |
2 |
3) |
3 |
4) |
0 |
В ряду химических элементов
Mg 


металлические свойства
1)убывают
2)возрастают
3)изменяются периодически
4)не изменяются
Ковалентная неполярная связь реализуется в соединении
|
1) CrO3 |
2) P2O5 |
3) SO2 |
4) F2 |
|
A5 |
Степень окисления углерода в CH3Cl |
|||
|
1) + 1 |
2) – 1 |
3) + 2 |
4) – 2 |
|
|
Молекулярной структуры не имеет |
||||
|
A6 |
1)иод (тв.)
2)графит
3)углекислый газ (тв.)
4)метан (тв.)
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕН 2003 ХИМИЯ, 11 КЛ. (1201 — 3 )
A7 На свойства вещества не оказывает влияние
1)число промежуточных стадий получения
2)пространственное строение молекулы
3)порядок соединения атомов в молекуле
4)взаимное влияние атомов в молекуле
|
A8 |
Из приведенных ниже металлов наиболее |
активным является |
|||
|
1) бериллий |
2) магний |
3) |
кальций |
4) барий |
|
|
Железо реагирует с каждым из двух веществ: |
|||||
|
A9 |
|||||
1)хлоридом натрия и водой
2)кислородом и хлором
3)оксидом алюминия и карбонатом калия
4)водой и гидроксидом натрия
A10 Среди перечисленных элементов V группы типичным неметаллом является
1)фосфор
2)мышьяк
3)сурьма
4)висмут
A11 В схеме превращений
Na2CO3 +X CaCO3 +Y Ca(HCO3)2
буквами «X» и «Y» обозначены вещества
1) X – CaO; Y – HCl
2)X – Ca(OH)2; Y – NaCl
3)X – CaF2; Y – CO2 и H2O
4)X – CaCl2; Y – CO2 и H2O
|
A12 |
Число изомерных карбоновых кислот с общей формулой |
С5Н10О2 равно |
||||||
|
1) |
5 |
2) |
2 |
3) |
3 |
4) |
4 |
|
|
В молекуле 2-метилбутена-2 гибридизация орбиталей углеродных атомов |
||||||||
|
A13 |
||||||||
1)только sp3
2)только sp2
3)sp3 и sp2
4)sp3 и sp
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕН 2003 ХИМИЯ, 11 КЛ. (1201 — 4 )
A14 Реакция с аммиачным раствором оксида серебра характерна для
1)1-пропанола
2)пропаналя
3)пропановой кислоты
4)диметилового эфира
A15 Жиры представляют собой сложные эфиры
1)этиленгликоля и низших карбоновых кислот
2)этиленгликоля и высших карбоновых кислот
3)глицерина и низших карбоновых кислот
4)глицерина и высших карбоновых кислот
|
A16 |
Как альдегид и как спирт глюкоза взаимодействует с веществом, формула |
|||
|
которого |
||||
|
1) Ag2O |
2) H2 |
3) Cu(OH)2 |
4) NaOH |
|
|
При взаимодействии анилина с бромной водой образуется |
||||
|
A17 |
||||
1)орто—броманилин
2)2,4,6-триброманилин
3)3,5-диброманилин
4)мета-броманилин
A18 Формула аминоуксусной кислоты
1)CH3 − COOH
2)CH3 − CH2 – COOH
3)NH2 – CH2 − COOН
4)Cl – CH2 − COOH
A19 Гидроксид цинка (II)
1)проявляет только основные свойства
2)проявляет только кислотные свойства
3)проявляет амфотерные свойства
4)не проявляет кислотно-основных свойств
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕН 2003 |
ХИМИЯ, 11 КЛ. |
(1201 — 5 ) |
||
|
Реакция, уравнение которой |
||||
|
A20 |
CaO (к) + CO2 (г) – Q, |
|||
|
CaCO3 (к) |
||||
|
относится к реакциям |
1)соединения, экзотермическим
2)разложения, эндотермическим
3)соединения, эндотермическим
4)разложения, экзотермическим
A21 Скорость гомогенной химической реакции пропорциональна изменению
1)концентрации вещества в единицу времени
2)количества вещества в единице объема
3)массы вещества в единице объема
4)объема вещества в ходе реакции
A22 При увеличении давления химическое равновесие не смещается в системе
1)CO (г) + Cl2 (г) = COCl2 (г)
2)CO2 (г) + C = 2CO (г)
3)2CO (г) + O2 (г) = 2CO2 (г)
4)C + O2 (г) = CO2 (г)
A23 Какие из утверждений о диссоциации оснований в водных растворах верны?
А. Основания в воде диссоциируют на катионы металла (или подобный им
катион NH4+) и гидроксид анионы OH –.
Б. Никаких других анионов, кроме OH–, основания не образуют.
1)верно только А
2)верно только Б
3)верны оба утверждения
4)оба утверждения неверны
A24 При сливании растворов сульфата аммония и гидроксида калия реагируют ионы
1)SO42− и К+
2)К+ и OH−
3)NH4+ и OH−
4)NH4+ и SO42−
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕН 2003 ХИМИЯ, 11 КЛ. (1201 — 6 )
A25 Процессу окисления соответствует схема
1)C 
2)CO 
3)CO32– 
4)C 
A26 Гидролиз идет до конца при растворении в воде соли
1)AlCl3
2)Al2(SO4)3
3)Al(NO3)3
4)Al2S3
|
A27 |
При электролизе водного раствора нитрата серебра на катоде образуется |
|||
|
1) Ag |
2) NO2 |
3) NO |
4) H2 |
|
|
В наиболее жестких условиях гидрируется |
||||
|
A28 |
1)циклогексан
2)циклобутан
3)метилциклопропан
4)циклопропан
A29 При взаимодействии 4-метил-1-пентена с водой получается
1)4-метил-1-пентаналь
2)4-метил-2-пентанон
3)4-метил-2-пентанол
4)2-гексанол
A30 При щелочном гидролизе 1,2-дихлорпропана образуется
1)пропанол-1
3)пропанол-2
2)пропаналь
4) пропандиол-1,2
A31 Реактивами для получения водорода и кислорода в лаборатории могут быть, соответственно, следующие вещества:
1)Cu и HCl, KClO3
2)Zn и HCl, KMnO4
3)H2O2, HgO
4)HCl, Na2O
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕН 2003 |
ХИМИЯ, 11 КЛ. |
(1201 — 7 ) |
|||
|
Для получения нержавеющей стали в ее состав вводят |
|||||
|
A32 |
|||||
|
1) фосфор |
2) хром |
3) кремний |
4) |
углерод |
|
|
Синтетический каучук получают из бутадиена-1,3 реакцией |
|||||
|
A33 |
1)изомеризации
2)гидрогенизации
3)полимеризации
4)поликонденсации
A34 Избыточные углеводы в организме человека превращаются в
1)жиры
2)аминокислоты
3)карбоновые кислоты
4)глицерин
|
A35 Объем сероводорода (н.у.), образующегося при действии избытка серной |
|||
|
кислоты на 35,2 г сульфида железа (II), равен |
|||
|
1) 2,24 л |
2) 4,48 л |
3) 6,72 л |
4) 8,96 л |
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕН 2003 |
ХИМИЯ, 11 КЛ. |
(1201 — 8 ) |
Часть 2
Ответом к заданиям этой части (В1 – В10) является набор букв, слово или число. Впишите ответы в текст экзаменационной работы, а затем перенесите их в бланк ответов № 1 рядом с номером соответствующего задания, начиная с первой левой клеточки. Каждую букву, цифру, символ (запятая в десятичной дроби) пишите в отдельной клеточке без пробелов в соответствии с приведенными образцами.
В заданиях В1 – В5 на установление соответствия запишите в таблицу буквы выбранных вами ответов, а затем получившуюся последовательность букв перенесите в бланк ответов № 1 без пробелов и других символов.
Установите соответствие между элементом и электронной конфигурацией атомов.
|
ЭЛЕМЕНТЫ |
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ |
||||
|
АТОМОВ |
|||||
|
1) |
He |
А) 1s22s22p3 |
|||
|
2) |
N |
Б) 1s22s22p1 |
|||
|
3) |
B |
В) 1s2 |
|||
|
4) |
C |
Г) 1s22s2 |
|||
|
Д) 1s22s22p2 |
|||||
|
1 |
2 |
3 |
4 |
||
Установите соответствие между названием вещества и числом π-связей в его молекуле.
|
НАЗВАНИЕ ВЕЩЕСТВА |
π |
|||||
|
ЧИСЛО -СВЯЗЕЙ В МОЛЕКУЛЕ |
||||||
|
1) |
метаналь |
А) ноль |
||||
|
2) |
этан |
Б) |
одна |
|||
|
3) |
ацетилен |
В) две |
||||
|
4) |
бутадиен-1,3 |
Г) |
три |
|||
|
Д) четыре |
||||||
|
3 |
||||||
|
1 |
2 |
4 |
||||
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕН 2003 ХИМИЯ, 11 КЛ. |
(1201 — 9 ) |
||||||
|
Установите соответствие между веществом и его принадлежностью к |
|||||||
|
соответствующему классу (группе) неорганических соединений. |
|||||||
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС (ГРУППА) |
||||||
|
НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|||||||
|
1) |
CsOH |
А) амфотерный оксид |
|||||
|
2) |
MnO |
Б) |
основной оксид |
||||
|
3) |
Cr2O3 |
В) |
соль |
||||
|
4) |
K4[Fe(CN)6] |
Г) |
щелочь |
||||
|
Д) амфотерный гидроксид |
|||||||
|
3 |
|||||||
|
1 |
2 |
4 |
|||||
Установите соответствие между названием соединения и типом гибридизации атомных орбиталей углерода в нем.
|
CОЕДИНЕНИЕ |
ТИП ГИБРИДИЗАЦИИ |
||
|
1) |
бензол |
А) sp |
|
|
2) |
этилен |
Б) |
sp2 |
|
3) |
метанол |
В) |
sp3 |
|
4) |
ацетилен |
|
1 |
2 |
3 |
4 |
||||||
|
Установите соответствие между реагентами и ионно-молекулярным |
|||||||||
|
B5 |
|||||||||
|
уравнением реакции. |
|||||||||
|
РЕАГЕНТЫ |
ИОННО-МОЛЕКУЛЯРНОЕ |
||||||||
|
УРАВНЕНИЕ |
|||||||||
|
1) |
NaOH + HNO3 |
А) CaCO3 + 2H+ |
= Ca2+ +H2O + CO2 |
||||||
|
2) |
Na2CO3 + HCl |
Б) CO32– + H2O = HCO3– + OH– |
|||||||
|
3) |
Na2CO3 + CO2 + H2O |
В) OH– + H + = H2O |
|||||||
|
4) |
CaCO3 + HCl |
Г) CO32– + 2H+ |
= CO2 + H2O |
||||||
|
Д) CO32– + CO2 + H2O = 2HCO3– |
|||||||||
|
3 |
|||||||||
|
1 |
2 |
4 |
|||||||
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается
|
ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕН 2003 |
ХИМИЯ, 11 КЛ. |
(1201 — 10 ) |
||
|
Вещества, с которыми способен взаимодействовать α-аминопропионовая |
||||
|
B6 |
||||
|
кислота: |
||||
|
А) |
этан |
|||
|
Б) |
гидроксид калия |
|||
|
В) |
хлорид калия |
|||
|
Г) |
серная кислота |
|||
|
Д) |
диметиловый эфир |
|||
|
Е) |
толуол |
|||
|
Ответ: ________________ . |
||||
|
(Запишите соответствующие буквы в алфавитном порядке.) |
||||
|
Предельная одноосновная карбоновая кислота, образующая с этанолом |
||||
|
B7 |
||||
|
сложный эфир состава С5Н10О2, называется ________________ кислотой. |
||||
|
(Запишите название кислоты по систематической номенклатуре в |
||||
|
соответствующем падеже.) |
||||
|
Продуктами разложения нитрита аммония являются: |
||||
|
B8 |
||||
|
А) |
N2 |
|||
|
Б) |
NO2 |
|||
|
В) |
N2O |
|||
|
Г) |
NO |
|||
|
Д) |
H2O |
Ответ: ________________ .
(Запишите соответствующие буквы в алфавитном порядке.)
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Русский, Математика, Обществознание, Физика, История, Биология, Химия, Английский, Информатика, Литература, География
О правах / ctege.info@gmail.com / Архив: 2020; 2021; 2022;
2005-2023 © ctege.info При использовании материалов указывайте гиперссылку.
ЕГЭ 2003, Химия, 11 класс, Экзамен, Вариант №1201.
На выполнение экзаменационной работы по химии дается 3 часа (180 минут). Работа состоит из 3 частей и включает 50 заданий.
Часть 1 включает 35 заданий (А1 — А35). К каждому заданию дается 4 варианта ответа, из которых только один правильный.
Часть 2 состоит из 10 заданий (В 1 — В10), для которых необходимо сформулировать краткий ответ (назвать вещество, тип реакции, окислитель или восстановитель, указать направление реакции и т.д.).
Часть 3 содержит 5 самых сложных заданий по общей, неорганической и органической химии. Задания Cl — С5 требуют полного (развернутого) ответа.
Примеры.
Реакция с аммиачным раствором оксида серебра характерна для
1) 1-пропанола
2) пропаналя
3) пропановой кислоты
4) диметилового эфира
Жиры представляют собой сложные эфиры
1) этиленгликоля и низших карбоновых кислот
2) этиленгликоля и высших карбоновых кислот
3) глицерина и низших карбоновых кислот
4) глицерина и высших карбоновых кислот
При взаимодействии анилина с бромной водой образуется
1) орто-броманилин
2) 2,4,6-триброманилин
3) 3,5-диброманилин
4) мета-броманилин
Гидроксид цинка (II)
1) проявляет только основные свойства
2) проявляет только кислотные свойства
3) проявляет амфотерные свойства
4) не проявляет кислотно-основных свойств.
Бесплатно скачать электронную книгу в удобном формате, смотреть и читать:
Скачать книгу ЕГЭ 2003, Химия, 11 класс, Экзамен, Вариант №1201 — fileskachat.com, быстрое и бесплатное скачивание.
Скачать pdf
Ниже можно купить эту книгу по лучшей цене со скидкой с доставкой по всей России.Купить эту книгу
Скачать книгу ЕГЭ 2003, Химия, 11 класс, Экзамен, Вариант №1201 — pdf — depositfiles.
Скачать книгу ЕГЭ 2003, Химия, 11 класс, Экзамен, Вариант №1201
— pdf — Яндекс.Диск.
Дата публикации: 29.10.2013 12:20 UTC
Теги:
ЕГЭ по химии :: химия :: 11 класс
Следующие учебники и книги:
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2009, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2009, Химия, 11 класс, Тренировочная работа №2
- ЕГЭ 2009, Химия, 11 класс, Тренировочная работа №1
Предыдущие статьи:
- ЕГЭ 2002, Химия, 11 класс, Экзамен, Вариант №151
- ЕГЭ 2013, Химия, 11 класс, Диагностическая работа №2
- Диагностическая работа №1 по химии, ЕГЭ 2013, 11 класс, 2012
- ЕГЭ 2009 по химии, 11 класс, 37 вариантов
Анатолий Краснянский
Единый государственный экзамен (2003): дефекты типовых тестовых заданий по химии
Педагогические науки. 2004. № 4. С.21-24. М. Издательство «Вестник+»
Тысячи людей видят нелепость какого-нибудь
положения, не имея ни возможности, ни способности
начисто опровергнуть его. Георг Лихтенберг
Введение
Единый государственный экзамен в форме всеобщего тестирования – эксперимент над школьным образованием проводят уже четвертый год. Теоретикам и организаторам различного рода реформ, инноваций и модернизаций полезно напомнить, что при «старой» системе образования страна одержала победу в самой большой войне в мировой истории, создала современные технологии, в том числе ядерные и космические. Традиционный экзамен – социальное и культурное наследие, которое сохранялось (и сохранится!) в течение длительного времени. Замена традиционного экзамена на централизованное тестирование требует обоснования, как, впрочем, требует обоснования любая идея и любое конструктивное действие. Один из законов традиционной логики формулируется так: «Всякая истинная мысль должна быть достаточно обоснованной». Речь идет об обосновании истинных мыслей; ложные же мысли (идеи) доказать нельзя. Обоснование – нахождение убедительных оснований (аргументов) для принятия некоторого положения или решения. Принимать решение – это делать выбор между разными способами достижения поставленной цели на основании сравнения их возможных следствий. Структура сравнительного обоснования [1]: «Лучше принять A, чем B, в силу C», где С – совокупность аргументов. Эксперимент основан на утверждении: «Централизованное тестирование лучше традиционного экзамена». Где опубликовано и существует ли вообще системное обоснование этого утверждения? Системный подход к принятию решений сформулировал Л.Н. Толстой [2]: «Всякий предмет осматривай со всех сторон. Всякое деяние осматривай со стороны его вреда и его пользы. При всяком деянии рассматривай, сколькими способами оно может быть сделано и который из этих способов лучший. Рассматривай причины всякого явления и могущие от него быть следствия».
По-видимому, оптимизм экспериментаторов зиждется лишь на том, что с каждым годом все больше школьников сдают ЕГЭ: «В прошлом году – миллион, а в этом – два!» Но расширение масштабов эксперимента не является доказательством. Анализ педагогической литературы показывает, что многие специалисты критически относятся к ЕГЭ в форме всеобщего тестирования. Не совсем о успешности (пользы). Как и в случае ядерных аварий, губительные последствия реформ в образовании могут проявляться только через 10 – 25 лет.
Анализ педагогической литературы показывает, что многие специалисты критически относятся к ЕГЭ в форме всеобщего тестирования. Не совсем ясно, какие именно знания, умения и навыки измеряют «измерительные материалы» (тесты), насколько «объективным» является централизованное тестирование, как (конкретно!) эта «объективность» обеспечивается. Методика определения итогового количества баллов, по остроумному выражению авторов статьи [3], остается «страшной военной тайной» Центра тестирования. Идет четвертый год эксперимента (ЕГЭ), но до сих пор не выполнено необходимое условие для проведения любого экзамена: не подготовлены экзаменационные задания высокого качества. В частности, экзаменационные задания по химии (2001, 2003) содержат различного рода погрешности [3,4].
В данной статье обсуждаются химические ошибки, неточности и некоторые другие (но не все!) дефекты в типовых вариантах тестовых заданий (тестах) единого государственного экзамена 2003 года по химии. Эти тесты опубликованы в виде учебного пособия [5]. Сборник содержит 10 вариантов (10 тестов), каждый из вариантов – 30 заданий, ответы на все задания и подробные решения одного из вариантов. Первая часть каждого варианта включает 16 простых заданий А1 – А16 с выбором ответа. Вторая часть варианта включает 5 заданий А17 – А21 с выбором ответа, 7 заданий В1 – В7 с ответом в виде целого числа и два задания С1, С2 с ответом в произвольной форме.
Ошибки и неточности в типовых тестовых заданиях
1. Логически некорректный вопрос
7-В5. Сколько литров кислорода надо добавить к 50 л оксида азота(II), чтобы полученная смесь имела такую же плотность, как аммиак (при одинаковых условиях). Предпосылка вопроса – ложное суждение: «Такую смесь можно приготовить». Вопрос, основанный на ложном суждении — это логически некорректный вопрос. Логически некорректные вопросы (задачи) не имеют приавильных (истинных) ответов [6]. (Примечание: 7-В5 означает вариант 7, задание В5).
2. При правильном решении задачи получается «неправильный» ответ
9-В5. Средняя молекулярная масса воздуха – 29 г/моль. Сколько молекул азота приходится на одну молекулу кислорода в воздухе?
Ответ авторов: 3. Этот ответ ученик получит исходя из предположения, что воздух состоит только из азота и кислорода. Из системы уравнений: 28a1 + 32a2 = 29, a1 + a2 =1, следует, что a1/a2 = 3. Отношение объемных долей газов a1/a2 равно отношению числа молекул этих газов в смеси, то есть N1/N2 = 3 («правильный» ответ). Однако хорошо подготовленный выпускник может вспомнить, что воздух содержит около 1 % аргона (объемная доля a3 = 0,01). В этом случае он составит систему уравнений: 28a1+ 32a2 + 40a3 = 29, a1+a2 +a3 = 1, из которой получит, что a1/a2 = 3,7 и даст «неправильный», с точки зрения составителей тестов, ответ (в виде целого числа): N1/N2 = 4. Он может также вспомнить, что объемные доли азота и кислорода в воздухе равны соответственно 0,78 и 0,21 (a1/a2 = N1/N2 = 3,7) и опять получит «неправильный» ответ: N1/N2 = 4.
3. Некорректные формулировки заданий
1-А15. В четырех сосудах содержится по одному литру перечисленных ниже веществ с концентрацией 1 моль/л. Укажите, в каком растворе содержится больше всего ионов: 1*) K2SO4 (звездочкой здесь и далее отмечены правильные ответы – А.К.); 2) KOH; 3) H3PO4; 4) C2H5OH.
В первом предложении пропущено слово «растворов». Следует читать: «… по одному литру растворов«. Сильному ученику, в отличие от слабого, сложнее преодолеть противоречивую информацию: 1) 1 л K2SO4 (?), 2) концентрация K2SO4 1 моль/л. Такая же погрешность допущена в вопросе 6-А15.
5-А9. Вещество X может реагировать с метилбензолом, но не реагирует с бензолом. Какое это вещество? 1) H2; 2) Cl2; 3) CH3Cl; 4*) KMnO4. Правильная формулировка: «Раствор вещества X…». Хорошо известно, что после смешивания (при 20 оС) перманганата калия (в виде кристаллического порошка) с глицерином полученная смесь вскоре самовозгорается. Смеси перманганата калия с органическими веществами могут даже взрываться [7]. Поэтому перманганат калия (порошок) при определенных условиях будет реагировать как с метилбензолом, так и с бензолом. Аналогичная погрешность допущена и в задании 6-А7.
1-А20. В колбе объемом 10 л содержится 50,8 г газообразного I2, 128 г HI и 0,5 г H2. Рассчитайте константу равновесия H2(г) + I2(г) <—> 2HI(г), выраженную через молярные концентрации.
Авторы не указывают, что система находится в равновесии, но требуют рассчитать константу равновесия. Хорошо знающий химию ученик может подумать, что в этой неопределенности есть какой-то непонятный ему смысл. Аналогичная погрешность в тестах 3-А20, 7-А20, 9-А20.
5-А20. В колбе объемом 10 л установилось химическое равновесие H2(г) + I2(г) <—> 2HI(г). Равновесная концентрация иодоводорода [HI] = 0,2 моль/л. Как изменится скорость обратной реакции, если в колбу добавить 128 г HI? Обратную реакцию можно считать элементарной.
Точная формулировка: «Как изменится скорость обратной реакции в первые моменты времени после введения в колбу 128 г HI?» При быстром введении иодоводорода концентрация HI резко возрастает и, следовательно, возрастает скорость обратной реакции, но затем, согласно принципу Ле Шателье-Брауна, концентрация HI начнет снижаться до тех пор, пока в системе снова не установится равновесие, но уже при других равновесных концентрациях всех участвующих в процессе компонентов. Аналогичные погрешности имеют задания: 6-А20, 8-А20, 10-А20.
6-А11. Укажите пару веществ, которые смешиваются друг с другом в любых отношениях: 1) H2O, NaOH; 2*) H2O, C2H5OH; 3) H2O, Br2; 4) C6H6 , NaCl.
При смешивании веществ образуется смесь веществ, эта смесь может быть как гомогенной (однородной), так и гетерогенной системой. Точная формулировка: «Укажите пару веществ, которые смешиваются друг с другом в любых отношениях с образованием однородной системы«.
9-А14. Авторы считают (судя по ответу на задание), что наличие сероводорода в загрязненном воздухе можно установить с помощью реакции H2S + Pb(NO3)2 = PbS(осадок) + HNO3. Можно, но не нужно. Это задание противоречит здравому смыслу. Дело в том, что для обнаружения H2S в воздухе не имеет смысла проводить какие-либо химические реакции. Органы обоняния человека, расположенные в задней части полости носа, позволяют обнаружить наличие сероводорода даже при очень низкой (меньше предельно допустимой) концентрации в воздухе. Задание 9-А14 лучше сформулировать так: «Концентрацию сероводорода в воздухе можно определить с помощью реакции…». Можно, но нелегко: проведение аналитических реакций при очень низких концентрациях веществ (ПДК — предельно допустимая концентрация H2S в воздухе 0,008 мг/м3) связано с большими трудностями.
3-А14. Авторы уверены (судя по ответу на задание), что наличие фтороводорода в загрязненном воздухе можно установить с помощью реакции 4HF + SiO2 = SiF4 + 2H2O. Как можно обнаружить присутствие HF в воздухе, если реакция HF (газ) с диоксидом кремния протекает медленно (даже при повышенной температуре), тетрафторид кремния – бесцветный газ, а ПДК HF в воздухе 0,005 мг/м3?
4. Ошибка в термине
5-А2. Кристалл поваренной соли состоит из… 1) молекул NaCl; 2) молекул Na и Cl2; 3*) ионов Na+ и Cl—; 4) атомов натрия и хлора, соединенных полярными ковалентными связями. Ответ 2) следует сформулировать так: атомов Na и молекул Cl2.
5. Случайные ошибки и дефекты, присущие тестовым заданиям
4-А15. В этом задании указаны несуществующие в природе ионы AlOH+ (вместо AlOH2+) – случайная ошибка.
2-А14. При пропускании избытка оксида серы(IV) через известковую воду (раствор гидроксида кальция) происходит реакция… 1) Ca(OH)2 + SO2 = CaSO3+ H2O; 2*) Ca(OH)2 + 2SO2 = Ca(HSO3)2 + H2O; 3) Ca(OH)2 + SO2 = CaSO4 + H2; 4) Ca(OH)2 + 2SO2 + H2O = Ca(HSO4)2 + H2. Ошибку авторов в в уравнении 2* можно считать случайной ошибкой. Отметим, что уравнения 3) и 4) – это ложная информация. Из четырех уравнений два не соответствуют реальным процессам. Ложная информация в виде химических уравнений, не отражающих реальные процессы, содержится также в заданиях: 2-А8, 3-А8, 4-А14, 5-А14, 6-А14, 7-А14, 7-А15, 8-А14, 10-А14. Ложная информация (дефект тестовых заданий) наносит вред школьникам, сдающим ЕГЭ.
6. Ошибки авторов [5] при операции: «Указать правильный ответ»
Авторы сборника тестов [5]сделали подробный разбор первого варианта. Они правильно ответили на ими же составленные задания (что неудивительно), но ошиблись при указании ответов на задания: 1-А8 [3) вместо 4)], 1-А20 [1) вместо 2)], 1-В6 [4 г/моль вместо 282 г/моль]. Таким образом, операция: «указать правильный ответ в тесте», как невольно доказали сами авторы тестов (!), может быть источником ошибки в каждом десятом задании и это – в комфортных условиях! Школьник, в отличие от авторов [5], во время выполнения заданий находятся в стрессовом состоянии, выполняет задания в одиночку, при этом никто его ответы не редактирует. Таким образом, ЕГЭ сам по себе является источником случайных ошибок, причем, в отличие от традиционного экзамена, ЕГЭ в форме автоматизированной проверки заданий не отличает случайную ошибку при обозначении правильного ответа в тестовом задании, от неправильного (по существу) ответа.
Выводы
1. Тестовые задания по химии ЕГЭ содержат химические ошибки и неточности, причем нет тенденции (2001 – 2003) к повышению качества тестов. 2. Можно ожидать, что хорошо знающим химию ученикам труднее, чем слабым ученикам, преодолевать неточности в формулировках заданий. 3. ЕГЭ, в отличие от традиционного экзамена, не является видом учебно-познавательной деятельности. Он наносит вред ученикам, так как задания содержат большое количество ложной информации. 4. ЕГЭ в форме автоматизированной проверки заданий не отличает случайную ошибку – неправильное обозначение истинного ответа в задании, от ложного ответа.
Литература
[1] А.А. Ивин, А.Л. Никифоров. Словарь по логике. М.: «Владос». 1998.
[2] Л.Н. Толстой. Правила для развития обдуманности.
[3] В.В. Загорский, Е.А.Менделеева, Н.И. Морозова. Как мы «поиздевались» над нашими школьниками. Химия в школе. № 3. 2002.
[4] Ошибки в заданиях ЕГЭ (2003): httr://www.chem.msu.su/rus/school/ege-errors/.html.
[5] О.Н. Рыжова, Е.А. Еремина. Единый государственный экзамен. Химия. Типовые тестовые задания: Учебно-практическое пособие. Под общей ред. Н.Е. Кузьменко. М.: «Экзамен». 2003.
[6] Ю.В. Ивлев. Логика. М.: «Проспект». 2002.
[7] Химическая энциклопедия. Том 2. М. 1990.
libcats.org
Главная →
Экзаменационный вариант ЕГЭ 2003 г. Химия
Экзаменационный вариант ЕГЭ по химии за 2003 год.
Скачать книгу бесплатно (pdf, 367 Kb)
Читать «Экзаменационный вариант ЕГЭ 2003 г. Химия»
EPUB | FB2 | MOBI | TXT | RTF
* Конвертация файла может нарушить форматирование оригинала. По-возможности скачивайте файл в оригинальном формате.
Популярные книги за неделю:
#1
Ф.И.Бурдейный, Н.В.Казанский. Карманный справочник радиолюбителя-коротковолновика (1959, DjVu)
440 Kb
#2
Я.Войцеховский. Радиоэлектронные игрушки (1977, djvu)
13.76 Mb
#3
Подготовка саперов, подразделений специального назначения по разминированию
Категория: Научно-популярная литература (разное)
1.49 Mb
#4
128 советов начинающему программисту
Очков В.Ф., Пухначев Ю.В.
Категория: computers, computers, prog
8.91 Mb
#5
Английский язык в картинках
I.A. Richards; Christine M. Gibson
Категория: Иностранные языки
5.77 Mb
#6
Ограждение участка. Ограды. Заборы. Калитки. Ворота
В.И.Рыженко
Категория: Строительство
1.23 Mb
#7
Эти загадочные зеркала
В. Правдивцев
Категория: Религия. Эзотерика
88.19 Mb
#8
Самоделки школьника
Тарасов Б.В.
Категория: science, science, technical, hobby, oddjob
41.91 Mb
#9
Наука и жизнь.Маленькие хитрости
Категория: E_Engineering, EM_Mechanics of elastic materials
3.50 Mb
#10
Каталог почтовых марок 1857-1991. Россия, РСФСР, СССР
В.Б. Загорский
Категория: КНИГИ ХОББИ и РАЗВЛЕЧЕНИЯ
139.85 Mb
Только что пользователи скачали эти книги:
#1
Заметки о международном браке по Интернет
Автор неизвестен
Категория: Юмор
41 Kb
#2
Геометрическая алгебра
Артин Э.
Категория: Mathematics, Algebra
3.59 Mb
#3
Ремонт двигателей зарубежных автомобилей
А.Э.Хрулев
Категория: civil, civil, transport
14.87 Mb
#4
Криминология
Шиханцов Г.Г.
Категория: Юридические науки учебная литература
466 Kb
#5
Справочник по математике для инженеров и учащихся ВТУЗов
Бронштейн И.Н., Семендяев К.А.
Категория: Энциклопедии, справочники, учебники
9.06 Mb
#6
Арифметика
Магницкий Л.Ф.
Категория: science, science, exact
21.19 Mb
#7
Общая хирургия
Петров С.В.
32.57 Mb
#8
Моя первая книга (от 6 мес до 3 лет)
Астахова А.А.
Категория: Children
31.77 Mb
#9
Энциклопедия «Современное естествознание в 10 томах», физика конденсированных сред
Сойфер В.Н. (Главный редактор энциклопедии), Струков Б.А., Грибов В.А.
Категория: science, science, exact
15.22 Mb
#10
Курс качественного химического полумикроанализа
Алексеев В.Н.
Категория: КНИГИ НАУКА и УЧЕБА
15.14 Mb
ЭКЗАМЕНЫ НЕ ЗА
ГОРАМИ
ГОТОВИМСЯ К ЕДИНОМУ
ГОСУДАРСТВЕННОМУ ЭКЗАМЕНУ
ПО ХИМИИ
Единый государственный экзамен (ЕГЭ)
проводится с целью создания системы
объективного контроля подготовки выпускников
общеобразовательных учреждений и абитуриентов,
поступающих в средние и высшие специальные
учебные заведения. Достаточно массовый характер
проводимого эксперимента по введению единого
государственного экзамена создал необходимость
разработки для выпускников школ и абитуриентов,
а также для учителей специальных рекомендаций.
Некоторые сведения по порядку
проведения
и структуре ЕГЭ
ЕГЭ проводится в школах России в качестве
эксперимента с 2001 г., Министерство образования
Российской Федерации своим приказом за № 1306 от 9
апреля 2002 г. утвердило Положение о проведении
ЕГЭ. Его проведение осуществляется в субъектах
Российской Федерации Государственной
экзаменационной комиссией (ГЭК).
Организационно-технологическое обеспечение ЕГЭ
проводится Центром тестирования Минобразования
России и уполномоченными организациями в
субъектах Российской Федерации, участвующих в
эксперименте по введению ЕГЭ.
ЕГЭ осуществляется практически по всем
общеобразовательным предметам, определенным
Минобразованием России. В 2003 г. ЕГЭ проводился по
следующим предметам: русскому языку, математике,
физике, химии, биологии, истории, обществознанию,
географии, английскому, французскому, немецкому
языкам и литературе. Форма, сроки и
продолжительность ЕГЭ по различным предметам
определены приказом Минобразования России.
О своем желании участвовать в ЕГЭ выпускник
должен окончательно заявить администрации
своего учебного заведения до 25 апреля года
проведения экзамена. ЕГЭ проводится по
расписанию, утвержденному Минобразованием
России, где также предусмотрены резервные дни
для выпускников, пропустивших ЕГЭ по
уважительным причинам.
Все выпускники, участвующие в ЕГЭ, до 15 мая
текущего года должны получить у администрации
своего учреждения пропуск, где указываются
предметы ЕГЭ, адрес пункта проведения, дата и
время начала экзаменов. Для участия в ЕГЭ
выпускник должен явиться в пункт проведения в
день и время, указанные в пропуске, и иметь при
себе пропуск, паспорт, а также гелевую,
капилярную или перьевую ручку с черными
чернилами. Каждый выпускник должен внимательно
ознакомиться с выданным ему заданием. По-другому
задания называют контрольно-измерительными
материалами (КИМы). Бланк ЕГЭ содержит задания
трех типов: А, В, С.
В заданиях типа А выпускникам предлагается
выбрать правильный ответ из нескольких
предлагаемых вариантов. В бланке ответов № 1 для
каждого такого задания под заголовком «Номера
заданий типа А с выбором ответа из предложенных
вариантов» выпускник должен под номером задания
отметить знаком «Х» ту клетку, номер которой
соответствует номеру выбранного ответа.
В заданиях типа В выпускникам необходимо дать
ответ в виде последовательности символов (не
более 17). В бланке ответа № 1 для таких заданий
выделены поля с заголовком «Результаты
выполнения заданий типа В с ответом в краткой
форме». Выпускник должен аккуратно вписать свой
ответ рядом с номером задания, причем ответ
записывается печатными буквами или цифрами по
образцу, помещенному в верхней части бланка
ответов. При этом не допускается запись формул
или математических выражений. Какие-либо
словесные заголовки или комментарии к числу
писать не разрешается.
В заданиях типа С выпускникам предлагается
дать развернутый ответ в виде решения задачи или
краткого рассказа, которые записывают в бланке
ответов № 2. При недостатке места для ответов на
лицевой стороне бланка № 2 продолжение ответов
можно писать на его оборотной стороне.
Результаты ЕГЭ определяются на основании
ответов выпускников в заполненных полях бланков
ответов № 1 и № 2.
Результаты ЕГЭ объявляются выпускникам в виде
баллов по стобалльной системе и отметок по
пятибалльной системе. Проставление отметок в
аттестат о среднем (полном) образовании по
результатам ЕГЭ осуществляется в соответствии с
Положением о едином государственном экзамене.
Результаты ЕГЭ, указанные в свидетельстве,
признаются участвующими в эксперименте вузами в
качестве результатов вступительных испытаний на
направления подготовки и специальности,
включенные в эксперимент. По решению ученых
советов результаты ЕГЭ могут также учитываться
вузами, не участвующими в эксперименте.
Характеристика ЕГЭ по химии
На выполнение экзаменационного задания по
химии отводится 3 ч (180 мин). Экзаменационная
работа состоит из трех частей и включает 50
заданий.
Первая часть включает 35 заданий (А1–А35). К
каждому заданию дается 4 варианта ответа, из
которых только один правильный. Вторая часть
состоит из 10 заданий (В1–В10), для которых
необходимо сформулировать краткий ответ.
Например, назвать вещество, тип реакции,
окислитель или восстановитель, указать
направление реакции и т.д. Третья часть
работы содержит пять самых сложных заданий по
всему курсу химии (общей, неорганической и
органической). Эти задания требуют полного
развернутого ответа на отдельных листах. Все
необходимые черновые записи можно также делать
на этих листах. Ответы следует писать четко и
разборчиво.
Необходимо внимательно прочитать каждое
задание и предлагаемые варианты ответов, если
они имеются. Отвечать следует только после того,
как вопрос понят и проанализированы все варианты
ответа. Задания выполнять лучше в том порядке, в
котором они даны. Для экономии времени можно
пропустить задание, которое не удается выполнить
сразу, и перейти к следующему. К пропущенному
заданию можно вернуться после выполнения всей
работы, если останется время.
Чтобы получить удовлетворительную оценку («3»),
достаточно выполнить верно любые 20 заданий из
первой (А) и второй (В) частей работы. Оценка «4»
ставится, если выполнено верно не менее 38 заданий
из первой и второй частей. Для получения отличной
оценки («5») необходимо выполнить задания из всех
частей работы. При этом не требуется выполнить
все задания, но среди верно выполненных должно
быть не менее трех заданий из третьей части (С) и
не менее 40 заданий из первой (А) и второй (В)
частей.
Вариант задания ЕГЭ по химии
Данное задание представлено в таком виде, как
это дается в рамках ЕГЭ по химии. Такое задание
можно предложить учащимся для самостоятельной
работы в качестве тренировки и самоконтроля
знаний по химии. Для проверки правильности
выполнения приведенного варианта задания после
его текста приведены ответы на все вопросы.
А. Задания с выбором ответа из
предложенных вариантов
A1. Атом стронция имеет электронную формулу:
1) 1s22s22p63s23p64s2;
2) 1s22s22p63s23p63d104s2;
3) 1s22s22p63s23p63d104s24p65s2;
4) 1s22s22p63s23p63d104s24p64d105s2.
А2. У атома таллия валентные электроны
находятся на орбиталях:
1) 6s25p1; 2) 6s26p1;
3) 6s24f1; 4) 6s25f1.
А3. Тип кристаллической решетки вещества
определяется:
1) видом химической связи между частицами,
находящимися в узлах кристаллической решетки;
2) частицами, находящимися в узлах
кристаллической решетки;
3) физическими свойствами вещества;
4) расположением частиц в пространстве.
А4. За счет только ковалентных полярных
связей образованы молекулы веществ в ряду:
1) NaCl, N2, HCl; 2) O2,F2,H2;
3) KF, H2O, HCl; 4) HCl, CH4, H2O.
А5. Степень окисления хрома в соединении Fe(CrO2)2:
1) 0; 2) +1; 3) +3; 4) +6.
А6. Из приведенных ниже молекул газов
наиболее прочной является:
1) H2; 2) F2; 3) N2; 4) O2.
А7. Для оснований не характерно утверждение:
1) сложные вещества, в которых каждый атом
металла связан с одной или несколькими
гидроксигруппами;
2) взаимодействуют с кислотами;
3) взаимодействуют с кислотными оксидами;
4) взаимодействуют с основными оксидами.
А8. Из опытов, иллюстрирующих химические
свойства хлора, при обычных условиях можно
осуществить:
1) горение сурьмы в хлоре;
2) горение меди в хлоре;
3) взаимодействие хлора с натрием;
4) взаимодействие хлора с железом.
А9. С ростом порядкового номера элемента
кислотные свойства оксидов в ряду
N2О3–P2O3–As2O3–Sb2O3–Bi2O3:
1) усиливаются;
2) ослабевают;
3) остаются неизменными;
4) усиливаются, затем ослабевают.
А10. В пробирку с нитратом цинка добавили
немного гидроксида натрия. Образовался осадок.
Его разделили на две части. В первую часть
добавили раствор соляной кислоты, а во вторую –
раствор гидроксида калия. При этом оказалось,
что:
1) с осадком ничего не произошло;
2) в первой части осадок растворился, а во второй
не растворился;
3) в первой части осадок не растворился, а во
второй растворился;
4) в обеих частях осадок растворился.
А11. Нельзя использовать для перевода
гидроксида железа(III) в растворимое состояние
раствор вещества:
1) NaOH; 2) HCl; 3) H2SO4; 4) CH3COOH.
А12. Из газов: хлороводород, оксид
углерода(IV), метан, аммиак – попарно
несовместимы:
1) NH3 и HCl; 2) CO2 и CH4;
3) CO2 и HCl; 4) NH3 и CH4.
А13. Наличие пентина-1 среди таких
углеводородов, как пропен, бутан, гексадиен,
можно определить реакцией с:
1) бромной водой;
2) аммиачным раствором оксида серебра(I);
3) водородом;
4) подкисленным раствором перманганата калия.
А14. К дисахаридам относится ряд:
1) сахароза, мальтоза, лактоза;
2) рибоза, глюкоза, фруктоза;
3) крахмал, манноза, рибоза;
4) целлюлоза, сахароза, лактоза.
А15. Толуол в лаборатории преимущественно
получают:
1) фракционной перегонкой нефти;
2) фракционной перегонкой каменноугольной
смолы;
3) дегидрированием метилциклогексана;
4) акилированием бензола.
А16. Сложный эфир имеет следующую
структурную формулу:
CH3–CH2–CО–O–CH3.
Название этого соединения:
1) метиловый эфир пропионовой кислоты;
2) этиловый эфир уксусной кислоты;
3) метиловый эфир уксусной кислоты;
4) этилпропионат.
А17. Глюкоза обладает химическими
свойствами, характерными для:
1) альдегидов и предельных углеводородов;
2) непредельных углеводородов;
3) спиртов и карбоновых кислот;
4) многоатомных спиртов и альдегидов.
А18. Из перечисленных ниже веществ основные
свойства наиболее выражены у:
1) аммиака; 2) этиламина;
3) диэтиламина; 4) метиламина.
А19. При действии на анилин хлороводорода
получается вещество, относящееся к классу:
1) солей; 2) кислот;
3) жиров; 4) аминокислот.
А20. Растворение одного моля безводной соды
идет с выделением 25 кДж теплоты, а растворение
одного моля кристаллогидрата с поглощением 67 кДж
теплоты. Тепловой эффект реакции гидратации
безводной соды равен (кДж):
1) +92; 2) –42; 3) +42; 4) –92.
А21. Считая, что реакция
2А + Б В
идет в одну стадию, выражение для скорости
реакции запишется:
1) = k[B]; 2)
= k[A]2;
3) = k[A][Б]; 4)
= k[A]2[Б].
А22. Равновесие системы, описываемое
уравнением
N2 (г.) + 3H2 (г.) = 2NH3 (г.),
при повышении давления сдвигается таким
образом, что образуется:
1) больше NH3 (г.);
2) больше H2 (г.);
3) больше N2 (г.) и H2(г.);
4) никаких изменений в количествах реагентов и
продуктов реакции не наблюдается.
А23. Постоянную жесткость воды нельзя
устранить:
1) кипячением;
2) добавлением раствора фосфата калия;
3) добавлением соды;
4) пропусканием через катионообменную смолу.
А24. Из реакций не может быть использована
для получения карбоната кальция:
1) CaCl2 (р-р) + Na2CO3 (р-р) … ;
2) CaCl2 (р-р) + CO2 … ;
3) Ca(OH)2 + CO2 (г.) … ;
4) Ca(OH)2 (р-р) + Na2CO3 (р-р) … .
А25. Приведенной схеме
M – ne Mn+
соответствует уравнение реакции:
1) 2KOH + H2SO4 = K2SO4 + 2H2O;
2) CaO + CO2 = CaCO3;
3) Mg + 2HCl = MgCl2 + H2;
4) FeO + H2 = Fe + H2O.
А26. Чтобы усилить гидролиз сульфида натрия,
к его водному раствору необходимо добавить:
1) NaOH; 2) Ca(OH)2; 3) Na2SO4; 4) H2SO4.
А27. При приливании раствора карбоната
натрия к раствору хлорида алюминия(III):
1) выпадает белый осадок;
2) выделяется газ;
3) выпадает осадок и выделяется газ;
4) видимых изменений не происходит.
А28. При окислении 0,25 моль сахарозы (н.у.)
образуется следующий объем (л) оксида углерода(IV):
1) 0,13; 2) 7,5; 3) 36; 4) 67,2.
А29. Получить 2-метилпентановую кислоту
можно из спирта:
1) 2-метилпентанол-5; 2) 2-метилпентанол-1;
3) 3-метилпентанол-2; 4) 2-метилпентанол-3.
А30. В двух склянках без этикеток находятся
растворы глюкозы и фруктозы. Их можно достаточно
надежно различить следующим образом:
1) визуально, сравнив цвет растворов;
2) по различию во взаимодействии продуктов их
гидролиза с аммиачным раствором оксида серебра;
3) взвесив склянки с растворами;
4) по различию во взаимодействии растворов с
аммиачным раствором оксида серебра.
А31. Водород при обычных условиях не может
образоваться в результате реакции:
1) Zn + HNO3 (разб.) … ;
2) Zn + H2SO4 (разб.) … ;
3) Al + NaOH + H2O … ;
4) Al + HCl (разб.) … .
А32. От примеси сероводорода очистить
водород можно пропусканием последнего через
раствор:
1) соляной кислоты; 2) серной кислоты;
3) нитрата свинца(II); 4) хлорида натрия.
А33. Продуктом взаимодействия многоатомного
спирта – глицерина – и азотной кислоты является
нитроглицерин, который относится к классу:
1) нитросоединений; 2) сложных эфиров;
3) глицератов; 4) жиров.
А34. При брожении глюкозы массой 180 г
получена молочная кислота массой 153 г. Массовая
доля выхода (в %) молочной кислоты составляет:
1) 42,5; 2) 52,3; 3) 85,0; 4) 95,0.
А35. Для полного восстановления 9,5 кг оксида
железа(III) необходим оксид углерода(II) объемом (м3):
1) 4; 2) 3; 3) 2; 4) 1.
В. Задания с кратким ответом
В1. В ядре иона Mn2+ содержится протонов …
.
В2. Массовая доля (в %) сульфата натрия в
растворе, полученном растворением 10 г его
десятиводного кристаллогидрата в 100 г воды, равна
… .
В3. В цепи превращений
этин бензол
Х
анилин
вещество «Х» называется … (по систематической
номенклатуре).
В4. При электролизе водного раствора
хлорида натрия на аноде выделилось три литра
хлора (н.у.). За это же время на катоде выделился
газ … объемом … (л).
В5. При бромировании 112 мл (н.у.) предельного
углеводорода образовалось 1,62 г бромоводорода.
Число атомов водорода, замещенных в молекуле
углеводорода бромом, равно … .
В6. Предложенные ниже названия способов
получения спиртов расположите в таблице в
соответствии с уравнениями реакций:
а) ферментативный синтез;
б) получение из синтез-газа;
в) синтез из галогенпроизводных углеводородов;
г) гидратация этилена.
| Уравнения реакций | Название способа |
|---|---|
| 1) CH2=CH2 + H2O |
|
| Ni, 900 °C, р 2) CH4 + H2O |
|
| дрожжи 3) C6H12O6 |
|
| 4) C5H11Cl + KOH |
В7. В свободном виде этот
моносахарид содержится почти во всех органах
зеленых растений. Особенно его много в соке
винограда, именно поэтому его иногда называют
виноградным сахаром. Моносахарид, о котором идет
речь, – это … .
В8. Одну из аминокислот получают при
взаимодействии аммиака с хлоруксусной кислотой.
Как и все аминокислоты, она представляет собой
белое кристаллическое вещество, растворимое в
воде. Эта аминокислота называется … .
В9. К водному раствору медного купороса
прилили в избытке раствор щелочи. Выпавший
осадок отфильтровали, промыли водой, высушили и
прокалили. Полученный твердый остаток нагрели в
атмосфере водорода. При этом получилось
вещество, которое называется … .
В10. При взаимодействии 10 г смеси железных и
медных опилок с избытком соляной кислоты
выделилось 2,24 л водорода (н.у.). Массовая доля (в %)
меди в смеси составляет … .
С. Задания с развернутым ответом
С1. Как и во сколько раз изменится давление к
моменту наступления равновесия реакции синтеза
аммиака, протекающей в закрытом сосуде при
постоянной температуре, если начальные
концентрации азота и водорода в смеси равны
соответственно 2 и 6 моль в литре смеси и
равновесие наступит тогда, когда прореагирует 10%
азота?
С2. При сжигании 0,9 г газообразного вещества,
масса 1 л которого при нормальных условиях равна
1,34 г, получено 672 мл углекислого газа (н.у.) и 0,54 г
воды. Определите молекулярную формулу вещества.
Какой примерно объем воздуха необходим для
полного сгорания 1 м3 этого вещества?
(Считать, что в воздухе примерно 20% кислорода по
объему.)
С3. Напишите уравнения реакций,
соответствующих следующей cхеме:
железо хлорид железа(II)
нитрат железа(II)
гидроксид железа(II)
гидроксид железа(III)
оксид железа(III)
железо.
С4. Через 100 мл 32%-го раствора гидроксида
калия ( = 1,32 г/мл)
пропустили весь оксид углерода(IV), который
образовался при сжигании 18 л метана (н.у.).
Определите состав и массу образовавшейся соли.
С5. Напишите уравнения реакций,
соответствующих приведенной ниже схеме:
Назовите вещества А и Б (по систематической
номенклатуре). Напишите уравнение реакции
полимеризации вещества Б и назовите
получившийся продукт.
Ответы к варианту задания ЕГЭ по химии
Ответы на задания с выбором ответа
(задания группы А)
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 | А11 | А12 |
| 3 | 2 | 2 | 4 | 3 | 3 | 4 | 1 | 2 | 4 | 1 | 1 |
| А13 | А14 | А15 | А16 | А17 | А18 | А19 | А20 | А21 | А22 | А23 | А24 |
| 2 | 1 | 4 | 1 | 4 | 3 | 1 | 1 | 4 | 1 | 1 | 2 |
| А25 | А26 | А27 | А28 | А29 | А30 | А31 | А32 | А33 | А34 | А35 | |
| 3 | 4 | 3 | 4 | 2 | 4 | 1 | 3 | 2 | 3 | 1 |
Ответы на задания с
кратким ответом
| В1 | В2 | В3 | В4 | В5 | В6 | В7 | В8 | В9 | В10 |
| 25 | 4 | Нитро- бензол |
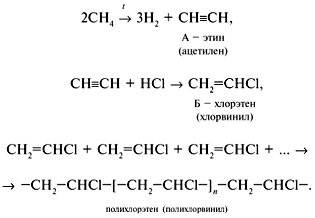
Водород, три |
4 | г, б, а, в | Глюкоза | Глицин | Медь | 44 |
Ответы на задания с
развернутым ответом
С1. Поскольку давление прямо пропорционально
концентрации, то достаточно узнать число молей
частиц в 1 л смеси до начала реакции и сопоставить
их с числом молей частиц в момент равновесия.
Уравнение реакции синтеза аммиака:
N2 + 3H2 = 2NH3.
Исходя из данных о начальной концентрации N2
и H2, находим общее число молей частиц до
реакции: 2 + 6 = 8 моль. Затем по уравнению реакции
находим число молей частиц в момент равновесия.
В реакцию вступило 10% азота, что составляет: 2•0,1
= 0,2 моль. На это количество азота израсходовалось
0,6 моль водорода, и к моменту равновесия
образовалось 0,4 моль аммиака. Равновесная
концентрация азота: 2 – 0,2 = 1,8 моль; равновесная
концентрация водорода: 6 – 0,6 = 5,4 моль. Общее число
молей частиц в момент равновесия: 5,4 + 1,8 + 0,4 = 7,6
моль. В начальный момент общее число частиц было
больше (8 моль). Значит, давления уменьшилось (8/7,6 =
1,05) в 1,05 раза.
С2. Образование углекислого газа указывает
на наличие в исходном веществе атомов углерода.
По объему углекислого газа находим массу
углерода, используя соотношения:
(C) =
(CO2),
(CO2) = V/VM,
m(C) = (C)•M(C)
= (0,672/22,4)•12 = 0,36 г.
По массе воды находим массу водорода в исходном
веществе:
(Н2О)
= m/M, (Н) = 2
(Н2О),
m(H) = 2(0,54/18)•1 = 0,06 г.
Сумма масс углерода и водорода в исходном
веществе равна: 0,36 + 0,06 = 0,42 г.
При сопоставлении с массой исходного вещества
делаем вывод о наличии в нем атомов кислорода.
Масса кислорода в исходном веществе равна:
0,9 – 0,42 = 0,48 г.
В общем виде формулу вещества можно
представить так: СxHyOz.
На основе закона постоянства состава и значений
масс углерода, водорода и кислорода в веществе
можно вывести простейшую формулу этого вещества.
12х : y : 16z = 0,36 : 0,06 : 0,48;
х : y : z = 0,03 : 0,06 : 0,03.
Заменив отношение дробных чисел на отношение
целых чисел, получаем:
х : y : z = 1 : 2 : 1,
и простейшая формула вещества – СН2О.
Из данных задачи находим молярную массу
вещества: 22,4•1,34 = 30 г/моль. Сопоставив ее со
значением относительной молекулярной массы
вещества простейшей формулы (Mr(CH2O)
= 30), приходим к выводу, что численно они
совпадают. Значит, молекулярная формула вещества
– СН2О.
Уравнение реакции горения вещества:
СН2О + О2 СО2 + Н2О.
Из уравнения реакции видно, что на 1 м3
вещества требуется 1 м3 кислорода.
Следовательно, воздуха потребуется в пять раз
больше по объему, т.е. 5 м3.
С3. Fe + 2HCl = FeCl2 +H2,
FeCl2 + 2AgNO3 = 2AgCl
+ Fe(NO3)2,
Fe(NO3)2 + 2NaOH = Fe(OH)2+ 2NaNO3,
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3,
2Fe(OH)3 Fe2O3
+ 3H2O,
Fe2O3 + 3H2
2Fe + 3H2O.
С4. Уравнение реакции горения метана:
Число молей СО2 равно:
18/22,4 = 0,8 моль.
Число молей КОН равно:
(100•1,32•0,32)/56 = 0,754 моль.
В этих условиях реакция идет с образованием
только кислой соли:
Зная молярную массу соли:
М(КНСО3) = 100 г/моль,
находим массу соли: 0,754•100 = 75,4 г.
C5. СН3СООNa + NaOH
Na2CO3 + CH4,
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Хомченко Г.П. Химия (для подготовительных
отделений). М.: Высшая школа, 1993; Горбунова В.В.,
Новикова Т.А., Злотников Э.Г. Химия. Пособие для
поступающих в вузы. Под ред. Э.Г.Злотникова. СПб.:
Изд-во РГПУ им. А.И.Герцена, изд-во «Союз», 2002; Лидин
Р.А., Молочко В.А. Химия для абитуриентов. От
средней школы к вузу. М.: Химия, 1993; Хомченко Г.П.,
Хомченко И.Г. Задачи по химии для поступающих в
вузы. М.: Высшая школа, 1993; Сорокин В.В., Злотников
Э.Г. Химия в тестах (пособие по химии для
школьников и абитуриентов). СПб.: Химия, 1996; Сорокин
В.В., Злотников Э.Г. Тесты по химии. М.:
Просвещение, 1997; Злотников Э.Г. Краткий
справочник по химии. (Серия «Карманный
справочник».) 2-е изд. СПб.: Питер, 2003, 2005.
Э.Г.ЗЛОТНИКОВ,
доцент Российского
государственного педагогического
университета им. А.И.Герцена
(Санкт-Петербург)
Рубрика «Химия варианты»
Тренировочный вариант ЕГЭ 2023 по химии №3 с ответами
Тренировочный вариант ЕГЭ 2023 по химии №3 с ответами «ЕГЭ 100 БАЛЛОВ». Пробные варианты ЕГЭ по химии 2023. ЕГЭ химия. https://vk.com/ege100ballov https://vk.com/chemistry_100 скачать Примеры некоторых заданий из варианта Смотрите также: Тренировочный вариант ЕГЭ 2023 по химии №2 с ответами
Читать далее
Тренировочный вариант ЕГЭ 2023 по химии №2 с ответами
Тренировочный вариант ЕГЭ 2023 по химии №2 с ответами «ЕГЭ 100 БАЛЛОВ». Пробные варианты ЕГЭ по химии 2023. ЕГЭ химия. https://vk.com/ege100ballov https://vk.com/chemistry_100 скачать Примеры некоторых заданий из варианта Смотрите также: Тренировочный вариант ЕГЭ 2023 по химии №1 с ответами
Читать далее
Тренировочный вариант ЕГЭ 2023 по химии №1 с ответами
Тренировочный вариант ЕГЭ 2023 по химии №1 с ответами «ЕГЭ 100 БАЛЛОВ». Пробные варианты ЕГЭ по химии 2023. ЕГЭ химия. https://vk.com/ege100ballov https://vk.com/chemistry_100 скачать Примеры некоторых заданий из варианта Смотрите также: Демоверсия ЕГЭ 2023 по химии с ответами
Читать далее
Демоверсия ЕГЭ 2023 по химии с ответами
Демоверсия ЕГЭ 2023 по химии с ответами. Демонстрационный вариант ЕГЭ 2023 г. ХИМИЯ, 11 класс. Единый государственный экзамен по ХИМИИ. скачать Кодификатор — скачать Спецификация — скачать Смотрите также: Демоверсия ЕГЭ 2022 по химии с ответами
Читать далее
Реальный вариант ЕГЭ по химии 2022
Реальный вариант ЕГЭ по химии 2022. Реальные варианты егэ химия 2022 скачать
Читать далее
Открытый вариант КИМ ЕГЭ по химии 2022
Открытый вариант КИМ ЕГЭ по химии 2022. Открытые варианты КИМ ЕГЭ 2022 ФИПИ. Реальный вариант с досрочного ЕГЭ 2022 по химии. Опубликованы открытые варианты контрольных измерительных материалов единого государственного экзамена 2022 года скачать
Читать далее
Тренировочный вариант ЕГЭ 2022 по химии №9 с ответами
Тренировочный вариант ЕГЭ 2022 по химии №9 с ответами «ЕГЭ 100 БАЛЛОВ». Пробные варианты ЕГЭ по химии 2022. ЕГЭ химия. https://vk.com/ege100ballov https://vk.com/chemistry_100 скачать Примеры некоторых заданий из варианта Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Ca 2) O 3) S 4) Cr 5) Se Ответом в заданиях 1–3 является последовательность цифр, под …
Читать далее
Тренировочный вариант №2 ЕГЭ 2022 по химии ChemFamily
Тренировочный вариант №2 ЕГЭ 2022 по химии ChemFamily. Авторский вариант ГЭ 2022 по химии с ответами. https://vk.com/gofor200 скачать Смотрите также: Тренировочный вариант №1 ЕГЭ 2022 по химии ChemFamily
Читать далее
Тренировочный вариант №1 ЕГЭ 2022 по химии ChemFamily
Тренировочный вариант №1 ЕГЭ 2022 по химии ChemFamily. Авторский вариант ГЭ 2022 по химии с ответами. https://vk.com/gofor200 скачать Смотрите также: Досрочный ЕГЭ 2022 по химии от 21.03.2022 Елена Тарасова
Читать далее
Досрочный ЕГЭ 2022 по химии от 21.03.2022 Елена Тарасова
Досрочный ЕГЭ 2022 по химии от 21.03.2022 Елена Тарасова. Досрочный вариант ЕГЭ по химии 2022. Полный разбор скачать
Читать далее