|
«Заголовок» |
(«Вариант» — 1 ) |
|
«УТВЕРЖДАЮ» |
|
|
Руководитель Департамента |
|
|
общего и дошкольного образования |
|
|
Минобразования России |
|
|
______________________ А.В.Баранников |
|
|
«_______» __________________ 2003 г |
|
|
Единый государственный экзамен по ХИМИИ |
|
|
Демонстрационный вариант 2004 г. |
|
|
Инструкция по выполнению работы |
На выполнение экзаменационной работы по химии дается 3 часа (180 минут). Работа состоит из 3 частей и включает 50 заданий.
Часть 1 включает 35 заданий (А1 – А35). К каждому заданию дается 4 варианта ответа, из которых только один правильный.
Часть 2 состоит из 10 заданий (В1 – В10), для которых необходимо сформулировать краткий ответ (назвать вещество, тип реакции, окислитель или восстановитель, указать направление реакции и т.д.).
Часть 3 содержит 5 самых сложных заданий по общей, неорганической и органической химии. Задания C1 – C5 требуют полного (развернутого) ответа.
Внимательно прочитайте каждое задание и предлагаемые варианты ответа, если они имеются. Отвечайте только после того, как вы поняли вопрос и проанализировали все варианты ответа.
Выполняйте задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. К пропущенному заданию вы сможете вернуться после выполнения всей работы, если останется время.
За выполнение различных по сложности заданий дается один или более баллов. Баллы, полученные вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
«Заголовок» |
(«Вариант» — 2 ) |
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером выполняемого вами задания (А1 – А35) поставьте знак « × » в
клеточку, номер которой соответствует номеру выбранного вами ответа.
Сумма протонов, нейтронов и электронов в атоме 40Са равна
|
1) |
40 |
2) |
60 |
3) |
30 |
4) |
50 |
Электронная конфигурация 1s22s22p63s23p6 соответствует иону
|
1) Sc2+ |
2) Al3+ |
3) Cr3+ |
4) Ca2+ |
В молекуле аммиака NH3 химическая связь
1)ионная
2)ковалентная неполярная
3)ковалентная полярная
4)водородная
Степень окисления элемента в высшем оксиде равна + 6, а в водородном соединении его степень окисления равна
|
1) – 2 |
2) + 2 |
3) + 6 |
4) – 6 |
|
A5 |
Молекулярную кристаллическую решетку имеет соединение |
|||
|
1) HBr |
2) Li2O |
3) BaO |
4) KCl |
|
|
Аллотропные модификации кислорода не отличаются |
||||
|
A6 |
1)физическими свойствами
2)типом химической связи между атомами
3)химическими свойствами
4)числом атомов, входящих в состав молекул
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
«Заголовок» |
(«Вариант» — 3 ) |
|
A7 |
Из приведенных ниже металлов наиболее |
активным является |
|||
|
1) бериллий |
2) магний |
3) |
кальций |
4) барий |
|
|
Железо реагирует с каждым из двух веществ: |
|||||
|
A8 |
1)хлоридом натрия и азотом
2)кислородом и хлором
3)оксидом алюминия и карбонатом калия
4)водой и гидроксидом алюминия
|
A9 |
Элемент, образующий водородное соединение с наиболее сильными ос- |
|||
|
нóвными свойствами – это |
||||
|
1) C |
2) N |
3) F |
4) O |
|
|
В ряду |
F2 – Cl2 – Br2 – I2 |
|||
|
A10 |
окислительная активность
1)увеличивается
2)уменьшается
3)не изменяется
4)изменяется периодически
|
A11 |
Водные растворы серной и азотной кислот можно различить с помощью |
|||||||||||
|
1) |
Cu |
2) MgO |
3) |
Fe(OH)3 |
4) |
Na2CO3 |
||||||
|
В цепочке превращений |
||||||||||||
|
A12 |
||||||||||||
|
Сa |
+H2O |
X1 |
+CO2 |
X2 |
1000°C |
X3 |
||||||
|
конечным продуктом «Х3» является |
||||||||||||
|
1) |
CaO |
2) CaСО3 |
3) |
CaH2 |
4) |
CaC2 |
||||||
|
Изомерами являются |
||||||||||||
|
A13 |
||||||||||||
|
1) |
бензол и фенол |
|||||||||||
|
2) |
гексан и 2-метилпентан |
|||||||||||
|
3) |
метан и метанол |
|||||||||||
|
4) |
этанол и уксусная кислота |
|||||||||||
|
Общая формула алкенов |
||||||||||||
|
A14 |
||||||||||||
|
1) |
СnH2n–6 |
2) CnH2n–2 |
3) |
CnH2n |
4) |
CnH2n+2 |
||||||
|
A15 |
||||||||||||
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
«Заголовок» |
(«Вариант» — 4 ) |
Жидкий углеводород, молекула которого при жестком УФ освещении присоединяет шесть атомов хлора, а в присутствии железа с хлором образует монохлорпроизводное, называется
1)пропеном
2)бензолом
3)гексаном
4)метилциклопентаном
|
A16 |
Отличие в химических свойствах спиртов и фенолов проявляется в их |
|||
|
взаимодействии с |
||||
|
1) NaOH |
2) Na |
3) CО2 |
4) Na2CO3 |
|
|
Вещество, которое может реагировать с уксусной кислотой и с этаналем, |
||||
|
A17 |
||||
|
имеет формулу |
||||
|
1) NaOH |
2) Cu(OH)2 |
3) CH4 |
4) HBr |
|
|
Сложный эфир можно получить при взаимодействии уксусной кислоты с |
||||
|
A18 |
1)пропеном
2)метанолом
3)диэтиловым эфиром
4)муравьиной кислотой
|
A19 |
Углевод, для которого характерна реакция «серебряного зеркала», – это |
||||
|
1) сахароза |
2) крахмал |
3) фруктоза |
4) |
глюкоза |
|
|
Этиламин не взаимодействует с веществом, формула которого |
|||||
|
A20 |
|||||
|
1) HCl |
2) O2 |
3) H2 |
4) |
Н2О |
|
|
Аминоуксусная кислота реагирует с каждым из двух веществ: |
|||||
|
A21 |
|||||
1)HСl, KOH
2)NaCl, NH3
3)C2H5OH, KCl
4)CO2, HNO3
A22 Реакция, уравнение которой
CaCO3 (к) 
относится к реакциям 1) соединения, экзотермическим
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
«Заголовок» |
(«Вариант» — 5 ) |
2)разложения, эндотермическим
3)соединения, эндотермическим
4)разложения, экзотермическим
A23 При комнатной температуре с наибольшей скоростью протекает реакция между
1)NaOH (р-р) и HCl (р-р)
2)CuO (тв.) и H2SO4 (р-р)
3)CaCO3 (тв.) и HCl (р-р)
4)Zn (тв.) и H2SO4 (р-р)
A24 Согласно термохимическому уравнению
C2H4 + H2 
1)выделяется 311,4 кДж теплоты
2)поглощается 311,4 кДж теплоты
3)выделяется 622,8 кДж теплоты
4)поглощается 622,8 кДж теплоты
A25 Химическое равновесие в системе
CO2 (г) + C (тв) 
сместится вправо при
1)повышении давления
2)понижении температуры
3)повышении концентрации СO
4)повышении температуры
A26 Уравнением электролитической диссоциации является
1)CaCO3 
2)CH3COONa + H2O 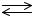
3)NH4Cl 
4)H3PO4 
A27 Реакцией ионного обмена, идущей в водном растворе до конца, является взаимодействие
1)сульфата аммония и хлорида бария
2)серной кислоты и нитрата натрия
3)сульфата натрия и соляной кислоты
4)нитрата калия и сульфата натрия
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
«Заголовок» |
(«Вариант» — 6 ) |
A28 Только окислительные свойства проявляет
1)сульфид натрия
2)сера
3)серная кислота
4)сульфит калия
A29 При пропускании избытка пропилена через бромную воду наблюдается
1)выпадение осадка
2)обесцвечивание раствора
3)синее окрашивание раствора
4)пожелтение раствора
A30 При щелочном гидролизе 1,2-дихлорпропана образуется
1)пропанол-1
3)пропанол-2
2)пропаналь
4) пропандиол-1,2
|
A31 |
Окраска водного раствора амина в присутствии фенолфталеина |
|||
|
1) малиновая |
2) желтая |
3) фиолетовая |
4) оранжевая |
|
|
Присоединение HCl к метилпропену, в соответствии с правилом |
||||
|
A32 |
||||
|
В.В. Марковникова, приводит к образованию |
||||
1)2-метил-2-хлорпропана
2)2-метил-1-хлорпропана
3)2-метил-2-хлорпропена
4)2-метил-1-хлорпропена
A33 Реактивами для получения водорода и кислорода в лаборатории могут быть, соответственно, следующие вещества:
1)Cu и HCl; KClO3
2)Zn и HCl; KMnO4
3)H2O2; HgO
4)HCl; Na2O
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается
|
«Заголовок» |
(«Вариант» — 7 ) |
|
A34 |
Способом переработки нефти и нефтепродуктов, при котором |
||||
|
не происходят химические реакции, является |
|||||
|
1) перегонка |
2) крекинг |
3) риформинг |
4) |
пиролиз |
|
|
Объем сероводорода (н.у.), образующегося при действии избытка серной |
|||||
|
A35 |
|||||
|
кислоты на 35,2 г сульфида железа (II), равен |
|||||
|
1) 2,24 л |
2) 4,48 л |
3) 6,72 л |
4) |
8,96 л |
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
«Заголовок» |
(«Вариант» — 8 ) |
Часть 2
Ответом к заданиям этой части (В1 – В10) является набор букв, слово или число. Впишите ответы в текст экзаменационной работы, а затем перенесите их в бланк ответов № 1 рядом с номером соответствующего задания, начиная с первой левой клеточки. Каждую букву, цифру, символ (запятая в десятичной дроби) пишите в отдельной клеточке без пробелов в соответствии с приведенными образцами.
В заданиях В1 – В5 на установление соответствия запишите в таблицу буквы выбранных вами ответов, а затем получившуюся последовательность букв перенесите в бланк ответов № 1 без пробелов и других символов.
B1 Установите соответствие между реагентами и схемами превращений элемента серы.
РЕАГЕНТЫ
1)сера и кислород
2)оксид серы (IV) и кислород
3)сероводород и кислород
4)серная кислота (конц.) и медь
СХЕМЫ ПРЕВРАЩЕНИЙ
|
А) |
S+4 |
S+6 |
|
|
Б) |
S+4 |
S0 |
|
|
В) |
S0 |
S+4 |
|
|
Г) |
S–2 |
S+4 |
|
|
Д) |
S0 |
S–2 |
|
|
Е) |
S+6 |
S+4 |
|
|
3 |
|||
|
4 |
|||
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
«Заголовок» |
(«Вариант» — 9 ) |
|
B2 |
Установите соответствие между реагентами и ионно-молекулярным урав- |
||||||||
|
нением реакции. |
|||||||||
|
РЕАГЕНТЫ |
ИОННО-МОЛЕКУЛЯРНОЕ |
||||||||
|
УРАВНЕНИЕ |
|||||||||
|
1) |
NaOH + HNO3 |
А) CaCO3 + 2H+ |
= Ca2+ +H2O + CO2 |
||||||
|
2) |
Na2CO3 + HCl |
Б) CO32– + H2O = HCO3– + OH– |
|||||||
|
3) |
Na2CO3 + CO2 + H2O |
В) OH– + H + = H2O |
|||||||
|
4) |
CaCO3 + HCl |
Г) CO32– + 2H+ |
= CO2 + H2O |
||||||
|
Д) CO32– + CO2 + H2O = 2HCO3– |
|||||||||
|
3 |
|||||||||
|
1 |
2 |
4 |
|||||||
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается

|
«Заголовок» |
(«Вариант» — 10 ) |
|
B3 |
Установите соответствие между солью и реакцией среды в ее водном рас- |
||||||||
|
творе. |
|||||||||
|
СОЛЬ |
РЕАКЦИЯ СРЕДЫ |
||||||||
|
1) |
нитрат бария |
А) кислая |
|||||||
|
2) |
хлорид железа (III) |
Б) |
нейтральная |
||||||
|
3) |
сульфат аммония |
В) |
щелочная |
||||||
|
4) |
ацетат калия |
||||||||
|
3 |
|||||||||
|
1 |
2 |
4 |
|||||||
© 2005 Министерство образования Российской Федерации Копирование и распространение без письменного разрешения Минобразования РФ не допускается
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
25 декабря 2008
В закладки
Обсудить
Жалоба
При подготовке к экзамену эти тесты просто необходимо прорешать. Выполнив демоверсии за все годы эксперимента, будет гораздо легче сдать ЕГЭ, а также это поможет вам избежать неожиданных заданий, которых вы не выполняли.
Скачать: chimiya.rar
Демоверсия ЕГЭ 2019 по химии
Русский, Математика, Обществознание, Физика, История, Биология, Химия, Английский, Информатика, Литература, География
О правах / ctege.info@gmail.com / Архив: 2020; 2021; 2022;
2005-2023 © ctege.info При использовании материалов указывайте гиперссылку.
Демоверсии ЕГЭ по химии
Демоверсии ЕГЭ по химии 2004-2010 гг.
Пояснения к демонстрационному варианту контрольных измерительных материалов для ЕГЭ 2010 года по химии
При ознакомлении с демонстрационным вариантом контрольных измерительных материалов ЕГЭ 2010 года следует иметь в виду, что задания, в него включённые, не отражают всех вопросов содержания, которые будут проверяться с помощью вариантов КИМ в 2010 году. Полный перечень вопросов, которые могут контролироваться на едином государственном экзамене 2010 года, приведен в Кодификаторе элементов содержания и требований к уровню подготовки выпускников общеобразовательных учреждений для единого государственного экзамена 2010 года по химии.
Назначение демонстрационного варианта заключается в том, чтобы дать возможность любому участнику ЕГЭ и широкой общественности составить представление о структуре будущих КИМ, количестве заданий, их форме, уровне сложности: базовом, повышенном и высоком. Приведённые критерии оценки выполнения заданий с развёрнутым ответом, включённые в этот вариант, дают представление о требованиях к полноте и правильности записи развёрнутого ответа.
Эти сведения позволят выпускникам выработать стратегию подготовки к ЕГЭ.
На главную страницу
Карта сайта
Вернуться назад
Неорганическая химия
Органическая химия
—
Неорганическая химия
Участники первой волны неплохо
справились с заданиями В3, в которых надо было установить соответствие между
исходными веществами и продуктами в реакциях неорганических веществ (48,9%). А
вот их возможности определять возможность протекания реакции значительно слабее
(В2, 41,3%). Наиболее сложной оказалась тема «Гидролиз солей» (В5, 21,8%).
Наиболее сложным вопросом, в которых необходимо было определить возможность протекания реакций, оказался вопрос, посвященный свойствам оксидов:
B2
(2005, 8%) Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
1) оксид кремния(IV) А) Al, H2SO4, CO
2) оксид азота(IV) Б) Fe2O3, H2O, NH3
3) оксид бария В) С, КОН, СаСО3
4) оксид железа(III) Г) NaOH, H2O, СаО
Д) Н2О, SO3, Н3РО4
Е) Н2О, HNO3, Са(ОН)2
Для правильного ответа
необходимо учитывать и кислотно-основные и окислительно-восстановительные
свойства оксидов, а также способность их взаимодействия с водой. Правильный ответ: ВГДА
В 2004 году задание на характерные химические свойства
неорганических веществ различных классов давался в другой форме:
В6 (2004, 14,0%)
Кислород при подходящих условиях реагирует с
A) Fe(OH)2
Б) KCl
В) P2O5
Г) SO2
Д) Zn
Е) N2 Ответ: __________
Вопросы данного типа требуют выбрать все правильные варианты
ответа и затем записать соответствующие буквы в алфавитном порядке.
Рекомендуется сначала записать их в предложенном поле после слова «Ответ» и
только после проверки, исправления возможных ошибок, перенести в бланк ответов
№1.
В данном вопросе следует учесть, что кислород – сильный
окислитель. Из представленных веществ не могут окисляться только P2O5
(фосфор уже в высшей степени окисления) и KCl. Даже азот окисляется
кислородом в электрическом разряде.
Правильный ответ: АГДЕ.
Легче находилось соответствие между
исходными веществами и продуктами реакций, однако и здесь были трудности с
казалось бы хорошо изученными веществами:
B3 (2005, 31%) Установите соответствие между реагирующими веществами и продуктами
их взаимодействия.
РЕАГИРУЮЩИЕ
ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
1) HNO3(разб) + Сu А) Сu(NO3)2
+ H2
2) HNO3(конц) + Сu Б) Сu(NO3)2
+ H2O
3)
HNO3 + СuО В) Сu(NO3)2 + N2 +H2O
4)
HNO3 + Сu(ОН)2 Г) Сu(NO3)2 + N2O + H2O
Д) Сu(NO3)2 + NO + H2O
Е)
Сu(NO3)2 +
NO2 + H2O
Правильный ответ: ДЕББ
Уже отмечалось, что школьники
сравнительно неплохо определяют степени окисления элементов. Но следующий
вопрос вызвал большие затруднения, поскольку требовал не только знания
стандартных приемов, но и учета электроотрицательности элементов:
B4 (2005, 4%) Установите соответствие между формулой вещества и степенью окисления
азота в нем.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
1) NF3 А) – 3
2) H2N2O2 Б) + 1
3) NBr3 В) + 2
4) Сa(NO3)2 Г) + 3
Д) + 4
Е) + 5
В третьем веществе, в отличие от первого, азот, как более электроотрицательный элемент, будет иметь степень
окисления –3 (а бром, что тоже непривычно, +1).
Правильный ответ: ГБАЕ
Трудности возникали
школьников и при рассмотрении реакции гидролиза:
B5(2005, 10%) Установите соответствие между солью и ее способностью к гидролизу.
СОЛЬ СПОСОБНОСТЬ К ГИДРОЛИЗУ
1) SrCl2 А) по катиону
2) NH4F Б) по аниону
3) CuSO4 В) по катиону и аниону
4) СН3СООNa Г) гидролизу не подвергается
Способность соли к гидролизу можно
определить по ее составу. Общее правило: гидролиз идет по «слабому звену». Если
соль образована слабым основанием и сильной кислотой (CuSO4),
идет гидролиз по катиону. Если соль образована сильным основанием и слабой
кислотой (Li2S) – гидролиз по аниону. Если и то и другое слабое (NH4F), идет совместный гидролиз. Если и основание, и кислота сильные (SrCl2) – гидролиз не
идет.
Возможно, не все учителя используют
подобную классификацию реакций гидролиза. Кроме того, школьники часто и силу
оснований определяют по таблице растворимости, отсюда мнение, что гидроксид стронция – слабое основание. Здесь надо учитывать положение металлов в таблице Д.И.Менделеева. Аналогичные вопросы вызвали затруднения и в заданиях
предыдущего года. Правильный ответ: ГВАБ.
В части вариантов этот вопрос выглядел несколько иначе:
Вопрос В5 (2005, 28%) Установите соответствие между солью и концентрациями ионов водорода и ионов
гидроксида в растворе этой соли.
СОЛЬ КОНЦЕНТРАЦИИ [H+] и [OH–]
1) FeI2 А) [H+] = [OH– ]
2) Na2S Б) [H+] > [OH– ]
3) CsCl В) [H+] < [OH– ]
4) Be(NO3)2
Для правильного ответа на этот вопрос школьник должен был знать, что йодоводородная кислота – сильная. Правильный ответ: БВАБ.
Неорганическая химия
Органическая химия
—
Органическая химия
Лучше всего школьники справились с
заданием по элементу: «Классификация органических веществ. Систематическая
номенклатура» (В1 50,6%). Наиболее сложными для испытуемых оказались темы:
- Характерные химические свойства кислородсодержащих органических
соединений: предельных одноатомных и многоатомных спиртов, фенола; альдегидов и
предельных карбоновых кислот. Жиры, углеводы. (В6, В7 22,3%); - Свойства аминов и аминокислот (В8, 16,1%);
- Расчетные задачи на объемные отношения газов (В10, 20,8%).
Как и в части А, много ошибок допускалось при рассмотрении свойств даже
такихорганических веществ, изучению которых уделяется достаточно много времени:
В6 (2005, 10%) Этанол реагирует с
A) CuO
Б) K
В) Cu(OH)2
Г) O2
Д) Na2CO3
Е) CH3COOH Ответ: __________
Сложность
вопросов этого типа в том, что число букв в ответе неизвестно, и для
правильного ответа надо вспомнить все свойства спиртов. Правильный ответ: АБГЕ.
В 2004 году
знание характерных химических свойств органических соединений проверялось на
примере небольшой цепочки:
В8 (2004, 12%). В схеме превращений
CH3CHO X1
X2
Относительная молекулярная масса органического вещества Х2
равна: __________. Запишите число с точностью до целых.
Вещество, с которого начинается
цепочка – это уксусный альдегид, и первая реакция – это характерная для
альдегидов реакция «серебряного зеркала». Реактив, который используется в этой
реакции, обычно называется «аммиачный раствор оксида серебра». На самом деле,
в этом растворе серебро находится в виде комплексного соединения, формула
которого указана над стрелкой. Во многих школьных учебниках для простоты в
уравнении реакции пишут формулу Ag2O, и в качестве продуктов
указывается серебро и соответствующая карбоновая кислота. Но реакция идет в
растворе аммиака, поэтому реально образуется аммонийная соль карбоновой
кислоты. В нашем случае X1 – это ацетат аммония, при действии на
который соляной кислотой образуется уксусная кислота X2.
Правильный ответ: 60.
Сложным оказался вопрос, посвященный
свойствам углеводов:
В7. (2005, 3%) При различных видах брожения глюкозы могут образоваться
А) углекислый газ
Б) масляная кислота
В) этанол
Г) муравьиная кислота
Д) водород
Е) молочная кислота Ответ:________
Видимо, не все виды брожения известны школьникам. Помимо спиртового и молочнокислого видов брожения, упоминаемого во многих учебниках, существует и маслянокислое:
С6Н12О6 С3Н7СООН
+ 2Н2 + 2СО2
Правильный ответ: АБВДЕ.
В 2004 году
основную сложность для выпускников составили вопросы, в которых надо было показать
знание качественных реакций веществ:
В7 (2004, 9%). Отличить растворы муравьиной кислоты и фенола
можно с помощью растворов:
A) Na2CO3
Б) [Ag(NH3)2]OH
В) AgNO3
Г) FeCl3
Д) BaCl2
Е) H2SO4 Ответ:
__________
Нам нужно выбрать такие реагенты, которые реагировали бы только
с одним из веществ, или, реагируя с обоими, давали бы разные реакции. Надо
учитывать, что муравьиная кислота проявляет свойства не только кислоты, но и
альдегида. Как кислота она может вступать в реакции обмена с некоторыми солями
(Na2CO3), как альдегид – восстанавливать аммиачный
комплекс серебра (реакция «серебряного зеркала»).
Фенол проявляет очень слабые
кислотные свойства и с большинством солей не реагирует. Но фенол дает
фиолетовое окрашивание с хлоридом железа(III), это качественная реакция на
фенолы. Правильный ответ: АБГ.
Из вопросов, посвященных
азотсодержащим соединениям, самым сложным в первой волне 2005 года оказался
следующий:
В8 (2005, 5%). Вещество NH2CH2CH(CH3)COOH
взаимодействует с
А) соляной кислотой
Б) хлоридом калия
В) гидроксидом калия
Г) карбонатом натрия
Д) аминоуксусной кислотой
Е) водородом Ответ:________
Учитывая амфотерность аминокислоты, правило реакций ионного обмена, выпускник должен был
прийти к правильному ответу: АВГД
Задачи
Задачи на определение состава раствора, предложенные в задании В9 были не слишком сложны,
хотя и требовали расчета по уравнению реакции. Но одна из этих задач требовала
составления алгебраического уравнения. Она и оказалась самой трудной:
В9 (2005, 4%).
Какой объем хлороводорода (н.у.) нужно растворить в 4 л воды для получения его 10,89%-ного раствора?
Ответ: __________ л. (Запишите число с точностью до целых.)
Возможное решение: Пусть необходимое
количество вещества хлороводорода равно х моль. Тогда искомый объем будет равен
22,4х л, а масса 36,5х г. Масса полученного раствора составит (4000+36,5х) г,
и, используя понятие массовой доли, можно записать:
36,5х = (4000+36,5х)*0,1089; откуда х=13,4 моль; V=300 л.
Правильный ответ: 300
В заданиях с численным ответом ошибки могут быть вызваны либо
неумением округлять, либо невнимательностью (экзаменующиеся просто не обращают
внимания на требование округления, не учитывая, что ответы проверяются
компьютером, и неокругленное число считается ошибочным). Чтобы уменьшить число
ошибок, рекомендуется предполагаемый ответ сначала записывать в предложенном
поле, и только после проверки единиц измерения и округления переносить в бланк
ответов.
Трудными для выпускников оказались
задачи, в которых требовался найти объем воздуха, необходимый для сжигания
вещества:
В10 (2005, 5%). Для полного
сжигания 8 л метиламина (н.у.) потребуется воздух объемом ___ л. (Запишите
число с точностью до целых.)
4CH3NH2 + 9O2 = 2N2 + 4CO2 + 10H2O
Поскольку объемы реагирующих газов
пропорциональны коэффициентам в уравнении реакции, для сжигания 8 л метиламина потребуется 18 л кислорода, и, учитывая его объемную долю в воздухе (21%), 85,7 л воздуха. Если принять округленное значение («одна пятая часть»), то получим в качестве ответа
число 90. Правильный ответ: 86 или 90.
Наверх
Г.М. Можаев
старший преподаватель
ТюмГУ, химический факультет;
ТОГИРРО
.
libcats.org
Главная →
Демонстрационный вариант ЕГЭ 2004 г. Химия
Демонстрационный вариант ЕГЭ по химии за 2004 год.
Скачать книгу бесплатно (pdf, 417 Kb)
Читать «Демонстрационный вариант ЕГЭ 2004 г. Химия»
EPUB | FB2 | MOBI | TXT | RTF
* Конвертация файла может нарушить форматирование оригинала. По-возможности скачивайте файл в оригинальном формате.
Популярные книги за неделю:
#1
Ф.И.Бурдейный, Н.В.Казанский. Карманный справочник радиолюбителя-коротковолновика (1959, DjVu)
440 Kb
#2
Я.Войцеховский. Радиоэлектронные игрушки (1977, djvu)
13.76 Mb
#3
Подготовка саперов, подразделений специального назначения по разминированию
Категория: Научно-популярная литература (разное)
1.49 Mb
#4
128 советов начинающему программисту
Очков В.Ф., Пухначев Ю.В.
Категория: computers, computers, prog
8.91 Mb
#5
Английский язык в картинках
I.A. Richards; Christine M. Gibson
Категория: Иностранные языки
5.77 Mb
#6
Ограждение участка. Ограды. Заборы. Калитки. Ворота
В.И.Рыженко
Категория: Строительство
1.23 Mb
#7
Эти загадочные зеркала
В. Правдивцев
Категория: Религия. Эзотерика
88.19 Mb
#8
Самоделки школьника
Тарасов Б.В.
Категория: science, science, technical, hobby, oddjob
41.91 Mb
#9
Наука и жизнь.Маленькие хитрости
Категория: E_Engineering, EM_Mechanics of elastic materials
3.50 Mb
#10
Каталог почтовых марок 1857-1991. Россия, РСФСР, СССР
В.Б. Загорский
Категория: КНИГИ ХОББИ и РАЗВЛЕЧЕНИЯ
139.85 Mb
Только что пользователи скачали эти книги:
#1
Химия гетероциклических соединений
Иванский В.И.
7.05 Mb
#2
Муниципальное право Российской Федерации
Бондарь Н.С., и др.
Категория: Юридические науки учебная литература
135 Kb
#3
Наперекор космическому порядку (Космисты)
Баландин Рудольф Константинович
Категория: Научно-популярное
7 Kb
#4
Наша судьба на наших руках
Баландин Рудольф Константинович
Категория: Научно-популярное
5 Kb
#5
Пора признать- взрыв был (о Чернобыле)
Баландин Рудольф Константинович
Категория: Научно-популярное
8 Kb
#6
Образование древнерусского государства
В.В.Мавродин
Категория: society, history, society, country
19.95 Mb
#7
МиГ-29
Е.Гордон, А.Фомин, А.Михеев
Категория: civil, tech, society, military
42.25 Mb
#8
Коррекционная педагогика в начальном образовании
Г.Ф. Кумарина, М.Э. Вайнер, Ю.Н. Вьюнкова
Категория: Психология, философия
1.76 Mb
#9
Вышивка & плетение иглой
Кей Деннис
Категория: ХОББИ и РЕМЕСЛА, ДОМ и СЕМЬЯ
11.85 Mb
#10
Очерк истории логарифмов
Успенский Я.В.
1.49 Mb















