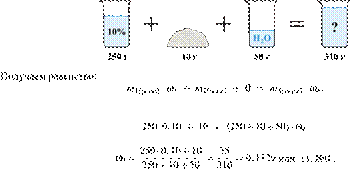
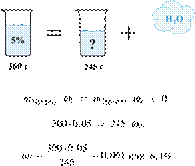
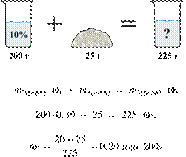
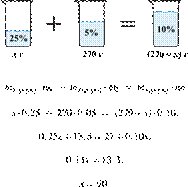
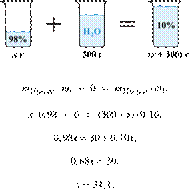
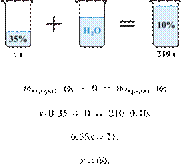
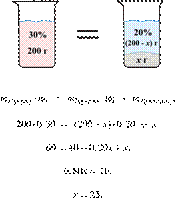
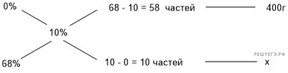Электролиз 640 г 15%-го раствора сульфата меди(II) прекратили, когда масса раствора уменьшилась на 32,0 г. К образовавшемуся раствору добавили 400 г 20%-го раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Спрятать решение
Решение.
Hайдём массу и количество вещества исходного сульфата меди(II):
Запишем уравнение электролиза водного раствора сульфата меди(II):
(1)
Масса раствора при электролизе уменьшается за счёт, выделяющихся на электродах, меди и кислорода. При образовании 1 моль кислорода и 2 моль меди масса раствора уменьшается на 160 г. По условию масса раствора уменьшилась на 32,0 г, значит, образовалось 0,20 моль кислорода и 0,40 моль меди.
По уравнению (1):
Найдём количество вещества добавленной щёлочи:
Запишем ионные уравнения химических процессов, которые происходят при добавлении щёлочи (гидроксида натрия):
(2)
(3)
По уравнениям (2) и (3) получаем:
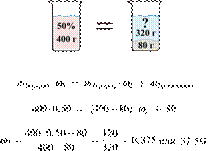
Составим таблицу:
| до электролиза | ||||
| изменения в процессе электролиза |
||||
| после электролиза | ||||
| изменения при добавлении щёлочи (без учёта реакций) |
||||
| изменения в процессе реакций со щёлочью |
||||
| после реакций со щёлочью |
Откуда,
Ответ:
Спрятать критерии
Критерии проверки:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы:
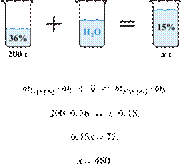
• правильно записаны уравнения реакций, соответствующих условию задания; • правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания; • продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которых проводятся расчёты; • в соответствии с условием задания определена искомая физическая величина |
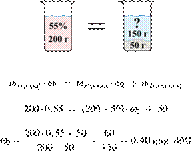
4 |
| Правильно записаны три элемента ответа | 3 |
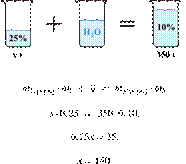
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
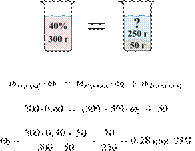
| Максимальный балл | 4 |
Источник: ЕГЭ — 2018, основная волна. Задания 34 (С5).
Чтобы поделиться, нажимайте
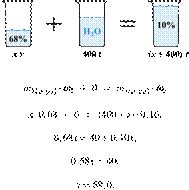
Реальный ЕГЭ по химии 2020. Задание 32
Представляем вашему вниманию задание 32 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с подробными текстовыми решениями и ответами.
Реальный ЕГЭ 2020. Задание 32. Вариант 1
- Дигидрофосфат кальция растворили в избытке раствора гидроксида калия. Полученное соединение кальция отделили и высушили, а затем сплавили с оксидом кремния (IV) и углеродом. Полученное простое вещество прореагировало с хлоратом калия. Образовавшуюся соль растворили в воде и провели электролиз полученного раствора. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) 3Ca(H2PO4)2 + 12KOH = 4K3PO4 + Ca3(PO4)2↓ + 12H2O
2) Ca3(PO4)2 + 5C + 3SiO2 = 2P + 3CaSiO3 + 5CO (сплавление)
или 2Ca3(PO4)2 + 10C + 6SiO2 = P4 + 6CaSiO3 + 10CO (сплавление)
3) 5KClO3 + 6P = 5KCl + 3P2O5
или 10KClO3 + 12P = 10KCl + 3P4O10
или 10KClO3 + 3P4 = 3P4O10 + 10KCl
или 10KClO3 + 3P4 = 6P2O5 + 10KCl
4) 2KCl + 2H2O = H2↑ + Cl2↑ + 2KOH (электролиз)
Реальный ЕГЭ 2020. Задание 32. Вариант 2
- К раствору сульфата хрома (III) прилили раствор сульфита натрия. В результате реакции выделился газ и выпал осадок. Полученный газ пропустили через раствор перманганата калия. А осадок, полученный в первой реакции, отделили и добавили к раствору пероксида водорода подщелоченного гидроксидом натрия. Затем к образовавшемуся раствору прилили избыток раствора разбавленной серной кислоты. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Cr2(SO4)3 + 3Na2SO3 + 3H2O = 2Cr(OH)3↓ + 3SO2↑ + 3Na2SO4
2) 5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
3) 2Cr(OH)3 + 3H2O2 + 4NaOH = 2Na2CrO4 + 8H2O
4) 2Na2CrO4 + H2SO4 = Na2SO4 + Na2Cr2O7 + H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 3
- Железную окалину растворили в разбавленной серной кислоте. В полученный раствор добавили раствор дихромата калия, подкисленный серной кислотой. Хромосодержащее вещество, полученное в результате реакции, выделили и добавили его к раствору карбоната натрия. Полученный осадок отделили и растворили в горячем растворе хлората калия и гидроксида калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Fe3O4 + 4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O
2) 6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
3) Cr2(SO4)3 + 3Na2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 3Na2SO4
4) 2Cr(OH)3 + KClO3 + 4KOH = KCl + 2K2CrO4 + 5H2O (нагревание)
Реальный ЕГЭ 2020. Задание 32. Вариант 4
- Натрий нагрели с кислородом. Полученное твёрдое вещество обработали подкисленным серной кислотой раствором перманганата калия. Газ, образовавшийся в ходе реакции, прореагировал с пиритом при нагревании. Полученное твёрдое вещество растворили в растворе иодоводорода. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) 2Na + O2 = Na2O2
2) 5Na2O2 + 2KMnO4 + 8H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 + 5O2↑ + 8H2O
3) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 (нагревание)
4) Fe2O3 + 6HI = 2FeI2 + I2↓ + 3H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 5
- Провели электролиз раствора нитрата серебра (I). Полученный на аноде газ прореагировал с раскалённым железом. Образовавшееся твёрдое вещество чёрного цвета растворили в растворе иодоводородной кислоты. Полученное простое вещество отделили и растворили при нагревании в растворе гидроксида натрия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) 4AgNO3 + 2H2O = 4Ag↓ + O2↑ + 4HNO3 (электролиз)
2) 3Fe + 2O2 = Fe3O4 (нагревание)
3) Fe3O4 + 8HI = 3FeI2 + I2↓ + 4H2O
4) 3I2 + 6NaOH = NaIO3 + 5NaI + 3H2O (нагревание)
Реальный ЕГЭ 2020. Задание 32. Вариант 6
- К фосфиду алюминия добавили соляную кислоту. Затем к получившемуся раствору добавили раствор сульфита калия, в результате чего образовался белый осадок и бесцветный газ. Выделившийся газ разделили на две части. Первую часть пропустили через раствор дихромата натрия, подкисленный серной кислотой. Вторую часть газа пропустили через концентрированную азотную кислоту. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) AlP + 3HCl = AlCl3 + PH3↑
2) 2AlCl3 + 3K2SO3 + 3H2O = 2Al(OH)3↓ + 3SO2↑ + 6KCl
3) Na2Cr2O7 + 3SO2 + H2SO4 = Na2SO4 + Cr2(SO4)3 + H2O
4) SO2 + 2HNO3 = H2SO4 + 2NO2↑
Реальный ЕГЭ 2020. Задание 32. Вариант 7
- Смешали растворы хлорной кислоты и гидроксида натрия. Полученную соль выделили и сплавили с оксидом хрома (III) и гидроксидом натрия. Соль, содержащую хром, отделили и добавили к избытку разбавленного раствора серной кислоты. Затем через полученный кислый раствор пропустили сероводород. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) HClO4 + NaOH = NaClO4 + H2O
2) 3NaClO4 + 4Cr2O3 + 16NaOH = 8Na2CrO4 + 3NaCl + 8H2O (сплавление)
3) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
4) 3H2S + Na2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + Na2SO4 + 7H2O
или 3H2S + 4Na2Cr2O7 + 13H2SO4 = 4Cr2(SO4)3 + 4Na2SO4 + 16H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 8
- К раствору сульфата цинка добавили избыток раствора гидроксида калия. Через образовавшийся раствор пропустили сероводород, образовавшийся белый осадок растворили в концентрированной азотной кислоте и наблюдали выделение бурого газа. Выделившийся бурый газ пропустили через раствор гидроксида бария. Запишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) ZnSO4 + 4KOH = K2SO4 + K2[Zn(OH)4]
2) K2[Zn(OH)4] + 3H2S = ZnS↓ + 2KHS + 4H2O
или K2[Zn(OH)4] + 2H2S = ZnS↓ + K2S + 4H2O
3) ZnS + 8HNO3 = ZnSO4 + 8NO2↑ + 4H2O
или ZnS + 10HNO3 = Zn(NO3)2 + 8NO2↑ + H2SO4 + 4H2O
или ZnS + 4HNO3 = Zn(NO3)2 + S↓ + 2NO2↑ +2H2O
4) 4NO2 + 2Ba(OH)2 = Ba(NO2)2 + Ba(NO3)2 + 2H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 9
- Алюминий добавили к раствору гидроксида калия. Через полученный прозрачный раствор пропустили газ, получившийся при взаимодействии магния с концентрированной серной кислотой. Образовавшийся осадок отделили, а в оставшийся раствор добавили раствор перманганата калия, в результате чего в осадок перешло простое вещество. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) 2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2↑
2) 4Mg + 5H2SO4 (конц.) = 4MgSO4 + H2S↑ + 4H2O
3) 2K[Al(OH)4] + H2S = 2Al(OH)3↓ + K2S + 2H2O
или K[Al(OH)4] + H2S → KHS + Al(OH)3↓ + H2O
4) 3K2S + 2KMnO4 + 4H2O = 3S↓ + 2MnO2↓ + 8KOH
или 3KHS + 2KMnO4 + H2O = 5KOH + 2MnO2↓ + 3S↓
Реальный ЕГЭ 2020. Задание 32. Вариант 10
- Оксид хрома (VI) обработали избытком раствора гидроксида натрия. К полученному жёлтому раствору прилили серную кислоту. Затем раствор снова подкислили серной кислотой и пропустили через него фосфин. Полученную соль хрома выделили и добавили к ней раствор карбоната калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) CrO3 + 2NaOH = Na2CrO4 + H2O
2) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
3) 4Na2Cr2O7 + 16H2SO4 + 3PH3 = 4Cr2(SO4)3 + 4Na2SO4 + 3H3PO4 + 16H2O
4) Cr2(SO4)3 + 3K2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
Реальный ЕГЭ 2020. Задание 32. Вариант 11
- Оксид меди (I) растворили в концентрированной азотной кислоте. Образовавшуюся соль выделили, высушили и прокалили. Через полученный твёрдый остаток при нагревании пропустили газ, полученный при сливании известковой воды и раствора гидрофосфата аммония. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Cu2O + 6HNO3 (конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2) 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑ (прокаливание)
3) 3Ca(OH)2 + 2(NH4)2HPO4 = Ca3(PO4)3↓ + 4NH3↑ + 6H2O
или Ca(OH)2 + (NH4)2HPO4 = CaHPO4↓ + 2NH3↑ + 2H2O
4) 3CuO + 2NH3 = 3Cu + N2 + 3H2O (нагревание)
Реальный ЕГЭ 2020. Задание 32. Вариант 12
- Дихромат аммония прокалили до постоянной массы. Твёрдый остаток растворили в растворе пероксида водорода с гидроксидом калия. К образовавшемуся раствору жёлтого цвета прилили избыток концентрированной бромоводородной кислоты. Полученную соль хрома выделили и добавили к раствору карбоната калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) (NH4)2Cr2O7 = N2↑ + Cr2O3 + 4H2O (прокаливание)
2) Cr2O3 + 4KOH + 3H2O2 = 2K2CrO4 + 5H2O
3) 2K2CrO4 + 16HBr = 4KBr + 2CrBr3 + 3Br2 + 8H2O
4) 2CrBr3 + 3K2CO3 + 3H2O = 6KBr + 2Cr(OH)3↓ + 3CO2↑
Реальный ЕГЭ 2020. Задание 32. Вариант 13
- Карбид алюминия сожгли. Полученное твёрдое вещество поместили в раствор гидроксида натрия. Через образовавшийся прозрачный раствор пропустили газ, полученный при действии на магний концентрированной серной кислоты. При пропускании газа происходило выпадение белого осадка и образование соли бескислородной кислоты.
Развернуть/свернуть решение
1) Al4C3 + 6O2 = 3CO2 + 2Al2O3
2) Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
3) 4Mg + 5H2SO4 (конц.) = 4MgSO4 + H2S↑ + 4H2O
4) H2S + 2Na[Al(OH)4] = 2Al(OH)3 ↓+ Na2S + 2H2O (допустимо образование NaHS)
Реальный ЕГЭ 2020. Задание 32. Вариант 14
- Натрий растворили в воде. Образовавшееся газообразное вещество при нагревании пропустили через железную окалину. Получившееся простое вещество при нагревании растворили в необходимом количестве концентрированной серной кислоты, при этом образовался бесцветный газ с резким запахом. К полученному раствору добавили раствор карбоната калия.
Развернуть/свернуть решение
1) 2Na + 2H2O = 2NaOH + H2↑
2) Fe3O4 + 4H2 = 3Fe + 4H2O
3) 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2↑ + 6H2O
4) Fe2(SO4)3 + 3K2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
Реальный ЕГЭ 2020. Задание 32. Вариант 15
- Оксид меди (I) растворили в концентрированном растворе азотной кислоты. Полученный в результате бурый газ поглотили холодным раствором гидроксида натрия. К образовавшемуся раствору добавили подкисленный серной кислотой раствор дихромата натрия. Образовавшееся соединение хрома выделили и поместили в раствор карбоната калия.
Развернуть/свернуть решение
1) Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2↑ + 3H2O
2) 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
3) 3NaNO2 + Na2Cr2O7 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + Na2SO4 + 4H2O
4) Cr2(SO4)3 + 3K2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
Реальный ЕГЭ 2020. Задание 32. Вариант 16
- К раствору дигидрофосфата калия добавили избыток раствора гидроксида кальция. Образовавшийся осадок отделили, высушили и нагрели с кремнезёмом и углём. Полученное простое вещество вступило в реакцию с хлоратом калия. Полученный при этом оксид поместили в избыток раствора гидроксида натрия.
Развернуть/свернуть решение
1) 2KH2PO4 + 3Ca(OH)2 = Ca3(PO4)2↓ + 2KOH + 4H2O
2) Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO + 2P
3) 6P + 5KClO3 = 3P2O5 + 5KCl
4) P2O5 + 6NaOH = 2Na3PO4 + 3H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 17
- Нитрат хрома (III) прокалили. Образовавшееся при этом твёрдое вещество нагрели с хлоратом натрия и гидроксидом натрия. Одно из полученных веществ прореагировало с концентрированным раствором хлороводородной кислоты. Образовавшуюся при этом соль хрома выделили, растворили в воде и полученный раствор прилили к раствору карбоната натрия.
Развернуть/свернуть решение
1) 4Cr(NO3)3 = 2Cr2O3 + 12NO2↑ + 3O2↑
2) Cr2O3 + NaClO3 + 4NaOH = 2Na2CrO4 + NaCl + 2H2O
3) 2Na2CrO4 + 16HCl = 2CrCl3 + 3Cl2↑ + 4NaCl + 8H2O
4) 2CrCl3 + 3Na2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 6NaCl
Реальный ЕГЭ 2020. Задание 32. Вариант 18
- Перхлорат натрия сплавили с оксидом хрома (III) и гидроксидом натрия. Полученное соединение хрома поместили в разбавленный раствор серной кислоты. В образовавшийся раствор добавили серную кислоту и поместили иодид натрия. Образовавшееся простое вещество при нагревании прореагировало с гидроксидом калия.
Развернуть/свернуть решение
1) 3NaClO4 + 4Cr2O3 + 16NaOH = 8Na2CrO4 + 3NaCl + 8H2O
2) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
3) Na2Cr2O7 + 6NaI + 7H2SO4 = 3I2↓ + Cr2(SO4)3 + 4Na2SO4 + 7H2O
4) 3I2 + 6KOH = KIO3 + 5KI + 3H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 19
- Пероксид натрия поместили в раствор, содержащий перманганат калия и серную кислоту. Полученное простое вещество при нагревании прореагировало с железом. Образовавшееся при этом твёрдое вещество черного цвета поместили в раствор иодоводородной кислоты. Образовавшуюся при этом соль железа выделили, растворили в воде и полученный раствор прилили к раствору карбоната натрия.
Развернуть/свернуть решение
1) 5Na2O2 + 2KMnO4 + 8H2SO4 = 5O2↑ + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
2) 2O2 + 3Fe = Fe3O4
3) Fe3O4 + 8HI = 3FeI2 + I2↓ + 4H2O
4) FeI2 + Na2CO3 = FeCO3↓ + 2NaI
Реальный ЕГЭ 2020. Задание 32. Вариант 20
- Оксид железа (III) поместили в раствор бромоводородной кислоты. Через получившийся раствор пропустили аммиак. Образовавшийся при этом осадок отделили и прокалили. Полученное бурое вещество сплавили с твёрдым гидроксидом калия.
Развернуть/свернуть решение
1) Fe2O3 + 6HBr = 2FeBr3 + 3H2O
2) FeBr3 + 3NH3 + 3H2O = Fe(OH)3↓ + 3NH4Br
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 2KOH = 2KFeO2 + H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 21
- Через раствор силиката калия пропустили углекислый газ. Полученный при этом осадок отделили, а оставшийся раствор смешали с раствором сульфата железа (III). Выпавший при этом осадок отделили и прокалили. Полученное бурое вещество сплавили с твёрдым карбонатом натрия.
Развернуть/свернуть решение
1) K2SiO3 + CO2 + H2O = H2SiO3↓ + K2CO3 (допустимо образование KHCO3)
2) 3K2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + Na2CO3 = 2NaFeO2 + CO2↑
Реальный ЕГЭ 2020. Задание 32. Вариант 22
- Алюминат натрия растворили в серной кислоте. К полученному при этом раствору добавили раствор сульфида натрия. Выделившийся газ разделили на две части, одну часть поглотили раствором дихромата натрия, подкисленным серной кислотой. Другую часть газа поглотили бромной водой.
Развернуть/свернуть решение
1) 2NaAlO2 + 4H2SO4 = Na2SO4 + Al2(SO4)3 + 4H2O
2) Al2(SO4)3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 3Na2SO4
3) 3H2S + Na2Cr2O7 + 4H2SO4 = 3S↓ + Cr2(SO4)3 + Na2SO4 + 7H2O
4) H2S + Br2 = S↓ + 2HBr
Реальный ЕГЭ 2020. Задание 32. Вариант 23
- Цинк сплавили с твёрдым гидроксидом калия. Полученное в результате твёрдое вещество растворили в необходимом количестве раствора серной кислоты. В образовавшийся раствор добавили сульфид калия, в результате чего образовался белый осадок. Осадок отделили и при нагревании растворили в концентрированной серной кислоте, при этом образовался бесцветный газ с резким запахом.
Развернуть/свернуть решение
1) Zn + 2KOH = K2ZnO2 + H2↑
2) K2ZnO2 + 2H2SO4 = K2SO4 + ZnSO4 + 2H2O
3) ZnSO4 + K2S = ZnS↓ + K2SO4
4) ZnS + 4H2SO4 (конц.) = ZnSO4 + 4SO2↑ + 4H2O
Реальный ЕГЭ 2020. Задание 32. Вариант 24
- Нитрат железа (II) прокалили. Полученное твердое вещество сплавили с твердым гидроксидом калия. Образовавшийся твердый продукт растворили в необходимом количестве бромоводородной кислоты. Через полученный раствор пропустили аммиак.
Развернуть/свернуть решение
1) 4Fe(NO3)2 = 2Fe2O3 + 8NO2↑ + O2↑
2) Fe2O3 + 2KOH = 2KFeO2 + H2O
3) KFeO2 + 4HBr = KBr + FeBr3 + 2H2O
4) FeBr3 + 3NH3 + 3H2O = Fe(OH)3↓ + 3NH4Br
Реальный ЕГЭ 2020. Задание 32. Вариант 25
- Нитрат цинка прокалили. Полученное простое вещество прореагировало с оксидом азота (II). Полученный продукт прореагировал с холодным раствором гидроксида натрия. К образовавшемуся раствору прилили раствор, содержащий дихромат натрия и серную кислоту.
Развернуть/свернуть решение
1) 2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
2) 2NO + O2 = 2NO2
3) 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4) 3NaNO2 + Na2Cr2O7 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + Na2SO4 + 4H2O
Резерв
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 1
- Гидросульфит бария растворили в водном растворе пероксида водорода. Полученную соль отделили и нагрели с водородом. Полученное вещество добавили в раствор сульфата алюминия. К образовавшемуся нерастворимому основанию, которое отделили от раствора, добавили раствор гидроксида натрия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Ba(HSO3)2 + 2H2O2 = BaSO4↓ + H2SO4 + 2H2O
2) BaSO4 + 4H2 = BaS + 4H2O (нагревание) (очень спорная реакция)
3) 3BaS + Al2(SO4)3 + 6H2O = 3BaSO4↓ + 3H2S↑ + 2Al(OH)3↓
4) Al(OH)3 + NaOH = Na[Al(OH)4]
или Al(OH)3 + 3NaOH = Na3[Al(OH)6]
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 2
- Прокалили смесь карбоната калия и оксида цинка. Полученный в результате реакции газ прореагировал с избытком твёрдой щёлочи при нагревании. В результате реакции образовалась соль, которую растворили в воде и к образовавшемуся раствору добавили хлорид алюминия. Полученный осадок отделили и растворили в растворе гидроксида калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) K2CO3 + ZnO = K2ZnO2 + CO2↑ (прокаливание)
2) CO2 + 2NaOH = Na2CO3 + H2O
3) 2Na2CO3 + 2AlCl3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaCl
4) Al(OH)3 + KOH = K[Al(OH)4]
или Al(OH)3 + 3KOH = K3[Al(OH)6]
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 3
- Металюминат калия растворили в серной кислоте. В полученный раствор добавили сульфит натрия. В результате реакции выделился газ, который разделили на две части. Одну часть полученного газа пропустили через бромную воду, а вторую – через подкисленный серной кислотой раствор дихромата натрия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) 2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
2) Al2(SO4)3 + 3Na2SO3 + 3H2O = 2Al(OH)3↓ + 3Na2SO4 + 3SO2↑
3) 3SO2 + Na2Cr2O7 + H2SO4 = Na2SO4 + Cr2(SO4)3 + H2O
4) SO2 + Br2 + 2H2O = 2HBr + H2SO4
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 4
- Оксид меди (II) нагрели с медью. Образовавшееся вещество растворили в концентрированной азотной кислоте. Выделившийся бурый газ поглотили раствором гидроксида калия. К образовавшемуся раствору добавили подкисленный серной кислотой раствор дихромата калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) CuO + Cu = Cu2O (нагревание)
2) Cu2O + HNO3 (конц.) = 2Cu(NO3)2 + 2NO2↑ + 3H2O
3) 2NO2 + 2KOH = KNO2 + KNO3 + H2O
4) 3KNO2 + K2Cr2O7 + 4H2SO4 = 3KNO3 + K2SO4 + Cr2(SO4)2 + 4H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 5
- Через избыток раствора силиката натрия пропустили углекислый газ. Образовавшуюся соль отделили и растворили в растворе хлорида железа (III). Образовавшийся осадок отфильтровали и прокалили до постоянной массы. Образовавшийся твёрдый остаток растворили в растворе иодоводородной кислоты. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Na2SiO3 + CO2 + H2O = H2SiO3↓ + Na2CO3 (допустимо образование NaHCO3)
2) 3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3↓ + 6NaCl + 3CO2↑
3) 2Fe(OH)3 = Fe2O3 + 3H2O (прокаливание)
4) Fe2O3 + 6HI = I2↓ + 2FeI2 + 3H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 6
- Прокалили смесь карбоната калия и оксида цинка. Выделившийся газ пропустили через раствор силиката натрия. Образовавшийся осадок отделили, а оставшийся раствор смешали с раствором хлорида железа(III), при этом наблюдали образование осадка и выделение газа. Полученный осадок отделили и поместили в раствор иодоводородной кислоты.Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
1) Na2CO3 + ZnO = Na2ZnO2 + CO2↑ (прокаливание)
2) Na2SiO3 + CO2 + H2O = H2SiO3↓ + Na2CO3 (допустимо образование NaHCO3)
3) 2Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl
4) 2Fe(OH)3 + 6HI = 2FeI2 + I2↓ + 6H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 7
- К раствору сульфата цинка добавили избыток раствора гидроксида натрия. Через полученный раствор пропустили сероводород. Образовавшийся при этом осадок при нагревании растворили в концентрированной серной кислоте, при этом образовался бесцветный газ с резким запахом. Полученный газ поглотили раствором перманганата калия, подкисленным серной кислотой.
Развернуть/свернуть решение
1) ZnSO4 + 4NaOH = Na2[Zn(OH)4] + Na2SO4
2) Na2[Zn(OH)4] + 2H2S = ZnS↓ + Na2S + 4H2O (допустимо образование NaHS)
3) ZnS + 4H2SO4 = ZnSO4 + 4SO2↑ + 4H2O
4) 5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 8
- К раствору нитрата алюминия добавили раствор сульфида натрия. Полученный газ поглотили раствором перманганата калия, подкисленным серной кислотой, при этом наблюдали образование осадка. Осадок отделили и обработали горячим концентрированным раствором гидроксида калия. Полученную при этом кислородосодержащую соль добавили в раствор, содержащий дихромат калия и серную кислоту.
Развернуть/свернуть решение
1) 2Al(NO3)3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaNO3
2) 5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8H2O
3) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
4) 3K2SO3 + K2Cr2O7 + 4H2SO4 = 4K2SO4 + Cr2(SO4)3 + 4H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 9
- Оксид хрома (VI) поместили в раствор гидроксида калия. В полученный при этом раствор добавили раствор серной кислоты. Образовавшийся раствор дополнительно подкислили серной кислотой и пропустили через этот раствор сероводород. Образовавшийся при этом осадок отделили и поместили в горячий концентрированный раствор гидроксида калия.
Развернуть/свернуть решение
1) CrO3 + 2KOH = K2CrO4 + H2O
2) 2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
3) 3H2S + K2Cr2O7 + 4H2SO4 = 3S↓ + Cr2(SO4)3 + K2SO4 + 7H2O
4) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 10
- Фосфид цинка растворили в соляной кислоте. Полученный газ поглотили концентрированным раствором азотной кислоты при нагревании, при этом наблюдали выделение бурого газа. Бурый газ пропустили через раствор гидроксида натрия. К полученному раствору добавили раствор, содержащий дихромат натрия и серную кислоту.
Развернуть/свернуть решение
1) Zn3P2 + 6HCl = 3ZnCl2 + 2PH3↑
2) PH3 + 8HNO3 = H3PO4 + 8NO2↑ + 4H2O
3) 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4) 3NaNO2 + Na2Cr2O7 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + Na2SO4 + 4H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 32. Вариант 11
- Алюминий добавили к раствору гидроксида натрия. Через образовавшийся прозрачный раствор пропустили газ, полученный при растворении серы в концентрированной серной кислоте. Образовавшийся осадок отделили, а к полученному раствору добавили раствор перманганата калия.
Развернуть/свернуть решение
1) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 ↑
2) S + 2H2SO4 = 3SO2↑ + 2H2O
3) SO2 + 2Na[Al(OH)4] = 2Al(OH)3↓ + Na2SO3 + H2O (допустимо образование NaHSO3)
4) 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2↓ + 2KOH
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Задания
для подготовки
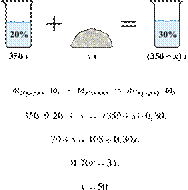
1. Задание 27 № 3265
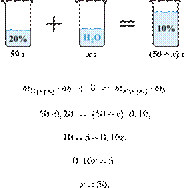
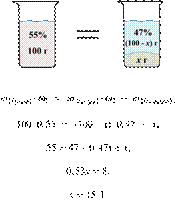
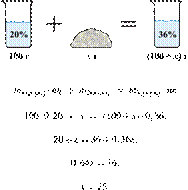
Смешали 80 г
раствора с массовой долей нитрата натрия 25 % и 20 г раствора этой же соли с
массовой долей 40 %. Вычислите массовую долю соли в полученном растворе. Ответ
дайте в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 28%.
1/59
2. 4767
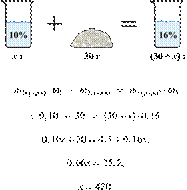
массу нитрата
калия (в граммах), который следует растворить в 150 г раствора с массовой долей
этой соли 10 % для получения раствора с
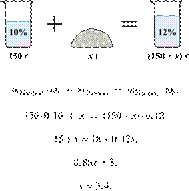
массовой долей 12 %. Ответ дайте точностью до десятых. Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 3,4 г.
2/59
3. 6248
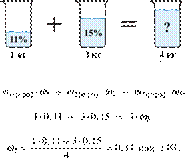
Вычислите массовую долю
соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг
15%-ного раствора соли. Ответ дайте в процентах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 14%.
3/59
4. 6249
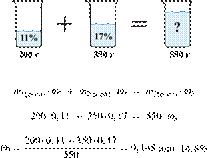
Смешали 200 г
11%-ного раствора нашатыря и 350 г 17%-ного раствора этой же соли. Вычислите
массовую долю нашатыря в полученном
растворе. Ответ укажите в процентах с
точностью до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 14,8%.
4/59
5. 6250
Упариванием 500 г
раствора с массовой долей соли 10 % получен раствор с массовой долей соли 14 %.
Вычислите массу выпаренной при этом воды. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 143 г.
5/59
6. 6251
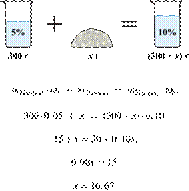
массу едкого натра,
который следует растворить в 300 г 5%-го раствора для получения 10%-го раствора
Ответ
укажите в граммах с точностью до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
щелочи не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 16,7 г.
6/59
7. 6252
К 250 г 10%-го
раствора нитрата натрия добавили 10 г этой же соли и 50 мл воды. Вычислите
массовую долю нитрата натрия в полученном
растворе. Ответ дайте в процентах с точностью до
десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Ответ просят дать с точностью до
десятых.
Ответ: 11,3%.
7/59
8. 6253
К 200 г 5%-ного
раствора хлорида аммония добавили 15 г этой же соли и столько же граммов воды.
Вычислите массовую долю хлорида аммония в полученном растворе. Ответ дайте в
процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Ответ просят дать с точностью до
целых.
Ответ: 11%.
8/59
9.
6254
К 250 г 20%-ной
серной кислоты добавили 50 мл 60%-ной кислоты (плотностью 1,6 г/мл). Вычислите
массовую долю кислоты в полученном растворе. Ответ дайте в процентах с
точностью до целых. Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 30%.
10.
Задание 27 № 6255
Вычислите массу
уксусной кислоты в растворе, полученном при смешивании 155 г 5%-го и 207 г
11%-го растворов кислоты. Ответ дайте в граммах с
точностью до десятых.
Решение.
Найдём массу кислоты:
Ответ: 30,5.
9/59
11. 6256
массу воды,
которую следует добавить к 300 г 22%-го раствора уксусной кислоты, чтобы
получить 9%-й раствор. Ответ дайте в граммах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 433 г.
10/59
12. 6257
При упаривании 300
г 5%-го раствора сахарозы получены 245 г раствора. Вычислите массовую долю
сахарозы в нём. Ответ дайте в процентах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 6%.
11/59
13. 6394
К 400 г 10%-го
раствора соли добавили 50 г этой же соли. Вычислите массовую долю соли в полученном
растворе. Ответ дайте в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 20%.
12/59
14. 6434
Из 400 г горячего
50%-го раствора соли при охлаждении выпало 80 г кристаллов соли. Вычислите
массовую долю соли в растворе над осадком.
Ответ дайте в процентах с точностью до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 37,5%.
13/59
15. 6474
массу карбоната
калия, который надо прибавить к 100 г 16%-го раствора, чтобы получить 30%-й
раствор. Ответ представьте в граммах с точностью до
целых.
Решение.
Масса раствора, масса
растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 20 г.
14/59
16. 6514
массу гидроксида
калия, который надо прибавить к 40 г 10%-го раствора, чтобы получить 40%-й
раствор. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 20 г.
15/59
17. 6551
массу воды нужно
добавить к 50 г 20%-го раствора соляной кислоты, чтобы уменьшить её
концентрацию до 10 %. Ответ укажите в
граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 50 г.
16/59
18. 6552
массу воды,
которую нужно добавить к 30 г 20%-го раствора гидроксида натрия, чтобы
понизить его концентрацию до 15 %. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 10 г.
17/59
19. 6553
массу воды нужно
испарить из 500 г 10%-го раствора гидроксида натрия, чтобы
увеличить его концентрацию в 1,5 раза. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
гидроксида натрия не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 167 г.
18/59
20. 6554
массу воды, которую
нужно испарить из 300 г 15 %-го раствора гидроксида калия, чтобы
увеличить его концентрацию в два раза. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 150 г.
19/59
21. 6555
массу соли нужно
добавить к 50 г 20%-го раствора, чтобы увеличить её концентрацию в два
раза. Ответ укажите в граммах с точностью до
целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 17 г.
20/59
22. 6611
К 300 г 10%-го
раствора гидроксида натрия добавили 60 г чистого гидроксида натрия. Вычислите
массовую долю растворённого вещества в полученном растворе. Ответ укажите в
процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида натрия не изменяется.
Получаем равенство:
Ответ: 25%.
21/59
23. 6651
К 200 г 10%-го
раствора гидроксида калия добавили 25 г чистого гидроксида калия. Вычислите
массовую долю растворённого вещества в полученном растворе. Ответ
укажите в процентах с точностью до целых. Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ: 20%.
22/59
24. 6691
Вычислите массу
твёрдого нитрата аммония, который надо добавить к 210 г воды, чтобы получить
16%-й раствор соли. Ответ укажите в граммах с
точностью до целых.
Решение.
Масса раствора, масса
растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении масса соли не
изменяется.
Получаем равенство:
Ответ: 40 г.
23/59
25. 6731
массу твёрдого
гидроксида калия, который надо добавить к 120 г воды, чтобы получить 20%-й
раствор щёлочи. Ответ укажите в граммах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении масса гидроксида
калия не изменяется.
Получаем равенство:
Ответ: 30 г.
24/59
26. 6780
К 240 г раствора с
массовой долей соли 10% добавили 160 мл воды. Вычислите массовую долю соли в
полученном растворе. Ответ дайте в процентах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 6%.
25/59
27. 6820
При выпаривании
25%-го водного раствора получено 60 г сухого вещества. Вычислите массу
испарившейся воды. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При выпаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 180 г.
26/59
28. 6860
При выпаривании
20%-го водного раствора получено 36 г сухого вещества. Вычислите массу
испарившейся воды. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При выпаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 144 г.
27/59
29. 9640
массу гидроксида калия, который
необходимо растворить в 150 г воды для получения раствора с массовой долей
щёлочи 25 %. Ответ дайте в граммах с точностью до целых. Решение.
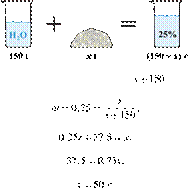
—
масса гидроксида калия (вещества), тогда — масса раствора, а —
(омега) массовая доля вещества, равная 25 % или 0,25. Имеем:
Ответ: 50.
28/59
30. 9681
Растворяя соль в горячей воде, приготовили
300 г 40%-го раствора. При охлаждении раствора из него выпало 50 г осадка
безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ
дайте в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 28%.
29/59
31. 9714
Вычислите массу
15%-го раствора вещества, который можно получить разбавлением 200 г 36%-го
раствора. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 480 г.
30/59
32. 9749
Растворяя соль в горячей воде, приготовили
200 г 55%-го раствора. При охлаждении раствора из него выпало 50 г осадка
безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте
в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 40%.
31/59
33. 9783
Разбавлением 25%-го
раствора вещества получили 350 г 10%-го раствора. Вычислите массу 25%-го
раствора. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 140 г.
32/59
34. 9820
Сколько граммов 25%-го раствора вещества
надо добавить к 270 г 5%-го раствора, чтобы получить
10%-й раствор? (Запишите число с
точностью до целых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 90.
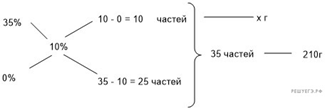
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 5 частей 25%-го раствора и 15 частей 5%-го
раствора. Составив пропорцию, получаем:
Ответ: 90.
33/59
35. 9854
Вычислите массу
5%-го раствора вещества, который надо добавить к 120 г 30%-го раствора, чтобы
получить 15%-й раствор. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 180 г.
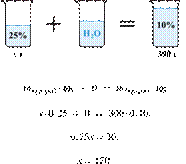
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для приготовления
15%-го раствора нужно 10 частей 30%-го раствора и 15 частей 5%-го раствора.
Составив пропорцию, получаем:
Ответ: 180 г.
34/59
36. 9888
Вычислите массу
воды, которую надо добавить к 200 г 36%-й соляной кислоты, чтобы получить 20%-ю
кислоту. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 160 г.
35/59
37. 9922
Вычислите массу
воды, которую надо добавить к 200 г 63%-й азотной кислоты, чтобы получить 15%ю
кислоту. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 640 г.
36/59
38. 10403
В 100 г 5%-го
раствора хлорида натрия растворили ещё 25 г этого вещества. Чему равна массовая
доля хлорида натрия (в %) в новом растворе? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 24%.
37/59
39.
10442
В 200 г 10%-го
раствора гидроксида калия растворили ещё 25 г этого вещества. Чему равна
массовая доля гидроксида калия (в %) в новом растворе? Ответ выразите в виде
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ: 20%.
40.
Задание 27 № 10673
Сколько граммов 98%-ной серной кислоты
надо добавить к 300 г воды, чтобы получить 10%-ный раствор кислоты? Ответ
округлите до ближайшего целого числа.
38/59
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
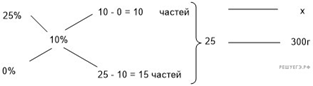
Ответ: 34.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 98%-го раствора и 88 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 34.
39/59
41. 10708
Сколько граммов
68%-ной азотной кислоты надо добавить к 400 г воды, чтобы получить 10%-ный
раствор кислоты? Ответ округлите до ближайшего целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 69.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 68%-го раствора и 58 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 69.
40/59
42. 11088
К 75 г раствора с
массовой долей соли 14% добавили 10 г той же соли и 10 мл воды. Вычислите
массовую долю соли в полученном растворе (в процентах). (Запишите число с
точностью до десятых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Ответ просят дать с точностью до
десятых.
Ответ: 21,6%.
41/59
43. 11168
При охлаждении 400
г горячего 50%-го раствора нитрата калия выпал осадок, не содержащий
кристаллизационной воды. Чему равна масса осадка (в г), если раствор над
осадком содержал 34% нитрата калия по массе? Ответ округлите до ближайшего
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 97 г.
42/59
44. 11233
При охлаждении 100
г горячего 55%-го раствора нитрата натрия выпал осадок, не содержащий
кристаллизационной воды. Чему равна масса осадка (в г), если раствор над
осадком содержал 47% нитрата натрия по массе? Ответ округлите до ближайшего
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 15 г.
43/59
45. 11271
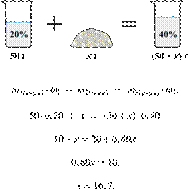
Сколько граммов
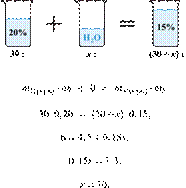
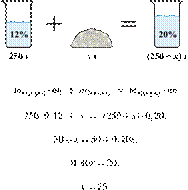
40%-го раствора гидроксида калия надо смешать с 200 г 10%-го раствора этого
вещества, чтобы получить 15%-й раствор? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 40.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 15%-го раствора нужно 5 частей 40%-го раствора и 25 частей 10%-го
раствора. Составив пропорцию, получаем:
Ответ: 40.
44/59
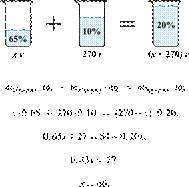
46. 11306
Сколько граммов
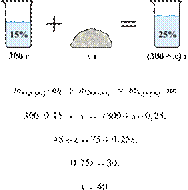
65%-го раствора азотной кислоты надо смешать с 270 г 10%-го раствора этого
вещества, чтобы получить 20%-й раствор? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 60.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 20%-го раствора нужно 10 частей 65%-го раствора и 45 частей
10%-го раствора. Составив пропорцию, получаем:
Ответ: 60.
45/59
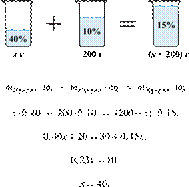
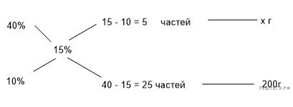
47. 11341
При разбавлении
35%-й соляной кислоты получили 210 г 10%-й кислоты. Сколько граммов 35%-го
раствора было взято? Ответ выразите в виде целого числа Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 60.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 35%-й кислоты и 25 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 60.
46/59
48. 11376
При разбавлении
25%-го раствора аммиака получили 300 г 10%-го раствора. Сколько граммов 25%го
раствора было взято? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 120.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 25%-го раствора и 15 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 120.
47/59
49. 12382
200 г горячего
30%-го раствора соли охладили до комнатной температуры. Сколько граммов соли
выпадет в осадок, если насыщенный при комнатной температуре раствор содержит
20% соли по массе?
Осадок представляет собой безводную
соль. Ответ запишите с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 25.
48/59
50. 12417
Насыщенный раствор
содержит 30 % соли по массе. Сколько граммов соли нужно растворить в 350 г
20%-го раствора для получения насыщенного раствора? Ответ выразите в виде
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 50.
49/59
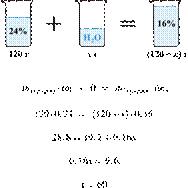
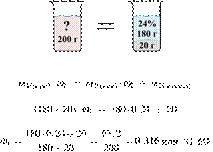
51. 12616
Имеется 120 г
24%-го раствора вещества. Из него надо получить 16%-й раствор. Сколько граммов
воды требуется добавить? Ответ округлите до ближайшего целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 60.
50/59
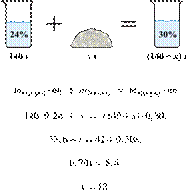
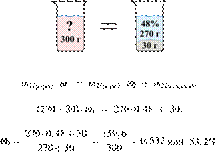
52. 12651
Имеется 140 г
24%-го раствора вещества. Из него надо получить 30%-й раствор. Сколько граммов
чистого вещества требуется добавить? Ответ округлите до ближайшего целого
числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
вещества не изменяется.
Получаем равенство:
Ответ: 12.
51/59
53. 12865
Сколько граммов
чистого вещества надо добавить к 100 г его 20%-го раствора, чтобы получить 36%й
раствор? Ответ представьте в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
вещества не изменяется.
Получаем равенство:
Ответ: 25.
52/59
54. 13033
30 граммов чистого
вещества добавили к 10%-му раствору этого вещества и получили 16%-й раствор.
Сколько граммов 10%-го раствора было взято? Ответ представьте в виде целого
числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 420.
53/59
55. 13095
Горячий раствор
нитрата калия охладили, при этом выпало 20 г осадка (безводной соли) и
образовалось 180 г 24%-го раствора. Чему была равна массовая доля нитрата калия
(в процентах) в горячем растворе? Ответ округлите до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 31,6%.
54/59
56. 13130
Горячий раствор
нитрата натрия охладили, при этом выпало 30 г осадка (безводной соли) и
образовалось 270 г 48%-го раствора. Чему была равна массовая доля нитрата
натрия (в процентах) в горячем растворе? Ответ округлите до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 53,2%.
55/59
57. 13557
В 81 г воды
растворили 9 г сульфата натрия. Вычислите массовую долю вещества (в процентах) в
полученном растворе. (Запишите число с точностью до целых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
Ответ просят дать с точностью до
целых.
Ответ: 10%.
56/59
58. 13630
К 250 г 12%-го
раствора гидроксида калия добавили твердый KOH и после перемешивания получили
20%-й раствор. Сколько граммов твердой щёлочи добавили? Ответ выразите в виде
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ: 25.
57/59
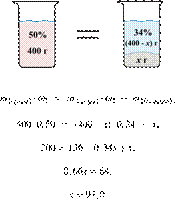
59. 13665
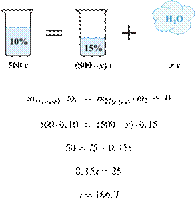
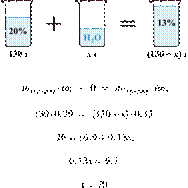
К 300 г 15%-го
раствора хлорида калия добавили твёрдый и после
перемешивания получили 25%-й раствор. Сколько граммов твёрдой соли добавили?
Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 40.
58/59
60. 13704
Найдите массу воды, которую необходимо
добавить к 130 г 20%-го раствора соли, чтобы получить
13%-ый раствор. (Запишите число с
точностью до целых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 70 г.
59/59
Пробный тренировочный вариант №6 по химии 11 класс в новом формате решу ЕГЭ 2023 года задания с ответами и решением в формате реального экзамена ЕГЭ 2023 из открытого банка тренировочных вариантов ФИПИ по новой демоверсии.
Решу ЕГЭ 2023 вариант №6 по химии 11 класс задания с ответами
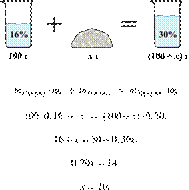
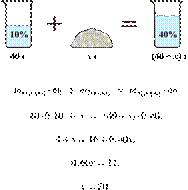
Задания и ответы с варианта
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1) Cl
- 2) Сa
- 3) Mg
- 4) S
- 5) Mn
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковую конфигурацию внешнего энергетического уровня.
2. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения кислотных свойств их высших гидроксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду элементов выберите два элемента, которые в кислородсодержащем анионе состава RO способны проявлять одинаковую степень окисления.
4. Из предложенного перечня выберите два вещества, в которых присутствуют только ковалентные полярные связи.
- 1) NH4NO3
- 2) CH3OH
- 3) H2O2
- 4) C6H6
- 5) H2S
5. Среди предложенных веществ, расположенных в пронумерованных ячейках, выберите:
- А) кислоту, соответствующую оксиду состава R2O3,
- Б) среднюю соль,
- В) основную соль
6. К одной из двух пробирок с бесцветным раствором вещества Х добавили раствор дигидрофосфата бария, а к другой – окрашенный раствор вещества Y. В результате в каждой из пробирок наблюдалось выпадение в осадок соли. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) H2SO4
- 2) FeCl3
- 3) Ba(OH)2
- 4) Na2SiO3
- 5) K2CrO4
11. Из предложенного перечня выберите два вещества, которые являются гомологами по отношению друг к другу.
- 1) C3H7COOH
- 2) CH3C(O)OC3H7
- 3) CH3COOH
- 4) CH3CHO
- 5) CH3OH
13. Из предложенного перечня выберите два вещества, которые вступают в реакцию поликонденсации.
- 1) метиламин
- 2) цистеин
- 3) глюкоза
- 4) трипальмитат глицерина
- 5) линолевая кислота
17. Из предложенного перечня выберите все реакции, которые являются одновременно экзотермическими и реакциями соединения:
- 1) NaOH + HCl →
- 2) Ca + H2O →
- 3) N2 + O2 →
- 4) Fe + Cl2 →
- 5) K2O + H2O →
23. В реакторе с постоянным объемом находится смесь этилена и водорода, причем молярные концентрации веществ равны 6 моль/л и 8 моль/л в порядке перечисления. Смесь нагрели в присутствии катализатора, в результате протекания обратимой реакции в системе установилось химическое равновесие. В равновесной смеси мольное соотношение этана и этилена оказалось равно 2 : 1. Используя данные задачи, определите равновесные концентрации водорода (X) и этана (Y). Выберите из списка номера правильных ответов:
- 1) 1,0 моль/л
- 2) 2,0 моль/л
- 3) 3,0 моль/л
- 4) 4,0 моль/л
- 5) 5,0 моль/л
- 6) 6,0 моль/л
26. При некоторой температуре в 1 л воды растворяется 582,4 л (в расчете на н. у.) бромоводорода. Вычислите массовую долю бромоводорода в его насыщенном при данной температуре растворе. Ответ дайте в процентах и округлите до десятых.
27. Вычислите тепловой эффект реакции CH4 (г.) + 2O2 (г.) = 2H2O (ж.) + CO2 (г.) + Q, если при полном сгорании 13,6 г метана выделилось 756,5 кДж теплоты. Ответ запишите с точностью до целых.
28. При сжигании 33,6 г железа в избытке хлора была получена соль массой 87,75 г. Вычислите долю выхода соли в процентах от теоретического. В ответ запишите целое число.
29. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого осадка и выделением газа, входящего в состав воздуха. Запишите уравнение только одной реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30. Из предложенного перечня веществ выберите сильное основание и вещество, между которыми протекает реакция ионного обмена с образованием двух солей. Осадок в итоговой реакционной смеси отсутствует. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ.
31. Оксид железа (III) сплавили с карбонатом натрия. Плав растворили в разбавленном растворе серной кислоты, к полученному раствору добавили иодид натрия. Образовавшееся простое вещество выделили и ввели в реакцию с горячей концентрированной азотной кислотой, при этом наблюдали выделение бурого газа. Составьте уравнения четырех описанных реакций.
33. При сжигании органического вещества Х массой 19,32 г было получено 20,61 л (при н.у.) углекислого газа и 8,28 мл воды. Данное вещество может вступать с бромом только в реакцию замещения и содержит функциональные группы при нечетных атомах углерода. Также известно, что одним из продуктов взаимодействия этого вещества с избытком водного раствора гидроксида калия является метиловый спирт. На основании данных в задаче:
1. Проведите необходимые и установите молекулярную формулу неизвестного вещества Х;
2. Составьте возможную структурную формулу вещества Х, которая однозначно отражает порядок связи атомов в его молекуле;
3. Напишите уравнение реакции вещества Х с избытком водного раствора гидроксида калия, используя структурные формулы веществ.
34. 39,4 г смеси хлорида натрия и безводного сульфата меди (II), содержащей 8,428 · 1023 атомов, растворили в воде. Через полученный раствор массой 200 г пропускали электрический ток до тех пор, пока на аноде не выделилось 3,36 л (при н. у.) газа. К оставшемуся после электролиза раствору прилили 5%-ный раствор гидроксида бария в количестве, необходимом для полного связывания сульфат-ионов. Вычислите массовую долю щелочи в конечном растворе.
Вам будет интересно:
Разговоры о важном материалы для 1-11 классов. Волонтеры России (5 декабря 2022)
Метки: 11 класс варианты и ответы ЕГЭ тренировочный вариант химия
Новый пробный тренировочный вариант №14 по химии 11 класс в формате решу ЕГЭ 2022 задания с ответами и решением в новом формате по новой демоверсии из открытого банка ФИПИ со всем изменениями 2022 года.


Решать пробный вариант №14 решу ЕГЭ 2022 по химии 11 класс задания и ответы:
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1) As
- 2) Al
- 3) Mn
- 4) Si
- 5) Na
1)Определите, в атомах каких из указанных в ряду элементов в основном состоянии содержится больше неспаренных электронов на внешнем слое, чем у каждого из трех оставшихся.
Правильный ответ: 14
2)Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке усиления кислотных свойств их высших гидроксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Правильный ответ: 523
3)Из числа указанных в ряду элементов выберите два элемента, которые в сложных веществах проявляют постоянную степень окисления.
Правильный ответ: 25
4)Выберите два физических свойства, которые соответствуют хлориду натрия.
- 1) Температура плавления 801°С
- 2) Температура кипения 118°С
- 3) Высокая электропроводность кристаллов
- 4) Пластичность в твердом состоянии
- 5) Высокая электропроводность расплава
Правильный ответ: 15
6)К одной из пробирок с сухим гидроксидом железа (II) добавили раствор вещества X, а к другой – раствор вещества Y. В результате в первой пробирке наблюдалось растворение осадка, а во второй – изменение цвета осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) Na2S
- 2) H2O2
- 3) HCl
- 4) H2SiO3
- 5) CuSO4
Правильный ответ: 32
11)Из предложенного перечня выберите два вещества, в молекулах которых не содержится кратных связей.
- 1) пропаналь
- 2) циклобутан
- 3) бутанон
- 4) этанол
- 5) пропилформиат
Правильный ответ: 24
12)Из предложенного перечня выберите все вещества, реакция которых с азотной кислотой приводит к образованию сложного эфира.
- 1) пропан
- 2) фенол
- 3) глицерин
- 4) этандиаль
- 5) этанол
Правильный ответ: 35
13)Из предложенного перечня выберите два процесса, в ходе которых образуется предельный многоатомный спирт.
- 1) омыление тристеарина
- 2) спиртовое брожение глюкозы
- 3) гидрирование фруктозы
- 4) гидролиз глицилаланина
- 5) гидролиз крахмала
Правильный ответ: 13
17)Из предложенного перечня реакций выберите все обратимые реакции:
- 1) Na2CO3 + H2O = NaOH + NaHCO3
- 2) Zn + 2HCl = H2 + ZnCl2
- 3) BaCl2 + H2SO4 = BaSO4 + 2HCl
- 4) C2H4 + H2 = C2H6
- 5) Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Правильный ответ: 14
18)Из предложенного перечня внешних воздействий выберите все воздействия, которые влияют на скорость реакции цинка с раствором сульфата меди (II).
- 1) концентрация ионов меди
- 2) концентрация ионов цинка
- 3) давление
- 4) температура раствора
- 5) площадь поверхности соприкосновения реагентов
Правильный ответ: 145
23)В реактор с постоянным объемом ввели азот, водород и металлический катализатор. Концентрации газов составили 5,5 моль/л и 4,5 моль/л, соответственно. Сосуд нагревали до достижения химического равновесия, при этом концентрация аммиака в реакционной смеси достигла 20% от максимально возможной. Используя приведенные данные, определите равновесные концентрации аммиака (X) и водорода (Y). Выберите из списка номера правильных ответов:
- 1) 0,6 моль/л
- 2) 1,1 моль/л
- 3) 1,2 моль/л
- 4) 2,2 моль/л
- 5) 3,4 моль/л
- 6) 3,6 моль/л
Правильный ответ: 16
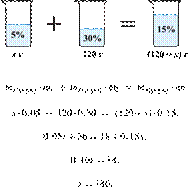
26) Вычислите массу 5%-го раствора азотной кислоты, которую необходимо добавить к 40 г 20%-го раствора азотной кислоты, чтобы получить ее 7,5%-ный раствор. Ответ запишите в виде целого числа.
Правильный ответ: 200
27)В результате реакции, термохимическое уравнение которой: C6H12O6 (тв) +6O2 (г) = 6CO2 (г) + 6H2O (ж) + 2803 кДж, выделилось 10,8 г воды. Вычислите количество выделившейся теплоты (в кДж). Ответ запишите с точностью до десятых.
Правильный ответ: 280,3
28)Для восстановления навески оксида меди (II) массой 36 г взяли необходимое количество алюминия, содержащего в качестве примеси 10% по массе оксида алюминия. Вычислите массу оксида алюминия в полученной реакционной смеси. Ответ запишите с точностью до десятых. Атомную массу меди примите равной 64.
Правильный ответ: 16,2
29)Из предложенного перечня выберите вещества, между которыми протекает окислительновосстановительная реакция. В этой реакции окислителем и восстановителем является одно и то же вещество, а число электронов, участвующих в процессе окисления, не равно числу электронов, участвующих в процессе восстановления (в расчете на один атом). Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня веществ выберите два вещества, между которыми протекает реакция ионного обмена. В ходе этой реакции наблюдается выпадение серо-зеленого осадка и не выделяется газ. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ.
31)Нитрат цинка обработали избытком раствора едкого натра. Через образовавшийся раствор пропустили избыток сероводорода. Выпавший осадок отделили и подвергли обжигу в токе кислорода. Полученный газ пропустили через раствор сульфата железа (III). Составьте уравнения четырех описанных реакций.
33)Нитрат меди (II) массой 65,8 г частично разложился при нагревании. Весь полученный при этом твердый остаток добавили к 340 г 10%-го раствора гидроксида натрия. Вычислите массовую долю гидроксида натрия в растворе над осадком, если массовая доля кислорода (как элемента) в осадке составляет 24,16%.
34)При сжигании органического вещества Х массой 26,1 г получено 26,88 л (при н.у.) углекислого газа и 18,9 г воды. Известно, что в ходе щелочного гидролиза этого вещества образуются две соли, одна из которых содержит четвертичный атом углерода, и еще один органический продукт. На основании данных в задаче:
- 1. Проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного вещества Х;
- 2. Составьте возможную структурную формулу вещества Х, которая однозначно отражает порядок связи атомов в его молекуле;
- 3. Напишите уравнение реакции гидролиза вещества Х в растворе гидроксида калия, используя структурную формулу вещества.
Другие тренировочные варианты ЕГЭ 2022 по химии 11 класс
Пробный вариант №13 решу ЕГЭ 2022 по химии 11 класс задания с ответами
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
Задания 32 из реального ЕГЭ по химии-2021, все задачи на неорганическую химию (мысленный эксперимент) из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
1. Фосфид алюминия растворили в бромоводородной кислоте. К полученному при этом раствору добавили избыток раствора гидроксида натрия. Через получившийся раствор пропустили газ с резким запахом, образовавшийся в результате полного растворения сульфида железа(II) в концентрированной серной кислоте. Напишите уравнения четырех описанных реакций.
AlP + 3HBr = AlBr3 + PH3
AlBr3 + 4NaOH = Na[Al(OH)4] + 3NaBr (допустимо образование Na3[Al(OH)6])
2FeS + 10H2SO4 = Fe2(SO4)3 + 9SO2 + 10H2O
SO2 + 2Na[Al(OH)4] = Na2SO3 + 2Al(OH)3 + H2O (возможно образование NaHSO3)
2. Кристаллический иодид аммония нагрели с твёрдым гидроксидом натрия. Получившуюся соль растворили в воде и поместили в раствор нитрата меди(II). Выпавшую в осадок соль отделили и поместили в концентрированный раствор серной кислоты, при этом происходило выделение газа с резким запахом и образование окрашенного простого вещества. Полученное простое вещество отделили и поместили в горячий раствор гидроксида натрия. Напишите уравнения четырех описанных реакций.
NH4I + NaOH = NaI + NH3 + H2O
4NaI + 2Cu(NO3)2 = 2CuI + 4NaNO3 + I2
2CuI + 4H2SO4 = 2CuSO4 + I2 + 2SO2 + 4H2O
3I2 + 6NaOH → 5NaI + NaIO3 + 3H2O
3. Оксид кремния при нагревании прореагировал с избытком магния. Одно из получившихся при этом соединений магния поместили в воду. Выделившийся при этом газ полностью поглотили раствором, содержащим перманганат калия и гидроксид калия. Из полученного раствора зелёного цвета выделили соединение кремния и поместили его в раствор бромоводородной кислоты. Напишите уравнения четырех описанных реакций.
SiO2 + 4Mg → Mg2Si + 2MgO
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4
SiH4 + 8KMnO4 + 10KOH = 8K2MnO4 + K2SiO3 + 7H2O
2HBr + K2SiO3 = 2KBr + H2SiO3
4. Сульфид алюминия растворили в избытке раствора гидроксида калия. Полученное в результате соединение серы выделили и поместили в раствор сульфата хрома(III). Образовавшийся осадок отделили и нагрели с перхлоратом калия и гидроксидом калия. Полученную соль хрома отделили, растворили в воде и поместили в раствор нитрата серебра. Напишите уравнения четырех описанных реакций.
Al2S3 + 8KOH = 2K[Al(OH)4] + K2S
Cr2(SO4)3 + 3K2S + 6H2O → 2Cr(OH)3 + 3H2S + 3K2SO4
8Cr(OH)3 + 3KClO4 + 16KOH →(tº) 8K2CrO4 + 3KCl + 20H2O
K2CrO4 + 2AgNO3 = Ag2CrO4 + 2KNO3
5. Нитрат железа(II) прокалили. Полученный твёрдый остаток растворили в растворе иодоводородной кислоты. Образовавшуюся соль железа поместили в раствор азотной кислоты и наблюдали образование окрашенного простого вещества и выделение бурого газа. Простое вещество отделили, а к оставшемуся раствору соли прилили раствор карбоната калия. Напишите уравнения четырех описанных реакций.
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
FeI2 + 6HNO3(конц.) = Fe(NO3)3 + I2 + 3NO2 + 3H2O
2Fe(NO3)3 + 3K2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 6KNO3
6. Фосфид алюминия растворили в соляной кислоте. К полученному при этом раствору добавили избыток раствора гидроксида калия. Через получившийся раствор пропустили газ с резким запахом, образовавшийся в результате полного растворения сульфида меди(I) в концентрированной серной кислоте. Напишите уравнения четырех описанных реакций.
AlP + 3HCl = AlCl3 + PH3
AlCl3 + 4KOH = K[Al(OH)4] + 3KCl (допустимо образование K3[Al(OH)6])
Cu2S + 6H2SO4 = 2CuSO4 + 5SO2 + 6H2O
SO2 + 2K[Al(OH)4] = K2SO3 + 2Al(OH)3 + H2O (возможно образование KHSO3)
7. Хлорид кремния(IV) поместили в воду. Выделившийся при этом осадок отделили, а в оставшийся раствор внесли фосфид цинка. Образовавшийся при этом газ пропустили через раствор, содержащий дихромат натрия и серную кислоту. Полученную при этом соль хрома выделили, растворили в воде и к полученному раствору добавили раствор карбоната калия. Напишите уравнения четырех описанных реакций.
SiCl4 + 3H2O = H2SiO3 + 4HCl
Zn3P2 + 6HCl = 3ZnCl2 + 2PH3
3PH3 + 4Na2Cr2O7 + 16H2SO4 = 4Cr2(SO4)3 + 4Na2SO4 + 3H3PO4 + 16H2O
Cr2(SO4)3 + 3K2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 3K2SO4
8. Кристаллический иодид аммония нагрели с твёрдым гидроксидом калия. Получившуюся соль растворили в воде и поместили в раствор сульфата меди(II). Выпавшую в осадок соль отделили и поместили в концентрированный раствор азотной кислоты, при этом наблюдали выделение бурого газа и образование окрашенного простого вещества. Полученное простое вещество отделили и поместили в горячий раствор гидроксида калия. Напишите уравнения четырех описанных реакций.
NH4I + KOH = KI + NH3 + H2O
4KI + 2CuSO4 = 2CuI + 2K2SO4 + I2
2CuI + 8HNO3 = 2Cu(NO3)2 + I2 + 4NO2 + 4H2O
3I2 + 6KOH → 5KI + KIO3 + 3H2O
9. Нитрат железа(III) прокалили. Полученный твёрдый остаток растворили в растворе иодоводородной кислоты. Образовавшуюся соль железа поместили в концентрированный раствор серной кислоты и наблюдали образование окрашенного простого вещества и выделение газа с резким запахом. Простое вещество отделили, а к оставшемуся раствору соли прилили раствор карбоната натрия. Напишите уравнения четырех описанных реакций.
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
2FeI2 + 6H2SO4(конц.) = Fe2(SO4)3 + 2I2 + 3SO2 + 6H2O
Fe2(SO4)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4
10. Сульфид алюминия растворили в избытке раствора гидроксида натрия. Полученное в результате соединение серы выделили и поместили в раствор нитрата хрома(III). Образовавшийся осадок отделили и нагрели с перхлоратом натрия и гидроксидом натрия. Полученную соль хрома отделили, растворили в воде и поместили в раствор ацетата серебра. Напишите уравнения четырех описанных реакций.
Al2S3 + 8NaOH = 2K[Al(OH)4] + Na2S
2Cr(NO3)3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S + 6NaNO3
8Cr(OH)3 + 3NaClO4 + 16NaOH → 8Na2CrO4 + 3NaCl + 20H2O
Na2CrO4 + 2CH3COOAg = Ag2CrO4 + 2CH3COONa
11. Железную окалину растворили в разбавленной серной кислоте. Полученный раствор обработали иодидом калия. Образовавшуюся соль бескислородной кислоты поместили в раствор азотной кислоты и наблюдали образование окрашенного простого вещества и выделение бурого газа. Простое вещество отделили, а к оставшемуся раствору соли прилили раствор карбоната калия. Напишите уравнения четырех описанных реакций.
Fe3O4 + 4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O
Fe2(SO4)3 + 6KI = 2FeI2 + I2 + 3K2SO4
FeI2 + 6HNO3(конц.) = Fe(NO3)3 + 2I2 + 3NO2 + 3H2O
2Fe(NO3)3 + 3K2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 6KNO3
12. Фосфор смешали с магнием и нагрели. Полученное при этом вещество поместили в воду. Выделившийся газ пропустили через раствор, содержащий перманганат калия и гидроксид калия, в результате раствор приобрёл зелёную окраску. Через полученный раствор пропустили хлор, при этом наблюдали изменение цвета раствора. Напишите уравнения четырех описанных реакций.
3Mg + 2P = Mg3P2
Mg3P2 + 6H2O = 2PH3 + 3Mg(OH)2
PH3 + 8KMnO4 + 11KOH = K3PO4 + 8K2MnO4 + 7H2O
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
13. Иодид калия прореагировал с нитритом калия в присутствии серной кислоты. Образовавшийся при этом газ собрали в колбу и наблюдали, как при стоянии на воздухе газ в колбе постепенно окрасился в бурый цвет. Полученный бурый газ смешали с кислородом и пропустили через воду, при этом образовалась кислота. В полученный концентрированный раствор кислоты внесли пирит, при этом наблюдали его полное растворение и выделение бурого газа. Напишите уравнения четырех описанных реакций.
2KI + 2KNO2 + 2H2SO4 = I2 + 2NO + 2K2SO4 + 2H2O
2NO + O2 = 2NO2
4NO2 + O2 + H2O = 4HNO3
FeS2 + 18HNO3 = Fe(NO3)3 + 2H2SO4 + 15NO2 + 7H2O
14. Сульфид натрия прореагировал с нитритом натрия в присутствии серной кислоты. Образовавшийся при этом газ собрали в колбу и наблюдали, как при стоянии на воздухе газ в колбе постепенно окрасился в бурый цвет. Полученный бурый газ смешали с кислородом и пропустили через воду, при этом образовалась кислота. В полученный концентрированный раствор кислоты внесли сульфид меди(I), при этом наблюдали его полное растворение и выделение бурого газа. Напишите уравнения четырех описанных реакций.
Na2S + 2NaNO2 + 2H2SO4 = S + 2NO + 2Na2SO4 + 2H2O
2NO + O2 = 2NO2
4NO2 + O2 + H2O = 4HNO3
Cu2S + 14HNO3 = 2Cu(NO3)2 + H2SO4 + 10NO2 + 6H2O
15. Фосфид цинка растворили в соляной кислоте. Полученный газ разделили на две части, одну часть поглотили раствором, содержащим перманганат калия и гидроксид калия, в результате раствор приобрёл зелёную окраску. Другую часть газа поглотили раствором дихромата калия, подкисленным серной кислотой. Полученную при этом соль хрома выделили, растворили в воде и к полученному раствору добавили раствор карбоната натрия. Напишите уравнения четырех описанных реакций.
Zn3P2 + 6HCl = 3ZnCl2 + 2PH3
PH3 + 8KMnO4 + 11KOH = K3PO4 + 8K2MnO4 + 7H2O
3PH3 + 4K2Cr2O7 + 16H2SO4 = 4Cr2(SO4)3 + 4K2SO4 + 3H3PO4 + 16H2O
Cr2(SO4)3 + 3Na2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 3Na2SO4