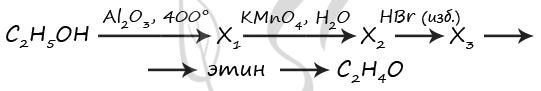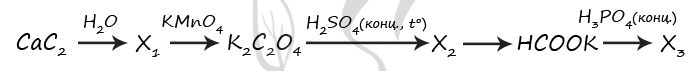Всего: 254 1–20 | 21–40 | 41–60 | 61–80 | 81–100 | 101–120 …
Добавить в вариант
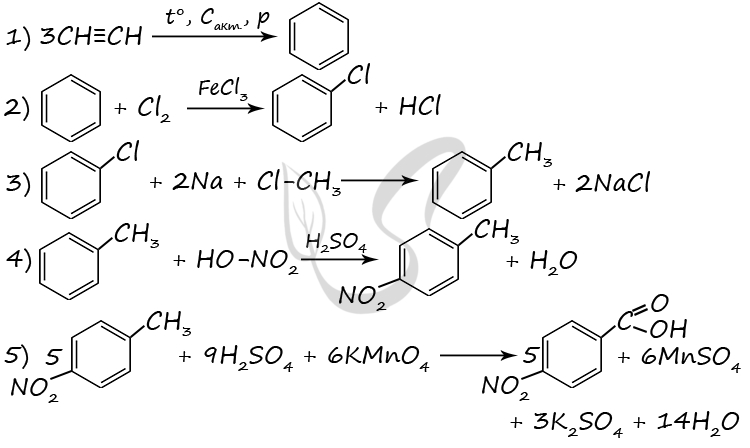
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях укажите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях укажите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях укажите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях укажите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях укажите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнении укажите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнении укажите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнении укажите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях приведите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях приведите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях приведите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях приведите структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях приведите структурные формулы органических веществ.
Всего: 254 1–20 | 21–40 | 41–60 | 61–80 | 81–100 | 101–120 …
15 мая 2022
В закладки
Обсудить
Жалоба
Подборка заданий прошлых лет.
Формулировка задания: «Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ».
32_reshenia.pdf
32_zadania.pdf
Источник: vk.com/examtop
Аннотация:
Предлагаю Вашему вниманию подборку тестовых заданий для подготовки к ЕГЭ-2016. Задания части 1, №32 на проверяемый элемент содержания курса химии «Характерные химические свойства неорганических веществ». Материал содержит 27 тестовых заданий. Ответы прилагаются.
Целевая аудитория: для 11 класса
Автор: Лихолетова Наталия Викторовна
Место работы: ГБОУ СОШ № 186, Санкт-Петербург
Добавил: lixnatali
Уважаемые коллеги! Автор ждёт Ваши отзывы! Оставьте своё мнение о разработке!
Всего комментариев: 1
Порядок вывода комментариев:

Физкультминутки
Физкультминутки обеспечивают кратковременный отдых детей на уроке, а также способствуют переключению внимания с одного вида деятельности на другой.

В помощь учителю
Уважаемые коллеги! Добавьте свою презентацию на Учительский портал и получите бесплатное свидетельство о публикации методического материала в международном СМИ.
Для добавления презентации на портал необходимо зарегистрироваться.
Конкурсы
Диплом и справка о публикации каждому участнику!
© 2007 — 2023 Сообщество учителей-предметников «Учительский портал»
Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.
Территория распространения: Российская Федерация, зарубежные страны.
Учредитель / главный редактор: Никитенко Е.И.
Сайт является информационным посредником и предоставляет возможность пользователям размещать свои материалы на его страницах.
Публикуя материалы на сайте, пользователи берут на себя всю ответственность за содержание этих материалов и разрешение любых спорных вопросов с третьими лицами.
При этом администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта.
Если вы обнаружили, что на сайте незаконно используются материалы, сообщите администратору через форму обратной связи — материалы будут удалены.
Все материалы, размещенные на сайте, созданы пользователями сайта и представлены исключительно в ознакомительных целях. Использование материалов сайта возможно только с разрешения администрации портала.
Фотографии предоставлены
Задание 32 на ЕГЭ по химии (бывшее задание С2 «нового типа») содержит описание эксперимента, состоящего из последовательно проводимых химических реакций и лабораторных методов разделения продуктов реакций (мысленный эксперимент).
По моим наблюдениям, у многих учеников это задание вызывает сложности. В немалой степени это объясняется все более академическим характером преподавания химии в школах и на курсах, когда изучению особенностей работы в лаборатории и собственно проведению лабораторных экспериментов выделяется недостаточное количество внимания.
Поэтому я решил систематизировать и обобщить материал по т.н. «лабораторной» химии. В этой статье рассматриваются примеры задания 32 в ЕГЭ по химии-2018 (бывшего задания С2), с подробным разбором и анализом решения.
Для выполнения этого задания необходимо хорошее понимание некоторых тем общей химии и химии элементов, а именно: основные классы неорганических веществ, химические свойства и получение оксидов, кислот, оснований и солей, и взаимосвязь между различными классами неорганических веществ; свойства простых веществ — металлов и неметаллов; гидролиз; электролиз; окислительно-восстановительные реакции (ОВР), основные окислители и восстановители, и их превращения в разных условиях, основные типы ОВР, химия щелочных металлов и их соединений, щелочноземельных металлов и соединений, углерода, кремния, азота, фосфора, серы, галогенов.
- Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты реакции разложения полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
Анализ и решение.
«Ключевые слова» — концентрированная азотная кислота и медь.
Медь — малоактивный металл, проявляет свойства восстановителя.
Окислительные свойства азотной кислоты определяет азот в степени окисления +5, поэтому при взаимодействии как с металлами, так и с другими восстановителями выделяется не водород, а вещество, содержащее азот в более низких степенях окисления; концентрированная азотная кислота растворяет малоактивные металлы и восстанавливается до NO2 (уравнение 1).
«Ключевые слова» — … осадок прокалили. Нитраты металлов, находящихся в ряду активности от магния до меди, разлагаются при нагревании на оксид металла, бурый газ и кислород (уравнение 2).
«Ключевые слова» — … пропустили водород. Восстановление оксидов металлов водородом — один из способов получения металлов (уравнение 3).
«Ключевые слова» — Газообразные продукты… поглощены водой…. При разложении нитрата меди выделяются NO2 и O2. Оксиду азота (IV) соответствуют азотистая и азотная кислоты, однако в присутствии окислителя — молекулярного кислорода в растворе образуется только азотная кислота (уравнение 4).
1) Сu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2↑ +2Н2O
2) 2Cu(NO3)2 = 2СuО + 4NO2↑ + O2↑
3) СuО + Н2 = Сu + Н2O
4) 4NO2 + O2+ 2Н2O = 4HNO3
- Простое вещество, полученное при нагревании фосфата кальция с коксом и оксидом кремния, сплавили с металлическим кальцием. Продукт реакции обработали водой, а выделившийся газ собрали и пропустили через раствор соляной кислоты. Напишите уравнения описанных реакций.
Анализ и решение
«Ключевые слова» — … нагревании фосфата кальция с коксом и оксидом кремния … . Первое из описанных превращений — промышленный способ получения фосфора (уравнение 1).
«Ключевые слова» — Простое вещество … сплавили с кальцием.
Простое вещество, образовавшееся в первом превращении, — фосфор. Металлы (восстановители) взаимодействуют с неметаллами (окислителями) с образованием бинарных соединений (солей или оксидов) (уравнение 2).
«Ключевые слова» — Продукт … обработали водой …. При взаимодействии фосфида Са3Р2 с водой происходит гидролиз (уравнение 3) и образуются гидроксид кальция Са(ОН)2 и фоcфин РН3, газ с чесночным запахом.
«Ключевые слова» — … газ … раствор соляной кислоты. Фосфин, являясь аналогом аммиака, проявляет основные свойства и реагирует с кислотой с образованием соли фосфония РН4Сl (уравнение 4).
1) Са3(Р+5O4)2 + 5С0 + 3SiO2 = 3CaSiO3 + 2Р0 + 5C+2O↑
2) 2Р + ЗСа = Са3Р2
3) Са3Р2 + 6Н2O = 3Са(ОН)2 + 2РН3↑
4) РН3 + НСl = РН4Сl
- Осадок, полученный при взаимодействии растворов хлорида железа (III) и нитрата серебра, отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует c алюминием с выделением тепла и света. Напишите уравнения описанных реакций.
Анализ и решение.
Ключевые слова: «… взаимодействии растворов хлорида железа (III) и нитрата серебра…». При взаимодействии двух растворимых солей протекает реакция ионного обмена, если в продуктах реакции есть малодиссоциирующее вещество (газ, осадок, вода и др.). При взаимодействии нитрата серебра и хлорида железа (III) выпадает белый творожистый осадок хлорида серебра (уравнение 1).
Далее осадок отфильтровали. Фильтрование — способ разделения смесей, при котором нерастворимые в воде вещества не проходят через тонкую пористую перегородку (фильтр), а растворимые в воде вещества с растворителем (фильтрат) переходят в отдельную емкость.
При фильтровании данного в задании раствора в осадке остается нерастворимый в воде хлорид серебра, а в фильтрат уходит растворимая в воде соль — нитрат железа (III).
Далее, ключевые слова: «… фильтрат обработали раствором едкого кали.«. При взаимодействии нитрата железа (III) с гидроксидом калия KOH протекает обменная реакция, с образованием нерастворимого в воде осадка — гидроксида железа (III)(реакция 2).
Далее, ключевые слова: «Выпавший осадок бурого цвета отделили и прокалили«. Гидроксид железа (III) — нерастворимое в воде основание. Как правило, нерастворимые основания при прокаливании разлагаются на оксид металла и воду (реакция 3).
Далее «Полученное вещество при нагревании реагирует c алюминием с выделением тепла и света«. Данное описание соответствует окислительно-восстановительной реакции между оксидом железа (III) и алюминием. При нагревании смеси этих соединений происходит экзотермическая реакция восстановления железа до простого вещества-металла, при этом теплота выделяется также в форме света. Восстановление металлов из оксидов с помощью алюминия называют алюмотермией.
1) FeCl3 + 3AgNO3 = 3AgCl + Fe(NO3)3
2) Fe(NO3)3 + 3KOH = Fe(OH)3 + 3KNO3
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 2Al = Al2O3 + 2Fe
4. Вещество, полученное на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Полученный продукт последовательно обработали сернистым газом и раствором гидроксида бария. Напишите уравнения описанных реакций.
Анализ и решение.
Первая часть: «… при электролизе расплава хлорида натрия«. Электролиз — это химическая реакция, протекающая под действием тока. При электролизе расплавов солей на катоде происходит восстановление металлов до простых веществ, на аноде — окисление неметаллов до простых веществ (уравнение 1).
Далее, ключевые слова: «Вещество, полученное на катоде … сожгли в кислороде«. При электролизе расплава хлорида натрия на катоде выделяется металлический натрий. При сжигании простое вещество натрий образует преимущественно пероксид (уравнение 2).
Ключевые слова: «Полученный продукт … обработали сернистым газом«. Пероксид натрия, как и пероксид водорода, проявляет двойственные свойства, и может выступать и как окислитель, и как восстановитель. Сернистый газ SO2 — типичный восстановитель. При взаимодействии с сернистым газом кислород пероксида натрия выступает в качестве окислителя и восстанавливается до степени окисления -2 (уравнение 3). Подробнее про ОВР — в статье «Окислительно-восстановительные реакции».
Ключевые слова: » … Полученный продукт последовательно обработали сернистым газом и раствором гидроксида бария«. Сульфат натрия, полученный в предыдущей стадии, вступает в реакцию ионного обмена с гидроксидом бария с выпадением осадка сульфата бария (уравнение 4).
1) 2NaCl = 2Na + Cl2
2) 2Na + O2 = Na2O2
3) Na2O2 + SO2 = Na2SO4
4) Na2SO4 + Ba(OH)2 = NaOH + BaSO4
5. Продукты разложения хлорида аммония последовательно пропустили через нагретую трубку, содержащую оксид меди (II), а затем через склянку с оксидом фосфора (V). Напишите уравнения описанных реакций.
Анализ и решение.
Ключевые слова: «Продукты разложения хлорида аммония…». Хлорид аммония — соль, которая разлагается при нагревании твердой соли на газообразный аммиак и газ хлороводород (уравнение 1)
Далее, продукты разложения последовательно пропускают через нагретую трубку, содержащую оксид меди (II). Последовательно, значит, они реагируют по очереди. Оксид меди (II) — основный, при взаимодействии с кислотой HCl образует соль и воду (уравнение 2). Оксид меди (II) также проявляет окислительные свойства, при взаимодействии с аммиаком восстанавливается до простого вещества — меди, а аммиак окисляется также до простого вещества (уравнение 3). Подробнее про ОВР — в статье «Окислительно-восстановительные реакции».
Далее, продукты реакций 2 и 3 пропускают через емкость с оксидом фосфора (V). Анализируем возможность протекания химической реакции между веществами. Простое вещество медь химически малоактивно и не реагирует с кислотным оксидом фосфора. Простое вещество азот также химически малоактивно, с оксидом фосфора (V) не реагирует. Зато с кислотным оксидом фосфора (V) отлично реагируют пары воды с образованием орто-фосфорной кислоты (уравнение 4).
1) NH4Cl = NH3 + HCl
2) CuO + 2HCl = CuCl2 + H2O
3) 3CuO + 2NH3 = 3Cu + N2 + 3H2O
4) 3H2O + P2O5 = 2H3PO4
6. К нерастворимой в воде соли белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прилили раствор соляной кислоты, в результате соль растворилась и выделился газ, при пропускании которого через известковую воду выпал осадок белого цвета; осадок растворился при дальнейшем пропускании газа. При кипячении полученного раствора выпадает осадок. Напишите уравнения описанных реакций.
Анализ и решение.
Из школьного курса химии хорошо известно, что нерастворимой в воде солью белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала является карбонат кальция CaCO3. Нерастворимые соли растворяются под действием более сильных кислот, в данном случае, соляной кислоты (уравнение 1).
Образующийся газ пропускают через известковую воду Ca(OH)2. Углекислый газ — типичный кислотный оксид, который при взаимодействии с щелочью образует соль — карбонат кальция (уравнение 2). Далее осадок растворился при дальнейшем пропускании газа. Здесь рассматривается очень важное свойство: средние соли многоосновных кислот под действием избытка кислоты образуют более кислые соли. Карбонат кальция в избытке углекислого газа образует более кислую соль — гидрокарбонат кальция Ca(HCO3)2, который хорошо растворим в воде (уравнение 3).
Свойства кислых солей в значительной степени складываются из свойств образующих кислые соли соединений. Свойства гидрокарбоната кальция определяются свойствами образующих его соединений — угольной кислоты H2CO3 и карбоната кальция. Несложно вывести, что при кипячении гидрокарбонат будет разлагаться на карбонат кальция (раздагается при более высоких температурах, порядка 1200 градусов Цельсия), углекислый газ и воду (уравнение 4).
1) CaCO3 + 2HCl = CaCl2 + CO2 + H2O
2) CO2 +Ca(OH)2 = CaCO3 + H2O
3) CaCO3 + H2O + CO2 = Ca(HCO3)2
4) Ca(HCO3)2 = CaCO3 + H2O + CO2
7. Вещество, полученное на аноде при электролизе раствора йодида натрия с инертными электродами, прореагировало с сероводородом. Образовавшееся твёрдое вещество сплавили с алюминием и продукт растворили в воде. Напишите уравнения описанных реакций.
Анализ и решение.
Электролиз раствора йодида натрия с инертными электродами описывается уравнением:
1. 2NaI + 2H2O = 2NaOH + H2 + I2
Более подробно про электролиз можно прочитать в соответствующей статье. При этом на аноде выделяется йод. Йод реагирует с сероводородом. При этом йод окислитель, а сера — восстановитель:
2. I20 + H2S-2 = 2HI— + S0
При этом образовалась твердая сера. Сера реагирует с алюминием при сплавлении, образуя сульфид алюминия. Большинство неметаллов реагируют с металлами с образованием бинарных соединений:
3. 3S0 + 2Al0 = Al2+3S3-2
Продукт реакции алюминия с серой — сульфид алюминия — при растворении в воде необратимо распадается на гидроксид алюминия и сероводород:
4. Al2S3 + 12H2O = 2Al(OH)3 + 3H2S
Такие реакции называют также реакциями необратимого гидролиза. Подробно случаи необратимого гидролиза рассмотрены в статье.
8. Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, реагирует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с горячей концентрированной азотной кислотой. Напишите уравнения описанных реакций.
9. Сульфид хрома (III) обработали водой, при этом выделился газ и осталось нерастворимое вещество. К этому веществу прибавили раствор едкого натра и пропустили газообразный хлор, при этом раствор приобрёл жёлтое окрашивание. Раствор подкислили серной кислотой, в результате окраска изменилась на оранжевую; через полученный раствор пропустили газ, выделившийся при обработке сульфида водой, и цвет раствора изменился на зелёный. Напишите уравнения описанных реакций.
Анализ и решение.
Ключевые слова: «Сульфид хрома (III) обработали водой, при этом выделился газ и осталось нерастворимое вещество«. Сульфид хрома (III) под действием воды разлагается на гидроксид и сероводород. Подробно реакции гидролиза таких соединений рассмотрены в статье «Гидролиз». (реакция 1)
1) Cr2S3 + 6H2O = 2Cr(OH)3 + 3H2S
Ключевые слова: «… прибавили раствор едкого натра и пропустили газообразный хлор, при этом раствор приобрёл жёлтое окрашивание«. Под действием хлора в щелочной среде хром +3 окисляется до хрома +6. Хром +6 образует кислотный оксид и гидроксид, в растворе едкого натрия образует устойчивую соль желтого цвета — хромат натрия (реакция 2).
2) 2Cr+3(OH)3 + 3Cl02 + 10NaOH = 2Na2Cr+6O4 + 6NaCl— + 8H2O
Далее, ключевые слова: «Раствор подкислили серной кислотой, в результате окраска изменилась на оранжевую«. Соли-хроматы в кислой среде переходят в дихроматы. Желтый хромат натрия в кислой среде превращается в оранжевый дихромат натрия (реакция 3). Это не ОВР!
3) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O.
Далее: «… через полученный раствор пропустили газ, выделившийся при обработке сульфида водой, и цвет раствора изменился на зелёный«. Дихромат натрия — сильный окислитель, при взаимодействии с сероводородом восстанавливается до трехвалентной соли хрома. Соединения хрома (III) — амфотерные, в кислой среде образуют соли. Соли хрома (III) окрашивают раствор в зеленый цвет (реакция 4).
4) Na2Cr+62O7 + 3H2S-2 + 4H2SO4 = 3S0 + Cr+32(SO4)3 + Na2SO4 + 7H2O
10. Получение чёрно-белого изображения при фотографировании основано на разложении соли неизвестного металла под действием света. При растворении этого металла в разбавленной азотной кислоте выделяется бесцветный газ, который на воздухе быстро изменяет свой цвет на бурый, и образуется соль, взаимодействующая с бромидом натрия с образованием творожистого осадка желтоватого цвета. Анионом в соли, используемой в фотографии, является анион кислоты, которая образуется одновременно с серной кислотой, при взаимодействии бромной воды и сернистого газа. Напишите уравнения описанных реакций.
11. В раствор, полученный при взаимодействии алюминия с разбавленной серной кислотой, по каплям добавляли раствор гидроксида натрия до образования осадка. Выпавший осадок белого цвета отфильтровали и прокалили. Полученное вещество сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
Анализ и решение.
Разбавленная серная кислота при взаимодействии с металлами ведет себя, как обычная минеральная кислота. Металлы, находящиеся в ряду электрохимической активности левее водорода, при взаимодействии с минеральными кислотами вытесняют водород:
1. 2Al0 + 3H+2SO4 = Al+32(SO4)3 + 3H02
Далее, с гидроксидом натрия взаимодействует сульфат алюминия. В условии указано, что гидроксид натрия добавляли по каплям. Это значит, что гидроксид натрия был в недостатке, а сульфат алюминия -в значительном избытки. При таких условиях образуется осадок гидроксида алюминия:
2. Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4
Осадок белого цвета — гидроксид алюминия, нерастворимый в воде. При прокаливании нерастворимые гидроксиды разлагаются на воду и соответствующий оксид:
3. 2Al(OH)3 = Al2O3 + 3H2O
Полученное вещество — оксид алюминия — сплавили с карбонатом натрия. В расплаве менее летучие оксиды вытесняют более летучие из солей. Карбонат — это соль, которой соответствует летучий оксид, углекислый газ. Соответственно, при сплавлении карбонатов щелочных металлов с твердыми оксидами (кислотными и амфотерными) образуется соль, соответствующая этому оксиду, и углекислый газ:
4. Al2O3 + Na2CO3 = 2NaAlO2 + CO2
12. Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
13. Простое вещество, полученное при нагревании смеси фосфата кальция с коксом и оксидом кремния, растворяется в растворе едкого кали. Выделяющееся газообразное вещество сожгли, продукты горения собрали и охладили, а в полученный раствор добавили нитрат серебра. Напишите уравнения описанных реакций.
14. Зловонную жидкость, образовавшуюся при взаимодействии бромистого водорода с перманганатом калия, отделили и нагрели с железной стружкой. Продукт реакции растворили в воде и добавили к нему раствор гидроксида цезия. Образовавшийся осадок отфильтровали и прокалили. Напишите уравнения описанных реакций.
15. Над поверхностью раствора едкого натра пропускали электрические разряды, при этом воздух окрашивался в бурый цвет, причём окраска через некоторое время исчезала. Полученный раствор осторожно выпарили и установили, что твёрдый остаток представляет собой смесь двух солей. Выдерживание смеси солей на воздухе приводит к образованию одного вещества. Напишите уравнения описанных реакций.
16. Кальций растворили в воде. При пропускании через полученный раствор сернистого газа образуется осадок белого цвета, который растворяется при пропускании избытка газа. Добавление к полученному раствору щёлочи приводит к образованию осадка белого цвета. Напишите уравнения описанных реакций.
17. При сжигании на воздухе простого вещества жёлтого цвета образуется газ с резким запахом. Этот газ выделяется также при обжиге некоторого минерала, содержащего железо, на воздухе. При действии разбавленной серной кислоты на вещество, состоящее из тех же элементов, что и минерал, но в другом соотношении, выделяется газ с характерным запахом тухлых яиц. При взаимодействии выделившихся газов друг с другом образуется исходное простое вещество. Напишите уравнения описанных реакций.
18. Газообразный продукт взаимодействия сухой поваренной соли с концентрированной серной кислотой ввели в реакцию с раствором перманганата калия. Выделившийся газ пропустили через раствор сульфида натрия. Выпавший осадок жёлтого цвета растворяется в концентрированном растворе гидроксида натрия. Напишите уравнения описанных реакций.
19. Газ, образовавшийся при пропускании хлористого водорода через горячий раствор хромата калия, взаимодействует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с концентрированной серной кислотой при нагревании. Напишите уравнения описанных реакций.
20. Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании её с раствором щёлочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой. Напишите уравнения описанных реакций.
21. К раствору сульфата алюминия добавили избыток раствора гидроксида натрия. В полученный раствор небольшими порциями прибавляли соляную кислоту, при этом наблюдали образование объёмного осадка белого цвета, который растворился при дальнейшем прибавлении кислоты. В образовавшийся раствор прилили раствор карбоната натрия. Напишите уравнения описанных реакций.
22. Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твёрдый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остаётся единственное вещество. Напишите уравнения описанных реакций.
23. Оксид цинка растворили в растворе хлороводородной кислоты и раствор нейтрализовали, добавляя едкий натр. Выделившееся студенистое вещество белого цвета отделили и обработали избытком раствора щёлочи, при этом осадок полностью растворился. Нейтрализация полученного раствора кислотой, например, азотной, приводит к повторному образованию студенистого осадка. Напишите уравнения описанных реакций.
24. Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
25. Смесь ортофосфата кальция, кокса и песка нагревали в электрической печи. Один из продуктов этой реакции может самовоспламеняться на воздухе. Твёрдый продукт горения этого вещества при нагревании растворили в воде и через полученный раствор пропустили газообразный аммиак. Напишите уравнения описанных реакций.
26. Вещество, полученное на катоде при электролизе раствора хлорида железа (II), сплавили с серой и продукт этой реакции подвергли обжигу. Образовавшийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
27. В нагретую концентрированную серную кислоту внесли медную проволоку и выделяющийся газ пропустили через избыток раствора едкого натра. Раствор осторожно выпарили, твёрдый остаток растворили в воде и нагрели с порошкообразной серой. Непрореагировавшую серу отделили фильтрованием и к раствору прибавили серную кислоту, при этом наблюдали образование осадка и выделение газа с резким запахом. Напишите уравнения описанных реакций.
28. После кратковременного нагревания неизвестного порошкообразного вещества оранжевого цвета начинается самопроизвольная реакция, которая сопровождается изменением цвета на зелёный, выделением газа и искр. Твёрдый остаток смешали с едким кали и нагрели, полученное вещество внесли в разбавленный раствор соляной кислоты, при этом образовался осадок зелёного цвета, который растворяется в избытке кислоты. Напишите уравнения описанных реакций.
29. Две соли окрашивают пламя в фиолетовый цвет. Одна из них бесцветна, и при лёгком нагревании её с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа. При добавлении к раствору второй соли раствора серной кислоты жёлтая окраска раствора изменяется на оранжевую, а при нейтрализации полученного раствора щёлочью восстанавливается первоначальный цвет. Напишите уравнения описанных реакций.
30. Раствор хлорида железа (III) подвергли электролизу с графитовыми электродами. Осадок бурого цвета, образовавшийся в качестве побочного продукта электролиза, отфильтровали и прокалили. Вещество, образовавшееся на катоде, растворили в концентрированной азотной кислоте при нагревании. Продукт, выделившийся на аноде, пропустили через холодный раствор гидроксида калия. Напишите уравнения описанных реакций.
31. Газ, выделившийся при взаимодействии хлористого водорода с бертолетовой солью, ввели в реакцию с алюминием. Продукт реакции растворили в воде и добавили гидроксид натрия до прекращения выделения осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
32. Неизвестная соль бесцветна и окрашивает пламя в жёлтый цвет. При лёгком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
33. Вещество, полученное на аноде при электролизе расплава йодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
34. Газы, которые выделяются при нагревании угля в концентрированных азотной и серной кислотах, смешали друг с другом. Продукты реакции пропустили через известковое молоко. Напишите уравнения описанных реакций.
35. Смесь железного порошка и твёрдого продукта, полученного при взаимодействии сернистого газа и сероводорода, нагрели без доступа воздуха. Полученный продукт подвергли обжигу на воздухе. Образовавшееся твёрдое вещество реагирует с алюминием с выделением большого количества тепла. Напишите уравнения описанных реакций.
36. Вещество чёрного цвета получили, прокаливая осадок, который образуется при взаимодействии растворов гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
37. Простое вещество, смесь которого с бертолетовой солью используется в спичках и воспламеняется при трении, сожгли в избытке кислорода. Твёрдое вещество белого цвета, образовавшееся в результате сгорания, растворили в избытке раствора гидроксида натрия. Полученная при этом соль с раствором нитрата серебра образует осадок ярко-жёлтого цвета. Напишите уравнения описанных реакций.
38. Цинк растворили в очень разбавленной азотной кислоте и в полученный раствор добавили избыток щёлочи, получив прозрачный раствор. Напишите уравнения описанных реакций.
39. Раствор, полученный при пропускании сернистого газа через бромную воду, нейтрализовали гидроксидом бария. Выпавший осадок отделили, смешали с коксом и прокалили. При обработке продукта прокаливания хлороводородной кислотой выделяется газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
40. Вещество, образующееся при добавлении цинкового порошка в раствор хлористого железа, отделили фильтрованием и растворили в горячей разбавленной азотной кислоте. Раствор упарили, твёрдый остаток прокалили и выделившиеся газы пропустили через раствор гидроксида натрия. Напишите уравнения описанных реакций.
41. Газ, выделившийся при нагревании раствора хлористого водорода с оксидом марганца (IV), ввели во взаимодействие с алюминием. Продукт реакции растворили в воде и добавили сначала избыток раствора гидроксида натрия, а затем соляную кислоту (избыток). Напишите уравнения описанных реакций.
42. Смесь двух бесцветных, не имеющих цвета и запаха, газов А и В пропустили при нагревании над катализатором, содержащим железо, и образующимся при этом газом В нейтрализовали раствор бромоводородной кислоты. Раствор выпарили и остаток нагрели с едким кали, в результате выделился бесцветный газ В с резким запахом. При сжигании газа В на воздухе образуются вода и газ А. Напишите уравнения описанных реакций.
43. Сернистый газ пропустили через раствор перекиси водорода. Из образовавшегося раствора выпарили воду и к остатку добавили магниевую стружку. Выделяющийся газ пропустили через раствор медного купороса. Выпавший осадок чёрного цвета отделили и подвергли обжигу. Напишите уравнения описанных реакций.
44. К нерастворимой в воде соли белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прилили раствор соляной кислоты, в результате соль растворилась и выделился газ, при пропускании которого через известковую воду выпал осадок белого цвета, который растворился при дальнейшем пропускании газа. При добавлении в полученный раствор избытка известковой воды выпадает осадок. Напишите уравнения описанных реакций.
45. При обжиге некоторого минерала А, состоящего из двух элементов, образуется газ, имеющий характерный резкий запах и обесцвечивающий бромную воду с образованием в растворе двух сильных кислот. При взаимодействии вещества Б, состоящего из тех же элементов, что и минерал А, но в другом соотношении, с концентрированной хлороводородной кислотой выделяется ядовитый газ с запахом тухлых яиц. При взаимодействии выделившихся газов друг с другом образуются простое вещество жёлтого цвета и вода. Напишите уравнения описанных реакций.
46. Вещество, выделяющееся на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Полученный продукт поместили в газометр, наполненный углекислым газом. Образовавшееся вещество добавили в раствор хлорида аммония и раствор нагрели. Напишите уравнения описанных реакций.
47. Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганата калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким характерным запахом. Напишите уравнения описанных реакций.
48. При взаимодействии раствора соли А со щёлочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твёрдый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твёрдое вещество чёрного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
49. Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе. Твёрдый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода; при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций.
50. На раствор хлорного железа подействовали раствором едкого натра, выпавший осадок отделили и нагрели. Твёрдый продукт реакции смешали с кальцинированной содой и прокалили. К оставшемуся веществу добавил и нитрат и гидроксид натрия и длительное время нагревали при высокой температуре. Напишите уравнения описанных реакций.
Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, пропустили через раствор тетрагидроксоалюмината натрия. Образовавшийся осадок отфильтровали, прокалили и твёрдый остаток обработали соляной кислотой. Напишите уравнения описанных реакций.
Азотоводородную смесь нагрели до температуры 500°С и под высоким давлением пропустили над железным катализатором. Продукты реакции пропускали через раствор азотной кислоты до его нейтрализации. Образовавшийся раствор осторожно выпарили, твёрдый остаток прокалили и выделившийся при этом газ пропустили над медью при нагревании, в результате образовалось твёрдое вещество чёрного цвета. Напишите уравнения описанных реакций.
Гидроксид трёхвалентного хрома обработали соляной кислотой. В полученный раствор добавили поташ, выделившийся осадок отделили и внесли в концентрированный раствор едкого кали, в результате осадок растворился. После добавления избытка соляной кислоты был получен раствор зелёного цвета. Напишите уравнения описанных реакций.
Вещество, полученное на аноде при электролизе раствора йодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций.
Оксид двухвалентного железа нагрели с разбавленной азотной кислотой. Раствор осторожно выпарили, твёрдый остаток растворили в воде, в получившийся раствор внесли железный порошок и через некоторое время профильтровали. К фильтрату добавили раствор едкого кали, выпавший осадок отделили и оставили на воздухе, при этом цвет вещества изменился. Напишите уравнения описанных реакций.
Одно из веществ, образующихся при сплавлении оксида кремния с магнием, растворяется в щёлочи. Выделяющийся газ ввели в реакцию с серой, а продукт их взаимодействия обработали хлором. Напишите уравнения описанных реакций.
Твёрдое вещество, образующееся при взаимодействии сернистого газа и сероводорода, при нагревании взаимодействует с алюминием. Продукт реакции растворили в разбавленной серной кислоте и в образовавшийся раствор добавили поташ. Напишите уравнения описанных реакций.
Неизвестный металл сожгли в кислороде. Продукт реакции, взаимодействуя с углекислым газом, образует два вещества: твёрдое, которое взаимодействует с раствором соляной кислоты с выделением углекислого газа, и газообразное простое вещество, поддерживающее горение. Напишите уравнения описанных реакций.
Продукт взаимодействия азота и лития обработали водой. Выделившийся в результате реакции газ смешали с избытком кислорода и при нагревании пропустили над платиновым катализатором; образовавшаяся газовая смесь имела бурый цвет. Напишите уравнения описанных реакций.
Медную стружку растворили в разбавленной азотной кислоте и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на чёрный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
Фосфор сожгли в избытке хлора, образующееся твёрдое вещество смешали с фосфором и нагрели. Продукт реакции обработали водой, при этом выделялся бесцветный газе резким запахом. Раствор добавили к подкисленному серной кислотой раствору перманганата калия, который в результате реакции обесцветился. Напишите уравнения описанных реакций.
Хлористое железо обработали при нагревании концентрированной азотной кислотой и раствор осторожно выпарили. Твёрдый продукт растворили в воде, добавили к полученному раствору поташ и выпавший осадок отделили и прокалили. Над полученным веществом пропустили при нагревании газообразный водород. Напишите уравнения описанных реакций.
Неизвестная соль при взаимодействии с раствором нитрата серебра образует осадок белого цвета и окрашивает пламя горелки в жёлтый цвет. При взаимодействии концентрированной серной кислоты с этой солью образуется ядовитый газ, хорошо растворимый в воде. В полученном растворе растворяется железо, при этом выделяется очень легкий бесцветный газ, который используется для получения металлов, например, меди, из их оксидов. Напишите уравнения описанных реакций.
Силицид магния обработали раствором хлороводородной кислоты и выделяющийся газ сожгли. Твёрдый продукт реакции смешали с кальцинированной содой, смесь нагрели до плавления и выдержали некоторое время. После охлаждения продукт реакции (широко используется под названием «жидкое стекло») растворили в воде и обработали раствором серной кислоты. Напишите уравнения описанных реакций.
Газовую смесь аммиака и большого избытка воздуха пропустили при нагревании над платиной и продукты реакции через некоторое время поглотили раствором едкого натра. После выпаривания раствора был получен единственный продукт. Напишите уравнения описанных реакций.
К раствору хлорного железа добавили кальцинированную соду и выпавший осадок отделили и прокалили. Над полученным веществом пропустили при нагревании угарный газ и твёрдый продукт последней реакции ввели во взаимодействие с бромом. Напишите уравнения описанных реакций.
Продукт взаимодействия серы с алюминием (реакция протекает при нагревании) растворили в холодной разбавленной серной кислоте и в раствор добавили карбонат калия. Образовавшийся осадок отделили, смешали с едким натром и нагрели. Напишите уравнения описанных реакций.
Хлорид кремния (IV) нагревали в смеси с водородом. Продукт реакции смешали с магниевым порошком, нагрели и обработали водой; одно из образующихся веществ самовоспламеняется на воздухе. Напишите уравнения описанных реакций.
Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели; выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твёрдый продукт реакции прокалили. Напишите уравнения описанных реакций.
Железную окалину растворили в концентрированной азотной кислоте при нагревании. Раствор осторожно выпарили и продукт реакции растворили в воде. К полученному раствору добавили железный порошок, через некоторое время раствор отфильтровали и фильтрат обработали раствором едкого кали, в результате выделился осадок светло-зелёного цвета, который быстро темнел на воздухе. Напишите уравнения описанных реакций.
К раствору кальцинированной соды добавили раствор хлорида алюминия, выделившееся вещество отделили и внесли в раствор едкого натра. В образовавшийся раствор по каплям прибавляли раствор хлороводородной кислоты до прекращения образования осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворялся с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
Продукт взаимодействия фосфида магния с водой сожгли и продукты реакции поглотили водой. Образовавшееся вещество используется в промышленности для получения двойного суперфосфата из фосфорита. Напишите уравнения описанных реакций.
Соль, полученную при взаимодействии оксида цинка с серной кислотой, прокалили при 800 °С. Твёрдый продукт реакции обработали концентрированным раствором щёлочи и через полученный раствор пропустили углекислый газ. Напишите уравнения реакций описанных превращений.
К раствору хлорного железа добавили железный порошок и через некоторое время раствор профильтровали. К фильтрату добавили гидроксид натрия, выделившийся осадок отделили и обработали перекисью водорода. К полученному веществу добавили избыток раствора едкого кали и бром; в результате протекания реакции окраска брома исчезла. Напишите уравнения описанных реакций.
Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твёрдый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
Сернистый газ пропустили через раствор перекиси водорода. Раствор упарили и в оставшуюся жидкость добавили медную стружку. Выделившийся газ смешали с газом, который образуется при взаимодействии сульфида железа (II) с раствором бромоводородной кислоты. Напишите уравнения описанных реакций.
При добавлении в раствор соли жёлтого цвета, окрашивающей пламя в фиолетовый цвет, разбавленной соляной кислоты окраска изменилась на оранжево-красную. После нейтрализации раствора концентрированной щёлочью цвет раствора вернулся к первоначальному. При добавлении в полученный раствор хлорида бария выпадает осадок жёлтого цвета. Осадок отфильтровали и в фильтрат добавили раствор нитрата серебра. Напишите уравнения описанных реакций.
Силицид магния обработали раствором соляной кислоты, продукт реакции сожгли, образовавшееся твёрдое вещество смешали с кальцинированной содой и нагрели до плавления. После охлаждения расплава его обработали водой и к полученному раствору добавили азотную кислоту. Напишите уравнения описанных реакций.
Нерастворимое вещество, образующееся при добавлении в раствор хлористого железа едкого натра, отделили и растворили в разбавленной серной кислоте. В полученный раствор добавили цинковую пыль, выделившийся осадок отфильтровали и растворили в концентрированной соляной кислоте. Напишите уравнения описанных реакций.
Нитрат алюминия прокалили, продукт реакции смешали с кальцинированной содой и нагрели до плавления. Образовавшееся вещество растворили в азотной кислоте и полученный раствор нейтрализовали раствором аммиака, при этом наблюдали выделение объёмного студенистого осадка. Напишите уравнения описанных реакций.
Нитрид магния обработали избытком воды. При пропускании выделяющегося газа как через бромную воду или через нейтральный раствор перманганата калия, так и при его сжигании образуется один и тот же газообразный продукт. Напишите уравнения описанных реакций.
Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты — становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
Твёрдое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой и, после отделения от серной кислоты, внесли в раствор хлорида натрия, содержащий медные опилки, и результате образовался осадок. Напишите уравнения описанных реакций.
Фосфин пропустили через горячий раствор концентрированной азотной кислоты. Раствор нейтрализовали негашёной известью, выпавший осадок отделили, смешали с коксом и кремнезёмом и прокалили. Продукт реакции, который светится на воздухе, нагрели в растворе едкого натра. Напишите уравнения описанных реакций.
Железный порошок растворили в большом количестве разбавленной серной кислоты и через полученный раствор пропустили воздух, а затем газ с запахом тухлых яиц. Образовавшуюся нерастворимую соль отделили и растворили в горячем растворе концентрированной азотной кислоты. Напишите уравнения описанных реакций.
Бесцветные газы выделяются при выдерживании концентрированной серной кислоты как с хлоридом натрия, так и с йодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли. Напишите уравнения описанных реакций.
Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.
Один из продуктов взаимодействия аммиака с бромом — газ, входящий в состав атмосферы, смешали с водородом и нагрели в присутствии платины. Образовавшуюся смесь газов пропустили через раствор соляной кислоты и к полученному раствору добавили при небольшом нагревании нитрит калия. Напишите уравнения описанных реакций.
Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
Неизвестное вещество А растворяется в концентрированной соляной кислоте, процесс растворения сопровождается выделением газа с запахом тухлых яиц; после нейтрализации раствора щёлочью образуется объёмный осадок белого (светло-зелёного) цвета. При обжиге вещества А образуются два оксида. Один из них — газ, имеющий характерный резкий запах и обесцвечивающий бромную воду с образованием в растворе двух сильных кислот. Напишите уравнения описанных реакций.
Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагревали до появления запаха, после чего добавили раствор щёлочи. Напишите уравнения описанных реакций.
К раствору сульфата трёхвалентного хрома добавили кальцинированную соду. Выделившийся осадок отделили, перенесли в раствор едкого натра, добавили бром и нагрели. После нейтрализации продуктов реакции серной кислотой раствор приобретает оранжевую окраску, которая исчезает после пропускания через раствор сернистого газа. Напишите уравнения описанных реакций.
Негашёную известь прокалили с избытком кокса. Продукт реакции после обработки водой используется для поглощения сернистого и углекислого газов. Напишите уравнения описанных реакций.
На сульфид двухвалентного железа подействовали раствором соляной кислоты, выделяющийся газ собрали и сожгли в воздухе. Продукты реакции пропустили через избыток раствора едкого кали, после чего в образовавшийся раствор добавили раствор перманганата калия. Напишите уравнения описанных реакций.
Твёрдый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили и твёрдый остаток прокалили, получив вещество чёрного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
Красный фосфор сожгли в атмосфере хлора. Продукт реакции обработали избытком воды и в раствор добавили порошкообразный цинк. Выделяющийся газ пропустили над нагретым оксидом двухвалентного железа. Напишите уравнения реакций описанных превращений.
Серебристо-серый металл, который притягивается магнитом, внесли в горячую концентрированную серную кислоту и нагрели. Раствор охладили и добавили едкий натр до прекращения образования аморфного осадка бурого цвета. Осадок отделили, прокалили и растворили в концентрированной соляной кислоте при нагревании. Напишите уравнения описанных реакций.
Магниевую стружку нагревали в атмосфере азота и продукт реакции последовательно обработали кипящей водой, растворами серной кислоты и нитрата бария. Напишите уравнения описанных реакций.
При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха; при нагревании этой соли без катализатора образуются соль Б и соль высшей кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный ядовитый газ (простое вещество) и образуется соль Б. Соль Б окрашивает пламя в фиолетовый цвет; при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
Осадок, полученный при добавлении в раствор сульфата алюминия каустической соды, отделили, прокалили, смешали с кальцинированной содой и нагрели до плавления. После обработки остатка серной кислотой была получена исходная соль алюминия. Напишите уравнения описанных реакций.
Вещество, образующееся при сплавлении магния с кремнием, обработали водой, в результате образовался осадок и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
Вещество, полученное при нагревании железной окалины в атмосфере водорода, внесли в горячую концентрированную серную кислоту и нагрели. Полученный раствор выпарили, остаток растворили в воде и обработали раствором хлорида бария. Раствор профильтровали и в фильтрат внесли медную пластинку, которая через некоторое время растворилась. Напишите уравнения описанных реакций.
Негашёную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при кальцинировании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение осадка. Напишите уравнения описанных реакций.
Смесь азота и водорода последовательно пропустили над нагретой платиной и через раствор серной кислоты. В раствор добавили хлорид бария и после отделения выпавшего осадка — известковое молоко и нагрели. Напишите уравнения описанных реакций.
Приведите примеры взаимодействия:
двух кислот
двух оснований
двух кислых солей
двух кислотных оксидов
Напишите уравнения описанных реакций.
Раствор средней соли, образующейся при пропускании сернистого газа через раствор щёлочи, на длительное время оставили на воздухе. Твёрдое вещество, образующееся после выпаривания раствора, смешали с коксом и нагрели до высокой температуры. При добавлении к твёрдому продукту реакции соляной кислоты выделяется газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
К порошкообразному веществу чёрного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
Красный фосфор сожгли в атмосфере хлора и к продукту реакции добавили небольшое количество (несколько капель) воды. Выделяющееся вещество растворили в избытке воды, в полученный раствор добавили железный порошок и газообразный продукт реакции пропустили над нагретой, окисленной до оксида двухвалентной меди, медной пластинкой. Напишите уравнения реакций описанных превращений.
Раствор хлорида железа (III) подвергли электролизу с графитовыми электродами. Осадок бурого цвета, образовавшийся при электролизе, отфильтровали и растворили в растворе гидроксида натрия, после чего добавили такое количество серной кислоты, которое необходимо для образования прозрачного раствора. Продукт, выделившийся на аноде, пропустили через горячий раствор гидроксида калия. Напишите уравнения описанных реакций.
В раствор кристаллической соды добавили хлорид алюминия, выделившийся осадок отделили и обработали раствором едкого натра. Полученный раствор нейтрализовали азотной кислотой, выделившийся осадок отделили и прокалили. Напишите уравнения описанных реакций.
Аммиак смешали с большим избытком воздуха, нагрели в присутствии платины и через некоторое время поглотили водой. Медная стружка, добавленная в полученный раствор, растворяется с выделением бурого газа. Напишите уравнения описанных реакций.
При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного цвета. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ, входящий и состав атмосферного воздуха. Напишите уравнения описанных реакций.
Продукт взаимодействия кремния с хлором легко гидролизуется. При сплавлении твёрдого продукта гидролиза как с каустической, так и с кальцинированной содой образуется жидкое стекло. Напишите уравнения описанных реакций.
К раствору, полученному при растворении железа в горячей концентрированной соляной кислоте, прибавили едкий натр. Выделившийся осадок отделили, на длительное время оставили на воздухе, после чего растворили в разбавленной соляной кислоте. Напишите уравнения описанных реакций.
При нагревании вещества оранжевого цвета оно разлагается; среди продуктов разложения — бесцветный газ и твёрдое вещество зелёного цвета. Выделившийся газ реагирует с литием даже при небольшом нагревании. Продукт последней реакции взаимодействует с водой, при этом выделяется газ с резким запахом, который может восстанавливать металлы, например медь, из их оксидов. Напишите уравнения описанных реакций.
Газ с запахом тухлых яиц пропустили через концентрированную серную кислоту при комнатной температуре. Образовавшийся осадок отделили и обработали горячей концентрированной азотной кислотой; выделяющийся газ растворили в большом количестве воды и в полученный раствор добавили кусочек меди. Напишите уравнения реакций описанных превращений.
Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения описанных реакций.
В концентрированную серную кислоту добавили металлический цинк. Образовавшуюся соль выделили, растворили в воде и в раствор добавили нитрат бария. После отделения осадка в раствор внесли магниевую стружку, раствор профильтровали, фильтрат выпарили и прокалили. Напишите уравнения описанных реакций.
Неизвестное вещество красного цвета нагрели в хлоре и продукт реакции растворили в воде. В полученный раствор добавили щёлочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливания, который имеет чёрный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
Йод нагревали с избытком фосфора и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.
Железо сожгли в хлоре. Продукт реакции растворили в воде и в раствор внесли железные опилки. Через некоторое время раствор профильтровали и в фильтрат добавили сульфид натрия. Выделившийся осадок отделили и обработали 20%-ной серной кислотой, получив почти бесцветный раствор. Напишите уравнения описанных реакций.
Газ, выделяющийся при нагревании твёрдой поваренной соли с концентрированной серной кислотой, пропустили через раствор перманганата калия. Газообразный продукт реакции поглотили холодным раствором едкого натра. После добавления в полученный раствор йодоводородной кислоты появляется резкий запах и раствор приобретает темную окраску. Напишите уравнения описанных реакций.
Через раствор, полученный при гашении извести, пропустили газ, который образуется при получении негашёной извести из известняка; в результате выделяется белый осадок. При действии уксусной кислоты на полученный осадок выделяется тот же газ, который образуется при прокаливании карбоната кальция. Напишите уравнения описанных реакций.
Вещество красного цвета, которое используется в производстве спичек, сожгли в избытке воздуха и продукт реакции при нагревании растворили в большом количестве воды. После нейтрализации полученного раствора пищевой содой в него добавили нитрат серебра. Напишите уравнения описанных реакций.
Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили, и результате произошёл взрыв. Напишите уравнения описанных реакций.
Газ, образующийся при сгорании кокса, длительное время соприкасался с раскалённым углем. Продукт реакции последовательно пропустили через слой нагретой железной руды и негашёную известь. Напишите уравнения описанных реакций.
К нагретой концентрированной серной кислоте добавили медную стружку и выделившийся газ пропустили через раствор едкого натра (избыток). Продукт реакции выделили, растворили в воде и нагревали с серой, которая в результате проведения реакции растворилась. В полученный раствор добавили разбавленную серную кислоту. Напишите уравнения описанных реакций.
К растворам веществ Л и Б, которые окрашивают пламя в жёлтый цвет, добавили хлороводородную кислоту: При взаимодействии раствора вещества А с хлороводородной кислотой выделяется бесцветный газ с неприятным запахом, образующий осадок чёрного цвета при пропускании через раствор нитрата свинца (II). При нагревании раствора вещества Б с хлороводородной кислотой окраска раствора сменяется с жёлтой на зелёную и выделяется ядовитый газ жёлто-зелёного цвета с характерным резким запахом. При добавлении к раствору вещества Б нитрата бария выпадает осадок жёлтого цвета. Напишите уравнения описанных реакций.
К пиролюзиту осторожно прибавили раствор соляной кислоты и выделяющийся газ пропустили в химический стакан, наполовину наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
Осадок, полученный при взаимодействии раствора соли алюминия и щёлочи, прокалили. Продукт реакции растворили в концентрированном горячем растворе щёлочи. Через полученный раствор пропустили углекислый газ, в результате чего образовался осадок. Напишите уравнения описанных превращений.
Чёрный порошок, который образовался при длительном нагревании металла красного цвета в избытке воздуха, растворили в 10%-ной серной кислоте и получили раствор голубого цвета. В раствор добавили щёлочь и выпавший осадок отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
К твёрдому веществу, которое образуется при сжигании фосфора в избытке хлора, добавили фосфор и смесь нагрели. Продукт реакции обработали небольшим количеством горячей воды и в полученный раствор добавили подкисленный серной кислотой раствор перманганата калия. Напишите уравнения описанных реакций.
Через баритовую воду пропускали углекислый газ. В полученный раствор добавили гидроксид бария, продукт реакции отделили и растворили в ортофосфорной кислоте. Напишите уравнения описанных реакций.
Нитрат цинка прокалили, продукт реакции при нагревании обработали раствором едкого натра. Через образовавшийся раствор пропустили углекислый газ до прекращения выделения осадка, после чего обработали избытком концентрированного нашатырного спирта, при этом осадок растворился. Напишите уравнения описанных реакций.
В двух сосудах находятся растворы неизвестных веществ. При добавлении к раствору первого вещества хлорида бария выпадает осадок белого цвета, нерастворимый в воде и кислотах. Осадок белого цвета выпадает также и при добавлении раствора нитрата серебра к пробе, отобранной из второго сосуда. При нагревании пробы первого раствора с гидроксидом натрия выделяется газе резким запахом. При взаимодействии второго раствора с хроматом натрия выпадает осадок жёлтого цвета. Напишите уравнения описанных реакций.
Сернистый газ растворили в воде и раствор нейтрализовали, добавляя едкий натр. В образовавшийся раствор добавили перекись водорода и после окончания реакции — серную кислоту. Напишите уравнения описанных реакций.
Цинк растворили в очень разбавленной азотной кислоте, полученный раствор осторожно выпарили и остаток прокалили. Продукты реакции смешали с коксом и нагрели. Составьте уравнения реакций описанных превращений.
Вещества, выделяющиеся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействует с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия. Напишите уравнения описанных реакций.
Вещество, которое образуется при электролизе расплава боксита в криолите, растворяется как в растворе соляной кислоты, так и в растворе щёлочи с выделением одного и того же газа. При смешивании полученных растворов образуется объёмный осадок белого цвета. Напишите уравнения описанных реакций.
К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании се в присутствии диоксида марганца — газ, входящий и состав атмосферы. Напишите уравнения описанных реакций.
Бурый осадок, полученный при взаимодействии сульфита натрия с водным раствором перманганата калия, отфильтровали и обработали концентрированной серной кислотой. Выделяющийся газ при нагревании реагирует с алюминием, а образующееся вещество — с раствором соляной кислоты. Напишите уравнения реакций описанных превращений.
Кальций нагрели в атмосфере водорода. Продукт реакции обработали водой, выделяющийся газ пропустили над нагретым оксидом цинка, а в раствор добавили кальцинированную соду. Напишите уравнения описанных реакций.
Нитрат серебра прокалили и твёрдый продукт реакции нагрели в кислороде. Образовавшееся вещество растворяется в избытке концентрированного нашатырного спирта. При пропускании через полученный раствор сероводорода образуется осадок чёрного цвета. Напишите уравнения описанных реакций.
Твёрдое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
Несколько гранул цинка внесли в сосуд с концентрированной серной кислотой. Выделяющийся газ пропустили через раствор ацетата свинца (II), осадок отделили, подвергли обжигу и образовавшийся газ ввели во взаимодействие с водным раствором перманганата калия. Напишите уравнения описанных реакций.
Несколько гранул цинка растворили при нагревании в растворе едкого натра. В полученный раствор небольшими порциями добавляли азотную кислоту до образования осадка. Осадок отделили, растворили в разбавленной азотной кислоте, раствор осторожно выпарили и остаток прокалили. Напишите уравнения описанных реакций.
Газ, выделяющийся при растворении меди в горячей концентрированной азотной кислоте, может взаимодействовать как с газом, выделяющимся при обработке меди горячей концентрированной серной кислотой, так и с медью. Напишите уравнения описанных реакций.
Раствор хлорида железа (III) подвергли электролизу с графитовыми электродами. Выделившийся осадок бурого цвета (побочный продукт электролиза) отфильтровали, прокалили и сплавили с веществом, образовавшимся на катоде. Другое, также выделившееся на катоде, вещество ввели в реакцию с продуктом, выделившимся при электролизе на аноде; реакция протекает при освещении и со взрывом. Напишите уравнения описанных реакций.
Нерастворимую в воде соль белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прокалили при 1000°С. К твёрдому остатку после охлаждения добавили воду и через полученный раствор пропустили газообразный продукт реакции разложения, в результате образовался осадок белого цвета, который растворился при дальнейшем пропускании газа. Напишите уравнения описанных реакций.
20920. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 20920.
7934. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

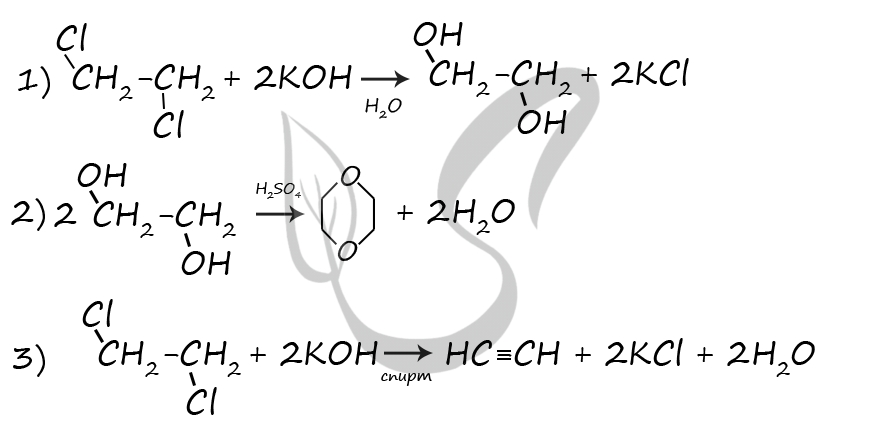
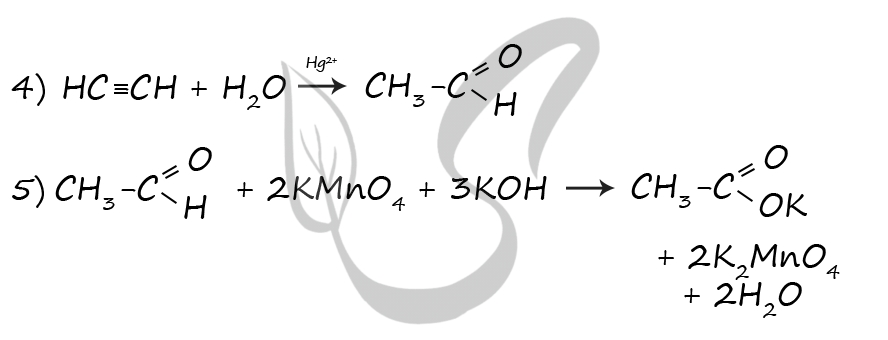
1) C2H5OH = (400 °C, Al2O3) CH2=CH2 + H2O
2) 3CH2=CH2 + 2KMnO4 + 4H2O = 3CH2(OH)-CH2(OH) + 2MnO2 + 2KOH
3) CH2(OH)-CH2(OH) + 2HBr = C2H4Br2 + 2H2O
4) C2H4Br2 + 2KOH(спирт.) = CH≡CH + 2H2O + 2KBr
5) CH≡CH + H2O = (Hg2+) CH3-CHO
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7934.
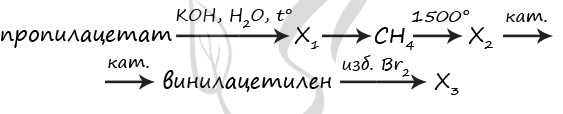
7899. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) H3C-C(O)O-CH2-CH2-CH3 + KOH = (t°) CH3COOK + CH3-CH2-CH2-OH
2) CH3COOK + KOH = (t°) CH4↑ + K2CO3
3) 2CH4 = (1500 °C) CH≡CH + 3H2
4) CH≡CH + CH≡CH = (кат.) CH2=CH-C≡CH
5) CH2=CH-C≡CH + 3Br2 = CH2(Br)-CH(Br)-C(Br2)-CH(Br2)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7899.
7864. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7864.
7829. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) C2H5Cl + CH3Cl + Mg = MgCl2 + CH3-CH2-CH3 (допустимо использовать Na)
2) CH3-CH2-CH3 = (t°, Pt) H3C-CH=CH2 + H2
3) 3H3C-CH=CH2 + 2KMnO4 + 4H2O = 3H3C-CH(OH)-CH2(OH) + 2MnO2 + 2KOH
4) H3C-CH(OH)-CH2(OH) + 2HBr = H3C-CH(Br)-CH2(Br) + 2H2O
5) H3C-CH(Br)-CH2(Br) + 2KOH(спирт.) = (t°) H3C-C≡CH + 2KBr + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7829.
7794. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) CaC2 + 2H2O = Ca(OH)2 + CH≡CH↑
2) CH≡CH + H2O = (Hg2+, H2SO4, t°) CH3CHO
3) 5CH3CHO + 2KMnO4 + 3H2SO4 = 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
4) CH3COOH + Cl2 = (P) Cl-CH2-COOH + HCl
5) Cl-CH2-COOH + 2NH3 = NH2-CH2-COOH + NH4Cl
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7794.
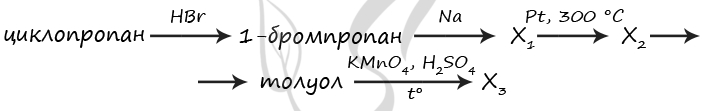
7759. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) C3H6 + HBr = (t°) CH3CH2CH2Br
2) 2CH3CH2CH2Br + 2Na = C6H14 + 2NaBr
3) C6H14 = (Pt, 300 °C) C6H6 + 4H2
4) C6H6 + CH3Cl = (AlCl3) C6H5CH3 + HCl
5) 5C6H5CH3 + 6KMnO4 + 9H2SO4 = (t°) 5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7759.
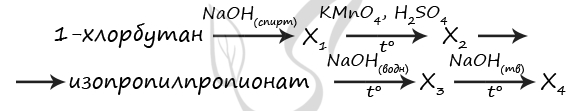
7724. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) C4H9Cl + NaOH(спирт.) = (t°) C2H5-CH=CH2 + NaCl + H2O
2) C2H5-CH=CH2 + 2KMnO4 + 3H2SO4 = (t°) C2H5COOH + CO2↑ + 4H2O + 2MnSO4 + K2SO4
3) C2H5COOH + CH3-CH(OH)-CH3 = CH3-CH2-C(O)O-CH(CH3)2 + H2O
4) CH3-CH2-C(O)O-CH(CH3)2 + NaOH(водн.) = CH3-CH(OH)-CH3 + C2H5COONa
5) C2H5COONa(тв.) + NaOH(тв.) = (t°) C2H6↑ + Na2CO3
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7724.
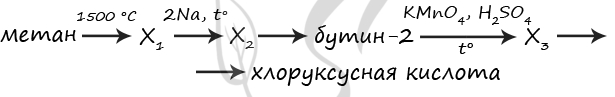
7689. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) 2CH4 = (1500 °C) CH≡CH + 3H2
2) CH≡CH + 2Na = (t°) Na-C≡C-Na + H2
3) Na-C≡C-Na + 2CH3I = CH3-C≡C-CH3 + 2NaI
4) 5CH3-C≡C-CH3 + 6KMnO4 + 9H2SO4 = (t°) 10CH3COOH + 6MnSO4 + 3K2SO4 + 4H2O
5) CH3COOH + Cl2 = (P) Cl-CH2-COOH + HCl
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7689.
7654. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

1) CaC2 + 2H2O = Ca(OH)2 + CH≡CH↑
2) 3CH≡CH + 8KMnO4 = 3KOOC-COOK + 2H2O + 8MnO2 + 2KOH
3) 3KOOC-COOK + 2H2SO4 = CO↑ + CO2↑ + H2O + 2KHSO4
4) CO + KOH = (t°, p) HCOOK
5) HCOOK + H3PO4 = HCOOH + KH2PO4 (образование K3PO4 следует считать ошибочным)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7654.
Для вас приятно генерировать тесты, создавайте их почаще
1) Кремний сожгли в атмосфере хлора. Полученный хлорид обработали водой. Выделившийся при этом осадок прокалили. Затем сплавили с фосфатом кальция и углём. Составьте уравнения четырёх описанных реакций.
2) Газ, полученный при обработке нитрида кальция водой, пропустили над раскалённым порошком оксида меди(II). Полученное при этом твёрдое вещество растворили в концентрированной азотной кислоте, раствор выпарили, а полученный твёрдый остаток прокалили. Составьте уравнения четырёх описанных реакций.
3) Некоторое количество сульфида железа(II) разделили на две части. Одну из них обработали соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество жёлтого цвета. Полученное вещество нагрели с концентрированной азотной кислотой, при этом выделился бурый газ. Напишите уравнения четырёх описанных реакций.
4) При взаимодействии оксида алюминия с азотной кислотой образовалась соль. Соль высушили и прокалили. Образовавшийся при прокаливании твёрдый остаток подвергли электролизу в расплавленном криолите. Полученный при электролизе металл нагрели с концентрированным раствором, содержащим нитрат калия и гидроксид калия, при этом выделился газ с резким запахом. Напишите уравнения четырёх описанных реакций.
5) Оксид хрома(VI) прореагировал с гидроксидом калия. Полученное вещество обработали серной кислотой, из образовавшегося раствора выделили соль оранжевого цвета. Эту соль обработали бромоводородной кислотой. Полученное простое вещество вступило в реакцию с сероводородом. Напишите уравнения четырёх описанных реакций.
6) Порошок магния нагрели в атмосфере азота. При взаимодействии полученного вещества с водой выделился газ. Газ пропустили через водный раствор сульфата хрома(III), в результате чего образовался серый осадок. Осадок отделили и обработали при нагревании раствором, содержащим пероксид водорода и гидроксид калия. Напишите уравнения четырёх описанных реакций.
7) Аммиак пропустили через бромоводородную кислоту. К полученному раствору добавили раствор нитрата серебра. Выпавший осадок отделили и нагрели с порошком цинка. На образовавшийся в ходе реакции металл подействовали концентрированным раствором серной кислоты, при этом выделился газ с резким запахом. Напишите уравнения четырёх описанных реакций.

9) Натрий нагрели в атмосфере водорода. При добавлении к полученному веществу воды наблюдали выделение газа и образование прозрачного раствора. Через этот раствор пропустили бурый газ, который был получен в результате взаимодействия меди с концентрированным раствором азотной кислоты. Напишите уравнения четырёх описанных реакций.
10) Алюминий прореагировал с раствором гидроксида натрия. Выделившийся газ пропустили над нагретым порошком оксида меди(II). Образовавшееся простое вещество растворили при нагревании в концентрированной серной кислоте. Полученную соль выделили и добавили к раствору иодида калия. Напишите уравнения четырёх описанных реакций.
11) Провели электролиз раствора хлорида натрия. К полученному раствору добавили хлорид железа(III). Выпавший осадок отфильтровали и прокалили. Твёрдый остаток растворили в иодоводородной кислоте. Напишите уравнения четырёх описанных реакций.
12) К раствору гидроксида натрия добавили порошок алюминия. Через раствор полученного вещества пропустили избыток углекислого газа. Выпавший осадок отделили и прокалили. Полученный продукт сплавили с карбонатом натрия. Напишите уравнения четырёх описанных реакций.
Задания 32
. Реакции, подтверждающие взаимосвязь различных классов неорганических веществ.
1. Нитрат
натрия прокалили. Твердый продукт реакции нагрели с иодидом аммония, выделился
газ, входящий в состав воздуха. Соль обработали раствором пероксида водорода,
подкисленным серной кислотой. Образовавшееся простое вещество прореагировало
при нагревании с раствором гидроксида натрия.
Напишите
уравнения четырёх описанных реакций.
1) При разложении нитратов щелочных металлов образуется
нитрит щелочного металла и выделяется кислород:
2NaNO3
→ 2NaNO2 + O2↑ (нагрев)
2) При нагревании нитритов с аммонийными солями образуется
неустойчивый нитрит аммония, который разлагается до азота и воды:
NaNO2 + NH4I
→ NaI + N2↑ + 2H2O (нагрев)
3) При взаимодействии иодидов с пероксидом водорода в
сернокислой среде выделяется молекулярный йод:
2NaI + H2O2
+ H2SO4 → Na2SO4 + I2↓ +
2H2O
4) При взаимодействии йода с горячим раствором щелочи
протекает реакция диспропорционирования, в результате которой молекулярный йод
окисляется до I+5 и восстанавливается до I-1:
3I2 + 6NaOH(р−р)
→ NaIO3 + 5NaI + 3H2O
2. Через
раствор сульфата железа (II) пропустили аммиак. Образовавшийся осадок отделили
и обработали необходимым количеством концентрированной азотной кислоты, при
этом наблюдали растворение осадка и выделение бурого газа. К полученному
раствору добавили раствор карбоната калия, а бурый газ пропустили через раствор
гидроксида кальция.
1) При пропускании аммиака через раствор сульфата железа
(II) протекает реакция обмена с образованием гидроксида железа (II):
FeSO4 + 2NH3
+ 2H2O → Fe(OH)2↓ + (NH4)2SO4
2) При действии концентрированной азотной кислоты на
гидроксид железа (II) железо окисляется с образованием нитрата железа (III) и
выделением бурого газа — диоксида азота:
Fe(OH)2 + 4HNO3(конц.) → Fe(NO3)3
+ NO2↑ + 3H2O
3) При добавлении к раствору нитрата железа (III) карбоната
натрия в осадок выпадает гидроксид железа (III) и выделяется углекислый газ:
2Fe(NO3)3 +
3K2CO3 + 3H2O → 2Fe(OH)3↓ + 6KNO3
+ 3CO2↑
4) При пропускании диоксида азота через раствор щелочи N+5
диспропорционирует с образованием нитрата и нитрита кальция:
2Ca(OH)2 + 4NO2
→ Ca(NO3)2 + Ca(NO2)2 + 2H2O
3.
Безводный хлорид алюминия при нагревании без доступа воздуха восстановили
металлическим калием. Получившееся простое вещество добавили к раствору
гидроксида калия. Через полученный раствор пропустили углекислый газ и
наблюдали выпадение белого осадка. Осадок отфильтровали и к оставшемуся
раствору добавили сульфат железа (III).
1) Калий является более активным металлом по сравнению с
алюминием, поэтому способен вытеснять его из соли:
3K + AlCl3
→ Al + 3KCl (нагревание без доступа воздуха)
2) Алюминий – амфотерный металл, поэтому взаимодействует с
растворами щелочей с образованием комплексных солей:
2Al + 2KOH + 6H2O →
2K[Al(OH)4] + 3H2↑
3) При пропускании углекислого газа через раствор
комплексной соли выпадает белый осадок гидроксида алюминия и образуется гидрокарбонат
калия:
K[Al(OH)4] + CO2
→ Al(OH)3↓ + KHCO3
4) При добавлении к гидрокарбонату калия сульфата железа
(III) протекает реакция обмена с образованием гидроксида железа (III) и
выделением углекислого газа:
6KHCO3 + Fe2(SO4)3
→ 2Fe(OH)3↓ + 3K2SO4 + 6CO2↑
4.
Пероксид водорода прореагировал с оксидом серебра (I). Выделившийся газ
пропустили через нагретую трубку, наполненную сульфидом цинка. Полученный в
результате этой реакции остаток прореагировал с концентрированным раствором
гидроксида натрия. Полученную соль прокалили.
1) Пероксид водорода проявляет восстановительные свойства в
реакции с оксидом серебра, при этом выделяется кислород и образуется
металлическое серебро:
H2O2
+ Ag2O → 2Ag↓ + O2↑ + H2O (нагрев)
2) Выделившийся кислород участвует в окислительно-восстановительной
реакции с сульфидом серы, окисляя ее до диоксида:
2ZnS + 3O2 → 2ZnO + 2SO2↑
(нагрев)
3) Оксид цинка проявляет амфотерные свойства, реагируя с
кислотами и щелочами. При растворении оксида цинка в концентрированном растворе
щелочи образуются комплексные соли – тетрагидроксоцинкаты:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
4) При прокаливании тетрагидроксоцинкаты, теряя воду,
превращаются в цинкаты:
Na2[Zn(OH)4]
→ Na2ZnO2 + 2H2O (нагрев)
5. Над
металлическим хромом при нагревании пропустили избыток хлора. Твердый продукт
реакции растворили в воде и обработали необходимым количеством пероксида
водорода в присутствии гидроксида натрия, в результате чего образовался раствор
желтого цвета. К полученному раствору добавили серную кислоту. Образовавшееся
при этом вещество оранжевого цвета выделили, растворили в разбавленном растворе
серной кислоты и добавили оксид меди (I).
1) При высоких температурах хром окисляется галогенами. При
пропускании над ним избытка хлора, брома или йода образуется галогенид хрома
(III):
2Cr + 3Cl2
→ 2CrCl3 (нагревание)
2) Хлорид хрома (III), как и другие его соединения,
окисляется до соединений хрома (VI) преимущественно в щелочной среде. В данной
реакции за желтую окраску раствора отвечает образующийся хромат натрия:
2CrCl3 + 3H2O2
+ 10NaOH → 2Na2CrO4 + 6NaCl + 8H2O
3) Образующийся хромат натрия в растворах кислот переходит
в бихромат натрия – соль ярко-оранжевого цвета:
2Na2CrO4 + H2SO4(разб.) → Na2Cr2O7
+ Na2SO4 + H2O
4) Действием окислителей оксид меди (I) переводится в
раствор с образованием солей двухвалентной меди:
3Cu2O + Na2Cr2O7
+ 10H2SO4 → 6CuSO4 + Cr2(SO4)3
+ Na2SO4 + 10H2O
6. Твердый
хлорид кальция прореагировал с концентрированной серной кислотой, при этом
выпал бесцветный осадок и выделился газ с резким запахом. Растворенный в
минимальном количестве воды газ прореагировал с твердым дихроматом калия, при
этом наблюдали выделение газа желто-зеленого цвета. Газ собрали и пропустили
через раствор хлорида железа (II), в результате чего цвет раствора стал
красно-коричневым. К раствору полученного вещества добавили карбонат натрия.
1) Хлорид кальция вступает в обменную реакцию с раствором
серной кислоты, в результате чего образуется малорастворимая соль — сульфат
кальция:
CaCl2 + H2SO4
→ CaSO4↓ + 2HCl↑
2) Дихромат калия способен восстанавливаться до соединений
хрома (III) преимущественно в кислой среде:
K2Cr2O7(тв.)
+ 14HCl(конц.) → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
3) Хлорид железа (II) способен окисляться до хлорида железа
(III) при действии хлора:
2FeCl2 +
Cl2 → 2FeCl3
4) Железо (III) не образует солей карбонат-анионом, поэтому
при взаимодействии с карбонатом натрия выпадает гидроксид трехвалентного
железа:
2FeCl3 + 3Na2CO3
+ 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
7. Через
нагретую трубку, заполненную оксидом меди (II), пропустили водород.
Образовавшееся простое вещество прореагировало с концентрированной серной
кислотой, в результате чего наблюдали выделение бесцветного газа с резким
запахом. К полученному раствору добавили порошок иодида калия, при этом в
осадок выпало простое вещество. Это простое вещество поместили в раствор
гидроксида натрия и пропустили ток хлора.
1) Оксид меди (II) можно восстановить до металлической меди
действием различных восстановителей (H2, CO, C, Al, NH3):
CuO + H2
→ Cu + H2O (нагревание)
2) Медь расположена в ряду стандартных электродных
потенциалов правее водорода и не вытесняет его из разбавленных растворов
кислот. Медь взаимодействует только с кислотами-окислителями (HNO3,
H2SO4(конц.) и т.д.):
Cu + 2H2SO4(конц.) → CuSO4 + SO2↑
+ 2H2O
3) При пропускании через раствор сульфата меди (II)
раствора иодида калия образуется иодид одновалентной меди и выделяется
молекулярный йод:
2CuSO4 +
4KI → 2CuI + I2↓ + 2K2SO4
4) При взаимодействии молекулярных йода и хлора в растворе
щелочи хлор выступает окислителем, восстанавливаясь до Cl-1, йод –
восстановителем, окисляясь до I+5:
5Cl2 + I2 +
12NaOH → 2NaIO3 + 10NaCl + 6H2O
8. К
раствору бромоводородной кислоты добавили гидрокарбонат калия, в результате
чего наблюдали выделение бесцветного газа. Полученную соль выделили и добавили
к раствору дихромата калия, подкисленного серной кислотой. Образовавшееся в
результате этой реакции простое вещество – красно-бурая жидкость с резким
запахом прореагировало с алюминием. Продукт этой реакции помесили в раствор
сульфида натрия, в результате чего наблюдали выделение токсичного газа с
неприятным запахом.
1) Более сильная бромоводородная кислота способна вытеснить
более слабую угольную из ее соли, в результате чего выделяется диоксид углерода:
KHCO3 +
HBr → KBr + CO2↑ + H2O
2) Действием восстановителей соединения хрома (VI)
восстанавливаются до соединений хрома (III) преимущественно в кислой среде:
K2Cr2O7
+ 6KBr + 7H2SO4 → Cr2(SO4)3
+ 3Br2 + 4K2SO4 + 7H2O
3) Галогены (F2, Cl2, Br2)
способны окислить алюминий до галогенида алюминия:
2Al + 3Br2
→ 2AlBr3
4) Хлорид алюминия вступает в обменную реакцию с сульфидом
натрия, при этом образующийся сульфид алюминия сразу же гидролизуется с
образованием гидроксида алюминия и сероводорода (реакция совместного гидролиза
хлорида алюминия и сульфида натрия):
2AlBr3 + 3Na2S
+ 6H2O → 2Al(OH)3↓ + 6NaBr + 3H2S↑
9. Смешали
растворы нитрата кальция и фосфата натрия, в результате чего в осадок выпало
бесцветное кристаллическое вещество. Это вещество выделили и прокалили с песком
и углем. Полученное простое вещество, используемое в качестве водоотнимающего
средства, добавили к концентрированной азотной кислоте. Выделившийся бурый газ
собрали и пропустили через раствор гидроксида бария.
1) Между растворами нитрата кальция и фосфата натрия
протекает обменная реакция, в результате которой в осадок выпадает фосфат
кальция:
3Ca(NO3)2 +
2Na3PO4 → Ca3(PO4)2↓ +
6NaNO3
2) Окислительная способность фосфата кальция проявляется
только при значительном нагревании в присутствии сильных восстановителей.
Сплавление фосфата кальция с коксом и кремнеземом при температуре около 1600oC
является реакцией получения фосфора:
2Ca3(PO4)2
+ 6SiO2 + 10C → 4P + 6CaSiO3 + 10CO↑
3) Фосфор окисляется всеми галогенами, кислородом, серой, а
также некоторыми сложными веществами. В концентрированной азотной кислоте
фосфор превращается в ортофосфорную кислоту, при этом выделяется диоксид азота:
P + 5HNO3(конц.) → H3PO4
+ 5NO2↑ + H2O
4) Бурый газ – диоксид азота при пропускании через раствор
щелочи диспропорционирует, окисляясь до N+5 и восстанавливаясь до N+3:
2Ba(OH)2 + 4NO2
→ Ba(NO3)2 + Ba(NO2)2 + 2H2O
10.
Раствор нитрата меди (II) подвергли электролизу на инертном аноде. Выделившийся
при этом бесцветный газ прореагировал с металлическим натрием. Полученное
вещество осторожно растворили в воде и далее к этому раствору добавили сульфат
хрома (III), в результате чего образовался раствор желтого цвета.
1) При проведении электролиза раствора нитрата меди (II) с
использованием инертного анода (графита, платины) на электродах протекают
конкурирующие процессы с участием воды. Поскольку медь находится в ряду стандартных
электродных потенциалов правее водорода, поэтому на катоде преимущественно
происходит восстановление катиона меди, обладающего большей окислительной
активностью. На аноде в первую очередь будут окисляться анионы OH−,
обладающие большей по сравнению с NO32- восстановительной
активностью:
2Cu(NO3)2 +
2H2O → 2Cu + O2↑ + 4HNO3 (электролиз)
2) При сжигании натрия в кислороде или на воздухе
образуется пероксид натрия:
2Na + O2
→ Na2O2
3) Пероксид натрия энергично реагирует с водой с выделением
тепла (образуются щелочь и пероксид водорода):
Na2O2
+ 2H2O → 2NaOH + H2O2
4) Сульфат хрома (III) способен окислиться до хромата
действием окислителей в щелочной среде:
Cr2(SO4)3
+ 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4
+ 8H2O
11.
Смешали растворы нитрата серебра и хлорида натрия, в результате чего выпал
белый творожистый осадок. Этот осадок отделили, а полученный раствор выпарили.
Образовавшееся вещество прокалили и продукт, образованный при прокаливании,
добавили к раствору перманганата калия. Выпавший в осадок порошок
темно-коричневого цвета прореагировал с раствором соляной кислоты, при этом
наблюдали выделение желто-зеленого газа.
1) Нитрат серебра вступил в обменную реакцию с хлоридом
натрия, в результате чего выделился белый творожистый осадок – хлорид серебра:
AgNO3 +
NaCl → AgCl↓ + NaNO3
2) Нитраты щелочных металлов при нагревании разлагаются с
образованием нитритов и выделением кислорода:
2NaNO3 →
2NaNO2 + O2↑ (нагревание)
3) Нитрит натрия за счет N+3 является
восстановителем и под действием сильного окислителя — перманганата калия
окисляется до N+5, превращаясь в нитрат:
3NaNO2 + 2KMnO4
+ H2O → 2MnO2↓ + 2KOH + 3NaNO3
4) При обычных условиях диоксид марганца относительно
инертное вещество. По при нагревании с кислотами проявляет окислительные
свойства, например, способен окислить концентрированную соляную кислоту до
хлора:
MnO2 +
4HCl(конц.) → MnCl2 + Cl2↑ + 2H2O
(нагревание)
12. Через
раствор гидроксида натрия пропустили избыток углекислого газа. Раствор
выпарили, полученное вещество прокалили, при этом наблюдали выделение
бесцветного газа. Образовавшееся вещество собрали и добавили к раствору бромида
железа (III). Выпавший при этом осадок красновато-коричневого цвета
прореагировал с раствором иодоводородной кислоты.
1) При пропускании через раствор щелочи кислотного оксида –
углекислого газа образуется кислая соль – гидрокарбонат натрия:
NaOH + CO2
→ NaHCO3
2) При прокаливании гидрокарбоната натрия образуется
средняя соль – карбонат натрия и выделяется углекислый газ:
2NaHCO3 → Na2CO3
+ CO2↑ + H2O (нагревание)
3) При взаимодействии карбоната натрия с бромидом железа
(III) в водном растворе в осадок выпадает гидроксид железа (III) и выделяется
углекислый газ (карбонат железа (III) не существует):
2FeBr3 + 3Na2CO3
+ 3H2O → 6NaBr + 2Fe(OH)3↓ + 3CO2↑
4) С иодоводородной кислотой гидроксид железа (III)
вступает в окислительно-восстановительную реакцию, в результате которой Fe+3
восстанавливается до Fe+2 и выделяется молекулярный йод:
2Fe(OH)3 + 6HI → 2FeI2
+ I2↓ + 6H2O
13.
Смешали раствор гидрокарбоната натрия и гидроксида натрия. К полученному
раствору добавили бромид хрома (III), в результате чего выпал осадок и
выделился бесцветный газ. Осадок при нагревании при нагревании прореагировал с
необходимым количеством пероксида водорода в присутствии гидроксида калия, в
результате чего образовался раствор желтого цвета. Далее к раствору добавили
серную кислоту, при этом раствор поменял цвет с желтого на оранжевый.
1) При взаимодействии кислой соли – гидрокарбоната натрия с
гидроксидом натрия образуется средняя соль – карбонат натрия:
NaHCO3 +
NaOH → Na2CO3 + H2O
2) В результате взаимодействия карбоната натрия с бромидом
хрома (III) в растворе выпадает осадок гидроксид хрома (III) и выделяется
углекислый газ:
3Na2CO3 +
2CrBr3 + 3H2O → 2Cr(OH)3↓ + 6NaBr + 3CO2↑
3) Гидроксид хрома (III) в щелочной среде под действием
окислителей окисляется до соединений хрома (VI), в данном случае до хромата
калия:
2Cr(OH)3
+ 4KOH + 3H2O2 → 2K2CrO4 + 8H2O
(нагревание)
4) Хроматы неустойчивы в щелочном растворе, поэтому при
добавлении к ним раствора серной кислоты образуются дихроматы:
2K2CrO4
+ H2SO4 → K2Cr2O7 + K2SO4
+ H2O
14.
Гидрокарбонат натрия разложили. Полученное в результате разложения вещество
добавили к раствору бромида алюминия, в результате чего выпал осадок и
выделился бесцветный газ. Избыток выделившегося газа пропустили через раствор
силиката калия, а осадок растворили в азотной кислоте.
1) При разложении кислой соли – гидрокарбоната натрия
образуется средняя соль – карбонат натрия и выделяется углекислый газ:
2NaHCO3 → Na2CO3
+ CO2↑ + H2O (нагревание)
2) При взаимодействии карбоната натрия с раствором бромида
алюминия в осадок выпадает гидроксид алюминия (III) и выделяется углекислый
газ:
3Na2CO3 +
2AlBr3 + 3H2O → 2Al(OH)3↓ + 6NaBr + 3CO2↑
3) Нерастворимое вещество с амфотерными свойствами –
гидроксид алюминия хорошо растворяется в растворах как в кислотах, так и в
основаниях:
Al(OH)3 + 3HNO3
→ Al(NO3)3 + 3H2O
4) При пропускании избытка углекислого газа через раствор
силиката калия в осадок выпадает более слабая нерастворимая кремниевая кислота
и образуется гидрокарбонат калия:
K2SiO3
+ H2O + CO2 → Н2SiO3↓ + 2KНCO3
15. Раствор
нитрата меди (II) подвергли электролизу на инертном аноде. Выделившееся на
катоде простое вещество растворили в концентрированной серной кислоте, при этом
наблюдали выделение бесцветного газа с резким запахом. Газ собрали и пропустили
через раствор сероводородной кислоты, в результате чего в осадок выпало простое
вещество желтого цвета. Это вещество прореагировало с расплавленным гидроксидом
калия.
1) При проведении электролиза раствора нитрата меди (II) с
использованием инертного анода (графита, платины) на электродах протекают
конкурирующие процессы с участием воды. Поскольку медь находится в ряду
стандартных электродных потенциалов правее водорода, поэтому на катоде
преимущественно происходит восстановление катиона меди, обладающего большей
окислительной активностью. На аноде в первую очередь будут окисляться анионы OH−,
обладающие большей по сравнению с NO3— восстановительной
активностью:
2Cu(NO3)2
+ 2H2O → 2Cu + O2↑ + 4HNO3 (электролиз)
2) Медь расположена в ряду стандартных электродных
потенциалов правее водорода и не вытесняет его из разбавленных растворов
кислот. Медь взаимодействует только с кислотами-окислителями (HNO3,
H2SO4(конц.) и т.д.):
Cu + 2H2SO4(конц.) → CuSO4 + SO2↑
+ 2H2O
3) При взаимодействии диоксида серы с сероводородом
протекает реакция сопропорционирования, в результате которой S+4
восстанавливается, а S-2 окисляется до молекулярной серы:
SO2 + 2H2S
→ 3S↓ + 2H2O
4) Сера, диспропорционируя, взаимодействует с
расплавленными щелочами аналогично галогенам, в результате чего образуются
сульфиты (S+4) и сульфиды (S-2):
3S + 6KOH → K2SO3
+ 2K2S + 3H2O
16. Гидрокарбонат
натрия разложили, при этом выделился бесцветный газ. Алюминий растворили в
горячем концентрированном растворе гидроксида калия и через полученный при этом
раствор пропустили газ, выделившийся при разложении гидрокарбоната натрия.
Осадок отделили, в раствор добавили гидроксид бария, при этом в осадок выпало
бесцветное вещество.
1) При разложении кислой соли – гидрокарбоната натрия
образуется средняя соль – карбонат натрия и выделяется углекислый газ:
2NaHCO3 → Na2CO3
+ CO2↑ + H2O (нагревание)
2) Алюминий, бериллий и цинк — единственные три металла,
способные реагировать с щелочами:
2Al + 2KOH + 6H2O →
2K[Al(OH)4] + 3H2↑
3) При пропускании кислотного оксида – углекислого газа
через раствор комплексной соли – тетрагидроксоалюмината натрия комплекс
разрушается, в результате чего образуется гидрокарбонат натрия и в осадок
выпадает гидроксид алюминия:
K[Al(OH)4] + CO2
→ Al(OH)3↓ + KHCO3
4) При взаимодействии щелочи – гидроксида бария и кислой
соли – гидрокарбоната натрия образуются средние соли – карбонаты натрия и
бария, выпадающего в осадок:
Ba(OH)2 + 2NaHCO3
→ Na2CO3 + BaCO3↓ + 2H2O
17. Смешали
растворы хлорида бария и фосфата натрия. Выпавший осадок отделили, а раствор
оставшегося вещества подвергли электролизу на инертном аноде, при этом
выделился газ желто-зеленого цвета. Его собрали и пропустили через горячий
раствор гидроксида калия. Далее к раствору добавили оксид хрома (III).
1) При сливании растворов хлорида бария и фосфата натрия
протекает обменная реакция, в результате чего в осадок выпадает фосфат бария и
образуется хлорид натрия:
3BaCl2 +
2Na3PO4 → Ba3(PO4)2↓ +
6NaCl
2) При проведении электролиза раствора хлорида натрия с
использованием инертного анода (графита, платины), на электродах протекают
конкурирующие процессы с участием воды. Поскольку натрий расположен в ряду
стандартных электродных потенциалов левее водорода, то на катоде
преимущественно происходит восстановление катиона водорода, обладающего большей
окислительной активностью. На аноде в первую очередь будут окисляться анионы Cl—,
обладающие большей по сравнению с OH— восстановительной активностью:
2NaCl + 2H2O
→ 2NaOH + Cl2↑ + H2↑ (электролиз)
3) При пропускании хлора через горячий раствор гидроксида
калия протекает окислительно-восстановительная реакция, в результате которой
молекулярный хлор диспропорционирует на Cl+5 и Cl-:
6KOH + 3Cl2
→ KClO3 + 5KCl + 3H2O
4) Оксид хрома (III) – это амфотерный оксид, в щелочном
растворе в присутствии окислителя окисляется до хромата (с хлоридом калия
реакция не протекает):
Cr2O3 + KClO3
+ 4KOH → 2K2CrO4 + KCl + 2H2O
18. Смесь аммиака
и кислорода пропустили при высоких температуре и давлении над катализатором, в
результате чего образовался бесцветный газ. Далее этот газ окислили кислородом,
при этом образовался газ бурого цвета, который затем пропустили через раствор
гидроксида натрия. К полученному раствору в присутствии гидроксида калия
добавили перманганат калия.
1) На реакции взаимодействия аммиака с кислородом при
высоких давлении и температуре в присутствии катализатора основан промышленный
способ получения моноксида азота:
4NH3 + 5O2 →
4NO + 6H2O (кат. Pt, Cr2O3,
t, p)
2) Образующийся моноксид азота окисляется кислородом при
комнатной температуре и атмосферном давлении до диоксида азота:
2NO + O2
→ 2NO2
3) При пропускании бурого газа – диоксида азота через
раствор гидроксида натрия протекает окислительно-восстановительная реакция, в
результате которой N+4 диспропорционирует на N+5 и N+3:
2NaOH + 2NO2
→ NaNO3 + NaNO2 + H2O
4) Перманганат калия способен окислить нитрит натрия до
нитрата, при этом сам в условиях щелочной среды превращается до манганата:
NaNO2 + 2KMnO4
+ 2KOH → 2K2MnO4 + NaNO3 + H2O
19. При
взаимодействии оксида серы (VI) с водой получили кислоту. При обработке
порошкообразного иодида калия концентрированным раствором этой кислоты
образовались серые кристаллы простого вещества. Это вещество прореагировало с
алюминием. Полученную соль растворили в воде и смешали с раствором карбоната
натрия, в результате чего образовался осадок и выделился газ.
1) При взаимодействии кислотного оксида – оксида серы (VI)
с водой образуется серная кислота:
SO3 + H2O
→ H2SO4
2) При действии на порошок иодида калия концентрированной
серной кислоты протекает окислительно-восстановительная реакция, в результате
которой образуются кристаллы простого вещества – йода и выделяется сероводород
(реакция твердого KI с концентрированной серной кислотой протекает с
образованием сероводорода и кислой соли — гидросульфата калия):
8KI(тв.)
+ 9H2SO4(конц.)
→ 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
3) Алюминий легко реагирует с галогенами, в данном случае
образуется иодид алюминия:
2Al + 3I2
→ 2AlI3
4) При взаимодействии иодида алюминия с водным раствором
карбонатом натрия в осадок выпадает гидроксид алюминия и выделяется углекислый
газ (соли карбоната алюминия не существует):
2AlI3 + 3Na2CO3
+ 3H2O → 2Al(OH)3↓ + 6NaI + 3CO2↑