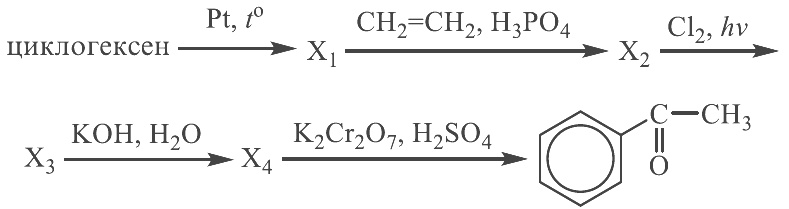Чтобы поделиться, нажимайте
Представляем вашему вниманию задания (30-35) из реального ЕГЭ 2019 (основная волна, 31 мая 2019 года) с подробными видео-объяснениями,текстовыми решениями и ответами.
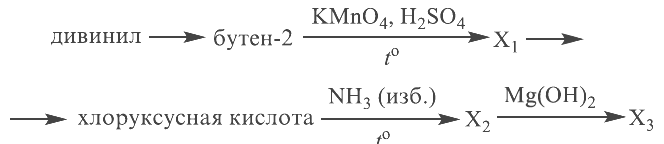
Задание 30
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции. Дан следующий перечень веществ (смотри ниже).
Задание 31
Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций. Дан следующий перечень веществ (смотри ниже).
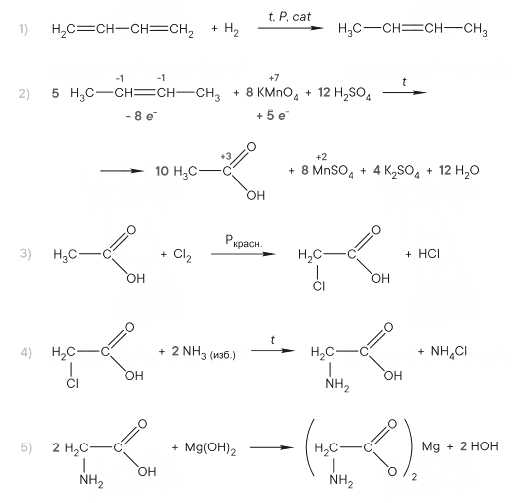
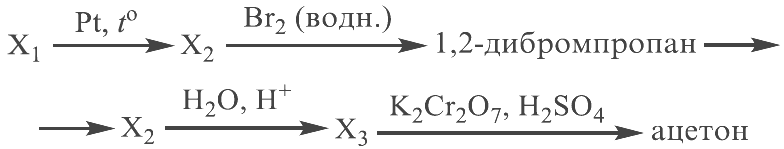
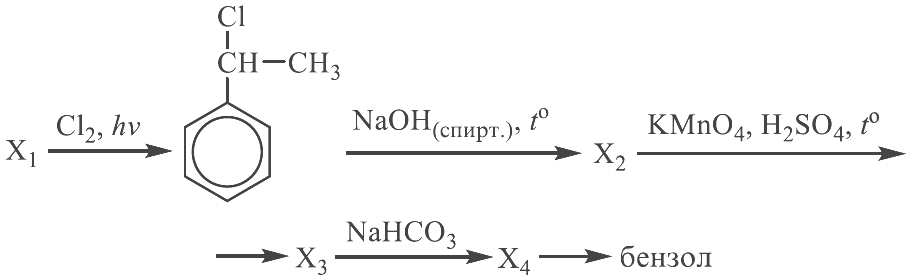
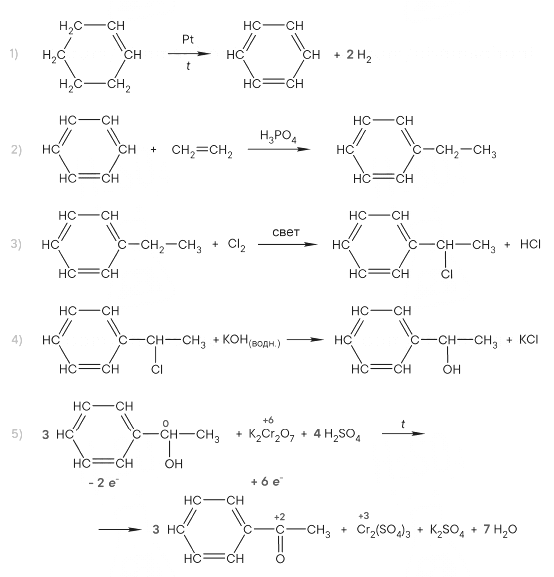
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 1.
Азотная кислота, сульфат меди(II), ацетат магния, фосфин, хлороводород.
Развернуть/свернуть решение
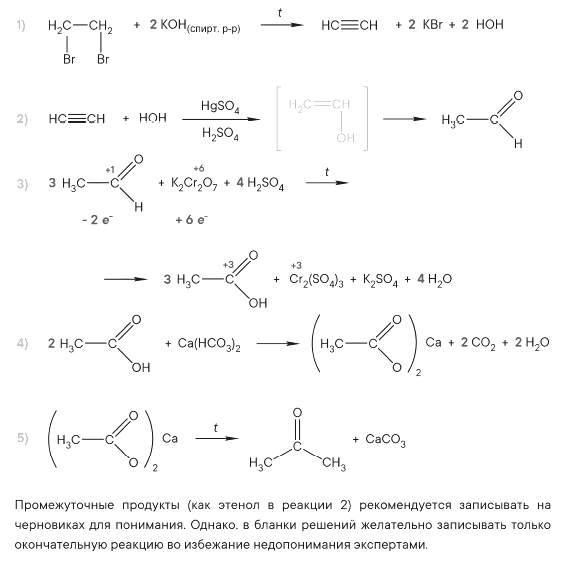
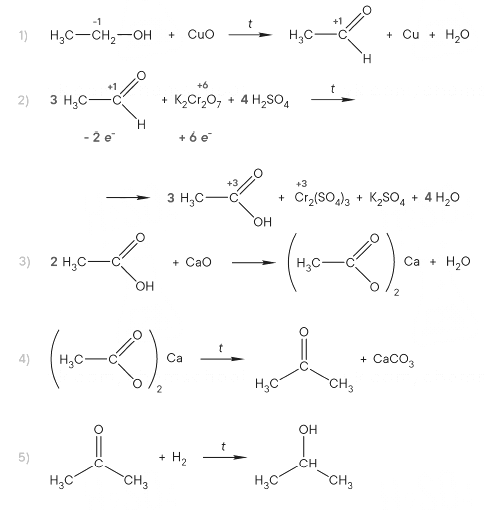
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
P-3 – 8e = P+5 8 восстановитель
N+5 + 1e = N+4 1 окислитель
(CH3COO)2Mg + 2HCl = MgCl2 + 2CH3COOH
2CH3COO— + Mg2+ + 2H+ + 2Cl— = Mg2+ + 2Cl— + 2CH3COOH
CH3COO— + H+ = CH3COOH
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 2.
Сульфид серебра(I), азотная кислота, сульфат аммония, нитрат железа(III), ацетат стронция.
Развернуть/свернуть решение
Ag2S + 10HNO3 = 2AgNO3 + H2SO4 + 8NO2 + 4H2O (реакция протекает в горячей концентрированной кислоте)
S-2 – 8e = S+6 1 восстановитель
N+5 + 1e = N+4 8 окислитель
Возможны и другие варианты этой же реакции.
(NH4)2SO4 + (CH3COO)2Sr = SrSO4↓ + 2CH3COONH4
2NH4+ + SO42- + 2CH3COO— + Sr2+ = SrSO4↓ + 2CH3COO— + 2NH4+
Sr2+ + SO42- = SrSO4↓
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 3.
Ацетат аммония, нитрат цинка, фосфин, оксид серы(IV), серная кислота.
Развернуть/свернуть решение
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
P-3 – 8e = P+5 1 восстановитель
S+6 + 2e = S+4 4 окислитель
2CH3COONH4 + H2SO4 = (NH4)2SO4 + 2CH3COOH
2CH3COO— + 2NH4+ + 2H+ + SO42- = 2NH4+ + SO42- + 2CH3COOH
CH3COO— + H+ = CH3COOH
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 4.
Хлорат калия, гидроксид калия, оксид хрома(III), ацетат меди(II), оксид меди(II).
Развернуть/свернуть решение
Cr2O3 + KClO3 + 4KOH = 2K2CrO4 + KCl + 2H2O
2Cr+3 – 6e = 2Cr+6 1 восстановитель
Cl+5 + 6e = Cl-1 1 окислитель
2KOH + (CH3COO)2Cu = Cu(OH)2↓ + 2CH3COOK
2K+ + 2OH— + 2CH3COO— + Cu2+ = Cu(OH)2↓ + 2CH3COO— + 2K+
Cu2+ + 2OH— = Cu(OH)2↓
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 5.
Гипохлорит калия, оксид хрома(III), гидроксид калия, сульфат железа(III), оксид магния.
Развернуть/свернуть решение
Cr2O3 + 3KClO + 4KOH = 2K2CrO4 + 3KCl + 2H2O
2Cr+3 – 6e = 2Cr+6 1 восстановитель
Cl+1 + 2e = Cl-1 3 окислитель
6KOH + Fe2(SO4)3 = 2Fe(OH)3↓ + 3K2SO4
6K+ + 6OH— + 2Fe3+ + 3SO42- = 2Fe(OH)3↓ + 6K+ + 3SO42-
Fe3+ + 3OH— = Fe(OH)3↓
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 6.
Сульфат железа(II), оксид марганца(IV), серная кислота, ацетат магния, нитрит аммония.
Развернуть/свернуть решение
2FeSO4 + MnO2 + 2H2SO4 = MnSO4 + Fe2(SO4)3 + 2H2O
2Fe+2 — 2e = 2Fe+3 1 восстановитель
Mn+4 + 2e = Mn+2 1 окислитель
Второй вариант NH4NO2 + MnO2 + H2SO4 = MnSO4 + NH4NO3+H2O
N+3 – 2e = N+5 1 восстановитель
Mn+4 + 2e = Mn+2 1 окислитель
(CH3COO)2Mg + H2SO4 = MgSO4 + 2CH3COOH
2CH3COO— + Mg2+ + 2H+ + SO42- = Mg2+ + SO42- + 2CH3COOH
CH3COO— + H+ = CH3COOH
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 7.
Перманганат натрия, сульфид натрия, ацетат стронция, нитрат лития, гидрокарбонат натрия.
Развернуть/свернуть решение
2NaMnO4 + 3Na2S + 4H2O = 2MnO2 + 3S + 8NaOH
Mn+7 + 3e = Mn+4 2 окислитель
S-2 – 2e = S0 3 восстановитель
Na2S + (CH3COO)2Sr = SrS↓ + 2CH3COONa
2Na+ + S2- + 2CH3COO— + Sr2+ = SrS↓ + 2CH3COO— + 2Na+
Sr2+ + S2- = SrS↓
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 8.
Перманганат калия, иодид калия, фторид серебра, ацетат магния, нитрат аммония.
Развернуть/свернуть решение
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
Mn+7 + 3e = Mn+4 2 окислитель
2I— – 2e = I20 3 восстановитель
2AgF + (CH3COO)2Mg = MgF2↓ + 2CH3COOAg
2Ag+ + 2F— + 2CH3COO— + Mg2+ = MgF2↓ + 2CH3COO— + 2Ag+
Mg2+ + 2F— = MgF2↓
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 9.
Пероксид водорода, серная кислота, перманганат калия, нитрат аммония, ацетат меди(II).
Развернуть/свернуть решение
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
2O-1 – 2e = O20 5 восстановитель
Mn+7 + 5e = Mn+2 2 окислитель
(CH3COO)2Cu + H2SO4 = CuSO4 + 2CH3COOH
2CH3COO— + Cu2+ + 2H+ + SO42- = Cu2+ + SO42- + 2CH3COOH
CH3COO— + H+ = CH3COOH
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 10.
Гипохлорит калия, гидроксид калия, ацетат аммония, хлорид хрома(III), оксид серебра(I).
Развернуть/свернуть решение
2CrCl3 + 3KClO + 10KOH = 2K2CrO4 + 9KCl + 5H2O
Cr+3 – 3e = Cr+6 2 восстановитель
Cl+1 + 2e = Cl-1 3 окислитель
KOH + CH3COONH4 = NH3↑ + H2O + CH3COOK
K+ + OH— + CH3COO— + NH4+ = NH3↑ + H2O + CH3COO— + K+
NH4+ + OH— = NH3↑ + H2O
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 11.
Хлорат натрия, гидроксид натрия, ацетат магния, гидроксид хрома(III), гидроксид меди(II).
Развернуть/свернуть решение
2Cr(OH)3 + NaClO3 + 4NaOH = 2Na2CrO4+NaCl+5H2O
Cr+3 – 3e = Cr+6 2 восстановитель
Cl+5 + 6e = Cl-1 1 окислитель
2NaOH + (CH3COO)2Mg = Mg(OH)2↓ + 2CH3COONa
2Na+ + 2OH— + 2CH3COO— + Mg2+ = Mg(OH)2↓ + 2CH3COO— + 2Na+
Mg2+ + 2OH— = Mg(OH)2↓
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 12.
Карбонат магния, бром, гидроксид калия, нитрит калия, гидрофосфат калия.
Развернуть/свернуть решение
3Br2 + 6KOH → KBrO3 + 5KBr + 3H2O (при нагревании)
Br0 + 1e = Br-1 5 окислитель
Br0 – 5e = Br+5 1 восстановитель
Возможен другой вариант
2KOH + Br2 → KBr + KBrO + H2O
Br0 + 1e = Br-1 1 окислитель
Br0 – 1e = Br+1 1 восстановитель
Возможен другой вариант
KNO2 + Br2 + 2KOH = 2KBr + KNO3 + H2O
N+3 – 2e = N+5 1 восстановитель
Br20 + 2e = 2Br-1 1 окислитель
KOH + K2HPO4 = K3PO4 + H2O
K+ + OH— + 2K+ + HPO42- = 3K+ + PO43- + H2O
OH— + HPO42- = PO43- + H2O
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 13.
Перманганат калия, фосфин, серная кислота, нитрат лития, гидроксид железа(III).
Развернуть/свернуть решение
8KMnO4 + 5PH3 + 12H2SO4 → 5H3PO4 + 8MnSO4 + 4K2SO4 + 12H2O
Mn+7 + 5e = Mn+2 8 окислитель
P-3 – 8e = P+5 5 восстановитель
3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O
6H+ + 3SO42- + 2Fe(OH)3 = 2Fe3+ + 3SO42- + 6H2O
3H+ + Fe(OH)3 = Fe3+ + 3H2O
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 14.
Гидроксид железа(II), гидроксид натрия, хлор, гидрофосфат натрия, карбонат меди(II).
Развернуть/свернуть решение
3Cl2 + 6NaOH → NaClO3 + 5NaCl + 3H2O (при нагревании)
Cl0 + 1e = Cl-1 5 окислитель
Cl0 – 5e = Cl+5 1 восстановитель
Возможен другой вариант
2NaOH + Cl2 → NaCl + NaClO + H2O
Cl0 + 1e = Cl-1 1 окислитель
Cl0 – 1e = Cl+1 1 восстановитель
Возможен другой вариант
2Fe(OH)2 + Cl2 + 2NaOH = 2Fe(OH)3 + 2NaCl
Fe+2 – 1e = Fe+3 2 восстановитель
Cl20 + 2e = 2Cl-1 1 окислитель
NaOH + Na2HPO4 = Na3PO4 + H2O
Na+ + OH— + 2Na+ + HPO42- = 3Na+ + PO43- + H2O
OH— + HPO42- = PO43- + H2O
Реальный ЕГЭ 2019. Задание 30 и 31. Вариант 15.
Перманганат калия, сульфид калия, ацетат магния, фосфат калия, гидроксид алюминия.
Развернуть/свернуть решение
2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
Mn+7 + 3e = Mn+4 2 окислитель
S-2 – 2e = S0 3 восстановитель
3(CH3COO)2Mg + 2K3PO4 = Mg3(PO4)2↓ + 6CH3COOK
6CH3COO— + 3Mg2+ + 6K+ + 2PO43- = Mg3(PO4)2↓ + 6CH3COO— + 6K+
3Mg2+ + 2PO43- = Mg3(PO4)2↓
Задание 32
Реальный ЕГЭ 2019. Задание 32. Вариант 1.
Пероксид натрия обработали оксидом углерода(IV). Выделившийся бесцветный газ прореагировал с раскалённым железом с образованием железной окалины. Полученное вещество растворили в концентрированной азотной кислоте, при этом наблюдали выделение бурого газа. Образовавшуюся соль выделили и добавили к раствору карбоната калия, наблюдали образование бурого осадка и выделение газа. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- 2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
- 3Fe + 2O2 → Fe3O4
- Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2↑ + 5H2O
- 2Fe(NO3)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
Реальный ЕГЭ 2019. Задание 32. Вариант 2.
Газ, полученный при нагревании смеси хлорида аммония и гашёной извести, пропустили над нагретым оксидом меди(II). Полученное твёрдое вещество растворили в разбавленной азотной кислоте. Образовавшийся раствор соли подвергли электролизу. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
- 2NH3 + 3CuO → 3Cu + 3H2O + N2↑
- 3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO↑ + 4H2O
- 2Cu(NO3)2 + 2H2O → 2Cu↓ + O2↑ + 4HNO3 (электролиз раствора)
Реальный ЕГЭ 2019. Задание 32. Вариант 3.
Смешали растворы сульфата железа(III) и нитрата бария. Выпавший осадок отделили, из оставшегося раствора выделили соль, затем её высушили и прокалили. Твёрдый остаток обработали иодоводородной кислотой. Полученное простое вещество при нагревании вступило в реакцию с концентрированным раствором гидроксида натрия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- Fe2(SO4)3 + 3Ba(NO3)2 → 3BaSO4↓ + 2Fe(NO3)3
- 4Fe(NO3)3 → 2Fe2O3 + 12NO2↑ + 3O2↑
- Fe2O3 + 6HI → 2FeI2 + I2↓ + 3H2O
- 3I2 + 6NaOH(р−р) → NaIO3 + 5NaI + 3H2O (при нагревании)
Реальный ЕГЭ 2019. Задание 32. Вариант 4.
Сульфат меди(II) прореагировал с алюминием. Полученную соль выделили, растворили в воде и добавили к раствору карбоната натрия. Образовавшийся осадок обработали раствором гидроксида натрия. К раствору полученного вещества добавили избыток раствора серной кислоты. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- 3CuSO4 + 2Al → Al2(SO4)3 + 3Cu↓
- Al2(SO4)3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 3Na2SO4
- Al(OH)3 + NaOH → Na[Al(OH)4]
- 2Na[Al(OH)4] + 4H2SO4 → Na2SO4 + Al2(SO4)3 + 8H2O
Реальный ЕГЭ 2019. Задание 32. Вариант 5.
Смесь оксида азота(IV) и кислорода поглотили водой, при этом образовалась кислота. Оксид железа(III) сплавили с твёрдым карбонатом натрия, при этом образовался твердый остаток. Этот остаток растворили в избытке раствора полученной кислоты. Образовавшуюся соль железа выделили и поместили в раствор карбоната калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- 4NO2 + O2 + 2H2O → 4HNO3
- Fe2O3 + Na2CO3 (тв.) → 2NaFeO2 + CO2↑ (сплавление)
- NaFeO2 + 4HNO3(изб.) → NaNO3 + Fe(NO3)3 + 2H2O
- 2Fe(NO3)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
Реальный ЕГЭ 2019. Задание 32. Вариант 6.
К раствору серной кислоты добавили оксид меди(II). Через образовавшийся раствор пропустили газ с неприятным запахом, полученный в результате взаимодействия раствора хлорида алюминия с раствором сульфида натрия. Выпавший после пропускания газа черный осадок отделили и обработали концентрированным раствором азотной кислоты. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- CuO + H2SO4 → CuSO4 + H2O
- 2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 6NaCl
- CuSO4 + H2S → CuS↓ + H2SO4
- CuS + 8HNO3(конц.) → CuSO4 + 8NO2↑ + 4H2O
Реальный ЕГЭ 2019. Задание 32. Вариант 7.
Смешали растворы бромида железа(II) и гидроксида калия. Выпавший осадок отделили, из оставшегося раствора выделили соль, затем её высушили и обработали концентрированной серной кислотой. Полученное простое вещество разделили на две части. Одну часть поместили в раствор гидроксида калия и нагрели. Вторую часть поместили в раствор, содержащий сульфит калия и гидроксид натрия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- FeBr2 + 2KOH → Fe(OH)2↓ + 2KBr
- 2KBr(тв) + 2H2SO4(конц.) → K2SO4 + Br2 + SO2↑ + 2H2O
- 3Br2 + 6KOH → 5KBr + KBrO3 + 3H2O (при нагревании)
- Br2 + K2SO3 + 2NaOH → 2NaBr + K2SO4 + H2O
Реальный ЕГЭ 2019. Задание 32. Вариант 8.
Фосфат кальция прокалили с оксидом кремния и углём. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали раствором гидроксида лития. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- Ca3(PO4)2 + 5C + 3SiO2 → 2P + 5CO + 3CaSiO3
- 2P + 5Cl2 (изб.) → 2PCl5
- 8KOH + PCl5 → K3PO4 + 5KCl + 4H2O
- K3PO4 + 3LiOH → Li3PO4↓ + 3KOH
Реальный ЕГЭ 2019. Задание 32. Вариант 9.
Гидрокарбонат натрия прокалили. Образовавшийся при этом газ (избыток) пропустили через раствор гидроксида калия. К полученному раствору прилили раствор сульфата хрома(III), при этом наблюдали выпадение осадка и выделение бесцветного газа. Осадок отделили и обработали при нагревании раствором, содержащим пероксид водорода и гидроксид натрия, при этом раствор приобрёл жёлтую окраску. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- 2NaHCO3 → Na2CO3 + CO2↑ + H2O (прокаливание)
- CO2 + KOH → KHCO3
- 6KHCO3 + Cr2(SO4)3 → 2Cr(OH)3↓ + 3K2SO4 + 6CO2↑
- 2Cr(OH)3 + 4NaOH + 3H2O2 → 2Na2CrO4 + 8H2O
Реальный ЕГЭ 2019. Задание 32. Вариант 10.
Смешали растворы сульфата калия и гидроксида бария. Выпавший осадок отделили, а через оставшийся раствор пропустили газ, полученный в результате взаимодействия серебра с концентрированной азотной кислотой. К образовавшемуся после пропускания газа раствору добавили водный раствор перманганата калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- K2SO4 + Ba(OH)2 → BaSO4↓ + 2KOH
- Ag + 2HNO3 → AgNO3 + NO2 + H2O
- 2NO2 + 2KOH → KNO2 + KNO3 + H2O
- 3KNO2 + 2KMnO4 + H2O → 2MnO2↓ + 2KOH + 3KNO3
Реальный ЕГЭ 2019. Задание 32. Вариант 11.
Алюминий прореагировал с раствором гидроксида натрия. К получившемуся раствору добавили избыток раствора азотной кислоты. Образовавшееся соединение алюминия выделили, высушили и прокалили. Полученную при этом газовую смесь пропустили через раствор гидроксида кальция. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
- Na[Al(OH)4] + 4HNO3 → NaNO3 + Al(NO3)3 + 4H2O
- 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑ (прокаливание)
- 2Ca(OH)2 + 2NO2 + 3O2 → 2Ca(NO3)2 + 2H2O
Реальный ЕГЭ 2019. Задание 32. Вариант 12.
Газ, полученный при обработке иодида калия концентрированной серной кислотой, сожгли в недостатке кислорода. Полученное при этом твёрдое вещество растворили в горячей концентрированной азотной кислоте. Выделившийся бурый газ пропустили через раствор гидроксида калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- 8KI(тв.) + 9H2SO4(конц.) → 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
- 2H2S + O2(недост.) → 2S↓ + 2H2O
- S + 6HNO3 → H2SO4 + 6NO2↑ + 2H2O
- 2NO2 + 2KOH → KNO2 + KNO3 + H2O
Реальный ЕГЭ 2019. Задание 32. Вариант 13.
Нитрат алюминия прокалили. Полученное твёрдое вещество поместили в раствор гидроксида калия. Через образовавшийся прозрачный раствор пропустили избыток газа, полученный при действии на бромид натрия концентрированной серной кислоты. При пропускании газа наблюдалось выпадение белого осадка. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑ (прокаливание)
- Al2O3 + 2KOH + 3H2O → 2K[Al(OH)4]
- 8NaI(тв.) + 9H2SO4(конц.) → 8NaHSO4 + 4I2↓ + H2S↑ + 4H2O
- K[Al(OH)4] + H2S → KHS + Al(OH)3↓ + H2O
Реальный ЕГЭ 2019. Задание 32. Вариант 14.
Смесь газов, полученную при прокаливании нитрата меди(II), поглотили водой, при этом образовалась кислота. В горячий концентрированный раствор этой кислоты поместили оксид железа(II). Образовавшуюся соль железа выделили и поместили в раствор карбоната калия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- 2Cu(NO3)2 → 2CuO + 4NO2 + O2↑ (прокаливание)
- 4NO2 + O2 + 2H2O → 4HNO3
- FeO + 4HNO3(конц.) → Fe(NO3)3 + NO2↑ + 2H2O
- 2Fe(NO3)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
Реальный ЕГЭ 2019. Задание 32. Вариант 15.
Фосфид калия растворили в воде. Через избыток образовавшегося раствора пропустили газ с неприятным запахом, полученный при действии на иодид калия концентрированной серной кислоты. К образовавшемуся после пропускания газа раствору добавили раствор сульфата алюминия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение
- K3P + 3H2O → 3KOH + PH3↑
- 8KI(тв.) + 9H2SO4(конц.) → 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
- 2KOH + H2S → K2S + 2H2O
- Al2(SO4)3 + 3K2S + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 3K2SO4
Задание 33
Реальный ЕГЭ 2019. Задание 33. Вариант 1.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 2.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 3.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 4.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 5.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 6.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 7.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 8.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 9.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 10.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 11.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 12.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 13.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 14.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 15.
Развернуть/свернуть решение
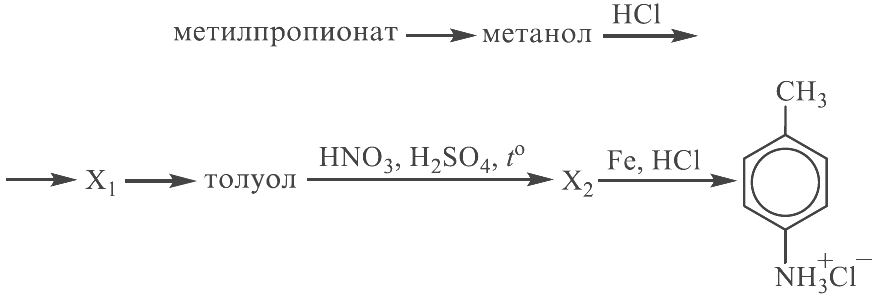
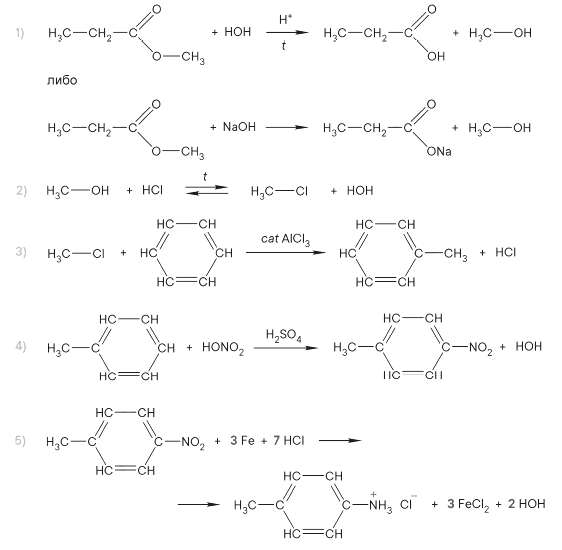
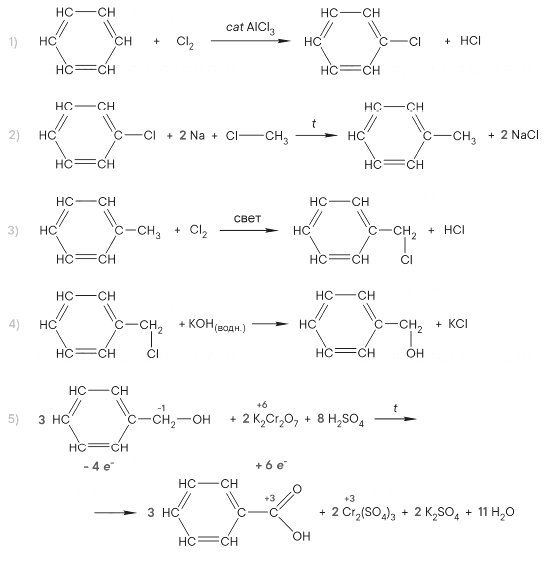
Задание 34
Реальный ЕГЭ 2019. Задание 34. Вариант 1.
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа(III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 2 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
Ответ: 22,1%.
Реальный ЕГЭ 2019. Задание 34. Вариант 2.
Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г раствора соляной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
Развернуть/свернуть решение
Эта задача аналогична задаче из Варианта 1, только химические уравнения другие, поэтому видео-объяснение вы можете посмотреть к задаче Варианта 1 и вы полностью поймёте, как решить эту задачу. Но для вашего удобства приведём очень подробное текстовое решение этой задачи:
1. Сначала запишем уравнения химических реакций, протекающих в колбах:
Колба 1: 3Na2S + 2AlCl3 + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl (уравнение 1)
Колба 2: Na2S + 2HCl = 2NaCl + H2S↑ (уравнение 2)
2. Определим то, что нужно найти в задаче и подробно распишем, как это найти через формулу массовой доли:
Найти нужно массовую долю хлорида натрия в конечном растворе во второй колбе. Значит надо подумать, как получился конечный раствор во второй колбе. Он получился добавлением к насыщенному раствору сульфида натрия, содержащегося во второй колбе, раствора соляной кислоты, за вычетом газа сероводорода (так как осадки и газы НЕ входят в состав раствора). Значит
W(в-ва) = m(в-ва)/m(р-ра)
W(NaCl) = m(NaCl)/m(р-ра Na2S из колбы 2) + m(p-pa HCl) — m(H2S образовавшегося в колбе 2)
3. Теперь мы должны найти каждый компонент в этой формуле по отдельности, всё подставить и найти ответ.
4. Чтобы найти массу NaCl, надо использовать уравнение 2, но никаких конкретных чисел для этого уравнения нет. Но известно по условию задачи, что «объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы». Т.е. уравнение 1 и 2 связаны через газ по химическому количеству (объём прямо пропорционален хим. количеству). Поэтому мы можем ввести х.
Пусть х моль газа выделилось в колбе 1, тогда 1,5х моль газа выделилось в колбе 2 (по условию задачи).
5. А связать эти переменные можно через Na2S, так как он есть и уравнении 1 и в уравнении 2, а также известно, что его раствор насыщенный и известна растворимость, значит мы можем найти общую массу, а затем и химическое количество сульфида натрия в исходной колбе (или, что тоже самое, сумму химических количеств Na2S в колбе 1 и колбе 2) с учётом того, что изначально приготовили 289 г насыщенного раствора.
Используем пропорцию для решения задач на растворимость (если вы не знакомы с задачами на растворимость, то смотрите отдельную страницу «Задачи на растворимость» с подробными видео-объяснениями)
| Соль | Вода | Раствор | |
| Растворимость | 15,6 г | 100 г | 115,6 г (15,6+100) |
| По условию задачи | y | 289 г |
Отсюда y=15,6 г*289 г/115,6 г = 39 г (Na2S исходный или общий).
n = m/M, M(Na2S) = 78 г/моль, n(Na2S) = 39г/78 г/моль = 0,5 моль
6. Теперь найдём химическое количество Na2S по уравнению 1 и по уравнению 2 через выделившийся газ Н2S. Сложим их и приравняем к общему хим. количеству Na2S, так как известно, что Na2S полностью прореагировал, потому что добавляемые растворы были в избытке (об этом сказано в условии задачи), и найдём х.
n(Na2S) = n(H2S) = x моль (по уравнению 1)
n(Na2S) = n(H2S) = 1,5 x моль (по уравнению 2)
х + 1,5х = 0,5
2,5 х = 0,5
х = 0,2
7. Теперь зная х, мы можем найти количестов NaCl по уравнению 2
n(NaCl) = 2n(H2S) = 2*1,5х = 3х = 3*0,2 моль = 0,6 моль (по уравнению 2)
m = n*M, M(NaCl) = 58,5 г/моль, m(NaCl) = 0,6 моль*58,5 г/моль = 35,1 г
8. Также мы можем найти массу улетевшего H2S из колбы 2
n(H2S) = 1,5x = 1,5*0,2 моль = 0,3 моль
m = n*M, M(H2S) = 34 г/моль, m(H2S) = 0,3 моль*34 г/моль = 10,2 г
9. И теперь находим массу раствора Na2S во второй колбе через растворимость
n(Na2S в колбе 2) = 1,5x = 1,5*0,2 моль = 0,3 моль
m = n*M, M(Na2S) = 78 г/моль, m(Na2S) = 0,3 моль*78 г/моль = 23,4 г
| Соль | Вода | Раствор | |
| Растворимость | 15,6 г | 100 г | 115,6 г (15,6+100) |
| По условию задачи | 23,4 г | z |
Отсюда z=23,4 г*115,6 г/15,6 г = 173,4 г (масса раствора Na2S во второй колбе)
10. Теперь всё подставим в формулу из пункта 2 и найдём ответ задачи:
W(NaCl) = m(NaCl)/m(р-ра Na2S из колбы 2) + m(p-pa HCl) — m(H2S образовавшегося в колбе 2) = 35,1 г/173,4 г + 100 г — 10,2 г = 35,1 г/263,2 г = 0,133 или 13,3%.
Ответ: 13,3%.
Реальный ЕГЭ 2019. Задание 34. Вариант 3.
Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке. При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
Реальный ЕГЭ 2019. Задание 34. Вариант 4.
Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твёрдого гидроксида натрия и нагрели до прекращения выделения газа. К раствору во второй колбе добавили 250 г раствора соляной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из первой колбы, оказался в 3 раза больше объёма газа, выделившегося из второй колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
Развернуть/свернуть решение
Эта задача аналогична задаче из Варианта 1, только химические уравнения другие, поэтому видео-объяснение вы можете посмотреть к задаче Варианта 1 и вы полностью поймёте, как решить эту задачу. Но для вашего удобства приведём очень краткое текстовое решение этой задачи для вашей самопроверки.
1. Колба 1: (NH4)2CO3 + 2NaOH = Na2CO3 + 2NH3↑ + 2H2O (уравнение 1)
Колба 2: (NH4)2CO3 + 2HCl = 2NH4Cl + CO2↑ + H2O (уравнение 2)
2. W(в-ва) = m(в-ва)/m(р-ра)
W(NH4Cl) = m(NH4Cl)/m(р-ра (NH4)2CO3 из колбы 2) + m(p-pa HCl) — m(CO2)
3. Пусть х моль газа CO2 выделилось в колбе 2, тогда 3х моль газа NH3 выделилось в колбе 1 (по условию задачи).
4. Используем пропорцию для решения задач на растворимость (если вы не знакомы с задачами на растворимость, то смотрите отдельную страницу «Задачи на растворимость» с подробными видео-объяснениями)
| Соль | Вода | Раствор | |
| Растворимость | 96 г | 100 г | |
| По условию задачи | y | 250 г |
Отсюда y=96 г*250 г/100 г = 240 г ((NH4)2CO3 исходный или общий).
n = m/M, M((NH4)2CO3) = 96 г/моль, n((NH4)2CO3) = 240г/96 г/моль = 2,5 моль
5. n((NH4)2CO3) = 1/2n(NH3) = 1,5x моль (по уравнению 1)
n((NH4)2CO3) = n(CO2) = x моль (по уравнению 2)
1,5х + х = 2,5
2,5 х = 2,5
х = 1
6. n(NH4Cl) = 2n(CO2) = 2*х = 2*1 моль = 2 моль (по уравнению 2)
m = n*M, M(NH4Cl) = 53,5 г/моль, m(NH4Cl) = 2 моль*53,5 г/моль = 107 г
7. n(CO2) = x = 1 моль
m = n*M, M(CO2) = 44 г/моль, m(CO2) = 1 моль*44 г/моль = 44 г
8. n((NH4)2CO3 в колбе 2) = x = 1 моль
m = n*M, M((NH4)2CO3) = 96 г/моль, m((NH4)2CO3) = 1 моль*96 г/моль = 96 г
| Соль | Вода | Раствор | |
| Растворимость | 96 г | 100 г | 196 г |
| По условию задачи | 96 г | z |
Отсюда z=96 г*196 г/96 г = 196 г (масса раствора (NH4)2CO3 во второй колбе)
9. W(NH4Cl) = m(NH4Cl)/m(р-ра (NH4)2CO3 из колбы 2) + m(p-pa HCl) — m(CO2) = 107 г/196 г + 250 г — 44 г = 107 г/402 г = 0,266 или 26,6%
Ответ: 26,6%
Реальный ЕГЭ 2019. Задание 34. Вариант 5.
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 200 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. К раствору во второй колбе добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в конечном растворе во второй колбе.
Реальный ЕГЭ 2019. Задание 34. Вариант 6.
Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа(II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-ного раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
Развернуть/свернуть решение
Эта задача аналогична задаче из Варианта 5, только химические уравнения другие, поэтому видео-объяснение вы можете посмотреть к задаче Варианта 5 (cмотри выше) и вы полностью поймёте, как решить эту задачу. Но для вашего удобства приведём очень краткое текстовое решение этой задачи для вашей самопроверки.
- Колба 1:FeSO4 + BaCl2 = BaSO4↓ + FeCl2 (уравнение 1)
Колба 2: FeSO4 + 2NH3 + 2H2O = Fe(OH)2↓ + (NH4)2SO4 (уравнение 2)
- W(в-ва) = m(в-ва)/m(р-ра)
W(NH3)конечн = m(NH3)исх – m(NH3)прор/m2(p-pa FeSO4) + m(p-pa NH3)исх – m(Fe(OH)2
- Используем пропорцию для решения задач на растворимость (если вы не знакомы с задачами на растворимость, то смотрите отдельную страницу «Задачи на растворимость» с подробными видео-объяснениями)
| Соль | Вода | Раствор | |
| Растворимость | 30,4 г | 100 г | 130,4 г (30,4 + 100) |
| По условию задачи | х | 326 г |
Отсюда х=30,4 г*326 г/130,4 г = 76 г (FeSO4 исходный или общий).
n = m/M, M(FeSO4) = 152 г/моль, n(FeSO4) = 76 г/152 г/моль = 0,5 моль
- n = m/M, M(BaSO4) = 233 г/моль, n(BaSO4) = 46,6 г/233 г/моль = 0,2 моль
n1(FeSO4) = n(BaSO4) = 0,2 моль (по уравнению 1)
- n2(FeSO4) = n(FeSO4)исх – n1(FeSO4) = 0,5 моль – 0,2 моль = 0,3 моль
m2(FeSO4) = 0,3 моль * 152 г/моль = 45,6 г
- 6.Используем пропорцию на растворимость
| Соль | Вода | Раствор | |
| Растворимость | 30,4 г | 100 г | 130,4 г |
| По условию задачи | 45,6 г | z |
Отсюда z=45,6 г*130,4 г/30,4 г = 195,6 г (масса раствора FeSO4 во второй колбе)
- m(NH3)исх = 50 г * 0,34 = 17 г
n = m/M, M(NH3) = 17 г/моль, n(NH3)исх = 17 г/17 г/моль = 1 моль
n(NH3)прор = 2*n2(FeSO4) = 2*0,3 моль = 0,6 моль (по уравнению 2)
m = n*M, m(NH3)прор = 0,6 моль * 17 г/моль = 10,2 г
- n2(FeSO4) = n(Fe(OH)2 = 0,3 моль (по уравнению 2)
m = n*M, M(Fe(OH)2) = 90 г/моль, m(Fe(OH)2) = 0,3 моль * 90 г/моль = 27 г
- W(NH3)конечн = m(NH3)исх – m(NH3)прор/m2(p-pa FeSO4) + m(p-pa NH3)исх – m(Fe(OH)2 = 17 г – 10,2 г/195,6 г + 50 г – 27 г = 6,8 г/218,6 г = 0,031 или 3,1%
Ответ: 3,1%
Реальный ЕГЭ 2019. Задание 34. Вариант 7.
Растворимость безводного сульфата алюминия при некоторой температуре составляет 34,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
Реальный ЕГЭ 2019. Задание 34. Вариант 8.
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили 395,4 г насыщенного раствора карбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата кальция. При этом образовалось 50 г осадка. К раствору во второй колбе добавили 252 г 30%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в конечном растворе во второй колбе.
Развернуть/свернуть решение
Эта задача аналогична задаче из Варианта 5, только химические уравнения другие, поэтому видео-объяснение вы можете посмотреть к задаче Варианта 5 (cмотри выше) и вы полностью поймёте, как решить эту задачу. Но для вашего удобства приведём очень краткое текстовое решение этой задачи для вашей самопроверки.
- Колба 1: Na2CO3 + Ca(NO3)2 = CaCO3↓ + 2NaNO3 (уравнение 1)
Колба 2: Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ +H2O (уравнение 2)
- W(в-ва) = m(в-ва)/m(р-ра)
W(HNO3)конечн = m(HNO3)исх – m(HNO3)прор/m2(p-pa Na2CO3) + m(p-pa HNO3)исх – m(CO2)
- Используем пропорцию для решения задач на растворимость (если вы не знакомы с задачами на растворимость, то смотрите отдельную страницу «Задачи на растворимость» с подробными видео-объяснениями)
| Соль | Вода | Раствор | |
| Растворимость | 31,8 г | 100 г | 131,8 г (31,8 + 100) |
| По условию задачи | х | 395,4 |
Отсюда х=31,8*395,4/131,8 = 95,4 г (Na2CO3 исходный или общий).
n = m/M, M(Na2CO3) = 106 г/моль, n(Na2CO3) = 95,4 г/106г/моль = 0,9 моль
- n = m/M, M(СaСO3) = 100 г/моль, n(СaСO3) = 50 г/100 г/моль = 0,5 моль
n1(Na2CO3) = n(СaСO3) = 0,5 моль (по уравнению 1)
- n2(Na2CO3) = n(Na2CO3)исх – n1(Na2CO3) = 0,9 моль – 0,5 моль = 0,4 моль
m2(Na2CO3) = 0,4 моль * 106 г/моль = 42,4 г
6.Используем пропорцию на растворимость
| Соль | Вода | Раствор | |
| Растворимость | 31,8 г | 100 г | 131,8 г |
| По условию задачи | 42,4 г | z |
Отсюда z=42,4 г*131,8 г/31,8 г = 175,73 г (масса раствора Na2CO3 во второй колбе)
- m(HNO3)исх = 252 г * 0,3 = 75,6 г
n = m/M, M(HNO3) = 63 г/моль, n(HNO3)исх = 75,6 г/63 г/моль = 1,2 моль
n(HNO3)прор = 2*n2(Na2CO3) = 2*0,4 моль = 0,8 моль (по уравнению 2)
m = n*M, m(HNO3)прор = 0,8 моль * 63 г/моль = 50,4 г
- n2(Na2CO3) = n(СO2) = 0,4 моль (по уравнению 2)
m = n*M, M(СO2) = 44 г/моль, m(СO2) = 0,4 моль * 44 г/моль = 17,6 г
- W(HNO3)конечн = m(HNO3)исх – m(HNO3)прор/m2(p-pa Na2CO3) + m(p-pa HNO3)исх – m(CO2) = 75,6г – 50,4г/175,73г + 252г – 17,6г = 25,2г/410,13г = 0,061 или 6,1%
Ответ: 6,1%
Реальный ЕГЭ 2019. Задание 34. Вариант 9.
Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
Развернуть/свернуть решение
Эта задача аналогична задаче из Варианта 5, только химические уравнения другие, поэтому видео-объяснение вы можете посмотреть к задаче Варианта 5 (cмотри выше) и вы полностью поймёте, как решить эту задачу. Но для вашего удобства приведём очень краткое текстовое решение этой задачи для вашей самопроверки.
- Колба 1:FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4 (уравнение 1)
Колба 2: FeSO4 + Ba(NO3)2 = BaSO4↓ + Fe(NO3)2 (уравнение 2)
- W(в-ва) = m(в-ва)/m(р-ра)
W(Ba(NO3)2)конечн = m(Ba(NO3)2)исх – m(Ba(NO3)2)прор/m2(p-pa FeSO4) + m(p-pa Ba(NO3)2)исх – m(BaSO4)
- Используем пропорцию для решения задач на растворимость (если вы не знакомы с задачами на растворимость, то смотрите отдельную страницу «Задачи на растворимость» с подробными видео-объяснениями)
| Соль | Вода | Раствор | |
| Растворимость | 30,4 г | 100 г | |
| По условию задачи | х | 250 г |
Отсюда х=30,4 г*250 г/100 г = 76 г (FeSO4 исходный или общий).
n = m/M, M(FeSO4) = 152 г/моль, n(FeSO4) = 76 г/152 г/моль = 0,5 моль
- n = m/M, M(Fe(OH)2) = 90 г/моль, n(СaСO3) = 18 г/90 г/моль = 0,2 моль
n1(FeSO4) = n(Fe(OH)2) = 0,2 моль (по уравнению 1)
- n2(FeSO4) = n(FeSO4)исх – n1(FeSO4) = 0,5 моль – 0,2 моль = 0,3 моль
m2(FeSO4) = 0,3 моль * 152 г/моль = 45,6 г
- 6.Используем пропорцию на растворимость
| Соль | Вода | Раствор | |
| Растворимость | 30,4 г | 100 г | 130,4 г |
| По условию задачи | 45,6 г | z |
Отсюда z=45,6 г*130,4 г/30,4 г = 195,6 г (масса раствора FeSO4 во второй колбе)
- m(Ba(NO3)2)исх = 870 г * 0,15 = 130,5 г
n = m/M, M(Ba(NO3)2) = 261 г/моль, n(Ba(NO3)2)исх = 130,5 г/261 г/моль = 0,5 моль
n(Ba(NO3)2)прор = n2(FeSO4) = 0,3 моль (по уравнению 2)
m = n*M, m(Ba(NO3)2)прор = 0,3 моль * 261 г/моль = 78,3 г
- n2(FeSO4) = n(BaSO4) = 0,3 моль (по уравнению 2)
m = n*M, M(BaSO4) = 233 г/моль, m(BaSO4) = 0,3 моль * 233 г/моль = 69,9 г
- W(Ba(NO3)2)конечн = m(Ba(NO3)2)исх – m(Ba(NO3)2)прор/m2(p-pa FeSO4) + m(p-pa Ba(NO3)2)исх – m(BaSO4) = 130,5 г – 78,3 г/195,6 г + 870 г – 69,9 г = 52,2 г/995,7 г = 0,052 или 5,2%
Ответ: 5,2%.
Реальный ЕГЭ 2019. Задание 34. Вариант 10.
Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфида натрия к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. К раствору во второй колбе добавили 450 г 15%-ного раствора хлорида меди(II). Определите массовую долю хлорида меди(II) в конечном растворе во второй колбе.
Развернуть/свернуть решение
- Колба 1:Na2S + 2HCl = 2NaCl + H2S↑ (уравнение 1)
Колба 2: Na2S + CuCl2 = CuS↓ + 2NaCl (уравнение 2)
- W(в-ва) = m(в-ва)/m(р-ра)
W(CuCl2)конечн = m(CuCl2)исх – m(CuCl2)прор/m2(p-pa Na2S) + m(p-pa CuCl2)исх – m(CuS)
- Используем пропорцию для решения задач на растворимость (если вы не знакомы с задачами на растворимость, то смотрите отдельную страницу «Задачи на растворимость» с подробными видео-объяснениями)
| Соль | Вода | Раствор | |
| Растворимость | 15,6 г | 100 г | |
| По условию задачи | х | 250 г |
Отсюда х = 15,6 г*250 г/100 г = 39 г (Na2S исходный или общий).
n = m/M, M(Na2S) = 78 г/моль, n(Na2S) = 39 г/78 г/моль = 0,5 моль
- n = V/Vm, n(H2S) = 4,48 л/22,4 л/моль = 0,2 моль
n1(Na2S) = n(H2S) = 0,2 моль (по уравнению 1)
- n2(Na2S) = n(Na2S)исх – n1(Na2S) = 0,5 моль – 0,2 моль = 0,3 моль
m2(Na2S) = 0,3 моль * 78 г/моль = 23,4 г
- 6.Используем пропорцию на растворимость
| Соль | Вода | Раствор | |
| Растворимость | 15,6 г | 100 г | 115,6 г |
| По условию задачи | 23,4 г | z |
Отсюда z = 23,4 г*115,6 г/15,6 г = 173,4 г (масса раствора Na2S во второй колбе)
- m(CuCl2)исх = 450 г * 0,15 = 67,5 г
n = m/M, M(CuCl2) = 135 г/моль, n(CuCl2)исх = 67,5 г/135 г/моль = 0,5 моль
n(CuCl2)прор = n2(Na2S) = 0,3 моль (по уравнению 2)
m = n*M, m(CuCl2)прор = 0,3 моль * 135 г/моль = 40,5 г
- n2(Na2S) = n(CuS) = 0,3 моль (по уравнению 2)
m = n*M, M(CuS) = 96 г/моль, m(CuS) = 0,3 моль * 96 г/моль = 28,8 г
- W(CuCl2)конечн = m(CuCl2)исх – m(CuCl2)прор/m2(p-pa Na2S) + m(p-pa CuCl2)исх – m(CuS) = 67,5 г – 40,5 г/173,4 г + 450 г – 28,8 г = 27 г/594,6 г = 0,045 или 4,5%
Ответ: 4,5%.
Реальный ЕГЭ 2019. Задание 34. Вариант 11.
Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 160 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната натрия. При этом образовалось 30 г осадка. К раствору во второй колбе добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в конечном растворе во второй колбе.
Развернуть/свернуть решение
- Колба 1:CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl (уравнение 1)
Колба 2: CaCl2 + 2AgNO3 = 2AgCl↓ + Ca(NO3)2 (уравнение 2)
- W(в-ва) = m(в-ва)/m(р-ра)
W(AgNO3)конечн = m(AgNO3)исх – m(AgNO3)прор/m2(p-pa CaCl2) + m(p-pa AgNO3)исх – m(AgCl)
- Используем пропорцию для решения задач на растворимость (если вы не знакомы с задачами на растворимость, то смотрите отдельную страницу «Задачи на растворимость» с подробными видео-объяснениями)
| Соль | Вода | Раствор | |
| Растворимость | 55,5 г | 100 г | |
| По условию задачи | х | 160 г |
Отсюда х = 55,5 г*160 г/100 г = 88,8 г (CaCl2 исходный или общий).
n = m/M, M(CaCl2) = 111 г/моль, n(CaCl2) = 88,8 г/111 г/моль = 0,8 моль
- n = m/M, M(CaCO3) = 100 г/моль, n(CaCO3) = 30 г/100 г/моль = 0,3 моль
n1(CaCl2) = n(CaCO3) = 0,3 моль (по уравнению 1)
- n2(CaCl2) = n(CaCl2)исх – n1(CaCl2) = 0,8 моль – 0,3 моль = 0,5 моль
m2(CaCl2) = 0,5 моль * 111 г/моль = 55,5 г
- 6.Используем пропорцию на растворимость
| Соль | Вода | Раствор | |
| Растворимость | 55,5 г | 100 г | 155,5 г |
| По условию задачи | 55,5 г | z |
Отсюда z = 55,5 г*155,5 г/55,5 г = 155,5 г (масса раствора CaCl2 во второй колбе)
- m(AgNO3)исх = 595 г * 0,4 = 238 г
n = m/M, M(AgNO3) = 170 г/моль, n(AgNO3)исх = 238 г/170 г/моль = 1,4 моль
n(AgNO3)прор = 2*n2(CaCl2) = 2 * 0,5 моль = 1 моль (по уравнению 2)
m = n*M, m(AgNO3)прор = 1 моль * 170 г/моль = 170 г
- 2*n2(CaCl2) = n(AgCl) = 2 * 0,5 моль = 1 моль (по уравнению 2)
m = n*M, M(AgCl) = 143,5 г/моль, m(AgCl) = 1 моль * 143,5 г/моль = 143,5 г
- W(AgNO3)конечн = m(AgNO3)исх – m(AgNO3)прор/m2(p-pa CaCl2) + m(p-pa AgNO3)исх – m(AgCl) = 238 г – 170 г/155,5 г + 595 г – 143,5 г = 68 г/607 г = 0,112 или 11,2%.
Ответ: 11,2%.
Задание 35
Реальный ЕГЭ 2019. Задание 35. Вариант 1.
Органическое вещество содержит 3,41% водорода, 34,09% углерода, 36,36% кислорода и 26,14 натрия по массе. Известно, что при нагревании этого вещества с избытком гидроксида натрия образуется предельный углеводород. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции, протекающей при нагревании исходного вещества с избытком гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 2.
Органическое вещество, массовая доля углерода в котором равна 45,45%, водорода – 6,06%, кислорода – 48,48%, при нагревании реагирует с водным раствором гидроксида натрия, образуя два спирта и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакциитисходного вещества с водным раствором гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 3.
Органическое вещество, массовая доля углерода в котором равна 49,31%, кислорода – 43,84%, при нагревании реагирует с водным раствором гидроксида натрия, образуя этанол и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия.
Решение этой задачи смотрите в следующем варианте, так как они абсолютно аналогичные.
Реальный ЕГЭ 2019. Задание 35. Вариант 4.
Органическое вещество, массовая доля водорода в котором равна 6,85%, кислорода – 43,84%, при нагревании реагирует с водным раствором гидроксида натрия, образуя этанол и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 5.
Органическое вещество содержит 9,43% водорода, а также углерод и кислород, массовые доли которых равны. Известно, что это вещество реагирует с натрием и со свежеосажденным гидроксидом меди(II), молекула его содержит третичный атом углерода. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с избытком натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 6.
При сжигании образца органического вещества массой 3,8 г получено 3,36 л (н.у.) углекислого газа и 3,6 г воды. Известно, что это вещество реагирует с натрием и со свежеосажденным гидроксидом меди(II). На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с избытком азотной кислоты.
Реальный ЕГЭ 2019. Задание 35. Вариант 7.
Органическое вещество, массовая доля углерода в котором равна 40,68%, кислорода – 54,24%, при нагревании реагирует с водным раствором гидроксида натрия, образуя метанол и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 8.
Органическое вещество содержит 2,47% водорода, 29,63% углерода, 39,5% кислорода и 28,4% натрия по массе. Известно, что при нагревании этого вещества с избытком гидроксида натрия образуется предельный углеводород. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции, протекающей при нагревании исходного вещества с избытком гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 9.
При нагревании с водным раствором гидроксида натрия некоторое органические вещество подвергается гидролизу с образованием двух продуктов, первый из которых имеет состав С2H3O2Na. Второй продукт гидролиза содержит 38,71% углерода и 9,68% водорода по массе. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции гидролиза исходного вещества в растворе гидроксида калия.
Реальный ЕГЭ 2019. Задание 35. Вариант 10.
При сжигании образца органического вещества массой 8,76 г получено 8,064 л (н.у.) углекислого газа и 5,4 г воды. При нагревании в присутствии кислоты данное вещество подвергается гидролизу с образованием двух продуктов в соотношении 2 : 1, первый из которых имеет состав С2H4O2. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции гидролиза исходного вещества в кислой среде.
Реальный ЕГЭ 2019. Задание 35. Вариант 11.
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 11,76% азота, 26,89% кислорода и 10,92% водорода по массе. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А; 2) запишите молекулярную формулу органического вещества А; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра.
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
Дорогие друзья! На этой странице вы можете найти варианты реальных КИМ ЕГЭ по химии. На сайте размещены только ссылки на варианты КИМ ЕГЭ. Если вы хотите помочь и дополнить коллекцию вариантов, пожалуйста, присылайте свои материалы на почту: ste-vn@ya.ru. Все качественные материалы я опубликую с обратными ссылками.
Приобрести сборник вариантов ЕГЭ по химии вы можете здесь.
2021-2022 учебный год
| Демонстрационный вариант КИМ ЕГЭ по химии-2022 | ||
| Вариант Ответы | Кодификатор | Спецификация |
| Перспективный вариант демо-версии КИМ ЕГЭ по химии-2022 | ||
| Вариант | Спецификация |
2020-2021 учебный год
| Реальные варианты КИМ ЕГЭ по химии | ||
| Основная волна ЕГЭ по химии-2021 | ||
| Вариант 1 | Ответы и решения | 31 мая 2021 |
| Все задания второй части реального ЕГЭ по химии-2021 с решениями: 30-31, 32, 33, 34, 35 | ||
| Открытый вариант ЕГЭ по химии-2021 от ФИПИ | ||
| Вариант | Ответы и решения | |
| Демонстрационный вариант ЕГЭ по химии-2021 (проект) | ||
| Вариант Ответы | Кодификатор | Спецификация |
|
Тренировочные варианты ЕГЭ по химии-2021 |
||
| Вариант 1
Вариант 2 |
Вариант 1 — ответы и решения
Вариант 2 — ответы, критерии |
2019-2020 учебный год
| Реальные варианты КИМ ЕГЭ по химии | ||
| Основная волна ЕГЭ по химии-2020 | ||
| Вариант 1 |
Ответы и решения | 16 июля 2020 г. |
| Вариант 2 | 16 июля 2020 г. | |
| Все задания второй части реального ЕГЭ по химии-2020 с решениями: 30-31, 32, 33, 34, 35 |
||
| Демонстрационный ЕГЭ по химии-2020 | ||
| Вариант Ответы | Кодификатор | Спецификация |
|
Досрочный ЕГЭ по химии-2020 |
||
| Вариант 1
Вариант 2 |
Вариант 1 — ответы, критерии
Вариант 2 — ответы, критерии |
апрель 2020 г. |
2018-2019 учебный год
| Реальные варианты КИМ ЕГЭ по химии | ||
| Демонстрационный ЕГЭ по химии-2019 | ||
| Вариант Ответы | Кодификатор | Спецификация |
| Досрочный ЕГЭ по химии 25 марта 2019 года | ||
| Вариант 1 | Решения и ответы | |
| Вариант от ФИПИ | ||
| Основная волна 31 мая 2019 года | ||
2017-2018 учебный год
| Демонстрационный ЕГЭ по химии-2018 | ||
| Вариант Ответы | Кодификатор | Спецификация |
| Досрочный ЕГЭ по химии 26 марта 2018 года | ||
| Вариант резервного дня 06.04.2018 | ||
| Вариант от ФИПИ | ||
| Основная волна 4 июня 2018 года | ||
- 14.09.2019
Сборник заданий с реального ЕГЭ по химии, который проходил 31 мая 2019 года (основная волна).
- Другие предметы (реальные варианты 2019)
- Реальные варианты с досрочного ЕГЭ 2019
Сверяем ответы и решения в комментариях ниже!
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Сохранить ссылку:
Комментарии (1)
Добавить комментарий
Комментарии
-9
#1
Галина
16.09.2019 22:45
Каким боком это к химии относится?
Цитировать
Обновить список комментариев
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Имя (обязательное)
E-Mail
Подписаться на уведомления о новых комментариях
Отправить
Досрочный вариант ЕГЭ по химии 2019 от ФИПИ. Реальные варианты ЕГЭ 2019. Варианты с досрочного периода ЕГЭ 2019 от ФИПИ.
скачать
Смотрите также:
- ЕГЭ ХИМИЯ 2019. Разбор Досрочного варианта с сайта ФИПИ. Альфия Агеева.
- Тренировочный вариант ЕГЭ 2019 по химии №18 с ответами
ХИМИЯ
2022—2023 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2023 года с решениями.
2021—2022 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2022 года с решениями.
2020—2021 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2021 года с решениями.
2019—2020 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2020 года с решениями.
2018—2019 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2019 года с решениями.
ЕГЭ по химии 25.03.2019. Досрочная волна. Вариант.
ЕГЭ по химии 31.05.2019. Основная волна. Вариант.
2017—2018 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2018 года с решениями.
2016—2017 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2017 года с решениями.
ЕГЭ по химии 29.03.2017. Досрочная волна. Вариант.
2015—2016 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2016 года с решениями.
2014—2015 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2015 года с решениями.
ЕГЭ по химии 05.05.2015. Досрочная волна. Вариант.
2013—2014 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2014 года с решениями.
2012—2013 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2013 года с решениями.
2011—2012 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2012 года с решениями.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 5.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 5.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 5.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5.
Вариант 1
1. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную −2.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выберите два сложных вещества, в молекулах которых имеется -связь.
1) метанол
2) азот
3) метаналь
4) аммиак
5) оксид углерода (II)
Запишите в поле ответа номера выбранных соединений.
5. Установите соответствие между формулой вещества и классом неорганических соединений, к которому оно принадлежит.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС СОЕДИНЕНИЙ |
|
|
А) Б) В) |
1) основный оксид 2) гидроксид 3) кислотный оксид 4) кислота |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
6. Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид цинка.
1) H2SO4 и KOH
2) H2O и NaOH
3) CO и O2
4) Cl2 и NaNO3
5) NaOH и HCl
Запишите в поле ответа номера выбранных пар веществ.
7. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
8. Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА |
ПРОДУКТЫ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) 6) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
9. Установите соответствие между формулой вещества и формулами реагентов, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
ФОРМУЛЫ РЕАГЕНТОВ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
10. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
11. Установите соответствие между молекулярной формулой вещества и классом (группой) органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
МОЛЕКУЛЯРНАЯ ФОРМУЛА |
КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
|
A) Б) В) |
1) многоатомные спирты 2) одноатомные спирты 3) одноосновные кислоты 4) алкины |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
12. Из предложенного перечня выберите два вещества, в молекулах которых находятся атомы углерода только в sp2-гибридном состоянии.
1) ацетилен
2) стирол
3) бутен
4) пентан
5) этилен
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите два вещества, с которыми реагируют и бензол, и циклогексан.
1) вода
2) бром
3) раствор перманганата калия
4) аммиак
5) азотная кислота
Запишите в поле ответа номера выбранных веществ.
14. Из предложенного перечня выберите два вещества, при взаимодействии с которыми бутанол-1 образует сложный эфир.
1) пропанол
2) муравьиная кислота
3) соляная кислота
4) уксусная кислота
5) метаналь
Запишите в поле ответа номера выбранных веществ.
15. Из предложенного перечня выберите два вещества, с которыми взаимодействует метиламин.
1) уксусная кислота
2) этан
3) бензол
4) гидроксид железа (III)
5) хлорметан
Запишите в поле ответа номера выбранных веществ.
16. Установите соответствие между названием углеводорода и формулой органического продукта, который преимущественно образуется при взаимодействии углеводорода с хлором на свету: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
УГЛЕВОДОРОД |
ФОРМУЛА ПРОДУКТА ВЗАИМОДЕЙСТВИЯ С ХЛОРОМ |
|
|
А) бензол Б) толуол В) этан Г) циклогексан |
1) 2) 3) 4) 5) 6) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
17. Установите соответствие между реагирующими веществами и органическим веществом – продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА |
ПРОДУКТ РЕАКЦИИ |
|
|
А) Б) В) Г) |
1) метилформиат 2) ацетат аммония 3) ацетат натрия 4) метилацетат 5) этилат натрия 6) аминоуксусная кислота |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
18. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами и
.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам.
19. Из предложенного перечня выберите два вещества, разложение каждого из которых является окислительно-восстановительной реакцией.
1) перманганат калия
2) хлорид аммония
3) дихромат аммония
4) гидрокарбонат кальция
5) кремниевая кислота
Запишите в поле ответа номера выбранных веществ.
20. Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к увеличению скорости реакции
1) охлаждение системы
2) снижение давления
3) удаление аммиака
4) нагревание системы
5) добавление водорода
Запишите в поле ответа номера выбранных внешних воздействий.
21. Установите соответствие между схемой реакции и формулой недостающего в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
СХЕМА РЕАКЦИИ |
ФОРМУЛА ВЕЩЕСТВА |
|
|
A) Б) B) Г) |
1) 2) 3) 4) 5) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
22. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
|
|
A) Б) В) Г) |
1) 2) 3) 4) 5) 6) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
23. Установите соответствие между формулой соли и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
|
A) Б) B) Г) |
1) гидролизуется по катиону 2) гидролизуется по аниону 3) не гидролизуется 4) гидролизуется как по катиону, так и по аниону |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
24. Установите соответствие между уравнением обратимой химической реакции и направлением смещения химического равновесия в результате увеличения объёма (расширения) системы при постоянной температуре: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
УРАВНЕНИЕ РЕАКЦИИ |
НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ |
|
|
А) Б) В) Г) |
1) равновесие смещается в сторону продуктов 2) равновесие смещается в сторону реагентов 3) положение равновесия не изменяется |
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
25. Установите соответствие между парой неорганических веществ и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ВЕЩЕСТВА |
РЕАГЕНТ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
26. Установите соответствие между веществом и источником его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ВЕЩЕСТВО |
ИСТОЧНИК ПОЛУЧЕНИЯ |
|
|
А) полиэтилен Б) кислород В) углекислый газ Г) железо |
1) воздух 2) вода 3) гематит 4) дымовые газы 5) этилен |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
27. Вычислите массу 15 %-го раствора вещества, который можно получить разбавлением 200 г 36 %-го раствора. Ответ дайте в граммах с точностью до целых.
28. Термохимическое уравнение сгорания железа в кислороде:
В результате реакции выделилось 2057,5 кДж. Вычислите массу образовавшегося оксида железа (III). Ответ дайте в граммах с точностью до целых.
29. При растворении серебра в концентрированной азотной кислоте выделилось 33,6 л (н. у.) оксида азота (IV). Сколько граммов серебра израсходовано? Ответ округлите до ближайшего целого числа.
30. Для выполнения задания используйте следующий перечень веществ: фосфор, хлорноватая кислота, карбонат калия, нитрат цинка, сульфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
31. Для выполнения задания используйте следующий перечень веществ: фосфор, хлорноватая кислота, карбонат калия, нитрат цинка, сульфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
32. Раствор нитрата меди (II) подвергли электролизу на инертном аноде. Выделившийся при этом бесцветный газ прореагировал с металлическим натрием. Полученное вещество осторожно растворили в воде и далее к этому раствору добавили сульфат хрома (III), в результате чего образовался раствор желтого цвета.
Напишите уравнения четырёх описанных реакций.
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях приведите структурные формулы органических веществ.
34. Гидрокарбонат натрия массой 43,34 г прокалили до постоянной массы. Остаток растворили в избытке соляной кислоты. Получившийся при этом газ пропустили через 100 г 10 %-ного раствора гидроксида натрия. Определите состав и массу образовавшейся соли, её массовую долю в растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
35. При сгорании 16,2 г органического вещества нециклического строения получили 26,88 л (н. у.) углекислого газа и 16,2 г воды. Известно, что 1 моль этого органического вещества в присутствии катализатора присоединяет только 1 моль воды и данное вещество не реагирует с аммиачным раствором оксида серебра.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции гидратации органического вещества.
Вариант 2
1. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов.
2. Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке усиления неметаллических свойств.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +1.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выберите два соединения, в молекулах которых имеются -связи.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных соединений.
5. Установите соответствие между формулой вещества и классом неорганических соединений, к которому оно принадлежит.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС СОЕДИНЕНИЙ |
|
|
А) Б) В) |
1) несолеобразующий оксид 2) кислота 3) амфотерный оксид 4) кислотный оксид |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
6. Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид железа (II).
1) плавиковая и соляная кислота
2) вода и хлорид натрия
3) фосфорная кислота и гидроксид меди (II)
4) алюминий и гидроксид магния
5) серная кислота и водород
Запишите в поле ответа номера выбранных пар веществ.
7. В пробирку с раствором соли Х добавили несколько кусочков металла Y. В результате реакции наблюдали растворение кусочков металла Y и выделение другого металла.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
8. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ ОКСИДА |
ФОРМУЛЫ ВЕЩЕСТВ |
|
|
A) оксид азота (IV) Б) оксид бария B) оксид цинка Г) оксид хрома (II) |
1) 2) 3) 4) 5) 6) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
9. Установите соответствие между формулой вещества и формулами реагентов, с каждым из которых оно может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ВЕЩЕСТВО |
ФОРМУЛЫ РЕАГЕНТОВ |
|
|
A) Б) B) Г) |
1) 2) 3) 4) 5) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
10. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
11. Установите соответствие между названием вещества и классом (группой) органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ ВЕЩЕСТВА |
КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
|
A) метаналь Б) глицерин B) глицин |
1) арены 2) альдегиды 3) спирты 4) аминокислоты |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
12. Из предложенного перечня выберите два вещества, в молекулах которых находятся атомы углерода только в sp2-гибридном состоянии.
1) ацетилен
2) стирол
3) бутен
4) пентан
5) этилен
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите два вещества, которые в определённых условиях способны присоединять воду.
1) циклогексан
2) толуол
3) 2-метилпропан
4) пропен
5) пентин-2
Запишите в поле ответа номера выбранных соединений.
14. Из предложенного перечня выберите два вещества, с которыми не взаимодействует этанол.
1) уксусная кислота
2) натрий
3) водород
4) вода
5) бромоводород
Запишите в поле ответа номера выбранных веществ.
15. Из предложенного перечня выберите два вещества, с которыми может взаимодействовать диметиламин.
1) сульфат бария
2) хлороводород
3) гидроксид кальция
4) уксусная кислота
5) карбонат кальция
Запишите в поле ответа номера выбранных веществ.
16. Установите соответствие между названием вещества и продуктом, который образуется при взаимодействии этого вещества с избытком водорода.
|
НАЗВАНИЕ ВЕЩЕСТВА |
ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
|
А) циклопропан Б) 3-метилбутин-1 В) бензол Г) изопрен (2-метилбутадиен-1,3) |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
17. Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА |
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
|
А) 2-хлорбутан и Б) 1-хлорбутан и В) 1-хлорбутан и Г) 2-хлорбутан и |
1) бутен-1 2) бутанол-1 3) бутен-2 4) бутанол-2 5) н-октан 6) 3,4-диметилгексан |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
18. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами и
.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
19. Из предложенного перечня выберите две пары веществ, каждая из которых даёт реакцию замещения.
1) этен и хлороводород
2) бензол и азотная кислота
3) ацетилен и вода
4) этилен и вода
5) метан и хлор
Запишите в поле ответа номера выбранных пар веществ.
20. Из предложенного перечня выберите два воздействия, которые приводят к уменьшению скорости реакции между цинком и соляной кислотой.
1) измельчение цинка
2) охлаждение
3) добавление
4) нагревание
5) уменьшение количества реагентов с течением времени
Запишите в поле ответа номера выбранных воздействий.
21. Установите соответствие между веществами, вступившими в реакцию, и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ |
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ |
|
|
А) Б) B) Г) |
1) 2) 3) 4) 5) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
22. Установите соответствие между формулой вещества и уравнением полуреакции, которая протекает на катоде при электролизе водного раствора вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
УРАВНЕНИЕ ПОЛУРЕАКЦИИ НА КАТОДЕ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) 6) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
23. Установите соответствие между названием соли и способностью ее к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ СОЛИ |
СПОСОБНОСТЬ К ГИДРОЛИЗУ |
|
|
A) ацетат натрия Б) йодид кальция B) сульфид алюминия Г) карбонат калия |
1) гидролизу не подвергается 2) гидролиз по катиону 3) гидролиз по аниону 4) гидролиз по катиону и аниону |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
24. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении общего давления.
|
УРАВНЕНИЕ РЕАКЦИИ |
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
|
А) Б) В) Г) |
1) смещается в направлении прямой реакции 2) смещается в направлении обратной реакции 3) практически не смещается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
25. Установите соответствие между парами веществ и реагентами, с помощью которых их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ПАРА ВЕЩЕСТВ |
РЕАГЕНТ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
26. Установите соответствие между процессом и его целью: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ПРОЦЕСС |
ЦЕЛЬ ПРОЦЕССА |
|
|
A) перегонка (фракционирование) сжиженного воздуха Б) прокаливание фосфатов кальция с углем и диоксидом кремния В) крекинг нефтепродуктов Г) каталитическое окисление диоксида серы в триоксид серы |
1) получение бензина 2) получение серной кислоты 3) получение каучука 4) получение фосфора 5) получение легких газов (азот, кислород) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
27. Вычислите массу гидроксида калия, который надо прибавить к 40 г 10 %-го раствора, чтобы получить 40 %-й раствор. Ответ дайте в граммах с точностью до целых.
28. При разложении оксида азота образовалось 25 л азота и 12,5 л кислорода. Вычислите объём вступившего в реакцию оксида азота. Объёмы газов измерены при одинаковых условиях. Ответ дайте в литрах с точностью до целых.
29. Литий массой 3,5 г сожгли в кислороде. Вычислите массу оксида лития, образовавшегося при этом. Ответ укажите в граммах с точностью до десятых.
30. Для выполнения задания используйте следующий перечень веществ: аммиак, нитрат алюминия, бромоводород, серебро, дихромат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
31. Для выполнения задания используйте следующий перечень веществ: аммиак, нитрат алюминия, бромоводород, серебро, дихромат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
32. На кристаллический хлорид натрия подействовали концентрированной серной кислотой. Образовавшийся газ растворили в воде и в получившийся раствор добавили необходимое количество оксида меди (II). Полученный раствор смешали с раствором нитрата серебра, выпавший при этом осадок отделили. К оставшемуся раствору добавили раствор иодида калия. Напишите уравнения четырёх описанных реакций.
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях приведите структурные формулы органических веществ.
34. При взаимодействии 20 г пиролюзита (минерала, содержащего диоксид марганца) с избытком концентрированной соляной кислоты выделился хлор, поглощённый избытком горячего раствора гидроксида натрия. Последующее добавление к получившемуся раствору избытка раствора нитрата серебра привело к образованию 47,84 г осадка хлорида серебра. Какова массовая доля диоксида марганца в пиролюзите?
35. При полном сгорании органического вещества массой 29,6 г образовалось 26,88 л (при н. у.) углекислого газа и 21,6 г воды. Относительная плотность паров этого вещества по водороду равна 37. Установлено, что оно не реагирует с гидрокарбонатом натрия, не даёт реакции «серебряного зеркала», но взаимодействует со щелочами. Установите молекулярную формулу вещества, изобразите его структурную формулу и напишите уравнение реакции с гидроксидом натрия.
Вариант 3
1. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Выберите два элемента, которые в соединениях могут иметь степень окисления –4.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выберите две пары веществ с молекулярным строением.
1) графит и оксид углерода (IV)
2) вода и оксид углерода (II)
3) кремний и оксид железа (III)
4) сероводород и аммиак
5) серная кислота и оксид кремния (IV)
Запишите в поле ответа номера выбранных пар веществ.
5. Установите соответствие между формулой вещества и классом неорганических соединений, к которому оно принадлежит.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС СОЕДИНЕНИЙ |
|
|
А) Б) В) |
1) несолеобразующий оксид 2) кислота 3) амфотерный оксид 4) кислотный оксид |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
6. Из предложенного перечня выберите два элемента, которые реагируют с водой только при нагревании.
1) серебро
2) медь
3) цинк
4) золото
5) железо
Запишите в поле ответа номера выбранных веществ.
7. В пробирку с раствором соли Х добавили небольшое количество раствора Y. В результате реакции наблюдали образование осадка.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
8. Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА |
ПРОДУКТЫ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) 6) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
9. Установите соответствие между реагентами и продуктами реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
РЕАГЕНТЫ |
ПРОДУКТЫ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
10. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
11. Установите соответствие между формулой вещества и классом (группой) органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС (ГРУППА) СОЕДИНЕНИЙ |
|
|
А) Б) В) |
1) амин 2) предельный двухатомный спирт 3) сложный эфир 4) арен |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
12. Из предложенного перечня выберите два соединения, в которых все атомы углерода находятся в состоянии sp2-гибридизации.
1) бутен-1
2) бутадиен-1,2
3) бутадиен-1,3
4) этилбензол
5) бензол
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите две реакции, в которые не вступает пропан, в отличие от циклопропана.
1) гидрирование
2) гидрогалогенирование
3) дегидрирование
4) полимеризация
5) этерификация
Запишите в поле ответа номера выбранных реакций.
14. Из предложенного перечня выберите два вещества, с которыми реагирует пропанол-2 , а фенол — нет?
1) бромоводород
2) бромная вода
3) натрий
4) гидроксид натрия
5) соляная кислота
Запишите в поле ответа номера выбранных веществ.
15. Из предложенного перечня выберите два вещества, с которыми взаимодействует аминоуксусная кислота.
1) этан
2) метанол
3) хлорид натрия
4) кальций
5) диэтиловый эфир
Запишите в поле ответа номера выбранных веществ.
16. Установите соответствие между названием углеводорода и продуктом, который преимущественно образуется при его взаимодействии с хлором на свету: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ ВЕЩЕСТВА |
ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
|
А) метан Б) 2-метилпропан В) бензол Г) толуол |
1) 2) 3) 4) 5) 6) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
17. Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА |
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
|
A) уксусная кислота и сульфид натрия Б) муравьиная кислота и гидроксид натрия В) муравьиная кислота и гидроксид меди (II) (при нагревании) Г) этанол и натрий |
1) пропионат натрия 2) этилат натрия 3) формиат меди (II) 4) формиат натрия 5) ацетат натрия 6) углекислый газ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
18. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
19. Из предложенного перечня веществ выберите два вещества, реакция термического разложения которых является окислительно-восстановительной.
1) нитрат алюминия
2) гидрокарбонат калия
3) гидроксид алюминия
4) карбонат аммония
5) нитрат аммония
Запишите в поле ответа номера выбранных веществ.
20. Из предложенного перечня выберите две реакции, увеличение скорости протекания которых происходит благодаря повышению концентрации азота.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных реакций.
21. Установите соответствие между схемой окислительно-восстановительной реакции и степенью окисления восстановителя: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
СХЕМА ОВР |
СТЕПЕНЬ ОКИСЛЕНИЯ |
|
|
А) Б) В) Г) |
1) –3 2) –1 3) 0 4) +4 |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
22. Установите соответствие между формулой вещества и процессом, происходящем на катоде при электролизе его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
УРАВНЕНИЕ ПОЛУРЕАКЦИИ НА КАТОДЕ |
|
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
23. Установите соответствие между формулой соли и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
|
А) Б) В) Г) |
1) не гидролизуется 2) гидролизуется по катиону 3) гидролизуется по аниону 4) гидролизуется и по катиону, и по аниону |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
24. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
УРАВНЕНИЕ РЕАКЦИИ |
НАПРАВЛЕНИЕ СМЕЩЕНИЯ |
|
|
А) Б) В) Г) |
1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
25. Установите соответствие между ионом и реактивом, использующимся для его качественного определения: к позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
|
ИОН |
РЕАКТИВ ДЛЯ КАЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ |
|
|
A) катион серебра Б) катион кальция В) катион хрома(III) Г) катион бария |
1) ацетат натрия 2) фторид калия 3) сульфат аммония 4) йодид свинца 5) нитрат стронция |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
26. Установите соответствие между ионом и реактивом, использующимся для его каче-ственного определения: к позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
|
ИОН |
РЕАКТИВ ДЛЯ КАЧЕСТВЕННОГО |
|
|
А) катион железа (III) Б) катион серебра В) анион хлора Г) катион бария |
1) сульфат калия 2) соляная кислота 3) гидроксид аммония 4) хлорид свинца 5) нитрат серебра |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
27. К 75 г раствора с массовой долей соли 14% добавили 10 г той же соли и 10 мл воды. Вычислите массовую долю соли в полученном растворе (в процентах). (Запишите число с точностью до десятых.)
28. В результате реакции, термохимическое уравнение которой
выделилось 968 кДж теплоты. Вычислите массу образовавшейся при этом воды. Ответ укажите в граммах с точностью до целых.
29. Вычислите объём газа (н. у.), который выделится при растворении 28,0 г железа в соляной кислоте. Ответ укажите в литрах с точностью до десятых.
30. Для выполнения задания используйте следующий перечень веществ: хлорат калия, фосфат натрия, иодоводород, углекислый газ, карбонат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
31. Для выполнения задания используйте следующий перечень веществ: хлорат калия, фосфат натрия, иодоводород, углекислый газ, карбонат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
32. Алюминий растворили в разбавленной азотной кислоте, при этом выделения газа не наблюдалось. К полученному раствору добавили избыток водного раствора аммиака. Выпавший осадок прокалили, а твёрдый остаток сплавили с сульфитом калия. Напишите уравнения четырёх описанных реакций.
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
34. 25,0 г сплава магния и алюминия обработали избытком раствора щёлочи. Выделившийся при этом газ полностью восстановил 32,0 г оксида меди (II). Рассчитайте массовые доли (в %) металлов в сплаве.
35. При сгорании 4,00 г органического соединения образовалось 4,48 л углекислого газа (н.у.) и 2,88 г воды. Вещество обесцвечивает бромную воду и вступает в реакцию с раствором гидроксида бария при нагревании, один из продуктов имеет формулу
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции этого вещества с раствором гидроксида бария при нагревании (используйте структурные формулы органических веществ).
Официальный сайт ФИПИ опубликовал по одному варианту ЕГЭ 2019 досрочного периода по всем предметам, в том числе и по химии.
ЕГЭ досрочного периода по химии состоялся 25 марта 2019 года.
Досрочный вариант ЕГЭ 2019 по химии
Структура КИМ ЕГЭ 2019 по химии.
Каждый вариант экзаменационной работы построен по единому плану: работа состоит из двух частей, включающих в себя 35 заданий.
Часть 1 содержит 29 заданий с кратким ответом, в их числе 21 задание базового уровня сложности (в варианте они присутствуют под номерами: 1–7, 10–15, 18–21, 26–29) и 8 заданий повышенного уровня сложности (их порядковые номера: 8, 9, 16, 17, 22–25).
Часть 2 содержит 6 заданий высокого уровня сложности, с развёрнутым ответом. Это задания под номерами 30–35.
Дополнительные материалы и оборудование
К каждому варианту экзаменационной работы ЕГЭ 2019 по химии прилагаются следующие материалы:
− Периодическая система химических элементов Д.И. Менделеева;
− таблица растворимости солей, кислот и оснований в воде;
− электрохимический ряд напряжений металлов.
Во время выполнения экзаменационной работы разрешается использовать непрограммируемый калькулятор.
Перечень дополнительных устройств и материалов, пользование которыми разрешено на ЕГЭ, утверждается приказом Рособрнадзора.
Смотрите также: