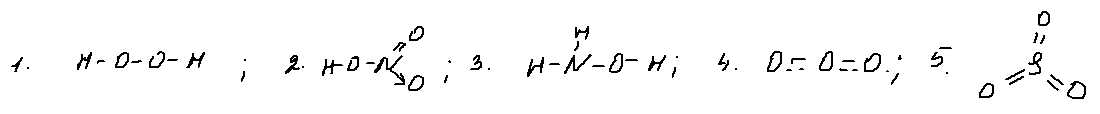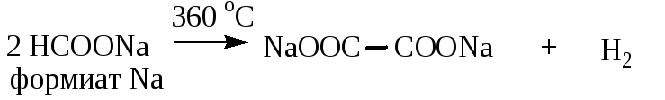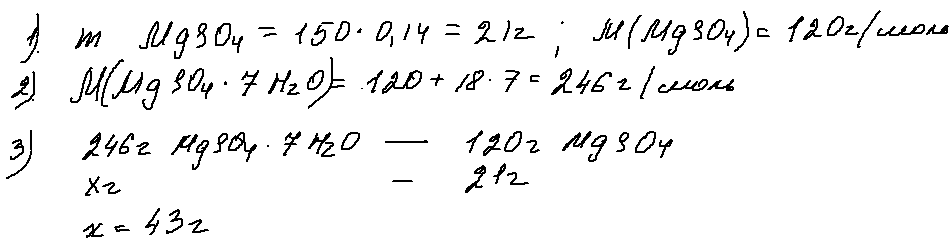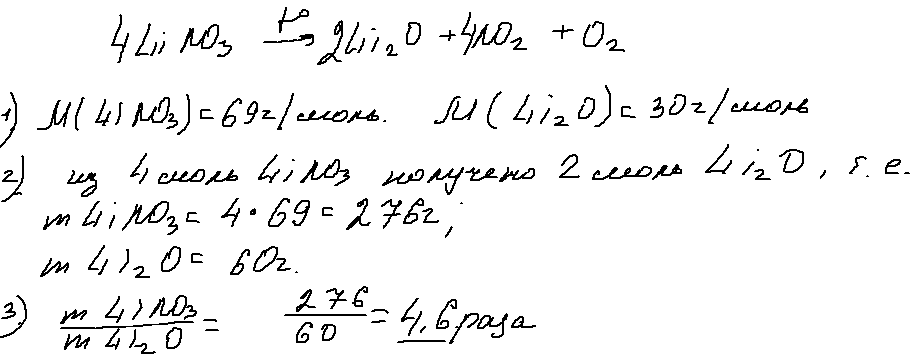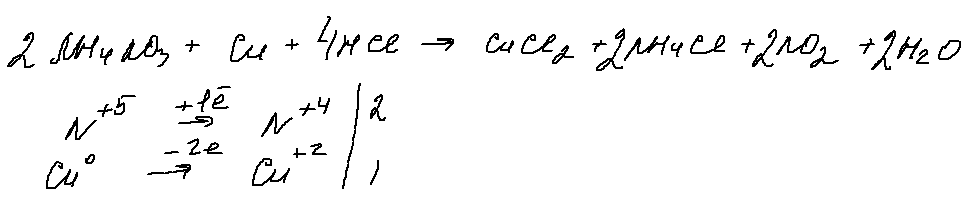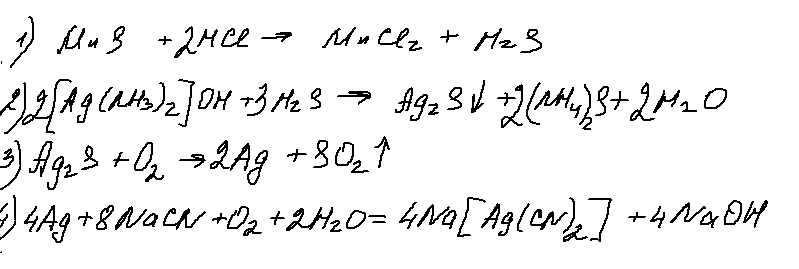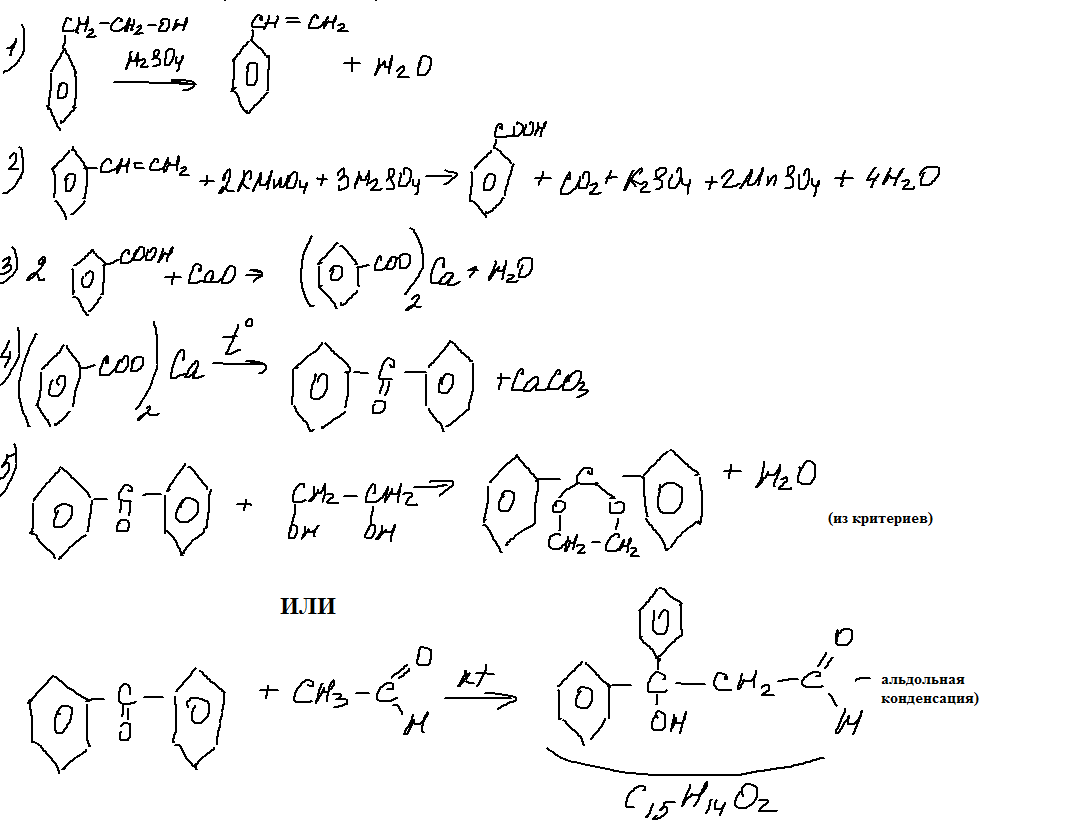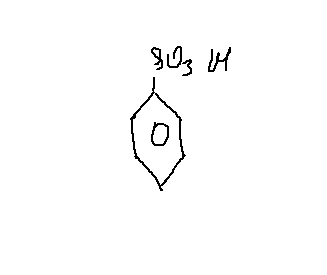Если смесь хлоридов калия и кальция добавить к избытку раствора карбоната натрия, то образуется 10 г осадка. Если ту же смесь добавить к избытку раствора нитрата серебра, то образуется 57,4 г осадка. Определите массовую долю хлорида калия в исходной смеси.
Спрятать решение
Решение.
Составим уравнения реакций:
Рассчитаем количество моль и массу хлорида кальция:
Рассчитаем количество моль и массу хлорида калия:
Рассчитаем массовую доля хлорида калия:
Спрятать критерии
Критерии проверки:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, включает все названные выше элементы | 4 |
| В ответе допущена ошибка в одном из названных выше элементов | 3 |
| В ответе допущены ошибки в двух из названных выше элементов | 2 |
| В ответе допущены ошибки в трёх из названных выше элементов | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
Задача №34 на фильтрование и прокаливание | ЕГЭ по химии 2023
Смотреть видео:
#химия #химияпросто #неорганика #егэпохимии #эксперименты #химик #егэхимия #опыты #химияегэ
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Задача № 2F95FF из банка ЕГЭ по химии ФИПИ
Сергей Широкопояс

Задача № D86D27 из банка заданий ЕГЭ по химии ФИПИ
Сергей Широкопояс

Задача по химии на растворы повышенной сложности.
День знаний

Задача по химии. На пластинку
Химия с Аней
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
01.03.2023
- Комментарии
RSS
Написать комментарий
Нет комментариев. Ваш будет первым!
Ваше имя:
Загрузка…
Экзамен по химии считается одним из самых сложных, наряду с историей и физикой. Его обязаны сдавать все, кто хочет поступить в медицинский вуз. Иногда химия нужна, чтобы стать экологом или биоинженером. В прошлом году средний балл по химии составил 54,3. Однако около 12 тысяч человек справились с экзаменом на 81–100 баллов. Учитель химии онлайн школы «Синергия» Елена Тетяйкина поделилась, как готовит учеников к высоким результатам и что нужно выучить и понять для успешной сдачи.
Из этой статьи вы узнаете
Особенности экзамена по химии
Структура ЕГЭ по химии
Что изменилось в 2023 году
Сколько нужно готовиться к экзамену
Как помочь себе подготовиться
Особенности экзамена по химии
Готовиться лучше заранее. Желательно приступить к углублённому изучению химии с восьмого класса. Специфика предмета в том, что для получения высоких баллов нужны способности, вызубрить наизусть не получится, утверждает эксперт.
Советую родителям не наседать на ребёнка, если у него нет склонности к химии. У меня была ученица, которая хотела поступить в медицинский (точнее, её мама этого хотела). У неё была хорошая память, мы много и усердно занимались, она сдала ОГЭ практически на максимум, но в десятом классе просто выгорела и забросила предмет. У неё не было интереса к химии, и давление родителей только усугубило ситуацию
Елена Тетяйкина
ЕГЭ в 2023 году: расписание, проходные баллы, продолжительность экзаменов
Читать подробнее
Структура ЕГЭ по химии
Экзамен состоит из двух частей: базовой и части с заданиями повышенной сложности. Для удобства экзамен разделён по тематическим блокам:
1 блок. Теоретические основы химии. Перед этим блоком ученику предоставляют список из пяти элементов. В заданиях 1–4 он должен продемонстрировать знания следующих тем:
-
современные представления о строении атома;
-
периодический закон и периодическая система химических элементов Д.И. Менделеева;
-
химическая связь и строение вещества.
Понимание периодического закона поможет успешно справиться с заданиями этого блока, поэтому лучше выучить его наизусть и повторить строение атома (программа 8―9-го классов).
2 блок. Неорганические вещества. Задания этого блока в комплексе проверяют знания свойств соединений элементов и закономерностей протекания реакций. Здесь нужно знать простые и сложные неорганические вещества, особенности их строения, химические свойства, генетическую связь между классами соединений. Эти вещества изучают в девятом классе, а в 11-м дополняют исключениями, которые любят спрашивать на ЕГЭ, поэтому лучше выучить их наизусть.
Пример исключения:
Оксиды делятся на солеобразующие и несолеобразующие. Кстати, несолеобразующие необходимо знать назубок. В частности к несолеобразующим относят СО ― угарный газ, NO ― оксид азота (II), N2O ― оксид азота (I).
3 блок. Органические вещества. Здесь также, как во втором блоке, нужно знать классификации веществ (задание 10), строение (задание 11), химические свойства. Но теперь речь идёт об органических веществах, которые изучают в программе 10-го класса. Нужно знать, как из одного класса веществ получить другие, какими химическими свойствами обладают органические вещества и т. д. (задания 12–16).
4 блок. Методы познания в химии. В этом блоке, начиная с задания 17, проверяют знания классификаций реакций по различным параметрам (числу участников, тепловому эффекту, наличию катализатора и т. д.). Для этих заданий нужно повторить промышленные способы получения веществ, процесс электролиза, принцип Ле Шателье.
Онлайн-школа
Готовься к ЕГЭ онлайн под руководством педагогов и наставников
Узнать подробнее
Что изменилось в 2023 году
Основные изменения, по мнению эксперта, нацелены на развитие аналитических способностей учеников.
«Дети, возможно, начнут путаться. Они привыкли работать с готовой информацией, а теперь надо анализировать, больше думать головой и понимать», ― говорит Елена.
Изменения в ЕГЭ по химии в 2023 году:
-
Нумерация. В этом году изменили последовательность заданий в части с развёрнутым ответом. Задача на определение молекулярной и структурной формулы теперь идёт под номером 33, а задача на определение состава исходной смеси ― под номером 34. Получилось, что задания 32 и 33 вошли в блок по органической химии.
-
Формат задания 23. Условия задания представили в другой форме: раньше была таблица, а теперь они записаны в виде текста. Поэтому ученикам придётся потратить больше времени, чтобы ознакомиться с информацией. Алгоритм решения остался прежним.
-
Изменения сложности заданий 9, 12, 16. В 2023 году задания усложнили, хотя алгоритмы решения, тематика и максимальный балл за каждое остались прежними.
По наблюдениям Елены, задания меняют, чтобы ещё раз убедиться в объективности оценки знаний. Ещё организаторы хотят лучше развивать у детей метапредметные умения: навыки понимать универсальные форматы заданий, работать и с текстами, и с таблицами, и с практическими задачами.
ЕГЭ по информатике на 100 баллов: как готовиться и хватит ли школьных знаний
Читать подробнее
Сколько нужно готовиться к экзамену
Эксперт советует начинать готовиться в десятом классе, предварительно повторив информацию из прошлых лет обучения. Именно в программе десятого класса начинают изучать органическую химию. По мнению Елены, детям бывает сложно воспринимать этот раздел.
Во многих школах химию проходят в базовом виде: по одному уроку в неделю. Для успешной сдачи этого мало, темы дают в сокращённом виде. Не понимая, как происходят реакции, сдать экзамен сложно. Если в вашей школе изучают базовый уровень, можно попросить у учителя учебник с углублённым курсом
Елена Тетяйкина
Хорошей базой для подготовки к ОГЭ и ЕГЭ может стать участие в олимпиадах. Ссем желающим сдавать химию Елена советует с восьмого класса активно посещать конкурсы и олимпиады: в них дают задачи повышенной сложности, которые помогают развивать кругозор и учат справляться с трудными заданиями.
Читай советы по карьере и новости об образовании в нашем Telegram-канале
Подписаться
Как помочь себе подготовиться
-
Решать пробники. Выполнять задания из базы fipi.ru надо с 10-го класса, чтобы привыкать к формату и требованиям, осознавать пробелы в своих знаниях различных тем. Если вы столкнулись со сложной задачей при самостоятельной подготовке, Елена советует обратиться к видеоразборам задач на YouTube. Там наглядно решают трудные случаи, показывают примеры и комментируют действия.
-
Тренироваться с таймером. Поскольку в экзамене много сложных задач, а время ограничено, надо учиться вписываться в тайминг. Для этого Елена предлагает ученикам работать с таймером: каждую задачу решать за определённое время. Эта практика помогает выполнить больше заданий.
-
Пользоваться чёрно-белой таблицей. На экзамене ученикам выдают таблицу с элементами, на которой нет цветовых подсказок. Чтобы привыкнуть к работе с ней, лучше в домашних условиях использовать чёрно-белый вариант.
-
Найти свой способ восприятия информации. Елена советует проанализировать свои индивидуальные особенности.
«У одних людей получается воспринимать информацию на слух, а другим надо просто зазубрить. Я предлагаю ученикам рисовать схемы и картинки, иллюстрировать состав и связь веществ. Кто-то запоминает по конспектам, кто-то ― по картинкам. На мой взгляд, лучше всего усваивается материал, когда работает несколько видов памяти: ученики слушают информацию, записывают за учителем, видят перед собой схемы», ― утверждает педагог.
alto-lab.ru/tablica-mendeleeva
Как сдать ЕГЭ по обществознанию на 100 баллов: читать новости и уметь отвечать по делу
310 баллов ЕГЭ из 300: как личные достижения помогут вам поступить в вуз
ЕГЭ по биологии: какие особенности экзамена надо учесть, чтобы сдать его на 100 баллов
Онлайн-школа
Готовься к ЕГЭ онлайн под руководством педагогов и наставников
Педагоги и эксперты ЕГЭ системно преподают все нужные темы и учат выполнять задания независимо от их формулировки и формата, ориентируясь на актуальные материалы и варианты ФИПИ. После курсов школьники сдают ЕГЭ на 90+ баллов. Ученика поддерживают наставники, психологи и тьюторы.
Узнать подробнее
Задания 34 (2021). Расчет массовой доли химического соединения в смеси и массы веществ.
Источник текстов условий задач — паблик Вконтакте И.С. Ермолаева «ЕГЭ по химии на максимум».
Авторы решений: Иванова А.М., Широкопояс С.И.
[raw shortcodes=1]
Задание №1
Смесь, содержащую оксид фосфора(V) и оксид калия, в которой соотношение числа атомов кислорода к числу атомов фосфора равно 14,5 : 4, сплавили, затем растворили в горячей воде. В результате получили 447,4 г раствора, в котором массовая доля атомов водорода составляет 7,6%. Вычислите массу фосфата калия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
3K2O + P2O5 = 2K3PO4 (1)
Пусть в исходной смеси содержалось х моль P2O5 и y моль K2O.
Отношение количеств атомов фосфора и кислорода равно отношению количеств веществ этих атомов:
N(О)/N(P) =ν(О)/ν(P) =14,5/4
ν(O)= 5 ⋅ ν(P2O5) + ν(K2O) = 5x+y, а ν(P) = 2⋅ν(P2O5) = 2x;
Тогда будет верным такое соотношение:
(5x+y)/2x=14,5/4
Отсюда выразим одну переменную через другую:
4⋅(5x + y) = 2x ⋅14,5
20⋅x + 4⋅y = 29⋅x
9⋅x = 4y
x = 4/9⋅y
Далее, зная массовую долю водорода в полученном растворе, можем определить массу атомов водорода и добавленной воды:
m(H) = ω(Н) ∙ m(получ.р-ра)= 0,076 ∙ 447,4 = 34 г
ν(Н) = 34/1= 34 моль
ν(Н2О) = ν(Н)/2 = 34/2=17 моль
m(Н2О)=17 ∙ 18 = 306 г
Так как после растворения в воде получившейся в результате реакции (1) смеси никакие вещества не покидали сферу реакции, масса раствора стала равна сумме масс исходной смеси оксидов и добавленной воды:
m (получ. р-ра) = mисх (P2O5 и K2O) + mдоб(Н2О) = 142x +94y+306 = 447,4 г
Составим систему уравнений:
x= y∙ 4/9
142x+94y+306=447,4
Подставим выражение для х во второе уравнение:
142 y ⋅4/9 +94y+306=447,4
63,11y+94y+306=447,4
157,11y=141,4
y=0,9
x=0,9 ⋅ 4/9=0,4
Таким образом исходные количества оксидов равны х = νисх (P2O5) = 0,4 моль,
y = νисх (K2O) = 0,9 моль.
Количество вступившего в реакцию сплавления оксида фосфора(V) согласно уравнению реакции (1) в 3 раза меньше количества оксида калия:
ν1 (P2O5)= νисх (K2O)/3 = 0,9/3 = 0,3 моль, из этого видно, что оксид фосфора взят в избытке. Количество полученного в результате реакции (1) фосфата калия рассчитаем по соотношению с количеством вещества оксида калия:
ν1(K3PO4) = ν(K2O) ∙ 2/3 = 0,9∙ 2/3 = 0,6 (моль)
Оставшийся оксид фосфора будет вступать в реакцию с добавленной водой с образованием ортофосфорной кислоты:
P2O5 + 3Н2О = 2H3PO4 (2)
Найдём количества оставшегося после реакции (1) оксида фосфора, вступившего в реакцию (2), и фосфорной кислоты:
ν2(P2O5) = νисх.(P2O5) — ν1(P2O5) = 0,4 – 0,3 = 0,1 (моль).
ν(H3PO4) = 2 ∙ ν2 (P2O5) = 2 ∙ 0,1 = 0,2 (моль)
Теперь обратим внимание на то, что фосфорная кислота может взаимодействовать с фосфатом натрия двумя путями в зависимости от соотношения «соль : кислота» с образованием двух разных кислых солей:
2K3PO4 + H3PO4 = 3K2НPO4
K3PO4 + 2H3PO4 = 3KН2PO4
Установим соотношение между полученными количествами фосфата калия и кислоты в нашей задаче:
ν(H3PO4):ν1(K3PO4) = 0,2:0,6 = 1:3, то есть соли в полученном растворе в 3 раза больше, чем кислоты, поэтому реакция (3) протекает с образованием гидрофосфата калия:
2K3PO4 + H3PO4 = 3K2НPO4
Количество вещества фосфата калия, затраченного на взаимодействие с кислотой:
ν3 (K3PO4) = ν(H3PO4) ∙ 2 = 2 ∙ 0,2 = 0,4 (моль), тогда в растворе фосфата калия осталось
νост (K3PO4) = ν1 (K3PO4) — ν3 (K3PO4) = 0,6 – 0,4 = 0,2 (моль)
mост (K3PO4) = 0,2 ∙ 212 = 42,4 г
Задание №2
Смесь, содержащую оксид фосфора(V) и оксид натрия, в которой соотношение числа атомов фосфора к числу атомов натрия равно 7 : 18, нагрели, а затем растворили в горячей воде. В результате получили 312,5 г раствора, в котором массовая доля атомов водорода составляет 7,36 %. Вычислите массу фосфата натрия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
(1) 3Na2O + P2O5 = 2Na3PO4
Пусть в исходной смеси содержалось х моль P2O5 и y моль Na2O.
Отношение количеств атомов фосфора и натрия равно отношению количеств веществ этих атомов и по условию составляет:
N(P)/N(Na) =ν(P)/ν(Na) =7/18
ν(P) = 2⋅ν(P2O5 ) = 2x, а ν(Na) = 2⋅ν(Na2O) = 2y
Тогда будет верным такое соотношение:
2x/2y = 7/18
2x ⋅ 18 = 2y ⋅ 7
x = y ⋅ 7/18
Далее, зная массовую долю водорода в полученном растворе, можем определить массу атомов водорода и добавленной воды:
m(H) = ω(Н) ∙ m(получ.р-ра) = 0,0736 ∙ 312,5 = 23 г
ν(Н) = 23 /1 = 23 моль
ν(Н2О) = ν(Н)/2 = 23 /2 = 11,5 моль
m(Н2О) = 11,5 ∙ 18 = 207 г
Так как после растворения в воде получившейся в результате реакции (1) смеси никакие вещества не покидали сферу реакции, масса раствора стала равна сумме масс исходной смеси оксидов и добавленной воды:
m (получ. р-ра) = mисх (P2O5 и Na2O) + mдоб(Н2О) = 142x + 62y + 206,64 = 312,5 (г)
Составим систему уравнений:
x = y ⋅ 7/18
142x+62y+207=312,5
Подставим выражение для х во второе уравнение:
142y ⋅ 7/18 + 62y + 207=312,5
55,22y + 62y + 207 = 312,5
117,22y = 105,5
y = 0,9
x = 0,9⋅7/18 = 0,35
Таким образом исходные количества оксидов равны х = νисх (P2O5) = 0,35 моль,
y = νисх (Na2O) = 0,9 моль.
Количество вступившего в реакцию сплавления оксида фосфора (V) согласно уравнению реакции (1) в 3 раза меньше количества оксида натрия:
ν1 (P2O5) = νисх (K2O)/3 = 0,9/3 = 0,3 моль, из этого видно, что оксид фосфора взят в избытке. Количество полученного в результате реакции (1) фосфата натрия рассчитаем по соотношению с количеством вещества оксида натрия:
ν1 (Na3PO4) = ν (Na2O) ∙ 2/3 = 0,9∙ 2/3 = 0,6 моль
Оставшийся оксид фосфора будет вступать в реакцию с добавленной водой с образованием ортофосфорной кислоты:
(2) P2O5 + 3Н2О = 2H3PO4
Найдём количества оставшегося после реакции (1) оксида фосфора, вступившего в реакцию (2), и фосфорной кислоты:
ν2 (P2O5) = νисх (P2O5) — ν1 (P2O5) = 0,35 – 0,3 = 0,05 моль
ν (H3PO4) = 2 ∙ ν2 (P2O5) = 2 ∙ 0,05 = 0,1 моль
Теперь обратим внимание на то, что фосфорная кислота может взаимодействовать с фосфатом натрия двумя путями в зависимости от соотношения «соль : кислота» с образованием двух разных кислых солей:
2Na3PO4 + H3PO4 = 3Na2НPO4
Na3PO4 + 2Na3PO4 = 3NaН2PO4
Установим соотношение между полученными количествами фосфата калия и кислоты в нашей задаче:
ν (H3PO4) : ν1 (Na3PO4) = 0,1 : 0,6 = 1:6, то есть соли в полученном растворе в 6 раз больше, поэтому реакция (3) протекает с образованием гидрофосфата калия:
(3) 2Na3PO4 + H3PO4 = 3Na2НPO4
Количество вещества фосфата натрия, затраченного на взаимодействие с кислотой:
ν3 (Na3PO4) = ν(H3PO4) ∙ 2 = 2 ∙ 0,1 = 0,2 (моль), тогда в растворе фосфата натрия осталось
νост (Na3PO4) = ν1 (Na3PO4) — ν3 (Na3PO4) = 0,6 – 0,2 = 0,4 моль
mост (Na3PO4) = 0,4 ∙ 164 = 65,6 г
Задание №3
Смесь хлорида бария и гидроксида бария растворили в воде. Полученный раствор разлили по трем колбам. К 520 г раствора в первой колбе добавили избыток раствора серной кислоты. При этом образовалось 163,1 г осадка. К 130 г раствора во второй колбе добавили 166,5 г 20%-ной соляной кислоты. В результате массовая доля кислоты в растворе уменьшилась вдвое. Вычислите массовую долю хлорида бария и гидроксида бария в растворе в третьей колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Запишем уравнения реакций, протекающих в первой и второй колбах. В первой колбе с серной кислотой реагируют и хлорид бария, и гидроксид бария. Во второй колбе только гидроксид бария вступает во взаимодействие с соляной кислотой:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl (1)
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O (2)
Ba(OH)2 + 2HCl = BaCl2 + 2H2O (3)
Начнем решение задачи с рассмотрения процессов во второй колбе. Рассчитаем количество вещества хлороводорода в исходном растворе соляной кислоты, добавленной во II колбу:
νисх (HCl) = mисх.р-ра (HCl) ∙ ω1 (HCl) / M(HCl) = 166,5 ∙ 0,2 / 36,5 = 0,912 моль
Массовая доля хлороводорода после добавления к раствору во II колбе составила
ω2 = ω1/2 = 20% / 2 = 10%, а масса полученного раствора будет складываться из массы исходного раствора добавленной кислоты и исходного раствора во II колбе:
m (получ. р-ра во II колбе) = mисх.р-ра (HCl) + mисх.р-ра (во II колбе) = 166,65 + 130 = 296,65 г
Тогда количество вещества хлороводорода, оставшегося во II колбе после реакции:
νост (HCl) = m (получ. р-ра во II колбе) ∙ ω2(HCl) / M(HCl) = 296,65 ∙ 0,1 / 36,5 = 0,813 моль
Исходя из полученных данных рассчитаем количество вещества хлороводорода, затраченного на реакцию (3):
νпрореаг (HCl) = νисх (HCl) — νост (HCl) = 0,912 – 0,813 ≈ 0,1 моль
Согласно уравнению реакции (3) количество вещества вступившего в реакцию гидроксида бария в 2 раза меньше количества вещества хлороводорода:
ν3 (Ba(OH)2) = νпрореаг (HCl) / 2 = 0,1 / 2 = 0,05 моль
Так как отношение количеств растворенных веществ к общей массе раствора одинаково для каждой колбы, найдем количество вещества гидроксида бария в первой колбе:
ν3 (Ba(OH)2) / m ( исх. р-ра во II колбе) = ν2 (Ba(OH)2) / m ( исх. р-ра во I колбе), где
ν3 (Ba(OH)2) — количество вещества гидроксида бария во II колбе
ν2 (Ba(OH)2) — количество вещества гидроксида бария в I колбе
0,05 / 130 = ν2 (Ba(OH)2) / 520
ν2 (Ba(OH)2) = 0,05 ∙ 520 / 130 = 0,2 моль
Рассчитаем количество вещества сульфата бария, выделившегося в первой колбе:
νобщ (BaSO4) = 163,1 / 233 = 0,7 моль
По уравнению реакции (2) количества веществ гидроксида бария и сульфата бария равны: ν2 (BaSO4) = ν2 (Ba(OH)2) = 0,2 моль, тогда в реакции (1) выделилось
ν1 (BaSO4) = 0,7 – 0,2 = 0,5 моль. Отсюда найдем количество хлорида бария в I колбе:
ν1 (BaCl2) = ν1 (BaSO4) = 0,5 моль
m1 (BaCl2) = 0,5 ∙ 208 = 104 г
m1 (Ba(OH)2) = 0,2 ∙ 171 = 34,2 г
Зная, что массовая доля хлорида бария и гидроксида бария одинакова во всех исходных растворах, разлитых по трем колбам, вычислим массовые доли этих веществ в первой колбе, что и будем верным ответом для третьей колбы:
ωIII (Ba(OH)2) = ωI (Ba(OH)2) = 34,2 / 520 ∙ 100% = 6,58%
ωIII (BaCl2) = ωI (BaCl2) = 104 / 520 ∙ 100% = 20%
Задание №4
Смесь хлорида бария и хлорида алюминия растворили в воде. Полученный раствор разлили по трем колбам. К 300 г раствора в первой колбе добавили 164 г 10%-ного раствора фосфата натрия. При этом все исходные вещества прореагировали полностью. К 120 г раствора во второй колбе добавили 155,61 г 20%-ого раствора сульфата натрия. При этом массовая доля сульфата натрия в полученном растворе оказалась вдвое меньше, чем в исходном. Вычислите массовую долю каждой из солей в третьей колбе. Процессами гидролиза пренебречь.
Решение
Запишем уравнения реакций, протекающих в первой и второй колбах. В первой колбе с фосфатом натрия реагируют и хлорид бария, и хлорид алюминия. Во второй колбе только хлорид бария вступает во взаимодействие с сульфатом натрия:
AlCl3 + Na3PO4 = AlPO4↓ + 3NaCl (1)
3BaCl2 + 2Na3PO4 = Ba3(PO4)2↓ + 6NaCl (2)
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl (3)
Начнем решение задачи с рассмотрения процессов во второй колбе. Рассчитаем количество вещества сульфата натрия в исходном растворе, добавленном во II колбу:
mисх(Na2SO4) = mисх.р—ра (Na2SO4) ∙ ω1 (Na2SO4)= 155,61 ∙ 0,2 = 31,122 г
Массовая доля Na2SO4 сульфата натрия после добавления к раствору во II колбе составила
ω2 (Na2SO4) = ω1/2 = 20% / 2 = 10%
Пусть в (3) реакцию вступило х моль Na2SO4, тогда образовалось х моль сульфата бария.
Масса полученного раствора будет складываться из массы исходного раствора сульфата натрия, исходного раствора солей во II колбе, учитывая массу выпавшего осадка:
m (получ. р-ра во II колбе) = mисх.р-ра (Na2SO4) + mисх.р-ра (во II колбе) – m (BaSO4)= 155,61+ 120 – 233х = 275,61 – 233х г
Тогда массовая доля сульфата натрия в полученном растворе после протекания (3) реакции:
(31,122 – 142х) / (275,61 – 233х) = 0,1
31,122 – 142х = (275,61 – 233х) ∙ 0,1
31,122 – 142х = 27,561 – 23,3х
118,7х = 3,561
х = 0,03
ν3 (Na2SO4) = ν3 (BaCl2) = х = 0,03 моль
Так как отношение количеств растворенных веществ к общей массе раствора одинаково для каждой колбы, найдем количество вещества хлорида бария в первой колбе:
ν3 (BaCl2) / m ( исх. р-ра во II колбе) = ν2 (BaCl2) / m ( исх. р-ра во I колбе), где
ν3 (BaCl2) — количество вещества хлорида бария во II колбе
ν2 (BaCl2) — количество вещества хлорида бария в I колбе
0,03 / 120 = ν2 (BaCl2) / 300
ν2 (BaCl2) = 0,03 ∙ 300 / 120 = 0,075 моль
Рассчитаем количество вещества фосфата натрия, прореагировавшего с хлоридом бария в первой колбе:
ν2 (Na3PO4) = ν2 (BaCl2) ∙ 2 / 3 = 0,075 ∙ 2 / 3 = 0,05 моль
Общее количество фосфата натрия, добавленного в I колбу составит:
νобщ (Na3PO4) = 164 ∙ 0,1 / 164 = 0,1 моль
Тогда рассчитаем количество фосфата, прореагировавшего с хлоридом алюминия:
ν1 (Na3PO4) = νобщ (Na3PO4) — ν2 (Na3PO4) = 0,1 – 0,05 = 0,05 моль
Отсюда по уравнению (1) найдем количество хлорида алюминия в первой колбе:
ν1 (AlCl3) = ν1 (Na3PO4) = 0,05 моль
m1 (AlCl3) = 0,05 ∙ 133,5 = 6,675 г
m1 (BaCl2) = 0,075 ∙ 208 = 15,6 г
Зная, что массовая доля хлорида бария и хлорида алюминия одинакова во всех исходных растворах, разлитых по трем колбам, вычислим массовые доли этих веществ в первой колбе, что и будем верным ответом для третьей колбы:
ωIII (AlCl3) = ωI (AlCl3) = 6,675 / 300 ∙ 100% = 2,225%
ωIII (BaCl2) = ωI (BaCl2) = 15,6 / 300 ∙ 100% = 5,2%
Задание №5
Смесь хлорида магния и нитрата алюминия растворили в воде. Полученный раствор разлили по трем колбам. К 750 г раствора в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 114,8 г осадка. К 300 г раствора во второй колбе добавили 868,54 г 20%-ого раствора гидроксида натрия. При этом массовая доля щелочи в растворе уменьшилась в 1,6 раза. Вычислите массовую долю каждой из солей в третьей колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Начнем решение задачи с рассмотрения процессов в первой колбе. С нитратом серебра взаимодействует только хлорид магния:
2AgNO3 + MgCl2 = 2AgCl↓ + Mg(NO3)2 (1)
Вычислим массу выпавшего осадка:
ν1 (AgCl) = 114,8 / 143,5 = 0,8 моль
ν1 (MgCl2) = ν1 (AgCl) / 2 = 0,8 / 2 = 0,4 моль
m1 (MgCl2) = 0,4 ∙ 95 = 38 г
Рассчитаем массовую долю хлорида магния, которая в каждой колбе одинакова:
ωIII (MgCl2) = ωI (MgCl2) = 38 / 750 ∙ 100% = 5,07%
Реакции, протекающие после добавления гидроксида натрия во вторую колбу:
MgCl2 + 2NaOH = Mg(OH)2 +2NaCl (2)
Al(NO3)3 + 4NaOH = Na[Al(OH)4] + 3NaNO3 (3)
Далее рассчитаем количество хлорида магния во второй колбе, учитывая, что отношение количества растворенного вещества к массе раствора везде одинаково:
ν1 (MgCl2) / mI (исх. раствора солей) = ν2 (MgCl2) / mII (исх. раствора солей)
ν2 (MgCl2) = ν1 (MgCl2) ∙ mII (исх. раствора солей) / mI (исх. раствора солей) = 0,4 ∙ 300 / 750 = 0,16 моль.
Найдем общее количество вещества гидроксида натрия, добавленного во вторую колбу:
νобщ (NaOH) = 0,2 ∙ 868,54 / 40 = 4,34 моль
Известно, что после взаимодействия гидроксида натрия с растворенными солями его массовая доля уменьшилась в 1,6 раз, то есть составила
ω2 (NaOH) = ω1/1,6 = 20% / 1,6 = 12,5%
Для вычисления массы полученного после реакций (2) и (3) раствора нам потребуется найти массу выпавшего в осадок гидроксида магния:
ν (Mg(OH)2) = ν2 (MgCl2) = 0,16 моль
m (Mg(OH)2) = 0,16 ∙ 54 = 8,64 г
mII (полученного раствора после 2 и 3 реакции) = mII (исх. раствора солей) + mисх (р-ра NaOH) — m (Mg(OH)2) = 300 + 868,54 – 8,64 = 1160 г
Пусть в реакцию (3) вступило х моль нитрата алюминия, тогда количество прореагировавшего с ним гидроксида натрия составит 4х моль.
Массовая доля оставшегося гидроксида натрия в полученном после реакций (2) и (3) раствора:
(4,02 – 4х) ∙ 40 / 1160 = 0,125
1160 ∙ 0,125 = (4,02 – 4х) ∙ 40
145 = 160,8 – 160х
160х = 15,8
х = 0,1
ν2 (Al(NO3)3) = х = 0,1 моль
m2 (Al(NO3)3) = 0,1 ∙ 213 = 21,3 г
Учитывая, что массовая доля солей одинакова во всех колбах, рассчитаем массовую долю нитрата алюминия:
ωIII (Al(NO3)3) = ωII (Al(NO3)3) = 21,3 / 300 ∙ 100% = 7,1%
[adsp-pro-3]
Задание №6
Смесь сульфата железа (II) и хлорида цинка растворили в воде. Полученный раствор разлили по трем колбам. К 800 г раствора в первой колбе добавили избыток раствора нитрата бария. При этом образовалось 116,5 г осадка. К 320 г раствора во второй колбе добавили 462 г 40%-ого раствора гидроксида натрия без доступа воздуха. При этом массовая доля щелочи в растворе уменьшилась в 2 раза. Вычислите массовую долю каждой из солей в растворе в третьей колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
В первой колбе с нитратом бария взаимодействует только сульфат железа.:
FeSO4 + Ba(NO3)2 = Fe(NO3)2 + BaSO4↓ (1)
При этом выпадает ν1 (BaSO4) = 116,5 / 233 = 0,5 моль, тогда по уравнению реакции (1) ν1 (FeSO4) = ν1 (BaSO4) = 0,5 моль
m1 (FeSO4) = 152 ∙ 0,5 = 76 г
Так как массовая доля растворенных солей одинакова во всех трех колбах, найдем массовую долю сульфата железа в первой колбе:
ωIII (FeSO4) = ωI (FeSO4) = 76 / 800 ∙ 100% = 9,5%
Рассмотрим процессы, протекающие во второй колбе. С гидроксидом натрия реагируют обе исходные соли, при этом выпадают гидроксид железа, массу которого нам потребуется вычесть для нахождения массы полученного раствора после протекания реакций (2) и (3):
2NaOH + FeSO4 = Fe(OH)2↓ + Na2SO4 (2)
4NaOH + ZnCl2 = Na2[Zn(OH)4] + 2NaCl (3)
Исходя из того, что отношение количества растворенного вещества к общей массе раствора одинаково в каждой колбе, найдем количество вещества сульфата железа во второй колбе:
ν1 (FeSO4) / m (исх. р-ра в I колбе) = ν2 (FeSO4) / m (исх. р-ра во II колбе)
ν2 (FeSO4) = ν1 (FeSO4) ∙ m (исх. р-ра во II колбе) / m (исх. р-ра в I колбе)
ν2 (FeSO4) = 0,5 ∙ 320 / 800 = 0,2 моль, тогда согласно уравнению (2):
ν2 (NaOH) = 2 ∙ ν2 (FeSO4) = 2 ∙ 0,2= 0,4 моль
Количество вещества гидроксида натрия в исходном растворе:
νисх (NaOH) = 462 ∙ 0,4 / 40 = 4,62 моль
Массовая доля щелочи в полученном растворе составит:
ωост (NaOH) = ωисх/2 = 40% / 2 = 20%
Количество прореагировавшего в (3) реакции хлорида цинка примем за х моль, что позволит выразить массу оставшейся в растворе щелочи:
mост (NaOH) = 40 ∙ (4,62 – 4х – 0,4) = 168,8 – 160х г
m (получ. р-ра после реакций (2) и (3)) = m (исх. р-ра солей во II колбе) + m (исх. р-ра NaOH) – m (Fe(OH)2) = 320 + 462 – 90 ∙ 0,2 = 764 г
Приравняем отношение массы оставшегося гидроксида натрия к массе полученного раствора к найденной массовой доле:
(168,8 – 160х) / 764 = 0,2
168,8 – 160х = 0,2 ∙ 764
168,8 – 160х = 152,8
160х = 16
х = 0,1
ν3 (ZnCl2) = 0,1 моль
m3 (ZnCl2) = 0,1 ∙ 136 = 13,6 г
ωIII (ZnCl2) = ωII (ZnCl2) = 13,6 / 320 ∙ 100% = 4,25%
Задание №7
Смесь бромида калия и иодида калия растворили в воде. Полученный раствор разлили по трем колбам. К 250 г раствора в первой колбе добавили 430 г 40%-ого раствора нитрата серебра. После завершения реакции массовая доля нитрата серебра в образовавшемся растворе составила 8,44%. К 300 г раствора во второй колбе добавили избыток раствора нитрата меди (II), в результате чего в осадок выпало 28,65 г соли. Вычислите массовую долю каждой из солей в третьей колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
В первой колбе обе соли взаимодействуют с нитратом серебра, при этом выпадают в осадок галогениды серебра, массу которых нужно вычесть при нахождении массы полученного раствора после протекания реакций (1) и (2).
Во второй колбе только йодид калия способен окислиться нитратом меди (II), поэтому начнем решение задачи с рассмотрения второй колбы.
KBr + AgNO3 = AgBr↓ + KNO3 (1)
KI + AgNO3 = AgI↓ + KNO3 (2)
2Cu(NO3)2 + 4KI = 2CuI↓ + I2 + 4KNO3 (3)
Найдем количество выпавшего йодида меди (I):
ν3 (CuI) = 28,65 / 191 = 0,15 моль
Согласно уравнению реакции (3) количество йодида калия во второй колбе в 2 раза больше количества выпавшего йодида меди:
ν3 (KI) = 2 ∙ ν3 (CuI) = 2 ∙ 0,15 моль = 0,3 моль
m3 (KI) = 0,3 ∙ 166 = 49,8 г
Так как массовая доля растворенных солей одинакова во всех трех колбах, найдем массовую долю сульфата железа в первой колбе:
ωIII (KI) = ωII (KI) = 49,8 / 300 ∙ 100% = 16,6%
Исходя из того, что отношение количества растворенного вещества к общей массе раствора одинаково в каждой колбе, найдем количество вещества йодида калия в первой колбе:
ν2 (KI) / m (исх. р-ра в I колбе) = ν3 (KI) / m (исх. р-ра во II колбе)
ν2 (KI) = ν3 (KI) ∙ m (исх. р-ра во I колбе) / m (исх. р-ра во II колбе)
ν2 (KI) = 0,3 ∙ 250 / 300 = 0,25 моль, тогда согласно уравнению (2) количество вступившего в реакцию (2) нитрата серебра:
ν2 (AgNO3) = ν2 (KI) = 0,25 моль
Вычислим общее количество вещества добавленного в первую колбу нитрата серебра:
mисх (AgNO3) = 430 ∙ 0,4 = 172 г
Пусть количество вещества нитрата серебра, вступившего в реакцию (1) х моль, тогда масса оставшегося нитрата серебра составит:
mост (AgNO3) = 172 — 170 ∙ (0,25 + х) = 172 – 42,5 – 170х = 129,5 – 170х г, а масса полученного раствора в первой колбе:
m (получ.р-ра в I колбе по реакций (1) и (2)) = 250 + 430 – 235 ∙ 0,25 – 188х =
=621,25 – 188х г
Составим выражение для нахождения массовой доли нитрата серебра в полученном растворе и найдем х:
(129,5 – 170х) / (621,25 – 188х) = 0,0844
129,5 – 170х = (621,25 – 188х) ∙ 0,0844
129,5 – 170х = 52,43 – 15,87х
154,13х = 77,07
х = 0,5
ν1 (AgNO3) = ν1 (KBr) = 0,5 моль
m1 (KBr) = 0,5 ∙ 119 = 59,5 г
ωIII (KBr) = ωII (KBr) = 59,5/ 250 ∙ 100% = 23,8%
Задание №8
Смесь бромида кальция и хлорида меди (II) растворили в воде. Полученный раствор разлили по трем колбам. К 200 г раствора в первой колбе добавили 785 г 30%-ого раствора нитрата серебра. При этом массовая доля нитрата серебра в растворе уменьшилась вдвое. К 340 г раствора во второй колбе добавили избыток раствора иодида калия, в результате чего в осадок выпало 64,94 г соли. Вычислите массовую долю каждой из солей в третьей колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
В первой колбе с нитратом серебра взаимодействуют обе растворенные соли, при этом в осадок выпадают хлорид и бромид серебра:
2AgNO3 + CaBr2 = 2AgBr↓ + Ca(NO3)2 (1)
2AgNO3 + CuCl2 = 2AgCl↓ + Cu(NO3)2 (2)
Во второй колбе йодид калия окисляется хлоридом меди (II):
4KI + 2CuСl2 = 2CuI↓ + I2 + 4KCl (3)
В результате этой реакции в осадок выпадает ν3 (CuI) = 64,94 / 191 = 0,34 моль.
Согласно уравнению реакции (3) ν3 (CuCl2) = ν3 (CuI) = 0,34 моль.
Известно, что массовая доля растворенных солей одинакова во всех трех колбах, рассчитаем массовую долю хлорида меди (II) во второй колбе:
m3 (CuCl2) = 0,34 ∙ 135 = 45,9 г
ωIII (CuCl2) = ωII (CuCl2) = 45,9 / 340 ∙ 100% = 13,5%
Теперь учитывая, что отношение количества растворенного вещества к общей массе раствора одинаково в каждой колбе, найдем количество вещества хлорида меди в первой колбе:
ν2 (CuCl2) / m (исх. р-ра в I колбе) = ν3 (CuCl2) / m (исх. р-ра во II колбе)
ν2 (CuCl2) = ν3 (CuCl2) ∙ m (исх. р-ра во I колбе) / m (исх. р-ра во II колбе)
ν2 (CuCl2) = 0,34 ∙ 200 / 340 = 0,2 моль, тогда согласно уравнению (2) количество вступившего в реакцию (2) нитрата серебра и выпавшего хлорида серебра:
ν2 (AgNO3) = 2 ∙ ν2 (CuCl2) = 2 ∙ 0,2 моль = 0,4 моль = ν2 (AgCl)
Рассчитаем массу нитрата серебра в исходном растворе, добавленном в первую колбу:
mисх (AgNO3) = 785 ∙ 0,3 = 235,5 г
Пусть в реакцию (1) вступило х моль бромида кальция, тогда с ним прореагировало 2х моль нитрата серебра и в осадок выпало 2х моль бромида серебра. Тогда выразим массу полученного раствора после протекания реакций (1) и (2) и составим выражение для массовой доли оставшегося в растворе нитрата серебра:
m (получ.р-ра после р-ций (1) и(2)) = 200 + 785 – 0,4 ∙ 143,5 – 2х ∙ 188 = 927,6 – 376х г
ωост (AgNO3) = (235,5 – 170 ∙ (0,4 + 2х)) / (927,6 – 376х) = 0,3 / 2
235,5 – 170 ∙ (0,4 + 2х) = (927,6 – 376х) ∙ 0,15
167,5 – 340х = 139,14 – 56,4х
283,6х = 28,36
х = 0,1
ν1 (CaBr2) = 0,1 моль
m1 (CaBr2) = 0,1 ∙ 200 = 20 г
Учитывая, что массовая доля солей одинакова во всех колбах, рассчитаем массовую долю бромида кальция:
ωIII (CaBr2) = ωI (CaBr2) = 20 / 200 ∙ 100% = 10%
Задание №9
Через 520 г 16,1%-ого раствора сульфата цинка пропускали электрический ток до тех пор, пока объём газа, выделившегося на катоде, не оказался равным объёму газа, выделившегося на аноде. При этом получили раствор, в котором массовая доля сульфата цинка составила 10,3%. К полученному раствору добавили 212 г 10%-ого раствора карбоната натрия. Вычислите массовую долю сульфата цинка в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Рассмотрим процессы, протекающие при электролизе сульфата цинка. По условию задачи сказано, что на катоде выделяется газ. Он получается не иначе как в результате электролиза воды. Запишем уравнения реакций:
2ZnSO4 + 2H2O = 2Zn + O2↑ + 2H2SO4 (1)
2H2O = 2H2↑ + O2↑ (2)
Пусть в реакции (2) выделилось х моль кислорода, тогда водорода выделилось 2х моль. Так как сказано, что объемы газов на катоде и аноде равны, значит при н.у. равны их количества веществ:
V(H2) = V1(O2) + V2(O2)
ν (H2) = ν1 (O2) + ν2 (O2)
2х = ν1 (O2) + х
ν1 (O2) = х моль, тогда количество сульфата цинка, вступившего в реакцию электролиза составит 2х моль.
Общая масса сульфата цинка в исходном растворе составляла:
mобщ (ZnSO4) = 520 ∙ 0,161 = 83,72 г
После проведения электролиза масса раствора уменьшается за счет разложившейся воды, кислорода и цинка в реакции (1):
m (раствора после электролиза) = m (исх. р-ра ZnSO4) – mразл (H2O) – m (O2) =
= 520 – 18 ∙ 2х – 32х – 65 ∙ 2х = 520 – 198х г
Составим выражение для массовой доли оставшегося в растворе после электролиза сульфата цинка и найдем х:
(83,72 – 161 ∙ 2х) / (520 – 198х) = 0,103
83,72 – 322х = (520 – 198х) ∙ 0,103
83,72 – 322х = 53,56 – 20,4х
301,6х = 30,16
х = 0,1
Масса полученного раствора m (раствора после электролиза) = 520 – 198х = 500,2 г
Сравним количества серной кислоты и карбоната натрия:
ν (H2SO4) = 2 ∙ 0,1 = 0,2 моль
ν (Na2CO3) = 212 ∙ 0,1 / 106 = 0,2 моль
Так как их соотношение 1:1, сделаем вывод, что протекает только реакция карбоната натрия с серной кислотой:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ (3)
Для определения массовой доли сульфата цинка в конечном растворе найдем массу оставшегося сульфата цинка и массу полученного после (3) реакции раствора:
mост (ZnSO4) = 83,72 – 161 ∙ 0,2 = 51,52 г
m (получ. р-ра после (3) р-ции) = m (раствора после электролиза) + m (р-ра Na2CO3) – m (CO2) = 500,2 + 212 — 44 ∙ 0,2 = 703,4 г
ωост (ZnSO4) = 51,52 / 703,4 ∙ 100% = 7,32%
Задание №10
Через 400 г 36%-ого раствора нитрата железа (II) пропускали электрический ток до тех пор, пока объём газа, выделившийся на катоде, не оказался в 2 раза меньше объёма газа, выделившегося на аноде. При этом получили раствор, в котором массовая доля нитрата железа (II) составила 10,19%. К полученному раствору добавили 120 г 40%-ого раствора карбоната аммония. Вычислите массовую долю нитрата железа (II) в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
При электролизе водного раствора нитрата железа на катоде выделяется водород из воды
2Fe(NO3)2 + 2H2O = 2Fe + O2↑+ 4HNO3 (1)
2H2O = 2H2↑ + O2↑ (2)
По условию дано соотношение объемов газов, выделившихся на катоде и аноде:
V(H2) = V(O2) / 2, для газов при н.у. ν (H2) = (ν1 (O2) + ν2 (O2)) / 2
2 ∙ ν (H2) = ν1 (O2) + ν2 (O2)
Пусть количество вещества кислорода, выделившегося во второй реакции х моль, тогда количество водорода — 2х моль:
2 ∙ 2х = ν1 (O2) + х
ν1 (O2) = 3х моль
Масса нитрата железа (II) в исходном растворе составляла:
mобщ (Fe(NO3)2) = 400 ∙ 0,36 = 144 г
Масса, вступившего в реакцию электролиза нитрата железа:
mпрореаг. (Fe(NO3)2) 3х ∙ 2 ∙ 180 = 1080х г
Масса раствора после электролиза будет уменьшаться за счет разложившейся воды и кислорода и железа, выделяющихся в первой реакции:
m (получ.р-ра после электролиза) = 400 – 18 ∙ 2х – 32 ∙ 3х – 56 ∙ 2 ∙ 3х = 400 – 468х г
Составим выражение для массовой доли оставшегося нитрата железа в полученном после электролиза растворе:
(144 — 1080х) / (400 – 468х) = 0,1019
144 — 1080х = (400 – 468х) ∙ 0,1019
144 — 1080х = 40,76 – 47,67х
1032,33х = 103,24
х = 0,1
Количество вещества выделившейся азотной кислоты в реакции (1) составит
ν1 (HNO3) = 3х ∙ 4 = 1,2 моль
Запишем уравнение реакции азотной кислоты и карбоната аммония:
2HNO3 + (NH4)2CO3 = 2NH4NO3 + H2O + CO2↑ (3)
Найдем количество вещества карбоната аммония:
ν ((NH4)2CO3) = 120 ∙ 0,4 / 96 = 0,5 моль
Азотная кислота по сравнению с карбонатом аммония — в избытке.
При расчете массы конечного раствора учтем массу выделившегося углекислого газа:
m (СO2) = 0,5 ∙ 44 = 22 г
m (конечного р-ра) = 400 – 468 ∙ 0,1 + 120 – 22 = 451,2 г
mост (Fe(NO3)2) = 144 – 1080 ∙ 0,1 = 36 г
ωост (Fe(NO3)2) = 36 / 451,2 ∙ 100% = 7,98%
[adsp-pro-3]
Задание №11
Через 522 г 5%-ого раствора нитрата бария пропускали электрический ток до тех пор, пока на аноде не выделилось 8,4 л (н.у.) газа. К образовавшемуся раствору добавили насыщенный раствор, приготовленный при комнатной температуре растворением 96,6 г глауберовой соли (Na2SO4 ∙ 10H2O) в необходимом количестве воды. При этом массовая доля сульфата натрия в растворе уменьшилась в 4,5 раза. Вычислите растворимость безводного сульфата натрия при комнатной температуре (в г на 100 г воды).
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Электролиз водного раствора нитрата бария сводится к электролизу воды:
2H2O = 2H2↑+ O2↑ (1)
Газ, выделившийся на аноде – кислород. Найдем его количество вещества, и по уравнению реакции (1) определим количество и массу разложившейся в ходе электролиза воды:
ν (O2) = 8,4 / 22,4 = 0,375 моль
νразл (H2O) = 2 ∙ ν (O2) = 0,375 ∙ 2 = 0,75 моль
mразл (H2O) = 0,75 ∙ 18 = 13,5 г
Оставшийся в растворе нитрат бария реагирует с сульфатом натрия глауберовой соли:
Na2SO4 + Ba(NO3)2 = BaSO4↓+ 2NaNO3 (2)
Количество вещества нитрата бария в исходном растворе:
ν (Ba(NO3)2) = 522 ∙ 0,05 / 261 = 0,1 моль
Количество вещества сульфата натрия равно количеству вещества глауберовой соли:
νисх (Na2SO4) = ν (Na2SO4 ∙ 10H2O) = 96,6 / 322 = 0,3 моль
mисх (Na2SO4) = 0,3 ∙ 142 = 42,6 г
Согласно уравнению реакции (2) количество вступившего в реакцию сульфата натрия равно количеству нитрата бария и выпавшего сульфата бария:
νпрореаг (Na2SO4) = ν (Ba(NO3)2) = ν (BaSO4) = 0,1 моль
Примем за х г массу воды, добавленной к глауберовой соли для получения насыщенного раствора сульфата натрия. С этим учетом масса исходного насыщенного раствора:
mисх.(насыщ. р-ра Na2SO4) = 96,6 + х г,
а масса конечного раствора после реакции (2) составляла:
m (конечного р-ра) = 522 – 13,5 + 96,6 + х – 0,1 ∙ 233 = 581,8 + х г
Масса оставшегося сульфата натрия:
mост (Na2SO4) = 142 ∙ (0,3 – 0,1) = 28,4 г
По условию задачи массовая доля сульфата натрия уменьшается в 4,5 раза:
ω1 (Na2SO4) / ω2 (Na2SO4) = 4,5
ω1 (Na2SO4) = 42,6 / (96,6 + х)
ω2 (Na2SO4) = 28,4 / 581,8 + х
Подставим соответствующие выражения и найдем х:
42,6 / (96,6 + х) = 4,5 ∙ 28,4 / 581,8 + х
42,6 ∙ (581,8 + х) = 4,5 ∙ 28,4 ∙ (96,6 + х)
12345,48 + 127,8х = 24784,68 +42,6х
85,2х = 12439,2
х = 146
mдоб (H2O) = 146 г
Теперь найдем массовую долю сульфата натрия в насыщенном растворе при комнатной температуре:
ω1 (Na2SO4) = 42,6 / (96,6 + 146) = 0,1756
Так как массовая доля вещества в насыщенном растворе при определенной температуре не зависит от массы раствора, можем рассчитать растворимость сульфата натрия, что есть масса растворенного вещества в 100 г растворителя, в нашем случае воды.
Обозначим эту массу через y г, составим выражение для массовой доли и приравняем к уже известному значению:
y / (y+100) = 0,1756
(y+100) ∙ 0,1756 = у
0,8244у = 17,56
у = 21,3
Растворимость сульфата натрия составляет 21,3 г в 100 г воды.
Задание №12
Через 522 г 10%-ого раствора нитрата бария пропускали электрический ток до тех пор, пока на катоде не выделилось 94,08 л (н.у.) газа. К образовавшемуся раствору добавили насыщенный раствор, приготовленный при комнатной температуре растворением 100 г медного купороса (CuSO4 ∙ 5H2O) в необходимом количестве воды. При этом массовая доля сульфата меди (II) в растворе уменьшилась в 4 раза. Вычислите растворимость безводного сульфата меди (II) при комнатной температуре (в г на 100 г воды).
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Электролиз водного раствора нитрата бария сводится к электролизу воды:
2H2O = 2H2↑+ O2↑ (1)
Газ, выделившийся на катоде – водород. Найдем его количество вещества, и по уравнению реакции (1) определим количество и массу разложившейся в ходе электролиза воды:
ν (H2) = 94,08 / 22,4 = 4,2 моль
νразл (H2O) = ν (H2) = 4,2 моль
mразл (H2O) = 4,2 ∙ 18 = 75,6 г
Оставшийся в растворе нитрат бария реагирует с сульфатом меди (II):
CuSO4 + Ba(NO3)2 = BaSO4↓+ Cu(NO3)2 (2)
Количество вещества нитрата бария в исходном растворе:
ν (Ba(NO3)2) = 522 ∙ 0,1 / 261 = 0,2 моль
Количество вещества сульфата натрия равно количеству вещества глауберовой соли:
νисх (CuSO4) = ν (CuSO4 ∙ 5H2O) = 100 / 250 = 0,4 моль
mисх (CuSO4) = 0,4 ∙ 160 = 64 г
Согласно уравнению реакции (2) количество вступившего в реакцию сульфата меди (II) равно количеству нитрата бария и выпавшего сульфата бария:
νпрореаг (CuSO4) = ν (Ba(NO3)2) = ν (BaSO4) = 0,2 моль
Примем за х г массу воды, добавленной к медному купоросу для получения насыщенного раствора сульфата меди (II). С этим учетом масса исходного насыщенного раствора:
mисх.(насыщ. р-ра CuSO4) = 100 + х г,
а масса конечного раствора после реакции (2) составляла:
m (конечного р-ра) = 522 – 75,6 + 100 + х – 0,2 ∙ 233 = 499,8 + х г
Масса оставшегося сульфата натрия:
mост (Na2SO4) = 160 ∙ (0,4 – 0,2) = 28,4 г
По условию задачи массовая доля сульфата меди уменьшается в 4 раза:
ω1 (CuSO4) / ω2 (CuSO4) = 4
ω1 (CuSO4) = 64 / (100 + х)
ω2 (CuSO4) = 32 / 499,8 + х
Подставим соответствующие выражения и найдем х:
64 / (100 + х) = 4 ∙ 32 / 499,8 + х
64 ∙ (499,8 + х) = 4 ∙ 32∙ (100 + х)
31987,2 + 64х = 12800 + 128х
64х = 19187,2
х = 299,8
mдоб (H2O) = 299,8 г
Теперь найдем массовую долю сульфата натрия в насыщенном растворе при комнатной температуре:
ω1 (CuSO4) = 64 / (100 + 299,8)
Так как массовая доля вещества в насыщенном растворе при определенной температуре не зависит от массы раствора, можем рассчитать растворимость сульфата натрия, что есть масса растворенного вещества в 100 г растворителя, в нашем случае воды.
Обозначим эту массу через y г, составим выражение для массовой доли и приравняем к
ω1 (CuSO4):
y / (y+100) = 64 / (100 + 299,8)
(y+100) ∙ 64 = у ∙ 399,8
335,8у = 6400
у = 19,06
Растворимость сульфата меди (II) составляет 19,06 г в 100 г воды.
Задание №13
Кристаллогидрат сульфата алюминия, в котором массовая доля атомов серы меньше массовой доли атомов кислорода в 5 раз, растворили в воде. При этом образовался раствор массой 722,4 г. Через образовавшийся раствор пропускали электрический ток до тех пор, пока на аноде не выделилось 35,84 л (н.у.) газа. К образовавшемуся в процессе электролиза раствору добавили 424 г 10%-ого раствора карбоната натрия. При этом массовая доля карбоната натрия в растворе уменьшилась в 10 раз. Вычислите массу растворенного кристаллогидрата сульфата алюминия.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Определим формулу кристаллогидрата Al2(SO4)3 ∙ xH2O. Нам известно соотношение массовых долей серы и кислорода, оно равно соотношению массы атомов серы к массе атомов кислорода.
В 1 моль кристаллогидрата содержится 3 моль атомов серы и (12 + х) моль атомов кислорода, тогда:
m (S) = 32 ∙ 3 = 96 г
m (О) = (12 + х) ∙ 16 = 192 + 16х г
ω (S) / ω (О) = m (S) / m (О) = 96 / (192 + 16х) = 1 / 5
96 ∙ 5 = 192 + 16х
16х = 480 – 192
х = 18
Состав кристаллогидрата: Al2(SO4)3 ∙ 18H2O
Электролиз водного раствора этого кристаллогидрата сводится к электролизу воды:
2H2O = 2H2↑+ O2↑ (1)
Газ, выделившийся на аноде – кислород.
ν (O2) = 35,84 / 22,4 = 1,6 моль
νразл (H2O) = 2 ∙ ν (O2) = 1,6 ∙ 2 = 3,2 моль
mразл (H2O) = 0,75 ∙ 18 = 57,6 г
Далее добавленный карбонат натрия вступает в реакцию с сульфатом алюминия:
Al2(SO4)3 + 3Na2CO3 +3H2O = 2Al(OH)3 + 3CO2 + 3Na2SO4 (2)
mисх (Na2CO3) = 424 ∙ 0,1 = 42,4 г
Массовая доля уменьшилась в 10 раз и в конечном растворе составила 1%.
Примем за х моль количество вступившего в реакцию сульфата алюминия. Тогда согласно уравнению реакции (2) количество карбоната натрия, прореагировавшего с ним:
νпрореаг (Na2CO3) = 3х моль
Для расчета массы конечного раствора необходимо вычислить массы покинувших сферу реакции гидроксида алюминия и углекислого газа:
ν (Al(OH)3) = 2х моль
m (Al(OH)3) = 2х ∙ 78 = 156х г
ν (CO2) = 3х моль
m (CO2) = 3х ∙ 44 = 132х г
Тогда масса конечного раствора равна:
m (конечного раствора) = 722,4 – 57,6 + 424 – 156х – 132х г
Составим выражение для массовой доли оставшегося карбоната натрия в конечном растворе:
ω2 (Na2CO3) = (42,4 — 3х ∙ 106) / (1088,8 -288х)
(42,4 — 3х ∙ 106) / (1088,8 — 288х) = 0,01
42,4 – 318х = 0,01 ∙ (1088,8 — 288х)
42,4 – 318х = 10,888 – 2,88х
315,12х = 31,512
х = 0,1
ν (Al2(SO4)3) = 0,1 моль
ν (Al2(SO4)3 ∙ 18H2O) = ν (Al2(SO4)3) = 0,1 моль
m (Al2(SO4)3 ∙ 18H2O) = 0,1 ∙ 666 = 66,6 г
Задание №14
Смесь, состоящую из нитрата цинка, нитрата меди (II) и нитрата серебра, растворили в воде. При этом получили раствор, в котором массовая доля нитрата цинка составила 18,9%, а массовая доля нитрата меди (II) – 9,4%. В первую колбу налили 500 г этого раствора и внесли медную проволоку. После окончания реакции массовая доля нитрата меди (II) в колбе составила 25,5%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь.) Во вторую колбу налили 200 г исходного раствора и добавили избыток порошка цинка. Вычислите массовую долю соли в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Рассмотрим процессы, происходящие в первой колбе:
2AgNO3 + Cu = Cu(NO3)2 +2Ag (1)
Исходная масса нитрата меди (II) в первой колбе составляла:
mисх (Cu(NO3)2) в I колбе = 500 ∙ 0,094 = 47 г
νисх (Cu(NO3)2) в I колбе = 47 / 188 = 0,25 моль
Учитывая, что доля вещества в растворе не зависит от массы раствора, найдем исходное количество вещества нитрата меди (II) во второй колбе:
0,25 / 500 = νисх (Cu(NO3)2) во II колбе / 200
νисх (Cu(NO3)2) во II колбе = 0,1 моль
Пусть в реакцию (1) вступило х моль меди, тогда образовалось х моль нитрата меди (II) и 2х моль серебра.
Масса нитрата меди (II) в образовавшемся растворе после протекания реакции (1) складывается из масс исходной и образовавшейся соли:
mполуч (Cu(NO3)2) в I колбе = mисх (Cu(NO3)2) в I колбе + mобр (Cu(NO3)2) в I колбе = 47 + 188х г
Для расчета массы полученного раствора в первой колбе потребуется учесть вступившую в реакцию медь и выделившееся серебро:
mполуч (р-ра) в I колбе = 500 + 64х — 108 ∙ 2х = 500 – 152х г
Зная, что массовая доля нитрата меди (II) в полученном растворе составляла 25,5%, найдем х:
(47 + 188х) / = 0,255
47 + 188х = 0,255 ∙ (500 – 152х)
226,76х = 80,5
х = 0,355
ν (AgNO3) в I колбе = 20,355 = 0,71 моль, тогда рассчитаем количество нитрата серебра во второй колбе:
0,71 / 500 = ν (AgNO3) во II колбе /200
ν (AgNO3) во II колбе = 0,71 ∙ 200 / 500 = 0,284 моль
Во второй колбе с цинковым порошком взаимодействовали нитрат меди (II) и нитрат серебра:
Cu(NO3)2 + Zn = Cu + Zn(NO3)2 (2)
2AgNO3 + Zn = 2Ag + Zn(NO3)2 (3)
Масса нитрата цинка во второй колбе таким образом после протекания реакций составит:
mполуч (Zn(NO3)2) во II колбе = mисх (Zn(NO3)2) во II колбе + mобр в реакции (2) (Zn(NO3)2) во II колбе +
mобр в реакции (3) (Zn(NO3)2) во II колбе = 0,189 ∙ 200 + 189 ∙ (0,1 + 0,142) = 83,54 г
При расчете массы конечного раствора во второй колбе прибавим массу прореагировавшего цинка и вычтем массы серебра и меди:
mполуч (раствора) во II колбе = 200 + (0,1 +0,142) ∙ 65 – 0,1 ∙ 64 – 0,284 ∙ 108 = 178,66 г
ω (Zn(NO3)2) во II колбе = 83,54 / 178,66 ∙ 100% = 46,76%
Задание №15
Раствор нитрата меди(II) массой 2 кг 730 г с массовой долей нитрата меди(II) 18,8%, содержащий в качестве примеси нитрат серебра, разлили на две колбы в соотношении 1 : 2. В первую колбу, содержащую меньшую часть раствора, внесли медную проволоку. После окончания реакции массовая доля нитрата меди (II) в колбе составила 20%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь.) В раствор во второй колбе внесли порошок цинка, в результате получили бесцветный раствор. Вычислите массовую долю соли в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Пусть масса раствора нитрата меди (II) в первой колбе равна х г, тогда масса раствора нитрата меди (II), приходящаяся на вторую колбу – 2х г
х + 2х = 2730
х = 910
mI (р-ра Cu(NO3)2) = 910 г, mII (р-ра Cu(NO3)2) = 910 ∙ 2 =1820 г
Запишем уравнение реакции между нитратом серебра и медной проволокой, происходящей в первой колбе:
2AgNO3 + Cu = Cu(NO3)2 +2Ag (1)
Исходя из постоянства массовой доли растворенного вещества в любой отобранной порции раствора, найдем исходную массу нитрата меди (II) в первой колбе:
mисх (Cu(NO3)2) в I колбе = 0,188 ∙ 910 = 171,08 г
Примем количество вступившей в реакцию (1) меди за у моль, тогда и нитрата меди (II) образовалось у моль, серебра — 2у моль.
Рассчитывая массу получившегося раствора после протекания реакции, учтем массу вступившей в реакцию меди и выделившегося серебра:
mполуч (р-ра) в I колбе = 910 + 64у – 2у ∙ 108 = 910 – 152у
Масса нитрата меди (II) в полученном после реакции растворе в первой колбе складывается из исходной массы и массы образовавшегося нитрата меди (II):
mполуч (Cu(NO3)2) в I колбе = 171,08 + 188у г
Составим выражение для уже численно известной массовой доли нитрата меди (II) в конечном растворе в первой колбе и найдем у:
(171,08 + 188у) / (910 – 152у) = 0,2
171,08 + 188у = 0,2 ∙ (910 – 152у)
218,4у = 10,92
у = 0,05
Согласно уравнению реакции (1) нитрат серебра вступил в количестве:
ν (AgNO3) в I колбе = 2у = 0,1 моль
Тогда рассчитаем исходное количество нитрита серебра во второй колбе:
0,1 / 910 = ν (AgNO3) во II колбе / 1820
ν (AgNO3) во II колбе = 0,2 моль
νисх (Cu(NO3)2) во II колбе = (0,188 ∙ 1820) / 188 = 1,82 моль
Cu(NO3)2 + Zn = Cu + Zn(NO3)2 (2)
2AgNO3 + Zn = 2Ag + Zn(NO3)2 (3)
Масса нитрата цинка в конечном растворе во второй колбе:
mполуч (Zn(NO3)2) во II колбе = (1,82 + 0,1) ∙ 189 = 362,88 г
mполуч (р-ра) во II колбе = 1820 + 65 ∙ (0,1 + 1,82) – 1,82 ∙ 64 – 0,2 ∙ 108 = 1806, 72 г
ω (Zn(NO3)2) во II колбе = 362,88 / 1806, 72 ∙ 100% = 20%
[adsp-pro-3]
Елена Шаврак. ЕГЭ по химии: новые упражнения и цепочки превращений. вопрос — хим. связь.. вопрос.
Елена Шаврак
ЕГЭ по химии: новые упражнения и цепочки превращений
Здравствуйте, уважаемые читатели!
Сегодня я хочу рассмотреть некоторые задания из нового СтатГрадовского пробника от 3 марта 2021 года. Причина — подобные упражнения ранее мне не встречались ни в одном из пробников и пособий за последние 8 лет. Про себя я данный факт обозначила как : «СтатГрад расширяет границы», причем это расширение носит как экстенсивный, так и интенсивный характер.
Итак, по порядку. Начинаю с заданий 1 варианта.
1. 4 вопрос — хим. связь.
Для выполнения этого задания запишем структурные формулы всех веществ (не учитываю валентные углы):
Только одинарные ковалентные связи есть в молекуле пероксида водорода (1) и гидроксиламина (3).
Новизна этого задания, скорее, экстенсивного характера. Т.е., несмотря на то, что ранее подобная формулировка 4 задания не встречалась в пробниках (мое субъективное мнение), для его выполнения вполне достаточно школьной базы.
2. 7 вопрос.
Для выполнения этого задания необходимо знать, что соединения меди могут выпадать в осадок при добавлении растворов трех реагентов из предложенного списка, а именно: аммиака, сероводорода и карбоната калия. Но в избытке аммиака осадок растворится вследствие образования аммиакатного комплекса меди. Одновременное образование осадка и газа — это маркерный признак совместного (или смешанного) гидролиза, протекающего при смешении растворов соли меди и карбоната. Т.о., ответы — Х- H2S, Y- K2CO3.
Новизна этого задания также условная. Аммиакатные комплексы меди (и цинка) в 7 задании встречались и ранее, но ОЧЕНЬ редко.
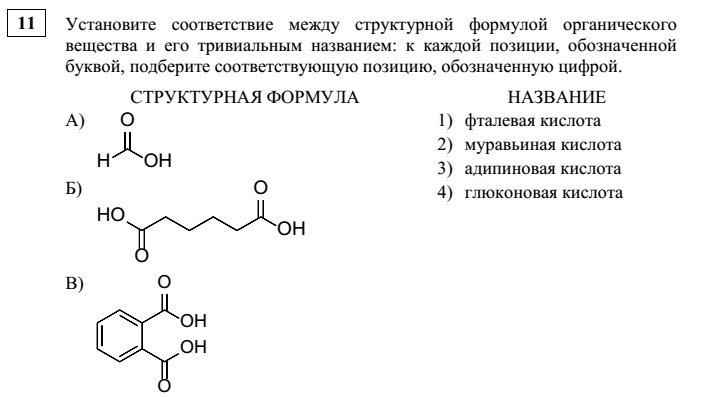
3. 11 вопрос
Практически во всех последних СтатГрадовских пробниках в 11 задании используются «скелетные» формулы органических веществ. Выскажу свою точку зрения: это хорошо, поскольку, опять же, — расширяет границы восприятия материала. Надеюсь, что, со временем, в формулировках будут использоваться классические скелетные формулы, в которых клинообразными линиями обозначаются связи, направленные вверх относительно плоскости, т.е. к наблюдателю, пунктирными линиями обозначаются связи, направленные вниз относительно плоскости, т.е. от наблюдателя.
Ответы — 231
Новизна этого задания невелика. Пожалуй, при подготовке стоит обратить внимание на отработку тривиальных названий органических соединений.
4. 17 вопрос
В 17 задании, посвященном кислородсодержащей органике, приведена практически не упоминавшаяся в пробниках и сборниках тестов реакция термического превращения формиата натрия до оксалата натрия:
Мой личный вывод: спасибо СтатГраду за актуализацию ранее невостребованной информации, относящейся, в принципе, к школьной программе (способы получения дикарбоновых кислот).
5. 27 задача.
Задача 27, в который уже раз в этом году, обращает внимание к кристаллогидратам. Решать ее можно разными способами — через моли, через пропорцию, правилом креста …
Ниже я привела один из вариантов решения., суть которого заключается в нахождении массы всей растворенной соли и последующем «заключении» ее в кристаллогидрат:
Ответ — 43 г.
6. 29 задача.
Задача 29 обращает на себя внимание формулировкой (полное отсутствие числовых данных) и «незамыленной» химией — разложением нитрата активного металла. Опять же и эту задачу можно решать несколькими способами. Ниже привожу один из них:
7. 30 задание.
«Грозное» 30 задание, в котором, при ближайшем рассмотрении, можно выделить только 1 окислитель (нитрат аммония), 1 восстановитель — медь. Для перевода нитрата в азотную кислоту, с которой будет реагировать медь, добавим соляную кислоту. Берем ее концентрированной, чтобы в результате реакции обмена получить концентрированную азотную кислоту (кстати, можно проводить реакцию с выделением оксида азота (2), для этого нужно взять разбавленную соляную кислоту). В результате получаем:
Данная реакция напоминает мне качественную реакцию на нитраты, в которой к нитрату добавляют медь и концентрированную серную кислоту и наблюдают образование бурого газа.
8. 32 задание.
Хорошее задание, ничего не скажешь! Реакция 2 — разрушение комплекса, достаточно типовая. Реакция 3 — окисление сульфида серебра (а еще и ртути) идет с образованием только одного оксида. Реакция достаточно редкая, но встречалась. А вот 4 реакция — меня лично ввела в ступор. Возможно ошибаюсь, но неоднократно от представителей ФИПИ на вебинарах звучало, что на ЕГЭ будут только гидроксокомплексы цинка и алюминия. Понемногу «пробрались» аммиакаты. Но цианидных комплексов до сих пор еще не было. Искренний респект составителям!
9. 33 цепочка.
Вот это задание заслуживает самого пристального внимания. С одной стороны — бруттоформулы в задании- это очень хорошо, поскольку способствует более глубокому проникновению в суть задания. С другой стороны- последняя реакция, представляющая собой введение ацетальной защиты (по мнению авторов пробника). Я бы написала здесь и альдольную конденсацию дифенилкетона с ацетальдегидом. Но этого не дают в школьной программе (или я ошибаюсь?).
Необходимо отметить, что еще одну цепочку с ацетальной защитой я нашла в сборнике
10. 34 задача.
Данную задачу в этой статье отрешивать не буду. Сделаю это позже. Но бросается в глаза новое усложнение — нахождение состава газовой смеси по плотности. Практически не встречалось такого в задачах , предназначенных для подготовки к ЕГЭ.
11. 35 задача.
Одно из заданий, которое мне очень понравилось в этом пробнике.
Решение
1. Схема реакции сгорания неизвестного соединения:
CxHySzOk+O2=CO2+H2O+SO2
2. Найдем молекулярную формулу неизвестного соединения:
а) n(C)=n(CO2)= 20,16/22,4=0,9 моль,
n(Н)=2n(Н2О)= 2*8,1 /18=0,9 моль,
n(S)=n(SO2)= 3,36/22,4=0,15 моль,
n(O)=(23,7-(12*0,9+0,9+32*0,15))/16=0,45 моль
б) Молекулярная формула неизвестного вещества-: С6Н6SO3. Это — бензолсульфокислота
3. Структурная формула —
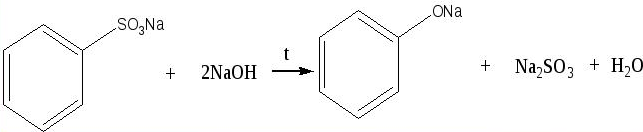
4. Уравнение реакции, происходящей при сплавлении бензолсульфоната натрия со щелочью:
Рассмотрела только первый вариант пробника, но и в нем много информации к размышлению. Резюмирую:
1. Реальный ЕГЭ по сложности раньше не всегда корреллировал со статградовскими пробниками, поэтому не факт, что задания уровня сложности рассмотренных 32-34 стоит ожидать на реальном экзамене.
2. Задания данного пробника актуализируют изучаемую, но относительно редко используемую информацию об органических и неорганических веществах (особенно — задания 4, 7, 11, 17, 27, 29, 35).
3. Для выполнения заданий 32 и 33 необходимо обладать информацией, адекватное усвоение которой возможно только в ходе изучения вузовских курса неорганической и органической химий (подчеркиваю, что это — мое субъективное мнение).
4. Великолепна задача 35. Впервые в пробниках ЕГЭ: серосодержащая органика и практически не используемый ранее при составлении заданий способ получения фенола.
5. В целом — еще раз — респект составителям, но — детей жалко. Без хорошего репетитора до уровня такого пробника не подняться.
Всего доброго!
Вариант ХИ2210401 с ответами
Скачать ответы и
решения для варианта
Для выполнения заданий 1–3 используйте следующий ряд
химических элементов:
●
1) Mg,
●
2) C,
●
3) B,
●
4) Si, ● 5) Li.
Ответом в заданиях 1–3 является последовательность
цифр, под которыми указаны химические элементы в данном ряду.
1.
Какие из указанных элементов имеют в первом возбуждённомсостоянии
конфигурацию внешнего уровня ns1 np3 ? Запишите номера выбранных элементов.
2.
Из указанного ряда выберите три элемента, принадлежащие
одномупериоду Периодической системы, и расположите их в порядке увеличения
первой энергии ионизации атома. Запишите в поле ответа номера выбранных
элементов в нужной последовательности.
3.
Из указанного ряда выберите два элемента, у которых разностьмежду
высшей и низшей степенями окисления равна 8. Запишите в поле ответа номера
выбранных элементов.
4.
Из предложенного перечня выберите две частицы, в которых одиниз
элементов образует четыре ковалентные связи. Запишите номера выбранных ответов.
●
1) NH3
●
2) H2O2
●
3) BF4 –
●
4) P4O6
●
5) SO2
5.
Среди предложенных формул/названий веществ, расположенных
впронумерованных ячейках, выберите формулы/названия: А) сильного основания; Б)
основной соли; В) одноосновной кислоты. Запишите в таблицу номера ячеек, в
которых расположены вещества, под соответствующими буквами.
6.
В двух пробирках находился раствор карбоната аммония. В
первуюпробирку добавили раствор вещества Х, а во вторую – раствор вещества Y. В
первой пробирке видимых признаков реакции не наблюдалось даже при нагревании, а
во второй выпал желтоватый осадок. Из предложенного перечня выберите вещества X
и Y, которые могут вступать в описанные реакции.
●
1) NaOH
●
2) CaCl2
●
3) AgNO3
●
4) K2SO4
●
5) CuSO4
7.
Установите соответствие между формулой вещества и реагентами,
скаждым из которых это вещество может взаимодействовать: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
8.
Установите соответствие между исходными веществами,вступающими в
реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к
каждой позиции, обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
10.
Установите соответствие между названием гомологического ряда иего
общей формулой: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
11.
Из предложенного перечня выберите два межклассовых
изомера.Запишите номера выбранных ответов.
●
1) пентанон-3 ● 2)
пентанол-1
●
3) 3-метилбутанон
●
4) пентановая кислота
●
5) этилизопропиловый эфир
12.
Из предложенного перечня выберите все вещества, которые приопределённых
условиях могут быть восстановлены до первичного спирта. Запишите номера
выбранных ответов.
●
1) ацетон
●
2) масляная кислота
●
3) фенол
●
4) этилацетат
●
5) 2-метилпропаналь
13.
Из предложенного перечня выберите два вещества, которыепроявляют
более сильные основные свойства, чем аммиак. Запишите номера выбранных ответов.
●
1) нитробензол
●
2) 1,2-диаминоэтан
●
3) анилин
●
4) пиридин
●
5) диметиламин
14.
Установите соответствие между схемой реакции и веществом
Х,принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
15.
Установите соответствие между реагирующими веществами
иуглеродсодержащим продуктом, который образуется при взаимодействии этих
веществ: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
17. Из
предложенного перечня выберите все реакции присоединения.Запишите номера
выбранных ответов.
●
1) взаимодействие хлорэтана со спиртовым раствором щёлочи
●
2) взаимодействие циклопропана с бромом
●
3) взаимодействие пентана с бромом на свету
●
4) взаимодействие бутадиена с хлороводородом
●
5) димеризация ацетилена в присутствии катализатора
18. Из
предложенного перечня выберите все реакции, скоростькоторых зависит от
давления. Запишите номера выбранных ответов.
●
1) взаимодействие хлора с раствором щёлочи
●
2) растворение железа в соляной кислоте
●
3) восстановление оксида меди(II) водородом
●
4) нитрование бензола
●
5) горение алюминия в кислороде
19. Установите
соответствие между схемойокислительно-восстановительной реакции и степенью
окисления элемента-восстановителя: к каждой позиции, обозначенной буквой,
подберите соответствующую позицию, обозначенную цифрой.
20. Установите
соответствие между формулой вещества и продуктамиэлектролиза водного раствора
или расплава этого вещества, выделившимися на инертных электродах: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
21. Для
веществ, приведённых в перечне, определите характер средыих водных растворов,
имеющих одинаковую молярную концентрацию. Запишите номера веществ в порядке
возрастания значения pH их водных растворов.
●
1) K2SO4
●
2) K2SO3
●
3) KHSO4
●
4) K2S
22. Установите
соответствие между способом воздействия наравновесную систему CO3 2– (р-р) +
H2O(ж.) HCO3 – (р-р) + OH– (р-р) – Q и направлением смещения равновесия при
этом воздействии: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
23. В реакторе
постоянного объёма смешали азот и водород. Врезультате обратимой реакции: N2(г)
+ 3H2(г) ←→ 2NH3(г) в реакторе установилось равновесие. Исходная концентрация
азота была равна
1,0 моль/л, а равновесные концентрации водорода и
аммиака составили 2,0 моль/л и 0,8 моль/л, соответственно. Найдите равновесную
концентрацию азота (X) и исходную концентрацию водорода (Y). Выберите из списка
номера правильных ответов.
●
1) 0,4 моль/л
●
2) 0,6 моль/л
●
3) 0,8 моль/л
●
4) 1,2 моль/л
●
5) 2,4 моль/л
●
6) 3,2 моль/л
24. Установите
соответствие между названием вещества и признакомреакции, который наблюдается
при взаимодействии вещества с водным раствором аммиака: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
25. Установите
соответствие между смесью веществ и методом еёразделения: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
26. При
охлаждении 200 г раствора гидрокарбоната аммония выпалосадок – безводная соль.
Раствор над осадком имел массу 150 г и содержал 18 % соли по массе. Найдите
массовую долю (в %) соли в исходном растворе. (Запишите число с точностью до
десятых.)
27. Горение
угарного газа описывается термохимическим уравнением: CO(г) + 1/2O2(г) = CO2(г)
+ 284 кДж Сколько литров кислорода (н. у.) потребуется для получения 213 кДж
теплоты сжиганием угарного газа? (Запишите число с точностью до десятых.)
28. Сколько
килограммов бутадиена-1,3 можно получить из 20 кг 96 %-го этанола, если выход в
реакции Лебедева составляет 71 %? (Ответ запишите с точностью до целых.)
29. Из предложенного
перечня выберите вещества, между которымиокислительно-восстановительная реакция
протекает с изменением цвета раствора. В ответе запишите уравнение только одной
из возможных окислительновосстановительных реакций с участием выбранных
веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30. Из
предложенного перечня веществ выберите вещества, которыевступают в реакцию
ионного обмена с выделением газа. Запишите молекулярное, полное и сокращённое
ионное уравнения реакции с участием выбранных веществ.
31. Серебро
растворили в разбавленной азотной кислоте. Черезполученный раствор пропустили
сероводород, из раствора выпал чёрный осадок. Осадок отфильтровали и прокалили
на воздухе. Газ, выделившийся при прокаливании, поглотили известковой водой, в
результате из раствора выпал осадок. Напишите молекулярные уравнения четырёх
описанных реакций.
32. Напишите
уравнения реакций, с помощью которых можноосуществить следующие превращения:
С3H6 → C3H6Br2 → X1 → пропандиовая кислота → X2 → C2H3OCl При написании
уравнений реакций указывайте преимущественно образующиеся продукты, используйте
структурные формулы органических веществ.
33. Органическое
вещество X относится к ароматическим соединениям и проявляет слабые основные
свойства. Оно реагирует с одним эквивалентом хлороводорода, образуя вещество,
содержащее 27,4 % хлора и 10,8 % азота по массе. Вещество X окисляется
перманганатом калия, не реагирует с бромной водой и азотистой кислотой. На
основании данных условия задачи: 1) проведите необходимые вычисления
(указывайте единицы измерения и обозначения искомых физических величин) и
установите молекулярную формулу вещества X; 2) составьте возможную структурную
формулу вещества X, которая однозначно отражает порядок связи атомов в его
молекуле; 3) напишите уравнение реакции вещества X с горячим водным раствором
перманганата калия (в уравнении используйте структурные формулы органических
веществ).
34. Навеску хлорида
фосфора(V) растворили в 50 мл горячей воды.
Для полной нейтрализации полученного раствора
потребовалось 190 г
3,6 %-го раствора гидроксида
бария. Выпавший осадок отфильтровали. Рассчитайте массу осадка и массовую долю
соли в фильтрате. В ответе запишите уравнения реакций, которые указаны в
условии задачи, и приведите все необходимые вычисления (указывайте единицы
измерения и обозначения искомых физических величин).
Вариант ХИ2210402 с ответами
Для выполнения заданий 1–3 используйте следующий ряд
химических элементов: 1) Na, 2) O, 3) Ar, 4) B, 5) Al Ответом в заданиях 1–3
является последовательность цифр, под которыми указаны химические элементы в
данном ряду.
1.
Какие из указанных элементов имеют в первом возбуждённомсостоянии
конфигурацию внешнего уровня ns1 np2 ? Запишите номера выбранных элементов.
2.
Из указанного ряда выберите три элемента, принадлежащие
одномупериоду Периодической системы, и расположите их в порядке уменьшения
первой энергии ионизации атома. Запишите в поле ответа номера выбранных
элементов в нужной последовательности.
3.
Из указанного ряда выберите два элемента, способные
проявлятьотрицательную степень окисления. Запишите в поле ответа номера
выбранных элементов.
4.
Из предложенного перечня выберите две частицы, в которых одиниз
элементов образует три ковалентные связи. Запишите номера выбранных ответов.
●
1) NH4 +
●
2) SO3
●
3) AlH4 –
●
4) H3O+
●
5) HCN
5.
Среди предложенных формул/названий веществ, расположенных
впронумерованных ячейках, выберите формулы/названия: А) основного оксида; Б)
бескислородной кислоты; В) кислой соли. Запишите в таблицу номера ячеек, в
которых расположены вещества, под соответствующими буквами.
6.
В двух пробирках находился раствор иодида алюминия. В
первуюпробирку добавили раствор вещества Х, а во вторую – раствор вещества Y. В
первой пробирке видимых признаков реакции не наблюдалось, а во второй выпал
белый осадок, при этом газ не выделялся. Из предложенного перечня выберите
вещества X и Y, которые могут вступать в описанные реакции.
●
1) NH4Cl
●
2) Pb(NO3)2
●
3) K2CO3
●
4) NH3
●
5) (NH4)2S
7.
Установите соответствие между формулой вещества и реагентами,
скаждым из которых это вещество может взаимодействовать: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
8.
Установите соответствие между исходными веществами,вступающими в
реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к
каждой позиции, обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
10.
Установите соответствие между названием гомологического ряда иего
общей формулой: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
11.
Из предложенного перечня выберите два структурных
изомера.Запишите номера выбранных ответов.
●
1) пентандиол-2,3
●
2) пропилацетат
●
3) дипропиловый эфир
●
4) циклопентанол
●
5) 2-метилбутаналь
12.
Из предложенного перечня выберите все вещества, при
гидролизекоторых в кислой среде образуется карбоновая кислота. Запишите номера
выбранных ответов.
●
1) 2,2-дихлопропан
●
2) уксусный ангидрид
●
3) 1,1,1-трихлорэтан
●
4) цианометан
●
5) метоксибензол
13.
Из предложенного перечня выберите два вещества, которыепроявляют
основные свойства, но являются более слабыми основаниями, чем аммиак. Запишите
номера выбранных ответов.
●
1) пиррол
●
2) пиридин
●
3) триметиламин
●
4) метилат натрия
●
5) 2-метиланилин
14.
Установите соответствие между схемой реакции и веществом
Х,принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
15.
Установите соответствие между реагирующими веществами
иорганическим продуктом, который преимущественно образуется при взаимодействии
этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
17.
Из предложенного перечня выберите все реакции замещения.Запишите
номера выбранных ответов.
●
1) взаимодействие 2-хлорпропана с водным раствором щёлочи
●
2) взаимодействие фенола с разбавленной азотной кислотой
●
3) нагревание 1,3-дибромпропана с цинком
●
4) взаимодействие ацетона с водородом
●
5) взаимодействие метиламина с хлорметаном
18.
Из предложенного перечня выберите все реакции, скоростькоторых не
зависит от давления. Запишите номера выбранных ответов.
●
1) горение серы в кислороде
●
2) растворение алюминия в растворе щёлочи
●
3) нейтрализация азотной кислоты гидроксидом бария
●
4) изомеризация α-глюкозы в β-глюкозу
●
5) взаимодействие аммиака и хлороводорода
19.
Установите соответствие между
схемойокислительно-восстановительной реакции и степенью окисления
элемента-окислителя: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
20.
Установите соответствие между формулой вещества и
продуктамиэлектролиза водного раствора или расплава этого вещества,
выделившимися на инертных электродах: к каждой позиции, обозначенной буквой,
подберите соответствующую позицию, обозначенную цифрой.
21.
Для веществ, приведённых в перечне, определите характер средыих
водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера
веществ в порядке уменьшения значения pH их водных растворов.
●
1) NaHCO3
●
2) NaI
●
3) NaOH
●
4) HI
23.
В реакторе постоянного объёма смешали оксид серы(IV) и кислород.
В результате обратимой реакции: 2SO2(г) + O2(г) ←→ 2SO3(г) в реакторе
установилось равновесие. Исходная концентрация кислорода была равна 0,1 моль/л,
а равновесные концентрации оксида серы(VI) и оксида серы(IV) составили 0,08
моль/л и 0,12 моль/л, соответственно. Найдите равновесную концентрацию
кислорода (X) и исходную концентрацию оксида серы(IV) (Y). Выберите из списка
номера правильных ответов.
●
1) 0,04 моль/л
●
2) 0,06 моль/л
●
3) 0,08 моль/л
●
4) 0,12 моль/л
●
5) 0,16 моль/л
●
6) 0,2 моль/л
24.
Установите соответствие между названием вещества и
признакомреакции, который наблюдается при взаимодействии вещества с
разбавленной соляной кислотой: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
25.
Установите соответствие между смесью веществ и методом
еёразделения: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
26.
При охлаждении 400 г 70 %-го раствора нитрата аммония выпалосадок
– безводная соль. В образовавшемся растворе массовая доля нитрата аммония
снизилась до 60 %. Найдите массу осадка (в г). (Запишите число с точностью до
целых.)
27.
Горение бутана описывается термохимическим уравнением: C4H10(г) +
6,5O2(г) = 4CO2(г) + 5H2O(ж) + 2880 кДж Сколько миллилитров углекислого газа
(н.у.) выделится в атмосферу при получении 360 Дж теплоты сжиганием бутана?
(Ответ запишите с точностью до десятых).
28.
В результате тримеризации пропина объёмом 74 л (н. у.)
получилисмесь триметилбензолов общей массой 99 г. Рассчитайте общий выход (в %)
продуктов тримеризации. (Ответ запишите с точностью до целых.)
29.
Из предложенного перечня выберите вещества, между
которымиокислительно-восстановительная реакция протекает с выделением газа и
изменением цвета раствора. В ответе запишите уравнение только одной из
возможных окислительновосстановительных реакций с участием выбранных веществ.
Составьте электронный баланс, укажите окислитель и восстановитель.
30.
Из предложенного перечня веществ выберите вещества,
которыевступают в реакцию ионного обмена с образованием осадка. Запишите
молекулярное, полное и сокращённое ионное уравнения реакции с участием
выбранных веществ.
31.
Чёрное вещество, образовавшееся при прокаливании нитрата
меди,растворили в соляной кислоте. Через полученный раствор пропустили
сернистый газ, в результате выпал белый осадок, который растворяется в
аммиачной воде. Напишите молекулярные уравнения четырёх описанных реакций.
32.
Напишите уравнения реакций, с помощью которых можноосуществить
следующие превращения: C4H10O → бутен-2 → X1 → бутин-2 → X2 → C12H6O12 При
написании уравнений реакций указывайте преимущественно образующиеся продукты,
используйте структурные формулы органических веществ.
33.
Органическое вещество X представляет собой бесцветную жидкость с
запахом аммиака. Оно реагирует с двумя эквивалентами бромоводорода, образуя
вещество, содержащее 72,1 % брома и 12,6 % азота по массе. Вещество X реагирует
с азотистой кислотой, при этом выделяется в 2 раза больше азота, чем при
сгорании X. На основании данных условия задачи:
●
1) проведите необходимые вычисления (указывайте единицы измерения
и обозначения искомых физических величин) и установите молекулярную формулу
вещества X;
●
2) составьте структурную формулу вещества X, которая однозначно
отражает порядок связи атомов в его молекуле;
●
3) напишите уравнение реакции вещества X с избытком гидроксида
калия (в уравнении используйте структурные формулы органических веществ).
34.
Для полной нейтрализации раствора, полученноговзаимодействием
хлорангидрида серной кислоты SO2Cl2 со 100 мл горячей воды, потребовалось 380 г
2,7 %-го раствора гидроксида бария. Выпавший осадок отфильтровали. Рассчитайте
массу осадка и массовую долю соли в фильтрате. В ответе запишите уравнения
реакций, которые указаны в условии задачи, и приведите все необходимые
вычисления (указывайте единицы измерения и обозначения искомых физических
величин).
Скачать ответы и
решения для варианта
-
Типы задач в задании 33.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Дополнение по определению структурной формулы:
-
Ответы и комментарии к задачам для самостоятельного решения.
Автор статьи — профессиональный репетитор О. В. Овчинникова.

- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки при написании требуемых уравнений реакций с участием найденного вещества.
к оглавлению ▴
Типы задач в задании 33.
- 1. Определение молекулярной формулы вещества по массовым долям химических элементов или по общей формуле вещества, а затем его структурной формулы по химическим свойствам;
- 2. Определение молекулярной формулы вещества по продуктам сгорания, а затем его структурной формулы по химическим свойствам.
Стоит отметить, что во всех подобных заданиях ЕГЭ требуется написать уравнение реакции, в котором принимает участие искомое вещество. Так что знание реакций тоже необходимо.
к оглавлению ▴
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе составасодержится
атома углерода и
атома водорода. Если взять
молекулу такого вещества, то его молекулярная масса будет равна:
а.е.м. и там содержится
а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
или
Если вещество имеет общую формулу
, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса
атомов
равна
, масса
атомов
, масса
атомов кислорода
Тогда
Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например,
— истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение, т.е. простейшая формула бензола —
.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол Бутен Уксусная кислота Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа
по газу
Относительная плотность
— это величина, которая показывает, во сколько раз газ
тяжелее газа
. Её рассчитывают как отношение молярных масс газов
и
:
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа
по водороду:
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за
г/моль (исходя из примерного усреднённого состава).
Поэтому: - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса
л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
Если взять
моль газа, то тогда:
,
а молярную массу газа можно найти, умножая плотность на молярный объём.
- Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы — Алкены Алкины Диены — Гомологи бензола Предельные одноатомные спирты Многоатомные спирты Предельные альдегиды Кетоны Фенолы Предельные карбоновые кислоты Сложные эфиры Амины Аминокислоты (предельные одноосновные)
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
-
Пример 1.
Определить формулу вещества, если оно содержити
и имеет относительную плотность по воздуху, равную
.
Решение примера 1.
- Пусть масса вещества равна
г. Тогда масса
будет равна
г, а масса
г.
- Найдём количество вещества каждого атома:
моль,
моль.
- Определяем мольное соотношение атомов
и
:
(сократим оба числа на меньшее)
(домножим на
)
Таким образом, простейшая формула
. Однако вещества с такой формулой не существует. Для нахождения молекулярной формулы нам потребуется домножать простейшую формулу на небольшие числа: 2, 3 и т. п. Например при домножении эмпирической формулы на 2 мы получаем алкан, имеющий в своём составе 8 атомов углерода:
.
Чтобы проверить, правильна ли найденная нами формула, необходимо использовать дополнительные данные, которые всегда указаны в задаче. Это могут быть либо химические свойства вещества, либо информация, позволяющая вычислить его молярную массу. В данном случае дана относительная плотность соединения по воздуху. - По относительной плотности рассчитаем молярную массу:
г/моль.
Молярная масса, соответствующая простейшей формуле
г/моль, это в
раза меньше истинно молярной массы.
Значит, истинная формула
.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу ( г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
т.е. число атомов
т.е число атомов
Формула вещества .
-
Пример 2.
Определить формулу алкина с плотностьюг/л при нормальных условиях.
Решение примера 2.
Общая формула алкина
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность — это масса
литра газа при нормальных условиях.
Так как моль вещества занимает объём
л, то необходимо узнать, сколько весят
л такого газа:
плотность
молярный объём
г/л
л/моль =
г/моль.
Далее, составим уравнение, связывающее молярную массу и :
Значит, алкин имеет формулу
-
Пример 3.
Определить формулу предельного альдегида, если известно, чтомолекул этого альдегида весят
г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в моль вещества.
Это число Авогадро: (молекул).
Значит, можно найти количество вещества альдегида:
моль,
и молярную массу:
г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим .
Общая формула предельного альдегида , то есть
.
-
Пример 4.
Определить формулу дихлоралкана, содержащегоуглерода.
Решение примера 4.
Общая формула дихлоралкана: , там
атома хлора и
атомов углерода.
Тогда массовая доля углерода равна:
число атомов
в молекуле
атомная масса
молекулярная масса дихлоралкана
вещество — дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось
г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) —
Тогда схема реакции сгорания выглядит так:
Нетрудно заметить, что при сгорании
моль алкана выделится
моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
моль.
- При пропускании углекислого газа через известковую воду
выпадает осадок карбоната кальция:
Масса осадка карбоната кальция —
г, молярная масса карбоната кальция
г/моль.
Значит, его количество вещества
моль.
Количество вещества углекислого газа тоже
моль.
- Количество углекислого газа в
раза больше чем алкана, значит формула алкана
.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна. При сжигании
г этого соединения образуется
л углекислого газа (н. у) и
г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов и, возможно,
. Поэтому его общую формулу можно записать как
.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду.
- Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
моль.
На одну молекулу
приходится один атом
, значит, углерода столько же моль, сколько
.
моль
моль.
В одной молекуле воды содержатся два атома
, значит количество водорода в два раза больше, чем воды.
моль.
- Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
- Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
Простейшая формула
.
- Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул
и его молярная масса
г/моль):
г/моль.
Истиная формула
, её молярная масса
.
Истинная формула
.
-
Пример 7.
Определите молекулярную формулу вещества, при сгоранииг которого образовалось
г
г воды и азот. Относительная плотность этого вещества по водороду —
. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы
и
. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения: - Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
- Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
г ,
моль.
Простейшая формула —
Истинная молярная масса
г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
-
Пример 8.
Вещества содержити
. При сгорании
г его выделилось
г
г
, а сера была полностью переведена в сульфат бария, масса которого оказалась равна
г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
моль.
моль.
моль.
моль.
моль.
моль.
- Рассчитываем предполагаемую массу кислорода в исходном веществе:
- Находим мольное соотношение элементов в веществе:
Формула вещества
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы
получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветитьг
-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов —
.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с
моль диена вступят
моль брома:
- Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
г
моль.
- Так как количество брома, вступившего в реакцию, в
раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через
:
Это пентадиен
.
-
Пример 10.
При взаимодействииг предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования
мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта —
Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой
.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
- Находим молярную массу спирта и
:
Спирт — бутанол
.
-
Пример 11.
Определить формулу сложного эфира, при гидролизег которого выделяется
г спирта и
г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
Соответственно, спирт будет иметь формулу
,
а кислота
.
Уравнение гидролиза сложного эфира:
- Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
= (масса кислоты) + (масса спирта) − (масса эфира) =
г
моль
Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:
г/моль,
г/моль.
Получим два уравнения, из которых найдём
и
:
— уксусная кислота
— этанол.
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
-
Пример 12.
Определить формулу аминокислоты, если при действии наг её избытком гидроксида натрия можно получить
г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно.
- Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что
.
Можно это сделать математически, если принять, что
.
.
Это аланин — аминопропановая кислота.
Однако на данном этапе решение задачи не заканчивается. В ней требуется установить и структурную формулу вещества. Вот пример подобного задания:
При сгорании 5,8 г органического вещества образуется 6,72 л углекислого газа и 5,4 г воды. Плотность паров этого вещества по воздуху равна 2.
Установлено, что это вещество не взаимодействует с аммиачным раствором оксида серебра, но каталитически восстанавливается водородом с образованием вторичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты и углекислого газа. На основании этих данных:
1) установите простейшую формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с водородом.
(источник: Типовые тестовые задания по химии, под редакцией Ю. Н. Медведева. 2015 г.)
В первой части задачи в результате вычислений мы находим молекулярную формулу соединения: C3H6O. Затем начинаем путём логических размышлений находить структурную формулу. Общая формула CnH2nO характерна для альдегидов и кетонов, так же возможно предположить спирт: пропен-2-ол-1 (напомним: соединение с гидроксильной группы у атома углерода, образующего двойную связь является неустойчивым). Во-первых, данное вещество не подвергается окислению аммиачным раствором оксида серебра, значит, это не альдегид. Во-вторых, данное вещество каталитически восстанавливается водородом с образованием вторичного спирта, а значит, это не спирт. Единственный оставшийся вариант – кетон, а именно – ацетон. Подтверждает это и возможность окисления соединения кислым перманганатом калия до углекислого газа и карбоновой кислоты. Написание уравнения реакции уже не должно вызвать затруднений.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна г/л. Массовая доля углерода в нем равна
. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна , массовая доля азота равна
. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна . Выведите молекулярную формулу карбоновой кислоты.
1–4. л алкадиена при н.у. имеет массу, равную
г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна . При сжигании
г этого вещества образуется
г углекислого газа (н.у.) и
г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой г в избытке кислорода получили
г азота,
л (н.у.)
и
г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится
молекул.
2–3. Углекислый газ, полученный при сгорании г углеводорода, пропустили через избыток раствора гидроксида кальция и получили
г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего и хлор, выделилось
л (н.у.) углекислого газа,
г воды,
г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось л (н.у.) углекислого газа,
г воды и
л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он г его при присоединении воды образуют
г спирта.
3–2. Для окисления г предельного альдегида до кислоты потребовалось
г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой г с избытком бромоводорода образует
г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой г с избытком калия выделилось
л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили г альдегида,
г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Дополнение по определению структурной формулы:
Д-1. Дана молекулярная формула: C2H6O. Искомое вещество газообразно при н. у., не реагирует с металлическим натрием и может быть получено дегидратацией спирта. Установите его структурную формулу.
Д-2. Дана молекулярная формула: C3H8O2. Искомое вещество реагирует с натрием, а при дегидратации под действием серной кислоты превращается в соединение, содержащее шестичленный цикл. Установите его структурную формулу.
Д-3. Дана молекулярная формула: C2H7NO. Искомое вещество представляет собой бесцветную, вязкую жидкость с запахом аммиака. Оно реагирует и с натрием, и с азотистой кислотой, причём в обоих случаях выделяется газ. Установите его структурную формулу.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1.
1–2.
1–3.
1–4.
1–5. — формиат кальция, соль муравьиной кислоты
2–1.
2–2.
2–3. (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. (не забудьте, что атомы водорода содержатся не только в воде, но и в
)
2–5.
3–1.
3–2.
3–3.
3–4.
3–5.
Д–1.
Д–2.
Д–3.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Задача 33 на ЕГЭ по химии. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.03.2023