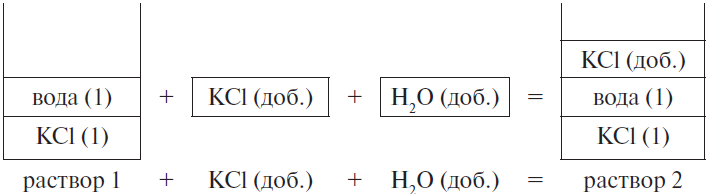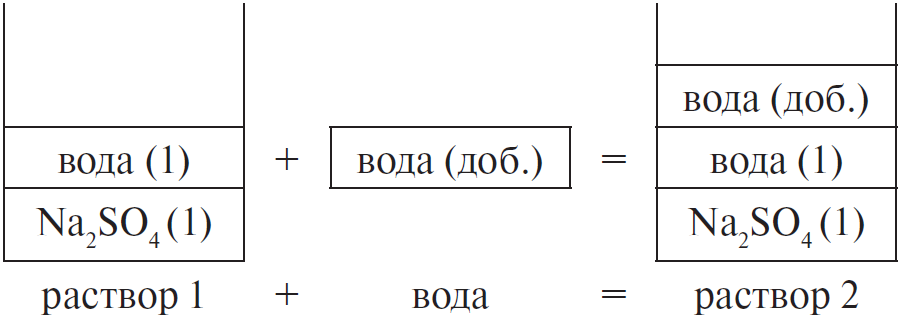|
Элемент и его соединения |
Применение |
|
Ø Al Ø Al₂O₃ Ø AlCl₃ Ø Al₂(SO₄)₃ ∙ 18H₂O |
· Алюмотермия используется в металлургии для получения металлов: 2Al + Fe₂O₃ = 2Fe + Al₂O₃ · Машиностроение, авиастроение, судостроение · Алюминиевая посуда · Некоторые соли применяются в медицине для лечения кожных заболеваний · Адсорбент в хроматографии · Катализатор в органической химии · Очистка воды |
|
Ø Fe Ø FeCl₃ Ø Fe(NO₃)₃ |
· Сплавы железа являются основным конструкционным материалом · Катализатор в органической химии · Окраска тканей |
|
Ø Cr Ø «Хромовая смесь» — раствор K₂Cr₂O₇ вH₂SO₄(конц) |
· В металлургии для получения специальных сортов стали · Хромом покрывают другие металлы с целью предохранения их от коррозии · Окислитель для очистки стеклянной химической посуды |
|
Ø KMnO₄ |
· Дезинфицирующее средство |
|
Ø Cu |
· Соединения меди используются для борьбы с вредителями сельскохозяйственных растений |
|
Ø H₂ Ø H₂O₂ |
· Сырьё для получения NH₃, HCl, CH₃OH · В пищевой промышленности водород используют для выработки твёрдых жиров путём гидрогенизации растительных масел · В металлургии для восстановления некоторых металлов и оксидов · Летательные аппараты, воздушные шары, зонды наполняют водородом · «водородная горелка» для сварки и резки металлов · Жидкий водород – одно из наиболее эффективных видов ракетного топлива · В энергетике водород используют в качестве топлива · Дезинфицирующее средство в медицине для полосканий, промываний и как кровоостанавливающее средство |
|
Ø Cl₂ |
· В производстве пластмасс · Отбеливатель бумаги и тканей · Обеззараживание воды – «хлорирование» · В химической промышленности для получения соляной кислоты, фосгена, хлорной извести, хлороформа, моющих средств, ядохимикатов, каучуков |
|
Ø O₂ |
· В металлургии при выплавке чугуна и стали · В смеси с ацетиленом используют для сварки и резки металлов · В химической промышленности · В медицине (кислородные подушки, кислородные коктейли и др.) |
|
Ø S Ø H₂S Ø SO₂ Ø H₂SO₄ Ø MgSO₄ ∙ 7H₂O(горькая английская соль)и Na₂SO₄ ∙ 10H₂O(глауберова соль) Ø CaSO₄ ∙ 2H₂O |
· Широко применяется для борьбы с вредителями сельского хозяйства · Для вулканизации каучука · В производстве спичек, пороха · В медицине для лечения кожных заболеваний · В медицине для лечения ревматизма и кожных заболеваний · Сероводород – один из компонентов минеральных вод · В текстильной промышленности для отбеливания различных изделий · Для уничтожения вредных микроорганизмов · Получение серной кислоты · Осушка газов · Получение других кислот · Получение удобрений · Различные красители · Слабительное · Гипсовые повязки |
|
Ø N₂ Ø NH₃ Ø NH₄OH(нашатырный спирт) и NH₄Cl Ø Аммонийные соли Ø N₂O(веселящий газ) Ø HNO₃ |
· Исходное сырьё для получения аммиака, азотной кислоты, азотных удобрений · Получение азотной кислоты, гидроксида аммония и т.д. · В медицине · Удобрения · В медицине для наркоза · Для получения удобрений, лекарственных и взрывчатых веществ |
|
Ø P Ø H₃PO₄ |
· Производство фосфорной кислоты · Красный фосфор используется при изготовлении спичек · Производство удобрений · Изготовление реактивов, многих органических веществ, для получения катализаторов · Для создания защитных покрытий на металлах · В фармацевтической промышленности |
|
Ø C Ø CO Ø CO₂ Ø Na₂CO₃ |
· Алмаз применяется в промышленности для обработки твердых сплавов и бурения, также для изготовления ювелирных изделий · Графит применяется в электротехнике для изготовления электродов · В металлургии для получения металлов и руд · Пищевая промышленность (газированная вода, лимонады) · Сухой лёд · Пищевая промышленность (сода) |
|
Ø Si Ø SiO₂ |
· Получение полупроводниковых материалов и сплавов · Из сплава кремния с железом (ферросилиций) изготавливают химическую аппаратуру · Сырьё для производства стекла · Изготовление цемента |
Область применения:
Аммиак — производство удобрений
Метан (природный газ) — в качестве топлива , энергетика
Изопрен — получение каучука
Этилен — получение пластмасс
капролактам — получение капрона
пропан — в качестве топлива
изопрен — получение каучука
стирол — получение полистирола
пропилен — получение
полипропилена
гидроксид аммония — в медицине
оксид кремния — получение стекол
сера — процесс вулканизации резины
тетрахлорид углерода — в качестве растворителя
ацетон — в качестве растворителя
углерод – для металлургия , для
производство чугуна
стирол — для производство
пластмасс
азот — для производство
удобрений
уксусная кислота — для производство
волокон, для пищевая промышленность
фосфорная кислота — для
производство удобрений
кислород — для металлургия
бензол — -для
производство пластмасс
хлор — для производство
пластмасс , производство органических растворителей
азотная кислота- для
производство удобрений
карбонат кальция – для
производство стекла
углекислый газ – для пищевая
промышленность
аргон создание инертной
атмосферы
карбонат натрия – для
производство стекла
озон — для очистка воды
кислород – для производство
стали
Полиэтилен – для игрушки,
пластиковые пакеты
политетрафторэтилен – для
тефлоновая посуда
изопреновый каучук — для автомобильные
шины
поливинилхлорид — для трубы,
оконные панели
поликарбонат — для пластиковые
бутыли, DVD-диски
полистирол – для контейнеры
для пищи
нефть – для
производства топлива
сода — для производство
стекла
водород –для производство
аммиака
кислород – для выплавка стали
бутадиен – для производство
пластмасс
Классификация:
Каучук — происхождение
-природный органический
Асбест- происхождение-
неорганический
Вискозное волокно- происхождение
-искусственный
Лен — происхождение -природный
органический
Поливинилхлорид —
происхождение -синтетический
Карбидное волокно — происхождение
-неорганический
Капрон — происхождение
-синтетический
Борное волокно- происхождение
— неорганический
Ацетатное волокно —
происхождение -искусственный
Винол — происхождение
-синтетический
Хлопок — происхождение
-природный органический
Кварцевое волокно —
происхождение -неорганический
Стекловолокно- происхождение —
неорганический
Нейлон- происхождение —
синтетический
Шелк — происхождение
-природный органический
Базальт- происхождение —
неорганический
Пенька- происхождение
-природный органический
Акрил- происхождение
-синтетический
Карбидкремниевое волокно-
происхождение — неорганический
Эластан- происхождение —
синтетический
Оксидное волокно —
происхождение -неорганический
Лайкра- происхождение —
синтетический
Триацетатное волокно —
происхождение -искусственный
Полиэстер- происхождение —
синтетический
Мономер-полимер:
винилхлорид — поливинилхлорид
хлорэтилен — поливинилхлорид
этилен — полиэтилен
пропен — полипропилен
винилбензол — полистирол
бутадиен — каучук
пропен — полипропилен
капролактам — капрон
терефталевая кислота —
полиэтилентерефталат
изопрен — каучук
этилен — полиэтилен
стирол — полистирол
тетрафторэтилен — тефлон
винилацетат — поливинилацетат
акриламид — полиакриламид
ацетилен — полиацетилен
этиленоксид — полиэтиленгликоль
винилбромид — поливинилбромид
Алюминий – из электролиз
расплава
железо – из восстановление
оксида углеродом
Натрий — электролиз расплава
кремний — восстановление оксида
углеродом
Аммиак -из воздуха
Стекло – из сода
этилен — из нефть
чугун – из магнитный железняк
Хлор — водный раствор хлорида
натрия
медь — халькопирит
полипропилен — получают из
пропилен
полиэтилен — получают из этилен
железо — получают из гематит,
пирит
Этанол — получают из древесина
Кислород — получают из воздух
углекислый газ — получают из
дымовые газы
фтор — получают из расплав
фторида калия
Процессы:
электролиз воды — получение
легких газов (водород, кислород)
крекинг нефтепродуктов —
получение бензина
перегонка (фракционирование)
сжиженного воздуха — получение легких газов (азот, кислород)
брожение древесины или соломы —
получение этанола
горение — получение тепловой
энергии
этерификация — получение
сложных эфиров
полимеризация — получение пластмасс и резины
вулканизация —
получение резины
перегонка (фракционирование)
сжиженного воздуха — получение легких газов (азот, кислород)
прокаливание фосфатов кальция с
углем и диоксидом кремния — получение фосфора
каталитическое окисление
диоксида серы в триоксид серы — получение серной кислоты
сшивание
молекул каучука в единую пространственную сеть — вулканизация
термическое или каталитическое
разложение тяжелых углеводородов — крекинг
присоединение воды к
непредельным соединениям — гидратация
реакция образования сложных
эфиров при взаимодействии кислот и спиртов — этерификация
присоединение водорода к
непредельным соединением с получением предельных соединений — гидрирование
замещение
водорода на галоген — радикальное галогенирование
присоединение воды к
непредельным соединениям — гидратация
присоединение водорода к
непредельным соединением с получением предельных соединений — гидрирование
переработка каменного угля —
коксование
Способ
разделения:
воды и октана — разделение с
помощью делительной воронки
воды и карбоната кальция
–разделение фильтрованием
железо и нитрат калия -с
помощью магнита
железо и магний — разделить с помощью
магнита
железа и меди -разделение с
помощью магнита
гексана и бензола — разделение фракционной
перегонкой
жидкий азот и кислород – разделяют фракционной
перегонкой
вода и пропанол —
фракционной перегонкой
вода и ацетон — разделить фракционной
перегонкой
вода и этанол -фракционной
перегонкой
поваренная соль и кварцевый песок —
-разделить обработка водой, фильтрование, выпаривание раствора
воды и бензола — декантацией
воды и сульфата бария —
фильтрованием
хлорид лития и кварцевый
песок -обработка водой
железа и хлорида стронция — с
помощью магнита
воды и фенол — декантацией
бутанола и этанола —
фракционной перегонкой
сульфат бария и хлорид калия
обработка водой
воды и тетрахлорметан — декантацией
алюминия и железа разделить с
помощью магнита
углерод и хлорид натрия —
обработка водой
изопропанол и этанол —
фракционной перегонкой
ацетон и изопропанол фракционной перегонкой
хлорид натрия и полиэтилен
обработка водой
Цвет
пламени:
соли борной кислоты- зеленое
пламя
соли стронция — карминово-красное
пламя
соли калия – фиолетовое пламя
соли меди — зеленое пламя
соли кальция — кирпично-красное
пламя
соли натрия — желтое пламя
соли калия — фиолетовое пламя
соли меди — зеленое пламя
соли бария —
желто-зеленое
соли лития — красное
Задание №1:
Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящем в этом аппарате.
АППАРАТ:
А) печь кипящего слоя
Б) колонна синтеза
В) поглотительная башня
ПРОЦЕСС:
1) взаимодействие водорода и азота
2) окисление оксида азота(IV)
3) получение олеума
4) получение оксида серы(IV)
Решение:
Итак, рассмотрим первый пункт — печь для обжига в «кипящем слое».
Кипящий слой — это часть процесса производства серной кислоты, в которой совмещены твердая и жидкая фазы; при помощи этой технологии получают сернистый газ(SO2), ответ 4.
Колонна синтеза — это сложный аппарат, направленный на получение аммиака из водорода и азота, ответ 1.
Поглотительная башня используется при получении олеума(раствор SO3 в серной кислоте), ответ 3.
Задание №2:
Установите соответствие между осуществляемым в промышленности процессом и оборудованием, которое используется при получении серной кислоты.
ПРОЦЕСС:
А) получение сернистого газа
Б) получение олеума
В) получение оксида серы(VI)
ОБОРУДОВАНИЕ:
1) окислительная башня
2) печь «кипящего слоя»
3) контактный аппарат
4) поглотительная башня
Решение:
Получение сернистого газа сопровождается обжигом пирита(FeS) в печи «кипящего слоя», ответ 2.
Получение олеума происходит путем растворения оксида серы(SO3) в серной кислоте, сам процесс осуществляется в поглотительной башне, ответ 4.
Оксид серы(VI) получают в контактном аппарате с помощью каталитического окисления SO2, ответ 3.
Задание №3:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) стирол
Б) этиленгликоль
В) синтез-газ
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) производство маргарина
3) производство метанола
4) получение пластмасс
Решение:
Стирол(винилбензол) — это гомолог бензола, имеет формулу C6H5ꟷCH=CH2, за счет наличия кратной связи способен к реакциям полимеризации, в частности, в производстве пластмасс, ответ 4.
Этиленгликоль(1,2-этандиол) — это двухатомный спирт, который используется при получении полиэфиров, так как имеет две OH группы, которые потенциально могут вступать в реакцию поликонденсации с образованием полиэтилентерефталата (наши «любимые» пластиковые бутылки), ответ 1.
Синтез-газ(CO + H2) — довольно известная смесь угарного газа и водорода, используется при промышленном способе получения метилового спирта(метанола), ответ 3.
Задание №4:
Установите соответствие между веществом и способом его попадания в окружающую среду.
ВЕЩЕСТВО:
А) углекислый газ
Б) оксиды азота
В) гексахлоран
СПОСОБ ПОПАДАНИЯ В ОКРУЖАЮЩУЮ СРЕДУ:
1) сгорание углеводородного топлива
2) борьба с насекомыми
3) протравливание семян
4) сточные воды
Решение:
Углекислый газ и оксиды азота попадают в окружающую среду путем сгорания углеводородного топлива, А и Б ответ 1.
Гексахлоран используется в качестве инсектицида, ответ 2.
Задание №5:
Установите соответствие между названием процесса переработки нефти и его результатом.
НАЗВАНИЕ ПРОЦЕССА:
А) риформинг
Б) перегонка нефти
В) крекинг
РЕЗУЛЬТАТ:
1) разделение нефти на фракции
2) получение смазочных масел
3) увеличение количества легкокипящих фракций
4) получение ароматических углеводородов
Решение:
Риформинг — это процесс переработки алифатических углеводородов в ароматические(например, бензол), здесь подходит вариант 4.
Перегонка нефти приводит к разделению ее на фракции(лигроин, мазут, бензин), ответ 1.
Крекинг — это процесс высокотемпературного расщепления нефти с получением низкомолекулярных органических соединений, ответ 3.
Задание №6:
Установите соответствие между металлом и веществом, которое используется для получения этого металла в промышленности, или способом промышленного получения.
МЕТАЛЛ:
А) железо
Б) алюминий
В) натрий
ВЕЩЕСТВО /СПОСОБ ПОЛУЧЕНИЯ:
1) красный железняк
2) электролиз раствора оксида в криолите
3) электролиз раствора поваренной соли
4) электролиз расплава поваренной соли
Решение:
Железо — в промышленности его получают из красного железняка, или гематита, который имеет формулу Fe2O3, ответ 1.
Алюминий можно получить электролизом Al2O3 в расплаве криолита, ответ 2.
Криолит, или гексафторалюминат натрия(Na3AlF6) — это необычный, редкий минерал, впервые обнаружен в Гренландии(отсюда название(криос — холод, литос — камень)), плавится при температуре 1012 С,
может растворять оксиды алюминия, что позволяет легко извлекать алюминий электролизом.
Натрий — для него здесь указано два возможных пункта, 3 и 4, однако, чистый Na можно получить только в РАСПЛАВЕ поваренной соли(NaCl), ответ 4.
Задание №7:
Установите соответствие между смесью веществ и способом разделения данной смеси.
СМЕСЬ ВЕЩЕСТВ:
А) вода и этиловый спирт
Б) вода и глина
В) вода и поташ
СПОСОБ РАЗДЕЛЕНИЯ:
1) фильтрование
2) выпаривание
3) использование делительной воронки
4) перегонка
Решение:
Первая смесь — вода и этиловый спирт, она может быть разделена перегонкой, ответ 4.
Следующая смесь — вода и глина, здесь нужно использовать фильтрование, ответ 1.
Последний ряд веществ — вода и поташ; поташ имеет формулу K2CO3, как и все соли калия, она растворима, и отделить ее от воды можно путем выпаривания, ответ 2.
Задание №8:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) изопропилбензол
Б) этанол
В) триолеин
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение ацетона
3) производство маргарина
4) получение дивинила
Решение:
Первое вещество — изопропилбензол, или кумол, оно используется для получения ацетона, ответ 2.
Второе соединение — этанол, который имеет важное значение для получения дивинила, или бутадиена-1,3(это реакция Лебедева, проведенная в 1926 году, давшая начало производству синтетического каучука), ответ 4.
Последнее вещество в списке — триолеин, составной частью этого химического соединения является «олеин», что означает принадлежность к жирам, а соответственно, к получению маргарина, ответ 3.
Задание №9:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) криолит
Б) пирит
В) метилметакрилат
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) производство антифриза
2) получение алюминия
3) производство серной кислоты
4) получение органического стекла
Решение:
Криолит(Na3AlF6) используется при получении чистого алюминия путем электролиза, ответ 2.
Пирит(FeS2) является начальной составной частью производства серной кислоты, ответ 3.
Метилметакрилат(метил-2-метилпроп-2-еноат) — это сложное органическое соединение, из которого получают органическое стекло, ответ 4.
Задание №10:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) глицерин
Б) формальдегид
В) глюкоза
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение взрывчатых веществ
3) хранение биологических препаратов
4) источник энергии в организме
Решение:
Глицерин, или 1,2,3 — пропантриол, это трехатомный спирт, который используется для получения нитроглицерина, являющегося составной частью взрывчатых веществ, ответ 2.
Формальдегид, или муравьиный альдегид, хорошо знаком биологам для сохранения биологических объектов в течение длительного времени, ответ 3.
Глюкоза(C6H12O6) — это моносахарид, который является источником АТФ(энергия) в организме живых существ, ответ 4.
Задание №11:
Установите соответствие между происхождением полимера и его названием.
ПРОИСХОЖДЕНИЕ ПОЛИМЕРА:
А) природный органический
Б) синтетический органический
В) искусственный органический
Название полимера:
1) сахароза
2) пенька
3) полиэфир
4) вискоза
Решение:
Природный органический полимер — из данного списка нам подходит пенька(грубое лубяное конопляное волокно), ответ 2.
Синтетический органический полимер из указанных веществ — полиэфир, ответ 3.
Искусственным органическим полимером является вискоза, ответ 4.
На сегодня все!
Уважаемый посетитель!
Если у вас есть вопрос, предложение или жалоба, пожалуйста, заполните короткую форму и изложите суть обращения в текстовом поле ниже. Мы обязательно с ним ознакомимся и в 30-дневный срок ответим на указанный вами адрес электронной почты
Статус Абитуриент Студент Родитель Соискатель Сотрудник Другое
Филиал Абакан Актобе Алагир Алматы Алушта Анапа Ангарск Архангельск Армавир Асбест Астана Астрахань Атырау Баку Балхаш Барановичи Барнаул Белая Калитва Белгород Бельцы Берлин Бишкек Благовещенск Бобров Бобруйск Борисов Боровичи Бронницы Брянск Бузулук Чехов Челябинск Череповец Черкесск Дамаск Дербент Димитровград Дмитров Долгопрудный Домодедово Дубай Дубна Душанбе Екатеринбург Электросталь Елец Элиста Ереван Евпатория Гана Гомель Гродно Грозный Хабаровск Ханты-Мансийск Хива Худжанд Иркутск Истра Иваново Ижевск Калининград Карабулак Караганда Каракол Кашира Казань Кемерово Киев Кинешма Киров Кизляр Королев Кострома Красноармейск Краснодар Красногорск Красноярск Краснознаменск Курган Курск Кызыл Липецк Лобня Магадан Махачкала Майкоп Минеральные Воды Минск Могилев Москва Моздок Мозырь Мурманск Набережные Челны Нальчик Наро-Фоминск Нижневартовск Нижний Новгород Нижний Тагил Ногинск Норильск Новокузнецк Новосибирск Новоуральск Ноябрьск Обнинск Одинцово Омск Орехово-Зуево Орел Оренбург Ош Озёры Павлодар Пенза Пермь Петропавловск Подольск Полоцк Псков Пушкино Пятигорск Радужный Ростов-на-Дону Рязань Рыбинск Ржев Сальск Самара Самарканд Санкт-Петербург Саратов Сергиев Посад Серпухов Севастополь Северодвинск Щербинка Шымкент Слоним Смоленск Солигорск Солнечногорск Ставрополь Сургут Светлогорск Сыктывкар Сызрань Тамбов Ташкент Тбилиси Терек Тихорецк Тобольск Тольятти Томск Троицк Тула Тверь Тюмень Уфа Ухта Улан-Удэ Ульяновск Ургенч Усть-Каменогорск Вёшенская Видное Владимир Владивосток Волгодонск Волгоград Волжск Воркута Воронеж Якутск Ярославль Юдино Жлобин Жуковский Златоуст Зубова Поляна Звенигород
Тип обращения Вопрос Предложение Благодарность Жалоба
Тема обращения Поступление Трудоустройство Обучение Оплата Кадровый резерв Внеучебная деятельность Работа автоматических сервисов университета Другое
* Все поля обязательны для заполнения
Я даю согласие на обработку персональных данных, согласен на получение информационных рассылок от Университета «Синергия» и соглашаюсь c политикой конфиденциальности
Terms in this set (56)
Гидрокарбонат натрия (NaHCO3 ) — представляет собой мелкий порошок белого цвета, без запаха, растворимый в воде. Используется преимущественно в кулинарии, для выпечки. Это обусловлено тем, что во время нагревания сода легко разлагается с выделением углекислого газа.
2NaHCO3 → Na2CO3 + H2O + CO2.
Кроме этого гидрокарбонат натрия используется для придания пышности омлету, смягчения мяса, усиления аромата чая или кофе, добавления сладости плодам фруктов, очищения продуктов от нитратов и т.д.
Сильная двуосновная кислота (H2SO4) представляет собой бесцветную тяжелую маслянистую жидкость, не обладающую запахом. Широко распространено использование средства в различных отраслях промышленности:
сельском хозяйстве (производство минеральных удобрений);
химической (изготовление красителей, химволокна, взрывчатых веществ);
пищевой (пищевая добавка E513)$
металлообрабатывающей;
в промышленном органическом синтезе (реакции дегидратации, гидратации, сульфирования, алкилирования).
Так же соединения серы используется в качестве электролита в свинцовых аккумуляторах.
Цинковые белила (ZnO) — представляет собой белый порошок, меняющий цвет при нагревании. Применение продукта известно в медицине, химической промышленности в качестве наполнителя или пигмента:
при производстве красок и эмалей;
при изготовлении бумаги, резины, пластмассы, косметики и парфюмерии;
в составе мазей и присыпок.
Данное соединение обладает фотокаталитической активностью, что нашло свое применение при изготовлении самоочищающихся поверхностей, бактерицидных покрытий для помещений больниц и подобных учреждений.
Сульфат меди II (CuSO4) — бесцветное кристаллическое соединение, растворимое в воде. При реакции с воздухом или водой образуется голубой пентагидрат.
Применяется вещество как основа для других соединений или в качестве индикатора влажности помещения. Медный купорос — эффективное средство в борьбе с вредителями, грибковыми заболеваниями. Но есть и безвредное применение — изготовление минеральных красок, меднение ванн, пищевые добавки (консервант).
За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 58.9%
Ответом к заданию 26 по химии может быть целое число или конечная десятичная дробь.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Какую массу цинкового купороса $ZnSO_4 · 7H_2O$ необходимо добавить к 100 г раствора сульфата цинка с массовой долей 5 % для получения 10 %-ного раствора соли? (Запишите число с точностью до целых.) Ответ в (г).
Решение
Для начала найдем массу сульфата цинка в растворе:
100*0.05 = 5 г
Найдем массовую долю сульфата цинка в купоросе:
M($ZnSO_4$)/(7*M($H_2O$) + M($ZnSO_4$)) = 161/287 = 0.56
Примем массу купороса за m — тогда масса безводного сульфата цинка будет равна 0.56m
Составим уравнение:
5 + 0.56m = 0.1(m+100)
0.46m = 5
m = 5/0.46 = 10.87
Округлим до целых чисел – 11 грамм
Ответ: 11
Задача 2
К раствору сульфида калия массой 60 г с массовой долей 4 % добавили 1,6 г этой же соли и выпарили 11,6 г воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
ω = $m_{(комп.)}$ : $m_{(р-ра)}$
$m_{(комп.)}$ = $m_{(р-ра)}$ х ω
4% = 0.04
m($K_2S$) = 60 x 0.04 = 2.4 г
$m_{(р-ра)_2} = m_{(р-ра)_1}$ + 1.6 — 11.6
$m_{(р-ра)_2}$ = 50 г
ω($K_2S$) = (2.4 +1.6) : 50
ω($K_2S$) = 0.08 = 8%
Ответ: 8
Задача 3
200 мл 36,5 %-ного раствора соляной кислоты (плотностью 1,18 г/мл) оставили в открытой колбе в вытяжном шкафу, в результате концентрация кислоты снизилась до 30 %. Рассчитайте массу улетучившегося хлороводорода (испарением воды пренебречь). (Запишите число с точностью до сотых.) Ответ в (г).
Решение
Найдем массу начального раствора, умножив его объем на плотность:
m(раствор) = 200*1.18 = 236 г.
Найдем массу кислоты в растворе, умножив массу раствора на процентное содержание кислоты:
m(HCl, 1) = 236*0.365 = 86.14 г.
Найдем массу воды в растворе:
m($H_2O$) = 236 – 86.14 = 149.86 г.
Составим пропорцию:
149.86 – 70%
X – 30%
X – конечное количество кислоты
X = 64.23 г.
Найдем разницу масс кислоты:
∆m(HCl) = 86.14 – 64.23 = 21.91 г.
Ответ: 21.91
Задача 4
Сколько граммов хлорида натрия необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %? (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Раз соли в растворе 20%, то воды будет 80%
Составим пропорцию:
50 г. – 80%
X г. – 20%
Теперь составим уравнение и решим его:
50*20 = 80X
X = 12.5 г.
Ответ: 12.5
Задача 5
Смешали 60 г раствора гидроксида калия с массовой долей 15 % и 140 г раствора этого же вещества с массовой долей 18 %. Вычислите массу щёлочи в полученном растворе. (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Найдем массу гидроксида в первом растворе, умножив массовую долю на массу раствора:
m(KOH, 1 раствор) = 60 * 0.15 = 9 г.
Таким же образом найдем массу вещества во втором растворе:
m(KOH, 2 раствор) = 140 * 0.18 = 25.2 г.
А теперь просто сложим массы и получим общую массу гидроксида калия в конечном растворе:
m(KOH, кон.) = 25.2 + 9 = 34.2 г.
Ответ: 34.2
Задача 6
К 480 г раствора соли с массовой долей 10 % добавили 320 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу конечного раствора, сложив массу изначального с добавляемым:
$m_к = m_1 + m_2$ = 480 + 320 = 800 г.
Определим массу вещества в исходном растворе:
m (соли) = 480*0.1 = 48 г
Найдем массовую долю соли в конечном растворе:
M = $m_{(соли)}$ / $m_к$ = 48/800 = 0.06 = 6%
Ответ: 6
Задача 7
Смешали 200 г 10 %-ного и 400 г 20 %-ного раствора хлорида натрия, и из раствора выпарили 30 г Н2О. Вычислите массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Массовая доля хлорида натрия в 3-м растворе вычисляется по формуле:
$ω_3(NaCl) = {m_3(NaCl)}/{m_{р-ра 3}} = {m_1(NaCl) + m_2(NaCl)}/{m_{р-ра 1} + m_{р-ра 2} – m(H_2O)}$,
где $m_1(NaCl)$ и $m_2(NaCl)$ — массы NaCl в 1-м и во 2-м растворах,
$m_{р-ра 1}$ и $m_{р-ра 2}$ — массы 1-го и 2-го растворов соответственно,
$m(H_2O)$ — масса испарившейся воды.
Массы хлорида натрия в 1-м и 2-м растворах можно найти по формулам:
$m_1(NaCl) = ω_1 · m_{р-ра 1}(NaCl)$
$m_2(NaCl) = ω_2 · m_{р-ра 2}(NaCl)$
Проводим вычисления:
1) $m_1(NaCl)$ = 0.1 · 200 = 20 г
2) $m_2(NaCl)$ = 0.2 · 400 = 80 г
3) $m_3(NaCl)$ = 20 + 80 = 100 г
4) $m_{р-ра 3}$ = 200 + 400 – 30 = 570 г
5) $ω_3(NaCl)$ = 100 / 570 ≈ 0.1754, или 17.54 %
Ответ: 17.54
Задача 8
К 200 г 10 %-ного раствора хлорида калия добавили 25 г этой же соли и 15 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
Массовая доля хлорида калия во 2-м растворе вычисляется по формуле:
$ω_2(KCl) = {m_2(KCl)}/{m_{р-ра2}}$,
где $m_2(KCl)$ — масса KCl во 2-м растворе, $m_{р-ра2}$ — масса 2-го раствора.
Очевидно, что:
1) масса хлорида калия равна сумме массы хлорида калия в первом растворе и массы добавленной соли, т. е.:
$m_2(KCl) = m_1(KCl) + m(KCl)_{доб.}$
Массу хлорида калия в 1-м растворе можно найти по формуле:
$m_1(KCl) = ω_1 · m_{р-ра 1}(KCl)$
2) масса второго раствора равна сумме масс первого раствора, добавленной соли и воды, т. е.:
$m_{р-ра 2} = m_{р-ра 1} + m(KCl)_{доб.} + m(H_2O)_{доб.}$
Проводим вычисления:
1) $m_1(KCl)$ = 0.1 · 200 = 20 г
2) $m_2(KCl)$ = 20 + 25 = 45 г
3) $m(H_2O)_{доб.}$ = 1 ∙ 15 = 15 г
4) $m_{р-ра 2}$ = 200 + 25 + 15 = 240 г
5) $ω_2(KCl)$ = 45 / 240 = 0.1875, или 18.75 %
Ответ: 18.75
Задача 9
Вычислите массовую долю сульфата натрия в растворе, полученном добавлением 100 мл воды к 250 г 15 %-ного раствора соли. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
Массовая доля сульфата натрия во 2-м растворе вычисляется по формуле:
$ω_2(Na_2SO_4) = {m_2(Na_2SO_4)}/{m_{р-ра 2}},$
где $m_2(Na_2SO_4)$ — масса $Na_2SO_4$ во 2-м растворе,
$m_{р-ра 2}$ — масса 2-го раствора.
Очевидно, что:
1) масса сульфата натрия не изменяется, т. е. $m_1(Na_2SO_4) =$
$m_2(Na_2SO_4)$. Массу сульфата натрия в 1-м растворе можно найти
по формуле:
$m_1(Na_2SO_4) = ω_1 · m_{р-ра 1}(Na_2SO_4)$
2) масса второго раствора равна сумме масс первого раствора
и добавленной воды, т. е.:
$m_{р-ра 2} = m_{р-ра 1} + m(H_2O)_{доб.}$
Проводим вычисления:
1) $m_1(Na_2SO_4) = 0.15 · 250 = 37.5$ г
2) $m(H_2O) = ρ · V = 1 · 100 = 100$ г
$m_{р-ра 2} = 250 + 100 = 350$ г
3) $ω_2(Na_2SO_4) = 37.5 / 350 ≈ 0.1071$, или $10.71$ %
Ответ: 10.71
Задача 10
Какую массу поваренной соли нужно добавить к 250 г раствора этой же соли с массовой долей 10 % для получения раствора соли с массовой долей 18 %? (Запишите число с точностью до десятых, г.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу исходной соли в растворе:
m (NaCl, исх.) = 250*0.1 = 25 г
Составим уравнение и решим:
25+x – масса соли
250+x – масса раствора
(250+x)*0.18 = 25+x
20 = 0.82x
x = 20/0.82 = 24.4 г.
Ответ: 24.4
Задача 11
Вычислите массовую долю йодоводорода (в %) в растворе, полученном при растворении 112 л (н. у.) HI в 1 л воды. (Запишите число с точностью до целых, %.)
Решение
ω = $m_{(комп.)}$ : $m_{(р-ра)}$
ω(HI) = m(HI) : $m_{(р-ра)}$
$m_{(р-ра)}$ = m(HI) + $m(H_2O)$
n(газа) = V : Vm
n(HI) = 112 : 22.4 = 5 моль
m = nM
m(HI) = 5 x 128 = 640 г
$m(H_2O)$ = 1000 г
$m_{(р-ра)}$ = 1000 + 640 = 1640 г
ω(HI) = 640 : 1640 = 0.39 = 39%
Ответ: 39
Задача 12
Через 500 мл раствора с концентрацией аммиака 4 моль/л (ρ = 1,05 г/мл) пропустили 67,2 л (н. у.) аммиака. Рассчитайте массовую долю аммиака в полученном растворе. (Запишите число с точностью до десятых, %.)
Решение
n = CV, 500 мл = 0.5 л
$n(NH_3)_1$ = 4 · 0.5 = 2 моль
m = nM
$m(NH_3)_1$ = 2 · 17 = 34 г
n = V : Vm
n$(NH_3)_2$ = 67.2 : 22.4 = 3 моль
m$(NH_3)_2$ = 3 · 17 = 51 г
m$(NH_3)$ = m$(NH_3)_1$ + m$(NH_3)_2$ = 34 + 51 = 85 г
m = Vρ
m(р-ра1) = 500 · 1.05 = 525г
Массовая доля равна отношению массы компонента к массе раствора.
m(р-ра2) = m(р-ра1) + m$(NH_3)_1$ = 525 + 51 = 576г
Массовая доля $NH_3$ = 85 : 576 = 0.148 = 14.8 %
Ответ: 14.8
Задача 13
50 г медного купороса добавили в 200 г 10%-ного раствора сульфата меди(II). Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до десятых, %.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
Определим массу вещества в исходном растворе:
m(в-во, исх.) = 10*200/100 = 20 г.
Определим массу добавленного сульфата меди, для этого найдем моли купороса, а затем умножим моли на молярную массу сульфата меди:
n(купорос) = 50/250 = 0.2 моль
m(в-во, доб.) = 0.2*160 = 32 г
Определим массу конечного раствора:
m(р-р, кон.) = 50 + 200 = 250 г.
Определим массу вещества в конечном растворе:
m(в-во, кон.) = 32 + 20 = 52 г.
Определим массовую долю в конечном растворе:
w(кон.) = 52/250 = 0.208 = 20.8%
Ответ: 20.8
Рекомендуемые курсы подготовки
В результате выполнения задания 26 ЕГЭ по химии проверяются следующие требования/умения:
Коды проверяемых требований к уровню подготовки (по кодификатору):
Читать подробнее…
Коды проверяемых элементов содержания (по кодификатору):
Уровень сложности задания:
Максимальный балл за выполнение задания:
Примерное время выполнения задания выпускником, изучавшим предмет:
В качестве мономеров для синтеза высокомолекулярных соединений используют:
1. пропен
2. бутин-1
3. толуол
4. бутадиен-1,3
5. пентадиен-1,4
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) водород
Б) пропан
В) дивинил
Г) изопрен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение лавсана
2) в качестве топлива
3) получение каучука
4) получение аммиака
5) производство стали
Катализатор никель используется в технологических процессах:
1. окисление спиртов
2. восстановление альдегидов
3. дегидратация первичных спиртов
4. гидрирование алкенов
5. образование сложных эфиров
В качестве удобрений используют нитраты:
1) аммония
2) бария
3) меди (II)
4) ртути (II)
5) калия
На открытом пламени горелки нельзя нагревать колбу с:
1. 15%-ным раствором серной кислоты
2. водным раствором уксусной кислоты
3. спиртовым раствором КОН
4. раствором брома в гексане
5. раствором иода в тетрахлорметане
Установите соответствие между аппаратом химической промышленности и процессом, протекающем в этом аппарате: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
АППАРАТ
А) ректификационная колонна
Б) колонна синтеза
В) контактный аппарат
Г) поглотительная башня
ПРОЦЕСС
1) синтез метанола
2) перегонка нефти
3) окисление сернистого газа
4) взаимодействие оксида серы(VI) с серной кислотой
5) очистка сернистого газа
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) азотная кислота
Б) платина
В) сера
Г) фенол
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) в качестве катализатора
2) в качестве топлива
3) получение резины
4) производство селитры
5) получение пластмасс
Установите соответствие между названием химического продукта и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ПРОДУКТА
А) чугун
Б) метан
В) фенол
Г) лигроин
СПОСОБ ПОЛУЧЕНИЯ
1) выплавка в конвертере
2) выделение из каменноугольной смолы
3) выделение из природного газа
4) выплавка в доменной печи
5) перегонка нефти
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) ацетилен
Б) этиленгликоль
В) пропан
Г) тринитроглицерин
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) в составе незамерзающих жидкостей
2) в качестве топлива
3) получение каучука
4) сварка и резка металлов
5) в качестве лекарственного средства
В качестве удобрений используют нитраты
1) аммония
2) алюминия
3) железа(II)
4) железа(III)
5) калия