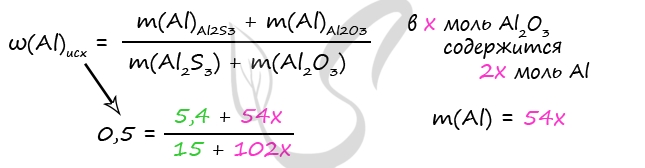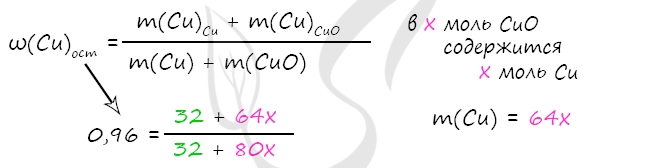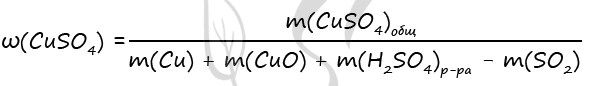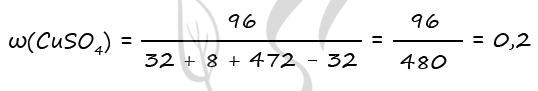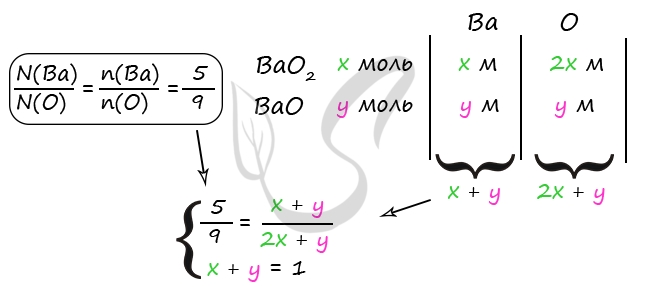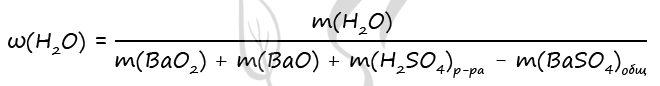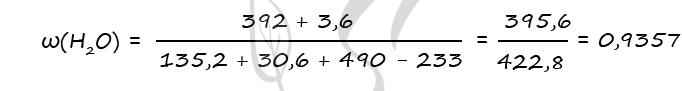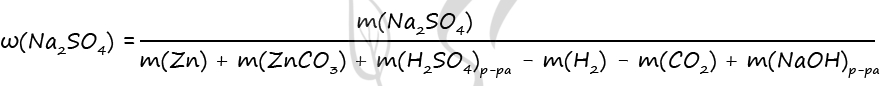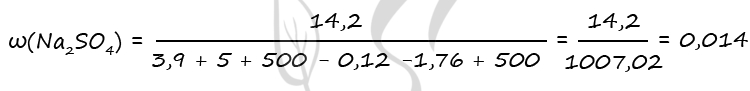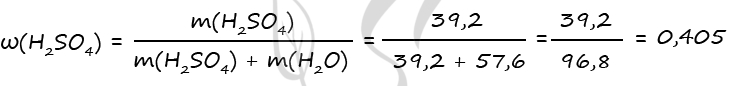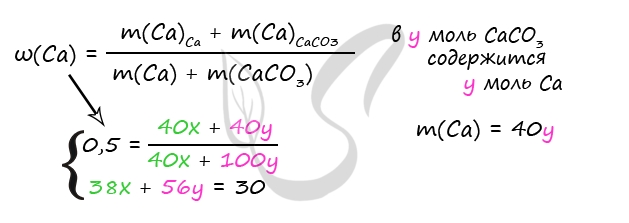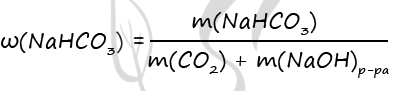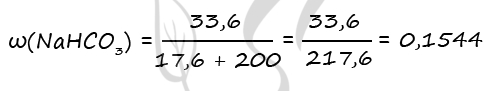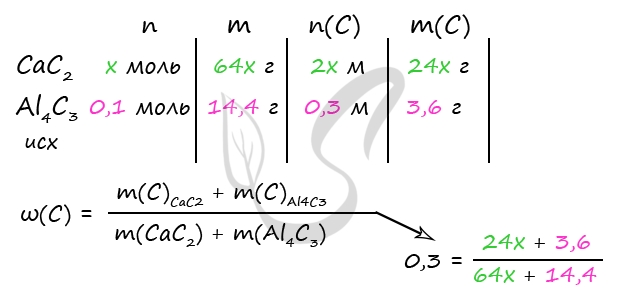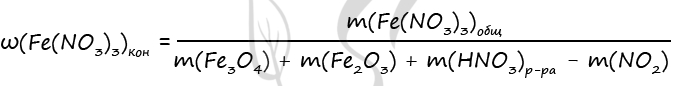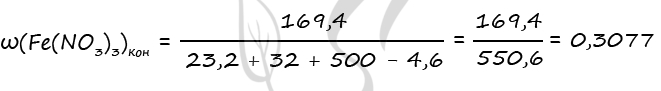Задания
Версия для печати и копирования в MS Word
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения.
В уравнениях приведите структурные формулы органических веществ.
Спрятать решение
Решение.
Написаны пять уравнений реакций, соответствующих схеме превращений:
1)
2)
3)
4)
5)
Спрятать критерии
Критерии проверки:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Правильно записаны 5 уравнений реакций | 5 |
| Правильно записаны 4 уравнения реакций | 4 |
| Правильно записаны 3 уравнения реакций | 3 |
| Правильно записаны 2 уравнения реакций | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 5 |
Спрятать решение
·
·
Hey Johnny 16.06.2017 13:09
в третьей реакции должен получиться кетон, а не кислота, — вторичный спирт же !
Ирина Широкова
В столь жестких условиях реакция идет с образованием кислоты.
-
Типы задач в задании 33.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Дополнение по определению структурной формулы:
-
Ответы и комментарии к задачам для самостоятельного решения.
Автор статьи — профессиональный репетитор О. В. Овчинникова.

- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки при написании требуемых уравнений реакций с участием найденного вещества.
к оглавлению ▴
Типы задач в задании 33.
- 1. Определение молекулярной формулы вещества по массовым долям химических элементов или по общей формуле вещества, а затем его структурной формулы по химическим свойствам;
- 2. Определение молекулярной формулы вещества по продуктам сгорания, а затем его структурной формулы по химическим свойствам.
Стоит отметить, что во всех подобных заданиях ЕГЭ требуется написать уравнение реакции, в котором принимает участие искомое вещество. Так что знание реакций тоже необходимо.
к оглавлению ▴
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе составасодержится
атома углерода и
атома водорода. Если взять
молекулу такого вещества, то его молекулярная масса будет равна:
а.е.м. и там содержится
а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
или
Если вещество имеет общую формулу
, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса
атомов
равна
, масса
атомов
, масса
атомов кислорода
Тогда
Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например,
— истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение, т.е. простейшая формула бензола —
.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол Бутен Уксусная кислота Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа
по газу
Относительная плотность
— это величина, которая показывает, во сколько раз газ
тяжелее газа
. Её рассчитывают как отношение молярных масс газов
и
:
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа
по водороду:
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за
г/моль (исходя из примерного усреднённого состава).
Поэтому: - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса
л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
Если взять
моль газа, то тогда:
,
а молярную массу газа можно найти, умножая плотность на молярный объём.
- Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы — Алкены Алкины Диены — Гомологи бензола Предельные одноатомные спирты Многоатомные спирты Предельные альдегиды Кетоны Фенолы Предельные карбоновые кислоты Сложные эфиры Амины Аминокислоты (предельные одноосновные)
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
-
Пример 1.
Определить формулу вещества, если оно содержити
и имеет относительную плотность по воздуху, равную
.
Решение примера 1.
- Пусть масса вещества равна
г. Тогда масса
будет равна
г, а масса
г.
- Найдём количество вещества каждого атома:
моль,
моль.
- Определяем мольное соотношение атомов
и
:
(сократим оба числа на меньшее)
(домножим на
)
Таким образом, простейшая формула
. Однако вещества с такой формулой не существует. Для нахождения молекулярной формулы нам потребуется домножать простейшую формулу на небольшие числа: 2, 3 и т. п. Например при домножении эмпирической формулы на 2 мы получаем алкан, имеющий в своём составе 8 атомов углерода:
.
Чтобы проверить, правильна ли найденная нами формула, необходимо использовать дополнительные данные, которые всегда указаны в задаче. Это могут быть либо химические свойства вещества, либо информация, позволяющая вычислить его молярную массу. В данном случае дана относительная плотность соединения по воздуху. - По относительной плотности рассчитаем молярную массу:
г/моль.
Молярная масса, соответствующая простейшей формуле
г/моль, это в
раза меньше истинно молярной массы.
Значит, истинная формула
.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу ( г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
т.е. число атомов
т.е число атомов
Формула вещества .
-
Пример 2.
Определить формулу алкина с плотностьюг/л при нормальных условиях.
Решение примера 2.
Общая формула алкина
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность — это масса
литра газа при нормальных условиях.
Так как моль вещества занимает объём
л, то необходимо узнать, сколько весят
л такого газа:
плотность
молярный объём
г/л
л/моль =
г/моль.
Далее, составим уравнение, связывающее молярную массу и :
Значит, алкин имеет формулу
-
Пример 3.
Определить формулу предельного альдегида, если известно, чтомолекул этого альдегида весят
г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в моль вещества.
Это число Авогадро: (молекул).
Значит, можно найти количество вещества альдегида:
моль,
и молярную массу:
г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим .
Общая формула предельного альдегида , то есть
.
-
Пример 4.
Определить формулу дихлоралкана, содержащегоуглерода.
Решение примера 4.
Общая формула дихлоралкана: , там
атома хлора и
атомов углерода.
Тогда массовая доля углерода равна:
число атомов
в молекуле
атомная масса
молекулярная масса дихлоралкана
вещество — дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось
г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) —
Тогда схема реакции сгорания выглядит так:
Нетрудно заметить, что при сгорании
моль алкана выделится
моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
моль.
- При пропускании углекислого газа через известковую воду
выпадает осадок карбоната кальция:
Масса осадка карбоната кальция —
г, молярная масса карбоната кальция
г/моль.
Значит, его количество вещества
моль.
Количество вещества углекислого газа тоже
моль.
- Количество углекислого газа в
раза больше чем алкана, значит формула алкана
.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна. При сжигании
г этого соединения образуется
л углекислого газа (н. у) и
г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов и, возможно,
. Поэтому его общую формулу можно записать как
.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду.
- Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
моль.
На одну молекулу
приходится один атом
, значит, углерода столько же моль, сколько
.
моль
моль.
В одной молекуле воды содержатся два атома
, значит количество водорода в два раза больше, чем воды.
моль.
- Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
- Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
Простейшая формула
.
- Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул
и его молярная масса
г/моль):
г/моль.
Истиная формула
, её молярная масса
.
Истинная формула
.
-
Пример 7.
Определите молекулярную формулу вещества, при сгоранииг которого образовалось
г
г воды и азот. Относительная плотность этого вещества по водороду —
. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы
и
. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения: - Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
- Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
г ,
моль.
Простейшая формула —
Истинная молярная масса
г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
-
Пример 8.
Вещества содержити
. При сгорании
г его выделилось
г
г
, а сера была полностью переведена в сульфат бария, масса которого оказалась равна
г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
моль.
моль.
моль.
моль.
моль.
моль.
- Рассчитываем предполагаемую массу кислорода в исходном веществе:
- Находим мольное соотношение элементов в веществе:
Формула вещества
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы
получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветитьг
-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов —
.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с
моль диена вступят
моль брома:
- Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
г
моль.
- Так как количество брома, вступившего в реакцию, в
раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через
:
Это пентадиен
.
-
Пример 10.
При взаимодействииг предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования
мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта —
Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой
.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
- Находим молярную массу спирта и
:
Спирт — бутанол
.
-
Пример 11.
Определить формулу сложного эфира, при гидролизег которого выделяется
г спирта и
г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
Соответственно, спирт будет иметь формулу
,
а кислота
.
Уравнение гидролиза сложного эфира:
- Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
= (масса кислоты) + (масса спирта) − (масса эфира) =
г
моль
Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:
г/моль,
г/моль.
Получим два уравнения, из которых найдём
и
:
— уксусная кислота
— этанол.
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
-
Пример 12.
Определить формулу аминокислоты, если при действии наг её избытком гидроксида натрия можно получить
г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно.
- Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что
.
Можно это сделать математически, если принять, что
.
.
Это аланин — аминопропановая кислота.
Однако на данном этапе решение задачи не заканчивается. В ней требуется установить и структурную формулу вещества. Вот пример подобного задания:
При сгорании 5,8 г органического вещества образуется 6,72 л углекислого газа и 5,4 г воды. Плотность паров этого вещества по воздуху равна 2.
Установлено, что это вещество не взаимодействует с аммиачным раствором оксида серебра, но каталитически восстанавливается водородом с образованием вторичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты и углекислого газа. На основании этих данных:
1) установите простейшую формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с водородом.
(источник: Типовые тестовые задания по химии, под редакцией Ю. Н. Медведева. 2015 г.)
В первой части задачи в результате вычислений мы находим молекулярную формулу соединения: C3H6O. Затем начинаем путём логических размышлений находить структурную формулу. Общая формула CnH2nO характерна для альдегидов и кетонов, так же возможно предположить спирт: пропен-2-ол-1 (напомним: соединение с гидроксильной группы у атома углерода, образующего двойную связь является неустойчивым). Во-первых, данное вещество не подвергается окислению аммиачным раствором оксида серебра, значит, это не альдегид. Во-вторых, данное вещество каталитически восстанавливается водородом с образованием вторичного спирта, а значит, это не спирт. Единственный оставшийся вариант – кетон, а именно – ацетон. Подтверждает это и возможность окисления соединения кислым перманганатом калия до углекислого газа и карбоновой кислоты. Написание уравнения реакции уже не должно вызвать затруднений.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна г/л. Массовая доля углерода в нем равна
. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна , массовая доля азота равна
. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна . Выведите молекулярную формулу карбоновой кислоты.
1–4. л алкадиена при н.у. имеет массу, равную
г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна . При сжигании
г этого вещества образуется
г углекислого газа (н.у.) и
г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой г в избытке кислорода получили
г азота,
л (н.у.)
и
г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится
молекул.
2–3. Углекислый газ, полученный при сгорании г углеводорода, пропустили через избыток раствора гидроксида кальция и получили
г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего и хлор, выделилось
л (н.у.) углекислого газа,
г воды,
г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось л (н.у.) углекислого газа,
г воды и
л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он г его при присоединении воды образуют
г спирта.
3–2. Для окисления г предельного альдегида до кислоты потребовалось
г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой г с избытком бромоводорода образует
г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой г с избытком калия выделилось
л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили г альдегида,
г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Дополнение по определению структурной формулы:
Д-1. Дана молекулярная формула: C2H6O. Искомое вещество газообразно при н. у., не реагирует с металлическим натрием и может быть получено дегидратацией спирта. Установите его структурную формулу.
Д-2. Дана молекулярная формула: C3H8O2. Искомое вещество реагирует с натрием, а при дегидратации под действием серной кислоты превращается в соединение, содержащее шестичленный цикл. Установите его структурную формулу.
Д-3. Дана молекулярная формула: C2H7NO. Искомое вещество представляет собой бесцветную, вязкую жидкость с запахом аммиака. Оно реагирует и с натрием, и с азотистой кислотой, причём в обоих случаях выделяется газ. Установите его структурную формулу.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1.
1–2.
1–3.
1–4.
1–5. — формиат кальция, соль муравьиной кислоты
2–1.
2–2.
2–3. (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. (не забудьте, что атомы водорода содержатся не только в воде, но и в
)
2–5.
3–1.
3–2.
3–3.
3–4.
3–5.
Д–1.
Д–2.
Д–3.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Задача 33 на ЕГЭ по химии. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.03.2023
Тренировочный вариант ЕГЭ по химии-2023 10 декабря 2022 с ответами и решениями.
Скачать тренировочный вариант ЕГЭ по химии 10 декабря 2022 года можно здесь.
19
Тренировочный вариант ЕГЭ по химии-2023
1 / 25
Установите соответствие между волокном и его типом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЛОКНО | ТИП ВОЛОКНА |
| А) вискоза Б) триацетатный шёлк В) лавсан |
1) натуральное 2) искусственное 3) синтетическое 4) минеральное |
Запишите в таблицу выбранные цифры под соответствующими буквами.
2 / 25
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) цинк и раствор гидроксида натрия
Б) хлорид бария и сульфат меди (II) В) сульфид натрия и сульфат меди(II) Г) сульфат алюминия и раствор аммиака |
1) выпадение белого осадка
2) выделение газа без запаха 3) выделение газа с запахом 4) выпадение чёрного осадка 5) выпадение голубого осадка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
3 / 25
В реактор постоянного объёма поместили водород и пары воды. При этом исходная концентрация йода составляла 0,6 моль/л. В результате протекания обратимой реакции
H2(г) + I2(г) ↔ 2HI(г)
в реакционной системе установилось химическое равновесие, при котором концентрации водорода и йодоводорода составили 0,3 моль/л и 0,6 моль/л соответственно. Определите исходную концентрацию H2 (X) и равновесную концентрацию I2 (Y). Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
4 / 25
Установите соответствие между способом воздействия на равновесную систему
2СO(г) + O2(г) ↔ 2СO2(г) + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) увеличение концентрации угарного газа
Б) добавление катализатора В) повышение температуры Г) повышение давления |
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции 3) практически не смещается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
5 / 25
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
21. Для веществ, приведенных в перечне, определите характер среды и водных растворов.
1) ZnSO4
2) LiOH
3) KNO2
4) Ba(NO3)2
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрации веществ во всех растворах (моль/л) одинаковая.
6 / 25
Установите соответствие между веществом и продуктами электролиза водного раствора этого вещества на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) NaNO3
Б) BaCl2 В) Al2(SO4)3 |
1) металл и галоген
2) водород и галоген 3) водород и кислород 4) металл, водород и кислород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
7 / 25
Установите соответствие между анионом и свойством, которое может проявлять сера в составе этого аниона: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АНИОН | СВОЙСТВО СЕРЫ |
| А) сульфат
Б) сульфид В) сульфит |
1) только окислитель
2) только восстановитель 3) и окислитель, и восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
8 / 25
Из предложенного перечня выберите все внешние воздействия, которые приводят к увеличению скорости химической реакции ацетона с водородом.
1) повышение давления в системе
2) уменьшение концентрации водорода
3) добавление катализатора
4) понижение температуры
5) увеличение объема сосуда
Запишите в поле ответа номера выбранных внешних воздействий.
9 / 25
Из предложенного перечня выберите все типы реакции, к которым можно отнести взаимодействие ацетальдегида с гидроксидом меди(II).
1) реакция нейтрализации
2) окислительно-восстановительная реакция
3) реакция гидратации
4) обратимая реакция
5) гетерогенная реакция
Запишите в поле ответа номера выбранных типов реакций.
10 / 25
Задана следующая схема превращений веществ:
Х → Y → циклогексен
Определите, какие из указанных веществ являются веществами X и Y.
1) бензол
2) толуол
3) фенол
4) циклогексанол
5) циклогексанон
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
11 / 25
Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО Х |
| А) Х Б) Х В) Х Г) Х |
1) метанол
2) этанол 3) бутанол-1 4) фенол 5) этилацетат 6) метиловый эфир муравьиной кислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
12 / 25
Установите соответствие между реагирующими веществами и продуктом их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) 1,2-дихлорпропан и цинк
Б) 1,2-дихлорпропан и гидроксид натрия (спирт.) В) 1-хлорпропан и натрий Г) 1,1-дихлорпропан и гидроксид натрия (водный) |
1) пропаналь
2) ацетон 3) н-гексан 4) пропанол-1 5) пропен 6) пропин |
Запишите в таблицу выбранные цифры под соответствующими буквами.
13 / 25
Из предложенного перечня выберите два вещества, которые можно получить щелочным гидролизом жиров.
1) этандиол-1,2
2) пропантриол-1,2,3
3) ацетат натрия
4) олеат натрия
5) бензоат натрия
Запишите в поле ответа номера выбранных веществ.
14 / 25
Из предложенного перечня выберите все вещества, которые можно получить при взаимодействии пропанола-1 с концентрированной серной кислотой при нагревании.
1) пропаналь
2) пропанол-2
3) пропен
4) дипропиловый эфир
5) пропиловый эфир пропионовой кислоты
Запишите номера выбранных ответов.
15 / 25
Из предложенного перечня выберите два вещества, которые являются изомерами бутанола-2.
1) этилацетат
2) бутаналь
3) диэтиловый эфир
4) метилпропанол-2
5) бутанон
Запишите номера выбранных ответов.
16 / 25
Установите соответствие между общей формулой гомологического ряда и названием вещества, которое может принадлежать к этому ряду: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОБЩАЯ ФОРМУЛА | НАЗВАНИЕ ВЕЩЕСТВА |
| А) CnH2n
Б) CnH2n-2 В) CnH2n-8 |
1) стирол
2) изопрен 3) циклооктан 4) толуол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
17 / 25
Задана следующая схема превращений веществ:
1) Cu
2) Cl2
3) HCl (раствор)
4) Cu(OH)2
5) AgCl
Запишите в таблицу выбранные цифры под соответствующими буквами.
18 / 25
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ(Ы) РЕАКЦИИ |
| А) K2Cr2O7 и KOH (р-р)
Б) K2CrO4 и H2SO4 (р-р) В) KCrO2 и H2SO4 (р-р) Г) Cr2(SO4)3 (изб.) и KOH (р-р) |
1) K3[Cr(OH)6]
2) K2SO4, K2Cr2O7 и H2O 3) K2CrO4 и H2O 4) Cr(OH)3 и K2SO4 5) K2SO4, Cr2(SO4)3 и H2O 6) K2SO4 и CrSO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
19 / 25
Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) Mg
Б) ZnO В) BaCl2 Г) NaOH |
1) CO2, N2, H2SO4
2) Na2O, HNO3, CO 3) K3PO4, K2SO4, AgF 4) Li, O2, HNO3 5) NaHCO3, HBr, CO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
20 / 25
Даны две пробирки с раствором вещества Х. В одну из них добавили соляную кислоту, а в другую — раствор вещества Y. При этом в каждой пробирке наблюдали выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) Al2S3
2) AlCl3
3) FeSO4
4) ZnSO3
5) Na2CO3
21 / 25
Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия А) щёлочи; Б) кислой соли; В) кислотного оксида.
| (1) N2O | (2) Cr(OH)2 | (3) питьевая сода | |
| (4) негашёная известь | (5) угарный газ | (6) гашёная известь | |
| (7) NH4I | (8) CrO3 | (9) гидроксокарбонат меди (II) |
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
22 / 25
Из предложенного перечня выберите два вещества с ионной кристаллической решеткой, в которых присутствует ковалентная полярная химическая связь.
1) NH4Br
2) PCl3
3) Na2O2
4) BaBr2
5) NaClO3
Запишите в поле ответа номера выбранных веществ.
23 / 25
Для выполнения задания 3 используйте следующий ряд химических элементов:
1) Cl; 2) F; 3) Mn; 4) Fe; 5) N.
Ответом в задании 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Из числа указанных в ряду химических элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степени окисления. Запишите номера выбранных элементов.
24 / 25
Для выполнения задания 2 используйте следующий ряд химических элементов:
1) Cl; 2) F; 3) Mn; 4) Fe; 5) N.
Ответом в задании 2 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке возрастания кислотности образуемых ими летучих водородных соединений. Запишите номера выбранных элементов в нужной последовательности.
25 / 25
1) Cl; 2) F; 3) Mn; 4) Fe; 5) N.
Ответом в задании 1 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных в ряду элементов имеют одинаковую конфигурацию внешнего энергетического уровня. Запишите номера выбранных элементов.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
1) Cl; 2) F; 3) Mn; 4) Fe; 5) N
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1. Определите, атомы каких из указанных в ряду элементов имеют одинаковую конфигурацию внешнего энергетического уровня. Запишите номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке возрастания кислотности образуемых ими летучих водородных соединений. Запишите номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду химических элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степени окисления. Запишите номера выбранных элементов.
4. Из предложенного перечня выберите два вещества с ионной кристаллической решеткой, в которых присутствует ковалентная полярная химическая связь.
1) NH4Br
2) PCl3
3) Na2O2
4) BaBr2
5) NaClO3
Запишите в поле ответа номера выбранных веществ.
5. Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия А) щёлочи; Б) кислой соли; В) кислотного оксида.
| (1) N2O | (2) Cr(OH)2 | (3) питьевая сода | |
| (4) негашёная известь | (5) угарный газ | (6) гашёная известь | |
| (7) NH4I | (8) CrO3 | (9) гидроксокарбонат меди (II) |
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
6. Даны две пробирки с раствором вещества Х. В одну из них добавили соляную кислоту, а в другую — раствор вещества Y. При этом в каждой пробирке наблюдали выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) Al2S3
2) AlCl3
3) FeSO4
4) ZnSO3
5) Na2CO3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) Mg
Б) ZnO В) BaCl2 Г) NaOH |
1) CO2, N2, H2SO4
2) Na2O, HNO3, CO 3) K3PO4, K2SO4, AgF 4) Li, O2, HNO3 5) NaHCO3, HBr, CO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
8. Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ(Ы) РЕАКЦИИ |
| А) K2Cr2O7 и KOH (р-р)
Б) K2CrO4 и H2SO4 (р-р) В) KCrO2 и H2SO4 (р-р) Г) Cr2(SO4)3 (изб.) и KOH (р-р) |
1) K3[Cr(OH)6]
2) K2SO4, K2Cr2O7 и H2O 3) K2CrO4 и H2O 4) Cr(OH)3 и K2SO4 5) K2SO4, Cr2(SO4)3 и H2O 6) K2SO4 и CrSO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
9. Задана следующая схема превращений веществ:
1) Cu
2) Cl2
3) HCl (раствор)
4) Cu(OH)2
5) AgCl
Запишите в таблицу выбранные цифры под соответствующими буквами.
10. Установите соответствие между общей формулой гомологического ряда и названием вещества, которое может принадлежать к этому ряду: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОБЩАЯ ФОРМУЛА | НАЗВАНИЕ ВЕЩЕСТВА |
| А) CnH2n
Б) CnH2n-2 В) CnH2n-8 |
1) стирол
2) изопрен 3) циклооктан 4) толуол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
11. Из предложенного перечня выберите два вещества, которые являются изомерами бутанола-2.
1) этилацетат
2) бутаналь
3) диэтиловый эфир
4) метилпропанол-2
5) бутанон
Запишите номера выбранных ответов.
12. Из предложенного перечня выберите все вещества, которые можно получить при взаимодействии пропанола-1 с концентрированной серной кислотой при нагревании.
1) пропаналь
2) пропанол-2
3) пропен
4) дипропиловый эфир
5) пропиловый эфир пропионовой кислоты
Запишите номера выбранных ответов.
13. Из предложенного перечня выберите два вещества, которые можно получить щелочным гидролизом жиров.
1) этандиол-1,2
2) пропантриол-1,2,3
3) ацетат натрия
4) олеат натрия
5) бензоат натрия
Запишите в поле ответа номера выбранных веществ.
14. Установите соответствие между реагирующими веществами и продуктом их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) 1,2-дихлорпропан и цинк
Б) 1,2-дихлорпропан и гидроксид натрия (спирт.) В) 1-хлорпропан и натрий Г) 1,1-дихлорпропан и гидроксид натрия (водный) |
1) пропаналь
2) ацетон 3) н-гексан 4) пропанол-1 5) пропен 6) пропин |
Запишите в таблицу выбранные цифры под соответствующими буквами.
15. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО Х |
| А) Х Б) Х В) Х Г) Х |
1) метанол
2) этанол 3) бутанол-1 4) фенол 5) этилацетат 6) метиловый эфир муравьиной кислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
16. Задана следующая схема превращений веществ:
Х → Y → циклогексен
Определите, какие из указанных веществ являются веществами X и Y.
1) бензол
2) толуол
3) фенол
4) циклогексанол
5) циклогексанон
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
17. Из предложенного перечня выберите все типы реакции, к которым можно отнести взаимодействие ацетальдегида с гидроксидом меди(II).
1) реакция нейтрализации
2) окислительно-восстановительная реакция
3) реакция гидратации
4) обратимая реакция
5) гетерогенная реакция
Запишите в поле ответа номера выбранных типов реакций.
18. Из предложенного перечня выберите все внешние воздействия, которые приводят к увеличению скорости химической реакции ацетона с водородом.
1) повышение давления в системе
2) уменьшение концентрации водорода
3) добавление катализатора
4) понижение температуры
5) увеличение объема сосуда
Запишите в поле ответа номера выбранных внешних воздействий.
19. Установите соответствие между анионом и свойством, которое может проявлять сера в составе этого аниона: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АНИОН | СВОЙСТВО СЕРЫ |
| А) сульфат
Б) сульфид В) сульфит |
1) только окислитель
2) только восстановитель 3) и окислитель, и восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
20. Установите соответствие между веществом и продуктами электролиза водного раствора этого вещества на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) NaNO3
Б) BaCl2 В) Al2(SO4)3 |
1) металл и галоген
2) водород и галоген 3) водород и кислород 4) металл, водород и кислород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
21. Для веществ, приведенных в перечне, определите характер среды и водных растворов.
1) ZnSO4
2) LiOH
3) KNO2
4) Ba(NO3)2
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрации веществ во всех растворах (моль/л) одинаковая.
22. Установите соответствие между способом воздействия на равновесную систему
2СO(г) + O2(г) ↔ 2СO2(г) + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) увеличение концентрации угарного газа
Б) добавление катализатора В) повышение температуры Г) повышение давления |
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции 3) практически не смещается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
23. В реактор постоянного объёма поместили водород и пары воды. При этом исходная концентрация йода составляла 0,6 моль/л. В результате протекания обратимой реакции
H2(г) + I2(г) ↔ 2HI(г)
в реакционной системе установилось химическое равновесие, при котором концентрации водорода и йодоводорода составили 0,3 моль/л и 0,6 моль/л соответственно. Определите исходную концентрацию H2 (X) и равновесную концентрацию I2 (Y). Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
24. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) цинк и раствор гидроксида натрия
Б) хлорид бария и сульфат меди (II) В) сульфид натрия и сульфат меди(II) Г) сульфат алюминия и раствор аммиака |
1) выпадение белого осадка
2) выделение газа без запаха 3) выделение газа с запахом 4) выпадение чёрного осадка 5) выпадение голубого осадка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
25. Установите соответствие между волокном и его типом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЛОКНО | ТИП ВОЛОКНА |
| А) вискоза Б) триацетатный шёлк В) лавсан |
1) натуральное 2) искусственное 3) синтетическое 4) минеральное |
Запишите в таблицу выбранные цифры под соответствующими буквами.
26. Какую массу 15%-ного раствора нитрата натрия надо взять, чтобы при добавлении 12 г этой же соли и одновременном выпаривании 12 г воды получить раствор с массовой долей соли 18%? Ответ выразите в граммах. (Запишите число с точностью до целых).
27. На основании термохимического уравнения реакции:
CH4 + 2O2 = CO2 + 2H2O + 893 кДж
определите объем затраченного кислорода, если известно, что при этом выделилось 357,2 кДж теплоты. Ответ выразите в литрах. (Запишите число точностью до сотых.)
28. При пропускании над нагретым оксидом меди(II) 5,6 л (н.у.) смеси аммиака с азотом было получено 19,2 г меди. Определите объемную долю примеси азота в исходной газовой смеси. (Запишите число с точностью до целых.)
Для выполнения заданий 29 и 30 используйте следующий перечень веществ: гипохлорит натрия, хлорид хрома(II), гидроксид натрия, нитрат серебра, нитрит натрия, соляная кислота.
Допустимо использование водных растворов веществ.
29. Из предложенного перечня веществ выберите вещества, окислительно восстановительная реакция между которыми протекает с образованием желтого раствора. Запишите уравнение только с одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
CrCl2 + 2NaClO + 4NaOH = Na2CrO4 + 4NaCl + 2H2O
Cr+2 — 4e = Cr+6 | 1
Cl+ + 2e = Cl— | 2
CrCl2 — восставновитель за счет Cr+2
NaClO — окислитель за счет Cl+
30. Из предложенного перечня веществ выберите соль и вещество, между которыми возможна реакция ионного обмена, протекающая без выделения газа и выпадения осадка. Запишите молекулярное, ионное и сокращенное ионное уравнение только одной возможной реакции.
NaNO2 + HCl → NaCl + HNO2
Na+ + NO2— + H+ + Cl— → Na+ + Cl— + HNO2
NO2— + H+ → HNO2
31. Карбонат калия сплавили с кремнезёмом. Выделившийся при этом газ собрали и сожгли в нем магний. Образовавшееся простое вещество нагрели с алюминием. Продукт реакции обработали водой. Напишите уравнения четырех описанных реакций.
K2CO3 + SiO2 → K2SiO3 + CO2
2Mg + CO2 → 2MgO + C
4Al + 3C → Al4C3
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
Решение:
CH3-CH(OH)-CH3 + HBr = CH3-CHBr-CH3 + H2O
Набирается
33. При сгорании 6,7 г (н.у.) органического вещества А получили 8,96 л (н.у.) углекислого газа и 2,7 г воды. Известно, что вещество А не вступает в реакцию гидрохлорирования, а его молекула содержит два заместителя, которые максимально удалены друг от друга. Известно также, что вещество А может быть получено щелочным гидролизом тетрахлорсодержащего вещества Б.
На основании данных условий задания:
1) проведите необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин) и установите молекулярную формулу вещества А;
2) Составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) Напишите уравнение реакции получения вещества А щелочным гидролизом тетрахлорсодержащего вещества Б.
n(CO2) = 8,96 / 22,4 = 0,4 моль; n(C) = 0,4 моль
n(H2O) = 2,7 / 18 = 0,15 моль; n(H) = 0,15 · 2 = 0,3 моль
m(O) = 6,7 — 0,4 · 12 — 0,3 · 1 = 1,6 г
n(О) = 1,6/16 = 0,1 моль
СхНyOz
x:y:z = 0,4:0,3:0,1 = 4:3:1
Простейшая формула С4Н3O
Молекулярная формула вещества А — C8H6O2
Структурная формула вещества А :
34. Через 500 г раствора хлорида бария, в котором 47% от общей массы раствора составляет масса нейтронов в ядрах всех атомов, пропускали электрический ток до тех пор, пока на аноде не выделилось 896 мл (н.у.) газа. К образовавшемуся в результате электролиза раствору добавили 63,6 г карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Ответы на вариант ЕГЭ по химии-2023
| № задания | Ответ | № задания | Ответ | № задания | Ответ |
| 1 | 34 | 11 | 34 | 21 | 1432 |
| 2 | 521 | 12 | 34 | 22 | 1321 |
| 3 | 15 | 13 | 24 | 23 | 63 |
| 4 | 15 | 14 | 5631 | 24 | 2141 |
| 5 | 638 | 15 | 1426 | 25 | 223 |
| 6 | 52 | 16 | 54 | 26 | 400 |
| 7 | 1235 | 17 | 25 | 27 | 17,92 |
| 8 | 3254 | 18 | 13 | 28 | 0,2 |
| 9 | 12 | 19 | 123 | ||
| 10 | 321 | 20 | 323 |
Ответы на вторую часть можете найти выше.
7935. Смесь оксида алюминия и сульфида алюминия, в которой массовая доля алюминия составляет 50%, растворили в избытке 700 г соляной кислоты. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди (II), причём исходные вещества прореагировали без остатка. Вычислите массовую долю соли, образовавшейся при взаимодействии исходной твёрдой смеси с соляной кислотой.

1) Уравнения реакций
Al2O3 + 6HCl = 2AlCl3 + 3H2O (1)
Al2S3 + 6HCl = 2AlCl3 + 3H2S↑ (2)
H2S + CuSO4 = CuS↓ + H2SO4 (3)
2) Вычислим количество Al2O3
m(CuSO4) = 240 ⋅ 0,2 = 48 г
n(CuSO4) = 48 : 160 = 0,3 моль
n(CuSO4) = n(H2S) = 0,3 моль (по уравнению 3)
n(Al2S3) = 1/3 ⋅ n(H2S) = 1/3 ⋅ 0,3 = 0,1 моль (по уравнению 2)
m(Al2S3) = 0,1 ⋅ 150 = 15 г
n(Al)в Al2S3 = n(Al2S3) ⋅ 2 = 0,1 ⋅ 2 = 0,2 моль
m(Al)в Al2S3 = 0,2 ⋅ 27 = 5,4 г
Примем x = n(Al2O3)
n(Al)в Al2O3 = n(Al) ⋅ 2 = 2x моль
m(Al2O3) = x ⋅ 102 = 120x (г)
m(Al)в Al2O3 = 2x ⋅ 27 = 54x (г)
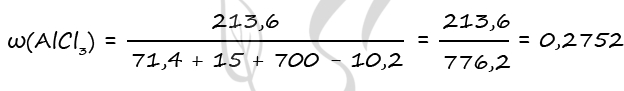
Решив уравнение получим x = 0,7 = n(Al2O3)
3) Рассчитаем массовую долю хлорида алюминия
n1(AlCl3) = 2n(Al2O3) = 2 ⋅ 0,7 = 1,4 моль (по уравнению 1)
n2(AlCl3) = 2n(Al2S3) = 2 ⋅ 0,1 = 0,2 моль (по уравнению 2)
n(AlCl3)общ = 1,4 + 0,2 = 1,6 моль
m(AlCl3)общ = 1,6 ⋅ 133,5 = 213,6 г
m(Al2O3) = 0,7 ⋅ 102 = 71,4 г
m(H2S) = 0,3 ⋅ 34 = 10,2 г
Ответ: ω(AlCl3) = 27,52%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7935.
7900. Смесь меди и оксида меди (II), в которой массовая доля атомов меди составляет 96%, растворили в концентрированной серной кислоте массой 472 г, взятой в избытке. Полученный газ растворили в минимальном количестве раствора гидроксида натрия массой 200 г с массовой долей щёлочи 10%. Вычислите массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой.

1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O (1)
CuO + H2SO4 = CuSO4 + H2O (2)
NaOH + SO2 = NaHSO3 (3)
2) Вычислим массу CuO
m(NaOH) = 200 ⋅ 0,1 = 20 г
n(NaOH) = 20 : 40 = 0,5 моль
n(NaOH) = n(SO2) = n(Cu) = 0,5 по уравнению 1 и 3
m(Cu) = 0,5 ⋅ 64 = 32 г
Примем x = n(CuO) = n(Cu)в CuO, тогда
m(Cu)в CuO = x ⋅ 64 = 64x (г)
m(CuO) = x ⋅ 80 = 80x (г)
В результате вычислений x = 0,1 моль = n(CuO)
m(CuO) = 0,1 ⋅ 80 = 8 г
3) Рассчитаем массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой
n(Cu) = n(SO2) = n1(CuSO4) = 0,5 моль (по уравнению 1)
n(CuO) = n2(CuSO4) = 0,1 моль (по уравнению 2)
n(CuSO4)общ = 0,5 + 0,1 = 0,6 моль
m(CuSO4) = 0,6 ⋅ 160 = 96 г
m(SO2) = 0,5 ⋅ 64 = 32 г
Ответ: ω(CuSO4) = 20%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7900.
7865. К смеси пероксида и оксида бария, где отношение количества атомов бария к количеству атомов кислорода равно 5:9, добавили 490 г холодного 20%-го раствора серной кислоты. В результате соединения бария прореагировали полностью, а полученный раствор оказался нейтральным. Найдите массовую долю воды в образовавшемся растворе.

1) Уравнения реакций
BaO2 + H2SO4 = BaSO4↓ + H2O2 (1)
BaO + H2SO4 = BaSO4↓ + H2O (2)
2) Вычислим количество вещества оксида бария и пероксида бария
m(H2SO4) = 490 ⋅ 0,2 = 98 г
n(H2SO4) = 98 : 98 = 1 моль
n(H2SO4) = n(исх. смеси) = 1 моль (по уравнению 1)
n(H2SO4) = n(BaO2) (по уравнению 1)
n(H2SO4) = n(BaSO4) (по уравнению 2)
m(H2O)исх = 490 — 98 = 392 г
Решив данную систему получаем y = 0,2 моль = n(BaO), x = 0,8 моль = n(BaO2)
3) Вычислим массовую долю воды в образовавшемся растворе
n(BaO) = n(H2O)образов. в ур-нии 2 = 0,2 моль (по уравнению 2)
n(H2O)образов. = 0,2 ⋅ 18 = 3,6 г
m(BaO2) = 0,8 ⋅ 169 = 135,2 г
m(BaO) = 0,2 ⋅ 153 = 30,6 г
n(BaO2) = n1(BaSO4) = 0,8 моль (по уравнению 1)
n(BaO) = n2(BaSO4) = 0,2 моль (по уравнению 2)
n(BaSO4)общ = 0,8 + 0,2 = 1 моль
m(BaSO4)общ = 1 ⋅ 233 = 233 г
Ответ: ω(H2O) = 93,57%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7865.
7830. Смесь цинка и карбоната цинка, в которой соотношение атомов цинка и кислорода 5:6, обработали 500 г раствора разбавленной серной кислоты. В результате исходная смесь и кислота прореагировали без остатка и выделилось 2,24 л газов (н.у.). К получившемуся раствору прилили 500 г раствора гидроксида натрия с массовой долей 40%. Найдите массовую долю сульфата натрия в получившемся растворе.

1) Уравнения реакций
Zn + H2SO4 = ZnSO4 + H2↑ (1)
ZnCO3 + H2SO4 = ZnSO4 + H2O + CO2↑ (2)
2) Найдем количество вещества цинка и карбоната цинка
n(CO2+H2) = 2,24 : 22,4 = 0,1 моль
Решив данную систему получим y = n(CO2) = 0,04 моль, x = n(Zn) = 0,06 моль
3) Вычислим количество вещества сульфата цинка и гидроксида натрия
n(Zn) = n1(ZnSO4) = 0,06 моль (по уравнению 1)
n(ZnCO3) = n2(ZnSO4) = 0,04 моль (по уравнению 2)
n(ZnSO4)общ = 0,06 + 0,04 = 0,1 моль
m(NaOH) = 500 ⋅ 0,2 = 200 г
n(NaOH) = 200 : 40 = 5 моль
Сравнивая количество вещества сульфата цинка и гидроксида натрия, можно сделать вывод о том, что гидроксид натрия в избытке — реакция 3 идет с образованием комплексной соли
Zn(SO4) + 4NaOH = Na2[Zn(OH)4] + Na2SO4
4) Вычислим массовую долю сульфата натрия в получившемся растворе
n(ZnSO4)общ = n(Na2SO4) = 0,1 моль (по уравнению 3)
m(Na2SO4) = 0,1 ⋅ 142 = 14,2 г
m(Zn) = 0,06 ⋅ 65 = 3,9 г
m(ZnCO3) = 0,04 ⋅ 125 = 5 г
m(H2) = 0,06 ⋅ 2 = 0,12 г
m(CO2) = 0,04 ⋅ 44 = 1,76 г
Ответ: ω(Na2SO4) = 1,4%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7830.
7795. Смесь твёрдых сульфата железа (II) и сульфата железа (III), в которой соотношение атомов серы и железа 4:3, добавили в подкисленный 5% раствор перманганата калия массой 126,4 г. Все вещества, участвовавшие в окислительно-восстановительной реакции, прореагировали полностью. Рассчитайте максимальную массу 20%-го раствора гидроксида натрия, который прореагирует с полученным раствором.

1) Уравнения реакций
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O (1)
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4 (2)
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4 (3)
2) Вычислим массу исходного сульфата железа (III)
m(KMnO4) = 126,4 ⋅ 0,05 = 6,32 г
n(KMnO4) = 6,32 : 158 = 0,04 моль
n(FeSO4)исх = 5n(KMnO4) = 5 ⋅ 0,04 = 0,2 (по уравнению 1)
По итогу вычислений получаем x = 0,2 моль = n(Fe2(SO4)3)исх
3) Найдем количество вещества MnSO4
n(Fe2(SO4)3)обр = 1/2 ⋅ n(FeSO4) = 1/2 ⋅ 0,2 = 0,1 моль (по уравнению 1)
n(Fe2(SO4)3)общ = 0,2 + 0,1 = 0,3 моль
n(NaOH) = 6n(Fe2(SO4)3)общ = 6 ⋅ 0,3 = 1,8 моль
n(MnSO4) = n(KMnO4) = 0,04 моль
4) Вычислим массу 20%-ного раствора NaOH
n(NaOH) = 2n(MnSO4) = 2 ⋅ 0,04 = 0,08 моль (по уравнению 3)
n(NaOH)общ = 1,8 моль + 0,08 моль = 1,88 моль
m(NaOH) = 1,88 ⋅ 40 = 75,2 г
m(NaOH)р-ра = 75,2 : 0,2 = 376 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7795.
7760. В холодный раствор серной кислоты добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.

1) Уравнения реакций
H2SO4 + BaO2 = BaSO4↓ + H2O2 (1)
2H2O2 = (кат. MnO2) 2H2O + O2↑ (2)
2) Вычислим количество воды в исходном растворе
Δm = m(O2) = 6,4 г
n(O2) = 6,4 : 32 = 0,2 моль
2n(O2) = n(H2O2) = n(H2SO4) = 0,4 моль (по уравнению 1 и 2)
m(H2SO4) = 0,4 ⋅ 98 = 39,2 г
Примем n(H2O) = x моль
В результате вычислений получаем x = 3,2 моль = n(H2O) в исходном растворе
m(H2O)исх = 3,2 ⋅ 18 = 57,6 г
3) Вычислим массовую долю серной кислоты в исходном растворе
Ответ: ω(H2SO4) = 40,5%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7760.
7725. Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в избытке соляной кислоты массой 300 г. После завершения всех реакций масса раствора составила 330 г, а выделившуюся газовую смесь пропустили через 200 г 8%-ного раствор гидроксида натрия. В результате чего один из газов полностью поглотился. Определите массовую долю соли в конечном растворе.

1) Уравнения реакций
Ca + 2HCl = CaCl2 + H2↑ (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
(?) 2NaOH + CO2 = Na2CO3 + H2O (3)
(?) CO2 + NaOH = NaHCO3 (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m(р-ра после реакций 1 и 2) = m(Ca) + m(CaCO3) + m(HCl)р-ра — m(H2) — m(CO2)
3) Примем n(Ca) = x моль, n(CaCO3) = y моль
m(Ca) = 40x (г)
m(CaCO3) = 100y (г)
n(Ca) = n(H2)по ур-нию 1 = x моль; m(H2) = 2x (г)
n(CaCO3) = n(CO2)по ур-нию 2 = y моль; m(CO2) = 44y (г)
Подставим все найденные значения в формулу массы раствора, записанную в пункте 2
330 = 40x + 100y + 300 — 2x — 44y
В результате решения системы получим: x = 0,2 моль = n(Ca), y = 0,4 моль = n(CaCO3)
4) Вычислим количество гидроксида натрия, массу и массовую долю гидрокарбоната натрия
n(CaCO3) = n(CO2) = 0,4 моль (по уравнению 2)
m(NaOH) = 200 ⋅ 0,08 = 16 г
n(NaOH) = 16 : 40 = 0,4 моль
n(CO2) : n(NaOH) = 0,4 моль : 0,4 моль = 1 : 1 (уравнение 4)
n(CO2) = n(NaOH) = n(NaHCO3) = 0,4 моль (по уравнению 4)
m(NaHCO3) = 0,4 ⋅ 84 = 33,6 г
m(CO2) = 0,4 ⋅ 44 = 17,6 г
Ответ: ω(NaHCO3) = 15,44%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7725.
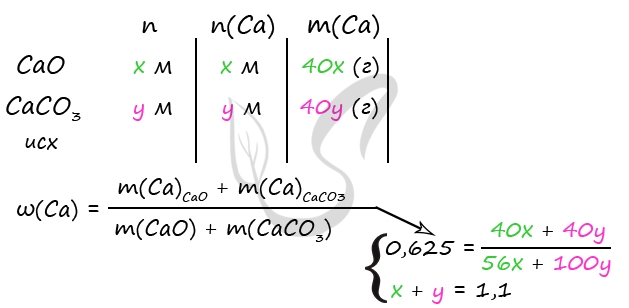
7690. Смесь оксида кальция и карбоната кальция, в которой массовая доля кальция 62,5%, растворили в 300 г соляной кислоты, которая была в избытке. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.

1) Уравнения реакций
CaO + 2HCl = CaCl2 + H2O (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
CO2 + NaOH = NaHCO3 (3)
CO2 + 2NaOH = Na2CO3 + H2O (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m (р-ра после реакции 1, 2) = m(CaO) + m(CaCO3) + m(HCl)р-ра — m(CO2)
3) Примем n(CaO) = x моль, n(CaCO3) = y моль
m(CaO) = 56x (г)
m(CaCO3) = 100y (г)
n(CaCO3) = n(CO2) = y моль (по уравнению 2)
m(CO2) = 44y (г)
Составим систему уравнений:
361,6 = 56x + 100y + 300 — 44y
x + y = 1,1
Решая систему получаем y = 0,2 = n(CaCO3) = n(CO2)
n(CO2) = n(CaCO3) = 0,2 моль
m(NaOH) = 80 ⋅ 0,1 = 8 г
n(NaOH) = 8 : 40 = 0,2 моль
n(NaOH) = n(CO2) (по уравнению 3)
n(CO2) = n(NaOH) = n(NaHCO3) = 0,2 моль
4) Вычислим массовую долю гидрокарбоната натрия в растворе
m(CO2) = 0,2 ⋅ 44 г/моль = 8,8 г
Ответ: ω(NaHCO3) = 18,92%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7690.
7655. Смесь карбида кальция и карбида алюминия, в которой массовая доля углерода 30%, растворили в 547,5 г соляной кислоты, взятой в необходимом стехиометрическом количестве. В полученный раствор добавляли 1260 г 8%-ного раствора гидрокарбоната натрия до завершения реакции. Найдите массовую долю хлороводорода в растворе, в котором растворяли смесь карбидов.

1) Уравнения реакций
CaC2 + 2HCl = CaCl2 + C2H2↑ (1)
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑ (2)
AlCl3 + 3NaHCO3 = Al(OH)3↓ + 3CO2↑ + 3NaCl (3)
CaCl2 + 2NaHCO3 = CaCO3 + CO2 + H2O + 2NaCl (4 — данная реакция не идет, так как ее обязательным условием является нагревание, о котором в тексте задачи не упоминается)
2) Вычислим массу карбида алюминия
m(NaHCO3) = 1260 ⋅ 0,08 = 100,8 г
n(NaHCO3) = 100,8 : 84 = 1,2 моль
n(AlCl3) = 1/3 ⋅ n(NaHCO3) = 1/3 ⋅ 1,2 = 0,4 моль (по уравнению 3)
n(Al4C3) = 1/4 ⋅ n(AlCl3) = 1/4 ⋅ 0,4 = 0,1 моль (по уравнению 2)
m(Al4C3) = 0,1 моль ⋅ 144 г/моль = 14,4 г
3) Вычислим количество вещества карбида кальция
Примем n(CaC2) = x моль
В результате вычислений получим x = 0,15 моль = n(CaC2)
4) Вычислим массовую долю HCl в растворе
n1(HCl) = 2 ⋅ n(CaC2) = 2 ⋅ 0,15 = 0,3 моль (по уравнению 1)
n2(HCl) = 12 ⋅ n(Al4C3) = 12 ⋅ 0,1 = 1,2 моль (по уравнению 2)
n(HCl)общ. = 0,3 + 1,2 = 1,5 моль (уравнение 1 + уравнение 2)
m(HCl) = 1,5 ⋅ 36,5 = 54,75 г
ω(HCl) = 54,75 : 547,5 = 0,1 * 100% = 10%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7655.
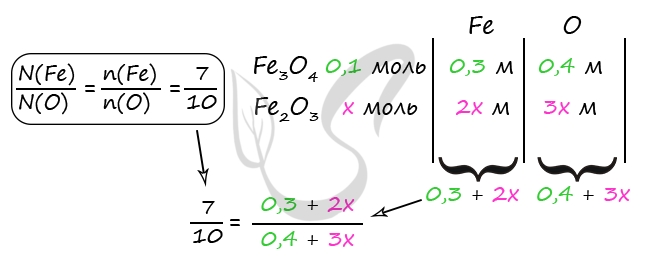
7620. Смесь железной окалины и оксида железа (III), в которой отношение числа атомов железа к числу атомов кислорода 7/10, полностью растворили в 500 г концентрированной азотной кислоты. Для поглощения полученного газа необходимо 20 г 20%-ного раствора гидроксида натрия. Найдите массовую долю соли железа в растворе, полученном после растворения смеси оксидов в кислоте.

1) Уравнения реакций
Fe3O4 + 10HNO3(к) = 3Fe(NO3)3 + NO2 + 5H2O (1)
Fe2O3 + 6HNO3(к) = 2Fe(NO3)3 + 3H2O (2)
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O (3)
2) Вычислим количество Fe3O4
m(NaOH) = 20 ⋅ 0,2 = 4 г
n(NaOH) = 4 : 40 = 0,1 моль
n(NaOH) = n(NO2) = 0,1 моль (по уравнению 3)
n(Fe3O4) = n(NO2) = 0,1 моль (по уравнению 1)
3) Пусть n(Fe2O3) = x моль
В результате решения системы получаем x = 0,2 моль = n(Fe2O3)
4) Запишем формулу массовой доли нитрата железа (III) в конечном растворе и проведем необходимые вычисления
n1(Fe(NO3)3) = 3 ⋅ n(Fe3O4) = 3 ⋅ 0,1 = 0,3 моль (по уравнению 1)
n2(Fe(NO3)3) = 2 ⋅ n(Fe2O3) = 2 ⋅ 0,2 = 0,4 моль (по уравнению 2)
n(Fe(NO3)3)общ. = 0,3 + 0,4 = 0,7 моль (уравнение 1 + уравнение 2)
m(Fe(NO3)3)общ. = 0,7 ⋅ 242 = 169,4 г
m(Fe3O4) = 0,1 ⋅ 232 = 23,2 г
m(Fe2O3) = 0,2 ⋅ 160 = 32 г
m(NO2) = 0,1 ⋅ 46 = 4,6 г
Подставим все вычисленные значения в формулу, записанную в пункте 4
Ответ: ω(Fe(NO3)3) = 30,77%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7620.
Для вас приятно генерировать тесты, создавайте их почаще
Задача 2. Хлор, выделившийся при взаимодействии 43.5 г оксида марганца (IV) с раствором HCl объемом 500 мл (плотность 1.18 г/мл) с массовой долей 36%, полностью поглощен горячим раствором гидроксида калия массой 600 г с массовой долей 28%. Определите массовую долю хлората калия в полученном растворе.
Источник: Я сдам ЕГЭ! Типовые Задания. А.А. Каверина (2018), стр. 209.
Решение:
1) Определим количества веществ, вступающих в первую реакцию и запишем саму реакцию:
n(MnO2) = 43.5/87 = 0.5 моль
m(HCl) = 500×1.18×0.36 = 212.4 г
n(HCl) = 212.4/36.5 = 5.8 моль
MnO2 + 4HCl → Cl2 + MnCl2 + 2H2O
Согласно коэффициентам, количество HCl, которое необходимо для полного расходования 0.5 моль MnO2, в 4 раза больше количества MnO2:
n(HCl) = 4×n(MnO2) = 4×0.5 = 2 моль. По условию задачи имеем 5.8 моль HCl, следовательно MnO2 в недостатке, а HCl в избытке. Расчет количества хлора ведем по количеству MnO2 (так как он в недостатке):
n(Cl2) = n(MnO2) = 0.5 моль.
2) Вычислим количество вещеста KOH и запишем вторую реакцию:
m(KOH) = 600×0.28 = 168 г
n(KOH) = 168/56 = 3 моль.
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (реакция с горячим раствором щелочи)
Так как хлор в недостатке, его количество используем, чтобы найти количество вещества и массу KClO3:
n(KClO3) = n(Cl2)/3 = 0.5/3 = 0.17 моль
m(KClO3) = 0.17×122.5 = 20.83 г
3) Находим массовую долю KClO3:
m(р-ра) = m(Cl2) + m(р-ра KOH) = 0.5×71 + 600 = 635.5 г
w(KClO3 = 20.83/635.5 = 0.0328 или 3.28%
В результате выполнения задания 4 ЕГЭ по химии проверяются следующие требования/умения:
Коды проверяемых требований к уровню подготовки (по кодификатору):
Читать подробнее…
Коды проверяемых элементов содержания (по кодификатору):
Уровень сложности задания:
Максимальный балл за выполнение задания:
Примерное время выполнения задания выпускником, изучавшим предмет:
Межмолекулярные водородные связи в жидком состоянии характерны для:
1. водорода
2. воды
3. аммиака
4. ацетальдегида
5. изобутана
И ионные, и ковалентные химические связи имеются в веществе:
1. НСl
2. H2SO4
3. NaOH
4. NH4Br
5. С2Н5ОН
Ионные связи реализуются в каждом из двух веществ:
1. Аl2O3 и FeCl3
2. K2S и NaNO3
3. KNO2 и NO2
4. HF и НСl
5. NaBr и NH4F
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
1) N2
2) НСlO
3) NH4Br
4) НСl
5) Р4
Ковалентные неполярные химические связи имеются в веществах:
1. белый фосфор
2. ортофосфорная кислота
3. аммиак
4. этиловый спирт
5. сера ромбическая
Немолекулярное строение имеют:
1. гидроксид калия
2. аммиак
3. уксусная кислота
4. азотная кислота
5. графит
Из предложенного перечня выберите два соединения, в которых присутствует и ионная, и ковалентная химическая связь.
1. Ca(NO3)2
2. НСlO
3. NH4Br
4. НВг
5. H2SO4
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная химическая связь.
1. H2
2. NH3
3. CaO
4. BaF2
5. NaBr
Из предложенного перечня выберите два соединения, между молекулами которых образуется водородная химическая связь.
1. H2
2. C2H5OH
3. C2H6
4. CH2=CH2
5. H2O
В сульфате калия присутствуют химические связи:
1. ионные
2. ковалентные неполярные
3. ковалентные полярные
4. водородные
5. металлические