Решу егэ химия 4778
Задания Д A5 № 4778
В каком из предложений 18−21 есть слово с чередующейся безударной гласной в корне.
(1)Вот тут-то и появился Лис.
— (2)Здравствуй, — сказал он.
– (3)Здравствуй, — вежливо ответил Маленький принц. — (4)Кто ты? (5)Какой ты красивый!
– (6)Я — Лис, — сказал Лис.
– (7)Поиграй со мной, — попросил Маленький принц. — (8)Мне так грустно.
– (9)Не могу я с тобой играть, — сказал Лис. — (10)Я не приручён.
– (11)А как это — приручить? — спросил Маленький принц.
– (12)Это давно забытое понятие, — объяснил Лис. — (13)Ты для меня пока всего лишь маленький мальчик, точно такой же, как сто тысяч других мальчиков. (14)Я для тебя всего только лисица, точно такая же, как сто тысяч других лисиц. (15)Но, если ты меня приручишь, мы станем нужны друг другу. (16)Ты будешь для меня единственным в целом свете, и я буду для тебя один в целом свете.
– (17)Я начинаю понимать, — сказал Маленький принц.
– (18)Скучная у меня жизнь, но, если ты меня приручишь, моя жизнь изменится, солнцем озарится, — продолжал Лис. — (19)Твои шаги я стану различать среди тысяч других. (20)Заслышав людские шаги, я всегда убегаю и прячусь. (21)Но твоя походка позовёт меня, точно музыка, и я выйду из своего убежища.
(22)Лис замолчал и долго смотрел на Маленького принца. (23)Потом сказал:
– (24)Пожалуйста, приручи меня!
– (25)Я бы рад, — отвечал Маленький принц, — но у меня так мало времени. (26)Мне ещё надо найти друзей и узнать разные вещи.
– (27)Узнать можно только те вещи, которые приручишь, — сказал Лис. — (28)У людей уже не хватает времени что-либо узнавать. (29)Они покупают вещи готовыми в магазинах. (30)Но таких магазинов, где торговали бы друзьями, конечно, нет, и потому люди больше не имеют друзей. (31)Если хочешь, чтобы у тебя был друг, приручи меня!
– (32)А что для этого надо делать? — спросил Маленький принц.
– (33)Надо запастись терпением, — ответил Лис. — (34)Спервá сядь вон там, поодаль. (35)Но с каждым днём садись немножко ближе.
(36)Так Маленький принц приручил Лиса.
(37)И вот настал час прощания.
– (38)Я буду плакать о тебе, — вздохнул Лис.
– (39)Я ведь не хотел, чтобы тебе было больно, — сказал Маленький принц. — (40)Ты сам пожелал, чтобы я тебя приручил.
– (41)Да, конечно, — сказал Лис.
(42)Он умолк. (43)Потом прибавил:
– (44)Поди взгляни ещё раз на розы, а когда вернёшься, чтобы проститься со мной, я открою тебе один секрет. (45)Это будет мой тебе подарок.
(46)Когда Маленький принц возвратился к Лису, тот сказал:
– (47)Вот мой секрет, он очень прост: зорко одно лишь сердце. (48)Самого главного глазами не увидишь.
– (49)Самого главного глазами не увидишь, — повторил Маленький принц, чтобы лучше запомнить.
– (50)Твоя роза так дорога тебе потому, что ты отдавал ей всю душу.
– (51)Потому что я отдавал ей всю душу. — повторил Маленький принц, чтобы лучше запомнить.
– (52)Люди забыли эту истину, — сказал Лис, — но ты не забывай: ты навсегда в ответе за всех, кого приручил.
* Антуан де Сент-Экзюпери (1900—1944) — французский писатель, поэт и профессиональный лётчик.
Задания Д A5 № 4778
33 Надо запастись терпением, ответил Лис.
Rus-oge. sdamgia. ru
11.08.2019 3:05:51
2019-08-11 03:05:51
Источники:
Https://rus-oge. sdamgia. ru/problem? id=4778
ЕГЭ–2022, история: задания, ответы, решения. Обучающая система Дмитрия Гущина. » /> » /> .keyword { color: red; } Решу егэ химия 4778
Решу егэ химия 4778
Решу егэ химия 4778
Ускоренная подготовка к ЕГЭ с репетиторами Учи. Дома. Записывайтесь на бесплатное занятие!
—>
Задание 8 № 4778
Назовите монарха, в период правления которого в состав Российского государства вошёл город, обозначенный на схеме цифрой «3».
Задание 9 № 4779
Заполните пропуск в предложении: «Одна из крупнейших ярмарок России в XVII–XVIII вв. — _____________ — обозначена на схеме цифрой «4»».
Это Макарьевская ярмарка под Нижним Новгородом.
Задания Д15 № 4780
Заполните пропуск в предложении: «Цифрой «1» на схеме обозначен город ______________, в непосредственной близости от которого были построены первые в России железоделательные заводы».
Цифрой «1» на карте обозначена Тула.
Задание 11 № 4781
Какие суждения, относящиеся к данной схеме, являются верными? Выберите несколько суждений из шести предложенных. Запишите в таблицу цифры, под которыми они указаны.
1) Крупными центрами кожевенного производства согласно схеме были Тверь, Калуга, Смоленск.
2) Горизонтальной штриховкой на схеме обозначены районы, специализировавшиеся на пушном промысле.
3) Точечным узором на схеме обозначен основной район производства льна и пеньки.
4) Цифрой «6» на схеме обозначена река, название которой было изменено в результате крупного народного восстания, произошедшего в том же веке, в котором установились границы Европейской части России, обозначенные на схеме.
5) Цифрой «5» на схеме обозначен город, вошедший в состав Российского государства в период правления Ивана IV.
6) Цифрой «2» на схеме обозначен Архангельск.
1) Крупными центрами кожевенного производства согласно схеме были Тверь, Калуга, Смоленск — НЕТ, неверно.
2) Горизонтальной штриховкой на схеме обозначены районы, специализировавшиеся на пушном промысле — ДА, верно.
3) Точечным узором на схеме обозначен основной район производства льна и пеньки — НЕТ, неверно.
4) Цифрой «6» на схеме обозначена река, название которой было изменено в результате крупного народного восстания, произошедшего в том же веке, в котором установились границы Европейской части России, обозначенные на схеме — НЕТ, неверно, это район Крестьянской войны Пугачева, а карта дана XVII в.
5) Цифрой «5» на схеме обозначен город, вошедший в состав Российского государства в период правления Ивана IV — ДА, верно, это Казань.
6) Цифрой «2» на схеме обозначен Архангельск — ДА, верно, это Архангельск.
Задание 9 № 4779
Задания Д15 № 4780
Задание 9 4779.
Hist-ege. sdamgia. ru
05.11.2017 23:34:31
2017-11-05 23:34:31
Источники:
Https://hist-ege. sdamgia. ru/problem? id=4778
РЕШУ ГВЭ, история 11: задания, ответы, решения. Обучающая система Дмитрия Гущина. » /> » /> .keyword { color: red; } Решу егэ химия 4778
Решу егэ химия 4778
Решу егэ химия 4778
Задание 15 № 4780
Заполните пропуск в предложении: «Цифрой «1» на схеме обозначен город ______________, в непосредственной близости от которого были построены первые в России железоделательные заводы».
Задание 13 № 4778
Назовите монарха, в период правления которого в состав Российского государства вошёл город, обозначенный на схеме цифрой «3».
Под цифрой 3 здесь обозначен Киев, который вошел в состав России в 1654 г. Когда царем был Алексей Михайлович.
Ответ: Алексей Михайлович.
Задание 14 № 4779
Заполните пропуск в предложении: «Одна из крупнейших ярмарок России в XVII–XVIII вв. — _____________ — обозначена на схеме цифрой «4»».
Это Макарьевская ярмарка под Нижним Новгородом.
Задание 16 № 4781
Какие суждения, относящиеся к данной схеме, являются верными? Выберите несколько суждений из шести предложенных. Запишите в таблицу цифры, под которыми они указаны.
1) Крупными центрами кожевенного производства согласно схеме были Тверь, Калуга, Смоленск.
2) Горизонтальной штриховкой на схеме обозначены районы, специализировавшиеся на пушном промысле.
3) Точечным узором на схеме обозначен основной район производства льна и пеньки.
4) Цифрой «6» на схеме обозначена река, название которой было изменено в результате крупного народного восстания, произошедшего в том же веке, в котором установились границы Европейской части России, обозначенные на схеме.
5) Цифрой «5» на схеме обозначен город, вошедший в состав Российского государства в период правления Ивана IV.
6) Цифрой «2» на схеме обозначен Архангельск.
1) Крупными центрами кожевенного производства согласно схеме были Тверь, Калуга, Смоленск — НЕТ, неверно.
2) Горизонтальной штриховкой на схеме обозначены районы, специализировавшиеся на пушном промысле — ДА, верно.
3) Точечным узором на схеме обозначен основной район производства льна и пеньки — НЕТ, неверно.
4) Цифрой «6» на схеме обозначена река, название которой было изменено в результате крупного народного восстания, произошедшего в том же веке, в котором установились границы Европейской части России, обозначенные на схеме — НЕТ, неверно, это район Крестьянской войны Пугачева, а карта дана XVII в.
5) Цифрой «5» на схеме обозначен город, вошедший в состав Российского государства в период правления Ивана IV — ДА, верно, это Казань.
6) Цифрой «2» на схеме обозначен Архангельск — ДА, верно, это Архангельск.
Задание 13 № 4778
Задание 16 № 4781
Когда царем был Алексей Михайлович.
Hist11-gve. sdamgia. ru
14.08.2018 10:31:44
2017-12-21 11:57:28
Источники:
Https://hist11-gve. sdamgia. ru/problem? id=4780
Установите соответствие между реагирующими веществами и продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) муравьиная кислота и аммиачный раствор оксида серебра(I) (при нагревании) Б) уксусная кислота и аммиачный раствор оксида серебра(I) В) муравьиная кислота и гидроксид калия Г) уксусная кислота и бутанол-1 |
1) формиат серебра 2) ацетат серебра 3) серебро 4) формиат калия 5) бутилацетат 6) бутилформиат |
Запишите выбранные цифры под соответствующими буквами.
А) Муравьиная кислота проявляет свойства альдегида, реагируя с реактивом Толленса (аммиачным раствором оксида серебра(I)), в этой реакции образуется серебро.
Б) Оксид серебра(I) является основным оксидом, поэтому в реакции с уксусной кислотой даёт соль — ацетат серебра.
В) В реакции муравьиной кислоты со щёлочью — гидроксидом калия образуется соль — формиат калия НСООK.
Г) Взаимодействие кислот со спиртами — реакция этерификации. Её продуктами являются сложные эфиры. Уксусная кислота и бутанол-1 образуют бутилацетат $С_4Н_9СОOСН_3$.
Ответ: 3245
-
Типы задач в задании С5.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
к оглавлению ▴
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол С2Н6О С:Н:О = 2:6:1 С2Н6О Бутен С4Н8 С:Н = 1:2 СН2 Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29 - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём. - Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы CnH2n+2 — Алкены CnH2n CnH2n+1–CH=CH2 Алкины CnH2n−2 CnH2n+1–C≡CH Диены CnH2n−2 — Гомологи бензола CnH2n−6 С6Н5–СnH2n+1 Предельные одноатомные спирты CnH2n+2O CnH2n+1–OH Многоатомные спирты CnH2n+2Ox CnH2n+2−x(OH)x Предельные альдегиды CnH2nO Кетоны CnH2nO O // CnH2n+1– C– O–CmH2m+1 Фенолы CnH2n−6O С6Н5(СnH2n)–OH Предельные карбоновые кислоты CnH2nO2 Сложные эфиры CnH2nO2 O // CnH2n+1– C– O–CmH2m+1 Амины CnH2n+3N СnH2n+1NH2 Аминокислоты (предельные одноосновные) CnH2n+1NO2 O // NH2– CH– C– OH C nH 2n+1
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль. - При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль. - Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду. - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.ν(C) = 0,7 моль
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль. - Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов. - Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2. - Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул N2 и его молярная масса 28 г/моль):
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Ответ: С4Н8.
-
Пример 7.
Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(C) = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.
ν(H) = 0,7 • 2 = 1,4 моль. - Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы С и Н.m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 гМасса всего вещества 9,8 г.
m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. - C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Ответ: С2Н7N.
-
Пример 8.
Вещества содержит С, Н, О и S. При сгорании 11 г его выделилось 8,8 г CO2, 5,4 г Н2О, а сера была полностью переведена в сульфат бария, масса которого оказалась равна 23,3 г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
ν(CO2) = m/M = 8,8/44 = 0,2 моль.
ν(C) = 0,2 моль.
ν(Н2О) = m / M = 5,4 / 18 = 0,3 моль.
ν(H) = 0,6 моль.
ν(BaSO4) = 23,3 / 233 = 0,1 моль.
ν(S) = 0,1 моль. - Рассчитываем предполагаемую массу кислорода в исходном веществе:
m(C) = 0,2 • 12 = 2,4 г
m(H) = 0,6 • 1 = 0,6 г
m(S) = 0,1 • 32 = 3,2 г
m(O) = mвещества − m(C) − m(H) − m(S) = 11 − 2,4 − 0,6 − 3,2 = 4,8 г,
ν(O) = m / M = 4,8 / 16 = 0,3 моль - Находим мольное соотношение элементов в веществе:
C : H : S : O = 0,2 : 0,6 : 0,1 : 0,3 = 2 : 6 : 1 : 3
Формула вещества C2H6SO3.
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы (С4Н12S2O6) получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Ответ: C2H6SO3.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль. - Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01 СnH2n−2 + 2Br2 → СnH2n−2Br4 Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.Это пентадиен С5Н8.
Ответ: C5H8.
-
Пример 10.
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na
→
2CnH2n+1ONa + H2
C3H6 + H2→
C3H8
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль. - Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
-
Пример 11.
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 мольСоответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
-
Пример 12.
Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
1–4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77 % кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204•1022 молекул.
2–3. Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего С, Н и хлор, выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он 5,6 г его при присоединении воды образуют 7,4 г спирта.
3–2. Для окисления 2,9 г предельного альдегида до кислоты потребовалось 9,8 г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой 3 г с избытком бромоводорода образует 6,24 г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1. С3Н8
1–2. С3Н6(NH2)2
1–3. C2H4(COOH)2
1–4. C4H6
1–5. (HCOO)2Ca — формиат кальция, соль муравьиной кислоты
2–1. С8Н16О
2–2. С3Н7NO
2–3. С5Н8 (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. C3H7Cl (не забудьте, что атомы водорода содержатся не только в воде, но и в HCl)
2–5. C4H11N
3–1. С4Н8
3–2. С3Н6О
3–3. С2Н5NO2
3–4. C4H8(OH)2
3–5. C4H9OH
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Химия, часть С. Задача С5. Определение формул органических веществ.» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
09.03.2023
.
09
34. Установление молекулярной и структурной формулы вещества
Вспоминай формулы по каждой теме
Решай новые задачи каждый день
Вдумчиво разбирай решения
ШКОЛКОВО.
Готовиться с нами — ЛЕГКО!
Подтемы раздела
органическая химия
.0110. Классификация и номенклатура органических веществ
.0211. Строение органических веществ
.0312. Химические свойства углеводородов и кислородсодержащих органических соединений
.0413. Химические свойства азотсодержащих органических соединений (амины, аминокислоты)
.0514. Химические свойства углеводородов
.0615. Химические свойства кислородсодержащих органических соединений
.0716. Взаимосвязь классов органических соединений
.0832. Цепочки реакций по органической химии
.0934. Установление молекулярной и структурной формулы вещества
Решаем задачи
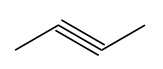
При сгорании органического вещества, не содержащего кислорода, получили 19,8 г углекислого газа, 5,4 г воды и 6,72 л хлороводорода (н.у.). Известно, что это вещество может быть получено взаимодействием соответствующего углеводорода с избытком хлороводорода. Напишите уравнение реакции получения данного вещества взаимодействием соответствующего углеводорода с избытком хлороводорода.
Показать ответ и решение
n(C) = n(CO2) = 19,8 г / 44 г/моль = 0,45 моль
n(H) = 2n(H2O) + n(HCl) = 2 * (5,4 г / 18 г/моль) + 6,72 л / 22,4 л/моль
n(Cl) = n(HCl) = 6,72 л / 22,4 л/моль
n(C) : n(H) : n(Cl) = 0,45 : 0,9 : 0,3 = 3 : 6 : 2
1) Молекулярная формула вещества: C3H6Cl2
2) Структурная формула вещества:
3) Уравнение реакции:
При сгорании 16,2 г органического вещества нециклического строения получили 26,88 л (н.у.) углекислого газа и 16,2 г воды. Известно, что 1 моль этого органического вещества в присутствии катализатора присоединяет только 1 моль воды и данное вещество не реагирует с аммиачным раствором оксида серебра.
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции гидратации органического вещества (используйте структурные формулы органических веществ).
Показать ответ и решение
n(C) = n(CO2) = 26,88 л / 22,4 л/моль = 1,2 моль
n(H) = 2n(H2O) = 2 * (16,2 г / 18 г/моль) = 1,8 моль
m(O) = 16,2 г — m(C) — m(H) = 16,2 г — 1,2 моль * 12 г/моль — 1 г/моль * 1,8 моль = 0 г
Следовательно, в этом веществе отсутствует кислород
n(C) : n(H) = 1,2 : 1,8 = 1 : 1,5 = 2 : 3
Вещества с молекулярной формулой C2H3 не существует, поэтому домножаем формулу на 2:
1) Молекулярная формула вещества: C4H6
2) Структурная формула вещества:
3) Уравнение реакции:
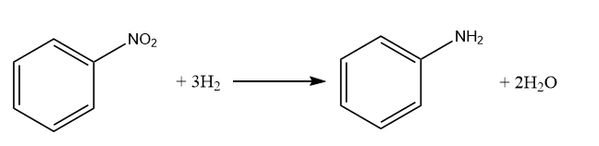
Некоторое органическое соединение, не содержащее кислорода, содержит 77,42% углерода и 15,05% азота по массе. Известно, что это вещество может быть получено восстановлением соответствующего нитросоединения водородом в присутствии катализатора.
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества восстановлением соответствующего нитросоединения водородом в присутствии катализатора (используйте структурные формулы органических веществ).
Показать ответ и решение
Пусть mв-ва = 100 г, тогда:
m(C) = 100 г * 0,7742 = 77,42 г
n(C) = 77,42 г / 12 г/моль = 6,45 моль
m(N) = 100 г * 0,1505 = 15,05 г
n(N) = 15,05 г / 14 г/моль = 1,075 моль
m(H) = 100 г — 77,42 г — 15,05 г = 7,53 г
n(H) = 7,53 г / 1 г/моль = 7,53 моль
n(C) : n(H) : n(N) = 6,45 : 7,53 : 1,075 = 6 : 7 : 1
1) Молекулярная формула вещества C6H7N
2) Структурная формула вещества:
3) Уравнение реакции:
При сгорании органического вещества, не содержащего кислорода, получили 6,72 л (н.у.) углекислого газа, 3,6 г воды и 7,3 г хлороводорода. Известно, что это вещество может быть получено взаимодействием соответствующего ациклического углеводорода с хлорной водой.
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества взаимодействием соответствующего углеводорода с хлорной водой (используйте структурные формулы органических веществ).
Показать ответ и решение
n(C) = n(CO2) = 6,72 л / 22,4 л/моль = 0,3 моль
n(H) = 2n(H2O) + n(HCl) = 2 * (3,6 г / 18 г/моль) + 7,3 г / 36,5 г/моль = 0,6 моль
n(Cl) = 7,3 г / 36,5 г/моль = 0,2 моль
n(C) : n(H) : n(Cl) = 0,3 : 0,6 : 0,2 = 3 : 6 : 2
1) Молекулярная формула вещества: C3H6Cl2
2) Структурная формула вещества:
CH3-CHCl-CH2Cl
3) Уравнение реакции:
CH3-CH=CH2 + Cl2 → CH3-CHCl-CH2Cl
При сгорании 12 г газообразного органического вещества получили 17,6 г углекислого газа и 7,2 г воды. Известно, что это вещество способно вступать в реакцию восстановления с водородом.
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции данного вещества с водородом (используйте структурные формулы органических веществ).
Показать ответ и решение
n(C) = n(CO2) = 17,6 г / 44 г/моль = 0,4 моль
n(H) = 2n(H2O) = 2 * (7,2 г / 18 г/моль) = 0,8 моль
m(O) = 12 г — m(C) — m(H) = 12 г — 12 г/моль * 0,4 моль — 1 г/моль * 0,8 моль = 6,4 г
n(O) = 6,4 г / 16 г/моль = 0,4 моль
n(C) : n(H) : n(O) = 0,4 : 0,8 : 0,4 = 1 : 2 : 1
1) Молекулярная формула вещества: CH2O
2) Структурная формула вещества:
HCHO
3) Уравнение реакции:
HCHO + H2 → CH3-OH
При сгорании 8,64 г органического вещества получили 21,12 г углекислого газа и 8,64 г воды. Известно, что это вещество не реагирует с гидроксидом меди(II) и может быть получено в результате окисления соответствующего спирта оксидом меди(II).
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества окислением соответствующего спирта оксидом меди(II) (используйте структурные формулы органических веществ).
Показать ответ и решение
n(C) = n(CO2) = 21,12 г / 44 г/моль = 0,48 моль
n(H) = 2n(H2O) = 2 * (8,64 г / 18 г/моль) = 0,96 моль
m(O) = 8,64 г — m(C) — m(H) = 8,64 г — 12 г/моль * 0,48 моль — 1 г/моль * 0,96 моль = 1,92 г
n(O) = 1,92 г / 16 г/моль = 0,12 моль
n(C) : n(H) : n(O) = 0,48 : 0,96 : 0,12 = 4 : 8 : 1
1) Молекулярная формула вещества C4H8O
2) Структурная формула вещества:
3) Уравнение реакции:
При сгорании 6,15 г органического вещества, не содержащего кислорода, получили углекислый газ, 2,7 мл воды и 1,12 л (н.у.) бромоводорода. Известно, что это вещество преимущественно образуется при взаимодействии соответствующего углеводорода с бромом на свету.
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества взаимодействием соответствующего углеводорода с бромом на свету (используйте структурные формулы органических веществ).
Показать ответ и решение
n(H) = 2n(H2O) + n(HBr) = 2 * (2,7 г /18 г/моль) + 1,12 л / 22,4 л/моль = 0,35 моль
n(Br) = n(HBr) = 1,12 л / 22,4 л/моль = 0,05 моль
m(C) = 6,15 г — m(H) — m(Br) = 6,15 г — 1 г/моль * 0,35 моль — 80 г/моль * 0,05 моль = 1,8 г
n(C) = 1,8 г / 12 г/моль = 0,15 моль
n(C) : n(H) : n(Br) = 0,15 : 0,35 : 0,05 = 3 : 7 : 1
1) Молекулярная формула вещества: C3H7Br
2) Cтруктурная формула вещества:
CH3-CHBr-CH3
3) Уравнение реакции:
CH3-CH2-CH3 + Br2 → CH3-CHBr-CH3 + HBr
При сгорании 9 г органического вещества получили 10,08 л (н.у.) углекислого газа и 10,8 г воды. Известно, что это вещество может быть получено из соответствующего альдегида в одну стадию.
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества из соответствующего альдегида (используйте структурные формулы органических веществ).
Показать ответ и решение
n(C) = n(CO2) = 10,08 л / 22,4 л/моль = 0,45 моль
n(H) = 2n(H2O) = 2 * (10,8 г / 18 г/моль) = 1,2 моль
m(O) = 9 г — m(C) — m(H) = 9 — 12 г/моль * 0,45 моль — 1 г/моль * 1,2 моль = 2,4 г
n(O) = 2,4 г / 16 г/моль = 0,15 моль
n(C) : n(H) : n(O) = 0,45 : 1,2 : 0,15 = 3 : 8 : 1
1) Молекулярная формула вещества C3H8O
2) Структурная формула вещества:
CH3-CH2-CH2-OH
3) Уравнение реакции:
CH3-CH2-CHO + H2 → CH3-CH2-CH2-OH
При сгорании 27,6 г органического вещества получили 26,88 л (н.у.) углекислого газа и 32,4 г воды. Известно, что это вещество реагирует с оксидом меди(II).
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции данного вещества с оксидом меди(II) (используйте структурные формулы органических веществ).
Показать ответ и решение
n(C) = n(CO2) = 26,88 л / 22,4 моль = 1,2 моль
n(H) = 2n(H2O) = 2 * (32,4 г / 18 г/моль) = 3,6 моль
m(O) = 27,6 — m(C) — m(H) = 27,6 г — 12 г/моль * 1,2 моль — 1 г/моль * 3,6 моль = 9,6 г
n(O) = 9,6 г / 16 г/моль = 0,6 моль
n(C) : n(H) : n(O) = 1,2 : 3,6 : 0,6 = 2 : 6 : 1
1) Молекулярная формула вещества C2H6O
2) Структурная формула вещества:
CH3-CH2-OH
3) Уравнение реакции:
CH3-CH2-OH + CuO → СH3-CHO + Cu + H2O
При сгорании 17,5 г органического вещества получили 28 л (н.у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н.у.) составляет 3,125 г/л. Известно также, что это вещество было получено в результате дегидратации третичного спирта.
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества дегидратацией соответствующего третичного спирта (используйте структурные формулы органических веществ).
Показать ответ и решение
n(C) = n(CO2) = 28 л / 22,4 л/моль = 1,25 моль
n(H) = 2n(H2O) = 2 * (22,5 г / 18 г) = 2,5 моль
m(O) = 17,5 — m(C) — m(H) = 17,5 — 12 г/моль * 1,25 моль — 1 г/моль * 2,5 моль = 0 г
Следовательно, кислорода в искомом соединении нет
n(C) : n(H) = 1,25 : 2,5 = 1 : 2
Общая формула соединения CnH2n
M(CnH2n) = 3,125 г/л * 22,4 л/моль = 70 г/моль
В таком случае:
12n + 2n = 70
n = 5
1) Молекулярная формула вещества: C5H10
2) Cтруктурная формула вещества:
3) Уравнение реакции:
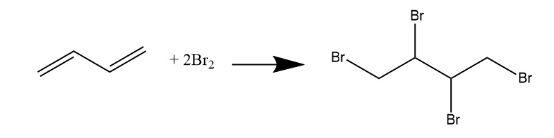
При сжигании образца органического вещества А получено 4,48 л(н.у.) углекислого газа, 0,9 г воды и 16,2 г бромоводорода.
Данное вещество А может быть получено присоединением избытка брома к соответствующему углеводороду Б. Также известно, что при бромировании этого углеводорода Б в условиях недостатка брома возможно образование структурных изомеров.
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества А взаимодействием соответствующего углеводорода Б с избытком брома(используйте структурные формулы органических веществ).
Показать ответ и решение
Проведены вычисления, и найдена молекулярная формула вещества А.
Общая формула вещества — CхHyBrz
n(CO2) = 4,48 / 22,4 = 0,2 моль
n(H2O) = 0,9 / 18 = 0,05 моль
n(HBr) = 16,2 / 81 = 0,2 моль
n(C) = n(CO2) = 0,2 моль
n(H) = 2n(H2O) + n(HBr) = 0,3 моль
n(Br) = n(HBr) = 0,2 моль
n(C) : n(H) : n(Br) = 0,2 : 0,3 :0,2 = 2 : 3 : 2 = 4 : 6 : 4
х : y : z = 4 : 6 : 4
Молекулярная формула вещества — C4H6Br4
Составлена структурная формула вещества А:
Составлено уравнение реакции:
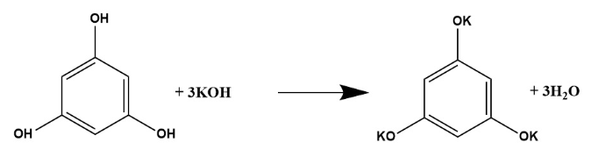
Вещество А содержит 30% углерода, 1,25% водорода, 48,75% калия по массе, остальное — кислород. Вещество А образуется при обработке избытком раствора гидроксида калия вещества Б без нагревания. Известно, что функциональные группы в молекуле вещества Б не находятся у соседних атомов углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А из вещества Б и гидроксида калия(используйте структурные формулы органических веществ).
Показать ответ и решение
Проведены вычисления, и найдена молекулярная формула вещества А.
Общая формула пещества А — СxНyОzКm
W(O) = 100 — 30 — 1,25 — 48,75 = 20%
x : y : z : m = 30 / 12 : 1,25 / 1 : 20 / 16 : 48,75 / 39 = 2 : 1 : 1 : 1 = 6 : 3 : 3 : 3
Молекулярная формула вещества А — С6Н3O3К3
Составлена структурная формула вещества А:
Составлено уравнение реакции:
Образец дипептида природного происхождения массой 26,4 г сожгли в кислороде. В результате чего получили 17,92 л (н.у.) углекислого газа, 14,4 г воды и 4,48 л (н.у.) азота. Данный дипептид в присутствии соляной кислоты подвергается гидролизу, в результате чего образуется только одна соль.
На основании данных условий задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу дипептида;
2) составьте структурную формулу дипептида, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции гидролиза дипептида в присутствии соляной кислоты (используйте структурные формулы органических веществ).
Показать ответ и решение
Проведены вычисления, и найдена молекулярная формула дипептида:
n(CO2) = 17,92 / 22,4 = 0,8 моль; n(C) = 0,8 моль;
n(H2O) = 14,4 / 18 = 0,8 моль; n(H) = 0,8 * 2 = 1,6 моль;
n(N2) = 4,48 / 22,4 = 0,2 моль; n(N) = 0,2 * 2 = 0,4 моль;
m(C + H + N) = 0,8 * 12 + 1,6 * 1 + 0,4 * 14 = 16,8 г;
m(O) = 26,4 — 16,8 = 9,6 г;
n(O) = 9,6 / 16 = 0,6 моль;
n(C) : n(H) : n(N) : n(O) = 4 : 8 : 2 : 3
Молекулярная формула — C4H8N2O3
Навеску органического вещества А массой 2,65 г сожгли в кислороде. В результате чего получили 4,48 л (н.у.) углекислого газа и 2,25 г воды. Известно, что при действии на это вещество сернокислого раствора перманганата калия образуется одноосновная кислота и выделяется углекислый газ.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы идмерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции окисления этого вещества сернокислым раствором перманганата калия (используйте структурные формулы орагнических веществ).
Показать ответ и решение
Проведём вычисления и найдём молекулярную формулу вещества А:
n(CO2) = 4,48 / 22,4 = 0,2 моль; n(C) = 0,2 моль;
n(H2O) = 2,25 / 18 = 0,125 моль; n(H) = 0,125х2 = 0,25 моль;
m(C + H) = 0,2 x12 + 0,25×1 = 2,65 г; кислород в составе вещества отсутствует;
n(C) : n(H) = 0,2 : 0,25 = 4 : 5
Молекулярная формула вещества — C8H10
При взаимодействии соли первичного амина с нитратом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 25,93% азота, 7,41% водорода и 44,44% кислорода по массе. На основании данных условия задания:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов;
3) напишите уравнение реакции получения вещества А взаимодействием соли первичного амина и нитрата серебра (используйте структурную формулу органического вещества).
Показать ответ и решение
n(N) = 25,93% / 14 г/моль = 1,85 моль
n(H) = 7,41% / 1 г/моль = 7,41 моль
n(O) = 44,44% / 16 г/моль = 2,7775 моль
n(C) = (100% — 25,93% — 7,41% — 44,44%) / 12 г/моль = 1,85 моль
n(C) : n(H) : n(O) : n(N) = 1,85 : 7,41 : 2,7775 : 1,85 = 2 : 8 : 3 : 2
1) Молекулярная формула искомого вещества C2H8O3N2
2) Структурная формула искомого вещества:
[CH3-CH2-NH3]+NO3—
3) Запишем уравнение реакции взаимодействия соли первичного амина и нитрата серебра:
[CH3-CH2-NH3]+Br— + AgNO3 = [CH3-CH2-NH3]+NO3— + AgBr
Вещество А содержит 72,0 % углерода и 16,0 % кислорода по массе, остальное – водород. Из вещества А при обработке подкисленным раствором перманганата калия образуется вещество Б. Известно, что в молекуле вещества А присутствуют только сигма-связи и отсутствуют первичные атомы углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества Б из вещества А с подкисленным раствором перманганата калия (используйте структурные формулы органических веществ).
Показать ответ и решение
1) проведены необходимые вычисления:
w(H) = 100 – 72 – 16 = 12 %.
Общая формула органического вещества – CxHyClz
х:у:z = (72/12): (12/1) : (16/16)
Установлено соотношение числа атомов С, Н и О в веществе: х:у:z = 6:12:1
Молекулярная формула органического вещества – С6H12O
2) Приведена структурная формула органического вещества:

3) Составлено уравнение реакции:
Органическое вещество содержит 48,39% углерода, 25,81% кислорода и 18,55% натрия по массе. Известно, что при электролизе водного раствора этого вещества образуется углеводород, галогенирование которого протекает с образованием только одного моногалогенпроизводного этого углеводорода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного вещества;
2) составьте возможную структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции, протекающей при электролизе водного раствора исходного вещества (используйте структурные формулы органических веществ).
Показать ответ и решение
а)
w(C) = 0,4839
w(O) = 0,2581
w(Na) = 0,1855
Значит на водород придется:
w(H) = 1 – w(C) – w(O) – w(Na) = 0,0725
Составим соотношение, предварительно приняв массу вещества за X:
n(C) : n(O) : n(H) : n(Na) = 

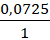
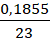
C5H9O2Na – простейшая формула, она же истинная.
б)
в)
При сгорании органического вещества X массой 8,88 г выделяется 8,064 л (н.у.) углекислого газа и 6,48 г воды. Известно, что вещество X реагирует с натрием, но не вступает в реакцию с щелочами и не даёт реакцию серебряного зеркала.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества c минимально возможной молярной массой;
2) составьте структурную формулу вещества Х, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции взаимодействия данного вещества с натрием (используйте структурные формулы органических веществ).
Показать ответ и решение
n(C) = n(CO2) = 8,064 л / 22,4 л/моль = 0,36 моль
n(H) = 2n(H2O) = 2 * 6,48 г / 18 г/моль = 0,72 моль
n(O) = (8,88 г — m(C) — m(H)) г / 16 г/моль = 0,24 моль
n(C) : n(H) : n(O) = 0,36 : 0,72 : 0,24 = 3 : 6 : 2
1) Молекулярная формула вещества: C3H6O2
2) Структурная формула вещества: HO-CH2-C(O)-CH3
3) Реакция данного вещества с натрием:
2HO-CH2-C(O)-CH3 + 2Na = 2NaO-CH2-C(O)-CH3 + H2
Органическое вещество А содержит 56,34% углерода, 10,40% водорода и 33,26% хлора по массе. Данное вещество образуется в качестве единственного возможного изомера при хлорировании углеводорода Б. На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А хлорированием углеводорода Б.
Показать ответ и решение

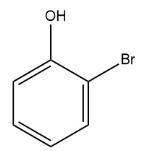
При сгорании 12,11 г органического вещества получили 18,48 г углекислого газа, 5,67 г бромоводорода и 2,52 г воды. Известно, что функциональные группы в молекуле этого вещества находятся у соседних атомов углерода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения физических величин) и установите молекулярную формулу вещества ;
2) составьте возможную структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции этого вещества с избытком водного раствора гидроксида натрия без нагревания (используйте структурные формулы органических веществ).
Показать ответ и решение
а)
m(X) = 12,11 г
m(CO2) = 18,48 г
m(HBr) = 5,67 г
m(H2O) = 2,52 г
n(C) = n(CO2) = 18,48 г / 44 (г/моль) = 0,42 моль
n(Br) = n(HBr) = 5,67 г / 81 (г/моль) = 0,07 моль
n(H) = 2n(H2O) + n(HBr) = 2*(2,52 г / 18 (г/моль)) + 5,67 г / 81 (г/моль) = 0,35 моль
Проверка на кислород: m(X) – m(C) – m(H) – m(Br) = 12,11 г – 5,04 г – 0,21 г – 5,6 г = 1,26 г
n(O) = 1,26 г / 16 (г/моль) = 0,07875 моль
Составим мольное соотношение:
n(С) : n(H) : n(O) : n(Br) = 0,42 : 0,35 : 0,07875 : 0,07 = 6 : 5 : 1 : 1
Простейшая формула, она же истинная.
C6H5OBr
б)
в) 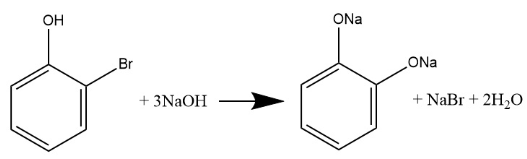
- 29.03.2022
Начинаем собирать реальные варианты ЕГЭ 2022 года по химии. Все варианты собираются и публикуются после проведения экзамена.
- Смотреть реальные варианты ЕГЭ 2022 по всем предметам
ОБНОВЛЕНОЕ 27.05.2022
Варианты с досрочного ЕГЭ 2022 по химии, с реальной основной волны от 26 мая 2022. Смотрим, разбираем. Все варианты будут сопровождаться видеоуроками, на которых будут разобраны примеры решения, правильные ответы и т.д.
- Другие варианты ЕГЭ по химии (включая Статград)
Есть вопросы? Пишите их ниже! Обсудим, решим, ответим.
- Вариант досрочного ЕГЭ 2022 по химии от 21.03.2022 — 5 вариантов разборов
- Открытый вариант от ФИПИ ЕГЭ 2022 по химии (аналог досрочного варианта) от 28.04.2022
Вариант №1 от 26 мая 2022
Вариант №2 от 26 мая 2022
Вариант №3 с Дальнего востока
Вариант №4 с Дальнего востока
Как прошла основная волна ЕГЭ 2022 по химии
Некоторые задания с основной волны от 26.05.2022