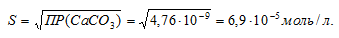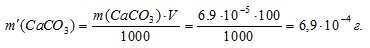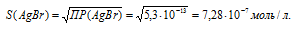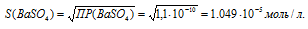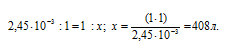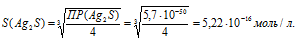Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
## — амфотерный гидроксид, при взаимодействии со щелочью при сплавлении образуется соль цинкат. Цинк в составе аниона и вода, при взаимодействии в растворах — комплексное соединение тетрагидроксоцинкат. При взаимодействии с кислотой — соль (катион цинка) и вода. При термическом разложении нерастворимых оснований образуется оксид металла и вода.
Ответ: 3426.
Решение задач по хими на вычисления с использованием значения произведения растворимости соли
Задача 563.
Исходя из произведения растворимости карбоната кальция, найти массу СаСО3, содержащуюся в 100 мл его насыщенного раствора.
Решение:
ПР(СаСО3) = 4,76 . 10-9.
Обозначим искомую растворимость соли СаСО3 через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ca2+ и CO32-.
Выражение произведения растворимости карбоната кальция можно записать как:
ПР(СаСО3) = [Ca2+] . [CO32-] = S . S = S2.
Отсюда
Теперь рассчитаем массу СаСО3 в 1 л насыщенного раствора его:
m(СаСО3) = S . M(СаСО3) = (6,9 . 10-5) . 100 = 6,9 . 10-2.
Находим массу СаСО3 в 100 мл насыщенного раствора его:
Ответ: 6,9 . 10-4 г.
Задача 564.
Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора АgВг.
Решение:
ПР(АgВг) = 5,3 . 10-13.
Обозначим искомую растворимость соли АgВг. через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ag+ и Br—.
Выражение произведения растворимости бромида серебра можно записать как:
ПР(AgBr = = [Ag+] . [Br—] = S . S = S2.
Отсюда
Рассчитаем массу АgВг в 1л раствора, учитывая, что M(Ag+) = 107,688 г/моль, получим:
m(Ag+) = S . M(Ag+) = (7,28 . 10-7) . 107,688 = 7,85 . 10-5 г.
Ответ: 7,85 . 10-5 г.
Задача 565.
Вычислить объем воды, необходимый для растворения при 25°С 1 г ВаSO4.
Решение:
ПР(ВаSO4) = 1 . 10-10.
Уравнение диссоциации ВаSO4 имеет вид:
ВаSO4 ⇔ Ba2+ + SO42-.
Обозначим искомую растворимость соли ВаSO4 через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ba2+ и SO42-.
Выражение произведения растворимости сульфата бария можно записать как:
ПР(AgBr) = [Ba2+] . [SO42-] = S . S = S2.
Отсюда
Рассчитаем массу ВаSO4 в 1л раствора, учитывая, что M(ВаSO4) = 233,39 г/моль, получим:
m(ВаSO4) = S . M(ВаSO4) = (1,049 . 10-5) . 233,39 = 2,45 . 10-3 г.
Находим объём воды, в котором растворится 1 г ВаSO4 для получения насыщенного раствора его из пропорции:
Ответ: 408 л.
Задача 566.
В каком объеме насыщенного раствора Ag2S содержится 1 мг растворенной соли?
Решение:
M(Ag2S) = 247,796 г/моль.
Обозначим искомую растворимость соли Ag2S через S моль/л. Тогда в насыщенном растворе соли содержится 2S моль ионов Ag+ и 1 моль ионов S2-.
Выражение произведения растворимости сульфида серебра можно записать как
ПР(Ag2S) = [Ag+]2 . [S2-] = 2S2 . S = 4S3.
Отсюда
Рассчитаем массу Ag2S в 1л раствора, учитывая, что M(Ag2S) = 247,796 г/моль, получим:
m(Ag2S) = S . M(Ag2S) = (5,22 . 10-16) . 247,796 = 1,3 . 1013 г или 1,3 . 1010 мг.
Находим объём воды, в котором можно растворить 1 мг сульфида серебра из пропорции:
Ответ: 7,69 . 10-11 л.
SuperEGE.ru
- 34
- 36
- 37
- 38
- 39
- 40
- 41
- 42
- 43
- 44
- 45
- 46
- 47
- 48
- 49
- 50
- 51
- 52
- 53
- 54
- 55
- 56
- 57
- 58
- 59
- 60
- 61
- 62
- 63
- 64
- 65
- 66
- 67
- 68
- 81
- 527
- 528
- 529
- 530
- 531
- 532
- 533
- 534
- 535
- 536
- 537
- 538
- 539
- 540
- 541
- 542
- 543
- 544
- 545
- 546
- 547
- 548
- 549
- 550
- 551
- 552
- 553
- 554
- 555
- 556
- 557
- 558
- 559
- 560
- 561
- 562
- 563
- 564
- 565
- 566
- 567
- 568
- 569
- 570
- 571
- 572
- 573
- 574
- 575
- 576
- 577
- 578
- 579
- 580
- 581
- 582
- 583
- 584
- 585
- 586
- 587
- 588
- 589
- 590
- 591
- 592
- 593
- 594
- 595
- 596
- 597
- 598
- 599
- 600
- 601
- 602
- 603
- 604
- 605
- 606
- 607
- 608
- 609
- 610
- 611
- 612
- 613
- 614
- 615
- 616
- 617
- 618
- 619
- 620
- 621
- 622
- 623
- 624
- 625
- 626
- 627
- 628
- 629
- 630
- 631
- 667
- 668
- 669
- 670
- 671
- 672
- 673
- 674
- 675
- 676
- 677
- 678
- 679
- 680
- 681
- 682
- 683
- 684
- 685
- 686
- 687
- 688
- 689
- 690
- 691
- 692
- 693
- 694
- 695
- 696
- 697
- 698
- 699
- 700
- 701
- 702
- 703
- 704
- 705
- 706
- 707
- 708
- 709
- 710
- 711
- 712
- 713
- 714
- 715
- 716
- 717
- 718
- 719
- 720
- 721
- 722
- 723
- 724
- 725
- 726
- 727
- 728
- 729
- 730
- 731
- 732
- 733
- 734
- 735
- 736
- 737
- 738
- 739
- 740
- 741
- 742
- 743
- 744
- 745
- 746
- 747
- 748
- 749
- 750
- 751
- 752
- 753
- 754
- 755
- 756
- 757
- 758
- 759
- 760
- 761
- 762
- 763
- 764
- 765
- 766
- 767
- 768
- 769
- 770
- 771
- 772
- 773
- 774
- 776
- 777
- 778
- 779
- 780
- 781
- 782
- 783
- 784
- 785
- 786
- 787
- 788
- 789
- 790
- 791
- 792
- 793
- 794
- 795
- 796
- 797
- 798
- 799
- 800
- 801
- 802
- 803
- 804
- 805
- 806
- 807
- 808
- 809
- 810
- 811
- 812
- 813
- 814
- 815
- 816
- 817
- 818
- 819
- 820
- 821
- 822
- 823
- 824
- 825
- 826
- 827
- 828
- 829
- 830
- 831
- 832
- 833
- 834
- 835
- 836
- 837
- 838
- 839
- 840
- 841
- 842
- 843
- 844
- 845
- 846
- 847
- 848
- 849
- 850
- 851
- 852
- 853
- 854
- 855
- 856
- 857
- 858
- 859
- 860
- 861
- 862
- 863
- 864
- 865
- 866
- 867
- 868
- 869
- 870
- 871
- 872
- 873
- 874
- 875
- 876
- 877
- 878
- 879
- 880
- 881
- 882
- 883
- 884
- 885
- 886
- 887
- 888
- 889
- 890
- 891
- 892
- 893
- 894
- 895
- 896
- 897
- 898
- 899
- 900
- 901
- 902
- 903
- 904
- 905
- 906
- 907
- 908
- 909
- 910
- 911
- 912
- 913
- 914
- 915
- 916
- 917
- 918
- 919
- 920
- 921
- 922
- 923
- 924
- 925
- 926
- 927
- 928
- 929
- 930
- 931
- 932
- 933
- 934
- 935
- 936
- 937
- 938
- 939
- 940
- 941
- 942
- 943
- 944
- 945
- 946
- 947
- 948
- 949
- 950
- 951
- 952
- 953
- 954
- 955
- 956
- 957
- 958
- 959
- 960
- 961
- 962
- 963
- 964
- 965
- 966
- 967
- 968
- 969
- 970
- 971
- 972
- 973
- 974
- 975
- 976
- 977
- 978
- 979
- 980
- 981
- 982
- 983
- 984
- 985
- 986
- 987
- 988
- 989
- 990
- 991
- 992
- 993
- 994
- 995
- 996
- 997
- 998
- 999
- 1000
- 1001
- 1002
- 1003
- 1004
- 1005
- 1006
- 1007
- 1008
- 1009
- 1010
- 1011
- 1012
- 1013
- 1014
- 1015
- 1016
- 1017
- 1018
- 1019
- 1020
- 1021
- 1022
- 1023
- 1024
- 1025
- 1026
- 1027
- 1028
- 1029
- 1030
- 1031
- 1032
- 1033
- 1034
- 1035
- 1036
- 1037
- 1038
- 1039
- 1040
- 1041
- 1042
- 1043
- 1044
- 1045
- 1046
- 1047
- 1048
- 1049
- 1050
- 1051
- 2918
- 2919
- 2920
- 2921
- 2922
- 2923
- 2924
- 2925
- 2926
- 2927
- 2928
- 2929
- 2930
- 2931
- 2932
- 2933
- 2934
- 2935
- 2936
- 2937
- 2938
- 2939
- 2940
- 2941
- 2942
- 2943
- 2944
- 2945
- 2946
- 2947
- 2948
- 2949
- 2950
- 2951
- 2952
- 2953
- 2954
- 2955
- 2956
- 2957
- 2958
- 2959
- 2960
- 2961
- 2962
- 2963
- 2964
- 2965
- 2966
- 2967
- 2968
- 2969
- 2970
- 2971
- 2972
- 2973
- 2974
- 2975
- 2976
- 2977
- 2978
- 2979
- 2980
- 2981
- 2982
- 2983
- 2984
- 2985
- 2986
- 2987
- 3026
- 3027
- 3028
- 3029
- 3030
- 3031
- 3032
- 3033
- 3034
- 3035
- 3036
- 3037
- 3038
- 3039
- 3040
- 3041
- 3042
- 3043
- 3044
- 3045
- 3046
- 3047
- 3048
- 3049
- 3050
- 3051
- 3052
- 3053
- 3054
- 3055
- 3056
- 3057
- 3058
- 3059
- 3060
- 3841
- 3876
- 3905
- 3954
- 3989
- 4124
- 4159
- 4194
- 4229
- 4264
- 4369
- 4524
- 4559
- 4594
- 4805
- 4806
- 4807
- 4808
- 4809
- 4810
- 4811
- 4812
- 4813
- 4814
- 4815
- 4816
- 4817
- 4818
- 4819
- 4820
- 4821
- 4822
- 4823
- 4824
- 4825
- 4826
- 4827
- 4828
- 4829
- 4830
- 4831
- 4832
- 4833
- 4834
- 4835
- 4836
- 4837
- 4838
- 4839
- 4841
- 4842
- 4843
- 4844
- 4845
- 4846
- 4847
- 4848
- 4849
- 4850
- 4851
- 4852
- 4853
- 4854
- 4855
- 4856
- 4857
- 4858
- 4859
- 4860
- 4861
- 4862
- 4863
- 4864
- 4865
- 4866
- 4867
- 4868
- 4869
- 4870
- 4871
- 4872
- 4873
- 4874
- 4875
- 4876
- 4877
- 4878
- 4879
- 4880
- 4881
- 4882
- 4883
- 4884
- 4885
- 4886
- 4887
- 4888
- 4889
- 4890
- 4891
- 4892
- 4893
- 4894
- 4895
- 4896
- 4897
- 4898
- 4899
- 4900
- 4901
- 4902
- 4903
- 4904
- 4905
- 4906
- 4907
- 4908
- 4909
- 4910
- 4946
- 4947
- 4948
- 4949
- 4950
- 4951
- 4952
- 4953
- 4954
- 4955
- 4956
- 4957
- 4958
- 4959
- 4960
- 4961
- 4962
- 4963
- 4964
- 4965
- 4966
- 4967
- 4968
- 4969
- 4970
- 4971
- 4972
- 4973
- 4974
- 4975
- 4976
- 4977
- 4978
- 4979
- 4980
- 4981
- 4982
- 4983
- 4984
- 4985
- 4986
- 4987
- 4988
- 4989
- 4990
- 4991
- 4992
- 4993
- 4994
- 4995
- 4996
- 4997
- 4998
- 4999
- 5000
- 5001
- 5002
- 5003
- 5004
- 5005
- 5006
- 5007
- 5008
- 5009
- 5010
- 5011
- 5012
- 5013
- 5014
- 5015
- 5016
- 5017
- 5018
- 5019
- 5020
- 5021
- 5022
- 5023
- 5024
- 5025
- 5026
- 5027
- 5028
- 5029
- 5030
- 5031
- 5032
- 5033
- 5034
- 5035
- 5036
- 5037
- 5038
- 5039
- 5040
- 5041
- 5042
- 5043
- 5044
- 5045
- 5046
- 5047
- 5048
- 5049
- 5050
- 5051
- 5052
- 5053
- 5054
- 5055
- 5056
- 5057
- 5058
- 5059
- 5060
- 5061
- 5062
- 5063
- 5064
- 5065
- 5066
- 5067
- 5068
- 5069
- 5070
- 5071
- 5072
- 5073
- 5074
- 5075
- 5076
- 5077
- 5078
- 5079
- 5080
- 5081
- 5082
- 5083
- 5084
- 5085
- 5086
- 5087
- 5088
- 5089
- 5090
- 5091
- 5092
- 5093
- 5094
- 5095
- 5096
- 5097
- 5098
- 5099
- 5100
- 5101
- 5102
- 5103
- 5104
- 5105
- 5106
- 5107
- 5108
- 5109
- 5110
- 5111
- 5112
- 5113
- 5114
- 5115
- 5116
- 5117
- 5118
- 5119
- 5120
- 5123
- 5124
- 5125
- 5126
- 5127
- 5128
- 5129
- 5130
- 5131
- 5132
- 5133
- 5134
- 5135
- 5136
- 5137
- 5138
- 5139
- 5140
- 5141
- 5142
- 5143
- 5144
- 5145
- 5146
- 5147
- 5148
- 5149
- 5150
- 5151
- 5152
- 5153
- 5154
- 5155
- 5156
- 5157
- 5158
- 5159
- 5160
- 5161
- 5162
- 5163
- 5164
- 5165
- 5166
- 5167
- 5168
- 5169
- 5170
- 5171
- 5172
- 5173
- 5174
- 5175
- 5176
- 5177
- 5178
- 5179
- 5180
- 5181
- 5182
- 5183
- 5184
- 5185
- 5186
- 5187
- 5188
- 5189
- 5190
- 5191
- 5192
- 5275
- 5277
- 5279
- 5280
- 5281
- 5282
- 5283
- 5284
- 5285
- 5286
- 5287
- 5288
- 5289
- 5290
- 5291
- 5292
- 5293
- 5294
- 5295
- 5296
- 5297
- 5298
- 5299
- 5300
- 5301
- 5302
- 5303
- 5304
- 5305
- 5306
- 5307
- 5310
- 5312
- 5314
- 5315
- 5316
- 5317
- 5318
- 5319
- 5320
- 5321
- 5322
- 5323
- 5324
- 5325
- 5326
- 5327
- 5328
- 5329
- 5330
- 5331
- 5332
- 5333
- 5334
- 5335
- 5336
- 5337
- 5338
- 5339
- 5340
- 5341
- 5342
- 5345
- 5347
- 5349
- 5350
- 5351
- 5352
- 5353
- 5354
- 5355
- 5356
- 5357
- 5358
- 5359
- 5360
- 5361
- 5362
- 5363
- 5364
- 5365
- 5366
- 5367
- 5368
- 5369
- 5370
- 5371
- 5372
- 5373
- 5374
- 5375
- 5376
- 5377
- 5440
- 5442
- 5444
- 5445
- 5446
- 5447
- 5448
- 5449
- 5450
- 5451
- 5452
- 5453
- 5454
- 5455
- 5456
- 5457
- 5458
- 5459
- 5460
- 5461
- 5462
- 5463
- 5464
- 5465
- 5466
- 5467
- 5468
- 5469
- 5470
- 5471
- 5472
- 5475
- 5477
- 5479
- 5480
- 5481
- 5482
- 5483
- 5484
- 5485
- 5486
- 5487
- 5488
- 5489
- 5490
- 5491
- 5492
- 5493
- 5494
- 5495
- 5496
- 5497
- 5498
- 5499
- 5500
- 5501
- 5502
- 5503
- 5504
- 5505
- 5506
- 5507
- 5510
- 5512
- 5514
- 5515
- 5516
- 5517
- 5518
- 5519
- 5520
- 5521
- 5522
- 5523
- 5524
- 5525
- 5526
- 5527
- 5528
- 5529
- 5530
- 5531
- 5532
- 5533
- 5534
- 5535
- 5536
- 5537
- 5538
- 5539
- 5540
- 5541
- 5542
- 5876
- 5877
- 5878
- 5879
- 5880
- 5881
- 5882
- 5883
- 5884
- 5885
- 5886
- 5887
- 5888
- 5889
- 5890
- 5891
- 5892
- 5893
- 5894
- 5895
- 5896
- 5897
- 5898
- 5899
- 5900
- 5901
- 5902
- 5903
- 5904
- 5905
- 5906
- 5907
- 5908
- 5909
- 5910
- 5941
- 5945
- 5946
- 5947
- 5948
- 5949
- 5950
- 5951
- 5952
- 5953
- 5954
- 5955
- 5956
- 5957
- 5958
- 5959
- 5960
- 5961
- 5962
- 5963
- 5964
- 5965
- 5966
- 5967
- 5968
- 5969
- 5970
- 5976
- 5980
- 5981
- 5982
- 5983
- 5984
- 5985
- 5986
- 5987
- 5988
- 5989
- 5990
- 5991
- 5992
- 5993
- 5994
- 5995
- 5996
- 5997
- 5998
- 5999
- 6000
- 6001
- 6002
- 6003
- 6004
- 6005
- 6011
- 6015
- 6016
- 6017
- 6018
- 6019
- 6020
- 6021
- 6022
- 6023
- 6024
- 6025
- 6026
- 6027
- 6028
- 6029
- 6030
- 6031
- 6032
- 6033
- 6034
- 6035
- 6036
- 6037
- 6038
- 6039
- 6040
- 6046
- 6050
- 6051
- 6052
- 6053
- 6054
- 6055
- 6056
- 6057
- 6058
- 6059
- 6060
- 6061
- 6062
- 6063
- 6064
- 6065
- 6066
- 6067
- 6068
- 6069
- 6070
- 6071
- 6072
- 6073
- 6074
- 6075
- 6081
- 6085
- 6086
- 6087
- 6088
- 6089
- 6090
- 6091
- 6092
- 6093
- 6094
- 6095
- 6096
- 6097
- 6098
- 6099
- 6100
- 6101
- 6102
- 6103
- 6104
- 6105
- 6106
- 6107
- 6108
- 6109
- 6110
- 6116
- 6120
- 6121
- 6122
- 6123
- 6124
- 6125
- 6126
- 6127
- 6128
- 6129
- 6130
- 6131
- 6132
- 6133
- 6134
- 6135
- 6136
- 6137
- 6138
- 6139
- 6140
- 6141
- 6142
- 6143
- 6144
- 6145
- 6151
- 6155
- 6156
- 6157
- 6158
- 6159
- 6160
- 6161
- 6162
- 6163
- 6164
- 6165
- 6166
- 6167
- 6168
- 6169
- 6170
- 6171
- 6172
- 6173
- 6174
- 6175
- 6176
- 6177
- 6178
- 6179
- 6180
- 6186
- 6190
- 6191
- 6192
- 6193
- 6194
- 6195
- 6196
- 6197
- 6198
- 6199
- 6200
- 6201
- 6202
- 6203
- 6204
- 6205
- 6206
- 6207
- 6208
- 6209
- 6210
- 6211
- 6212
- 6213
- 6214
- 6215
- 6221
- 6225
- 6226
- 6227
- 6228
- 6229
- 6230
- 6231
- 6232
- 6233
- 6234
- 6236
- 6237
- 6238
- 6239
- 6240
- 6241
- 6242
- 6243
- 6244
- 6245
- 6246
- 6247
- 6248
- 6249
- 6250
- 6256
- 6260
- 6261
- 6262
- 6263
- 6264
- 6265
- 6266
- 6267
- 6268
- 6269
- 6270
- 6271
- 6272
- 6273
- 6274
- 6275
- 6276
- 6277
- 6278
- 6279
- 6280
- 6281
- 6282
- 6283
- 6284
- 6285
- 6373
- 6377
- 6378
- 6379
- 6380
- 6381
- 6382
- 6383
- 6384
- 6385
- 6386
- 6387
- 6388
- 6389
- 6390
- 6391
- 6392
- 6393
- 6394
- 6395
- 6396
- 6397
- 6398
- 6399
- 6400
- 6401
- 6402
- 6408
- 6412
- 6413
- 6414
- 6415
- 6416
- 6417
- 6418
- 6419
- 6420
- 6421
- 6422
- 6423
- 6424
- 6425
- 6426
- 6427
- 6428
- 6429
- 6430
- 6431
- 6432
- 6433
- 6434
- 6435
- 6436
- 6437
- 6443
- 6447
- 6448
- 6449
- 6450
- 6451
- 6452
- 6453
- 6454
- 6455
- 6456
- 6457
- 6458
- 6459
- 6460
- 6461
- 6462
- 6463
- 6464
- 6465
- 6466
- 6467
- 6468
- 6469
- 6470
- 6471
- 6472
- 6478
- 6482
- 6483
- 6484
- 6485
- 6486
- 6487
- 6488
- 6489
- 6490
- 6491
- 6492
- 6493
- 6494
- 6495
- 6496
- 6497
- 6498
- 6499
- 6500
- 6501
- 6502
- 6503
- 6504
- 6505
- 6506
- 6507
- 6513
- 6517
- 6518
- 6519
- 6520
- 6521
- 6522
- 6523
- 6524
- 6525
- 6526
- 6527
- 6528
- 6529
- 6530
- 6531
- 6532
- 6533
- 6534
- 6535
- 6536
- 6537
- 6538
- 6539
- 6540
- 6541
- 6542
- 6581
- 6582
- 6583
- 6584
- 6585
- 6586
- 6587
- 6588
- 6589
- 6590
- 6591
- 6592
- 6593
- 6594
- 6595
- 6596
- 6597
- 6598
- 6599
- 6600
- 6601
- 6602
- 6603
- 6604
- 6605
- 6606
- 6607
- 6608
- 6609
- 6610
- 6611
- 6612
- 6613
- 6614
- 6996
- 7001
- 7002
- 7030
- 7035
- 7064
- 7069
- 7098
- 7103
- 7132
- 7137
- 7166
- 7171
- 7200
- 7205
- 7234
- 7239
- 7268
- 7273
- 7302
- 7307
- 7336
- 7341
- 7370
- 7375
- 7404
- 7409
- 7438
- 7443
- 7502
- 7503
- 7506
- 7511
- 7519
- 7524
- 7527
- 7528
- 7530
- 7601
- 7602
- 7603
- 7604
- 7605
- 7606
- 7607
- 7608
- 7609
- 7610
- 7611
- 7612
- 7613
- 7614
- 7615
- 7616
- 7617
- 7618
- 7619
- 7620
- 7621
- 7622
- 7623
- 7624
- 7625
- 7626
- 7627
- 7628
- 7629
- 7630
- 7631
- 7632
- 7633
- 7634
- Войти в свой аккаунт
-
Химия
-
Биология
-
Русский язык
-
Математика базовая
-
Математика профильная
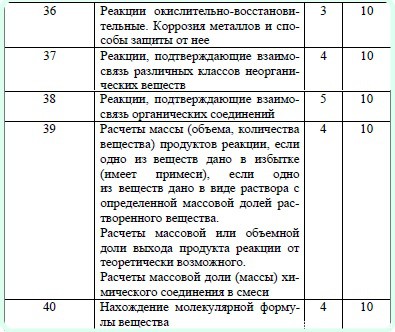
Задания ЕГЭ по Химии
06-Июл-2012 | комментариев 7 | Лолита Окольнова
Задания ЕГЭ по Химии
Принципиальных изменений в ЕГЭ 2015 нет
1. Уменьшено число заданий базового уровня сложности с 28 до 26 заданий.
2. Максимальный балл за выполнение всех заданий экзаменационной работы 2015 года составляет 64 (вместо 65 баллов в 2014 году).
3. Изменена система оценивания задания на нахождение молекулярной формулы вещества. Максимальный балл за его выполнение – 4 (вместо 3 баллов в 2014 году).
Чтобы знать, какие темы нужно пройти, существует такой документ — план ЕГЭ. В нем детально расписаны не только темы, но и максимальный балл, и время, которое стоит потратить на выполнение каждого задания.
По ходу подготовки к экзамену, когда для тренировки прорешивают все варианты ЕГЭ, стоит засекать время — над некоторыми заданиями имеет смысл посидеть подольше, некоторые должны решаться быстро.
К каждому варианту экзаменационной работы прилагаются следующие материалы:
− Периодическая система химических элементов Д.И. Менделеева (черно-белая) ;
− таблица растворимости солей, кислот и оснований в воде;
− электрохимический ряд напряжений металлов.Во время выполнения экзаменационной работы разрешается использовать непрограммируемый калькулятор.
Спецификация заданий ЕГЭ по химии :
Часть А:
максимум можно набрать 26 баллов
Первая часть теста включает 26 заданий. К каждому из них даны четыре варианта ответа, из которых нужно выбрать один правильный.
Часть В:
максимально можно набрать 18 баллов
Вторая часть теста состоит из 10 заданий. Ответ надо дать в виде числа или последовательности цифр.
Часть С:
Реакции и задачки
максимум — 20 баллов
- С1 — ОВР — можно решать обычным, привычным большинству методом, можно методом полуреакций, главное, чтобы было правильно составлено уравнение и расставлены правильные коэффициенты. Правильно определены окислитель и восстановитель;
- С2 — написать уравнения реакций по описанию химического эксперимента;
- С3 — органическая цепочка
- С4 — задачи по неорганике
- С5 — задачка (органика)
Всего заданий – 40;
Максимальный первичный балл за работу – 64.
Общее время выполнения работы – 180 мин.
Для тренировки — демо-варианты ЕГЭ с 2011 по 2015 гг:
|
2011 |
2012 | 2013 | 2014 |
2015 |
|
демо-версия задания ЕГЭ по химии 2011 |
демо-версияя задания ЕГЭ по химии 2012 |
демо-версия задания ЕГЭ по химии 2013 |
Демо-версия задания ЕГЭ по химии 2014 |
Демо-версия задания ЕГЭ по химии 2015 |
Подробный разбор всех тем и примеры заданий можно найти на странице ХИМИЯ
Есть примеры ЕГЭ — типовые задания
(платные материалы — для доступа необходим пароль)
КАК ПОЛУЧИТЬ ПАРОЛЬ?
Категории:
|
Обсуждение: «Задания ЕГЭ по Химии»
(Правила комментирования)
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
- 15) Хром и его соединения
- 16) Железо и его соединения
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
 Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
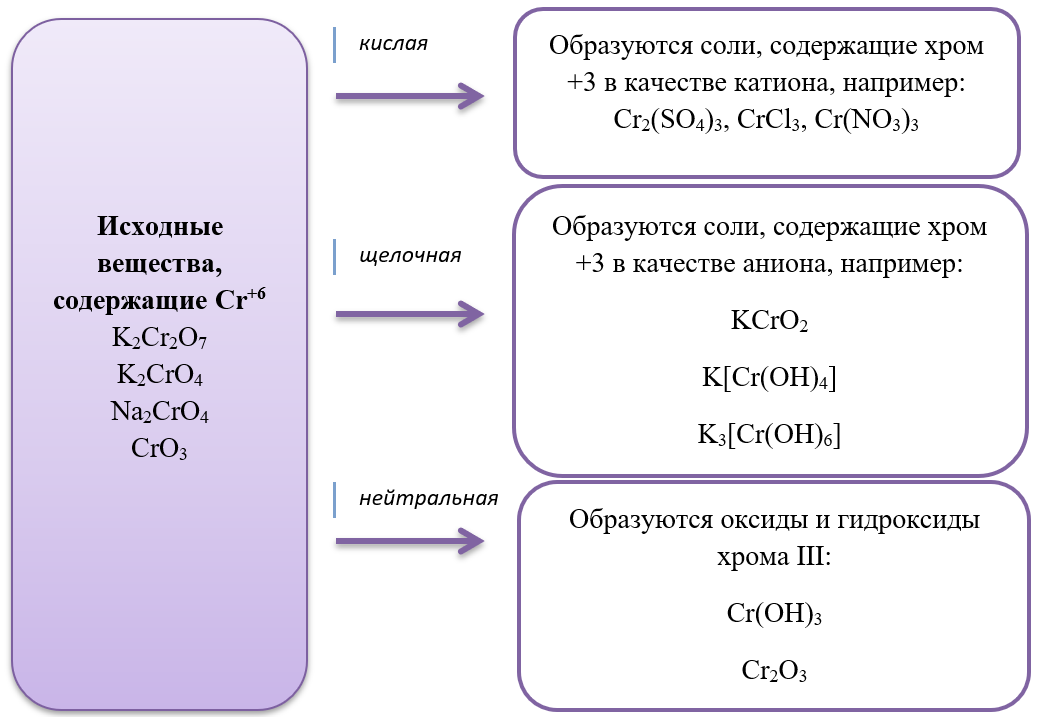
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
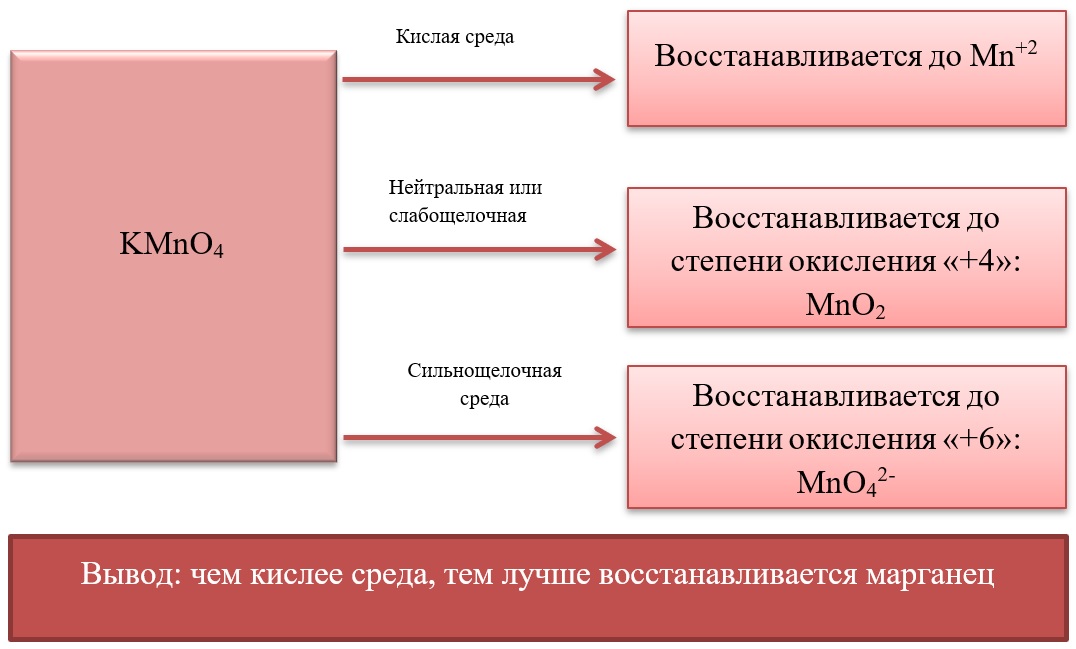
17) Соединения марганца
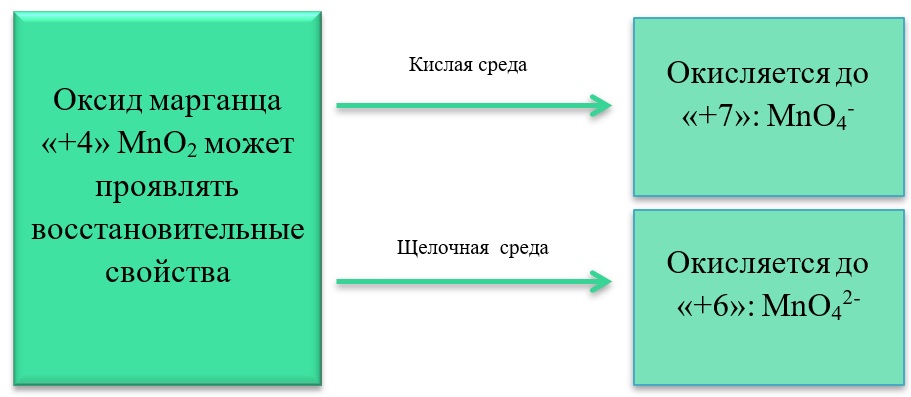
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
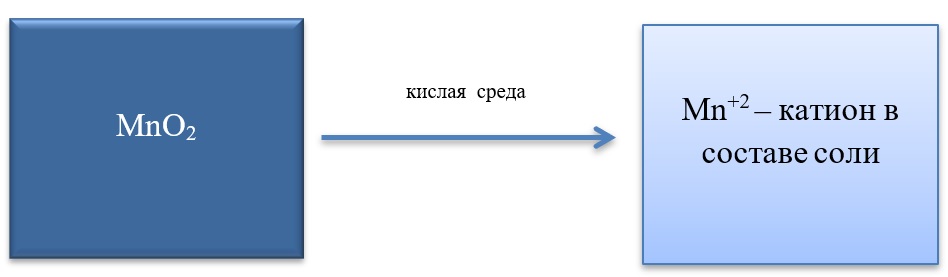
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
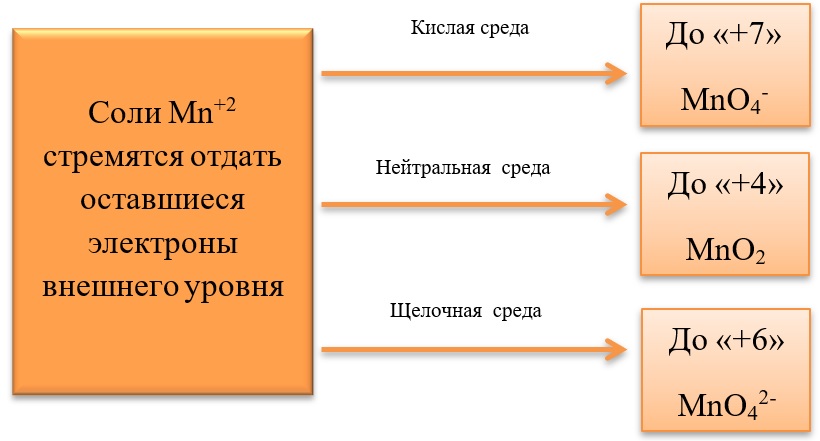
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl
За это задание ты можешь получить 2 балла. На решение дается около 7 минут. Уровень сложности: повышенный.
Средний процент выполнения: 48.6%
Ответом к заданию 8 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Установите соответствие между реагирующими веществами и продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) $NH_4Cl$ и $NaNO_2$ Б) $(NH_4)_2Cr_2O_7$ (нагревание) В) Mg и $HNO_3$ (оч. разб.) Г) Ag и $HNO3$ (конц.) |
1) $NO_2$ 2) $N_2$ 3) $NH_4NO_2$ 4) $(NH_4)_2CrO_4$ 5) NO 6) $NH_4NO_3$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $NH_4Cl + NaNO_2 = N_2 + 2H_2O + NaCl$
Б) $(NH_4)_2Cr_2O_7 →↖{t°C} N_2 + Cr_2O_3 + 4H_2O$
В) $4Mg + 10HNO_3 → 4Mg(NO_3)_2 + NH_4NO_3 + 3H_2O$
Г) $Ag+2HNO_{3(конц.)} =AgNO_3+NO_2+H_2O$
Ответ: 2261
Задача 2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $H_2SO_4$ (конц.) и C Б) $H_2SO_4$ (конц.) и S В) $H_2SO_4$ (конц.) и Cu Г) $H_2SO_4$ (конц.) и Ag |
1) $CO_2$, $SO_2$ и $H_2O$ 2) $Ag_2SO_4$, $SO_2$ и $H_2O$ 3) $SO_2$ и $H_2O$ 4) $CuSO_4$ и $H_2$ 5) $CuSO_4$, $SO_2$ и $H_2O$ 6) $Ag_2SO_4$ и $H_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Окисляющие кислоты окисляют углерод в углекислый газ (1)
Б) овр, где сера принимает среднюю степень окисления +4, ответ (3)
В) так как кислота конц., а металл неактивный, то в продуктах должен быть сернистый газ как продукт восстановления серной кислоты, ответ (5)
Г) рассуждаем так же, как в В, ответ (2)
Ответ: 1352
Задача 3
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Al и KOH (р-р) Б) Al и $H_2SO_4$ (разб.) В) $Al_2S_3$ и $H_2O$ Г) Al (без плёнки) и $H_2O$ |
1) гидроксид алюминия и сера 2) гидроксид алюминия и сероводород 3) тетрагидроксоалюминат калия и водород 4) сульфат алюминия и водород 5) сульфит алюминия и водород 6) гидроксид алюминия и водород |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Алюминий — амфотерный металл, поэтому в реакциях с раствором щелочей он даёт комплексные соли — тетрагидроксоалюминаты, в данном случае — калия, при этом также выделяется водород.
Б) В реакции с разбавленной серной кислотой алюминий не проявляет способность к пассивации и реагирует как типичный металл — замещая водород. Продукт реакции — сульфат алюминия и водород.
В) $Al_2S_3$ — сульфид алюминия — соль с катионом слабого основания и анионом слабой кислоты, подвергается полному гидролизу, при этом образуется осадок гидроксида алюминия и газообразный сероводород.
Г) Взаимодействуя с водой (реакция идёт при нагревании), алюминий замещает водород, который выделяется в виде простого вещества, при этом образуется нерастворимый гидроксид алюминия.
Ответ: 3426
Задача 4
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
| А) Fe и $HNO_3$ (конц.) Б) Fe и $H_2SO_4$ (разб.) В) Fe, $O_2$ и $H_2O$ Г) FeS и $O_2$ |
1) оксид железа(III) и оксид серы(IV) 2) гидроксид железа(II) 3) гидроксид железа(III) 4) сульфат железа(II) и водород 5) нитрат железа(II), оксид азота(II) и вода 6) нитрат железа(III), оксид азота(IV) и вода |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Fe и $HNO_{3(конц.)}$. Железо в реакциях с окисляющими кислотами точно окисляется до степени окисления +3. А вот продукты восстановления азотки могут быть разные в пределах подходящих продуктов по табличке. Но ориентируемся на степень окисления железа в первую очередь. Продукты реакции: нитрат железа (III), оксид азота (IV) и вода.
Б) Fe и $H_2SO_{4(разб.)}$. Разбавленная серная кислота не проявляет особенных свойств и реагирует с металлами как большинство других кислот — металл замещает водород, в данном случае образуется сульфат железа (II) и водород.
В) Fe, $O_2$ и $H_2O$. Реагируя с водой в присутствии кислорода железо ржавеет — образуется осадок гидроксида железа(III).
Г) При горении FeS образуется два оксида: оксид железа (III) и оксид серы (IV).
Ответ: 6431
Задача 5
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
| А) Fe и $Cl_2$ Б) Fe и HCl (конц.) В) Cu и $HNO_3$ (конц.) Г) Cu и $HNO_3$ (разб.) |
1) $FeCl_2$ 2) $FeCl_3$ 3) $FeCl_2$ и $H_2$ 4) $Cu(NO_3)_2$ и $H_2$ 5) $Cu(NO_3)_2$, NO и $H_2O$ 6) $Cu(NO_3)_2$, $NO_2$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $2Fe + 3Cl_2 = 2FeCl_3$
Б) $Fe + 2HCl_{(конц.)} = FeCl_2 + H_2$
В) $Cu + 4HNO_{3(конц.)} = Cu(NO_3)_2 + 2NO_2 + 2H_2O$
Г) $3Cu + 8HNO_{3(разб.)} = 3Cu(NO_3)_2 + 2NO + 4H_2O$
Ответ: 2365
Задача 6
Установите соответствие между реагирующими веществами и формулой газа, выделяющегося при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ФОРМУЛА ГАЗА |
| А) Zn и HCl (конц.) Б) Cu и $H_2SO_4$ (конц.) В) Mg и $H_2SO_4$ (разб.) Г) Ag и $HNO_3$ (конц.) |
1) $H_2$ 2) NO 3) $NO_2$ 4) $SO_2$ 5) $Cl_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Здесь цинк, являясь активным металлом, вытесняет водород из кислоты, образует соль, а водород выделяется в чистом виде.
Б: Концентрированная серная кислота — кислота окисляющая и реагирует с металлами за счет окислительных свойств S(VI). Неактивные металлы, как медь, восстанавливают серу только до сернистого газа.
В: Реакция похожа на первую: активный металл вытесняет водород из кислоты, поскольку разбавленная серная кислота реагирует с металлами за счет выделения водорода, как неокисляющие кислоты.
Г: Серебро неактивный металл, значит концентрированная(!) азотка восстановится только до $NO_2$.
Ответ: 1413
Задача 7
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $Na_2SiO_3$ и $CO_2$ (водн. р-р) Б) $Na_2SiO_3$ и HCl В) $AlCl_3$ и $Na_2CO_3$ (водн. р-р) Г) $AlCl_3$ и NaOH (водн. р-р) |
1) $Al(OH)_3$ и NaCl 2) $Al(OH)_3$, NaCl и $CO_2$ 3) $SiO_2$ и $NaHCO_3$ 4) NaCl и $H_2SiO_3$ 5) $H_2SiO_3$ и $Na_2CO_3$ 6) NaCl, $SiO_2$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) При реакции силиката и углекислого газа в водном растворе вода тоже вступает в реакцию, тогда получается кремниевая кислота и карбонат калия.
Б) В данном случае реагирует сильная кислота и соль, поэтому протекает обычный обмен, образуется хлорид натрия и кремниевая кислота.
В) В данном случае вода снова вступает в реакцию, происходит гидролиз карбоната алюминия, получается гидроксид алюминия (III), алюминий не меняет степень окисления, хлорид натрия и углекислый газ.
Г) В этой реакции протекает обмен.
Ответ: 5421
Задача 8
Установите соответствие между реагирующими веществами и продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) Ca и $HNO_3$ (оч. разб.) Б) Cu и $HNO_3$ (конц.) В) Fe и $HNO_3$ (конц.) (н. у.) Г) Al и $HNO_3$ (конц.) (н. у.) |
1) оксид азота(II) 2) оксид азота(IV) 3) аммиак 4) не взаимодействуют 5) нитрат аммония |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $4Ca + 10HNO_{3(оч. разб.)} = 4Ca(NO_3)_2 + NH_4NO_3 + 3H_2O$
Б) $Cu + 4HNO_3 = Cu(NO_3)_2 + 2NO_2 + 2H_2O$
В) Fe и $HNO_{3(конц)}$ при нормальных условиях не реагирует, происходит пассивация
Г) Al и $HNO_{3(конц)}$ при нормальных условиях не реагирует, происходит пассивация
Ответ: 5244
Задача 9
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $КHCO_3$ и $Ca(OH)_2$ Б) $КHCO_3$ и HCl В) $КHCO_3$ (нагревание) Г) $КHCO_3$, $CO_2$ и $H_2O$ |
1) $Ca(HCO_3)_2$ и КOH 2) $CaCO_3$, КOH и $H_2O$ 3) $CO_2$, $H_2O$ и КCl 4) КCl и $H_2CO_3$ 5) $К_2CO_3$, $H_2O$ и $CO_2$ 6) не реагируют |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Кислая соль слабой кислоты и щелочь реагируют с образованием новой нерастворимой соли, новой щелочи и воды.
Б) Кислая соль слабой кислоты с
сильной кислотой образуется среднюю соль и слабую кислоту (угольная кислота неустойчива и сразу распадается на оксид и воду).
В) При нагревании кислой соли образуется средняя соль и кислота, но угольная сразу распадается на воду и газ.
Г) Должна идти реакция обратная предыдущей, но это невозможно, так как кислая соль не может реагировать с слабой кислотой.
Ответ: 2356
Задача 10
Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $Cl_2$ и NaOH (хол. р-р) Б) C и $H_2SO_4$ (конц.) В) C и FeO Г) Cu и $H_2SO_4$ (конц.) |
1) $CuSO_4$, $SO_2$ и $H_2O$ 2) NaCl, NaClO и $H_2O$ 3) Fe и CO 4) $CuSO_4$ и $H_2$ 5) $CO_2$, $H_2O$ и $SO_2$ 6) NaCl, $NaClO_3$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Взаимодействие $Cl_2$ с холодным раствором NaOH — реакция диспропорционирования, хлор и понижает, и повышает свою степень окисления. Поскольку среда щелочная, а раствор холодный, то получаются соли — соляной кислоты (хлорид натрия NaCl) и хлорноватистой кислоты (гипохлорит натрия NaClO), а также вода, которые предложены во второй строке.
Б) В реакции углерода с концентрированной серной кислотой углерод является восстановителем и окисляется до углекислого газа $СО_2$, а серная кислота — окислителем и восстанавливается до оксида серы (IV) $SO_2$, оставшиеся водород и кислород образуют воду.
В) Взаимодействие оксидов среднеактивных и малоактивных металлов с углеродом — один из способов получения чистых металлов, в реакции углерода с оксидом железа (II) образуется железо Fe и угарный газ СО.
Г) В реакции меди с концентрированной серной кислотой медь является восстановителем и окисляется до сульфата меди (II), а серная кислота — окислителем и восстанавливается до до оксида серы (IV) $SO_2$, оставшиеся водород и кислород образуют воду.
Ответ: 2531
Задача 11
Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $Al(OH)_3$ и $H_2SO_4$ Б) $Al(OH)_3$ и NaOH (р-р) В) $Al(OH)_3$ и NaOH (сплавление) Г) $Al(OH)_3$ (нагревание) |
1) $Al_2(SO_4)_3$ и $H_2$ 2) $Al_2(SO_4)_3$ и $H_2O$ 3) $NaAlO_2$ и $H_2$ 4) $NaAlO_2$ и $H_2O$ 5) $Na[Al(OH)_4]$ 6) $Al_2O_3$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) В реакции кислоты и основания образуется соль и вода. Продукты взаимодействия $Al(OH)_3$ + $H_2SO_4$ = $Al_2(SO_4)_3$ и $H_2O$.
Б) $Al(OH)_3$ — амфотерный гидроксид, поэтому способен реагировать с щелочами. Если реакция протекает в растворе, то образуется комплексная соль — тетрагидроксоалюминат натрия $Na[Al(OH)_4]$.
В) Если в реакции амфотерного гидроксида со щёлочью отсутствует вода (происходит сплавление), то образуется средняя соль и вода. Продукт сплавления гидроксида алюминия с гидроксидом натрия — алюминат натрия $NaAlO_2$ и вода $H_2О$.
Г) При нагревании слабые основания разлагаются на оксид и воду. Продукты разложения $Al(OH)_3$ = $Al_2O_3$ + $H_2O$.
Ответ: 2546
Задача 12
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) преимущественно образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
| А) $Al_2O_3$ и KOH (сплавление) Б) $Al_2O_3$ и KOH (р-р) В) $Al_2O_3$ и $K_2CO_3$ (сплавление) Г) $Al_2O_3$ и HCl (р-р) |
1) $KAlO_2$ 2) $KAlO_2$ и $H_2O$ 3) $KAlO_2$ и $CO_2$ 4) $K[Al(OH)_4]$ 5) $AlCl_3$ и $H_2O$ 6) $AlCl_3$ и $H_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $2KOH + Al_2O_3$ =(сплавление) $2KAlO_2 + H_2O$
Б) $Al_2O_3 + 2KOH + 3H_2O = 2K[Al(OH)_4]$
В) $Al_2O_3 + K_2CO_3 = CO_2 + 2KAlO_2$
Г) $Al_2O_3 + 6HСl$(р-р) $= 2AlCl_3 + 3H_2O$
Ответ: 2435
Задача 13
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $K_2HPO_4 + H_3PO_4$ Б) $PH_3 + HNO_{3(конц.)}$ В) $KH_2PO_4 + KOH$ Г) $P + HNO_{3(конц.)}$ |
1) $KH_2PO_4$ 2) $K_3PO_4$ 3) $К_2HPO_4, H_2O$ 4) $NO_2, H_2O, H_3PO_4$ 5) $NO_2, H_2O, P_2O_5$ 6) $PH_3, NO_2, H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Гидрофосфат калия $K_2HPO_4$ — дизамещённая соль трёхосновной фосфорной кислоты, может реагировать с $H_3PO_4$, образуя $KH_2PO_4$:
$К_2HPO_4 + H_3PO_4 = 2КH_2PO_4$ (ответ А — 1)
Б) Фосфин $PH_3$ проявляет восстановительные свойства и при взаимодействии с окислителями будет переходить в соединения $P^{+5}$:
$PH_3 + 8HNO_3 = H_3PO_4 + 8NO_2↑ + 4H_2O$ (ответ Б — 4)
В) Дигидрофосфат калия $KH_2PO_4$ — кислая соль трёхосновной кислоты, может реагировать со щелочами с образованием гидрофосфата или фосфата, в зависимости от соотношения реагентов:
$KH_2PO_4 + KOH = K_2HPO_4 + H_2O$ (ответ В — 3) или
$KH_2PO_4 + 2KOH = K_3PO_4 + H_2O$
Г) Фосфор окисляется сильными окислителями до степени окисления +5:
$P + 5HNO_3 = H_3PO_4 + 5NO_2↑ + H_2O$ (ответ Г — 4)
Ответ: 1434
Задача 14
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Zn и $H_2SO_4$ (разб.) Б) ZnO и $H_2SO_4$ (разб.) В) Zn и $H_2SO_4$ (конц.) Г) ZnS и $O_2$ (изб., нагревание) |
1) $ZnSO_4$ и $H_2O$ 2) ZnO и $SO_2$ 3) $ZnSO_4$, $H_2S$ и $H_2O$ 4) ZnO и $SO_3$ 5) $ZnSO_4$ и $H_2$ 6) ZnS, $SO_2$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Цинк Zn — активный металл. Может реагировать с неметаллами, кислотами с выделением водорода (за исключением азотной и концентрированной серной кислот), солями и оксидами менее активных металлов и некоторыми другими окислителями.
Серная кислота $H_2SO_{4(разб.)}$ — сильная двухоснóвная кислота, проявляет все общие свойства кислот: диссоциация, окрашивание индикаторов, взаимодействие с металлами, находящимися в ряду активности левее водорода с выделением водорода, взаимодействие с оснóвными и амфотерными оксидами и гидроксидами, а также солями, если соблюдаются условия протекания реакций обмена.
$Zn + H_2SO_{4(разб.)} = ZnSO_4 + H_2$
Вывод: ответ А — 5.
Б) Оксид цинка ZnO — амфотерный оксид, $H_2SO_4$ — сильная кислота. Возможна реакция
$ZnO + H_2SO_{4(разб.)} = ZnSO_4 + H_2O$
Вывод: ответ Б — 1.
В) Концентрированная серная кислота $H_2SO_4$ является сильным окислителем. Окислительные свойства проявляет сера в степени окисления +6. С малоактивными восстановителями (тяжёлые металлы, неметаллы) восстанавливается до степени окисления +4, с активными металлами — преимущественно до степени окисления –2.
$4Zn + 5H_2SO_{4(конц.)} = 4ZnSO_4 + H_2S + 4H_2O$
Вывод: ответ В — 3.
Г) При обжиге сульфидов всегда образуется оксид серы(IV) и, как правило, оксид второго элемента в высокой устойчивой степени окисления.
$2ZnS + 3O_2 = 2ZnO + 2SO_2$
Вывод: ответ Г — 2.
Ответ: 5132
Задача 15
Установите соответствие между формулой вещества и продуктами термического разложения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ РАЗЛОЖЕНИЯ |
| А) KNO3 Б) Fe(NO3)3 В) Ni(NO3)2 Г) Hg(NO3)2 |
1) нитрит металла, кислород 2) оксид металла, кислород, оксид азота(IV) 3) металл, оксид азота(IV), кислород 4) металл, оксид азота(II), кислород 5) металл, азот, кислород 6) оксид металла, оксид азота(I), кислород |
Запишите выбранные цифры под соответствующими буквами.
Решение
Продукты термического разложения солей азотной кислоты и металлов определяются положением металла в ряду активности. При разложении солей, образованных металлами, расположенными левее магния (кроме лития), образуются нитрит металла и кислород. Если металл расположен от магния до меди или это литий, то образуются оксид металла, оксид азота(IV) и кислород. Продукты разложения солей менее активных, чем медь, металлов — металл, оксид азота(IV) и кислород.
А) $2KNO_3 = 2KNO_2 + O_2$
Вывод: ответ А — 1.
Б) $4Fe(NO_3)_3 = 2Fe_2O_3 + 12NO_2 + 3O_2$
Вывод: ответ Б — 2.
В) $2Ni(NO_3)_2 = 2NiO + 4NO_2 + O_2$
Вывод: ответ В — 2.
Г) $Hg(NO_3)_2 = Hg + 2NO_2 + O_2$
Вывод: ответ Г — 3.
Ответ: 1223
Рекомендуемые курсы подготовки
Ответом к заданиям 1–25 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами.
Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22–25 могут повторяться.
Задание №1
Из указанных в ряду химических элементов выберите два элемента, атомы которых в основном состоянии содержат одинаковое число спаренных электронов на внешнем энергетическом уровне:
1) Ca 2) F 3) Al 4) S 5) Na
Запишите в поле ответа номера выбранных элементов.
Задание №2
Из указанных в ряду химических элементов выберите три элемента, принадлежащих к главной подгруппе одной группы Периодической системы химических элементов Д.И. Менделеева.
Расположите выбранные элементы в порядке возрастания атомного радиуса.
1) Na 2) Ag 3) K 4) Au 5) Cs
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Задание №3
Из предложенного перечня химических элементов выберите два таких, которые способны проявлять степени окисления +1, +3 и +5 в сложных веществах:
1) N 2) Al 3) Cl 4) Si 5) C
Запишите в поле ответа номера выбранных элементов.
Задание №4
Из предложенного перечня веществ выберите два с таким же типом химической связи, как у кремния.
1) Cl2
2) SiC
3) SiCl4
4) H2
5) Fe
Запишите в поле ответа номера выбранных соединений.
Задание №5
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) соли слабой кислоты; Б) амфотерного гидроксида; В) основного оксида.
| 1) NaNO3 | 2) BeO | 3) Ba(OH)2 |
| 4) PbO | 5) KF | 6) Zn(OH)2 |
| 7) Mg(OH)2 |  SrO SrO |
9) LiClO3 |
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
[adsp-pro-3]
Задание №6
В пробирку с концентрированной холодной азотной кислотой внесли порошок вещества Х, в результате чего он растворился с выделением окрашенного газа и образованием бесцветного раствора. В пробирку с горячей концентрированной азотной кислотой внесли порошок вещества Y, который при растворении дал окрашенный раствор. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) серебро
2) железо
3) карбонат цинка
4) оксид магния
5) сульфат алюминия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задание №7
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №8
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №9
В заданной схеме превращений
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно:
1) карбонат свинца
2) нитрат свинца
3) магний
4) медь
5) оксид цинка
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
[adsp-pro-3]
Задание №10
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №11
Из предложенного перечня соединений выберите два таких, которые являются гомологами.
1) н-бутан
2) циклопропан
3) циклопентен
4) этен
5) пропан
Запишите в поле ответа номера выбранных веществ.
Задание №12
Из приведенного списка соединений выберите все такие, из которых в одну стадию не может быть получен дивинил.
Запишите в поле ответа номера выбранных веществ.
Ответ:___________________
Задание №13
Из предложенного перечня соединений, выберите два вещества, с которыми может вступать в реакцию аминоуксусная кислота.
1) сульфат натрия
2) бензол
3) метан
4) метанол
5) глицин
Запишите в поле ответа номера выбранных веществ.
[adsp-pro-3]
Задание №14
Установите соответствие между дигалогеналканом и продуктом его взаимодействия со спиртовым раствором щелочи: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ДИГАЛОГЕНАЛКАН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
А) 1,2-дихлорэтан Б) 1,2-дихлорпропан В) 2,3-дибромбутан Г) 1,1-дибромбутан |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №15
Установите соответствие между названием спирта и основным продуктом его внутримолекулярной дегидратации: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СТРУКТУРА СПИРТА | ПРОДУКТ ДЕГИДРАТАЦИИ |
|
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №16
Задана следующая схема превращений веществ
Определите, какие из указанных веществ являются веществами X и Y.
1) (NH4)2CO3
2) H2
3) Cu(OH)2
4) CuO
5) CH2O
Запишите в поле ответа номера выбранных веществ.
Задание №17
Из предложенного перечня типов реакций выберите все такие, к которым можно отнести реакцию
4KClO3 = KCl + 3KClO4
1) каталитическая
2) некаталитическая
3) сопропорционирования
4) диспропорционирования
5) соединения
6) нейтрализации
Запишите в поле ответа номера выбранных типов реакций.
Ответ:___________________
Задание №18
Из предложенных пар реагентов выберите все, реакция между которыми протекает быстрее при одинаковых условиях, чем между 10%-ным раствором соляной кислоты и железом:
1) литий и 10%-ный раствор соляной кислоты
2) растворы сульфита калия и бромида натрия
3) железо и сера
4) алюминий и 10%-ный раствор бромоводородной кислоты
5) натрий и кремний
Запишите в поле ответа номера выбранных пар реагентов.
Ответ:___________________
Задание №19
Установите соответствие между формулой частицы и окислительно-восстановительной функцией, которую может проявлять в ней азот: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ЧАСТИЦА | АЗОТ В НЕЙ |
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №20
Установите соответствие между веществом и продуктами, образующимися на инертных электродах при электролизе его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Для выполнения задания 21 используйте следующие справочные данные. Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V). pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
Задание №21
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) фенол
2) хлоруксусная кислота
3) гидроксид калия
4) фторид натрия
Запишите номера веществ в порядке убывания значения рН их водных растворов.
Задание №22
Установите соответствие между уравнением обратимой реакции и направлением смещения химического равновесия при увеличении давления: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №23
В замкнутый реактор, содержащий катализатор, поместили смесь угарного газа с хлором и нагрели. В результате протекания обратимой реакции
СO(г) + Cl2(г) ⇆ COCl2(г)
в системе установилось равновесие. При этом исходная концентрация хлора была равна 0,6 моль/л, а равновесные концентрации угарного газа и фосгена (СОCl2) — 0,2 моль/л и 0,1 моль/л соответственно.
Определите исходную концентрацию угарного газа (Х) и равновесную концентрацию хлора (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,45 моль/л
5) 0,5 моль/л
6) 0,55 моль/л
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №24
Установите соответствие между формулами двух веществ и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАГЕНТ |
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
[adsp-pro-3]
Задание №25
Установите соответствие между кратким описанием и соответствующим ему процессом нефтепереработки: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОПИСАНИЕ | ПРОЦЕСС НЕФТЕПЕРЕРАБОТКИ |
|
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответом к заданиям 26–28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
Задание №26
Какую массу соли надо добавить к 150 г 14%-ного раствора нитрата бария для получения раствора с массовой долей растворенного вещества 15%. Запишите число с точностью до сотых.
Ответ:___________________ г.
Задание №27
Реакция серы с фтором происходит согласно термохимическому уравнению
S(ромб) + 3F2(г) → SF6(г) + Q
Рассчитайте тепловой эффект реакции Q, если при образовании 50 г фторида серы (VI) выделяется 413 кДж энергии. Ответ округлите до целых.
Ответ:___________________ кДж.
Задание №28
При нагревании навески фосфора массой 204,6 мг с навеской технического магния массой 264 мг, содержащего 10% инертных примесей, был получен твердый продукт. Вычислите массовую долю примесей в нем. Ответ округлите до десятых.
Ответ:___________________ %.
Не забудьте перенести все ответы в бланк ответов № 1 в соответствии с инструкцией по выполнению работы. Проверьте, чтобы каждый ответ был записан в строке с номером соответствующего задания.
Для выполнения заданий 29, 30 используйте следующий перечень веществ:
раствор серной кислоты, гидроксид меди (II), дихромат калия, диоксид кремния, сульфид натрия, сульфат железа (II). Допустимо использование водных растворов веществ.
Задание №29
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделение осадка или газа в ходе этой реакции не наблюдается.
В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
[adsp-pro-3]
Задание №30
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, сопровождающаяся образованием голубого раствора. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Задание №31
Через водный раствор сульфата железа (III) пропустили избыток сероводорода. Полученный осадок отфильтровали и растворили в концентрированной азотной кислоте. Выделившийся газ поглотили водным раствором гидроксида бария, после чего к полученному раствору добавили раствор нитрата аммония и нагрели. Напишите уравнения четырёх описанных реакций.
Задание №32
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Задание №33
При сжигании навески неизвестного вещества массой 3,5 г образовалось 4,48 л углекислого (н.у.) газа и 2,7 г воды. Определите молекулярную формулу вещества и его структуру, если известно, что оно не реагирует с аммиачным раствором оксидом серебра и способно полимеризоваться.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции искомого соединения с избытком водорода в присутствии катализатора (используйте структурные формулы органических веществ).
Задание №34
К 47 г насыщенного раствора сульфата меди (II) добавили 5,6 г железного порошка. После окончания реакции к раствору добавили 117 г раствора сульфида натрия, в котором массовая доля протонов из соли равна 4,87%. Определите массовую долю сульфида натрия в конечном растворе, если известно, что в 100 г воды растворяется 20,5 г сульфата меди (II). (Считайте, что в условиях задачи при протекании реакции между сульфатом меди (II) и железом никакие соли в осадок не выпадают.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Ответы к первой части варианта №1
| № Задания, ответ | № Задания, ответ |
|
|
[adsp-pro-3]
Ответы ко второй части варианта №1
Задание 29
Вариант ответа:
K2Cr2O7 + 6FeSO4 + 7H2SO4 = K2SO4 + Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O
1∙ | 2Cr+6 + 6ē → 2Cr+3
6∙ | Fe+2 – 1ē → Fe+3
Железо в степени окисления +2 (или сульфат железа(II)) является восстановителем.
Хром в степени окисления +6 (или дихромат калия) – окислителем.
Задание 30
Вариант ответа:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Cu(OH)2 + 2H+ + SO42- = Cu2+ + SO42- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
Задание 31
1) Fe2(SO4)3 + H2S → 2FeSO4 + S + H2SO4
2) S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
3) 2Ba(OH)2 + 4NO2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
4) Ba(NO2)2 + 2NH4NO3 → Ba(NO3)2 + 2N2 + 4H2O
Комментарий к 4-й реакции: нитрат аммония имеет температуру разложения около 200 oC, то есть не будет разлагаться в водном растворе.
Задание 32
1) Бензойная кислота является производным бензола, содержащим ориентант II-го рода (мета-ориентант) − карбоксильную группу. Производные бензола с ориентантами II-го рода имеют более низкую активность, чем сам бензол, и реакции замещения в их случае происходят по мета-положению по отношению к заместителю:
1)
2)
3)
4)
5)
Задание 33
При сжигании навески неизвестного вещества массой 3,5 г образовалось 4,48 л углекислого (н.у.) газа и 2,7 г воды. Определите молекулярную формулу вещества и его структуру, если известно, что оно не реагирует с аммиачным раствором оксидом серебра и способно полимеризоваться.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции искомого соединения с избытком водорода в присутствии катализатора (используйте структурные формулы органических веществ).
Решение:
n(CO2) = V(CO2)/Vm(CO2) = 4,48/22,4 = 0,2 моль;
n(C) = n(CO2) = 0,2 моль;
m(C) = n(C) · M(C) = 0,2 · 12 = 2,4 г;
n(H2O) = n(H2O)/M(H2O) = 2,7/18 = 0,15 моль;
n(H) = 2n(H2O) = 2 · 0,15 = 0,3 моль;
m(H) = n(H)*M(H) = 0,3 · 1 = 0,3 г.
Проверим, есть ли в искомом соединении кислород:
m(O) = m(в-ва) − m(C) − m(H) = 3,5 г – 2,4 г – 0,3 г = 0,8 г, т.е. m(O) ≠ 0, значит кислород в соединении есть.
n(O) = m(O)/M(O) = 0,8/16 = 0,05 моль
Пусть простейшая формула искомого соединения CxHyOz, тогда:
x : y : z = n(C) : n(H) : n(O) = 0,2 : 0,3 : 0,05 = 4 : 6 : 1.
т.е. простейшая формула искомого вещества C4H6O
Истинная формула может отличаться от простейшей в целое число раз, т.е. ее можно записать как (C4H6O)k или C4kH6kOk, где k – некоторое целое положительное число. Задача на определение формулы в ЕГЭ считается решенной, если найдено хотя бы одно решение, удовлетворяющее условиям задачи. Поэтому будем искать решение, перебирая варианты, начиная с самого первого возможного значения k, т.е. единицы.
В случае, если k=1, истинная формула совпадает с простейшей, т.е. C4H6O.
Поскольку сказано, что искомое соединение способно полимеризоваться и не вступает в реакцию серебряного зеркала, можно предположить, что его структура будет иметь вид:
Тогда уравнение его взаимодействия с избытком водорода будет записываться следующим образом:
Задание 34
К 47 г насыщенного раствора сульфата меди (II) добавили 5,6 г железного порошка. После окончания реакции к раствору добавили 117 г раствора сульфида натрия, в котором массовая доля протонов из соли равна 4,87%. Определите массовую долю сульфида натрия в конечном растворе, если известно, что в 100 г воды растворяется 20,5 г сульфата меди (II). (Считайте, что в условиях задачи при протекании реакции между сульфатом меди (II) и железом никакие соли в осадок не выпадают.)
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение:
CuSO4 + Fe = FeSO4 + Cu
FeSO4 + Na2S = Na2SO4 + FeS
Рассчитаем массовую долю сульфата меди в стандартном насыщенном растворе, полученном растворением 20,5 г CuSO4 в 100 г воды:
ωст.(CuSO4) = mст.(CuSO4)/mст.(р-ра CuSO4) = mст.(CuSO4)/(mст.(H2O) + mст.(CuSO4)) = 20,5 г/(20,5 г + 100 г) = 0,1701 или 17,01 %
Концентрация насыщенного раствора для любой соли при одной и той же температуре величина постоянная, поэтому концентрация раствора массой 47 г из задачи совпадает с концентрацией раствора, полученного смешением 100 г воды с 20,5 г сульфата меди.
Тогда:
mисх.(CuSO4) = mисх.(р-ра CuSO4) ⋅ ωст.(CuSO4)/100% = 47 г · 0,1701 = 8 г;
n(CuSO4) = n(CuSO4)/M(CuSO4) = 8/160 = 0,05 моль;
n(Fe) = m(Fe)/M(Fe) = 5,6/56 = 0,1 моль;
nреаг.(Fe) = n(CuSO4) = 0,05 моль;
mреаг.(Fe) = nреаг.(Fe) · M(Fe) = 0,05 · 56 = 2,8 г;
n(Cu) = nреаг.(Fe) = 0,05 моль;
m(Cu) = n(Cu) · M(Cu) = 0,05 · 64 = 3,2 г;
Определим массу, приходящуюся на протоны от соли:
m(р+ из Na2S) = mисх.(р-ра Na2S) · w(р+ из Na2S)/100% = 117 · 0,0487 = 5,7 г;
Далее вычислим количество протонов и самой соли:
n(р+ из Na2S) = m(р+ из Na2S)/M(р+) = 5,7/1 = 5,7 моль;
n(р+)/n(Na2S) = N(р+)/N(Na2S) = 38/1
nисх.(Na2S) = n(р+)/38 = 5,7/38 = 0,15 моль
Далее вычислим количество и массу оставшегося сульфида натрия:
nреаг.(Na2S) = n(FeSO4) = 0,05 моль;
nост.(Na2S) = 0,15 – 0,05 = 0,1 моль;
mост.(Na2S) = 78 · 0,1 = 7,8 г;
n(FeS) = n(FeSO4) = 0,05 моль;
m(FeS) = n(FeS) · M(FeS) = 0,05 · 88 = 4,4 г;
Вычислим массу конечного раствора:
m(р-ра конечн.) = m(р-ра CuSO4) + mреаг.(Fe) – m(Cu) + mисх.(р-ра Na2S) – m(FeS) = 47 г + 2,8 г – 3,2 г + 117 г – 4,4 г = 159,2 г;
Определим массовую долю сульфида натрия в конечном растворе:
ωконечн.(Na2S) = 100% · mост.(Na2S)/m(р-ра конечн.) = 100% · 7,8 г/159,2 г = 4,9 %.
Ответ: 4,9%
[adsp-pro-10]