Задания
Версия для печати и копирования в MS Word
В пробирку с раствором соли серной кислоты Х добавили раствор соли Y. В результате реакции наблюдали выпадение осадка.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
Указанные вещества вступают в реакцию
.
Здесь Х — , а Y —
.
Ответ: 51.
Источник: РЕШУ ЕГЭ
Спрятать решение
·
·
Федя Горшков 13.01.2017 14:39
А я выбрал ответ 15 и у меня засчитало за ошибку. Почему?
Александр Иванов
Потому что Ваш ответ неверный.
В ответе важен порядок цифр, о чём написано в условии
София Гофман 03.12.2017 16:28
Почему не 3, ведь она тоже образует осадок с 1?
Ирина Широкова
Сульфат стронция нерастворим, поэтому не вступит в реакцию с другой солью.
В пробирку с раствором соли серной кислоты Х добавили раствор соли Y. В результате реакции наблюдали выпадение осадка.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| X | Y |
Подборка тренировочных вариантов ЕГЭ 2022 по химии с ответами.
Тренировочные варианты ЕГЭ 2022 по химии
| vk.com/repetitor_po_himii_i_biologii | |
| Вариант 1 | Ответы |
| vk.com/chem4you | |
| скачать вариант 1 | ответы |
| скачать вариант 2 | ответы |
| скачать вариант 3 | ответы |
| скачать вариант 4 | ответы |
| скачать вариант 5 | ответы |
| скачать вариант 6 | ответы |
| скачать вариант 7 | ответы |
| скачать вариант 8 | ответы |
| скачать вариант 9 | ответы |
| скачать вариант 10 | ответы |
| скачать вариант 11 | ответы |
| скачать вариант 12 | ответы |
| скачать вариант 13 | ответы |
| скачать вариант 14 | ответы |
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| Вариант 6 | скачать |
| Вариант 7 | скачать |
| Вариант 8 | скачать |
| Вариант 9 | скачать |
| Вариант 10 | скачать |
| Вариант 12 | скачать |
| Вариант 13 | скачать |
| Вариант 14 | скачать |
| Широкопояс (Источник: vk.com/naukadljatebja) | |
| Variant 1 | скачать |
| Variant 2 | скачать |
| Variant 3 | скачать |
| Variant 4 | скачать |
| Variant 5 | скачать |
| Variant 6 | скачать |
| Variant 7 | скачать |
| Variant 8 | скачать |
| Variant 9 | скачать |
| Variant 10 | скачать |
| Variant 11 | скачать |
| Variant 12 | скачать |
| Variant 13 | скачать |
| Variant 14 | скачать |
| Variant 15 | скачать |
| Variant 16 | скачать |
| Variant 17 | скачать |
| Variant 18 | скачать |
| Variant 19 | скачать |
| Variant 20 | скачать |
| Variant 21 | скачать |
| Variant 22 | скачать |
| Variant 23 | скачать |
| Variant 24 | скачать |
| Variant 25 | скачать |
| Variant 26 | скачать |
| Variant 27 | скачать |
| Variant 28 | скачать |
| Variant 29 | скачать |
| Variant 30 | скачать |
| vk.com/shkolkovo_him | |
| вариант 1 | разбор |
| вариант 2 | разбор |
| вариант 3 | ответы |
| вариант 4 | ответы |
| вариант 5 | ответы |
| vk.com/repetitor_korsakova | |
| variant 1 | otvet |
| variant 2 | otvet |
| variant 3 | otvet |
| СтатГрад | |
| Вариант 1-2 | критерии оценивания |
| Вариант 3-4 | критерии оценивания |
| vk.com/schoolzhukova | скачать вариант
ответы |
| → купить сборники типовых вариантов ЕГЭ по химии |
Варианты в соответствии с новой демоверсией ЕГЭ 2022 по химии.
→ Тренировочные варианты ЕГЭ 2021 по химии
Подходы к отбору содержания, разработке структуры КИМ ЕГЭ
Отбор содержания заданий КИМ для проведения ЕГЭ по химии в 2022 г. в целом осуществляют с сохранением установок, на основе которых формировались экзаменационные модели предыдущих лет. В числе этих установок наиболее важными с методической точки зрения являются следующие.
КИМ ориентированы на проверку усвоения системы знаний и умений, формирование которых предусмотрено действующими программами по химии для общеобразовательных организаций. Во ФГОС эта система знаний и умений представлена в виде требований к предметным результатам освоения учебного предмета. С данными требованиями соотносится уровень предъявления в КИМ проверяемых элементов содержания.
Экзаменационные варианты по химии содержат задания, различные по форме предъявления условия и виду требуемого ответа, по уровню сложности, а также по способам оценки их выполнения. Как и в предыдущие годы, задания КИМ ЕГЭ 2022 г. построены на материале основных разделов школьного курса химии: общей, неорганической и органической, изучение которых обеспечивает овладение учащимися системой химических знаний.
К числу главных составляющих этой системы относятся: ведущие понятия о химическом элементе, веществе и химической реакции; основные законы и теоретические положения химии; знания о системности и причинности
химических явлений, генезисе веществ, способах познания веществ.
В стандарте эта система знаний представлена в виде требований к уровню подготовке выпускников. В целях обеспечения возможности дифференцированной оценки учебных достижений выпускников КИМ ЕГЭ осуществляют проверку освоения основных образовательных программ по химии на трёх уровнях сложности: базовом, повышенном и высоком.
При разработке КИМ особое внимание было уделено реализации требований к конструированию заданий различного типа. Каждое задание строилось таким образом, чтобы его содержание соответствовало требованиям к уровню усвоения учебного материала и формируемым видам учебной деятельности.
Учебный материал, на основе которого строились задания, отбирался по признаку его значимости для общеобразовательной подготовки выпускников средней школы. Большое внимание при конструировании заданий было уделено усилению деятельностной и практико-ориентированной составляющей их содержания. Данный подход позволяет усилить дифференцирующую способность экзаменационной модели, так как требует от обучающихся последовательного выполнения нескольких мыслительных операций с опорой на понимание причинно- следственных связей, умений обобщать знания, применять ключевые понятия и др.
Смотрите также:
В пробирку с раствором соли X добавили раствор вещества Y. В результате произошла реакция, которую описывает следующее сокращённое ионное уравнение:
$S^{2–} + 2Н^{+} = H_2S↑$
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- сульфит калия
- угольная кислота
- бромоводород
- сульфид цинка
- сульфид натрия
Запишите выбранные цифры под соответствующими буквами.
Сокращённое ионное уравнение: $S^{2–} + 2Н^{+} = H_2S$
описывает взаимодействие растворимого сульфида с сильной кислотой (реагенты должны быть сильными электролитами, чтобы диссоциировать на ионы в растворе). Среди предложенных веществ растворимым сульфидом является сульфид натрия, а сильной кислотой — бромоводород.
Ответ: 53
Реальный вариант ЕГЭ по химии-2022 с ответами и решениями. Вариант восстановлен по памяти, поэтому могут встречаться неточности в условиях и ответах.
Скачать реальный вариант ЕГЭ по химии 26 мая 2022 года можно здесь.
55
Реальный вариант ЕГЭ по химии-2022
1 / 28
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
1) N; 2) Mn; 3) Ca; 4) Br; 5) F.
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Из указанных в ряду химических элементов выберите два элемента с одинаковым строением внешнего энергетического уровня:
2 / 28
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
1) N; 2) Mn; 3) Ca; 4) Br; 5) F.
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Из указанных в ряду химических элементов выберите три p-элемента и расположите их в порядке возрастания кислотных свойств образуемых ими летучих водородных соединений.
3 / 28
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
1) N; 2) Mn; 3) Ca; 4) Br; 5) F.
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Из указанных в ряду химических элементов выберите два элемента, у которых разница между высшей и низшей степенями окисления одинаковы.
4 / 28
Из указанных в ряду химических элементов выберите два вещества с молекулярной кристаллической решеткой, в молекулах которых присутствуют ковалентные неполярные связи.
1) PCl3
2) н-бутан
3) NH4Br
4) H2O2
5) SrBr2
Запишите в поле ответа номера выбранных веществ.
5 / 28
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) соли хлорной кислоты; Б) щелочи; В) несолеобразующего оксида.
| (1) Угарный газ | (2) Ca(OH)2 | (3) оксид хрома (III) | |
| (4) KClO4 | (5) KCl | (6) Zn(OH)2 | |
| (7) KClO3 | (8) NO2 | (9) гидроксид хрома (III) |
Запишите в поле ответа в нужной последовательности номера ячеек, в которых расположены вещества.
6 / 28
В две пробирки добавили раствор вещества Х. К раствору в первой пробирке добавили раствор Ba(OH)2, при этом наблюдали образование осадка. Во вторую пробирку добавили раствор вещества Y, в ходе реакции наблюдали выделение газа с резким запахом. Определите вещества Х и Y.
1) HBr
2) NaOH
3) Ca(HCO3)2
4) (NH4)2HPO4
5) HF
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
7 / 28
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) CO2
Б) Mg В) NaI Г) AgNO3 |
1) BaCl2, CaCO3, Cl2
2) C, NaOH, Mg 3) H2S, KNO3, Fe 4) KBr, NH3(р-р), Na2S 5) AgNO3, Br2, CuSO4 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
8 / 28
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ |
| А) SO2(изб.) + KOH
Б) Si + KOH В) KHSO3 + KOH Г) SO2 + KOH(изб.) |
1) K2SO3 + H2O
2) KHSO4 3) KHS 4) K2SiO3 + H2 5) K2SiO3 + H2O 6) KHSO3 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
9 / 28
Задана следующая схема превращений веществ:
1) SO3
2) SO2
3) K2O
4) K2SO3(раствор)
5) K2SO4
Запишите в поле ответа выбранные цифры в нужной последовательности.
10 / 28
Установите соответствие между названием вещества и названием группы/класса соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ГРУППА/КЛАСС СОЕДИНЕНИЙ |
| А) триацетат целлюлозы
Б) дивинил В) диэтиловый эфир |
1) алкины
2) простые эфиры 3) сложные эфиры 4) алкадиены |
Запишите в поле ответа выбранные цифры в нужной последовательности.
11 / 28
Из предложенного перечня выберите пару веществ одного гомологического ряда.
1) бутанон — 2
2) бутаналь
3) циклогексанон
4) ацетон
5) анилин
Запишите номера выбранных ответов.
12 / 28
Из предложенного перечня выберите все вещества, которые при реакции с пропионовой кислотой образуют сложный эфир.
1) циклогексан
2) глицерин
3) гексанол-3
4) толуол
5) метиламин
Запишите номера выбранных ответов.
13 / 28
Из предложенного перечня выберите два вещества, с которыми реагирует аланин.
1) H3PO4
2) CH2OH-CH2OH
3) CH3-CH3
4) C6H5CH3
5) MgSO4
Запишите в поле ответа номера выбранных веществ.
14 / 28
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
| А) (CH3)2CHCOONa + NaOH →
Б) CH3CH2CH2COONa В) ClCH2CH2Cl + KOH(спирт) ⟶ Г) СlCH2CH2CH2Cl + Mg ⟶ |
1) этин
2) гексан 3) н-бутан 4) этилен 5) циклопропан 6) пропан |
Запишите в поле ответа выбранные цифры в нужной последовательности.
15 / 28
Установите соответствие между реакцией и веществом Х, которое участвует в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАКЦИЯ | ВЕЩЕСТВО Х |
| А) Х Б) Х В) Х Г) Х |
1) CH3CH(OH)CH3
2) CH3COCH3 3) CH3CH2OH 4) CH2(OH)CH2(OH)CH2(OH) 5) CH2(OH)-CH2(OH) 6) HCOONH4 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
16 / 28
Задана следующая схема превращений веществ:
н-бутан → Х → Y → уксусная кислота
Определите, какие из указанных веществ являются веществами X и Y.
1) бутен-2
2) бутен-1
3) 2-бромбутан
4) изобутан
5) ацетат калия
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
17 / 28
Из предложенного перечня выберите все окислительно-восстановительные реакции.
1) PCl5 → PCl3 + Cl2
2) CO + 2H2 → CH3OH
3) (CuOH)2CO3 → CuO + CO2 + H2O
4) (NH4)2CO3 → 2NH3 + CO2 + H2O
5) 4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Запишите в поле ответа номера выбранных типов реакций.
18 / 28
Из предложенного перечня выберите все реакции, скорость которых меньше скорости реакций гранул цинка с соляной кислотой (температура и концентрации кислот постоянные).
1) цинк + плавиковая кислота
2) железо + уксусная кислота
3) магний + соляная кислота
4) магний + серная кислота
5) раствор гидроксида натрия + серная кислота
Запишите в поле ответа номера выбранных внешних воздействий.
19 / 28
Установите соответствие между схемой реакции и восстановителем: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВОССТАНОВИТЕЛЬ |
| А) NO2 + LiOH → LiNO2 + LiNO3 + H2O
Б) NH3 + O2 → N2 + H2O В) Li + NH3 → LiNH2 + H2 |
1) NO2
2) NH3 3) LiOH 4) Li 5) O2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
20 / 28
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) KClO4
Б) Na2SO4 В) K2S |
1) H2; S
2) Na; O2 3) H2; Cl2 4) H2; O2 5) Na, SO2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
21 / 28
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
Расположите нижеприведенные вещества в порядке увеличения pH среды.
1) HBr
2) Cu(NO3)2
3) Na2SO4
4) KHCO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
22 / 28
Установите соответствие между способом воздействия на равновесную систему
SO2(г) + H2O(ж) ↔ H+ + HSO3− + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) уменьшение давления
Б) снижение температуры В) повышение концентрации HSO3− Г) добавление HCl |
1) в сторону прямой реакции
2) в сторону обратной реакции реакции 3) практически не смещается |
Запишите в поле ответа выбранные цифры в нужной последовательности.
23 / 28
В реактор постоянного объёма поместили метан и воду. В результате протекания реакции
CH4 + H2O → CO + 3H2
в реакционной системе установилось химическое равновесие. При этом исходная концентрация метана составила 0,6 моль/л, равновесные концентрации воды и водорода составляют 0,1 моль/л и 0,6 моль/л соответственно.
Определите равновесную концентрацию метана (X) и исходную концентрацию воды (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите выбранные номера поле ответа в нужной последовательности.
24 / 28
24. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) пропанол-1 + K
Б) бутен-1 + H2 В) пентен-2 + Br2 Г) фенол (тв.) + NaOH |
1) выделение газа
2) растворение осадка 3) фиолетовая окраска раствора 4) выпадение красно-коричневого осадка 5) видимые признаки отсутствуют 6) обесцвечивание раствора |
Запишите в поле ответа выбранные цифры в нужной последовательности.
25 / 28
Установите соответствие между названием вещества и основной областью применения вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) озон Б) метан В) пропан |
1) в качестве топлива 2) в синтезе NH3 3) в качестве растворителя 4) водоочистка |
Запишите в поле ответа выбранные цифры в нужной последовательности.
26 / 28
Вычислите, какую массу глюкозы (в граммах) необходимо добавить к 200 г 5%-ного раствора глюкозы, чтобы получить 16%-ный раствор. Запишите число с точностью до целых.
27 / 28
В результате реакции, термохимическое уравнение которой:
CaCO3 → CaO + CO2 – 143,5 кДж
поглотилось 726 кДж тепла. Определите массу карбоната кальция, который при этом разложился. (Запишите число точностью до целых.)
28 / 28
Определите массовую долю (в %) примеси в техническом карбиде кальция массой 200 г, если при обработке этого карбида водой выделился газ объемом 56 л (при н.у.). Ответ запишите с точностью до целых.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
1) N; 2) Mn; 3) Ca; 4) Br; 5) F.
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1. Из указанных в ряду химических элементов выберите два элемента с одинаковым строением внешнего энергетического уровня:
2. Из указанных в ряду химических элементов выберите три p-элемента и расположите их в порядке возрастания кислотных свойств образуемых ими летучих водородных соединений.
3. Из указанных в ряду химических элементов выберите два элемента, у которых разница между высшей и низшей степенями окисления одинаковы.
4. Из указанных в ряду химических элементов выберите два вещества с молекулярной кристаллической решеткой, в молекулах которых присутствуют ковалентные неполярные связи.
1) PCl3
2) н-бутан
3) NH4Br
4) H2O2
5) SrBr2
Запишите в поле ответа номера выбранных веществ.
5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) соли хлорной кислоты; Б) щелочи; В) несолеобразующего оксида.
| (1) Угарный газ | (2) Ca(OH)2 | (3) оксид хрома (III) | |
| (4) KClO4 | (5) KCl | (6) Zn(OH)2 | |
| (7) KClO3 | (8) NO2 | (9) гидроксид хрома (III) |
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
6. В две пробирки добавили раствор вещества Х. К раствору в первой пробирке добавили раствор Ba(OH)2, при этом наблюдали образование осадка. Во вторую пробирку добавили раствор вещества Y, в ходе реакции наблюдали выделение газа с резким запахом. Определите вещества Х и Y.
1) HBr
2) NaOH
3) Ca(HCO3)2
4) (NH4)2HPO4
5) HF
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
7. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) CO2
Б) Mg В) NaI Г) AgNO3 |
1) BaCl2, CaCO3, Cl2
2) C, NaOH, Mg 3) H2S, KNO3, Fe 4) KBr, NH3(р-р), Na2S 5) AgNO3, Br2, CuSO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
8. Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ |
| А) SO2(изб.) + KOH
Б) Si + KOH В) KHSO3 + KOH Г) SO2 + KOH(изб.) |
1) K2SO3 + H2O
2) KHSO4 3) KHS 4) K2SiO3 + H2 5) K2SiO3 + H2O 6) KHSO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
9. Задана следующая схема превращений веществ:
1) SO3
2) SO2
3) K2O
4) K2SO3(раствор)
5) K2SO4
Запишите в таблицу выбранные цифры под соответствующими буквами.
10. Установите соответствие между названием вещества и названием группы/класса соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ГРУППА/КЛАСС СОЕДИНЕНИЙ |
| А) триацетат целлюлозы
Б) дивинил В) диэтиловый эфир |
1) алкины
2) простые эфиры 3) сложные эфиры 4) алкадиены |
Запишите в таблицу выбранные цифры под соответствующими буквами.
11. Из предложенного перечня выберите пару веществ одного гомологического ряда.
1) бутанон — 2
2) бутаналь
3) циклогексанон
4) ацетон
5) анилин
Запишите номера выбранных ответов.
12. Из предложенного перечня выберите все вещества, которые при реакции с пропионовой кислотой образуют сложный эфир.
1) циклогексан
2) глицерин
3) гексанол-3
4) толуол
5) метиламин
Запишите номера выбранных ответов.
13. Из предложенного перечня выберите два вещества, с которыми реагирует аланин.
1) H3PO4
2) CH2OH-CH2OH
3) CH3-CH3
4) C6H5CH3
5) MgSO4
Запишите в поле ответа номера выбранных веществ.
14. Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
| А) (CH3)2CHCOONa + NaOH →
Б) CH3CH2CH2COONa В) ClCH2CH2Cl + KOH(спирт) ⟶ Г) СlCH2CH2CH2Cl + Mg ⟶ |
1) этин
2) гексан 3) н-бутан 4) этилен 5) циклопропан 6) пропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
15. Установите соответствие между реакцией и веществом Х, которое участвует в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАКЦИЯ | ВЕЩЕСТВО Х |
| А) Х Б) Х В) Х Г) Х |
1) CH3CH(OH)CH3
2) CH3COCH3 3) CH3CH2OH 4) CH2(OH)CH2(OH)CH2(OH) 5) CH2(OH)-CH2(OH) 6) HCOONH4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
16. Задана следующая схема превращений веществ:
н-бутан → Х → Y → уксусная кислота
Определите, какие из указанных веществ являются веществами X и Y.
1) бутен-2
2) бутен-1
3) 2-бромбутан
4) изобутан
5) ацетат калия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
17. Из предложенного перечня выберите все окислительно-восстановительные реакции.
1) PCl5 → PCl3 + Cl2
2) CO + 2H2 → CH3OH
3) (CuOH)2CO3 → CuO + CO2 + H2O
4) (NH4)2CO3 → 2NH3 + CO2 + H2O
5) 4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Запишите в поле ответа номера выбранных типов реакций.
18. Из предложенного перечня выберите все реакции, скорость которых меньше скорости реакций гранул цинка с соляной кислотой (температура и концентрации кислот постоянные).
1) цинк + плавиковая кислота
2) железо + уксусная кислота
3) магний + соляная кислота
4) магний + серная кислота
5) раствор гидроксида натрия + серная кислота
Запишите в поле ответа номера выбранных внешних воздействий.
19. Установите соответствие между схемой реакции и восстановителем: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВОССТАНОВИТЕЛЬ |
| А) NO2 + LiOH → LiNO2 + LiNO3 + H2O
Б) NH3 + O2 → N2 + H2O В) Li + NH3 → LiNH2 + H2 |
1) NO2
2) NH3 3) LiOH 4) Li 5) O2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
20. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) KClO4
Б) Na2SO4 В) K2S |
1) H2; S
2) Na; O2 3) H2; Cl2 4) H2; O2 5) Na, SO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
21. Расположите нижеприведенные вещества в порядке увеличения pH среды.
1) HBr
2) Cu(NO3)2
3) Na2SO4
4) KHCO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
22. Установите соответствие между способом воздействия на равновесную систему
SO2(г) + H2O(ж) ↔ H+ + HSO3− + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) уменьшение давления
Б) снижение температуры В) повышение концентрации HSO3− Г) добавление HCl |
1) в сторону прямой реакции
2) в сторону обратной реакции 3) практически не смещается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
23. В реактор постоянного объёма поместили метан и воду. В результате протекания реакции
CH4 + H2O → CO + 3H2
в реакционной системе установилось химическое равновесие. Используя данные, приведённые в таблице, определите равновесную концентрацию метана (X) и исходную концентрацию воды (Y). Объем постоянный.
| Реагент | СH4 | H2O | H2 |
| Исходная концентрация | 0,6 | 0 | |
| Равновесная концентрация | 0,1 | 0,6 |
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
24. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) пропанол-1 + K
Б) бутен-1 + H2 В) пентен-2 + Br2 Г) фенол (тв.) + NaOH |
1) выделение газа
2) растворение осадка 3) фиолетовая окраска раствора 4) выпадение красно-коричневого осадка 5) видимые признаки отсутствуют 6) обесцвечивание раствора |
Запишите в таблицу выбранные цифры под соответствующими буквами.
25. Установите соответствие между названием вещества и основной областью применения вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) озон Б) метан В) пропан |
1) в качестве топлива 2) в синтезе NH3 3) в качестве растворителя 4) водоочистка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
26. Вычислите, какую массу глюкозы (в граммах) необходимо добавить к 200 г 5%-ного раствора глюкозы, чтобы получить 16%-ный раствор. Запишите число с точностью до целых.
27. В результате реакции, термохимическое уравнение которой:
CaCO3 → CaO + CO2 – 143,5 кДж
поглотилось 726 кДж тепла. Определите массу карбоната кальция, который при этом разложился. (Запишите число точностью до целых.)
28. Определите массовую долю (в %) примеси в техническом карбиде кальция массой 200 г, если при обработке этого карбида водой выделился газ объемом 56 л (при н.у.). Ответ запишите с точностью до целых.
СaC2 + 2H2O → Ca(OH)2 + CH≡CH
n(CH≡CH) = 2,5 моль
n(CaC2)чист = 2,5 моль
m(C2H2) = 160 г
m(примеси) = 200 — 160 = 40 г
ω(примеси) = 40/200 · 100% = 20%
Ответ: 20
Для выполнения заданий 29 и 30 используйте следующий перечень веществ: гидроксид железа (II), ацетат серебра, азотная кислота, сероводород, оксид хрома (III), хлорат калия.
Допустимо использование водных растворов веществ.
29. Из предложенного перечня веществ выберите вещества, при взаимодействии которых протекает окислительно-восстановительная реакция, при которой в растворе образуется только соль, и выделяется газ. Запишите уравнение реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение:
Fe(OH)2 + 4HNO3 = Fe(NO3)3 + NO2 + 3H2O
Fe+2 — 1e = Fe+3
N+5 + 1e = N+4
Fe(OH)2 за счет Fe+2 восстановитель
HNO3 за счет N+5 окислитель
30. Из предложенного перечня веществ выберите вещества, реакция обмена между которыми протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Решение:
CH3COOAg + HNO3 = CH3COOH + AgNO3
CH3COO— + Ag+ + H+ + NO3— = CH3COOH + Ag+ + NO3—
CH3COO— + H+ = CH3COOH
31. Перхлорат натрия смешали с оксидом хрома (III) и гидроксидом натрия. Полученную соль растворили в избытке серной кислоты. Затем в раствор добавили йодид натрия. Простое вещество, которое образовалось в ходе реакции, смешали c гидроксидом калия. Запишите уравнения четырех протекающих реакций.
Решение:
3NaClO4 + 4Cr2O3 + 16NaOH = 8Na2CrO4 + 3NaCl + 8Н2О
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 6NaI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7H2O
3I2 + 6KOH = 5KI + KIO3 + 3H2O
32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
метан → X1 → X2 → пара-нитротолуол → Х3 →
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
33. Смесь фосфида лития и нитрида лития, массовая доля протонов в которой составляет 46% от массы смеси растворили в соляной кислоте массой 200 г и массовой долей 36,5%. При этом выделилось 5,6 л газа. Определите массовую долю кислоты в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Решение:
Li₃P + 3HCl = 3LiCl + PH₃
Li₃N + 4HCl = 3LiCl + NH₄Cl
Объем фосфина V(PH3) = 5,6 л,
n(PH3) = 5,6/22,4 = 0,25 моль, масса: m(PH3) = 0,25*34 = 8,5 г
n(Li₃P) = 0,25 моль,
m(Li₃Р) = (7*3+31)*0,25 = 13 г
В одной частице фосфида лития Li₃P содержится 3*3+15 = 24 протона.
На 0,25 моль фосфида лития приходится 0,25*24 = 6 моль протонов.
Масса этих протонов составляет: mp(Li₃P) = 6 г
Пусть n(Li₃N) = x моль
В частице Li₃N содержится 3*3 + 7 = 16 протонов.
На х моль нитрида лития 16х моль протонов массой mp(Li₃N) = 16х г.
Масса нитрида лития: m(Li₃N) = (7*3+14)*х = 35х г
Получаем уравнение:
(16х + 6)/(35х + 13) = 0,46
n(Li₃N) = х = 0,2 моль
m(Li₃N) = (7*3+14)*0,2 = 7 г
Исходная соляная кислота:
n(HCl) = 200*0,365/36,5 = 2 моль
В первой реакции израсходуется: n1(HCl) = 0,25*3 = 0,75 моль
Во второй: n2(HCl) = 0,2*4 = 0,8 моль
В растворе останется:
nост(HCl) = 2 — 0,8 — 0,75 = 0,45 моль
mост(HCl) = 0,45*36,5 = 16,425 г
mр-ра = 200 + 7 + 13 — 8,5 = 204,5 г
ω(HCl) = 16,425/211,5 = 0,078 или 7,8%
Ответ: ω(HCl) = 7,8%
34. При сгорании 2,03 г органического вещества А образуется 1,904 л (н.у.) углекислого газа, 0,9 г воды, 0,112 л (н.у.) азота и 0,69 г карбоната калия. Известно, что в веществе А азотсодержащая функциональная группа находится в α-положении по отношению к кислородсодержащей, а в ароматическом ядре замещен только один атом водорода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов;
3) напишите уравнение реакции взаимодействия вещества А с избытком соляной кислоты (используйте структурные формулы органических веществ).
Ответы на реальный вариант ЕГЭ по химии-2022
| № задания | Ответ | № задания | Ответ | № задания | Ответ |
| 1 | 23 | 11 | 14 | 21 | 1234 |
| 2 | 154 | 12 | 23 | 22 | 2122 |
| 3 | 14 | 13 | 12 | 23 | 43 |
| 4 | 24 | 14 | 6215 | 24 | 1562 |
| 5 | 421 | 15 | 6531 | 25 | 411 |
| 6 | 42 | 16 | 31 | 26 | 26 |
| 7 | 2554 | 17 | 125 | 27 | 506 |
| 8 | 6411 | 18 | 12 | 28 | 20 |
| 9 | 24 | 19 | 124 | ||
| 10 | 342 | 20 | 441 |
Ответы на вторую часть можете найти выше.
Вторая часть из варианта с Дальнего Востока
Для выполнения заданий 29 и 30 используйте следующий перечень веществ: хлорид хрома (III), гидроксид калия, бром, хлороводород, перманганат натрия, нитрат аммония. Допустимо использование водных растворов веществ.
29. Из предложенного перечня выберите три вещества, окислительно-восстановительная реакция между которыми протекает с образованием желтого раствора. Ни осадка, ни газа при этом не образуется. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение:
2CrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KCl + 6KBr + 8H2O
Cr+3 — 3e = Cr+6
Br20 +2e = 2Br—
CrCl3 — восстановитель за счет Cr+3
Br2 0 — окислитель
30. Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми сопровождается образованием слабого растворимого основания. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Решение:
NH4NO3 + KOH = NH3·H2O + KNO3
NH4+ + NO3— + K+ + OH— = NH3·H2O + K+ + NO3—
NH4+ + OH— = NH3·H2O
31. Пероксид натрия поместили в раствор перманганата калия, подкисленный серной кислотой. В выделившемся при этом газе сожгли порошкообразное железо. Образовавшееся твёрдое вещество черного цвета поместили в раствор йодоводородной кислоты. Полученное соединение железа выделили, растворили в воде и смешали с раствором карбоната натрия. Напишите уравнения четырёх описанных реакций.
Решение:
5Na2O2 + 2KMnO4 + 8H2SO4 → 5O2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
3Fe + 2O2 = Fe3O4
Fe3O4 + 8HI = 3FeI2 + I2 + 4H2O
FeI2 + Na2CO3 = FeCO3 + 2NaI
32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
бутадиен-1,3 → X1 → метилпропан → X2 → Х3 → CH3-CO-CH3
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
Решение:
набираются
33. К 60 г раствора дигидрофосфата натрия, в котором 55% от общей массы раствора составляет масса протонов в ядрах всех атомов, добавили 40г 15%-ного раствора гидроксида натрия. Затем к образовавшемуся раствору добавили 51 г нитрата серебра. определите массовую долю нитрата серебря в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Решение набирается
34. При сгорании 2,03 г органического вещества А образуется 1,904 л (н.у.) углекислого газа, 0,9 г воды, 0,112 л (н.у.) азота и 0,69 г карбоната калия. Известно, что в веществе А азотсодержащая функциональная группа находится в α-положении по отношению к кислородсодержащей, а в ароматическом ядре замещен только один атом водорода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов;
3) напишите уравнение реакции взаимодействия вещества А с избытком соляной кислоты (используйте структурные формулы органических веществ).
Исполнитель преобразует число на экране.
У исполнителя есть две команды, которые обозначены латинскими буквами:
A. Вычти (2)
B. Найди целую часть от деления на (2)
Первая команда уменьшает число на экране на (2), вторая заменяет число на экране на целую часть от деления числа на (2).
Программа для исполнителя — это последовательность команд.
Сколько существует программ, для которых при исходном числе (40) результатом является число (2) и при этом траектория вычислений программы содержит число (10)?
Траектория вычислений программы — это последовательность результатов выполнения всех команд. Например, для программы (ABB) при исходном числе (13) траектория будет состоять из чисел (11), (5), (2)
Решение:
Python
def F(n, target):
if n < target:
return 0
if n == target:
return 1
return F(n - 2, target) + F(n // 2, target)
print(F(40, 10) * F(10, 2))
Ответ: (40)
Тренировочный вариант №1 (2023)
Часть 1

-
Определите, атомы каких из указанных в ряду элементов имеют одинаковую конфигурацию внешнего электронного слоя.

-
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в главных подгруппах. Расположите выбранные элементы в порядке уменьшения их атомных радиусов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Из числа указанных в ряду элементов выберите два элемента, которые способны проявлять несколько различных положительных степеней окисления.

-
Из предложенного перечня выберите два вещества ионного строения, в которых присутствуют ковалентные неполярные связи.
-
хлорид аммония
-
карбид кальция
-
пероксид водорода
-
оксалат калия
-
бензойная кислота
-
-
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите: А) соль азотистой кислоты, Б) комплексную соль, В) сульфид меди (II).
|
1 |
CuSO4 |
2 |
Cu2S |
3 |
[Ag(NH3)2]Cl |
|
4 |
Mg3N2 |
5 |
Fe(NO3)3 ∙ 9H2O |
6 |
KCl ∙ MgCl2 |
|
7 |
CuS |
8 |
H2[SiF6] |
9 |
Ba(NO2)2 |
Запишите в таблицу номер ячейки, в которой расположено вещество.
|
А |
Б |
В |
-
К одной из двух пробирок, содержащих раствор иодоводородной кислоты, добавили раствор вещества Х, а к другой – вещество Y. В результате в первой пробирке наблюдалось выпадение бесцветного желеобразного осадка, а во второй реакция протекала согласно ионному уравнению R(OH)2 + 2H+ = R2+ + 2H2O (где R – элемент). Определите вещества X и Y, которые могут вступать в описанные реакции.
-
Pb(OH)2
-
Cu(OH)2
-
AgNO3
-
Fe(OH)2
-
Na2SiO3
-
|
X |
Y |

-
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) FeCl3 (р-р) 1) H2S, CO2, NH3 (р-р)
Б) SO2 2) H2S, K2CO3 (тв), Fe
В) ZnS 3) Fe2(SO4)3 (р-р), KMnO4, NaOH
Г) CuSO4 (р-р) 4) HCl(р-р), O2, HNO3
5) NaOH, KCl, O2
|
А |
Б |
В |
Г |
-
Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) NaHCO3 (р-р) + Cl2 (t°) → 1) Na2CO3 + HCl
Б) Na2CO3 + HCl → 2) SiO2 + H2O
В) SiH4 + O2 (t°) → 3) NaCl + H2O + CO2
Г) H2SiO3 (t°) → 4) H2SiO3
-
SiO2 + H2
-
NaCl + NaClO3 + H2O + CO2
|
А |
Б |
В |
Г |
-
Задана следующая схема превращений веществ: Y

Определите, какие из указанных веществ являются веществами X и Y.
-
H2O
-
PCl5
-
KOH (изб.)
-
PH3
-
K3PO4
-
Установите соответствие между молекулярной формулой вещества и его тривиальным названием: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) C9H12 1) стирол
Б) C7H8 2) м-ксилол
В) C8H8 3) кумол
-
толуол
|
А |
Б |
В |
-
Из предложенного перечня выберите два вещества, все атомы углерода в молекулах которых находятся в состоянии sp2-гибридизации.
-
циклопентан
-
толуол
-
щавелевая кислота
-
стирол
-
пропадиен
-
-
Из предложенного перечня выберите все процессы, в ходе которых образуется продукт состава С4H6.
-
взаимодействие карбида натрия с бромметаном
-
димеризация ацетилена
-
гидрирование циклобутана
-
нагревание этанола со смесью ZnO и Al2O3
-
дегидрогалогенирование 1,4-дибромбутана
-
|
X |
Y |
-
Из предложенного перечня выберите два вещества, при взаимодействии которых образуется анилин.
-
хлорбензол и азот
-
нитробензол и водород
-
бензол и азотная кислота
-
хлорид фениламмония и щелочь
-
аммиак и циклогексан
-
-
Установите соответствие между названием вещества и продуктом его полного гидрирования: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) винилацетилен 1) бутан
Б) бензол 2) 3-метилбутен-1
В) изопрен 3) 2-метилбутан
Г) 3-метилбутин-1 4) 2-метилбутен-2
-
циклогексан
-
гексан
|
А |
Б |
В |
Г |
-
Установите соответствие между схемой реакции и углеродсодержащим продуктом, который преимущественно в ней образуется: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
H2, кат.

H2SO4, t°

KOH (водн.)


-
ацетат калия
-
диэтиловый эфир
-
Задана следующая схема превращений веществ:
Y

Определите, какие из указанных веществ являются веществами X и Y.
-
дихлорметан
-
гидроксид калия
-
метиламин
-
азотистая кислота
-
метан
|
X |
Y |
-
Выберите все вещества, взаимодействие которых с концентрированной бромоводородной кислотой относится к окислительно-восстановительным реакциям:
-
гидрокарбонат аммония
-
оксид марганца (IV)
-
железо
-
аммиак
-
хлор
-
-
Из предложенного перечня воздействий выберите все воздействия, которые приведут к увеличению скорости обратимой экзотермической реакции между кислородом и оксидом серы (IV):
-
повышение давления
-
понижение температуры
-
добавление ингибитора
-
повышение концентрации кислорода
-
повышение концентрации оксида серы (VI)
-
|
А |
Б |
В |
Г |
-
Установите соответствие между изменением степени окисления азота и веществами, при взаимодействии которых это изменение происходит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) N+4 → N0 1) NO2, KOH
Б) N0 → N−3 2) NO2, Zn
В) N+4 → N+5 3) N2, O2
4) N2, H2
5) NH4Cl, NaNO2
|
А |
Б |
В |
-
Установите соответствие между формулой соли и продуктом электролиза ее водного раствора, выделяющимся на катоде: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) AlCl3 1) металл
Б) Mn(NO3) 2) кислород
В) CuSO4 3) хлор
-
металл, водород
-
водород
-
оксид неметалла
|
А |
Б |
В |
-
Для выполнения задания используйте следующие справочные данные.
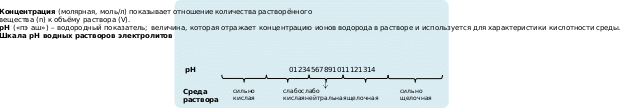
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
-
Хлорид бериллия
-
Фторид натрия
-
Нитрат калия
-
Гидроксид лития
Запишите номера веществ в порядке возрастания значения pH их водных растворов.




-
Установите соответствие между воздействием и направлением, в которое это воздействие сместит равновесие обратимой реакции:
С2H4(г) + H2(г) ⇄ С2H6(г) + Q.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) понижение температуры 1) в сторону продукта Б) введение никеля 2) в сторону реагентов В) понижение концентрации этана 3) не сместит
Г) увеличение объема сосуда (при неизменной температуре)
|
А |
Б |
В |
Г |
-
В реактор с постоянным объемом ввели водород, бромоводород и пары брома. Концентрации веществ составили 0,7 моль/л, 0,5 моль/л и 0,8 моль/л соответственно.
К моменту достижения равновесия концентрации брома и бромоводорода сравнялись. Определите равновесные концентрации водорода (X) и бромоводорода (Y). Выберите из списка номера правильных ответов:
-
0,1 моль/л
-
0,2 моль/л
-
0,3 моль/л
-
0,4 моль/л
-
0,6 моль/л
-
0,7 моль/л
|
X |
Y |
-
Установите соответствие между парой веществ и раствором реагента, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) CuS и FeS 1) KOH
Б) KCl и NaI 2) HCl
В) СaCO3 и BaSO3 3) Na3PO4
Г) MgSO4 и Al2(SO4)3 4) FeCl2
5) AgNO3
|
А |
Б |
В |
Г |
-
Установите соответствие между названием высокомолекулярного соединения и формулой соответствующего ему мономера: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
-
Вычислите массу воды (в граммах), которую надо добавить к 120 г 15% раствора соли, чтобы массовая доля вещества уменьшилась в шесть раз. Ответ запишите в виде целого числа.
-
В результате реакции, термохимическое уравнение которой: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + 3420 кДж
образовалось 8,96 л сернистого газа (н. у.). Вычислите количество выделившейся при этом теплоты (в кДж). Ответ запишите в виде целого числа.
-
Порцию нитрата цинка прокалили, полученную газовую смесь смешали с равной ей по объему (при одинаковых условиях) порцией кислорода. Вычислите объемную долю кислорода в конечной смеси. Ответ дайте в процентах в виде целого числа.
Часть 2

-
Из предложенного перечня выберите вещества, между которыми протекает окислительно-восстановительная реакция с образованием простого вещества. Один атом окислителя в ходе нее принимает один электрон. Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
А) крахмал 1) C6H5–CH2–CH(NH2)–COOH
Б) натуральный каучук 2) CH2=CH–CH=CH2
|
А |
Б |
В |
В) полипептид 3) CH2=C(CH3)–CH=CH2 4) С6H12O6
-
Из предложенного перечня веществ выберите среднюю соль и вещество, реакция ионного обмена между которыми протекает с образованием слабой кислородсодержа- щей кислоты. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ.
-
Перманганат калия прокалили. Выделившийся газ пропустили над влажным гидроксидом железа (II) и наблюдали изменение окраски осадка. Полученное вещество сплавили с гидроксидом натрия. Твердый продукт сплавления растворили в избытке серной кислоты. Составьте уравнения четырех описанных реакций.
-
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

O




H
этан
При написании уравнений реакций используйте структурные формулы органических веществ.
-
Органическое вещество Х, в молекуле которого присутствуют только вторичные атомы углерода, содержит 32,43% углерода, 3,60% водорода по массе и хлор. При взаимодействии Х с избытком водного раствора щелочи образуется вещество Y. Известно, что 1 моль Y способен присоединить 2 моль водорода, а функциональные группы в его молекуле разделены максимально возможным числом атомов углерода. На основании данных в задаче:
-
Проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного вещества Х;
-
Составьте возможную структурную формулу вещества Х, которая однозначно отражает порядок связи атомов в его молекуле;
-
Напишите уравнение реакции вещества Х с избытком водного раствора гидроксида калия, используя структурную формулу вещества.
-
11,52 г меди растворили в концентрированной серной кислоте. Выделившийся при этом газ полностью поглотили теплым раствором гидроксида натрия и получили 83,16 г раствора, содержащего только среднюю соль. При нагревании этого раствора до 75°С в осадок выпало 1,26 г безводной соли. Вычислите выход газа, выделившегося в первой реакции, в процентах от теоретического. Растворимость соли при 75°С составляет
30 г/100 г воды.




