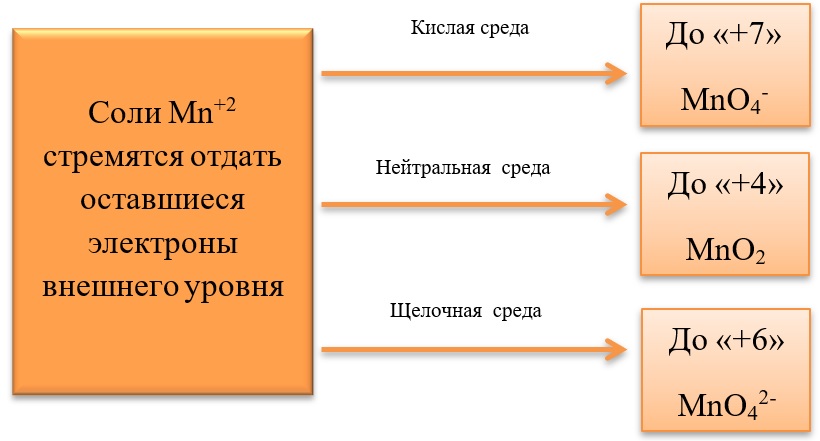
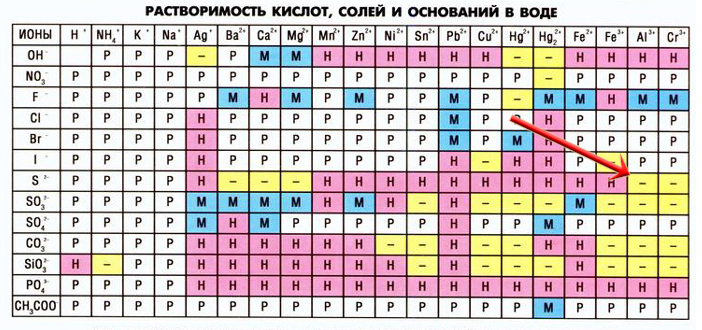
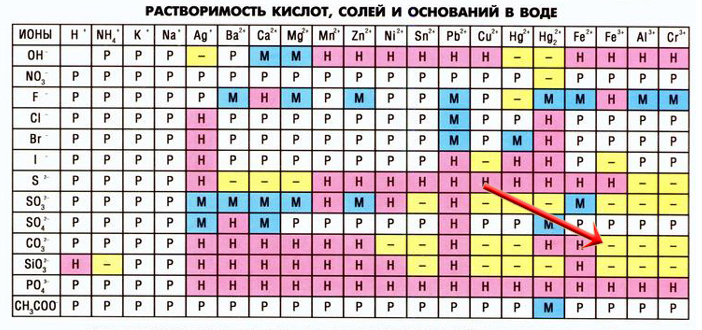
Установите соответствие между веществами и реагентами, с которыми они могут взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ РЕАГЕНТОВ
1) (разб) ,
2)
3)
4)
5)
6)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Задание 1:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) CuSO4
Б) KOH
В) Na2CO3
Г) Al(OH)3
Реагенты:
1) KOH, Ba(NO3)2, H2S
2) SiO2, Al, H2S
3) HNO3, NaOH, H2SO4
4) H2SiO3, Al, BaSO4
5) HNO3, BaCl2, MgCl2
Решение:
Сульфат меди(II) – это средняя соль, растворимая в воде, которая реагирует
— с щелочами(с образованием нерастворимого основания Cu(OH)2),
— солями(нитратом бария, в результате взаимодействия с которыми образуется осадок),
— кислотами(сероводородом — образуется сульфид меди(II) осадок бурого цвета);
Ответ 1.
Гидроксид калия – это растворимое основание, щелочь, которая вступает в реакции нейтрализации с кислотами и кислотными оксидами, амфотерными металлами; ответ 2.
Карбонат натрия – это средняя соль, как и все соли натрия, растворимая в воде, подобно другим солям реагирует со сложными веществами(щелочами, кислотами, другими солями) с образованием осадков, газов, воды, здесь подходит вариант ответа 5, так как в результате реакций с хлоридом бария и магния образуется два осадка в виде BaCO3 и MgCO3.
Гидроксид алюминия – амфотерное нерастворимое основание, которое реагирует
— с щелочами,
— с кислотами,
Ответ 3.
Задание 2:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) C
Б) S
В) CO2
Г) FeO
Реагенты:
1) P, Cu(OH)2, HNO3
2) H2O, KOH, CaO
3) CO, LiOH, N2
4) S, Ba, O2
5) HNO3, O2, C
Решение:
Углерод – неметалл, образующий целый раздел органической химии, благодаря которому образовались белки, жиры, углеводы, реагирует
— с неметаллами(например, серой, кислородом),
— металлами(например, барием, алюминием с образованием карбидов).
Ответ 4.
Сера – неметалл желтого цвета, реагирует с большим количеством веществ, в том числе, с кислородом, водородом, углеродом, азотной кислотой.
S + 6HNO3(к.) = H2SO4 + 6NO2 + 2H2O
S + 2HNO3(р.) = H2SO4 + 2NO
Важно! Заметьте, что в реакциях серы с разбавленной HNO3 выделяется оксид азота NO2, а с концентрированной азотной кислотой выделяется оксид азота NO.
Этот же принцип соблюдается в реакциях разбавленной и концентрированной кислот с металлами и другими неметаллами.
Ответ 5.
Углекислый газ – составляющая часть воздуха и выделяемого нашим организмом газа в результате энергетического обмена, этот газ является солеобразующим кислотным оксидом, который взаимодействует
— с основными оксидами,
— основаниями,
— водой.
Ответ 2.
FeO – основный оксид железа(II) черного цвета, не токсичен, не растворим в воде, реагирует
— с кислотами,
— с щелочами(сплавление),
— с углеродом(восстановление, t > 1000 C):
FeO + C = Fe + CO
— с кислородом(происходит окисление железа, t >400 C):
6FeO + O2 = 2Fe3O4
Ответ 5.
Задание 3:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Al(OH)3
Б) P2O3
В) MgBr2
Г) P
Реагенты:
1) HBr, KOH, Ba(OH)2
2) KOH, Na3PO4, Cl2
3) HNO3, HCl, Cl2
4) O2, KOH, HNO3
5) S, HCl, O2
Решение:
Al(OH)3 – амфотерное нерастворимое основание, реагирует
— с щелочами,
— с кислотами.
Ответ 1.
P2O3 – оксид фосфора(III), в виде белых хлопьев, высокотоксичное соединение, реагирует
— с водой,
— с галогенами,
— с щелочами,
— с неметаллами(сера, кислород)
Ответ 4.
MgBr2 – бромид магния, средняя соль, растворимая в воде, взаимодействует
— с кислотами,
— с щелочами,
— с солями(при наличии осадка),
— с галогенами(стоящими выше в ПСЭ, чем бром),
Ответ 2.
Фосфор – это типичный неметалл, имеет три аллотропические модификации в виде белого(ядовитого), красного и черного фосфора, вступает в реакции со многими веществами, в частности, реагирует
— с неметаллами(кислородом, водородом, серой, галогенами),
— с металлами(образует фосфиды),
— с водой(водяным паром при t > 500 C),
— с щелочами,
— с сильными кислотами(например, с азотной):
P(красн.) + 5HNO3(к.) = H3PO4 + 5NO2 + H2O
3P + 5HNO3(р.) + 2H2O = H3PO4 + 5NO
Ответ 4.
Задание 4:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Na2S
Б) Zn(OH)2
В) P2O5
Г) S
Реагенты:
1) O2, Fe, Br2
2) Cl2, FeSO4, HI
3) Li2O, Sr(OH)2, H2O
4) NH3, Ca3(PO4)3, HNO3
5) KOH, H3PO4, HCl
Решение:
Сульфид натрия – это растворимая средняя соль, которая реагирует
— с водой,
— с кислотами,
— с солями,
— с галогенами.
Ответ 2
Гидроксид цинка – это амфотерное нерастворимое основание, проявляет все свойства амфотерного гидроксида, реагируя
— с кислотами,
— с щелочами.
Ответ 5
Оксид фосфора(V) – это солеобразующий кислотный оксид, который вступает в реакцию
— с основаниями,
— с основными оксидами,
— с солями,
— с водой(образуя ортофосфорную кислоту).
Ответ 3
Сера – неметалл желтого цвета, реагирует с большим количеством веществ, в том числе, — с кислородом(образуя оксиды),
— с водородом(H2S),
— с углеродом(CS2),
— с галогенами(SCl2 – при расплаве, SF6 – при комнатной t),
— металлами.
Ответ 1
Задание 5:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) NH4Br
Б) HNO3
В) Ba(OH)2
Г) Na
Реагенты:
1) HCl, CO2, K3PO4
2) AgNO3, NaOH, Ca(OH)2
3) Pb, S, C
4) CaO, Br2, Na2SO4
5) S, Cl2, H2O
Решение:
Бромид аммония(NH4Br) – это средняя соль, которая при взаимодействии с щелочами дает гидроксид аммония, являющийся неустойчивым соединением и распадается на аммиак и воду. Также он реагирует с солями(если дает осадок). Ответ 2
Азотная кислота – самая удивительная кислота, которая являясь сильным окислителем, не дает ожогов, как серная кислота. Реагирует с огромным количеством соединений, среди которых
— металлы,
— неметаллы(сера, углерод, йод, фосфор),
— основания,
— соли,
— оксиды.
Важно! HNO3 никогда не выделяет водород при взаимодействии с металлами. Всегда выделяются соединения азота – от солей аммония до NO2.
Здесь подходит вариант ответа 3.
Гидроксид бария(Ba(OH)2) – это щелочь, которая проявляет типичные свойства всех подобных веществ, вступая в реакцию с кислотами, кислотными оксидами, солями.
Ответ 1.
Натрий – крайне опасный щелочной металл, который нельзя даже держать в руке по причине разъедания кожных покровов. Na вступает в экзотермическую реакцию с водой при комнатной температуре, при этом реакция идет достаточно бурно с выделением чистого водорода.
Как и все щелочные металлы, он реагирует с неметаллами(сера, галогены), кислотами, солями.
Ответ 5.
Задание 6:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) сера
Б) кислород
В) хлор
Г) фосфор
Реагенты:
1) H2S, KOH, C2H6
2) O2, SO3, C2H6
3) CH4, Zn, N2
4) Hg, HNO3, Cl2
5) O2, S, Cl2
Решение:
Сера — неметалл желтого цвета, реагирует со многими веществами, например,
— с кислородом(образуя SO2, SO3),
— с водородом(H2S),
— с углеродом(CS2),
— с галогенами(SCl2 – при расплаве, SF6 – при комнатной t),
— металлами(ртуть, натрий, железо).
Ответ 4
Кислород(O2) – главный неметалл для реакций горения, главный окислитель, главный элемент для органической жизни. Этот неметалл способен к огромному числу реакций как с простыми, так и со сложными веществами.
В данном варианте нам подходит вариант ответа 3.
Хлор(Cl2) – галоген, способный реагировать с щелочами, некоторыми кислотами(H2S), металлами, неметаллами.
Ответ 1.
Фосфор(P) — это типичный неметалл, имеет три аллотропические модификации в виде белого(ядовитого), красного и черного фосфора, вступает в реакции со многими веществами, в частности, реагирует
— с неметаллами(кислородом, водородом, серой, галогенами),
— с металлами(образует фосфиды),
— с водой(водяным паром при t > 500 C),
— с щелочами,
— с сильными кислотами.
Ответ 5.
Задание 7:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Ba(OH)2
Б) ZnO
В) Ag
Г) NH4Cl
Реагенты:
1) C, HCl, KOH
2) O2, Br2, HNO3
3) CO, CaCl2, SO2
4) HBr, Zn(OH)2, K2CO3
5) AgNO3, Sr(OH)2, H2SO4 (конц.)
Решение:
Гидроксид бария(Ba(OH)2) — это щелочь, которая проявляет типичные свойства всех растворимых оснований, вступая в реакцию с кислотами, кислотными оксидами, солями.
Ответ 4
Оксид цинка(ZnO) – это амфотерный оксид, нерастворим в воде, не токсичен, реагирует с щелочами, кислотами, кислотными оксидами, неметаллами; ответ 1
Серебро(Ag) – это неактивный благородный металл, взаимодействует с азотной кислотой, серой, галогенами, кислородом(при нагревании), ответ 2
Хлорид аммония(NH4Cl) – это средняя соль, хорошо растворимая в воде, имеет все свойства растворимых солей, плюс в реакциях со щелочами выделяет аммиак и воду за счет неустойчивости гидроксида аммония, ответ 5.
Задание 8:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Si
Б) SrO
В) HNO3
Г) Ca(HCO3)2
Реагенты:
1) CuSO4, O2, SO2
2) O2, Mg, NaOH
3) Cu, Ba(OH)2, MgCO3
4) CO2, ZnO, H3PO4
5) H3PO4, HBr, Ca(OH)2
Решение:
Кремний(Si) – неметалл, обладает схожими с углеродом свойствами, с трудом вступает в реакции при обычных условиях, способен реагировать
— с кислородом,
— с металлами(с образованием силицидов),
— с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + H2↑
Ответ 2
Оксид стронция(SrO) – это основный оксид, хорошо растворяется в воде, реагирует как и все основные оксиды щелочно — земельных металлов с кислотами, кислотными оксидами, солями, амфотерными соединениями; ответ 4
Азотная кислота(HNO3) – уже была расписана выше, в данном варианте выбираем пункт 3.
Гидрокарбонат кальция(Ca(HCO3)2) – это кислая соль, которая проявляет свойства растворимых кислот, при этом реагирует с гидроксидом кальция:
Ca(HСО3)2 + Cа(OН)2 = 2CaCO3 + 2H2O
Ответ 5
Задание 9:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) P4
Б) Fe2O3
В) Cu2O
Г) NH4Cl
Реагенты:
1) HCl, HNO3, K2CO3
2) O2, Zn, NaOH (р-р)
3) CaCl2, AgNO3, CO
4) O2, CO, HCl
5) H2SO4 (конц.), NaOH, Pb(NO3)2
Решение:
Фосфор(P4) – это формула белого фосфора, имеет такое обозначение за счет тетраэдрической структуры молекулы данной аллотропии; белый фосфор реагирует с кислородом, металлами, щелочами(с образованием фосфина), с кислотами.
Ответ 2
Оксид железа(Fe2O3) – это амфотерный оксид железа, красно-коричневого цвета, нерастворим в воде, реагирует с кислотами, солями, щелочами, водородом(восстановление).
Ответ 1.
Оксид меди(Cu2O) – представляет собой нерастворимый в воде оксид красно-бурого цвета, реагирует при относительно невысоких t с кислотами(серной, азотной, соляной); при высоких t
— с металлами(Al),
— с неметаллами(O, H, S, галогены),
— с аммиаком,
— c угарным газом:
Cu2O + CO = 2Cu + CO2
— с оксидами щелочных металлов:
Cu2O + BaO = BaCu2O2.
Ответ 4
Хлорид аммония(NH4Cl) — это средняя соль, хорошо растворимая в воде, имеет все свойства растворимых солей, плюс в реакциях со щелочами выделяет аммиак и воду за счет неустойчивости гидроксида аммония, ответ 5
Задание 10:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) CO2
Б) CuCl2
В) NH3
Г) FeS2
Реагенты:
1) HNO3, HBr, O2
2) AgNO3, Na2S, NaI
3) Mg, CaO, H2O
4) KOH, H2SO4, FeS
5) H2SO4, O2, Na2SO4
Решение:
CO2 – составляющая часть воздуха и выделяемого нашим организмом газа в результате энергетического обмена, этот газ является солеобразующим кислотным оксидом, который взаимодействует
— с основными оксидами,
— основаниями,
— водой,
— с некоторыми металлами:
2Mg + CO2 = 2MgO + C
Ответ 3
Хлорид меди(CuCl2) – средняя соль, растворимая в воде, проявляет типичные свойства солей, реагируя с кислотами, щелочами, а также с солями сульфидов и йодидов, при взаимодействии с которыми выделяются соответствующие нерастворимые соединения.
Ответ 2
Аммиак(NH3) – это водорастворимый токсичный газ, проявляющий основные свойства, тем самым легко вступает в реакции с кислотами(серной, азотной), окисляется кислородом с образованием двух разных продуктов азота:
4NH3 + 3O2 = 2N2 + 6H2O(сгорание)
4NH3 + 5O2 = 4NO + 6H2O
Ответ 1
Дисульфид железа(FeS2) – это средняя соль, которая является составляющей частью минерала пирита; способна разлагаться на отдельные элементы под действием высокой t(1170 С), реагирует с азотной, серной и другими кислотами, а также окисляется кислородом до оксида Fe(III).
Ответ 1
На сегодня все!
Задания 30 и 31 из реального ЕГЭ по химии-2021 — ответы и решения, все задачи на окислительно-восстановительную реакцию и реакции ионного обмена из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.»
Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания.
Примечания:
1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества.
2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации.
3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту.
1. Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота.
Задание 30. Из предложенного перечня веществ выберите те, которые вступают в окислительно-восстановительную реакцию с образованием бесцветного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня веществ выберите те, между которыми реакция ионного обмена протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
1 | P-3 — 8e → P+5
8 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Фосфор в степени окисления -3 (или фосфин) является восстановителем.
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Ba2+ + 2OH— + 2H+ + 2NO3— = Ba2+ + 2NO3— + 2H2O
OH— + H+ = H2O
2. Гидрокарбонат калия, нитрат алюминия, оксид фосфора(V), азотная кислота, сульфид меди(II), гидроксид бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием окрашенного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
8 | N+5 + e → N+4
1 | S-2 — 8e → S+6
Азот в степени окисления +5 (или азотная кислота) является окислителем .
Сера в степени окисления -2 (или сульфид меди (II)) является восстановителем.
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
3. Оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием в растворе двух солей и кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена и происходит растворение белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2 | Mn+7 + 5e → Mn+2
5 | S+4 — 2e → S+6
Марганец в степени окисления +7 (или перманганат калия) является окислителем
Сера в степени окисления +4 (или оксид серы (IV)) является восстановителем
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
Mg(OH)2 + 2H+ + 2Br— = Mg2+ + 2Br— + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
4. Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием зеленого раствора и без образования осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми реакция ионного обмена протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NaMnO4 + NaNO2 + 2NaOH = 2Na2MnO4 + NaNO3 + H2O
2 | Mn+7 + 1e → Mn+6
1 | N+3 — 2e → N+5
Марганец в степени окисления +7 (или перманганат натрия) является окислителем.
Азот в степени окисления +3 (или нитрит натрия) является восстановителем.
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2
HCO3— + H+ = H2O + CO2
5. Аммиак, перманганат калия, гидросульфат лития, нитрат стронция, иод, сульфит натрия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием нерастворимого вещества и без выделения газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит натрия) является восстановителем
LiHSO4 + Sr(NO3)2 = SrSO4 + LiNO3 + HNO3
Li+ + HSO4— + Sr2+ + 2NO3— = SrSO4 + Li+ + H+ + 2NO3—
Sr2+ + HSO4— = SrSO4 + H+
6. Гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3CaSO3 + H2O = 2MnO2 + 3CaSO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит кальция) является восстановителем
K2HPO4 + 2HCl = 2KCl + H3PO4
2K+ + HPO42- + 2H+ + 2Cl— = 2K+ + 2Cl— + H3PO4
HPO42- + 2H+ = H3PO4
7. Сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми в растворе протекает окислительно-восстановительная реакция с образованием трех солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
1 | Cr+6 + 3e → Cr+3
3 | Fe+2 — e → Fe+3
Хром в степени окисления + 6 (или дихромат калия) является окислителем
Железо в степени окисления + 2 (или сульфат железа (II)) является восстановителем
FeSO4 + (NH4)2CO3 = FeCO3 + (NH4)2SO4
Fe2+ + SO42- + 2NH4+ + CO32- = FeCO3 + 2NH4+ + SO42-
Fe2+ + CO32- = FeCO3
8. Бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота, нитрат калия, медь.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и не сопровождается выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Cu + 2KNO3 + 2H2SO4 = CuSO4 + 2NO2 + K2SO4 + 2H2O
1 | Cu0 — 2e → Cu+2
2 | N+5 + e → N+4
Азот в степени окисления + 5 (или нитрат калия) является окислителем
Медь в степени окисления 0 является восстановителем
СaBr2 + (NH4)2HPO4 = CaHPO4 + 2NH4Br
Ca2+ + 2Br— + 2NH4+ + HPO42- = CaHPO4 + 2NH4+ + 2Br—
Ca2+ + HPO42- = CaHPO4
9. Бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 16HBr = 2MnBr2 + 2KBr + 5Br2 + 8H2O
2 | Mn+7 + 5e → Mn+2
5 | 2Br— — 2e → Br20
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Бром в степени окисления -1 (или бромоводород) является восстановителем
(CH3COO)2Ba + KHSO4 = BaSO4 + CH3COOK + CH3COOH
Ba2+ + 2CH3COO— + K+ + HSO4— = BaSO4 + CH3COO— + K+ + CH3COOH
Ba2+ + CH3COO— + HSO4— = BaSO4 + CH3COOH
10. Оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием двух кислотных оксидов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
C + H2SO4 = 2CO2 + 2SO2 + H2O
1 | C0 — 4e → C+4
2 | S+6 + 2e → S+4
Сера в степени окисления + 6 (или серная кислота) является окислителем
Углерод в степени окисления 0 является восстановителем
FeCl3 + 3NaHCO3 = Fe(OH)3 + 3CO2 + 3NaCl
Fe3+ + 3Cl— + 3Na+ + 3HCO3— = Fe(OH)3 + 3CO2 + 3Na+ + 3Cl—
Fe3+ + 3HCO3— = Fe(OH)3 + 3CO2
11. Оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
1 | 2N-3 — 6e → N20
2 | Mn+7 + 3e → Mn+4
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Азот в степени окисления -3 (или аммиак) является восстановителем
3NaH2PO4 + 6KOH = 2K3PO4 + Na3PO4 + 6H2O
3Na+ + 3H2PO4— + 6K+ + 6OH— = 6K+ + 2PO43- + 3Na+ + PO43- + 6H2O
H2PO4— + 2OH— = PO43- + 2H2O
12. Оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, иод, фторид аммония.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием кислоты. При этом одна молекула восстановителя . отдает десять электронов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
I2 + 10HNO3 = 10NO2 + 2HIO3 + 4H2O
1 | I20 — 10e → 2I—
10 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем
Йод в степени окисления 0 является восстановителем
NH4F + HNO3 = NH4NO3 + HF
NH4+ + F— + H+ + NO3— = NH4+ + NO3— + HF
F— + H+ = HF
13. Оксид серы(IV), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием щелочи и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием средней соли. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 3Na2O2 = N2 + 6NaOH
1 | 2N-3 — 6e → N20
6 | O-1 + 1e → O-2
Азот в степени окисления -3 (или аммиак) является восстановителем
Кислород в степени окисления -1 (или пероксид натрия) является окислителем
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Na+ + H2PO4— + 2Na+ + 2OH— = 3Na+ + PO43- + 2H2O
H2PO4— + 2OH— = PO43- + 2H2O
14. Серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III).
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием бесцветного раствора кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием окрашенного раствора и без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
1 | P-3 — 8e → P+5
4 | S+6 + 2e → S+4
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
2Cr(OH)3 + 6H+ + 3SO42- = 2Cr3+ + 3SO42- + 6H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
15. Бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает в растворе с образованием двух кислот. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
1 | S+4 — 2e → S+6
1 | Br20 + 2e → 2Br—
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
Подборка тренировочных вариантов ЕГЭ 2022 по химии с ответами.
Тренировочные варианты ЕГЭ 2022 по химии
| vk.com/repetitor_po_himii_i_biologii | |
| Вариант 1 | Ответы |
| vk.com/chem4you | |
| скачать вариант 1 | ответы |
| скачать вариант 2 | ответы |
| скачать вариант 3 | ответы |
| скачать вариант 4 | ответы |
| скачать вариант 5 | ответы |
| скачать вариант 6 | ответы |
| скачать вариант 7 | ответы |
| скачать вариант 8 | ответы |
| скачать вариант 9 | ответы |
| скачать вариант 10 | ответы |
| скачать вариант 11 | ответы |
| скачать вариант 12 | ответы |
| скачать вариант 13 | ответы |
| скачать вариант 14 | ответы |
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| Вариант 6 | скачать |
| Вариант 7 | скачать |
| Вариант 8 | скачать |
| Вариант 9 | скачать |
| Вариант 10 | скачать |
| Вариант 12 | скачать |
| Вариант 13 | скачать |
| Вариант 14 | скачать |
| Широкопояс (Источник: vk.com/naukadljatebja) | |
| Variant 1 | скачать |
| Variant 2 | скачать |
| Variant 3 | скачать |
| Variant 4 | скачать |
| Variant 5 | скачать |
| Variant 6 | скачать |
| Variant 7 | скачать |
| Variant 8 | скачать |
| Variant 9 | скачать |
| Variant 10 | скачать |
| Variant 11 | скачать |
| Variant 12 | скачать |
| Variant 13 | скачать |
| Variant 14 | скачать |
| Variant 15 | скачать |
| Variant 16 | скачать |
| Variant 17 | скачать |
| Variant 18 | скачать |
| Variant 19 | скачать |
| Variant 20 | скачать |
| Variant 21 | скачать |
| Variant 22 | скачать |
| Variant 23 | скачать |
| Variant 24 | скачать |
| Variant 25 | скачать |
| Variant 26 | скачать |
| Variant 27 | скачать |
| Variant 28 | скачать |
| Variant 29 | скачать |
| Variant 30 | скачать |
| vk.com/shkolkovo_him | |
| вариант 1 | разбор |
| вариант 2 | разбор |
| вариант 3 | ответы |
| вариант 4 | ответы |
| вариант 5 | ответы |
| vk.com/repetitor_korsakova | |
| variant 1 | otvet |
| variant 2 | otvet |
| variant 3 | otvet |
| СтатГрад | |
| Вариант 1-2 | критерии оценивания |
| Вариант 3-4 | критерии оценивания |
| vk.com/schoolzhukova | скачать вариант
ответы |
| → купить сборники типовых вариантов ЕГЭ по химии |
Варианты в соответствии с новой демоверсией ЕГЭ 2022 по химии.
→ Тренировочные варианты ЕГЭ 2021 по химии
Подходы к отбору содержания, разработке структуры КИМ ЕГЭ
Отбор содержания заданий КИМ для проведения ЕГЭ по химии в 2022 г. в целом осуществляют с сохранением установок, на основе которых формировались экзаменационные модели предыдущих лет. В числе этих установок наиболее важными с методической точки зрения являются следующие.
КИМ ориентированы на проверку усвоения системы знаний и умений, формирование которых предусмотрено действующими программами по химии для общеобразовательных организаций. Во ФГОС эта система знаний и умений представлена в виде требований к предметным результатам освоения учебного предмета. С данными требованиями соотносится уровень предъявления в КИМ проверяемых элементов содержания.
Экзаменационные варианты по химии содержат задания, различные по форме предъявления условия и виду требуемого ответа, по уровню сложности, а также по способам оценки их выполнения. Как и в предыдущие годы, задания КИМ ЕГЭ 2022 г. построены на материале основных разделов школьного курса химии: общей, неорганической и органической, изучение которых обеспечивает овладение учащимися системой химических знаний.
К числу главных составляющих этой системы относятся: ведущие понятия о химическом элементе, веществе и химической реакции; основные законы и теоретические положения химии; знания о системности и причинности
химических явлений, генезисе веществ, способах познания веществ.
В стандарте эта система знаний представлена в виде требований к уровню подготовке выпускников. В целях обеспечения возможности дифференцированной оценки учебных достижений выпускников КИМ ЕГЭ осуществляют проверку освоения основных образовательных программ по химии на трёх уровнях сложности: базовом, повышенном и высоком.
При разработке КИМ особое внимание было уделено реализации требований к конструированию заданий различного типа. Каждое задание строилось таким образом, чтобы его содержание соответствовало требованиям к уровню усвоения учебного материала и формируемым видам учебной деятельности.
Учебный материал, на основе которого строились задания, отбирался по признаку его значимости для общеобразовательной подготовки выпускников средней школы. Большое внимание при конструировании заданий было уделено усилению деятельностной и практико-ориентированной составляющей их содержания. Данный подход позволяет усилить дифференцирующую способность экзаменационной модели, так как требует от обучающихся последовательного выполнения нескольких мыслительных операций с опорой на понимание причинно- следственных связей, умений обобщать знания, применять ключевые понятия и др.
Смотрите также:
Подборка экзаменационных заданий 5-8 с ответами.
Задание 5 (без ответов): 5_zadania.pdf
Задание 5 (с ответами): 5_otvety.pdf
Задание 6 (без ответов): 6_zadania.pdf
Задание 6 (с ответами): 6_otvety.pdf
Задание 7 (без ответов): 7_zadania.pdf
Задание 7 (с ответами): 7_otvety.pdf
Задание 8 (без ответов): 8_zadania.pdf
Задание 8 (с ответами): 8_otvety.pdf
Задания 1-4.
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
- 15) Хром и его соединения
- 16) Железо и его соединения
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
 Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
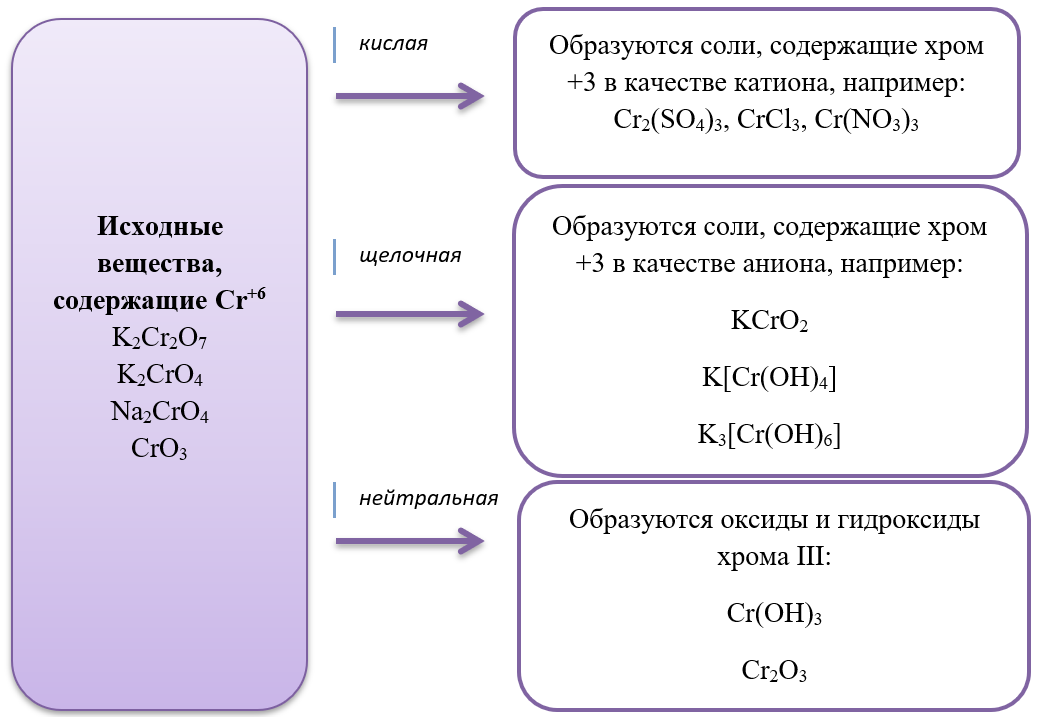
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
17) Соединения марганца
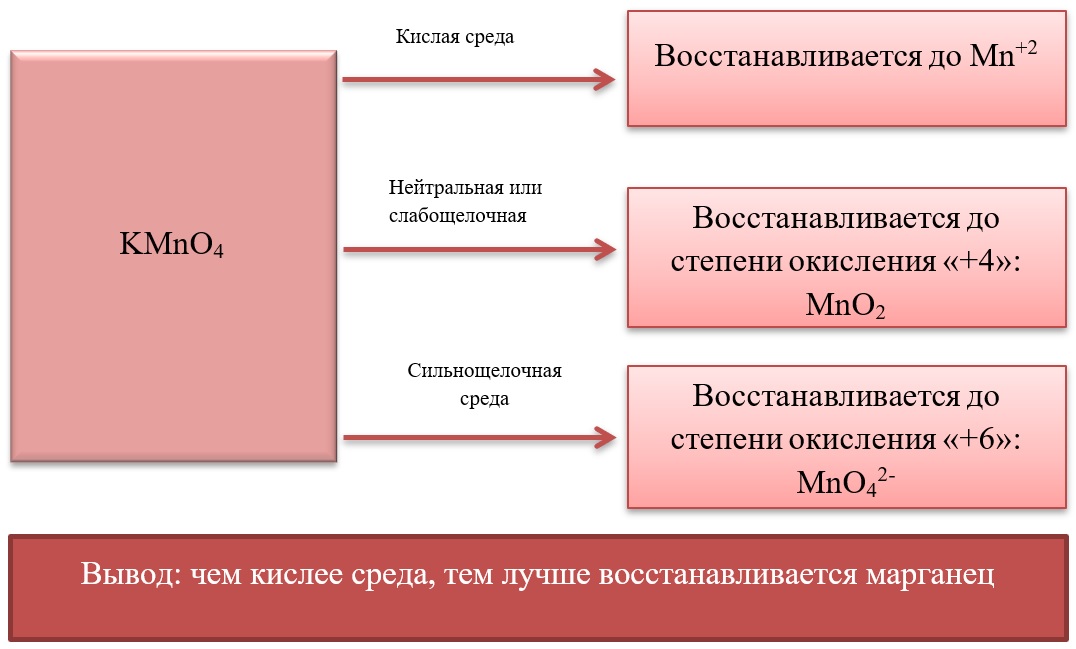
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
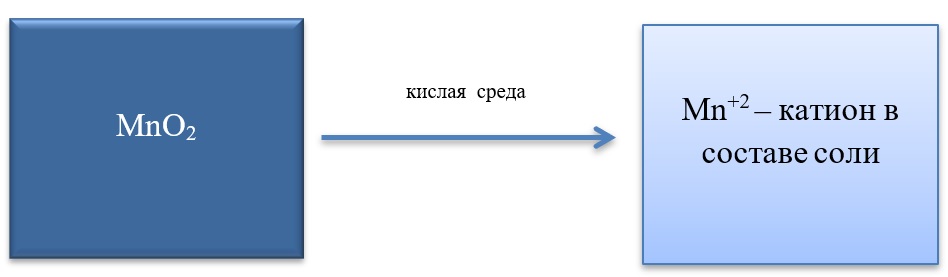
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
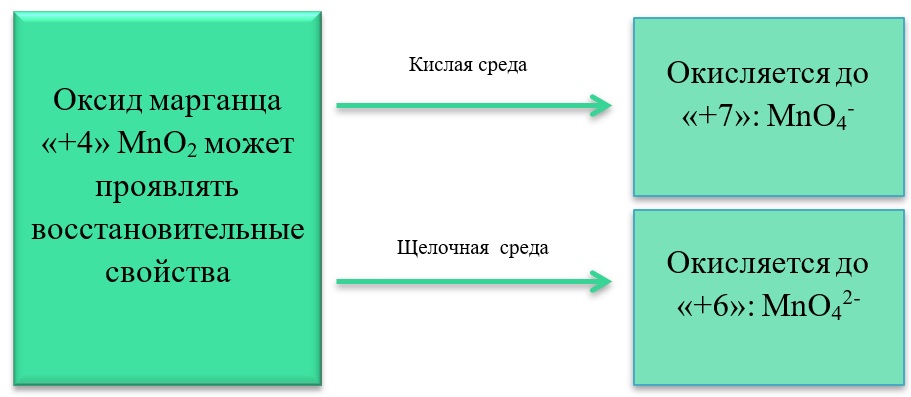
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl
5 новых пробных тренировочных вариантов по химии 11 класс в формате заданий решу ЕГЭ 2022 с ответами и решением по новой демоверсии из открытого банка ФИПИ со всем изменениями 2022 года, каждый вариант содержит 34 задания от 6 марта 2022 года.
Тренировочный вариант №26: задания, ответы
Тренировочный вариант №27: задания, ответы
Тренировочный вариант №28: задания, ответы
Тренировочный вариант №29: задания, ответы
Тренировочный вариант №30: задания, ответы
Решать тренировочный вариант №26 решу ЕГЭ 2022 по химии 11 класс:
1)Из указанных в ряду химических элементов выберите два элемента, атомы которых в основном состоянии содержат одинаковое число полностью заполненных подуровней. 1) Mg 2) Fe 3) N 4) Ar 5) Ca
Ответ: 25
2)Из указанных в ряду химических элементов выберите три элемента, электроотрицательность у которых выше, чем у марганца. Расположите выбранные элементы в порядке возрастания их высшей степени окисления. 1) Se 2) Ca 3) Br 4) K 5) As
Ответ: 513
3)Из предложенного перечня химических элементов выберите два элемента, которые могут иметь одинаковую степень окисления в образованных ими анионах с общей формулой ЭОх — . 1) C 2) N 3) I 4) Ti 5) K
Ответ: 23
4)Из предложенного перечня выберите два соединения, между структурными единицами которых имеют место водородные связи. 1) C2H6 2) CH3NH3Br 3) (CH3 )3N 4) (CH3 )2NH 5) CH3NH2
Ответ: 45
5)Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) железной окалины; Б) несолеобразующего оксида; В) кислотного оксида.
Ответ: 927
6)К раствору сульфата меди(II) добавили раствор вещества Х, что привело к образованию раствора, практически не содержащего сильных электролитов. К раствору сульфата алюминия добавили избыток раствора вещества Y, что сопровождалось образованием осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) сероводород 2) фтороводород 3) гидроксид калия 4) гидроксид бария 5) гидрат аммиака
Ответ: 45
11)Из предложенного перечня соединений выберите два таких, любые изомеры которых не могут содержать π-связи. 1) 1,2,4-трихлорпентан 2) циклогексанол 3) бутилацетат 4) бутанол-2 5) 2-нитропропан
Ответ: 14
12)Из предложенного перечня выберите все типы реакций, характерных как для метилциклопропана, так и для 1,3-диметилциклогексана. 1) гидрирование 2) галогенирование 3) гидрогалогенирование 4) ароматизация 5) горение
Ответ: 25
13)Из предложенного перечня выберите два реагента, с которыми не взаимодействует водный раствор метиламина. 1) сульфид свинца 2) уксусная кислота 3) сульфат хрома(III) 4) гидроксид кальция 5) нитрат железа(III)
Ответ: 14
17)Из предложенного перечня выберите все реакции, которые при наличии или отсутствии катализатора протекают с образованием разных продуктов. 1) разложение карбоната магния 2) взаимодействие уксусной кислоты и метанола 3) взаимодействие аммиака и кислорода 4) горение фосфина 5) разложение хлората натрия
Ответ: 35
18)Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости реакции CuSO4 ∙ 5H2O(тв.) → CuSO4(тв.) + 5H2O. 1) добавление кварцевого песка 2) охлаждение системы 3) повышение температуры 4) измельчение исходного вещества 5) добавление воды.
Ответ: 34
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). 1) хлоруксусная кислота 2) перхлорат калия 3) хлорная кислота 4) метиламин
Ответ: 3124
23)В замкнутый реактор поместили смесь хлора, оксида азота(II) и нитрозилхлорида (NOCl), затем нагрели. В результате протекания обратимой реакции 2NO(г) + Cl2(г) ⇆ 2NOCl(г) в системе установилось равновесие. Используя данные, приведенные в таблице, определите исходную концентрацию нитрозилхлорида (X) и равновесную концентрацию оксида азота (II) (Y).
Ответ: 56
26)Какую массу 50%-ого раствора азотной кислоты (в граммах) нужно добавить к 200 г ее 5%-ного раствора, чтобы получить раствор с массовой долей азотной кислоты, равной 25%? (Запишите число с точностью до целых.)
Ответ: 160
27)Взаимодействие железа и серы описывается следующим термохимическим уравнением: Fe(тв.) + S(ромб.) = FeS(тв.) + Q. При образовании 8,8 г сульфида железа выделилось 10,01 кДж энергии. Вычислите количество энергии (в кДж), выделяющееся при расходовании 16,8 г железного порошка. (Запишите число с точностью до целых.)
Ответ: 30
28)Вычислите объем (в литрах) кислорода (н.у.), необходимый для полного обжига 8 г сульфида меди(I) при выходе реакции в 90%. (Запишите число с точностью до десятых.)
Ответ: 2,5
29)Из предложенного перечня выберите вещества, в результате окислительновосстановительной реакции, в которой атом-восстановитель меняет степень окисления с низшей на высшую. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня выберите два вещества, при протекании ионного обмена между которыми образуется белый осадок, а в конечном растворе обнаруживаются гидроксид-ионы. Запишите молекулярное, полное и сокращенное ионные уравнения реакции с участием выбранных веществ.
31)К раствору сульфата хрома(III) добавили раствор сульфита цезия и наблюдали образование осадка и выделение бесцветного газа. Полученный газ поглотили раствором перманганата калия, подкисленным серной кислотой, а осадок обработали раствором, содержащим пероксид водорода и гидроксид натрия, и нагрели. В полученный при этом желтый раствор добавили раствор серной кислоты. Напишите уравнения четырех описанных реакций.
33)Смесь алюминия и сульфида алюминия, в которой соотношение числа атомов алюминия к числу атомов серы равно 5:3, растворили в 500 г разбавленного раствора соляной кислоты. При этом все исходные вещества прореагировали полностью, и выделилось 1,11 г смеси газов. К этому раствору добавили 20%- ный раствор гидроксида натрия в минимальном количестве, необходимом для получения однородного раствора без осадка. Вычислите массовую долю хлорида натрия в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин). В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)Неизвестное органическое соединение содержит 29,51% углерода, 8,20% водорода, 39,34% кислорода и азот. Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно получается в одну стадию из неорганического соединения и вещества, молекулы которого не образуют водородные связи. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение взаимодействия этого вещества с избытком раствора гидроксида стронция (используйте структурные формулы органических веществ).
Решать тренировочный вариант №27 решу ЕГЭ 2022 по химии 11 класс:
1)Из указанных в ряду химических элементов выберите два элемента, атомы которых в основном состоянии содержат одинаковое число спаренных s-электронов и спаренных p-электронов: 1) O 2) F 3) Li 4) N 5) Mg
Ответ: 25
2)Из указанных в ряду химических элементов выберите три элемента, являющихся металлами. Расположите выбранные элементы в порядке усиления восстановительных свойств соответствующих им простых веществ. 1) I 2) Sn 3) Mg 4) Xe 5) Rb
Ответ: 235
3)Из предложенного перечня химических элементов выберите два элемента, находящихся в одном периоде Периодической системы Д.И. Менделеева, которые образуют водородные соединения, структурная единица которых содержит два атома водорода. 1) Ga 2) Se 3) Ca 4) Be 5) S
Ответ: 23
4)Из предложенного перечня выберите два соединения, все ковалентные связи в которых образованы только по обменному механизму. 1) метан 2) хлор 3) гексагидроксохромат(III) натрия 4) бромид аммония 5) азотная кислота
Ответ: 12
6)В пробирку с бесцветным раствором вещества Х добавили раствор ацетата свинца, наблюдая при этом образование желтого осадка. Во вторую пробирку с окрашенным раствором вещества Y добавили раствор ацетата бария, что также сопровождалось образованием желтого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) сероводород 2) хлорид аммония 3) хромат натрия 4) йодид калия 5) перманганат натрия
Ответ: 43
11)Из предложенного перечня соединений выберите два таких, изомеры которых могут содержать атомы углерода в sp2 -гибридизации. 1) диизопропиловый эфир 2) 1,3-диаминопропан 3) 1,2-диметилциклопропан 4) нитроэтан 5) метилпропиловый эфир
Ответ: 34
12)Из предложенного перечня выберите все углеводороды, из которых при окислении перманганатом калия в кислой среде можно получить соединение с двумя функциональными группами. 1) изопропилбензол 2) 1,2-диметилциклогексен-1 3) 1-метилциклогексен 4) 3,4-диметилгексен-3 5) 1,3-диметилбензол
Ответ: 235
13)Из предложенного перечня выберите два утверждения, справедливых и для анилина, и для глюкозы. 1) содержат атомы углерода в sp3 -гибридизации 2) являются твердыми веществами при обычных условиях 3) вступают в каталитическое гидрирование 4) содержат π-связи между атомами углерода 5) реагируют с бромом
Ответ: 35
17)Из предложенного перечня выберите все соединения, взаимодействие которых с концентрированным раствором азотной кислоты не относится к окислительно-восстановительным реакциям. 1) оксид серы(IV) 2) гидроксид меди(II) 3) фосфид алюминия 4) карбонат железа(II) 5) хромат калия
Ответ: 25
18)Из приведенного перечня выберите все реакции, скорость протекания которых при обычных условиях выше, чем скорость взаимодействия гранул цинка с 10%-ным водным раствором соляной кислоты. 1) взаимодействие таких же гранул цинка с 2%-ным водным раствором уксусной кислоты 2) взаимодействие раствора нитрата бария с раствором серной кислоты 3) взаимодействие цинковой пыли с 10%-ным водным раствором соляной кислоты 4) взаимодействие натрия с серой 5) взаимодействие железа с концентрированной серной кислотой
Ответ: 23
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов. 1) нитрат фениламмония (0,01 моль/л) 2) азотная кислота (0,02 моль/л) 3) гидроксид цезия (0,1 моль/л) 4) фенолят натрия (0,01 моль/л)
Ответ: 3412
23)В замкнутый реактор поместили смесь оксидов азота(II) и (IV) с кислородом, затем нагрели. В результате протекания обратимой реакции 2NO(г) + O2(г) ⇆ 2NO2(г) в системе установилось равновесие. Используя данные, приведенные в таблице, определите исходную концентрацию оксида азота(II) (X) и равновесную концентрацию оксида азота(IV) (Y).
Ответ: 15
26)В первой колбе, содержащей 100 мл воды, растворили 2,24 л хлороводорода, а во второй колбе, содержащей 200 г воды, растворили 672 мл хлороводорода. Рассчитайте массовую хлороводорода (в %) в растворе, полученном при смешении содержимого этих двух колб. (Запишите ответ с точностью до десятых.)
Ответ: 1,6
27)Обжиг сульфида свинца происходит согласно термохимическому уравнению: 2PbS(тв.) + 3O2 (г.) = 2PbO(тв.) + 2SO2 (г.) + Q При образовании 4,46 г оксида свинца(II) выделилось 8,32 кДж энергии. Рассчитайте объем израсходованного кислорода (л, н.у.), если при этом выделилось 374,4 кДж энергии. (Запишите число с точностью до десятых.)
Ответ: 30,2
28)Вычислите массу (в граммах) оксида азота(IV), который выделится при полном окислении 5,88 г сульфида хрома(III), содержащего 15% кварца, под действием концентрированной азотной кислоты. (Запишите число с точностью до десятых.)
Ответ: 27,6
29)Из предложенного перечня выберите вещества, в результате окислительновосстановительной реакции между которыми выделяется газ тяжелее кислорода и образуется окрашенный раствор. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня выберите два вещества, при протекании реакции ионного обмена между которыми образуются сильный и слабый электролиты. Запишите молекулярное, полное и сокращенное ионные уравнения реакции с участием выбранных веществ.
31)Навеску манганата бария обработали большим избытком концентрированной соляной кислоты. К образовавшемуся раствору добавили сульфат аммония. Выпавший осадок отфильтровали, высушили и прокалили при высокой температуре с избытком кокса. Получившуюся соль внесли в избыток концентрированной азотной кислоты и нагревали до окончания реакции. Напишите уравнения четырех описанных реакций.
33)Смесь оксида железа(II) и оксида железа(III) массой 8,28 г растворили в 100 г концентрированной азотной кислоты, взятой в избытке. Полученный раствор упаривали до тех пор, пока твердый остаток не стал представлять собой одно единственное вещество. Данное вещество растворили в воде, а к образовавшемуся раствору добавили избыток раствора сульфида калия. При этом наблюдали образование осадка без выделения газа. Полученный в результате этого осадок отфильтровали и взвесили. Его масса оказалась равна 10,92 г. Определите массовую долю соли в растворе после растворения смеси оксидов. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)При сжигании 2,28 г неизвестного органического вещества А в качестве единственных продуктов сгорания были получены 1,8 г воды и 2,688 л углекислого газа (н.у.). Известно, что вещество А может быть синтезировано в одну стадию из углеводорода Б, который может реагировать с гидроксидом диамминсеребра в мольном соотношении 1:2 соответственно. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А; 2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции получения вещества А из вещества Б. (используйте структурные формулы органических веществ).
Решать тренировочный вариант №28 решу ЕГЭ 2022 по химии 11 класс:
1)Из указанных в ряду химических элементов выберите два элемента, атомы которых в основном состоянии имеют одинаковую конфигурацию третьего энергетического уровня: 1) Ti 2) Mn 3) Zn 4) Cr 5) Sc
Ответ: 24
2)Из указанных в ряду химических элементов выберите три элемента, электроотрицательность которых больше, чем у брома, и расположите их в порядке убывания атомного радиуса. 1) As 2) N 3) Cl 4) Be 5) F
Ответ: 325
3)Из предложенного перечня химических элементов выберите два элемента, находящихся в одном периоде Периодической системы, которые могут иметь одинаковую степень окисления в образованных ими анионах с общей формулой ЭО2 — . 1) Se 2) Br 3) S 4) Al 5) Cl
Ответ: 45
4)Из предложенного перечня выберите два соединения, в частицах которых присутствуют все типы химической связи, что и в молекуле этандиовой кислоты. 1) трибромметан 2) пероксид водорода 3) пероксид бария 4) серная кислота 5) бутин-2
Ответ: 25
5)Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) средней соли; Б) основного гидроксида; В) кислотного гидроксида.
Ответ: 579
6)В две пробирки поместили одинаковые медные пластинки. В первую пробирку добавили раствор вещества Х и наблюдали уменьшение массы пластинки после окончания реакции. Во вторую пробирку добавили раствор вещества Y и наблюдали увеличение массы пластинки после окончания процесса. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) соляная кислота 2) уксусная кислота 3) ацетат серебра 4) ацетат свинца 5) азотная кислота
Ответ: 53
11)Из предложенного перечня формул выберите две таких, которые не могут соответствовать веществам с двумя функциональными группами. 1) C3H7O2N 2) C2H2O2 3) C3H9N 4) C4H4O4 5) C6NH7
Ответ: 35
12)Из предложенного перечня выберите все соединения, которые могут вступить в реакцию замещения под действием металлического натрия и не являются газами. 1) метанол 2) пентен-1 3) гексин-1 4) пропин 5) гексадиин-1,3
Ответ: 135
13)Из предложенного списка соединений выберите те, при гидролизе которых можно получить трисахариды. 1) крахмал 2) нейлон 3) сахароза 4) рибоза 5) целлюлоза
Ответ: 15
17)Из предложенного перечня процессов выберите все такие, которые сопровождаются выделением газа. 1) взаимодействие ацетата железа(II) и азотной кислоты 2) сплавление карбоната калия и оксида цинка 3) нагревание раствора нитрата калия 4) взаимодействие раствора сульфата железа(III) и сернистого газа 5) взаимодействие горячих растворов нитрата аммония и нитрита бария
Ответ: 125
18)Из предложенного перечня реакций выберите все такие, скорость протекания которых можно ускорить как нагреванием, так и повышением давления в системе. 1) разложение карбоната магния 2) окисление алюминия хлором 3) обжиг пирита 4) взаимодействие натрия с водой 5) окисление сульфита натрия в растворе кислородом воздуха
Ответ: 235
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов. 1) хлорид калия (0,1 моль/л) 2) триметиламин (0,2 моль/л) 3) бромид метиламмония (0,01 моль/л) 4) этандиовая кислота (0,03 моль/л)
Ответ: 4312
23)В замкнутый реактор, содержащий катализатор, поместили пары метанола, смесь угарного газа и водорода, затем нагрели. В результате протекания обратимой реакции CO(г) + 2H2(г) ⇆ CH3OH(г) в системе установилось равновесие. Используя данные, приведенные в таблице, определите исходные концентрации водорода (X) и метанола (Y).
Ответ: 64
26)К раствору соляной кислоты с массовой долей воды 63,5% добавили 200 мл воды и получили раствор с массовой долей хлороводорода 18,25%. Вычислите массу исходного раствора. (Запишите ответ с точностью до целых.)
Ответ: 200
27)Взаимодействие лития с водой происходит согласно термохимическому уравнению: 2Li(тв) + 2H2O(ж) = 2LiOH(p-p) + Н2(г) + Q При образовании 12 г гидроксида лития выделилось 102 кДж энергии. Рассчитайте объем израсходованной воды в мл, если при этом выделилось 51 кДж энергии. (Запишите ответ с точностью до десятых.)
Ответ: 4,5
28)Рассчитайте массовую долю неона в смеси с углекислым газом общей массой 2400 мг, которая может прореагировать минимум с 61 г 5%-ного раствора силиката натрия. (Запишите ответ с точностью до десятых.)
Ответ: 8,3
29)Из предложенного перечня веществ выберите два таких, окислительновосстановительная реакция между которыми протекает с образованием белого осадка бинарного соединения. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня веществ выберите два таких, реакция ионного обмена между которыми протекает без видимых признаков. Запишите молекулярное, полное и сокращенное ионное уравнения данной реакции с участием выбранных веществ.
31)Навеску оксида фосфора(III) добавили к раствору, содержащему перекись водорода и гидроксид бария. Полученный раствор выпарили досуха, остаток прокалили с песком и углем. Выделившийся газ пропустили над оксидом железа(III), а образовавшийся при этом твердый остаток, представляющий собой одно вещество, растворили в разбавленной бромоводородной кислоте. При этом наблюдали образование желто-коричневого раствора. Напишите уравнения четырех описанных реакций.
33)Навеску смеси октагидрата гидроксида бария (Ba(OH)2 ·8H2O) и бромида цезия растворили в воде. В полученный раствор с массовой долей соли 5% пропустили углекислый газ до прекращения поглощения. Образовавшийся раствор разделили на две колбы. Первую колбу нагревали до окончания реакции. Во вторую колбу добавили 200 г 2%-ного раствора сульфата железа(III), причем реагенты прореагировали полностью. Вычислите массовую долю щелочи в исходном растворе, если известно, что отношение объемов газов, выделившихся из первой и второй колб, равно 7:6, а отношение масс бромида цезия во второй колбе и добавленного сульфата железа(III) равно 891:500. Растворимостью газов в воде пренебречь. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)При полном сгорании в кислороде неизвестного органического соединения массой 6,95 г в качестве единственных продуктов сгорания образовалось 7,84 л углекислого газа, 700 мг азота и 4,05 г воды. Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно может быть получено в одну стадию из вещества с молекулярной формулой С7Н6О. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение взаимодействия этого вещества с нитрующей смесью.
Решать тренировочный вариант №29 решу ЕГЭ 2022 по химии 11 класс:
1)Из указанных в ряду химических элементов выберите два элемента, атомы которых в возбужденном состоянии не содержат валентных электронов на трех подуровнях: 1) I 2) Ge 3) S 4) Tl 5) Sb
Ответ: 24
2)Из указанных в ряду химических элементов выберите три элемента, находящихся в одном периоде Периодической системы, и расположите выбранные элементы в порядке увеличения числа валентных электронов на внешнем энергетическом уровне. 1) As 2) P 3) Mo 4) Cr 5) Ga
Ответ: 451
3)Из предложенного перечня химических элементов выберите два, у каждого из которых сумма степеней окисления в высшем оксиде и водородном соединении равна шести. 1) S 2) Ti 3) Cl 4) Te 5) Al
Ответ: 35
4)Из предложенного перечня суждений о строении и химических связях выберите два таких, которые справедливы и для тетрагидроксоалюмината натрия, и для хлорида аммония. 1) содержат неполярную ковалентную связь 2) имеют немолекулярное строение 3) образуют водородные связи 4) содержат ковалентную связь, образованную по донорно-акцепторному механизму 5) имеют атомную кристаллическую решетку
Ответ: 24
5)Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) двухосновной кислоты; Б) сильной кислоты; В) амфотерного гидроксида.
Ответ: 352
6)Навески порошков Х и Y внесли в пробирки с избытком концентрированной серной кислотой. В случае вещества Х масса конечного раствора равна массе исходного. В случае вещества Y масса конечного раствора больше массы исходного. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) аморфный углерод 2) сера 3) фосфор 4) хлорид калия 5) медь
Ответ: 54
11)Из предложенного перечня формул выберите две таких, которые могут соответствовать веществам как с циклическим, так и с разветвленным строением. 1) C4H4 2) C3H6 3) C3H8 4) C5H8 5) C4H8
Ответ: 45
12)Из предложенного перечня веществ выберите все углеводороды, которые вступают в реакцию гидратации с образованием продуктов, способных вступать в реакцию гидрирования. 1) 1,2-дифенилэтен 2) стирол 3) толуол 4) бутин-1 5) циклогексен
Ответ: 124
13)Из предложенного перечня выберите два утверждения, справедливых для любого дисахарида, но несправедливых для любого дипептида. 1) относятся к слабым электролитам 2) реагируют с горячим раствором серной кислоты 3) при полном сгорании в кислороде образуют только два продукта 4) содержат σ-связи углерод-кислород 5) в продуктах их кислотного гидролиза нет органических солей
Ответ: 35
17)Из предложенного перечня процессов выберите все, протекание которых сопровождается выделением тепла. 1) разложение карбоната бария 2) взаимодействие растворов серной кислоты и гидроксида кальция 3) образование оксида азота(II) из простых веществ 4) образование йодоводорода из простых веществ 5) восстановление железа из железной окалины под действием алюминия
Ответ: 25
18)Из предложенного перечня реакций выберите все, которые при одинаковых условиях протекают быстрее взаимодействия гранулы цинка и 5%-ного раствора соляной кислоты. 1) магний + вода 2) медь + 10%-ный р-р HCl 3) магний(порошок) + 5%-ный р-р HCl 4) гидроксид натрия(р-р) + 5%-ный р-р СН3СООН 5) аммиак (р-р) + 1%-ный р-р H2SO4
Ответ: 345
21)Для смесей, приведённых в перечне, определите характер среды их водных растворов. 1) аммиак (0,09 моль/л) + метиламин (0,01 моль/л) 2) уксусная кислота (1%) + ацетон (1%) 3) гидроксид натрия (0,1 моль/л) + перхлорат калия (1 г/л) 4) нитрат калия (0,2 моль/л) + сахароза (1%)
Ответ: 2413
26)Газообразный аммиак объемом 4,48 л (н.у.) растворили в 166,6 мл воды, затем добавили его 10%-ный раствор, что привело к образованию раствора с массовой долей растворенного вещества 5%. Вычислите массу (в граммах) добавленного 10%-ного раствора аммиака. (Запишите ответ с точностью до целых.)
Ответ: 102
27)При расходовании 8 г кислорода на окисление оксида серы(IV) выделилось 71 кДж энергии. Вычислите количество энергии, выделяющееся при образовании 24 г оксида серы(VI). (Запишите ответ с точностью до десятых)
Ответ: 42,6
28)Рассчитайте выход кислорода, если при прокаливании навески перманганата натрия массой 7,1 г было получено 6,5 г твердого остатка. (Запишите ответ с точностью до целых)
Ответ: 75
29)Из предложенного перечня веществ выберите два таких, окислительновосстановительная реакция между которыми протекает с образованием четырех продуктов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня веществ выберите два таких, в реакции ионного обмена между которыми образуется нерастворимый гидроксид. Запишите молекулярное, полное и сокращенное ионное уравнения данной реакции с участием выбранных веществ.
31)Навеску брома добавили в раствор, полученный при пропускании газа, выделившегося при взаимодействии серы и концентрированной серной кислоты, в недостаток гидроксида бария. При этом наблюдали обесцвечивание смеси и выпадение осадка. Полученный осадок отделили, высушили и прокалили при очень высокой температуре в потоке водорода. Напишите уравнения четырех описанных реакций.
33)Навеску нитрата меди(II) и нитрата серебра массой 31,55 г растворили в 400 мл воды и подвергли полученный раствор электролизу с инертными электродами. Процесс остановили, когда в растворе не осталось катионов металла. В ходе электролиза через цепь прошло 0,275 моль электронов. Вычислите массовую долю азотной кислоты в образовавшемся растворе, если известно, что в ходе процесса на катоде не выделялся газ. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)Неизвестное органическое соединение состоит из трех элементов и содержит 60% углерода по массе. При этом массовая доля кислорода в 4 раза больше, чем водорода. Известно, что данное соединение при гидролизе дает единственный продукт, обладающий линейным строением. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение взаимодействия этого вещества с гидроксидом калия.
Решать тренировочный вариант №30 решу ЕГЭ 2022 по химии 11 класс:
1)Из указанных в ряду химических элементов выберите два элемента, число валентных электронов у которых совпадает с числом полностью заполненных подуровней: 1) S 2) Al 3) Br 4) Fe 5) Si
Ответ: 35
2)Из предложенного перечня выберите три элемента, неспособных образовывать оксиды. Расположите выбранные элементы в порядке уменьшения атомного радиуса. 1) He 2) F 3) N 4) B 5) Kr
Ответ: 521
3)Из предложенного перечня химических элементов выберите два таких, которые могут иметь одинаковые степени окисления в образованных ими анионах с общей формулой ЭОх — . 1) Se 2) Fe 3) Cs 4) Cr 5) Sr
Ответ: 24
4)Из предложенного перечня выберите два соединения, имеющих немолекулярное строение, ковалентные связи в которых образованы только по обменному механизму. 1) нитрат диметиламмония 2) пероксид стронция 3) фторид аммония 4) силан 5) оксид кремния(IV)
Ответ: 25
6)При пропускании сероводорода через пробирку с раствором вещества Х наблюдали образование осадка, растворимого в горячем растворе щелочи. При пропускании сероводорода в пробирку с раствором вещества Y наблюдали образование осадка, нерастворимого в щелочах и концентрированной соляной кислоте. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) нитрат алюминия 2) хлорид цинка 3) ацетат серебра 4) сульфат марганца 5) бромид железа(III)
Ответ: 53
11)Из предложенного перечня формул выберите две таких, которые не могут соответствовать веществам с двумя π-связями в молекуле. 1) C6H11N 2) C5H12O 3) C5H8 4) C3H6O3 5) C3H4O4
Ответ: 24
12)Из предложенного перечня выберите все углеводороды, из которых можно в одну стадию получить дикарбоновую кислоту или ее соль. 1) циклопентен 2) 1,4-диметилбензол 3) бутен-2 4) бензол 5) ацетилен
Ответ: 125
13)Из предложенного перечня выберите два реагента, с которыми реагирует триолеин, но не реагирует сахароза. 1) серная кислота (1%-ный р-р) 2) гидроксид меди(II) 3) бромная вода 4) водород 5) анилин
Ответ: 34
17)Из предложенного перечня реакции выберите все, относящиеся к окислительно-восстановительным и в результате протекания которых образуется простое вещество. 1) взаимодействие хлорида железа(III) и сульфида натрия 2) разложение дихромата аммония при сильном нагревании 3) взаимодействие твердого хлорида аммония и концентрированной серной кислоты 4) взаимодействие горячих растворов сульфата аммония и нитрита калия 5) взаимодействие растворов сульфата меди(II) и йодида калия.
Ответ: 1245
18)Из предложенного перечня реакций выберите все, которые можно замедлить как охлаждением, так и увеличением объема реакционного сосуда. 1) окисление меди азотной кислотой 2) взаимодействие сероводорода и сернистого газа 3) нитрование бензола 4) электролиз раствора хлорида калия 5) нитрование этана.
Ответ: 25
21)Для смесей, приведённых в перечне, определите характер среды их водных растворов. 1) фенол (0,1%) + изопропанол (0,2%) 2) муравьиная кислота (10 г/л) + хлороводород (1%) 3) фосфат натрия (0,01 моль/л) + карбонат калия (1 г/л) 4) гидроксид бария (0,1 моль/л) + сахароза (10 г/л)
Ответ: 1232
23)В замкнутый реактор, содержащий катализатор, поместили смесь паров метанола, водорода и угарного газа, затем нагрели. В результате протекания обратимой реакции СO(г) + 2Н2(г) ⇆ СН3ОН(г) в системе установилось равновесие. Используя данные, приведенные в таблице, определите равновесные концентрации водорода (X) и метанола (Y).
Ответ: 54
26)В результате упаривания 200 г 10%-ного раствора нитрата калия масса раствора уменьшилась на 15%. Какую массу 25%-ного раствора нитрата калия (в граммах) необходимо добавить к полученному в результате упаривания раствору для получения раствора с массовой долей соли равной 20%? (Запишите число с точностью до целых).
Ответ: 280
27)При нейтрализации 49 г неизвестной кислоты раствором щелочи при определенных условиях выделяется 48 кДж теплоты. Вычислите количество теплоты, выделяющееся при нейтрализации 9,8 г данной кислоты в тех же условиях. (Запишите ответ с точностью до десятых).
Ответ: 9,6
28)Вычислите минимальную массу (в граммах) порошка технического алюминия (массовая доля примеси 3%), необходимую для полного восстановления в щелочном растворе 1,515 г нитрата калия. Считать, что реакция протекает с выходом 85%. (Запишите число с точностью до сотых.)
Ответ: 1,31
29)Из предложенного перечня веществ выберите такие, окислительновосстановительная реакция между которыми протекает с образованием нерастворимого в воде соединения желтого цвета. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня веществ выберите два таких, реакция ионного обмена между которыми может сопровождаться образованием раствора, практически не содержащего сильных электролитов. Запишите молекулярное, полное и сокращенное ионное уравнения данной реакции с участием выбранных веществ.
31)Сернистый газ пропустили через трубку с пероксидом натрия. Содержимое трубки растворили в воде с образованием нейтрального раствора, который подвергли электролизу. Образовавшийся раствор нагрели до кипения и внесли последовательно навеску питьевой соды, затем сульфат алюминия. Напишите уравнения четырех описанных реакций.
33)В стакан с 26%-ным раствором хлорида железа(III) внесли навеску железной стружки и нагревали некоторое время. В момент, когда количество ионов Fe2+ стало равно 0,24 моль, остаток стружки отделили от раствора магнитной сепарацией. В образовавшийся раствор пропустили газообразный хлор до момента, когда отношение количеств ионов Fe2+ и Fe3+ стало равно 1:4. Отделенную ранее железную стружку смешали с дополнительным количеством железа и внесли в полученный раствор. После образования однородного раствора без осадка добавили 260 г раствора сульфида калия. Образовавшийся при этом осадок представлял собой единственное соединение, а раствор над осадком имел нейтральную среду. Вычислите массовую долю воды в конечном растворе, если известно, что всего в ходе эксперимента использовали 13,44 г железной стружки. Испарением воды в ходе всех процессов пренебречь. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)При полном сгорании неизвестного органического соединения А массой 1,98 г образовалось 2,016 л углекислого газа (н.у.) и 1,62 г воды. Известно, что в молекуле данного соединения все атомы углерода находятся в состоянии sp3 -гибридизации, а также то, что молекула вещества А содержит в своем составе в два раз больше атомов углерода, чем молекула вещества Б — продукта окисления некоторого алкена раствором перманганата калия. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение получения А из вещества Б.



 Азот на ЕГЭ
Азот на ЕГЭ