Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд феноло
Химические свойства спиртов
Способы получения спиртов
Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
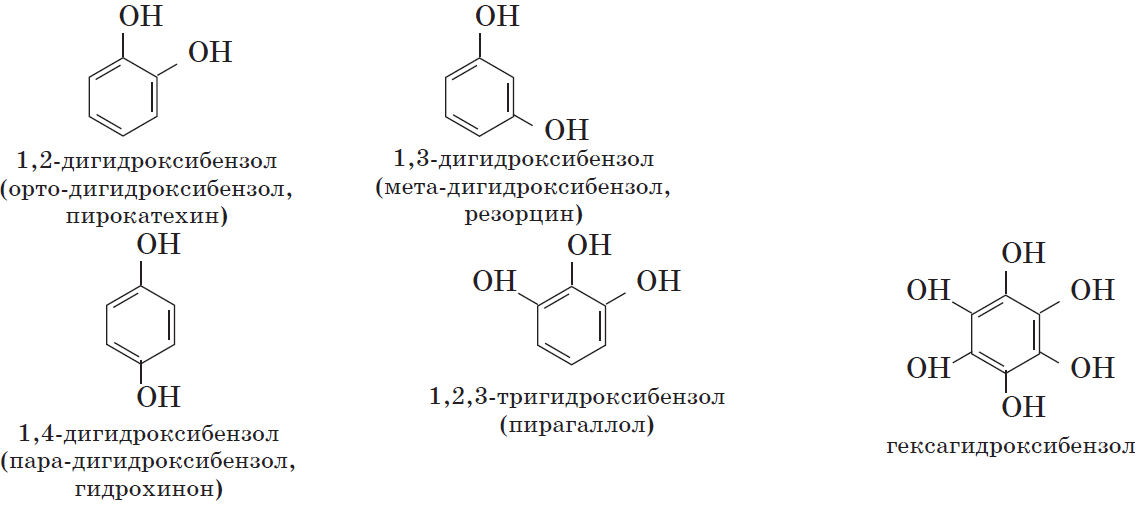
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты:
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
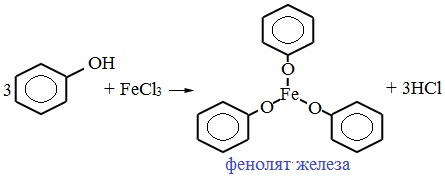
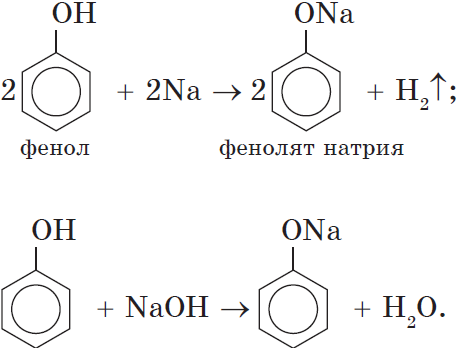
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия
Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
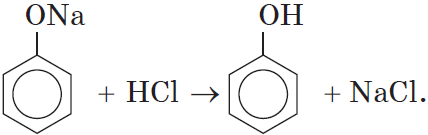
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода.
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце.
2.1. Галогенирование
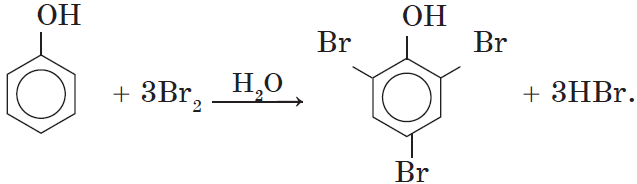
Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол).
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
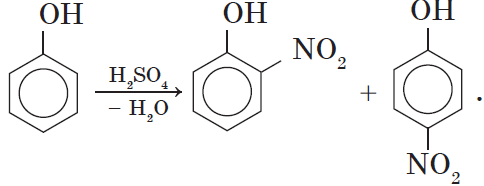
2.2. Нитрование
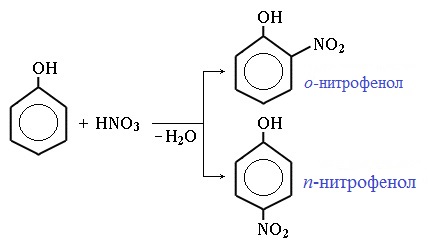
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
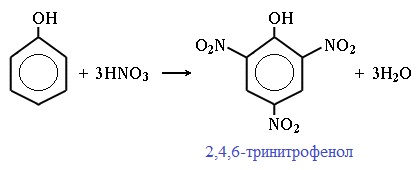
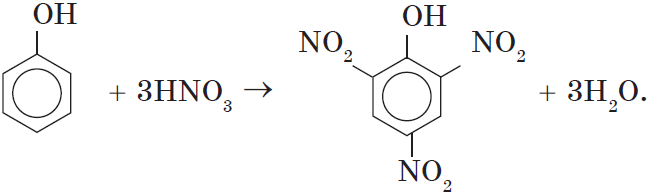
Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
-
Предельные спирты
-
Фенолы
-
Альдегиды
-
Карбоновые кислоты
-
Жиры
-
Углеводы
Фенолы
Фенолы — кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных
групп (OH), присоединенных к бензольному кольцу.
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие
номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
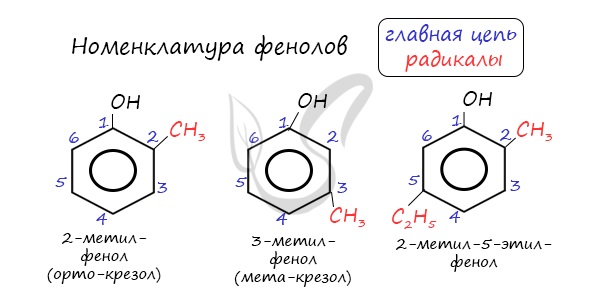
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования,
нитрования протекают в орто- и пара-положениях.
Получение фенолов
- Гидролиз галогенбензолов
- Кумольный способ
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.

Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению,
в результате получается фенол и ацетон.

Химические свойства фенолов
- Кислотные свойства
- Галогенирование
- Реакции с кислотами
- Гидрирование
- Поликонденсация фенолов с формальдегидом
Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей — фенолятов.
В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)

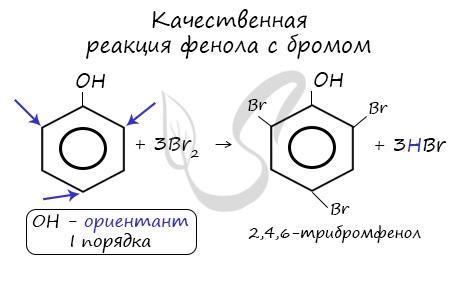
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь — осадок
трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал —
нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.

При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.

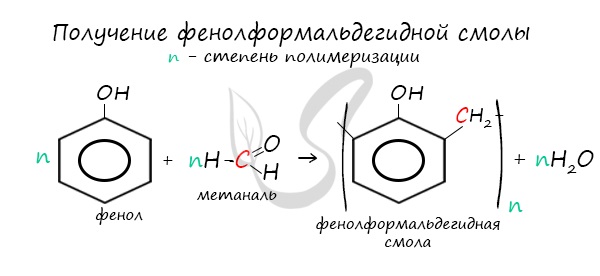
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию
смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Фенолы
1. В отличие от предельных одноатомных спиртов, фенолы реагируют с
Na
NaOH
CH3COOH
HCOOH
В отличие от предельных одноатомных спиртов, фенолы реагируют с щелочами, например NaOH.
2. Качественной реакцией на фенол является реакция с
Азотистой кислотой
Азотной кислотой
Натрием
Бромной водой
Качественной реакцией на фенол является реакция c бромной водой.
3. В результате кумольного синтеза фенола, помимо фенола, получают
Ацетон
Этан
Ацетилен
Пропадиен
В результате кумольного синтеза фенола, помимо фенола, получают ацетон (пропанон-2)
4. Гидроксогруппа в молекуле фенола вступает как
Ориентант II порядка
Ориентант I порядка
Гидроксогруппа в молекуле фенола вступает как ориентант I порядка.
5. Фенол с метаналем вступает в реакцию
Гидратации
Поликонденсации
Дегидрирования
Дегидратации
Фенол с метаналем вступает в реакцию поликонденсации, в результате которой получают фенолформальдегидную смолу.
Строение фенолов
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. Можно ожидать, что в зависимости от этого свойства, вещества будут существенно отличаться друг от друга из-за взаимного влияния групп атомов. И действительно, органические соединения, содержащие ароматический радикал фенил $С_6Н_5$—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называются фенолами.
Фенолы — органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и другие многоатомные фенолы, содержащие три и более гидроксильные группы в бензольном кольце.
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом $С_6Н_5ОН$. Название этого вещества и легло в основу названия всего класса — фенолы.
Физические и химические свойства
Физические свойства.
Фенол — твердое, бесцветное, кристаллическое вещество, $t°_{пл.}=43°С, t°_{кип.}=181°С$, с резким характерным запахом. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно!
Химические свойства.
Кислотные свойства. Как уже было сказано, атом водорода гидроксильной группы обладает кислотным характером. Кислотные свойства у фенола выражены сильнее, чем у воды и спиртов. В отличие от спиртов и воды, фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот. Так, например, кислотные свойства фенола примерно в $3000$ раз слабее, чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол:
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол.
Фенол реагирует с хлоридом железа (III) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.
Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах. Другие фенолы, содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа (III).
Реакции бензольного кольца
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
1. Бромирование фенола. В отличие от бензола, для бромирования фенола не требуется добавления катализатора (бромида железа (III)).
Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и параположения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же, как и реакция с хлоридом железа (III), служит для качественного обнаружения фенола.
2. Нитрование фенола также происходит легче, чем нитрование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пара-изомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется взрывчатое вещество — 2,4,6-тринитрофенол (пикриновая кислота):
3. Гидрирование ароматического ядра фенола в присутствии катализатора происходит легко:
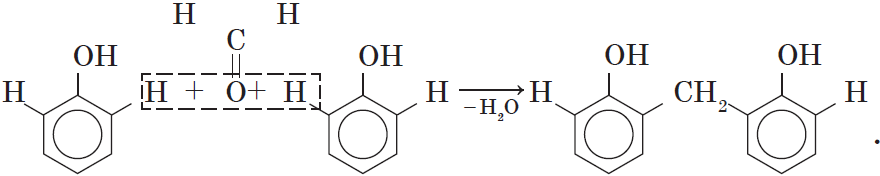
4. Поликонденсация фенола с альдегидами, в частности с формальдегидом, происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
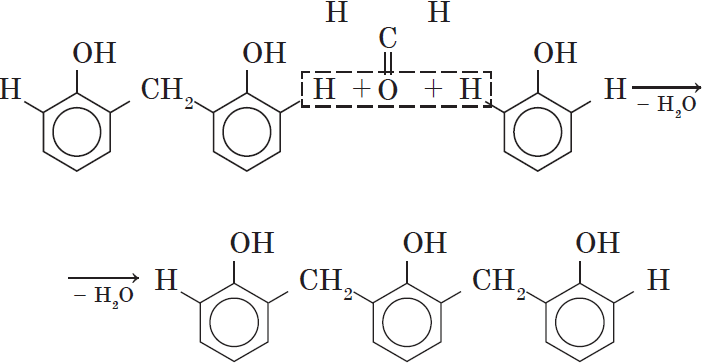
Вы, наверное, заметили, что в молекуле димера сохраняются «подвижные» атомы водорода, а значит, возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
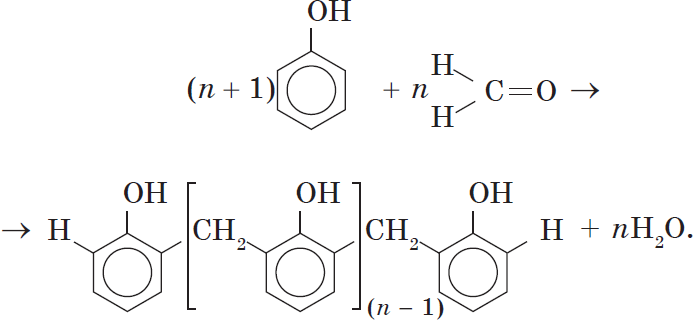
Реакция поликонденсации, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта (воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение же этой реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде. В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимеры на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению, действию воды, щелочей и кислот, обладающих высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин, полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы, сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе. Теперь вам понятно, почему фенол и продукты на его основе находят широкое применение.
Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
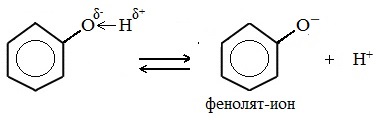
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.

1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
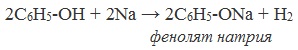
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов.
Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2— , Br— )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
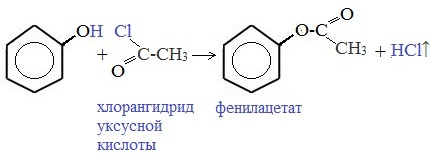
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
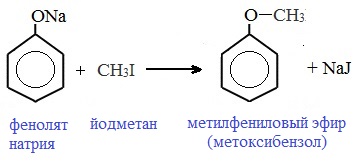
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II. Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+М-эффект ОН-группы):
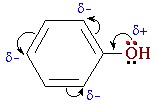
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!):
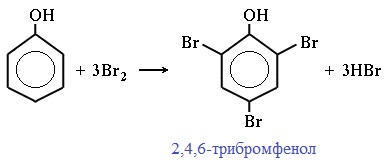
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
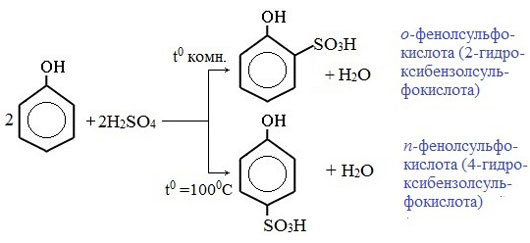
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер:
Реакции присоединения
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
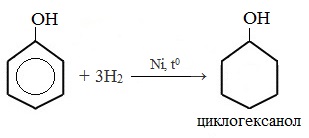
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
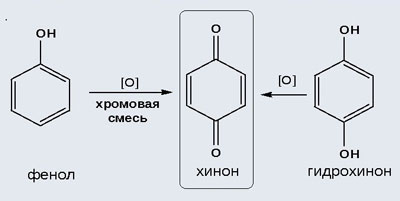
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Фенолы
Фенолы —
органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты,
фенолы классифицируют
по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы
содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы
содержат в молекулах более одной гидроксильной группы:
Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Познакомимся поподробнее со строением и свойствами простейшего представителя этого класса- фенолом С
6
Н
5
ОН . Название этого вещества и легло в основу в основу названия всего касса — фенолы.
Физические свойства фенола
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.
При попадании на кожу он вызывает
ожоги,
поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
Фенолы в большинстве реакций по связи О–Н активнее
спиртов
, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе p-сопряжения). Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (
+М-эффект
ОН-группы)
Кислотные свойства фенола
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:
Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
-
Бромирование фенола.
В отличие от бензола для бромирования фенола не требуется добавление катализатора (бромид железа(3)). Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в
орто-
и
пара-
положения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же как и реакция с хлоридом железа(3), служит для
качественного обнаружения фенола
.
2.
Нитрирование фенола
также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь
орто-
и
паро
изомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:
3. Гидрирование ароматического ядра фенола
в присутствии катализатора проходит легко:
4.
Поликонденсация фенола с альдегидами,
в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция
поликонденсаци,
т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.
Получение фенола
Применение фенолов
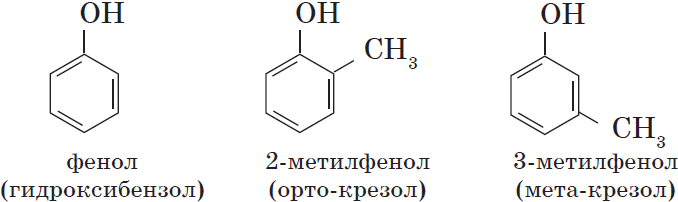
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.
Фенолы – радикал С6Н5 –фенил, связанный с одной
или несколькими группами ОН.

С-ОН С-ОН С-ОН
-СН3
Карболовая -С-ОН
кислота
Фенол (гидроксибензол) 2-метилфенол
1,3-дигидроксибензол
1. Физические свойства: Тв, Ц (на воздухе окисляется до
розового цвета)
З, tпл=43 , Ядовит, малорастворим в Н2О,
попадая на кожу, вызывает ожоги.
2. Химические свойства:
А) кислотные свойства – группа ОН взаимодействует с ароматическим
ядром, поляризация связи О-Н возрастает, увеличивается 6+ на
атоме Н, à кислотные свойства усиливаются и фенолы реагирует с
щелочными Ме и щелочами:

2C6H5
OH+ 2Naà 2C6H5ONa+H2 фенолят Na
C6H5
OH+ NaOHà 2C6H5ONa+H2O
Кислотные свойства фенола в 3000 раз меньше, чем Н2СО3,
поэтому пропуская через раствор C6H5ONa СО2 можно выделить фенол;
C6H5ONa +СО2+Н2О à C6H5 OH +NaHCO3
Добавляя к C6H5ONa (раствор) НСl (H2SO4) à образуетсяся
C6H5 –OH
C6H5ONa + НСl à C6H5OH + NaCl
Б) Качественная реакция:
C6H5 OH+ FeCl3à комплексная
соль, фиолетового цвета
В) Реакции бензольного кольца (электрофильное замещение)
Наличие группы ОН приводит к изменению П-облака бензольного кольца,
увеличению электронной плотности у 2,4 и 6 атомов углерода.
1) бромирование C6H5 OH без катализатора

С-ОН C—OH
Br Br
+ 3Br2 à
+ 3HBr
Br
белый осадок 2, 4, 6 – трибромфенол
Как и реакция с FeCl3, служит для обнаружения фенола
2) нитрование – легче, чем у бензола

С-ОН С-ОН
С-NO2
+ HNO3 à +
Разб.
Смесь орто- и пара- изомеров
При комн. t NO2
C-OH

2ON
NO2
+3HNO3à + 3H2O
Конц.
2,4,6 – тринитрофенол (пикриновая к-та)
NO2 взрывчатое
вещество
3) гидрирование

+ 3H2 à циклогексанол
4) поликонденсация с альдегидам ( с Н-С=О формальдегидом)
– с образованием фенолформальдегидных смол и твердых полимеров.

H CH2 C-OH
(n+1) + n C =O à +nH2O
H
n-1
Ароматические
спирты — проявляют свойства одноатомных спиртов.

-СН2— ОН
Группа ОН связана с С6Н5 через
R(-CH2-)
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
СВОЙСТВА ОДНОАТОМНЫХ СПИРТОВ
ОДНОАТОМНЫЕ СПИРТЫ содержат в углеводородной цепи одну гидроксильную группу ОН.
Общая формула CnH2n+1–OH или CnH2n+2O.
СТРОЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ.
Связи О–Н и С–О – полярные ковалентные.
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атому кислорода в спиртах свойственна sp3-гибридизация, валентный угол C–О–H близок к тетраэдрическому.
ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
Следствием полярности связи О–Н является способность гидроксисоединений к образованию водородных связей:
Поэтому даже низшие спирты — жидкости с относительно высокой температурой кипения (t кип. метанола +64,5оС).
При переходе от одноатомных к многоатомным спиртам или фенолам температуры кипения и плавления резко возрастают.
Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:
Спирты, содержащие до 15 атомов углерода – жидкости, 15 и более – твердые вещества.
Растворимость в воде зависит от молекулярной массы, чем она выше, тем спирт хуже растворяется воде. Так, низшие спирты (до пропанола) смешиваются с водой в любых пропорциях, а высшие практически не растворимы в ней.
Температура кипения также возрастает с увеличением атомной массы. Чем выше температура кипения, тем ниже летучесть, т.е. вещество плохо испаряется, что объясняется возникновением межмолекулярной водородной связи между отдельными молекулами самого соединения или спирта и воды
ХИМИЧЕСКИЕ СВОЙСТВА
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
С–ОН с замещением или отщеплением ОН-группы
О–Н с замещением водорода.
ЗАМЕЩЕНИЕ В ГИДРОКСИЛЬНОЙ ГРУППЕ
ОН – поляризована (некоторая кислотность)
1.С активными металлами (Na, K, Mg), образуя соли — алкоголяты (алкоксиды):
Реакционная способность одноатомных спиртов в реакциях по связи О–Н:
CH3OH > первичные > вторичные > третичные.
Алкоголяты нестойкие и под действием воды полностью гидролизуются с выделением спирта и гидроксида металла:
Со щелочами одноатомные спирты НЕ реагируют.
2. Образование сложных эфиров.
Спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры (этерификация).
ЗАМЕЩЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ -ОН
1. Реакции замещения ОН на галоген:
происходит в реакции с галогеноводородами или другими галогенсодержащими веществами в присутствии сильной кислоты (конц. H2SO4).
Реакционная
способность:
третичные
> вторичные > первичные > CH3OH
1. Внутримолекулярная дегидратация: образуются алкены.
Идет в присутствии концентрированной серной кислоты или водоотнимающих оксидов при повышенной температуре:
Дегидратация спиртов с длинной углеродной цепью идет по правилу Зайцева – водород отщепляется от менее гидрогенизированного атома углерода.
Основной
продукт – бутен-2.
2. Межмолекулярная дегидратация: образуются простые эфиры.
При межмолекулярной дегидратации спиртов также происходит нуклеофильное замещение: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы.
3. Реакция Лебедева –
это получение бутадиена каталитическим пиролизом этилового спирта
ОКИСЛЕНИЕ
1.Горение —> углекислый газ и вода
2. Окисление спиртов ( CuO (to), O2 (кат.Cu, to), KMnO₄, K₂Cr₂O₇),
а также дегидрирование при нагревании над медной сеткой.
(первичные окисляются до альдегидов, вторичные до кетонов, третичные более устойчивые – разрыв цепи):
3)Окисление подкисленным раствором перманганата калия приводит к образованию карбоновых кислот:
ИСКЛЮЧЕНИЕ: Окисление метанола ведет к образованию углекислого газа!!!
4) Окисление подкисленным раствором дихромата калия приводит к образованию карбоновых кислот:
Качественная реакция одноатомных спиртов– цвет из оранжевого переходит в зеленый (определение содержания алкоголя)
СВОЙСТВА МНОГОАТОМНЫХ СПИРТОВ
Многоатомные (две и более групп -ОН). Общая формула CnH2n+2Om.
Современное название многоатомных спиртов — полиолы (диолы, триолы и т.д).
Этиленгликоль и глицерин вязкие, сладкие на вкус жидкости, сорбит — белый порошок, все вещества хорошо растворимые в воде.
ХИМИЧЕСКИЕ СВОЙСТВА.
1.Замещение Н –атома (кислотные свойства).
Этиленгликоль, глицерин вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты.
Образуют соли не только в реакциях с активными металлами, но и под действием щелочей (частично и обратимо):
2.Взаимодействие с раствором гидроксида меди (II) в присутствии щелочи
с образованием комплексных соединений (качественная реакция на многоатомные спирты ). Голубой осадок гидроксида меди растворяется с образованием синего комплексного соединения многоатомного спирта.
3.Образование сложных эфиров
Реакция с азотной кислотой.
4. Образование жиров.
Жиры — это сложные эфиры, продукты взаимодействия глицерина с высшими карбоновыми кислотами.
5. Взаимодействие с галогеноводородами
Замещение -ОН на галоген:
Реагируют также, как и одноатомные спирты.
6. Окисление.
Так же, как и одноатомные спирты – оксидом меди или над медной сеткой (каталитическое дегидрирование) многоатомные спирты окисляются в карбонильные соединения.
Фенолы – гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром.
Общая формула – СnH2n-7OH n>6 (для фенолов с одной ОН-группой)
ФИЗИЧЕСКИЕ СВОЙСТВА ФЕНОЛА
Это твёрдое бесцветное вещество с резким запахом.
При температуре больше 70 °C растворяется в воде в любых отношениях. Фенол ядовит.
Неподеленная электронная пара атома кислорода взаимодействует (вступает в сопряжение с ароматической π-системой, в результате:
Увеличивается электронная плотность на ароматической системе, происходит ее перераспределение, и на атомах 2,4,6 появляется избыточный отрицательный заряд;
Электронная пара связи О-Н смещается к атому кислорода, и связь становится менее прочной (по сравнению со спиртами)
ХИМИЧЕСКИЕ СВОЙСТВА ФЕНОЛА
Проявляет свойства слабой кислоты. Реакции замещения группы ОН и образование эфиров нехарактерны: эфиры получают с помощью фенолятов.
Фенол легко вступает в реакции электрофильного замещения в ароматическом кольце.
Качественные реакции:
1. Образование осадка 2,4,6 трибромфенола с бромной водой;
2. Появление фиолетовой окраски с хлоридом железа (FeCl₃)
РЕАКЦИИ С УЧАСТИЕМ ГИДРОКСИЛЬНОЙ ГРУППЫ (КИСЛОТНЫЕ СВОЙСТВА ФЕНОЛОВ)
1. Как и спирты, реагируют с активными металлами.
2. Реагируют с гидроксидами щелочных и щелочноземельных металлов (отличие от спиртов), образуя соли – феноляты.
Кислотные свойства очень слабые, кислота не окрашивает
индикаторы и вытесняется из солей даже угольной кислотой, т.е. феноляты легко гидролизируются.
Из фенолятов получают простые и сложные эфиры
1. Образование простых эфиров
2. Образование сложных эфиров
РЕАКЦИИ ФЕНОЛА ПО БЕНЗОЛЬНОМУ КОЛЬЦУ
1. Галогенирование.
Фенол легко при комнатной температуре взаимодействует с бромной водой (раствор желтый) с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол №1).
2. Нитрование.
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота).
3. Сульфирование фенолов
Образуются сульфофенолы
4. Поликонденсация
– образование полимера и низкомолекулярного побочного продукта (H₂O). С формальдегидом фенол образует фенолоформальдегидные смолы.
ОКИСЛЕНИЕ
Фенолы легко окисляются даже под действием кислорода воздуха.
Полное окисление (горение)
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:
Гидрирование (восстановление)— образуются циклические спирты
Качественная реакция на фенол №2: с хлоридом железа (III).
Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
14(Б) Тесты ЕГЭ ФИПИ 2015 Одноатомные спирты
14(Б) Тесты ЕГЭ ФИПИ 2015 Многоатомные спирты
14(Б) Тесты ЕГЭ ФИПИ 2015 Фенолы


















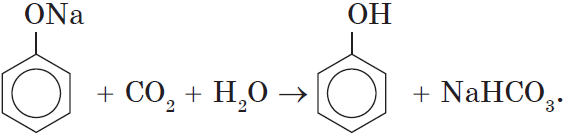
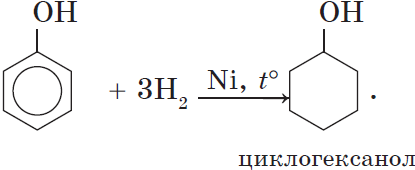





















![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)











































